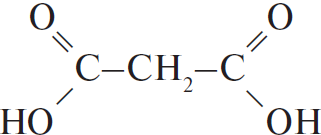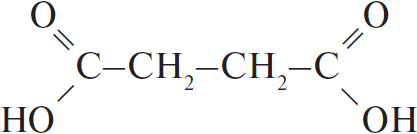Вариант ХИ2210401 с ответами
Скачать ответы и
решения для варианта
Для выполнения заданий 1–3 используйте следующий ряд
химических элементов:
●
1) Mg,
●
2) C,
●
3) B,
●
4) Si, ● 5) Li.
Ответом в заданиях 1–3 является последовательность
цифр, под которыми указаны химические элементы в данном ряду.
1.
Какие из указанных элементов имеют в первом возбуждённомсостоянии
конфигурацию внешнего уровня ns1 np3 ? Запишите номера выбранных элементов.
2.
Из указанного ряда выберите три элемента, принадлежащие
одномупериоду Периодической системы, и расположите их в порядке увеличения
первой энергии ионизации атома. Запишите в поле ответа номера выбранных
элементов в нужной последовательности.
3.
Из указанного ряда выберите два элемента, у которых разностьмежду
высшей и низшей степенями окисления равна 8. Запишите в поле ответа номера
выбранных элементов.
4.
Из предложенного перечня выберите две частицы, в которых одиниз
элементов образует четыре ковалентные связи. Запишите номера выбранных ответов.
●
1) NH3
●
2) H2O2
●
3) BF4 –
●
4) P4O6
●
5) SO2
5.
Среди предложенных формул/названий веществ, расположенных
впронумерованных ячейках, выберите формулы/названия: А) сильного основания; Б)
основной соли; В) одноосновной кислоты. Запишите в таблицу номера ячеек, в
которых расположены вещества, под соответствующими буквами.
6.
В двух пробирках находился раствор карбоната аммония. В
первуюпробирку добавили раствор вещества Х, а во вторую – раствор вещества Y. В
первой пробирке видимых признаков реакции не наблюдалось даже при нагревании, а
во второй выпал желтоватый осадок. Из предложенного перечня выберите вещества X
и Y, которые могут вступать в описанные реакции.
●
1) NaOH
●
2) CaCl2
●
3) AgNO3
●
4) K2SO4
●
5) CuSO4
7.
Установите соответствие между формулой вещества и реагентами,
скаждым из которых это вещество может взаимодействовать: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
8.
Установите соответствие между исходными веществами,вступающими в
реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к
каждой позиции, обозначенной буквой, подберите соответствующую позицию,
обозначенную цифрой.
10.
Установите соответствие между названием гомологического ряда иего
общей формулой: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
11.
Из предложенного перечня выберите два межклассовых
изомера.Запишите номера выбранных ответов.
●
1) пентанон-3 ● 2)
пентанол-1
●
3) 3-метилбутанон
●
4) пентановая кислота
●
5) этилизопропиловый эфир
12.
Из предложенного перечня выберите все вещества, которые приопределённых
условиях могут быть восстановлены до первичного спирта. Запишите номера
выбранных ответов.
●
1) ацетон
●
2) масляная кислота
●
3) фенол
●
4) этилацетат
●
5) 2-метилпропаналь
13.
Из предложенного перечня выберите два вещества, которыепроявляют
более сильные основные свойства, чем аммиак. Запишите номера выбранных ответов.
●
1) нитробензол
●
2) 1,2-диаминоэтан
●
3) анилин
●
4) пиридин
●
5) диметиламин
14.
Установите соответствие между схемой реакции и веществом
Х,принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
15.
Установите соответствие между реагирующими веществами
иуглеродсодержащим продуктом, который образуется при взаимодействии этих
веществ: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
17. Из
предложенного перечня выберите все реакции присоединения.Запишите номера
выбранных ответов.
●
1) взаимодействие хлорэтана со спиртовым раствором щёлочи
●
2) взаимодействие циклопропана с бромом
●
3) взаимодействие пентана с бромом на свету
●
4) взаимодействие бутадиена с хлороводородом
●
5) димеризация ацетилена в присутствии катализатора
18. Из
предложенного перечня выберите все реакции, скоростькоторых зависит от
давления. Запишите номера выбранных ответов.
●
1) взаимодействие хлора с раствором щёлочи
●
2) растворение железа в соляной кислоте
●
3) восстановление оксида меди(II) водородом
●
4) нитрование бензола
●
5) горение алюминия в кислороде
19. Установите
соответствие между схемойокислительно-восстановительной реакции и степенью
окисления элемента-восстановителя: к каждой позиции, обозначенной буквой,
подберите соответствующую позицию, обозначенную цифрой.
20. Установите
соответствие между формулой вещества и продуктамиэлектролиза водного раствора
или расплава этого вещества, выделившимися на инертных электродах: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
21. Для
веществ, приведённых в перечне, определите характер средыих водных растворов,
имеющих одинаковую молярную концентрацию. Запишите номера веществ в порядке
возрастания значения pH их водных растворов.
●
1) K2SO4
●
2) K2SO3
●
3) KHSO4
●
4) K2S
22. Установите
соответствие между способом воздействия наравновесную систему CO3 2– (р-р) +
H2O(ж.) HCO3 – (р-р) + OH– (р-р) – Q и направлением смещения равновесия при
этом воздействии: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
23. В реакторе
постоянного объёма смешали азот и водород. Врезультате обратимой реакции: N2(г)
+ 3H2(г) ←→ 2NH3(г) в реакторе установилось равновесие. Исходная концентрация
азота была равна
1,0 моль/л, а равновесные концентрации водорода и
аммиака составили 2,0 моль/л и 0,8 моль/л, соответственно. Найдите равновесную
концентрацию азота (X) и исходную концентрацию водорода (Y). Выберите из списка
номера правильных ответов.
●
1) 0,4 моль/л
●
2) 0,6 моль/л
●
3) 0,8 моль/л
●
4) 1,2 моль/л
●
5) 2,4 моль/л
●
6) 3,2 моль/л
24. Установите
соответствие между названием вещества и признакомреакции, который наблюдается
при взаимодействии вещества с водным раствором аммиака: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
25. Установите
соответствие между смесью веществ и методом еёразделения: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
26. При
охлаждении 200 г раствора гидрокарбоната аммония выпалосадок – безводная соль.
Раствор над осадком имел массу 150 г и содержал 18 % соли по массе. Найдите
массовую долю (в %) соли в исходном растворе. (Запишите число с точностью до
десятых.)
27. Горение
угарного газа описывается термохимическим уравнением: CO(г) + 1/2O2(г) = CO2(г)
+ 284 кДж Сколько литров кислорода (н. у.) потребуется для получения 213 кДж
теплоты сжиганием угарного газа? (Запишите число с точностью до десятых.)
28. Сколько
килограммов бутадиена-1,3 можно получить из 20 кг 96 %-го этанола, если выход в
реакции Лебедева составляет 71 %? (Ответ запишите с точностью до целых.)
29. Из предложенного
перечня выберите вещества, между которымиокислительно-восстановительная реакция
протекает с изменением цвета раствора. В ответе запишите уравнение только одной
из возможных окислительновосстановительных реакций с участием выбранных
веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30. Из
предложенного перечня веществ выберите вещества, которыевступают в реакцию
ионного обмена с выделением газа. Запишите молекулярное, полное и сокращённое
ионное уравнения реакции с участием выбранных веществ.
31. Серебро
растворили в разбавленной азотной кислоте. Черезполученный раствор пропустили
сероводород, из раствора выпал чёрный осадок. Осадок отфильтровали и прокалили
на воздухе. Газ, выделившийся при прокаливании, поглотили известковой водой, в
результате из раствора выпал осадок. Напишите молекулярные уравнения четырёх
описанных реакций.
32. Напишите
уравнения реакций, с помощью которых можноосуществить следующие превращения:
С3H6 → C3H6Br2 → X1 → пропандиовая кислота → X2 → C2H3OCl При написании
уравнений реакций указывайте преимущественно образующиеся продукты, используйте
структурные формулы органических веществ.
33. Органическое
вещество X относится к ароматическим соединениям и проявляет слабые основные
свойства. Оно реагирует с одним эквивалентом хлороводорода, образуя вещество,
содержащее 27,4 % хлора и 10,8 % азота по массе. Вещество X окисляется
перманганатом калия, не реагирует с бромной водой и азотистой кислотой. На
основании данных условия задачи: 1) проведите необходимые вычисления
(указывайте единицы измерения и обозначения искомых физических величин) и
установите молекулярную формулу вещества X; 2) составьте возможную структурную
формулу вещества X, которая однозначно отражает порядок связи атомов в его
молекуле; 3) напишите уравнение реакции вещества X с горячим водным раствором
перманганата калия (в уравнении используйте структурные формулы органических
веществ).
34. Навеску хлорида
фосфора(V) растворили в 50 мл горячей воды.
Для полной нейтрализации полученного раствора
потребовалось 190 г
3,6 %-го раствора гидроксида
бария. Выпавший осадок отфильтровали. Рассчитайте массу осадка и массовую долю
соли в фильтрате. В ответе запишите уравнения реакций, которые указаны в
условии задачи, и приведите все необходимые вычисления (указывайте единицы
измерения и обозначения искомых физических величин).
Вариант ХИ2210402 с ответами
Для выполнения заданий 1–3 используйте следующий ряд
химических элементов: 1) Na, 2) O, 3) Ar, 4) B, 5) Al Ответом в заданиях 1–3
является последовательность цифр, под которыми указаны химические элементы в
данном ряду.
1.
Какие из указанных элементов имеют в первом возбуждённомсостоянии
конфигурацию внешнего уровня ns1 np2 ? Запишите номера выбранных элементов.
2.
Из указанного ряда выберите три элемента, принадлежащие
одномупериоду Периодической системы, и расположите их в порядке уменьшения
первой энергии ионизации атома. Запишите в поле ответа номера выбранных
элементов в нужной последовательности.
3.
Из указанного ряда выберите два элемента, способные
проявлятьотрицательную степень окисления. Запишите в поле ответа номера
выбранных элементов.
4.
Из предложенного перечня выберите две частицы, в которых одиниз
элементов образует три ковалентные связи. Запишите номера выбранных ответов.
●
1) NH4 +
●
2) SO3
●
3) AlH4 –
●
4) H3O+
●
5) HCN
5.
Среди предложенных формул/названий веществ, расположенных
впронумерованных ячейках, выберите формулы/названия: А) основного оксида; Б)
бескислородной кислоты; В) кислой соли. Запишите в таблицу номера ячеек, в
которых расположены вещества, под соответствующими буквами.
6.
В двух пробирках находился раствор иодида алюминия. В
первуюпробирку добавили раствор вещества Х, а во вторую – раствор вещества Y. В
первой пробирке видимых признаков реакции не наблюдалось, а во второй выпал
белый осадок, при этом газ не выделялся. Из предложенного перечня выберите
вещества X и Y, которые могут вступать в описанные реакции.
●
1) NH4Cl
●
2) Pb(NO3)2
●
3) K2CO3
●
4) NH3
●
5) (NH4)2S
7.
Установите соответствие между формулой вещества и реагентами,
скаждым из которых это вещество может взаимодействовать: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
8.
Установите соответствие между исходными веществами,вступающими в
реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к
каждой позиции, обозначенной буквой, подберите соответствующую позицию,
обозначенную цифрой.
10.
Установите соответствие между названием гомологического ряда иего
общей формулой: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
11.
Из предложенного перечня выберите два структурных
изомера.Запишите номера выбранных ответов.
●
1) пентандиол-2,3
●
2) пропилацетат
●
3) дипропиловый эфир
●
4) циклопентанол
●
5) 2-метилбутаналь
12.
Из предложенного перечня выберите все вещества, при
гидролизекоторых в кислой среде образуется карбоновая кислота. Запишите номера
выбранных ответов.
●
1) 2,2-дихлопропан
●
2) уксусный ангидрид
●
3) 1,1,1-трихлорэтан
●
4) цианометан
●
5) метоксибензол
13.
Из предложенного перечня выберите два вещества, которыепроявляют
основные свойства, но являются более слабыми основаниями, чем аммиак. Запишите
номера выбранных ответов.
●
1) пиррол
●
2) пиридин
●
3) триметиламин
●
4) метилат натрия
●
5) 2-метиланилин
14.
Установите соответствие между схемой реакции и веществом
Х,принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
15.
Установите соответствие между реагирующими веществами
иорганическим продуктом, который преимущественно образуется при взаимодействии
этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
17.
Из предложенного перечня выберите все реакции замещения.Запишите
номера выбранных ответов.
●
1) взаимодействие 2-хлорпропана с водным раствором щёлочи
●
2) взаимодействие фенола с разбавленной азотной кислотой
●
3) нагревание 1,3-дибромпропана с цинком
●
4) взаимодействие ацетона с водородом
●
5) взаимодействие метиламина с хлорметаном
18.
Из предложенного перечня выберите все реакции, скоростькоторых не
зависит от давления. Запишите номера выбранных ответов.
●
1) горение серы в кислороде
●
2) растворение алюминия в растворе щёлочи
●
3) нейтрализация азотной кислоты гидроксидом бария
●
4) изомеризация α-глюкозы в β-глюкозу
●
5) взаимодействие аммиака и хлороводорода
19.
Установите соответствие между
схемойокислительно-восстановительной реакции и степенью окисления
элемента-окислителя: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
20.
Установите соответствие между формулой вещества и
продуктамиэлектролиза водного раствора или расплава этого вещества,
выделившимися на инертных электродах: к каждой позиции, обозначенной буквой,
подберите соответствующую позицию, обозначенную цифрой.
21.
Для веществ, приведённых в перечне, определите характер средыих
водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера
веществ в порядке уменьшения значения pH их водных растворов.
●
1) NaHCO3
●
2) NaI
●
3) NaOH
●
4) HI
23.
В реакторе постоянного объёма смешали оксид серы(IV) и кислород.
В результате обратимой реакции: 2SO2(г) + O2(г) ←→ 2SO3(г) в реакторе
установилось равновесие. Исходная концентрация кислорода была равна 0,1 моль/л,
а равновесные концентрации оксида серы(VI) и оксида серы(IV) составили 0,08
моль/л и 0,12 моль/л, соответственно. Найдите равновесную концентрацию
кислорода (X) и исходную концентрацию оксида серы(IV) (Y). Выберите из списка
номера правильных ответов.
●
1) 0,04 моль/л
●
2) 0,06 моль/л
●
3) 0,08 моль/л
●
4) 0,12 моль/л
●
5) 0,16 моль/л
●
6) 0,2 моль/л
24.
Установите соответствие между названием вещества и
признакомреакции, который наблюдается при взаимодействии вещества с
разбавленной соляной кислотой: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
25.
Установите соответствие между смесью веществ и методом
еёразделения: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
26.
При охлаждении 400 г 70 %-го раствора нитрата аммония выпалосадок
– безводная соль. В образовавшемся растворе массовая доля нитрата аммония
снизилась до 60 %. Найдите массу осадка (в г). (Запишите число с точностью до
целых.)
27.
Горение бутана описывается термохимическим уравнением: C4H10(г) +
6,5O2(г) = 4CO2(г) + 5H2O(ж) + 2880 кДж Сколько миллилитров углекислого газа
(н.у.) выделится в атмосферу при получении 360 Дж теплоты сжиганием бутана?
(Ответ запишите с точностью до десятых).
28.
В результате тримеризации пропина объёмом 74 л (н. у.)
получилисмесь триметилбензолов общей массой 99 г. Рассчитайте общий выход (в %)
продуктов тримеризации. (Ответ запишите с точностью до целых.)
29.
Из предложенного перечня выберите вещества, между
которымиокислительно-восстановительная реакция протекает с выделением газа и
изменением цвета раствора. В ответе запишите уравнение только одной из
возможных окислительновосстановительных реакций с участием выбранных веществ.
Составьте электронный баланс, укажите окислитель и восстановитель.
30.
Из предложенного перечня веществ выберите вещества,
которыевступают в реакцию ионного обмена с образованием осадка. Запишите
молекулярное, полное и сокращённое ионное уравнения реакции с участием
выбранных веществ.
31.
Чёрное вещество, образовавшееся при прокаливании нитрата
меди,растворили в соляной кислоте. Через полученный раствор пропустили
сернистый газ, в результате выпал белый осадок, который растворяется в
аммиачной воде. Напишите молекулярные уравнения четырёх описанных реакций.
32.
Напишите уравнения реакций, с помощью которых можноосуществить
следующие превращения: C4H10O → бутен-2 → X1 → бутин-2 → X2 → C12H6O12 При
написании уравнений реакций указывайте преимущественно образующиеся продукты,
используйте структурные формулы органических веществ.
33.
Органическое вещество X представляет собой бесцветную жидкость с
запахом аммиака. Оно реагирует с двумя эквивалентами бромоводорода, образуя
вещество, содержащее 72,1 % брома и 12,6 % азота по массе. Вещество X реагирует
с азотистой кислотой, при этом выделяется в 2 раза больше азота, чем при
сгорании X. На основании данных условия задачи:
●
1) проведите необходимые вычисления (указывайте единицы измерения
и обозначения искомых физических величин) и установите молекулярную формулу
вещества X;
●
2) составьте структурную формулу вещества X, которая однозначно
отражает порядок связи атомов в его молекуле;
●
3) напишите уравнение реакции вещества X с избытком гидроксида
калия (в уравнении используйте структурные формулы органических веществ).
34.
Для полной нейтрализации раствора, полученноговзаимодействием
хлорангидрида серной кислоты SO2Cl2 со 100 мл горячей воды, потребовалось 380 г
2,7 %-го раствора гидроксида бария. Выпавший осадок отфильтровали. Рассчитайте
массу осадка и массовую долю соли в фильтрате. В ответе запишите уравнения
реакций, которые указаны в условии задачи, и приведите все необходимые
вычисления (указывайте единицы измерения и обозначения искомых физических
величин).
Скачать ответы и
решения для варианта
- 09.03.2023
Пятый тренировочный вариант, составленный на основе демоверсии ЕГЭ 2023 года по химии от ФИПИ. Вариант включает все задания кодификатора 2023 года и учитывает все изменения, которые произошли в 2023 году (полный список изменений). Вариант содержит правильные ответы и подробные разборы для второй части теста — задания повышенной сложности. Ответы сохранены в конце варианта.
- Другие тренировочные варианты по химии
В варианте присутствуют задания на знание химических элементов и соединений, на составление и балансировку химических уравнений, на расчет массы вещества и концентрации растворов, а также на проведение простых химических экспериментов. Сам тренировочный вариант состоит из нескольких частей. В первой части представлены задания на знание химических элементов и соединений. Вторая часть содержит задания на балансировку химических уравнений и расчет массы вещества. Третья часть включает задания на расчет концентрации растворов и проведение простых химических экспериментов.
Задания из тренировочного варианта №5
Вещества для заданий с 1 по 3. 1) Не 2) Са 3) Cr 4) Cl 5) Se
Задание 1. Из указанных в ряду элементов выберите два элемента, атомы которых имеют сходную конфигурацию внешнего электронного слоя.
Задание 2. Из указанных в ряду химических элементов выберите три элемента, находящихся в одном периоде. Расположите выбранные элементы в порядке увеличения электроотрицательности.
Задание 3. Из указанных в ряду элементов выберите два элемента, в соединении с которыми водород способен проявлять отрицательную степень окисления.
Задание 4. Из предложенного перечня выберите два вещества, между молекулами которых образуются водородные связи.
- метилэтиловый эфир
- аланин
- триметиламин
- плавиковая кислота
- серная кислота
Задание 11. Из предложенного перечня выберите два вещества, являющиеся межклассовыми изомерами.
- нитроэтан
- пропанол-1
- глицин
- диметиловый эфир
- этиламин
Задание 13. Из предложенного перечня выберите два вещества, с каждым из которых может взаимодействовать метиламин.
- С6Н6
- О2
- СН4
- KOH
- СН3(СН2)2СООН
Задание 17. Из предложенного перечня выберите все наборы веществ, реакция между которыми протекает без изменения степени окисления.
- C2H6 и Cl2 (hν)
- фенол и NaOH
- NO2 и H2O
- Na2O2 и H2O (t°)
- K2CrO4 и H2SO4
Задание 18. Из предложенного перечня выберите все факторы, приводящие к уменьшению скорости реакции алюминиевой пластинки с 15%-ным раствором серной кислоты.
- добавление твердой щелочи
- добавление хлорида алюминия
- увеличение концентрации кислоты до 95%
- использование пластинки большей толщины
- замена серной кислоты на уксусную такой же концентрации
Задание 21. Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
- поваренная соль
- серная кислота
- нитрит натрия
- акриловая кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Для того чтобы решить расчетную задачу по химии, нужно воспользоваться следующим алгоритмом:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать значения известных и неизвестных величин с соответствующими единицами величин (только для чистых веществ, т.е. не содержащих примесей).
Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества; если в условии задачи идет речь о растворе, то сначала надо вычислить массу растворенного вещества.
3. Под формулами веществ с известными и неизвестными величинами записать соответствующие значения этих величин, найденные по уравнению реакции.
4. Составить и решить пропорцию.
5. Записать ответ.
Задача 1. Железо количеством вещества $0.5$ моль прореагировало без остатка с соляной кислотой. Определите массу образовавшегося хлорида железа (II).
Дано:
$n(Fe)=0.5$ моль
$m(FeCl_2)-?$
Решение:
1. Запишем уравнение химической реакции:
$Fe+2HCl=FeCl_2+H_2↑$.
2. Запишем известные и неизвестные числовые значения над формулами веществ в уравнении.
${Fe}↖{56}+2HCl={FeCl_2}↖{127}+H_2$
$M(Fe)=56$г/моль; $m(Fe)=56$г/м $·1$моль$=56$г
$M(FeCl_2)=56+35.5·2=127$г/моль;
$m(FeCl_2)=127$г/моль $·1$моль$=127$г
3. Найдем заданную химическим уравнением массу $0.5$ моль железа и запишем полученное значение под его формулой.
$m(Fe)=M·n=56$г/моль $·0.5$моль$=28$г
4. Уравнение примет вид:
${Fe}↙{28}↖{56}+2HCl={FeCl_2}↙{x}↖{127}+H_2↑$
5. Составим и решим пропорцию:
${56}/{28}={127}/{x}; x={28·127}/{56}=63.5$г.
Ответ: $m(FeCl_2)=63.5$ г.
Задача 2. В каком объеме кислорода (н.у.) нужно сжигать железо, чтобы получить $0.2$ моль оксида железа (III)?
Дано:
$n(Fe_2O_3)=0.2$моль
$V(O_2)-?$
Решение:
$1.4Fe+3O_2=2Fe_2O_3.$
$2.M_r(Fe_2O_3)=56·2+16·3=16$г/моль;
$m(Fe_2O_3)=M_r·n=16$г/моль $·2$моль$=320$г
$M_r(O_2)=16+16=32$/моль;
$m(O_2)=32$г/моль $·2$моль$=96$г
$4Fe+{3O_2}↙{x_{моль}}↖{96}={2Fe_2O_3}↙{0.2_{моль}}↖{320}$
$3.{96}/{x}={320}/{0.2}; x={96·0.2}/{320}=0.06$моль
$4.V=V_m·n=22.4$л/моль $·0.06$моль$=1.3$л
Ответ: $V(O_2)=1.34$л.
- Дисциплина: Химия
- Номер вопроса в билете: 7
- Баллы: 2
- Сложность: Базовый
-
В пробирку с раствором вещества X добавили несколько капель раствора соли Y. В результате реакции произошло выделение газа с неприятным запахом. Из предложенного перечня выберите два вещества, которые могут вступать в описанную реакцию.
-
вещества
- 1)КОН
- 2)НСl
- 3)CuSO4
- 4)Na2CO3
- 5)K2S
Баллы: 0 из 2
- Подробное решение
-
В списке веществ 3 соли. CuSO4 Na2CO3 K2S Из них 2 соли образованы сильным основанием и слабой кислотой Na2CO3 K2S.
В реакции ионного обмена c этими солями в присутствии ионов H+ растворе будут образовываться кислоты — H2S (сероводородная кислота, раствор сернистого газа в воде, растворяется плохо) и H2CO3 (угольная кислота, раствор углекислого газа в воде, растворяется плохо) Поскольку H2S — в воде растворим плохо сернистый газ будет выходить из зоны реакции. А H2CO3 будет разлагаться
HX2COX3= HX2O+COX2↑ce {H2CO3= H2O + CO2 ^ }
и углекислый газ будет выходить из зоны реакции
Однако, только сернистый газ неприятно пахнет (запах тухлых яиц). Значить раствор соли Y — это K2S, а раствор вещества X — HCl. Тут главное их не перепутать в ответе местами!
2 HCl+KX2S=HX2S (газ)↑+2 KClce{2HCl + K2S = H2S (газ) ^ + 2KCl}
За это задание ты можешь получить 3 балла. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 28.1%
Ответом к заданию 33 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
При полном сгорании углеводорода образовалось 8,96 л (н. у.) диоксида углерода и 5,4 г воды. Молярная масса углеводорода в 27 раз больше молярной массы водорода. При исследовании химических свойств этого вещества установлено, что оно обесцвечивает бромную воду, присоединяя атомы брома по четырем разным атомам углерода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с недостатком бромной воды (используйте структурные формулы органических веществ).
Решение
1) Находим количественный состав вещества.
Формула вещества — $C_xH_y$.
а) n(C) = n($CO_2$) = 8.96 / 22.4 = 0.4 моль
б) n(H) = 2n($H_2O$) = 2 · 5.4 / 18 = 0.6 моль
2) Определяем молекулярную формулу вещества:
а) $M_{ист.}(C_xH_y) = D(по H_2) · M(H_2)$ = 27 · 2 = 54 г/моль
б) x : y = n(C) : n(H) = 0.4 : 0.6 = 2 : 3 = 4 : 6
Вычисленная формула — $C_4H_6$.
$M_{выч.}(C_4H_6)$ = 54 г/моль
в) $M_{ист.}(C_xH_y)$ / $M_{выч.}(C_4H_6)$ = 54 / 54 = 1
Молекулярная формула исходного вещества — $C_4H_6$.
3) Структурная формула вещества — $CH_2=CH–CH=CH_2$ — бутадиен-1,3.
4) Записываем уравнение реакции вещества с бромом:
$CH_2=CH–CH=CH_2 + Br_2 → CH_2Br–CH=CH–CH_2Br$
Ответ:
Задача 2
При сгорании монобромпроизводного органического вещества массой 6,15 г образовался углекислый газ, 2,7 мл воды и бромоводород объёмом 1,12 л (н. у.). Известно, что данное вещество было получено при взаимодействии органического вещества с бромом при освещении.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу монобромпроизводного органического вещества;
- составьте структурную формулу этого органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции этого вещества с водным раствором гидроксида натрия (используйте структурные формулы органических веществ).
Решение
Допустим, что в веществе не содержится кислород, т. е. формула — $C_xH_yBr$.
1) Находим количественный состав образца:
а) n(Br) = n(H) = n(HBr) = 1.12 / 22.4 = 0.05 моль
m(Br) = 0.05 · 80 = 4 г
б) m($H_2O$) = 2.7 · 1 = 2.7 г; n(H) = 2n($H_2O$) = 2 · 2.7 / 18 = 0.3 моль
$n(H)_{общее}$ = 0.05 + 0.3 = 0.35 моль
m(H) = 1 · 0.35 = 0.35 г
в) m(C) = 6.15 – (4 + 0.35) = 1.8 г; n(C) = 1.8 / 12 = 0.15 моль
2) Находим молекулярную формулу вещества:
а) $M(C_xH_yBr)$ = 6.15 / 0.05 = 123 г/моль
б) x : y : z = n(C) : n(H) : n(Br) = 0.15 : 0.35 : 0.05 = 3 : 7 : 1
Вычисленная формула — $C_3H_7Br$.
$M(C_3H_7Br)$ = 36 + 7 + 80 = 123 г/моль
$M(C_xH_yBr)$ / $M(C_3H_7Br)$ = 123 / 123 = 1
Формула галогенпроизводного — $C_3H_7Br$
3) Структурная формула — $CH_3–CH(Br)–CH_3$
4) Уравнение реакции вещества с водным раствором гидроксида натрия:
$CH_3–CHBr–CH_3 + NaOH → NaBr + CH_3–CH(OH)–CH_3$
Ответ:
Задача 3
В результате сплавления органического вещества с гидроксидом калия был получен углеводород, 1,17 г паров которого занимают объём 336 мл (н. у.). Известно, что исходное вещество относится к классу солей. В этом соединении число атомов кислорода равно числу атомов водорода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с гидроксидом калия при сплавлении (используйте структурные формулы органических веществ).
Решение
1) Находим молярную массу углеводорода.
Пусть формула полученного углеводорода $C_xH_y$.
$n = V_г$ / $V_M$; $n(C_xH_y)$ = 0.336 / 22.4 = 0.015 моль
$M(C_xH_y) = m_{в-ва}$ / n = 1.17 / 0.015 = 78 г/моль
2) Находим молекулярную формулу углеводорода:
12x + y = 78
если x = 6, y = 6
Формула углеводорода — $C_6H_6$, молекулярная формула исходного вещества $C_8H_4O_4K_2$.
3) Составляем структурную формулу соли:
4) Уравнение реакции:
$KOOC–C_6H_4–COOK + 2KOH → 2K_2CO_3 + C_6H_6$
Ответ:
Задача 4
Вещество, которое содержит 61,54 % кислорода, 34,62 % углерода и 3,84 % водорода по массе, было получено при взаимодействии углеводорода состава $С_5H_8$ с раствором перманганата калия в присутствии серной кислоты.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного углеводорода с подкисленным раствором перманганата калия (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
1) Находим количественный состав вещества.
Пусть $m_{в-ва}$ = 100 г, тогда:
а) m(C) = 34.62 г, n(C) = 34.62 / 12 ≈ 2.89 моль
б) m(H) = 3.84 г, n(H) = 3.84 / 1 = 3.84 моль
в) m(O) = 61.54 г, n(O) = 61.54 / 16 ≈ 3.85 моль
2) Находим молекулярную формулу вещества:
x : y : z = n(C) : n(H) : n(O) = 2.89 : 3.84 : 3.85 ≈ 1 : 1.33 : 1. 33 ≈ 3 : 4 : 4.
Молекулярная формула — $C_3H_4O_4$.
3) Структурная формула —
4) Уравнение реакции окисления углеводорода:
$CH_2=CH–CH_2–CH=CH_2 + 4KMnO_4 + 6H_2SO_4 → 2K_2SO_4 + 4MnSO_4 + 8H_2O + 2CO_2 +$
Ответ:
Задача 5
При сгорании 1,8 г органического вещества, не содержащего кислорода, получили углекислый газ, 2,52 г воды и 448 мл (н. у.) азота. Известно, что вещество не может быть получено восстановлением соответствующего нитросоединения, но вступает в реакцию c хлорэтаном.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с хлорэтаном (используйте структурные формулы органических веществ).
Решение
Формула вещества — $C_xH_yN_z$.
1) Количественный состав образца:
М(C) = 12 г/моль, М(H) = 1 г/моль, М(N) = 14 г/моль, M($H_2O$) = 18 г/моль
n(H) = 2n($H_2O$) = 2 · 2.52 / 18 = 0.28 моль; m(H) = 0.28 · 1 = 0.28 г
n(N) = 2n($N_2$) = 2 · 0.448 / 22.4 = 0.04 моль; m(N) = 0.04 · 14 = 0.56 г
m(C) = 1.8 – 0.28 – 0.56 = 0.96 г; n(C) = 0.96 / 12 = 0.08 моль
2) Вычисленная формула:
x : y : z = n(C) : n(H) : n(N) = 0.08 : 0.28 : 0.04 = 2 : 7 : 1
Вычисленная формула — $C_2H_7N$.
3) Структурная формула — $CH_3–NH–CH_3$
4) Уравнение реакции: $CH_3–NH–CH_3 + C_2H_5Cl → [(CH_3)_2NH(C_2H_5)]^{+}Cl^{–}$
Ответ:
Задача 6
Некоторое вещество было получено при окислении циклического углеводорода, не содержащего заместителей в цикле, перманганатом калия в присутствии серной кислоты. Это вещество содержит 40,68 % углерода, 54,24 % кислорода и 5,08 % водорода по массе.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу полученного вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного органического вещества с перманганатом калия в присутствии серной кислоты (используйте структурные формулы органических веществ).
Решение
Формула вещества — $C_xH_yO_z$.
1) Находим количественный состав образца.
Пусть $m_{в-ва}$ = 100 г, тогда
m(C) = 40.68 г; n(C) = 40.68 / 12 = 3.39 моль
m(H) = 5.08 г; n(H) = 5.08 / 1 = 5.08 моль
m(O) = 54.24 г; n(O) = 54.24 / 16 = 3.39 моль
2) Находим молекулярную формулу:
x : y : z = n(C) : n(H) : n(O) =
= 3.39 : 5.08 : 3.39 =
= 1 : 1.5 : 1 = (умножаем на 2)
= 2 : 3 : 2 = (умножаем на 2)
= 4 : 6 : 4
Вычисленная формула — $C_4H_6O_4$.
3) Структурная формула вещества —
4) Уравнение реакции окисления циклического углеводорода:
5 
Ответ:
Задача 7
При сгорании 11,6 г органического вещества выделилось 13,44 л (н. у.) углекислого газа и 10,8 мл воды. Плотность паров этого вещества равна 2,59 г/л. Вещество реагирует с гидроксидом меди(II).
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с свежеосажденным гидроксидом меди(II) (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
1) Находим количественный состав образца:
а) n(C) = n($CO_2$) = 13.44 / 22.4 = 0.6 моль
m(C) = 0.6 · 12 = 7.2 г
б) m($H_2O$) = 1 · 10.8 = 10.8 г; n(H) = 2n($H_2O$) = 2 · 10.8 / 18 = 1.2 моль
m(H) = 1 · 1.2 = 1.2 г
в) m(O) = 11.6 – 7.2 – 1.2 = 3.2 г; n(O) = 3.2 / 16 = 0.2 моль
2) Находим молекулярную формулу вещества:
а) x : y : z = n(C) : n(H) : n(O) = 0.6 : 1.2 : 0.2 = 3 : 6 : 1
Вычисленная формула — $C_3H_6O$.
M($C_3H_6O$) = 12 · 3 + 6 + 16 = 58 г/моль
б) M($C_xH_yO_z$) = 2.59 · 22.4 / 1 = 58,016 ≈ 58 г/моль
в) M($C_xH_yO_z$) / M($C_3H_6O$) = 58 : 58 = 1
Молекулярная формула — $C_3H_6O$.
3) Структурная формула вещества — $CH_3–CH_2–CHO$
4) Составляем уравнение реакции окисления пропаналя:
$CH_3–CH_2CHO + 2Cu(OH)_2 → CH_3–CH_2–COOH + Cu_2O + 2H_2O$
Ответ:
Задача 8
Массовая доля водорода 2,06, углерода 24,74 %, кислорода 32,99 %, калия 40,21 %. Вещество реагирует с гидроксидом калия с образованием углеводорода.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с гидроксидом калия (используйте структурные формулы органических веществ).
Решение
1) Находим молекулярную формулу вещества.
Пусть формула вещества — $C_xH_yO_zK_t$ и $m_{образца}$ = 100 г, тогда
а) m(C) = 24.74 г, n(C) = 24.74 / 12 ≈ 2.06 моль
m(H) = 2.06 г, n(H) = 2.06 / 1 = 2.06 моль
m(O) = 32.99 г, n(O) = 32.99 / 16 ≈ 2.06 моль
m(K) = 40.21 г, n(K) = 40.21 / 39 ≈ 1.03 моль
б) x : y : z : t = n(C) : n(H) : n(O) : n(K) = 2.06 : 2.06 : 2.06 : 1.03 =
= (2.06 / 1.03) : (2.06 / 1.03) : (2.06 / 1.03) : (1.03 / 1.03) ≈ 2 : 2 : 2 : 1 =
= 4 : 4 : 4 : 2
Молекулярная формула — $C_4H_4O_4K_2$.
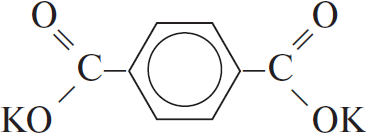
2) Структурная формула — $KO–CO–CH_2–CH_2–CO–OK$ или $(KOOC–CH_2CH_2–COOK)$
3) Уравнение реакции:
$KO–CO–CH_2–CH_2–CO–OK + 2KOH → 2K_2CO_3 + CH_3–CH_3$
Ответ:
Задача 9
Органическое вещество содержит 45,45 % углерода, 6,06 % водорода и 48,48 % кислорода. Известно, что при нагревании с раствором гидроксида натрия образуется несколько новых веществ, причём одно из них имеет разветвлённое строение. На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия (используйте структурные формулы органических веществ).
Решение
Вариант ответа:
Пусть формула вещества $C_xH_yO_z$ и $m_{образца}$ = 100 г, тогда:
а) m(C) = 45,45 г, n(C) = 45,45/12 ≈ 3,79 моль
m(H) = 6,06 г, n(H) = 6,06/1 = 6,06 моль
m(O) = 48,48 г, n(O) = 48,48/16 ≈ 3,03 моль
б) x : y : z = n(C) : n(H) : n(O) = 3,79 : 6,06 : 3,03 = (3,79/3,03) : (6,06/3,03) : (3,03/3,03) ≈ 1,25 : 2 : 1 = 5 : 8 : 4
Молекулярная формула вещества: $C_5H_8O_4$.
Структурная формула: $HO–CO–CO–OCH(CH_3)_2$
$(HOOC–COO–CH(CH_3)_2)$
Уравнение щелочного гидролиза сложного эфира:
$HO–CO–CO–OCH(CH_3)_2 + 2NaOH_{(водн.)} → CH_3–CH(OH)–CH_3 + NaO–CO–CO–ONa + H_2O$
Ответ: