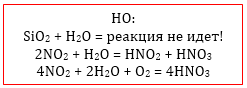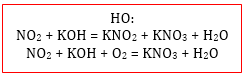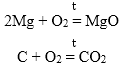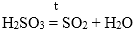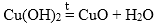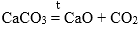Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Из предложенного перечня выберите два оксида, которые реагируют с раствором соляной кислоты, но не реагируют с раствором гидроксида натрия.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: Демонстрационная версия ЕГЭ—2017 по химии
2
Из предложенного перечня выберите два вещества, которые реагируют как с оксидом серы(VI), так и с оксидом серы(IV).
1) гидроксид калия
2) соляная кислота
3) оксид кремния (IV)
4) оксид натрия
5) кислород
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
3
Из предложенного перечня выберите два оксида, которые реагируют как с , так и с
.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
4
Из предложенного перечня выберите два вещества, которые не реагируют с оксидом меди (II).
1) кислород
2) серная кислота
3) алюминий
4) водород
5) вода
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
5
Из предложенного перечня выберите два оксида, которые могут реагировать с кислородом.
1) оксид цинка
2) оксид углерода (II)
3) оксид железа (III)
4) оксид серы (IV)
5) оксид серы (VI)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Пройти тестирование по этим заданиям
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 163 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Добавить в вариант
Из предложенного перечня выберите два вещества, с которыми реагирует оксид фосфора (V).
1) гидроксид бария
2) оксид натрия
3) водород
4) хлороводород
5) хлорид железа (II)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид углерода (IV) при нормальных условиях.
1) кислород и вода
2) вода и оксид кальция
3) сульфат калия и гидроксид натрия
4) гидроксид кальция и оксид бария
5) оксид кремния (IV) и водород
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 02.04.2016. Досрочная волна
Из предложенного списка выберите два оксида, которые растворяются в азотной кислоте, но не реагируют с щелочами.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных пар веществ.
Из предложенного списка выберите два оксида, которые реагируют с щелочами и не взаимодействуют с соляной кислотой.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных пар веществ.
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид цинка.
1) гидроксид натрия
2) оксид серы (VI)
3) оксид азота (II)
4) вода
5) сульфат калия
Запишите в поле ответа номера выбранных веществ.
Источник: ЕГЭ по химии 2019. Основная волна. Вариант 1
Оксид кальция реагирует с каждым из двух веществ:
1) и
2) и
3) и
4) и
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2
Из предложенного перечня выберите два вещества, с которыми оксид цинка не реагирует.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 2
Из предложенного перечня выберите две пары веществ, с каждым из которых взаимодействует оксид серы(IV).
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид кальция.
1) и
2) и
3) и
4) и
5) и
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид кальция.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 2
Из предложенного списка выберите два оксида, которые реагируют с углекислым газом.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Из предложенного списка выберите два оксида, которые реагируют и с соляной кислотой, и с раствором гидроксида натрия.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Из предложенного списка выберите два оксида, которые при нормальных условиях не реагируют ни с соляной кислотой, ни с раствором гидроксида натрия.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Из предложенного списка выберите два оксида, которые реагируют с разбавленным раствором гидроксида калия.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ порядке возрастания.
Из предложенного перечня выберите два оксида, которые взаимодействуют и с серной кислотой, и с гидроксидом натрия.
1) оксид цинка
2) оксид кальция
3) оксид серы(IV)
4) оксид углерода(IV)
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
Из предложенного перечня выберите два вещества, с которыми не реагирует оксид бария.
1) хлорид натрия
2) вода
3) серная кислота
4) карбонат кальция
5) оксид фосфора (V)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два оксида, которые при обычных условиях реагируют с водой.
1) оксид углерода (II)
2) оксид меди (II)
3) оксид фосфора (V)
4) оксид железа (III)
5) оксид углерода (IV)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два оксида, которые могут реагировать как с водой, так и с углекислым газом.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых возможна реакция.
1) и
2) и
3) и
4) и
5) и
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых возможна реакция.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Всего: 163 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Тематический тест на химические свойства оксидов.
Задание №1
Из предложенного списка оксидов выберите те, которые реагируют с водой при обычных условиях.
- 1. N2O5
- 2. Rb2O
- 3. ZnO
- 4. MnO
- 5. BeO
Решение
Ответ: 12
Задание №2
Из предложенного списка оксидов выберите те, которые не реагируют с водой при обычных условиях.
- 1. Cl2O
- 2. Li2O
- 3. CrO
- 4. CuO
- 5. CaO
Решение
Ответ: 34
Задание №3
Из предложенного списка оксидов выберите те, которые реагируют с водой при обычных условиях.
- 1. P2O3
- 2. Al2O3
- 3. Li2O
- 4. Fe2O3
- 5. N2O
Решение
Ответ: 13
Задание №4
Из предложенного списка оксидов выберите те, которые не реагируют с водой при обычных условиях.
- 1. NO2
- 2. CO
- 3. BaO
- 4. Cs2O
- 5. N2O
Решение
Ответ: 25
Задание №5
Из предложенного списка оксидов выберите те, которые не реагируют с водой при обычных условиях.
- 1. NO2
- 2. CO
- 3. BaO
- 4. Cs2O
- 5. N2O
Решение
Ответ: 25
Задание №6
Из предложенного списка оксидов выберите такой, который реагирует с водой при обычных условиях.
- 1. NO
- 2. Ag2O
- 3. ZnO
- 4. N2O5
- 5. Al2O3
В поле ответа введите уравнение реакции этого оксида с водой. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: N2O5 + H2O = 2HNO3
Задание №7
Из предложенного списка оксидов выберите такой, который реагирует с водой при обычных условиях.
- 1. CO
- 2. Li2O
- 3. CuO
- 4. Cu2O
- 5. Fe2O3
В поле ответа введите уравнение реакции этого оксида с водой. В качестве разделителя левой и правой частей используйте знак равенства.
Решение
Ответ: Li2O + H2O = 2LiOH
Задание №8
Из предложенного списка оксидов выберите тот, который реагирует с водой при обычных условиях.
- 1. P2O5
- 2. Al2O3
- 3. SiO2
- 4. Fe2O3
- 5. N2O
Запишите уравнение реакции этого оксида с избытком воды.
Решение
Ответ: P2O5 + 3H2O = 2H3PO4
Задание №9
Из предложенного списка оксидов выберите тот, который реагирует с водой при обычных условиях.
- 1. NO2
- 2. CO
- 3. BeO
- 4. Al2O3
- 5. N2O
Запишите уравнение реакции этого оксида с водой.
Решение
Ответ: 2NO2 + H2O = HNO3 + HNO2
Задание №10
Из предложенного списка оксидов выберите тот, который реагирует с водой при обычных условиях.
- 1. SiO2
- 2. Cu2O
- 3. SrO
- 4. CrO
- 5. Cr2O3
Запишите уравнение реакции этого оксида с водой.
Решение
Ответ: SrO + H2O = Sr(OH)2
[adsp-pro-3]
Задание №11
Из предложенного списка оксидов выберите тот, который реагирует с водой при обычных условиях.
- 1. MgO
- 2. FeO
- 3. N2O3
- 4. CO
- 5. CrO
Запишите уравнение реакции этого оксида с водой.
Решение
Ответ: N2O3 + H2O = 2HNO2
Задание №12
Из предложенного списка оксидов выберите такой, который реагирует с водой при обычных условиях.
- 1. NO2
- 2. BeO
- 3. SiO2
- 4. ZnO
- 5. CO
Запишите уравнение реакции этого оксида с водой в присутствии кислорода.
Решение
Ответ: 4NO2 + O2 + 2H2O = 4HNO3
Задание №13
Из предложенного списка оксидов выберите два таких, которые могут реагировать с кислородом.
- 1. P2O3
- 2. Rb2O
- 3. Al2O3
- 4. MgO
- 5. SO2
Решение
Ответ: 15
Задание №14
Из предложенного списка оксидов выберите два таких, которые не могут реагировать с кислородом.
- 1. FeO
- 2. ZnO
- 3. CuO
- 4. CO
- 5. MnO
Решение
Ответ: 23
Задание №15
Из предложенного списка оксидов выберите два таких, которые могут реагировать с кислородом.
- 1. Li2O
- 2. Cr2O3
- 3. CrO
- 4. FeO
- 5. BeO
Решение
Ответ: 34
Задание №16
Из предложенного списка оксидов выберите два таких, которые не могут реагировать с кислородом.
- 1. N2O5
- 2. Cu2O
- 3. FeO
- 4. CO
- 5. SO3
Решение
Ответ: 15
Задание №17
Из предложенного списка оксидов выберите два таких, которые могут реагировать с кислородом.
- 1. MnO
- 2. P2O5
- 3. SrO
- 4. Al2O3
- 5. NO
Решение
Ответ: 15
Задание №18
Из предложенного списка оксидов выберите два таких, которые не могут реагировать с кислородом.
- 1. SO3
- 2. FeO
- 3. Cl2O7
- 4. Cu2O
- 5. CrO
Решение
Ответ: 13
Задание №19
Из предложенного списка оксидов выберите два таких, которые могут реагировать с кислородом.
- 1. CO2
- 2. SiO2
- 3. CO
- 4. N2O
- 5. NO
Решение
Ответ: 35
Задание №20
Из предложенного списка оксидов выберите два таких, которые не могут реагировать с кислородом.
- 1. MgO
- 2. CrO
- 3. CuO
- 4. NO
- 5. CO
Решение
Ответ: 13
[adsp-pro-3]
Задание №21
Из предложенного списка оксидов выберите два таких, которые могут реагировать с кислородом.
- 1. MgO
- 2. MnO
- 3. N2O
- 4. Cu2O
- 5. CrO3
Решение
Ответ: 24
Задание №22
Из предложенного списка оксидов выберите два таких, которые не могут реагировать с кислородом.
- 1. FeO
- 2. Li2O
- 3. Fe2O3
- 4. NO
- 5. CO
Решение
Ответ: 23
Задание №23
Из предложенного перечня оксидов выберите такой, который реагирует с кислородом.
- 1. N2O
- 2. NO
- 3. N2O3
- 4. NO2
- 5. N2O5
Запишите уравнение этой реакции.
Решение
Ответ: 2NO + O2 = 2NO2
Задание №24
Из предложенного перечня оксидов выберите такой, который реагирует с кислородом.
- 1. Fe2O3
- 2. CrO3
- 3. Cr2O3
- 4. MnO2
- 5. SO2
Запишите уравнение данной реакции.
Решение
Ответ: 2SO2 + O2 = 2SO3
Задание №25
Из предложенного перечня оксидов выберите такой, который реагирует с кислородом.
- 1. Cu2O
- 2. Cr2O3
- 3. N2O
- 4. CrO3
- 5. NO2
Запишите уравнение данной реакции.
Решение
Ответ: 2Cu2O + O2 = 4CuO
Задание №26
Из предложенного списка оксидов выберите два таких, которые могут реагировать с соляной кислотой.
- 1. CO2
- 2. SO2
- 3. Al2O3
- 4. MgO
- 5. N2O
Решение
Ответ: 34
Задание №27
Из предложенного списка оксидов выберите два таких, которые не могут реагировать с соляной кислотой.
- 1. CO2
- 2. CrO
- 3. CO
- 4. FeO
- 5. BeO
Решение
Ответ: 13
Задание №28
Из предложенного списка оксидов выберите два таких, которые могут реагировать с концентрированной азотной кислотой.
- 1. N2O5
- 2. P2O3
- 3. SO3
- 4. SrO
- 5. NO2
Решение
Ответ: 24
Задание №29
Из предложенного списка оксидов выберите два таких, которые не могут реагировать с концентрированной азотной кислотой.
- 1. Cl2O7
- 2. Mn2O7
- 3. MnO
- 4. Ag2O
- 5. Cr2O3
Решение
Ответ: 12
Задание №30
Из предложенного списка оксидов выберите два таких, которые могут реагировать с плавиковой кислотой.
- 1. CO2
- 2. NO2
- 3. SiO2
- 4. SO2
- 5. Cs2O
Решение
Ответ: 35
[adsp-pro-3]
Задание №31
Из предложенного списка оксидов выберите два таких, которые не могут реагировать с плавиковой кислотой.
- 1. Cl2O
- 2. K2O
- 3. SrO
- 4. CO
- 5. FeO
Решение
Ответ: 14
Задание №32
Из предложенного списка оксидов выберите два таких, которые могут реагировать с концентрированной серной кислотой.
- 1. P2O3
- 2. P2O5
- 3. CrO3
- 4. CrO
- 5. N2O
Решение
Ответ: 14
Задание №33
Из предложенного списка оксидов выберите два таких, которые не могут реагировать с концентрированной серной кислотой.
- 1. Li2O
- 2. SO2
- 3. Rb2O
- 4. Cs2O
- 5. SO3
Решение
Ответ: 25
Задание №34
Из предложенного списка оксидов выберите два таких, которые могут реагировать с бромоводородной кислотой.
- 1. SiO2
- 2. SrO
- 3. N2O
- 4. Fe2O3
- 5. SO2
Решение
Ответ: 24
Задание №35
Из предложенного перечня кислот, выберите одну такую, которая будет реагировать с SO2:
- 1. HCl
- 2. HBr
- 3. H2SO4
- 4. H2S
- 5. HF
Запишите уравнение данной реакции.
Решение
Ответ: SO2 + 2H2S = 3S + 2H2O
Задание №36
Из предложенного списка выберите две пары оксидов, между которыми возможно протекание химической реакции.
1) оксид рубидия + сернистый газ
2) оксид натрия + веселящий газ
3) оксид калия + углекислый газ
4) оксид цезия + оксид марганца(II)
5) оксид лития + оксид кальция
Решение
Ответ: 13
Задание №37
Из предложенного списка выберите те пары оксидов, между которыми невозможно протекание химической реакции.
1) оксид серы(VI) + оксид стронция
2) сернистый газ + негашеная известь
3) оксид серы(VI) + оксид фосфора
4) оксид серы(VI) + оксид азота(V)
5) сернистый газ + оксид бария
Решение
Ответ: 34
Задание №38
Из предложенного списка выберите те пары оксидов, между которыми возможно протекание химической реакции.
1) оксид алюминия + оксид кальция
2) оксид алюминия + оксид серы(VI)
3) оксид алюминия + оксид цинка
4) оксид алюминия + угарный газ
5) оксид алюминия + углекислый газ
Решение
Ответ: 12
Задание №39
Из предложенного списка выберите те пары оксидов, между которыми невозможно протекание химической реакции.
1) оксид бария + оксид цинка
2) оксид стронция + оксид серы(IV)
3) оксид кальция + оксид калия
4) оксид магния + оксид хрома(II)
5) оксид стронция + углекислый газ
Решение
Ответ: 34
Задание №40
Из предложенного списка выберите те пары оксидов, между которыми возможно протекание химической реакции.
1) оксид хрома(II) + оксид натрия
2) оксид хрома(III) + оксид калия
3) оксид хрома(VI) + оксид серы(VI)
4) оксид хрома(III) + оксид азота(I)
5) оксид хрома(II) + угарный газ
Решение
Ответ: 25
[adsp-pro-3]
Задание №41
Из предложенного списка выберите те пары оксидов, между которыми невозможно протекание химической реакции.
1) угарный газ + оксид алюминия
2) углекислый газ + оксид бария
3) угарный газ + оксид меди(I)
4) углекислый газ + оксид стронция
5) угарный газ + оксид кальция
Решение
Ответ: 15
Задание №42
Из предложенного списка выберите те пары оксидов, между которыми возможно протекание химической реакции.
1) оксид азота(I) + оксид алюминия
2) оксид азота(II) + оксид железа(III)
3) оксид азота(V) + оксид натрия
4) оксид азота(IV) + оксид углерода(IV)
5) оксид азота(V) + оксид цинка
Решение
Ответ: 35
Задание №43
Из предложенного списка выберите те пары оксидов, между которыми невозможно протекание химической реакции.
1) оксид цинка + угарный газ
2) оксид цинка + оксид железа(III)
3) оксид цинка + оксид рубидия
4) оксид цинка + веселящий газ
5) оксид цинка + оксид цезия
Решение
Ответ: 24
Задание №44
Из предложенного списка выберите те пары оксидов, между которыми невозможно протекание химической реакции.
1) оксид железа(II) + оксид лития
2) оксид железа(III) + оксид цезия
3) оксид железа(II) + оксид серы(VI)
4) оксид железа(III) + оксид бериллия
5) оксид железа(II) + угарный газ
Решение
Ответ: 14
Задание №45
Из предложенного перечня оксидов выберите такой, который реагирует с оксидом фосфора (V)
- 1. CO
- 2. Mn2O7
- 3. Na2O
- 4. CrO3
- 5. N2O
В поле ответа введите уравнение этой реакции. В качестве разделителя левой и правой части используйте знак равенства.
Решение
Ответ: 3Na2O + P2O5 = 2Na3PO4
Задание №46
Из предложенного перечня оксидов выберите такой, который реагирует с оксидом алюминия
- 1. CO2
- 2. NO
- 3. SO3
- 4. ZnO
- 5. Fe2O3
В поле ответа введите уравнение этой реакции. В качестве разделителя левой и правой части используйте знак равенства.
Решение
Ответ: Al2O3 + 3SO3 = Al2(SO4)3
Задание №47
Из предложенного перечня оксидов выберите такой, который реагирует с оксидом алюминия при нагревании
- 1. BeO
- 2. K2O
- 3. Cr2O3
- 4. CO
- 5. N2O
Запишите уравнение данной реакции.
Решение
Ответ: Al2O3 + K2O = 2KAlO2
Задание №48
Из предложенного списка оксидов выберите те, которые могут реагировать с гидроксидом натрия.
- 1. N2O3
- 2. CrO3
- 3. CaO
- 4. BaO
- 5. CrO
Решение
Ответ: 12
Задание №49
Из предложенного списка оксидов выберите те, которые не могут реагировать с гидроксидом калия.
- 1. SeO3
- 2. CuO
- 3. Fe2O3
- 4. FeO
- 5. Cl2O
Решение
Ответ: 24
Задание №50
Из предложенного списка оксидов выберите те, которые могут реагировать с гашеной известью.
- 1. Mn2O7
- 2. MgO
- 3. Rb2O
- 4. Cr2O3
- 5. NO
Решение
Ответ: 14
[adsp-pro-3]
Задание №51
Из предложенного списка оксидов выберите те, которые не могут реагировать с гидроксидом бария.
- 1. SiO2
- 2. Li2O
- 3. Al2O3
- 4. SrO
- 5. Cl2O7
Решение
Ответ: 24
Задание №52
Из предложенного списка оксидов выберите те, которые могут реагировать с гидроксидом цинка.
- 1. Cs2O
- 2. N2O
- 3. Li2O
- 4. BeO
- 5. ZnO
Решение
Ответ: 13
Задание №53
Из предложенного списка оксидов выберите те, которые не могут реагировать с гидроксидом алюминия.
- 1. SO3
- 2. CaO
- 3. SrO
- 4. Cr2O3
- 5. CO
Решение
Ответ: 45
Задание №54
Из предложенного списка оксидов выберите те, которые могут реагировать с каустической содой.
- 1. Cs2O
- 2. SO3
- 3. CaO
- 4. CrO3
- 5. BaO
Решение
Ответ: 24
Задание №55
Из предложенного списка оксидов выберите те, которые не могут реагировать с раствором гидроксида калия.
- 1. CrO
- 2. BeO
- 3. CO
- 4. ZnO
- 5. NO2
Решение
Ответ: 13
Задание №56
Из предложенного списка оксидов выберите те, которые могут реагировать с гидроксидом цезия.
- 1. Cl2O
- 2. N2O
- 3. Li2O
- 4. K2O
- 5. Cr2O3
Решение
Ответ: 15
Задание №57
Из предложенного списка оксидов выберите те, которые не могут реагировать с гидроксидом стронция.
- 1. CO2
- 2. Al2O3
- 3. Na2O
- 4. Cr2O3
- 5. Cs2O
Решение
Ответ: 35
Задание №58
Впишите в поле ответа уравнение реакции, протекающей при пропускании углекислого газа через избыток водного раствора гидроксида натрия. В качестве разделителя левой и правой частей используйте знак равенства
Решение
Ответ: CO2 + 2NaOH = Na2CO3 + H2O
Задание №59
Впишите в поле ответа уравнение реакции, протекающей при пропускании избытка углекислого газа через водный раствор гидроксида натрия. В качестве разделителя левой и правой частей используйте знак равенства
Решение
Ответ: CO2 + NaOH = NaHCO3
Задание №60
Из предложенного перечня оксидов выберите такой, который будет реагировать с твердым гидроксидом натрия при сплавлении.
- 1. CaO
- 2. FeO
- 3. Al2O3
- 4. MnO
- 5. Li2O
Впишите в поле ответа уравнение данной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2NaOH + Al2O3 = 2NaAlO2 + H2O
[adsp-pro-3]
Задание №61
Из предложенного перечня оксидов выберите такой, который будет реагировать с водным раствором гидроксида калия
- 1. CO
- 2. FeO
- 3. MnO
- 4. ZnO
- 5. CrO
Впишите в поле ответа уравнение данной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: ZnO + 2KOH + H2O = K2[Zn(OH)4]
Задание №62
Из предложенного перечня оксидов выберите такой, который будет реагировать с водным раствором гидроксида натрия
- 1. NO
- 2. Ag2O
- 3. CuO
- 4. Al2O3
- 5. CrO
Впишите в поле ответа уравнение данной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Задание №63
Из предложенного перечня оксидов выберите такой, который будет реагировать с твердым карбонатом натрия при сплавлении:
- 1. FeO
- 2. CaO
- 3. ZnO
- 4. CO
- 5. NO
В поле ответа введите уравнение данной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na2CO3 + ZnO = Na2ZnO2 + CO2
Задание №64
Из предложенного перечня оксидов выберите такой, который будет реагировать с твердым карбонатом калия при сплавлении:
- 1. Li2O
- 2. BaO
- 3. N2O
- 4. CO2
- 5. SiO2
В поле ответа введите уравнение данной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: K2CO3 + SiO2 = K2SiO3 + CO2
Задание №65
Из предложенного перечня оксидов выберите такой, который будет реагировать с твердым карбонатом рубидия при сплавлении:
- 1. CrO
- 2. Na2O
- 3. N2O
- 4. Al2O3
- 5. CO
В поле ответа введите уравнение данной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Rb2CO3 + Al2O3 = 2RbAlO2 + CO2
Задание №66
Из предложенного списка оксидов выберите те, которые могут реагировать с угарным газом.
- 1. SrO
- 2. Cu2O
- 3. ZnO
- 4. Cs2O
- 5. BaO
Решение
Ответ: 23
Задание №67
Из предложенного списка оксидов выберите те, которые могут реагировать с водородом.
- 1. Cr2O3
- 2. Li2O
- 3. CrO
- 4. MgO
- 5. CaO
Решение
Ответ: 13
Задание №68
Из предложенного списка оксидов выберите те, которые можно восстановить углем до металлов.
- 1. Cr2O3
- 2. Al2O3
- 3. Li2O
- 4. Fe2O3
- 5. Na2O
Решение
Ответ: 14
Задание №69
Из предложенного списка оксидов выберите те, которые не могут реагировать с угарным газом.
- 1. Fe2O3
- 2. CO
- 3. BaO
- 4. CrO
- 5. FeO
Решение
Ответ: 23
Задание №70
Из предложенного списка оксидов выберите те, которые не могут реагировать с водородом.
- 1. SO2
- 2. CuO
- 3. Ag2O
- 4. Rb2O
- 5. ZnO
Решение
Ответ: 14
[adsp-pro-3]
Задание №71
Из предложенного списка оксидов выберите те, которые нельзя восстановить углем до металлов.
- 1. ZnO
- 2. MgO
- 3. Cr2O3
- 4. CrO
- 5. Al2O3
Решение
Ответ: 25
Задание №72
Из предложенного списка оксидов выберите те, которые могут реагировать с угарным газом.
- 1. Cu2O
- 2. FeO
- 3. MgO
- 4. BaO
- 5. SrO
Решение
Ответ: 12
Задание №73
Из предложенного списка оксидов выберите те, которые могут реагировать с водородом.
- 1. Cs2O
- 2. BeO
- 3. Fe2O3
- 4. BaO
- 5. PbO
Решение
Ответ: 35
Задание №74
Из предложенного списка оксидов выберите те, которые можно восстановить углем до металлов.
- 1. Cr2O3
- 2. MgO
- 3. PbO
- 4. SrO
- 5. Cs2O
Решение
Ответ: 13
Задание №75
Из предложенного списка оксидов выберите те, которые не могут реагировать с угарным газом.
- 1. Cu2O
- 2. SrO
- 3. Na2O
- 4. CrO
- 5. Cr2O3
Решение
Ответ: 23
Задание №76
Установите соответствие между формулой оксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ОКСИД | РЕАГЕНТЫ |
|
А) CO2 Б) Rb2O В) CrO |
1) вода, оксид натрия, оксид калия 2) кислород, водород, серная кислота 3) гидроксид лития, соляная кислота, азот 4) азотная кислота, вода, сернистый газ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 142
Задание №77
Установите соответствие между формулой оксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ОКСИД | РЕАГЕНТЫ |
|
А) SiO2 Б) CO В) Al2O3 |
1) H2O, HCl, HNO3 2) O2, Fe2O3, ZnO 3) KOH, K2CO3, HF 4) CO, HBr, Ca(OH)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 323
Задание №78
Установите соответствие между формулой оксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ОКСИД | РЕАГЕНТЫ |
|
А) SO2 Б) Cr2O3 В) Cs2O |
1) водород, азот, кислород 2) кислород, едкий натр, оксид стронция 3) карбонат цезия, угарный газ, серная кислота 4) углекислый газ, вода, плавиковая кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 234
Задание №79
Установите соответствие между формулой оксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ОКСИД | РЕАГЕНТЫ |
|
А) CrO3 Б) CO В) MgO |
1) H2SO4, SO3, HI 2) RbOH, Li2O, H2O 3) O2, Cu2O, Fe2O3 4) H2O, K2SO4, HNO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 231
Задание №80
Установите соответствие между формулой оксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ОКСИД | РЕАГЕНТЫ |
|
А) Al2O3 Б) Li2O В) CO2 |
1) едкий натр, оксид лития, соляная кислота 2) гашеная известь, едкий натр, вода 3) гидроксид бария, кислород, вода 4) соляная кислота, вода, оксид бериллия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 142
[adsp-pro-3]
Задание №81
Установите соответствие между формулой оксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ОКСИД | РЕАГЕНТЫ |
|
А) CrO Б) SiO2 В) NO2 |
1) CsOH, H2O, Sr(OH)2 2) HNO3(конц), C, H2 3) K2O, LiOH, K2CO3(тв) 4) HF, KOH, H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 231
Задание №82
Установите соответствие между формулой оксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ОКСИД | РЕАГЕНТЫ |
|
А) SO2 Б) P2O5 В) Na2O |
1) оксид алюминия, вода, едкий натр 2) вода, серная кислота, водород 3) кислород, оксид лития, гидроксид цезия 4) углекислый газ, вода, оксид цинка |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 314
Задание №83
Установите соответствие между формулой оксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ОКСИД | РЕАГЕНТЫ |
|
А) SrO Б) N2O5 В) Cr2O3 |
1) O2, LiOH, Ba(OH)2 2) H2, Na2CO3, HCl 3) SO2, H2O, HNO3 4) ZnO, K2O, H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 342
Задание №84
Установите соответствие между формулой оксида и набором реагентов, с каждым из которых он может взаимодействовать.
| ОКСИД | РЕАГЕНТЫ |
|
А) Al2O3 Б) СO2 В) CO |
1) оксид железа(III), оксид меди, кислород 2) оксид натрия, гидроксид калия, вода 3) карбонат стронция, соляная кислота, вода 4) серная кислота(разб), азотная кислота, поташ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 421
Задание №85
Определите объем углекислого газа, необходимый для реакции с 200 г 10% раствора едкого натра с образованием средней соли. Ответ укажите в литрах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 5,6
Задание №86
Вычислите массовую долю кислоты в растворе, полученном при взаимодействии 14,2 г оксида фосфора(V) и 185,8 мл воды. Ответ укажите в процентах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 9,8
Задание №87
Вычислите объем кислорода, необходимый для получения оксида фосфора(V) из 31 г фосфора при его сжигании Ответ укажите в литрах и округлите с точностью до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 28
Задание №88
Рассчитайте массовую долю кислоты в растворе, полученном при смешении 95 мл воды и 10 г смеси оксида хрома(VI) и песка. Массовая доля песка в смеси 50%. Ответ укажите в процентах и округлите с точностью до десятых. Считайте, что в результате реакции образуется только хромовая кислота H2CrO4
Решение
Ответ: 5,9
Задание №89
Определите массу углерода, необходимого для полного восстановления 23,2 г железной окалины до металла. Считать, что в условиях проведения реакции единственным газообразным продуктом является угарный газ. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 4,8
Задание №90
Рассчитайте объем сернистого газа, который может прореагировать с 100 мл 25% раствора гидроксида натрия (плотность 1,2 г/мл) с образованием средней соли. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 8,4
[adsp-pro-3]
Задание №91
Вычислите массу поташа, необходимую для получения 44,8 л углекислого газа в реакции с избытком соляной кислоты. Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 276
Задание №92
Определите массовую долю соли в растворе, полученном при смешении 100 г 10% раствора гидроксида натрия и 100 г 36% раствора соляной кислоты. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 7,3
Задание №93
Навеску серы массой 8 г сожгли в избытке кислорода. Образовавшийся сернистый газ пропустили через 200 г 20% раствора гидроксида калия. Определите массу образовавшейся соли. Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 39,5
Задание №94
Смесь оксида меди(II) и оксида меди(I) массой 50 г нагревали в токе кислорода до постоянной массы. Вычислите объем израсходованного кислорода, если массовая доля оксида меди(II) в изначальной смеси была 71,2%. Ответ укажите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 1,12
Пояснение:
Запишем уравнение реакции:
2Cu2O + O2 = 4CuO
m(CuO) = ω(CuO) · m(смеси) = 0,712 · 50 г = 35,6 г
m(Cu2O) = m(смеси) — m(CuO) = 50 г — 35,6 г = 14,4 г
ν(Cu2O) = m(Cu2O) / M(Cu2O) = 14,4 г / 144 г/моль = 0,1 моль
Из уравнения реакции следует, что:
ν(O2) = ν(Cu2O)/2 = 0,1 моль/2 = 0,05 моль
V(O2) = ν(O2) · Vm = 0,05 моль · 22,4 л/моль = 1,12 л
Задание №95
Смесь углекислого и угарного газов объемом 22,4 л пропустили через избыток раствора гидроксида натрия. Вычислите объем угарного газа, если в растворе образовалось 21,2 г карбоната натрия. Ответ укажите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 17,92
Задание №96
Навеску оксида алюминия массой 20,4 г смешали с избытком поташа и прокалили до постоянной массы. Рассчитайте объем выделившегося в реакции газа. Ответ укажите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 4,48
Задание №97
Рассчитайте массовую долю нитрата свинца, полученную при полном растворении смеси оксида цинка и оксида свинца(II) массой 100 г и массовой долей оксида цинка 15% в 0,9 кг раствора азотной кислоты. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 12,6
Задание №98
При горении навески углерода образовалась смесь углекислого и угарного газа объемом 11,2 л. Данная смесь может восстановить до металла 10 г оксида меди(II). Определите массу исходной навески. Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 6
Задание №99
Рассчитайте массовую долю щелочи в растворе, полученном при растворении 8,96 л оксида азота(IV) в 81,6 г 20% раствора едкого натра. Ответ укажите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 0,32
Задание №100
При горении 27 г алюминия образовался оксид, который далее полностью растворили в 349 г концентрированной азотной кислоты. Определите массовую долю соли в образовавшемся растворе. Ответ укажите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 53,25
[adsp-pro-3]
Задание №101
Вычислите массу водорода, необходимую для полного восстановления 100 г смеси меди и оксида меди(II), если известно, что массовая доля меди в исходной смеси равна 20%. Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 2
Задание №102
Определите массовую долю серной кислоты в растворе, полученном при смешении 20 г оксида серы(VI) и 0,12 л 50% раствора серной кислоты (плотность 1,5 г/мл). Ответ укажите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 57,25
[adsp-pro-10]
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Тип 9 № 9
Как кислотными, так и основными свойствами обладает каждый из оксидов ряда:
Источник: Демонстрационный вариант теста по химии 2016 год.
2
Тип 10 № 60
Кислотный оксид образуется при взаимодействии кислорода с веществом:
Источник: Централизованное тестирование по химии, 2016
3
Тип 25 № 75
При добавлении оксида серы(VI) к воде, содержащей метилоранж, в растворе:
а) увеличивается
б) уменьшается
в) увеличивается концентрация ионов
г) изменяется окраска
1) а, в
2) б, в
3) б, в, г
4) а, г
Источник: Централизованное тестирование по химии, 2016
4
Кислотный оксид образуется при взаимодействии кислорода с веществом:
Источник: Централизованное тестирование по химии, 2016
5
При добавлении оксида лития к воде, содержащей фенолфталеин, в растворе:
а) увеличивается
б) увеличивается концентрация ионов
в) изменяется окраска
г) уменьшается
1) а, б
2) в, г
3) а, б, в
4) а, в
Источник: Централизованное тестирование по химии, 2016
Пройти тестирование по этим заданиям
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления –2. Лишь один химический элемент — фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Классификация оксидов, которую мы ещё раз с вами повторим:
- основные: металл в степени окисления +1 и +2;
- амфотерные: металл в степени окисления +3 и +4. Исключения: ZnO, BeO, SnO, PbO;
- кислотные: все неметаллы и металлы в степенях окисления +5, +6 и +7;
- несолеобразующие: NO, N2O, CO, SiO.
Физические свойства оксидов.
- По агрегатному состоянию оксиды делятся на три группы: твердые (K2O, Al2O3, P2O5), жидкие (SO3, Mn2O7), и газообразные (CO2, NO2, SO2).
- По растворимости в воде оксиды делятся на растворимые (SO2, CO2, K2O) и нерастворимые (CuO, FeO, SiO2, Al2O3). Все кислотные оксиды, кроме SiO2, растворимы в воде. Среди основных оксидо растворимыми являются только оксиды щелочных металлов и щелочноземельных металлов. Амфотерные оксиды не растворяются в воде.
Химические свойства основных оксидов
1. Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием щелочей:
Оксид + H2O = Щелочь;
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
2. Общим свойством всех основных оксидов является их способность взаимодействовать с кислотами с образованием соли и воды:
Оксид + кислота = соль + H2O
CaO + H2SO4 = CaSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
3. Основные оксиды взаимодействуют с кислотными оксидами с образованием солей:
Основные оксид + кислотный оксид = Соль
3СaO + P2O5 = Ca3(PO4)2
BaO + CO2 = BaCO3
Химические свойства кислотных оксидов
1. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты:
Кислотный оксид + H2O = кислота
P2O5 + 3H2O = 2H3PO4
N2O5 + H2O = 2HNO3
2. Общим свойством всех кислотных оксидов является их способность взаимодействовать с овнованиями с образованием соли и воды:
кислотный оксид + основание = соль + H2O
P2O5 + 6NaOH = 2Na3PO4 + 6H2O
SO2 + Ca(OH)2 = CaSO3 + H2O
3. Кислотные оксиды взаимодействую с основными оксидами с образованием солей (при нагревании)
Ксилотный оксид + основные оксид = соль;
3CaO + P2O5 = Ca3(PO4)2
CrO3 + CaO = CaCrO4
Химические свойства амфотерных оксидов
1. Амфотерные оксиды взаимодействуют с кислотами с образованием солей и воды — проявляют свойства основных оксидов.
Амфотерный оксид + кислота = соль + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
2. Амфотерные оксиды взаимодействуют со щелочами с образованием солей и воды — проявляют свойства ксилотных оксидов.
Амфотерный оксид + щелочь = соль + H2O
ZnO + KOH = K2ZnO2 + H2O
3. Амфотерные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей.
Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3
4. Амфотерные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей.
Амфотерный оксид + основный оксид = соль
ZnO + Na2O = Na2ZnO2
Получение оксидов
1. Взаимодействие простых веществ с кислородом:
Металл или неметалл + O2 = Оксид
2. Разложение некоторых оксокислот:
Оксокислота = кислотный оксид + H2O
3. Разложение нерастворимых основний:
Нерастворимое основание = основный оксид + H2O;
4. Разложение некоторых солей:
Соль = основный оксид + кислотный оксид
Химические свойства оксидов
Взаимодействие оксидов с водой
| Правило | Комментарий |
|---|---|
| Основный оксид + H2O → Щелочь |
Реакция идет, если образуется растворимое основание, а также Ca(OH)2: CaO + H2O → Ca(OH)2 MgO + H2O → Реакция не идет, ак как Mg(OH)2 нерастворим* |
| Амфотерный оксид | Амфотерные оксиды, также как и амфотерные гидроксиды, с водой не взаимодействуют |
| Кислотный оксид + H2O → Кислота |
Все реакции идут за исключением SiO2 (кварц, песок): SiO2 + H2O → реакция не идет |
* Источник: [2] «Я сдам ЕГЭ. Курс самоподготовки», стр. 143.
Взаимодействие оксидов друг с другом
1. Оксиды одного типа друг с другом не взаимодействуют:
Na2O + CaO → реакция не идет
CO2 + SO3 → реакция не идет
2. Как правило, оксиды разных типов взаимодействуют друг с другом (исключения: CO2, SO2, о них подробнее ниже):
Na2O + SO3 → Na2SO4
CaO + CO2 → CaCO3
Na2O + ZnO → Na2ZnO2
Взаимодействие оксидов с кислотами
1. Как правило, основные и амфотерные оксиды взаимодействуют с кислотами:
Na2O + HNO3 → NaNO3 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Исключением является очень слабая нерастворимая (мета)кремниевая кислота H2SiO3. Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
CuO + H2SiO3 → реакция не идет.
2. Кислотные оксиды не вступают в реакции ионного обмена с кислотами, но возможны некоторые окислительно-восстановительные реакции:
SO2 + 2H2S → 3S + 2H2O
SO3 + H2S → SO2 + H2O
SiO2 + 4HF(нед.) → SiF4 + 2H2O
С кислотами-окислителями (только если оксид можно окислить):
SO2 + HNO3 + H2O → H2SO4 + NO
Взаимодействие оксидов с основаниями
1. Основные оксиды с щелочами и нерастворимыми основаниями НЕ взаимодействуют.
2. Кислотные оксиды взаимодействуют с основаниями с образованием солей:
SiO2 + 2NaOH → Na2SiO3 +H2O
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3 (если CO2 в избытке)
3. Амфотерные оксиды взаимодействуют с щелочами (т.е. только с растворимыми основаниями) с образованием солей или комплексных соединений:
а) Реакциях с растворами щелочей:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
б) Сплавление с твердыми щелочами:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
(кислота: H2ZnO2)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
(кислота: H2BeO2)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (алюминат натрия)
(кислота: HAlO2)
Взаимодействие оксидов с солями
1. Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
SiO2 + CaCO3 → CaSiO3 + CO2
P2O5 + 3CaCO3 → Ca3(PO4)2 + 3CO2
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
ZnO + 2KHCO3 → K2ZnO2 + 2CO2 + H2O
SiO2 + K2SO3 → K2SiO3 + SO2
ZnO + Na2SO3 → Na2ZnO2 + SO2
Если оба оксида являются газообразными, то выделяется тот, который соответствует более слабой кислоте:
K2CO3 + SO2 → K2SO3 + CO2 (H2CO3 слабее и менее устойчива, чем H2SO3)
2. Растворенный в воде CO2 растворяет нерастворимые в воде карбонаты (с образованием растворимых в воде гидрокарбонатов):
CO2 + H2O + CaCO3 → Ca(HCO3)2
CO2 + H2O + MgCO3 → Mg(HCO3)2
В тестовых заданиях такие реакции могут быть записаны как:
MgCO3 + CO2 (р-р), т.е. используется раствор с углекислым газом и, следовательно, в реакцию необходимо добавить воду.
Это один из способов получения кислых солей.
Восстановление слабых металлов и металлов средней активности из их оксидов возможно с помощью водорода, углерода, угарного газа или более активного металла (все реакции проводятся при нагревании):
1. Реакции с CO, C и H2:
CuO + C → Cu + CO
CuO + CO → Cu + CO2
CuO + H2 → Cu + H2O
ZnO + C → Zn + CO
ZnO + CO → Zn + CO2
ZnO + H2 → Zn + H2O
PbO + C → Pb + CO
PbO + CО → Pb + CO2
PbO + H2 → Pb + H2O
FeO + C → Fe + CO
FeO + CО → Fe + CO2
FeO + H2 → Fe + H2O
Fe2O3 + 3C → 2Fe + 3CO
Fe2O3 + 3CО → 2Fe + 3CO2
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
2. Восстановление активных металлов (до Al включительно) приводит к образованию карбидов, а не свободного металла:
CaO + 3C → CaC2 + 3CO
2Al2O3 + 9C → Al4C3 + 6CO
3. Восстановление более активным металлом:
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3.
4. Некоторые оксиды неметаллов также возможно восстановить до свободного неметалла:
2P2O5 + 5C → 4P + 5CO2
SO2 + C → S + CO2
2NO + C → N2 + CO2
2N2O + C → 2N2 + CO2
SiO2 + 2C → Si + 2CO
Только оксиды азота и углерода реагируют с водородом:
2NO + 2H2 → N2 + 2H2O
N2O + H2 → N2 + H2O
SiO2 + H2 → реакция не идет.
В случае углерода восстановления до простого вещества не происходит:
CO + 2H2 <=> CH3OH (t, p, kt)
Особенности свойств оксидов CO2 и SO2
1. Не реагируют с амфотерными гидроксидами:
CO2 + Al(OH)3 → реакция не идет
2. Реагируют с углеродом:
CO2 + C → 2CO
SO2 + C → S + CO2
3. С сильными восстановителями SO2 проявляет свойства окислителя:
SO2 + 2H2S → 3S + 2H2O
SO2 + 4HI → S + 2I2 + 2H2O
SO2 + 2C → S + CO2
SO2 + 2CO → S + 2CO2 (Al2O3, 500°C)
4. Сильные окислители окисляют SO2:
SO2 + Cl2 <=> SO2Cl2
SO2 + Br2 <=> SO2Br2
SO2 + NO2 → SO3 + NO
SO2 + H2O2 → H2SO4
5SO2 + 2KMnO4 +2H2O → 2MnSO4 + K2SO4 + 2H2SO4
SO2 + 2KMnO4 + 4KOH → 2K2MnO4 +K2SO4 + 2H2O
SO2 + HNO3 + H2O → H2SO4 + NO
6. Оксид углерода (IV) CO2 проявляет менее выраженные окислительные свойства, реагируя только с активными металлами, например:
CO2 + 2Mg → 2MgO + C (t)
Особенности свойств оксидов азота (N2O5, NO2, NO, N2O)
1. Необходимо помнить, что все оксиды азота являются сильными окислителями. Совсем необязательно помнить какие продукты образуются в подобных реакциях, так как подобные вопросы возникают только в тестах. Нужно лишь знать основные восстановители, такие как C, CO, H2, HI и йодиды, H2S и сульфиды, металлы (и т.д.) и знать, что оксиды азота их с большой вероятностью окислят.
2NO2 + 4CO → N2 + 4CO2
2NO2 + 2S → N2 + 2SO2
2NO2 + 4Cu → N2 + 4CuO
N2O5 + 5Cu → N2 + 5CuO
2N2O5 + 2KI → I2 + 2NO2 + 2KNO3
N2O5 + H2S → 2NO2 + S + H2O
2NO + 2H2 → N2 + 2H2O
2NO + C → N2 + CO2
2NO + Cu → N2 + 2Cu2O
2NO + Zn → N2 + ZnO
2NO + 2H2S → N2 + 2S + 2H2O
N2O + H2 → N2 + H2O
2N2O + C → 2N2 + CO2
N2O + Mg → N2 + MgO
2. Могут окисляться сильными окислителями (кроме N2O5, так как степень окисления уже максимальная):
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
NO + KMnO4 + H2SO4 → HNO3 + K2SO4 + MnSO4 + H2O
5N2O + 2KMnO4 + 3H2SO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O.
3. Несолеобразующие оксиды N2O и NO не реагируют ни с водой, ни с щелочами, ни с обычными кислотами (кислотами-неокислителями).
Химические свойства CO как сильного восстановителя
1. Реагирует с некоторыми неметаллами:
2CO + O2 → 2CO2
CO + 2H2 <=> CH3OH (t, p, kt)
CO + Cl2 <=> COCl2 (фосген)
2. Реагирует с некоторыми сложными соединениями:
CO + KOH → HCOOK
CO + Na2O2 → Na2CO3
CO + Mg → MgO + C (t)
3. Восстанавливает некоторые металлы (средней и малой активности) и неметаллы из их оксидов:
CO + CuO → Cu + CO2
3CO + Fe2O3 → 2Fe + 3CO2
3CO + Cr2O3 → 2Cr + 3CO2
2CO + SO2 → S + 2CO2 (Al2O3, 500°C)
5CO + I2O5 → I2 + 5CO2
4CO + 2NO2 → N2 + 4CO2
3. С обычными кислотами и водой CO (также как и другие несолеобразующие оксиды) не реагирует.
Химические свойства SiO2
1. Взаимодействует с активными металлами:
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
2. Взаимодействует с углеродом:
SiO2 + 2C → Si + 2CO
(Согласно пособию «Курс самоподготовки» Каверина, SiO2 + CO → реакция не идет)
3 С водородом SiO2 не взаимодействует.
4. Реакции с растворами или расплавами щелочей, с оксидами и карбонатами активных металлов:
SiO2 + 2NaOH → Na2SiO3 +H2O
SiO2 + CaO → CaSiO3
SiO2 + BaO → BaSiO3
SiO2 + Na2CO3 → Na2SiO3 + CO2
SiO2 + CaCO3 → CaSiO3 + CO2
SiO2 + Cu(OH)2 → реакция не идет (из оснований оксид кремния реагирует только с щелочами).
5. Из кислот SiO2 взаимодействует только с плавиковой кислотой:
SiO2 + 4HF → SiF4 + 2H2O.
Свойства оксида P2O5 как сильного водоотнимающего средства
HCOOH + P2O5 → CO + H3PO4
2HNO3 + P2O5 → N2O5 + 2HPO3
2HClO4 + P2O5 → Cl2O7 + 2HPO3.
Термическое разложение некоторых оксидов
В вариантах экзамена такое свойство оксидов не встречается, но рассмотрим его для полноты картины:
Основные:
4CuO → 2Cu2O + O2 (t)
2HgO → 2Hg + O2 (t)
Кислотные:
2SO3 → 2SO2 + O2 (t)
2N2O → 2N2 + O2 (t)
2N2O5 → 4NO2 + O2 (t)
Амфотерные:
4MnO2 → 2Mn2O3 + O2 (t)
6Fe2O3 → 4Fe3O4 + O2 (t).
Особенности оксидов NO2, ClO2 и Fe3O4
1. Диспропорционирование: оксидам NO2 и ClO2 соответствуют две кислоты, поэтому при взаимодействии с щелочами или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла в случае NO2 и хлорат и хлорит в случае ClO2:
2N+4O2 + 2NaOH → NaN+3O2 + NaN+5O3 + H2O
4NO2 + 2Ba(OH)2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
2NO2 + Na2CO3 → NaNO3 + NaNO2 + CO2
В аналогичных реакциях с кислородом образуются только соединения с N+5, так как он окисляет нитрит до нитрата:
4NO2 + O2 + 4NaOH → 4NaNO3 + 2H2O
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
2Cl+4O2 + H2O → HCl+3O2 + HCl+5O3
2ClO2 + 2NaOH → NaClO2 + NaClO3 + H2O
2. Оксид железа (II,III) Fe3O4 (FeO·Fe2O3) содержит железо в двух степенях окисления: +2 и +3, поэтому в реакциях с кислотами образуются две соли:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 4H2O.
Характерные химические свойства: оксидов: основных, амфотерных, кислотных
1. Оксид азота (V) взаимодействует с каждым из двух веществ:
1) вода и серная кислота
2) кислород и оксид магния
3) вода и оксид кремния
4) оксид натрия и гидроксид натрия 5) вода и оксид меди
2. Оксид углерода (IV) реагирует с каждым из двух веществ:
1) гидроксидом натрия и водой 2) оксидом кальция и оксидом серы (IV) 3) кислородом и водой
4) хлоридом натрия и оксидом азота (IV) 5) оксидом кальция и гидроксидом натрия
3. Оксид серы (IV) взаимодействует с 1) Са(ОН)2, 2) SiO2 3) K2SO4 4) СаСОз 5) O2
5. Способны взаимодействовать между собой
1) SiO2 и Н2О 2) СО2 и H2SO4 3) SO2 и Са(ОН)2 4) Na2O и Са(ОН)2 5) А12О3 и СаО
6. Ни с водой, ни с раствором гидроксида натрия не реагирует
1) SiО2 2) SO3 3) ВаО 4) FeO 5) N2O
7. Реагирует с соляной кислотой, но не с водой, оксид 1) CuO 2) N2O3 3) Na2О 4) Fе2O3 5) SiО2
8. Между собой взаимодействуют 1) NO и А12О3 2) СО и ВаО 3) Р2О5 и SO2 4) ВаО и SO2 5) А12О3 и K2О
10. Между собой НЕ взаимодействуют 1) СuО и FeO 2) СО2 и ВаО 3) Р2О5 и NO 4) Сг2О3 и SO3 5) SO2 и Са(ОН)2
11. Реакция возможна между1) Н2О и А12О3 2) СО2 и СаО 3) Р2О3 и SO2 4) Н2О и ВаО 5) СаО и FeO
12. И с раствором гидроксида натрия, и с соляной кислотой реагирует оксид
1) SiО2 2) AI2O3 3) СО2 4) MgO 5) ZnO
13. Реакция возможна между 1) ВаО и N2O 2) А12О3 и Н2О 3) Р2О5 и НС1 4) MgO и SO3 5) CuO и H2
14. Оксид натрия не взаимодействует с 1) FeO 2) СО2 3) Ca(OH)2 4) А12О3 5) Н2О
15. Оксид углерода (IV) не реагирует с
1) оксидом кальция 2) кислородом
3) сульфатом калия 4) гидроксидом натрия 5) водой
16. Оксид цинка не реагирует с 1) P2O5 2) CO 3) CrO 4) NaOH 5) Н2О
17. Какие из двух оксидов не могут взаимодействовать между собой?
1) СаО и СгО 2) СаО и NO2 3) SO2 и СО2 4) SiO2 и К2O 5) BeO и Р2О5
18. Реакция НЕ возможна между: 1) Н2О и ВаО 2) СО2 и СаО 3) Р2O3 и SO2 4) Н2О и А12О3 5) СО и О2
19. Верны ли следующие суждения о свойствах оксидов алюминия и хрома (III)?
А. Эти оксиды проявляют амфотерные свойства.
Б. В результате взаимодействия этих оксидов с водой получаются гидроксиды.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
20. Из предложенного перечня выберите те которые реагируют с оксидом фосфора (V)
1) гидроксид натрия 2) вода 3) углекислый газ 4) кислород 5) оксид серы (VI)
21. Из предложенного перечня выберите два вещества с которыми реагируют и оксид фосфора (V) и оксид натрия : 1) гидроксид бария 2) вода 3) углекислый газ 4) кислород 5) азотная кислота
21.Из предложенного перечня выберите те с которыми реагирует оксид углерода (II)
1) оксид железа (II) 2) оксид серы (IV) 3) соляная кислота
4) гидроксид железа (III) 5) оксид меди (I)
22. Оксид кальция взаимодействует с каждым из двух веществ:
1) вода и соляная кислота 2) кислород и оксид магния 3) оксид кальция и гидроксид натрия 4) вода и медь 5) оксид берилия и гидроксид алюминия
23. Из предложенного перечня выберите те вещества с которыми реагирует оксид азота (V)
1) вода 2) оксид серы (VI) 3) фосфорная кислота 4) гидроксид лития 5) кислород
24. Оксид серы (VI) взаимодействует с каждым из трех веществ:
1) вода и соляная кислота и карбонат натрия 2) кислород и оксид магния и гидроксид алюминия
3) оксид кальция и гидроксид натрия и вода 4) вода и медь и нитрат цинка 5) оксид алюминия, вода , гидроксид кальция
25. Оксид хрома (III) взаимодействует с 1) AI2O3 2) NaOH 3) Н20 4) АlCl3 5)СО
Задания повышенного уровня сложности
26.Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
A) ZnO + NaOH сплавление 1) Na2ZnО2
Б) ZnO + NaOH + Н20 2) Na2ZnО2+ Н2O
В) ZnO + Na2CO3 сплавление 3) Na2ZnО2 + СO2
Г) ZnO + HC1 4) Na2[Zn(OH)4l
5) ZnCl2+ Н2O
27. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А) СО2 + Н20 1) СаСО3
Б) СО2 + СаО 2) СаС03 + Н20
В) СО2 из6ыток) + Са(ОН)2 3) Са(НСО3)2
Г) СО2+Са(ОН)2 4) Са(НС03)2+ Н20
5) СО + Н2
6) Н2СО3
28. Установите соответствие между названиями оксидов и перечнем веществ, с которыми они могут взаимодействовать.
НАЗВАНИЕ ОКСИДА ВЕШЕСТВА
А) оксид кремния (IV) 1) Al, HNO3, СО2
Б) оксид aзотa (IV) 2) FeO, СO2, Н2O
В) оксид бария 3) С, КОН, СаСО3
Г) оксид железа(III) 4) NaOH, Н2О, СаО
5) NO2, SO3. Н3РO4
6) Н2O, HNO3, Са(ОН)2
29. Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА ФОРМУЛЫ ВЕЩЕСТВ
А) оксид бериллия 1) СO2,НС1,Н2O
Б) оксид калия 2) NaOH,H2,HCl
В) оксид серы (IV) 3) NaOH,O2,H2O
Г) оксид железа (II) 4) HCl,NaOH,H2O
5) H3N,Ca(OH)2,O2
6) HCI, H2, O2
30. Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА ФОРМУЛЫ ВЕЩЕСТВ
А) оксид цинка 1) Н2O, HNO3, Са(ОН)2
Б) оксид лития 2) O2, HCl , HNO3
В) оксид хрома (VI) 3) H2O NaOH K2O
Г) оксид железа (II) 4) K2CO3 HCL NaOH
5) P2O5 H2O H2SO4
6) K2SO4 КОН, NO2,
31. Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА ФОРМУЛЫ ВЕЩЕСТВ
А) оксид натрия 1) Н2O, СаO, KOH
Б) оксид углерода (II) 2) Fe3O4, Н2O, Si
В) оксид хрома (III) 3) Н2, Fe3O4 , O2
Г) оксид фосфора (V) 4) Н2O, N2O5, H3PO4
5) HСl, NaOH, Al
32. Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА ФОРМУЛЫ ВЕЩЕСТВ
А) оксид азота (IV) 1) КОН, Mg, Na2CO3
Б) оксид натрия 2) КОН,С,Н2O
В) оксид кремния (IV) 3) N2 , NaOH, N2O5
Г) оксид хрома(II) 4) CO2, H2S, H2O
5) HNO3, CO, O2
6) HCI, Ca(OH)2, O2
33. Установите соответствие между реагирующими веществами и продуктами реакции.
|
34. Установите соответствие между реагирующими веществами и продуктами реакции.
|
Часть С
- Сульфид цинка подвергли обжигу , выделившийся газ пропустили через раствор гидроксида кальция до выпадения осадка, Образовавшиеся твердое вещество растворили в в серной кислоте. Оксид цинка образовавшийся в первой реакции сплавили с твердым карбонатом кальция. Напишите уравнения четырех описаных реакций.
- Оксид меди сплавили с углем, полученный газообразный продукт сожгли в избытке кислорода , а затем пропустили через раствор гидроксида кальция до образования осадка . осадок отделили и сплавили с оксидом кремния . напишите уравнения четырех описанных реакций.
- Карбонат цинка прокалили , газообразный продукт пропустили над раскалённым углем. А твердое вещество разделили на две части одну сплавили с твердым гидроксидом натрия. А вторую растворили в растворе серной кислоты. Напишите уравнения четырез описанных реакций
- Кристаллическое вещество желтого цвета сожгли в атмосфере кислорода . Полученный газообразный продукт поглотили раствором щелочи. А затем смешали с ратвором соляной кислоты, выделившийся газ растворили в избытке воды.
- Порошок алюминия сплавили с порошком оксида железа (III). Одно из полученных твердых веществ растворили в растворе щёлочи, а другое в растворе соляной кислоты. Выделившийся при этом газ пропустили над нагретым черным порошком оксида меди.
- Оксид алюминия растворили в соляной кислота. После прекращения химической реакции раствор обработали раствором едкого натра до выпадения белого студенистого осадка. Осадок отделили и прокалили , образовавшееся твердое вещество сплавили с кальцинированной содой . Запишите уравнения четырех описанных реакций.
- Газ полученный при сжигании кокса пропустили через раствор известкового молока , до выпадения осадка. Осадок отделили и прокалили. Образовавшееся твердое вещество сплавили с твердым оксидом цинка . Запишите уравнения четырех описанных реакций.
- Сульфид меди подвергли обжигу образовавшийся газ пропустили через раствор баритовой воды до образования прозрачного раствора. Раствор выпарили и прокалили . Твердое вещество из первой реакции при нагревании восстановили газообразным водородом. Запишите уравнения четырех описанных реакций.
- Нитрат цинка прокалили образовавшиеся твердое вещество смешали с твердым коксом и прокалили. Выделившийся газ сожгли в избытке кислорода, а твердое вещество растворили в концентрированной растворе щелочи . Запишите уравнения четырех описанных реакций.
- Через раствор гидроксида натрия пропустили избыток углекислого газа. Полученное при этом вещество выделили из раствора, высушили и прокалили. Выделяющийся газ пропустили над раскаленным углем, а затем над раскаленным оксидом меди. Запишите уравнения четырех описанных реакций