Инфоурок
›
Другое
›Презентации›Презентация на тему Соединения хрома в заданиях ЕГЭ уровня С
Презентация на тему Соединения хрома в заданиях ЕГЭ уровня С
Скачать материал

Скачать материал






- Сейчас обучается 266 человек из 64 регионов


Описание презентации по отдельным слайдам:
-
1 слайд
Соединения хрома
в заданиях ЕГЭ уровня «С»
Цель занятия:
углубление и систематизация знаний по данной теме для подготовки к ЕГЭ -
2 слайд
«Мыслящий ум не чувствует себя счастливым, пока не удастся связать воедино разрозненные факты, им наблюдаемые»
Д. Хевеши -
3 слайд
Поведение соединений хрома в различных средах
Проверка теоретических знаний -
4 слайд
Зависимость свойств соединений хрома от степени окисления.
Заполните таблицу. -
5 слайд
Зависимость свойств соединений хрома от степени окисления.
-
6 слайд
Дихромат и хромат — окислители
K2Cr2O7 (кислая и нейтральная среда),
K2Cr O 4 (щелочная среда)
+ восстановители всегда получается …..?
кислая среда нейтральная среда щелочная среда
? в растворе …?.
?в расплаве …?.
-
7 слайд
K2Cr2O7 (кислая и нейтральная среда),
K2Cr O 4 (щелочная среда)
+ восстановители всегда получается Cr+3
кислая среда нейтральная среда щелочная среда
Соли тех кислот,
которые участвуют в в растворе
реакции:
в расплаве
Дихромат и хромат — окислители -
8 слайд
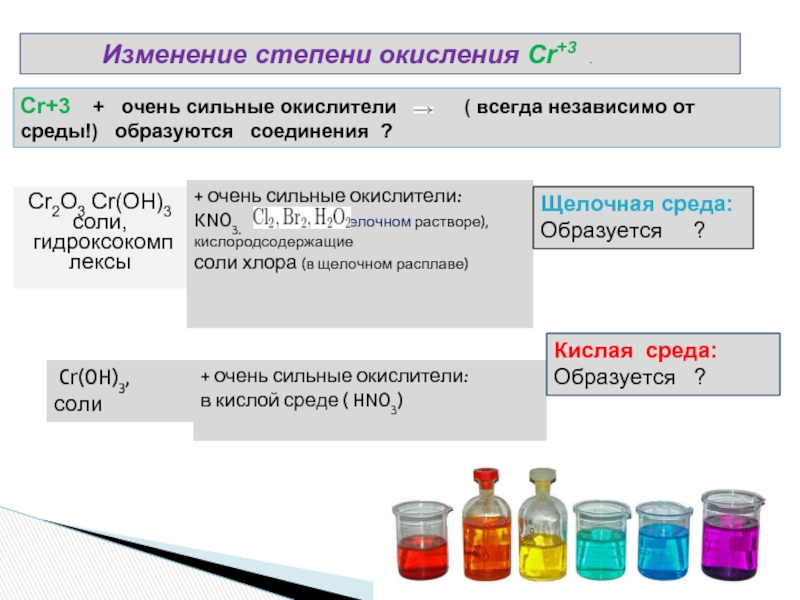
Изменение степени окисления Cr+3 .
Cr+3 + очень сильные окислители ( всегда независимо от среды!) образуются соединения ?
+ очень сильные окислители:
KNO3. ( в щелочном растворе),кислородсодержащие
соли хлора (в щелочном расплаве)Щелочная среда:
Образуется ?
Cr(OH)3,
соли
+ очень сильные окислители:
в кислой среде ( HNO3)Кислая среда:
Образуется ? -
9 слайд
Cr+3 + очень сильные окислители Cr+6 ( всегда независимо от среды!)
+ очень сильные окислители:
KNO3. ( в щелочном растворе),кислородсодержащие
соли хлора (в щелочном расплаве)Щелочная среда:
Образуется хромат
K2CrO4
Cr(OH)3,
соли
+ очень сильные окислители:
в кислой среде ( HNO3)Кислая среда:
Образуется дихромат
K2Cr2O 7
Изменение степени окисления Cr+3 -
10 слайд
Дихроматы получаются при действии на хроматы ….?
Na2CrO4 + ?= Na2Cr2O7 + ?+ ?
Возможен и обратный переход при добавлении …. ? к растворам дихроматов
Na2Cr2O7 + …? = Na2CrO4 + ?Превращение солей хрома
-
11 слайд
Превращение солей хрома
Дихроматы получаются при действии
на хроматы кислот
2 Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + Н2О
Возможен и обратный переход при добавлении щелочей к растворам дихроматов
Na2Cr2O7 + 2NaOH = 2Na2CrO4 + Н2О
Равновесие в системе хромат-дихромат можно представить следующими уравнениями:
2СrО42- + 2Н+ = Сr2О72- + Н2О
Сr2О72- + 2ОН- = 2 CrO 42- + Н2О -
12 слайд
Поведение солей хрома в различных средах
Работа с заданиями уровня С -
13 слайд
Сr2(SO4)3 + KMnO4 + … = K2CrO4 + … K2SO4 + H2O
К2Сr2О7 +Н2S + … = …+ Сr2(SО4)3 + …+ ….K2Cr2O7 + SO2 +… = K2SO4 +… + H2SO4
KCrO2 + Br2 +… =Na2CrO4 + KBr +… + H2OCr(OH)3 + Ag2O + NaOH = Ag + ? +.. ?
С1 Используя метод электронного баланса, составьте уравнения реакций , определите окислитель и восстановитель.
-
14 слайд
Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:
Na3 [Сг(OH)6] + Вг2 + NaOH →Na2CrO4 + HBr + Н2ОNa2SO3 + К2Сг2О7 + H2SO4 →Na2SO4+Cr2(SO4)3 + КOH + H2O
K2Cr2O7 + H2O2 +H2SO4→ Cr2(SO4)3+ КOH + O2 + H2O
Работа экспертов : -
15 слайд
Работа экспертов :
Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:
Na3 [Сг(OH)6] + Вг2 + NaOH →Na2CrO4 + HBr + Н2ОNa2SO3 + К2Сг2О7 + H2SO4 →Na2SO4+Cr2(SO4)3 + КOH + H2O
K2Cr2O7 + H2O2 +H2SO4→ Cr2(SO4)3+ КOH + O2 + H2O
-
16 слайд
не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в …среде не может получиться оксид металла, основание, аммиак;
б) в …..среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в …. растворе.Неверные с химической точки зрения продукты:
-
17 слайд
не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.Неверные с химической точки зрения продукты:
-
18 слайд
Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
составьте уравнения 4-х реакцийПрактическая часть С2
-
19 слайд
1. Cr2O3 + Br2 +NaOH→
2. Cr(OH)3 +Cl2 +NaOH→
3. CrCl3 +Br2 +KOH→
4. CrCl3 +H2O2 +NaOH→
5. Cr2(SO4)3 + Br2 +NaOH→
6. Cr2(SO4)3 +KMnO4 +KOH→
7. K2Cr2O7 + H2O2 +H2SO4→
8. K2Cr2O7 + Fe +H2SO4 →Домашнее задание.
ОВР. Соединения хрома.
Закончить уравнения реакций.
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 157 019 материалов в базе
- Выберите категорию:
-
Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы
- 05.12.2020
- 203
- 0
- 02.12.2020
- 191
- 0
- 29.11.2020
- 176
- 1
- 17.11.2020
- 163
- 1
- 15.11.2020
- 142
- 0
- 05.10.2020
- 190
- 0
- 27.09.2020
- 168
- 4
- 19.07.2020
- 129
- 3
Вам будут интересны эти курсы:
-
Курс профессиональной переподготовки «Организация деятельности по подбору и оценке персонала (рекрутинг)»
-
Курс повышения квалификации «Применение MS Word, Excel в финансовых расчетах»
-
Курс повышения квалификации «Организация практики студентов в соответствии с требованиями ФГОС медицинских направлений подготовки»
-
Курс повышения квалификации «Разработка бизнес-плана и анализ инвестиционных проектов»
-
Курс повышения квалификации «Страхование и актуарные расчеты»
-
Курс профессиональной переподготовки «Управление ресурсами информационных технологий»
-
Курс профессиональной переподготовки «Управление сервисами информационных технологий»
-
Курс профессиональной переподготовки «Организация системы менеджмента транспортных услуг в туризме»
-
Курс профессиональной переподготовки «Политология: взаимодействие с органами государственной власти и управления, негосударственными и международными организациями»
-
Курс профессиональной переподготовки «Организация и управление службой рекламы и PR»
-
Курс профессиональной переподготовки «Информационная поддержка бизнес-процессов в организации»
-
Курс профессиональной переподготовки «Управление качеством»
-
Настоящий материал опубликован пользователем Ахмедова Эльвиза Рустемовна. Инфоурок является
информационным посредником и предоставляет пользователям возможность размещать на сайте
методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них
сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайтЕсли Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с
сайта, Вы можете оставить жалобу на материал.Удалить материал
-
- На сайте: 2 года и 2 месяца
- Подписчики: 0
- Всего просмотров: 45705
-
Всего материалов:
242
Хром. Соединения хрома.
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
- Хром.
- С неметаллами
При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором:
4Cr + 3O2 = 2Cr2O3 2Cr + 3Br2 = 2CrBr3
2Cr + 3Cl2 = 2CrCl3 2Cr + 3S = Cr2S3 2Cr + N2 = 2CrN
- С водой. В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3H2O (пар) = Cr2O3 + 3H2
- С кислотами.
В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов соляной и разбавленной серной кислоты, образуя соли хрома (II):
Cr + 2HCl = CrCl2 + H2 Cr + H2SO4 (разб.) = CrSO4 + H2
В присутствии кислорода – соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O
Концентрированные серная и азотная кислоты на холоду пассивируют хром, однако при сильном нагревании они растворяют хром с образованием солей хрома (III):
2Cr + 6H2SO4 Cr2(SO4)3 + 3SO2 + 6H2O
Cr + 6HNO3 Cr(NO3)3 + 3NO2 + 3H2O
- С солями.
Хром способен вытеснять многие металлы, например медь, олово, серебро и др. из растворов их солей:
Cr + CuSO4 = CrSO4 + Cu
- С щелочами.
Растворы щелочей на хром практически не действуют. Но хром реагирует с щелочными расплавами окислителей. В качестве окислителей используют нитраты калия и натрия, хлорат калия и другие окислители.
Cr + KClO3 + 2KOH K2CrO4 + KCl + H2O
2Cr + KClO3 = Cr2O3 + KCl 2Cr + 3KNO3 = Cr2O3 + 3KNO2
- Соединения хрома.
Соединения хрома (II). Оксид, гидроксид, соли.
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
При высоких температурах оксид хрома (II) диспропорционирует:
3CrO Cr + Cr2O3
Все соединения хрома (II) – сильные восстановители, уже кислородом воздуха окисляются до соединений хрома (III):
4CrO + O2 = 2Cr2O3 4Cr(OН)2 + O2 + 2Н2О = 4Cr(OН)3
CrCl2 + 4HNO3(конц) = Cr(NO3)3 + NO2↑ + 2HCl↑ + H2O
2CrCl2 + 4H2SO4(конц) = Cr2(SO4)3 + SO2↑ + 4HCl↑ +2H2O
Оксид и гидроксид хрома (II) растворяются в кислотах:
CrO + 2HCl = CrCl2 + H2O Cr(OН)2 + 2HCl = CrCl2 + 2H2O
Соединения хрома (III).
- Оксид хрома (III) обладает амфотерными свойствами. Оксид хрома можно получить термическим разложением дихромата аммония:
(NH4)2C2O7 Cr2O3 + N2 + 4H2O
C кислотами оксид хрома (III) образует соли: Cr2O3 + 6HCl = 2CrCl3 + 3H2O
При сплавлении оксида хрома (III) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуются хроматы (III), (хромиты):
Сr2O3 + Ba(OH)2 Ba(CrO2)2 + H2O
Сr2O3 + Na2CO3 2NaCrO2 + CO2
C щелочными расплавами окислителей – хроматы (VI) (хроматы)
Cr2O3 + 3KNO3 + 4KOH = 2K2CrO4 + 3KNO2 + 2H2O
Cr2O3 + 3Br2 + 10NaOH = 2Na2CrO4 + 6NaBr + 5H2O
Сr2O3 + O3 + 4KOH = 2K2CrO4 + 2H2O
- Гидроксид хрома (III) обладает амфотерными свойствами.
Cr(OH)3 + 3HCl = CrCl3 + 3H2O Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
2Cr(OH)3 = Cr2O3 + 3H2O
- Соли хрома (III)
2CrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl + 8H2O
2CrCl3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4 + 8H2O
Cr2(SO4)3 + 3Br2 + 16NaOH = 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8H2O
Cr2(SO4)3 + 6KMnO4 + 16KOH = 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O.
Cr2S3 + 30HNO3(конц.) = 2Cr(NO3)3 + 3H2SO4 + 24NO2 + 12H2O
2CrCl3 + Zn = 2CrCl2 + ZnCl2
Cоли, образованные катионами хрома (III) и анионом слабой или летучей кислоты, в водных растворах полностью гидролизуются: Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
Cоединения хрома (VI)
- Оксид хрома (VI). Сильно ядовит! Кислотный оксид, который взаимодействует с основными оксидами, основаниями, водой:
CrO3 + Li2O → Li2CrO4 CrO3 + 2KOH → K2CrO4 + H2O
CrO3 + Н2O = Н2CrO4 2CrO3 + Н2O = Н2Cr2O7
Оксид хрома (VI) сильный окислитель: окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III)
4CrO3 → 2Cr2O3 + 3O2↑. 4CrO3 + 3S = 2Cr2O3 + 3SO2↑
Окисление солей:
2CrO3 + 3K2SO3 + 3H2SO4 = 3K2SO4 + Cr2(SO4)3 + 3H2O
Соли хромовых кислот – хроматы и дихроматы являются сильными окислителями. Продуктами восстановления которых являются производные хрома (III).
Продукт восстановления в различных средах можно представить схематично:
H2O Cr(OH)3 серо-зеленый осадок
K2CrO4 (CrO42– )
желтый OH– [Cr(OH)6]3– раствор изумрудно-зеленого цвета
K2Cr2O7 (Cr2O72– ) H+ Cr3+ растворы сине-фиолетового цвета
оранжевый
Изменяя реакцию раствора, можно осуществлять взаимное превращение хроматов в дихроматы:
2K2CrO4 + H2SO4(разб.) = K2Cr2O7 + K2SO4 + H2O K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
кислая среда
2СrO42– + 2H+ Cr2O72– + OH—
щелочная среда
Хромат-ион устойчив только в щелочной и, отчасти, в нейтральной среде. В кислотной среде хромат-ион превращается в дихромат-ион по реакции:
2CrO42- + 2H+ = Cr2O7 2- + H2O
Дихромат-ион устойчив только в кислотной и, отчасти, в нейтральной среде. В щелочной среде превращается в хромат-ион:
Cr2O72- + 2OH— = 2CrO42- + H2O
Поэтому в кислотной среде протекают окислительно-восстановительные процессы только с участием иона Cr2O7 2-, а в щелочной – только с участием иона CrO42-.
В нейтральной среде образуется гидроксид хрома (III):
K2Cr2O7 + 3Na2SO3 + 4H2O = 2Cr(OH)3↓ + 3Na2SO4 + 2KOH
2K2CrO4 + 3(NH4)2S + 2H2O = 2Cr(OH)3↓ + 3S↓ + 6NH3↑ + 4KOH
В щелочной – гидроксохроматы (III):
2K2CrO4 + 3NH4HS + 5H2O + 2KOH = 3S + 2K3[Cr(OH)6] + 3NH3 · H2O
2Na2CrO4 + 3SO2 + 2H2O + 8NaOH = 2Na3[Cr(OH)6] + 3Na2SO4
В кислой – соли хрома (III):
K2Cr2O7 + 3H2S +4H2SO4 = K2SO4 + Cr2(SO4)3 + 3S + 7H2O
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
8K2Cr2O7 + 3Ca3P2 + 64HCl = 3Ca3(PO4)2 + 16CrCl3 + 16KCl + 32H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 3KNO2 + 4H2SO4 = Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 7H2O + 2KCl
K2Cr2O7 + 3SO2 + 8HCl = 2KCl + 2CrCl3 + 3H2SO4 + H2O
2K2CrO4 + 16HCl = 3Cl2 + 2CrCl3 + 8H2O + 4KCl
Задание №32. Хром. Соединения хрома.
1. Сульфид хрома (III) обработали водой, при этом выделился газ и осталось нерастворимое вещество. К этому веществу прибавили раствор едкого натра и пропустили газообразный хлор, при этом раствор приобрел желтое окрашивание. Раствор подкислили серной кислотой, в результате окраска изменилась на оранжевую; через полученный раствор пропустили газ, выделившийся при обработке сульфида водой, и цвет раствора изменился на зеленый. Напишите уравнения описанных реакций.
2. После кратковременного нагревания неизвестного порошкообразного вещества оранжевого цвета начинается самопроизвольная реакция, которая сопровождается изменением цвета на зеленый, выделением газа и искр. Твердый остаток смешали с едким кали и нагрели, полученное вещество внесли в разбавленный раствор соляной кислоты, при этом образовался осадок зеленого цвета, который растворяется в избытке кислоты. Напишите уравнения описанных реакций.
3. Две соли окрашивают пламя в фиолетовый цвет. Одна из них бесцветна, и при легком нагревании ее с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь, последнее превращение сопровождается выделением бурого газа. При добавлении к раствору второй соли раствора серной кислоты желтая окраска раствора изменяется на оранжевую, а при нейтрализации полученного раствора щелочью восстанавливается первоначальный цвет. Напишите уравнения описанных реакций.
4. Гидроксид трехвалентного хрома обработали соляной кислотой. В полученный раствор добавили поташ, выделившийся осадок отделили и внесли в концентрированный раствор едкого кали, в результате осадок растворился. После добавления избытка соляной кислоты был получен раствор зеленого цвета. Напишите уравнения описанных реакций.
5. При добавлении в раствор соли желтого цвета, окрашивающей пламя в фиолетовый цвет, разбавленной соляной кислоты окраска изменилась на оранжево-красную. После нейтрализации раствора концентрированной щелочью цвет раствора вернулся к первоначальному. При добавлении в полученный хлорида бария выпадает осадок желтого цвета. Осадок отфильтровали и в фильтрат добавили раствор нитрата серебра. Напишите уравнения описанных реакций.
6. К раствору сульфата трехвалентного хрома добавили кальцинированную соду. Выделившийся осадок отделили, перенесли в раствор едкого натра, добавили бром и нагрели. После нейтрализации продуктов реакции серной кислотой раствор приобретает оранжевую окраску, которая исчезает после пропускания через раствор сернистого газа. Напишите уравнения описанных реакций.
7) Порошок сульфида хрома (III) обработали водой. Выпавший при этом серо-зеленый осадок обработали хлорной водой в присутствии гидроксида калия. К полученному желтому раствору прилили раствор сульфита калия, при этом вновь выпал серо-зеленый осадок, который прокалили до постоянства массы. Напишите уравнения описанных реакций.

9) Дихромат аммония разложили при нагревании. Твердый продукт разложения растворили в серной кислоте. К полученному раствору прилили раствор гидроксида натрия до выпадения осадка. При дальнейшем приливании гидроксида натрия к осадку он растворился. Напишите уравнения описанных реакций.
10) Оксид хрома (VI) прореагировал с гидроксидом калия. Полученное вещество обработали серной кислотой, из образовавшегося раствора выделили соль оранжевого цвета. Эту соль обработали бромоводородной кислотой. Полученное простое вещество вступило в реакцию с сероводородом. Напишите уравнения описанных реакций.
11. Хром сожгли в хлоре. Полученная соль прореагировала с раствором, содержащим пероксид водорода и гидроксид натрия. К образовавшемуся желтому раствору добавили избыток серной кислоты, цвет раствора изменился на оранжевый. Когда с этим раствором прореагировал оксид меди (I), цвет раствора стал сине-зеленым. Напишите уравнения описанных реакций.
12. Нитрат натрия сплавили с оксидом хрома (III) в присутствии карбоната натрия. выделившийся при этом газ прореагировал с избытком раствора гидроксида бария с выпадением осадка белого цвета. Осадок растворили в избытке раствора соляной кислоты и в полученный раствор добавили нитрат серебра до прекращения выпадения осадка. Напишите уравнения описанных реакций.
13. Калий сплавили с серой. Полученную соль обработали соляной кислотой. выделившийся при этом газ пропустили через раствор бихромата калия в серной кислоте. выпавшее вещество желтого цвета отфильтровали и сплавили с алюминием. Напишите уравнения описанных реакций.
14. Хром сожгли в атмосфере хлора. К образовавшейся соли добавили по каплям гидроксид калия до прекращения выделения осадка. Полученный осадок окислили перекисью водорода в среде едкого калия и упарили. К полученному твердому остатку добавили избыток горячего раствора концентрированной соляной кислоты. Напишите уравнения описанных реакций.
Хром. Соединения хрома.
1) Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
2Cr(OH)3 + 3Cl2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + Na2SO4 + 3S↓ + 7H2O
2) (NH4)2Cr2O7 Cr2O3 + N2↑ + 4H2O↑
Cr2O3 + 2KOH 2KCrO2 + H2O
KCrO2 + H2O + HCl = KCl + Cr(OH)3↓
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
3) KNO3(тв.) + H2SO4(конц.) HNO3 + KHSO4
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
4) Cr(OH)3 + 3HCl = CrCl3 + 3H2O
2CrCl3 + 3K2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 6KCl
Cr(OH)3 + 3KOH = K3[Cr(OH)6]
K3[Cr(OH)6] + 6HCl = CrCl3 + 3KCl + 6Н2О
5) 2K2CrO4 + 2HCl = K2Cr2O7 + 2KCl + H2O
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
K2CrO4 + BaCl2 = BaCrO4↓ + 2 KCl
KCl + AgNO3 = AgCl↓ + KNO3
6) Cr2(SO4)3 + 3Na2CO3 + 6H2O = 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
2Cr(OH)3 + 3Br2 + 10NaOH = 2Na2CrO4 + 6NaBr + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + H2SO4 + 3SO2 = Cr2(SO4)3 + Na2SO4 + H2O
7) Cr2S3 + 6H2O = 2Cr(OH)3↓ + 3H2S↑
2Cr(OH)3 + 3Cl2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O
2K2CrO4 + 3K2SO3 + 5H2O = 2Cr(OH)3 + 3K2SO4 + 4KOH
2Cr(OH)3 Cr2O3 + 3H2O

Cr2(SO4)3 + 6NH3 + 6H2O = 2Cr(OH)3↓ + 3(NH4)2SO4
H2S + Pb(NO3)2 = PbS + 2HNO3
PbS + 4H2O2 = PbSO4 + 4H2O
9) (NH4)2Cr2O7 Cr2O3 + N2 + 4H2O
Cr2O3 + 3H2SO4 = Cr2(SO4)3 + 3H2O
Cr2(SO4)3 + 6NaOH = 2Cr(OH)3↓ + 3Na2SO4
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
10) CrO3 + 2KOH = K2CrO4 + H2O
2K2CrO4 + H2SO4(разб.) = K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 14HBr = 3Br2 + 2CrBr3 + 7H2O + 2KBr
Br2 + H2S = S + 2HBr
11) 2Cr + 3Cl2 = 2CrCl3
2CrCl3 + 10NaOH + 3H2O2 = 2Na2CrO4 + 6NaCl + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 3Cu2O + 10H2SO4 = 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
12) 3NaNO3 + Cr2O3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
CO2 + Ba(OH)2 = BaCO3↓ + H2O
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
BaCl2 + 2AgNO3 = 2AgCl↓ + Ba(NO3)2
13) 2K + S = K2S
K2S + 2HCl = 2KCl + H2S↑
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
3S + 2Al = Al2S3
14) 2Cr + 3Cl2 = 2CrCl3
CrCl3 + 3KOH = 3KCl + Cr(OH)3↓
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
2K2CrO4 + 16HCl = 2CrCl3 + 4KCl + 3Cl2 + 8H2O
1.
ХРОМ и его соединения
2.
I. Исторические сведения
II. Хром – химический элемент:
1.Положение хрома в периодической системе
химических элементов Д.И.Менделеева
2. Строение атома.
3. Нахождение в природе
III.Хром – простое вещество
1. Состав. Физические свойства.
2. Получение.
3. Химические свойства
4. Биологическая роль и физиологическое
действие.
5. Применение
IV. Соединения хрома
3.
В 1766 году в окрестностях
Екатеринбурга был
обнаружен минерал,
который получил название
«сибирский красный
свинец», PbCrO4.
Современное название —
крокоит.
В 1797 французский химик Л. Н. Воклен открыл в сибирской
красной свинцовой руде новый элемент хром и в 1798 году
получил его в свободном состоянии.
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска —
из-за разнообразия окраски своих соединений.
4.
Французский химик Луи Николя
Воклен родился в Сент-Андред’Эберто (Нормандия).
Совместно с А. Ф. Фуркруа
выяснил (1799) химическую
природу мочевины. Совместно с
П. Ж. Робике открыл (1806)
первую аминокислоту аспарагин.
Открыл также пектин и яблочную
кислоту, выделил камфорную и
хинную кислоты.
Внёс существенный вклад в
развитие анализа минералов.
Создал школу химиков.
Опубликовал одно из первых в
мире руководств по химическому
анализу – «Введение в
аналитическую химию» (1799).
5.
6.
Положение хрома в ПСХЭ Д.И. Менделеева. Строение атома.
порядковый номер период
Cr
металл
+24
24
4
группа
VIB
1s2 2s22p6 3s23p6 3d 5 4s1
2 8
13 1
валентные электроны
Cr0 ─ 2e → Cr+2
Cr0 ─ 3e → Cr+3
Cr0 ─ 6e → Cr+6
7.
Нахождение хрома в природе
Хром является довольно распространённым элементом
(0,02 масс. долей, %). Основные соединения хрома —
хромистый железняк (хромит) FeO·Cr2O3. Вторым по
значимости минералом является крокоит PbCrO4.
хромит
крокоит
8.
Физические свойства
В свободном виде — голубовато- белый
металл.
Хром (с примесями) является одним из
самых твердых металлов.
Очень чистый хром достаточно хорошо
поддаётся механической обработке,
пластичен.
Устойчив на воздухе. При 2000 °C сгорает с
образованием зелёного оксида хрома (III)
Cr2O3.
Плотность 7,19 г/см3;
t плавления 1890°С;
t кипения
2480°С.
9.
Получение
Из хромистого железняка Fe(CrO2)2
(хромита железа) получают
феррохром восстановлением в
электропечах коксом (углеродом):
FeO· Cr2O3 + 4C → Fe + 2Cr + 4CO↑
Феррохром — сплав железа и хрома
(около 60% ),
основные примеси – углерод (до5%)
кремний (до 8%), сера (до 0,05 %),
фосфор (до 0,05 %).
Феррохром применяют для
производства легированных
сталей.
10.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия
(кальцинированная сода) на воздухе:
4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2↑
2) растворяют хромат натрия и отделяют его от оксида
железа;
3) переводят хромат в дихромат, подкисляя раствор и
выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата
углём:
Na2Cr2O7
+ 2C → Cr2O3 + Na2CO3 + CO↑
5) с помощью алюминотермии получают металлический хром:
Cr2O3 + 2Al → Al2O3 + 2Cr + 130 ккал
11.
С помощью электролиза получают электролитический хром
из раствора хромового ангидрида в воде, содержащего
добавку серной кислоты. При этом на катодах совершаются
в основном 3 процесса:
1) восстановление шестивалентного хрома до
трехвалентного с переходом его в раствор;
2) разряд ионов водорода с выделением газообразного
водорода;
3) разряд ионов, содержащих шестивалентный хром с
осаждением металлического хрома;
Cr2O72− + 14Н+ + 12е− = 2Cr + 7H2O
12.
Химические свойства
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn,
+
Fe Co,Sn,Pb, H2,Cu,Hg,Ag,Au
О2 + неметаллы
+
+
+
Cr
Cr
H2O
растворы HCl, H2SO4
H2SO4 (конц.), HNO3
растворы солей
+
щелочные расплавы окислителей
+
13.
При комнатной температуре хром химически мало активен
из-за образования на его поверхности тонкой прочной
оксидной пленки.
При нагревании оксидная пленка хрома разрушается, и он
реагирует практически со всеми неметаллами, например:
кислородом, галогенами, азотом, серой.
Составьте уравнения реакций
хрома с перечисленными неметаллами.
Рассмотрите данные реакции как
окислительно-восстановительные.
14.
4 Cr0 + 3 O20 = 2 Cr2+3O3–2
Cr0 – 3e → Cr+3
4
O20 + 4e → 2O–2 3
Cr0 – восстановитель, процесс окисления
O20 – окислитель, процесс восстановления
2 Cr0 + 3 Br20 = 2 Cr+3Br3–1
Cr0 – 3e → Cr+3
2
Br20 + 2e → 2Br–1 3
Cr0 – восстановитель, процесс окисления
Br20 – окислитель, процесс восстановления
15.
2 Cr0 + N20 = 2Cr+3N–3
Cr0 – 3e → Cr+3 2
N20 + 6e → 2N–3 1
Cr0 – восстановитель, процесс окисления
N20 – окислитель, процесс восстановления
2 Cr0 + 3 S0 = Cr2+3S3–2
Cr0 – 3e → Cr+3 2
S0 + 2e → S–2
3
Cr0 – восстановитель, процесс окисления
S0 – окислитель, процесс восстановления
16.
В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3H2O = Cr2O3 + 3H2
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn,
Cr
Fe Co,Sn,Pb, H2,Cu,Hg,Ag,Au
В ряду напряжений хром находится левее водорода и поэтому
в отсутствии воздуха может вытеснять водород из растворов
соляной и серной кислот, образуя соли хрома (II).
Составьте уравнения реакций хрома c растворами соляной
и серной кислот.
Рассмотрите данные реакции как окислительновосстановительные.
17.
Cr0 + 2 H+1Cl = Cr+2Cl2 + H20
Cr0 – 2e → Cr+2
1
2H+ + 2e → H20
1
Cr0 – восстановитель, процесс окисления
HCl (за счет Н+1) – окислитель, процесс восстановления
Cr0 +
H2+1SO4 = Cr+2SO4 + H20
Cr0 – 2e → Cr+2
2H+ + 2e → H20
1
1
Cr0 – восстановитель, процесс окисления
H2SO4(за счет Н+1) – окислитель,
процесс восстановления
18.
В присутствии кислорода
хром реагирует с растворами
кислот c образованием
солей хрома (III)
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O
19.
Концентрированные серная и азотная
кислоты на холоду пассивируют хром
При сильном нагревании кислоты
pастворяют хром с образованием
cолей хрома (III)
Cr + H2SO4 → Cr2(SO4)3 + SO2 + H2O
Cr + HNO3 → Cr(NO3)3 + NO2 + H2O
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
20.
Cr0 + H2S+6O4 → Cr2+3(SO4)3 + S+4O2 + H2O
Cr0 – 3e → Cr+3
S+6 + 2e → S+4
2
3
2Cr + 6H2SO4 = Cr2(SO4)3 + 3SO2 + 6H2O
Cr0 – восстановитель, процесс окисления
H2SO4 (за счет S+6) – окислитель, процесс восстановления
Cr0 + HN+5O3 → Cr+3(NO3)3 + N+4O2 + H2O
Cr0 – 3e → Cr+3
N+5 + 1e → N+4
1
3
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3H2O
Cr0 – восстановитель, процесс окисления
HNO3 (за счет N+5) – окислитель, процесс восстановления
21.
Хром способен вытеснять многие металлы, например
медь, олово, серебро и другие, из растворов их солей:
Составьте уравнение реакции хрома c раствором сульфата
меди (II). Рассмотрите данную реакцию как окислительновосстановительную.
Cr0 + Cu+2SO4 → Cr+2SO4 + Cu0
Cr0 – 2e → Cr+2 1
Cu+2+ 2e → Cu0 1
Cr + CuSO4 = CrSO4 + Cu
Cr0 – восстановитель, процесс окисления
CuSO4 (за счет Cu+2) – окислитель, процесс
восстановления
22.
Растворы щелочей на хром практически не действуют.
Хром реагирует с щелочными расплавами окислителей.
В качестве окислителей используют нитраты натрия, калия,
хлорат калия и другие окислители.
При взаимодействии с щелочными расплавами окислителей
хром образует соли анионного типа, в которых проявляет
высшую степень окисления.
Cr + KClO3 + KOH
сплавление
K2CrO4 + KCl + H2O
Рассмотрите эту реакцию как окислительно-восстановительную
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
23.
Cr0 + KCl+5O3 + KOH → K2Cr+6O4 + KCl–1 + H2O
Cr0 – 3e → Cr+3
Cl+5 + 6e → Cl–
1
2
Cr + KClO3 + 2KOH = K2CrO4 + KCl + H2O
Cr0 – восстановитель, процесс окисление
KClO3 (за счет Cl+5) – окислитель, процесс восстановление
24.
Хром — постоянная составная часть
растительных и животных организмов. В
крови содержится от 0,012 до 0,0035 %
хрома. Хром имеет большое значение в
метаболизме углеводов и жиров, а
также участвует в процессе синтеза
инсулина. Важнейшая его
биологическая роль состоит в регуляции
углеводного обмена и уровня глюкозы в
крови Элемент способствует
нормальному формированию и росту
детского организма. Снижение
содержания хрома в пище и крови
приводит к уменьшению скорости роста,
увеличению холестерина в крови.
25.
Хром важный компонент во многих легированных сталях.
Используется в качестве износоустойчивых и красивых
гальванических покрытий (хромирование)
Хром применяется для производства сплавов:
хром-30 и хром-90, незаменимых для производства сопел
мощных плазмотронов и в авиакосмической промышленности.
26.
Соединения хрома
Соединения хрома (II)
оксид
гидроксид
соли
Соединения хрома (III)
оксид
гидроксид
соли
Соединения хрома (VI)
оксид
гидроксид
соли
27.
Соединения хрома (II)
CrO
Оксид хрома (II) – кристаллы черного цвета,
имеет
основный характер
При осторожном нагревании
гидроксида хрома (II) в отсутствии
кислорода получают оксид хрома (II).
Составьте уравнение реакции.
Cr(OH)2 = CrO + H2O
При более высоких температурах оксид хрома (II)
диспропорционирует:
700°
3CrO = Cr + Cr2O3
28.
Составьте уравнение реакции оксида хрома (II) с соляной и
серной кислотами. Рассмотрите реакции с точки зрения ТЕД.
CrO + 2HCl = CrCl2 + H2O
CrO + 2H+ + Cl– = Cr2+ + 2Cl– + H2O
CrO + 2H+ = Cr2+ + H2O
CrO + H2SO4 = CrSO4 + H2O
CrO + 2H+ + SO42– = Cr2+ + SO42– + H2O
CrO + 2H+ = Cr2+ + H2O
29.
Оксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до оксида
хрома (III)
Составьте уравнение реакции.
Рассмотрите данную реакцию
как окислительно-восстановительную.
Cr+2O + O20 → Cr2+3O3–2
Cr+2 – 1e → Cr+3
O20 + 4e → 2O–2
4
1
4CrO + O2 = 2Cr2O3
CrO (за счет Cr+2) – восстановитель, процесс окисления
O2 – окислитель, процесс восстановления
30.
Гидроксид хрома (II)
Cr(OH)2
Гидроксид хрома (II) получают в виде желтого осадка
действием растворов щелочей на соли хрома (II) без доступа
воздуха.
Составьте уравнение реакции получения гидроксида
хрома (II) действием гидроксида натрия на хлорид хрома (II).
Рассмотрите реакцию с точки зрения ТЕД.
CrCl2 + 2NaOH = Cr(OH)2 ↓ + 2NaCl
Cr2+ + 2Cl– + 2Na+ + 2OH– = Cr(OH)2 ↓ + 2Na+ + 2Cl–
Cr2+ + 2OH– = Cr(OH)2 ↓
31.
Гидроксид хрома (II) обладает основными
свойствами.
Составьте уравнение реакции гидроксида хрома (II) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД
Cr(OН)2 + 2HCl = CrCl2 + 2H2O
Cr(OН)2 + 2H+ + 2Cl– = Cr2+ + 2Cl– + 2H2O
Cr(OН)2 + 2H+ = Cr2+ + 2H2O
32.
Гидроксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до гидроксида хрома (III)
Составьте уравнение реакции. Рассмотрите данную реакцию
как окислительно-восстановительную.
Cr+2(ОН)2+ O20 + Н2О → Cr+3(O –2Н)3
Cr+2 – 1e → Cr+3
O20 + 4e → 2O–2
4
1
4Cr(OН)2 + O2 + 2Н2О = 4Cr(OН)3
Cr(OН)2 (за счет Cr+2) –восстановитель, процесс окисления
O2 – окислитель, процесс восстановления
33.
Соли хрома (II)
Водные растворы солей хрома (II) получают без доступа
воздуха растворением металлического хрома в разбавленных
кислотах в атмосфере водорода или восстановлением цинком
в кислой среде солей трехвалентного хрома.
Безводные соли хрома (II) белого цвета, а водные растворы и
кристаллогидраты — синего цвета.
Соединения хрома (II) – сильные восстановители. Легко
окисляются. Именно поэтому очень трудно получать и хранить
соединения двухвалентного хрома.
Реагируют с концентрированными серной и азотной
кислотами:
CrCl2 + O2 + HCl → CrCl3 + H2O
CrCl2 + H2SO4 → Cr2(SO4)3 + SO2↑ + HCl↑ + H2O
CrCl2 + HNO3 → Cr(NO3)3 + NO2↑ + HCl↑ + H2O
Рассмотрите эти реакции как окислительновосстановительные. Расставьте коэффициенты..
34.
Cr+2Cl2 + O20 + HCl → Cr+3Cl3 + H2O–2
Cr+2 – 1e → Cr+3
O20 + 4e → 2O–2
4
1
4CrCl2 + O2 + 4HCl = 4CrCl3 + 2H2O
35.
Cr+2Cl2 + HN+5O3 (к) →Cr+3(NO3)3 + N+4O2↑ + HCl↑ + H2O
Cr+2 – 1e → Cr+3
N+5 + 1e → N+4
1
1
CrCl2 + 4HNO3(конц) = Cr(NO3)3 + NO2↑ + 2HCl↑ + H2O
Cr+2Cl2 + H2S+6O4(к.) →Cr2+3(SO4)3 + S+4O2↑ + HCl↑ + H2O
Cr+2 – 1e → Cr+3
S+6 + 2e → S+4
2
1
2CrCl2 + 4H2SO4(конц) = Cr2(SO4)3 + SO2↑ + 4HCl↑ +2H2O
36.
Соединения хрома (III)
Cr2O3
Оксид хрома () – тугоплавкий порошок темно-зеленого цвета.
Получение.
В лабораторных условиях термическим разложением
дихромата аммония:
t°
(NH4)2Cr2O7 = Cr2O3 + N2 + 2H2O
В промышленности восстановлением дихромата калия
коксом или серой:
t°
K2Cr2O7 + 3C = 2Cr2O3 + 2K2CO3 + CO2
t°
K2Cr2O7 + S = 2Cr2O3 + K2SO4
37.
Оксид хрома (III) обладает амфотерными свойствами
При взаимодействии с кислотами образуются соли хрома (III):
Составьте уравнение реакции оксида хрома (III) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД.
Cr2O3 + 6HCl = 2CrCl3 + 3H2O
Cr2O3 + 6H+ + 6Cl– = 2Cr3+ + 6Cl– + 3H2O
Cr2O3 + 6H+ = 2Cr3+ + 3H2O
38.
При сплавлении оксида хрома (III) с оксидами,
гидроксидами и карбонатами щелочных и
щелочноземельных металлов образуются
хроматы (III) (хромиты):
t°
Сr2O3 + Ba(OH)2 = Ba(CrO2)2 + H2O
t°
Сr2O3 + Na2CO3 = 2NaCrO2 + CO2
Оксид хрома (III) нерастворим в воде.
39.
В окислительно-восстановительных реакциях оксид хрома (III)
ведет себя как восстановитель:
Cr2O3 + KOH + KMnO4 → K2CrO4 + MnO2 + H2O
Cr2O3 + KOH + Сa(ClO)2 → K2CrO4 + CaCl2 + H2O
Cr2O3 + O2 + Na2CO3 → Na2CrO4 + CO2
Cr2O3 + KClO3 + Na2CO3 → Na2CrO4 + KCl + CO2
Cr2O3 + NaNO3 + Na2CO3 → Na2CrO4 + NaNO2 + CO2
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
40.
Cr2+3O3 + KOH + KMn+7O4 → K2Cr+6O4 + Mn+4O2 + H2O
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
Mn+7 + 3e → Mn+4
2 восстановление, окислитель
Cr2O3 + 2KOH + 2KMnO4 = 2K2CrO4 + 2MnO2 + H2O
Cr2+3O3 + KOH + Сa(Cl+1O)2 → K2Cr+6O4 + CaCl2–1 + H2O
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
Cl+1 + 2e → Cl–1
3 восстановление, окислитель
Cr2O3 + 4KOH + 3Сa(ClO)2 = 2K2CrO4 + 3CaCl2 + 2H2O
41.
Cr2+3O3 + O20 + Na2CO3 → Na2Cr+6O4 + CO2–2
2Cr+3 – 6e → 2Cr+6 2 окисление, восстановитель
O20 + 4e → O–2
3 восстановление, окислитель
Cr2O3 + 3O2 + 4Na2CO3 = 2Na2CrO4 + 4CO2
Cr2+3O3 + KCl+5O3 + Na2CO3 → Na2Cr+6O4 + KCl–1 + CO2
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
Cl+5 + 6e → Cl–1
1 восстановление, окислитель
Cr2O3 + KClO3
+ 2Na2CO3 = 2Na2CrO4 + KCl
+ 2CO2
Cr2+3O3 + NaN+5O3 + Na2CO3 → Na2Cr+6O4 + NaN+3O2 + CO2
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
N+5 + 2e → N+3
3 восстановление, окислитель
Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
42.
Оксид хрома (III) – катализатор
В присутствии оксида хрома (III)
аммиак окисляется кислородом воздуха до
монооксида азота, который в избытке
кислорода окисляется до бурого диоксида
азота.
43.
Каталитическое окисление этанола
Окисление этилового спирта
кислородом воздуха происходит
очень легко в присутствии оксида
хрома (III)
Реакция окисления спирта протекает
с выделением энергии. Продукт
реакции окисления спирта уксусный альдегид.
2СН3–СН2–ОН + О2
Cr2O3, t°
2СН3 – С ═ О + 2H2O
H
44.
Гидроксид хрома (III)
Cr(OH)3
Получают гидроксид хрома (III) действием
растворов щелочей или аммиака на растворы
солей хрома (III).
Лабораторный опыт № 1
К раствору хлорида хрома (III) прилейте раствор
аммиака. Что наблюдаете?
Составьте уравнение реакции получения
Cr(OH)3 действием раствора аммиака на
хлорид хрома (III):
CrCl3 + 3(NH3·H2O) = Cr(OH)3 + 3NH4Cl
45.
Лабораторный опыт № 2
Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте раствор соляной кислоты, а к другой –
щелочь. Что происходит?
Какими свойствами обладает гидроксид хрома (III)?
HCl
CrCl3
NaOH
Cr(OH)3
Na3[Cr(OH)6]
46.
Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте серной кислоты, а к другой – щелочь.
Что происходит?
+H2SO4
+NaOH
47.
Гидроксид хрома (III) обладает амфотерными свойствами.
При взаимодействии с кислотами образуются соли хрома (III):
Составьте уравнение реакции гидроксида хрома (III) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД.
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + 3H+ + 3Cl– = Cr3+ + 3Cl– + 3H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
48.
Гидроксид хрома (III) растворяется в щелочах
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
гексагидроксохромат (III) натрия
(изумрудно-зеленый)
Cr(OH)3 + 3Na+ + 3OH– = 3Na+ + [Cr(OH)6]3–
Cr(OH)3 + 3OH– = [Cr(OH)6]3–
При нагревании гидроксид хрома (III) разлагается:
t°
2Cr(OH)3 = Cr2O3 + 3H2O
49.
Соли хрома (III)
Хроматы (III) устойчивы в щелочной среде. Они легко
реагируют с кислотами:
недостаток кислоты:
NaCrO2 + HCl + H2O = Cr(OH)3 + NaCl
избыток кислоты:
NaCrO2 + 4HCl = CrCl3 + NaCl + 2H2O
с угольной кислотой
Na3[Cr(OH)6] + 3CO2 = Cr(OH)3 + 3NaHCO3
В растворе подвергаются полному гидролизу:
Cr2S3 + 6H2O = 2Cr(OH)3 + 3H2S
В водных растворах катион Cr3+ встречается только
в виде гидратированного иона [Cr(H2O)6] 3+, который
придает раствору сине-фиолетовый цвет.
50.
Сульфат хрома (III) образует двойные соли – хромовые квасцы.
Из смешанного раствора сульфата хрома (III) и сульфата калия
кристаллизуется двойная соль
сине-фиолетового цвета.
–
KCr(SO4)2·12H2O
Применяются в качестве дубящего вещества при
изготовлении эмульсий, а также в дубящих растворах
и дубящих фиксажах.
51.
Соединения хрома (III) могут проявлять как окислительные
так и восстановительные свойства.
K3[Cr(OH)6] + Br2 + KOH → K2CrO4 + KBr + H2O
CrCl3 + Zn → CrCl2 + ZnCl2
KCrO2 + PbO2 + KOH → K2CrO4 + K2PbO2 + H2O
CrCl3 + H2O2 + KOH → K2CrO4 + KCl + H2O
Cr2(SO4)3 + Cl2 + NaOH → Na2CrO4 + NaCl + H2O + Na2SO4
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
52.
K3[Cr+3(OH)6] + Br20 + KOH → K2Cr+6O4 + KBr– + H2O
Cr+3 – 3e → Cr+6 2 окисление, восстановитель
Br20 + 2e → 2Br–1 3 восстановление, окислитель
2K3[Cr(OH)6] + 3Br2 + 4KOH = 2K2CrO4 + 6KBr + 8H2O
Cr+3Cl3 + Zn0 → Cr+2Cl2 + Zn+2Cl2
Cr+3 + 1e → Cr+2
Zn0 – 2e → Zn+2
2
1
восстановление, окислитель
окисление, восстановитель
2CrCl3 + Zn = 2CrCl2 + ZnCl2
KCr+3O2 + Pb+4O2 + KOH → K2Cr+6O4 + K2Pb+2O2 + H2O
Cr+3 – 3e → Cr+6
Pb+4 + 2e → Pb–2
2
3
окисление, восстановитель
восстановление, окислитель
2KCrO2 + 3PbO2 + 8KOH = 2K2CrO4 + 3K2PbO2 + 4H2O
53.
Cr+3Cl3 + H2O2–1 + KOH → K2Cr+6O4 + KCl + H2O–2
Cr+3 – 3e → Cr+6 2
2O–1 + 2e → 2O–2 3
окисление, восстановитель
восстановление, окислитель
2CrCl3 + 3H2O2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O
Cr2+3(SO4)3 + Cl20 + NaOH → Na2Cr+6O4 + NaCl– + H2O + Na2SO4
Cr+3 – 3e → Cr+6
Cl20 + 2e → 2Cl–1
2
3
окисление, восстановитель
восстановление, окислитель
Cr2(SO4)3 +3Cl2 +16NaOH = 2Na2CrO4 + 6NaCl + 8H2O +3Na2SO4
54.
Оксид хрома (VI) CrO3 — хромовый ангидрид,
представляет собой темно-красные
игольчатые кристаллы.
Получают CrO3 действием избытка
концентрированной серной кислоты
на насыщенный водный раствор
дихромата натрия:
Na2Cr2O7 + 2H2SO4 = 2CrO3 + 2NaHSO4 + H2O
При нагревании выше 250 °C разлагается:
4CrO3 → 2Cr2O3 + 3O2↑.
Оксид хрома (VI) очень ядовит.
55.
CrO3 — кислотный оксид.
При растворении в воде образует кислоты.
С избытком воды образуется хромовая
кислота H2CrO4
CrO3 + Н2O = Н2CrO4
При большой концентрации CrO3 образуется дихромовая
кислота
Н2Cr2О7
2CrO3 + Н2O = Н2Cr2O7
которая при разбавлении переходит в хромовую кислоту:
Н2Cr2О7 + Н2О = 2Н2CrO4
Эти кислоты – неустойчивые. Существуют только в растворе.
Между ними в растворе устанавливается равновесие
2Н2CrO4 ↔ Н2Cr2O7 + Н2O
При взаимодействии CrO3 со щелочами образуются хроматы
CrO3 + 2KOH → K2CrO4 + H2O.
56.
CrO3 является сильным окислителем
Например этанол, ацетон и многие другие органические
вещества самовоспламеняются или даже взрываются при
контакте с ним.
CrO3 + C2H5OH → CO2 + Cr2O3 + H2O
C2H5OH + 3H2O – 12e → 2CO2 + 12H+
2CrO3 + 6H+ + 6e → Cr2O3 + 3H2O
1
2
C2H5OH + 3H2O + 4CrO3 + 12H+ = 2CO2 + 12H+ + 2Cr2O3 + 6H2O
4CrO3 + C2H5OH → 2CO2 + 2Cr2O3 + 3H2O
Окисляет йод, серу, фосфор, уголь.
4CrO3 + 3S = 2Cr2O3 + 3SO2↑.
57.
Окисление ацетона хромовым ангидридом.
Если поместить оксид хрома на
фарфоровую пластинку и
капнуть на него несколько
капель ацетона,то через
несколько секунд ацетон
загорается. При этом оксид
хрома (VI) восстанавливается
до оксида хрома (III), а ацетон
окисляется до углекислого газа
и воды.
16CrO3 + 3CH3– С – CH3 → 9CO2 + 8Cr2O3 + 9H2O
О
58.
Оксиду хрома (VI) соответствуют две кислоты –
хромовая Н2CrO4 и дихромовая Н2Cr2O7
59.
Хромовая кислота —
кристаллическое вещество
красного цвета; выделена
в свободном состоянии
при охлаждении
насыщенных водных
растворов CrO3; хромовая
кислота — электролит
средней силы.
Изополихромовые кислоты
существуют в водных
растворах, окрашенных в
красный цвет
60.
соли
хроматы – соли хромовой кислоты
устойчивы в щелочной среде, при
подкислении переходят в оранжевые
дихроматы, соли двухромовой
кислоты. Реакция обратима, поэтому
при добавлении щелочи желтая
окраска хромата восстанавливается.
2CrO42– + 2H+ ↔ Cr2O72– + H2O
хроматы
Н+
ОН–
дихроматы
61.
Лабораторный опыт № 3
К раствору дихромата калия добавьте гидроксид калия.
Как изменилась окраска? Чем это вызвано?
К полученному раствору добавьте
серной кислоты до восстановления
желтой окраски.
Напишите уравнения реакций.
62.
2K2CrO4 + H2SO4(разб.) = K2Cr2O7 + K2SO4 + H2O
2K2CrO4 + 2HCl(разб.) = K2Cr2O7 + 2KCl + H2O
2K2CrO4 + H2O + CO2 = K2Cr2O7 + KHCO3
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
63.
Взаимопревращение хроматов и дихроматов
Оксиду хрома (VI) соответствуют две кислоты –
хромовая Н2CrO4 и дихромовая Н2Cr2O7, Хромат калия
K2CrO4 и дихромат калия K2Cr2O7 – соли этих кислот.
Хроматы – желтого цвета, дихроматы – оранжевого. В
кислой среде хромат-ион превращается в дихромат-ион. В
присутствии щелочи дихроматы снова становятся
хроматами. Хромат калия превращаем в дихромат,
добавляя кислоту. Желтый раствор становится оранжевым.
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
В стакан с дихроматом калия добавляем щелочь, оранжевый
раствор становится желтым – дихроматы превращаются в
хроматы.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
64.
Соединения хрома (VI) –
сильные окислители
H+
Cr3+
Cr2O72– + 14H+ + 6e → 2Cr3+ + 7H2O
2–
Cr2O7
H2O
OH–
Cr(OH)3
[Cr(OH)6
3–
]
Cr2O72– + 7Н2О + 6e → 2[Cr(OH)6]3– + 2ОН–
65.
Окислительные свойства дихроматов
Дихроматы, например дихромат калия K2Cr2O7 – сильные
окислители. Под действием восстановителей дихроматы в
кислой среде переходят в соли хрома (III). Примером такой
реакции может служить окисление сульфита натрия
раствором дихромата калия в кислой среде. К раствору
дихромата калия добавляем серную кислоту и раствор
сульфита натрия.
K2Cr2O7 +3Na2SO3+4H2SO4 =Cr2(SO4)3 + 3Na2SO4+ K2SO4 + 4H2O
Оранжевая окраска, характерная для дихроматов, переходит в
зеленую. Образовался раствор сульфата хрома (III) зеленого
цвета. Соли хрома — ярко окрашены, именно поэтому элемент
получил такое название: «хром», что в переводе с греческого
означает «цвет, краска».
опыт
66.
Zn + K2Cr2O7 + H2SO4 → ZnSO4 + Cr2(SO4)3 + K2SO4 +H2O
K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 +H2O
K2Cr2O7 + H2O2 + H2SO4 → O2 + Cr2(SO4)3 + K2SO4 +H2O
K2Cr2O7 + H2O + H2S → S + Cr(OH)3 + KOH
K2Cr2O7 + H2O + K2S → S + K3[Cr(OH)6] + KOH
K2Cr2O7 + KOH + (NH4)2S → S + K3[Cr(OH)6] + NH3
Дихроматы проявляют окислительные свойства не только в
растворах, но и в твердом виде:
K2Cr2O7 + S → K2SO4 + Cr2O3
K2Cr2O7 + С → K2СO3 + СО + Cr2O3
K2Cr2O7 + Al → Cr + KAlO2 + Al2O3
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
67.
Zn0 + K2Cr2+6O7 + H2SO4 → Zn+2SO4 + Cr2+3(SO4)3 + K2SO4 +H2O
Cr+6 + 3e → Cr+3
Zn0 – 2e → Zn+2
2
3
восстановление, окислитель
окисление, восстановитель
3Zn + K2Cr2O7 + 7H2SO4 = 3ZnSO4 + Cr2(SO4)3 + K2SO4 + 7H2O
K2Cr2+6O7 + H2S–2 + H2SO4 → S0 + Cr2+3(SO4)3 + K2SO4 + H2O
Cr+6 + 3e → Cr+3
S–2 – 2e → S0
2
3
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + 3H2S + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
K2Cr2+6O7 + H2O2–1 + H2SO4 → O20 + Cr2+3(SO4)3 + K2SO4 +H2O
Cr+6 + 3e → Cr+3
2O–1 – 2e → O20
2 восстановление, окислитель
3 окисление, восстановитель
K2Cr2O7 + 3H2O2 + 4H2SO4 = 3O2 + Cr2(SO4)3 + K2SO4 + 7H2O
68.
K2Cr2+6O7 + H2O + H2S–2 → S0 + Cr+3(OH)3 + KOH
2Cr+6 + 6e → 2Cr+3 1
S–2 – 2e → S0
3
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + H2O + 3H2S = 3S + 2Cr(OH)3 + 2KOH
K2Cr2+6O7 + H2O + K2S–2 → S0 + K3[Cr+3 (OH)6] + KOH
2Cr+6 + 6e → 2Cr+3 1 восстановление, окислитель
S–2 – 2e → S0
3 окисление, восстановитель
K2Cr2O7 + 7H2O + 3K2S = 3S + 2K3[Cr(OH)6] + 2KOH
K2Cr2+6O7 + KOH +H2O + (NH4)2S–2 → S0 + K3[Cr+3(OH)6] + NH3
2Cr+6 + 6e → 2Cr+ 1 восстановление, окислитель
S–2 – 2e → S0
3 окисление, восстановитель
K2Cr2O7 + 4KOH + H2O + 3(NH4)2S = 3S + 2K3[Cr(OH)6] + 6NH3
69.
K2Cr2+6O7 + S0 → K2S+6O4 + Cr2+3O3
Cr+6 + 3e → Cr+3 2
S0 – 6e → S+6
1
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + S = K2SO4 + Cr2O3
K2Cr2+6O7 + С0 → K2С+4O3 + С+2О + Cr2+3O3
Cr+6 + 3e → Cr+3
С0 – 4e → С+4
С0 – 2e → С+2
3
4
2
2
1
1
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + 2С = K2СO3 + СО + Cr2O3
K2Cr2+6O7 + Al0 → Cr0 + KAlO2 + Al2+3O3
2Cr+6 + 6e → 2Cr+3 1 восстановление, окислитель
Al0 – 3e → Al+3
2 окисление, восстановитель
K2Cr2O7 + 4Al = 2Cr + 2KAlO2 + Al2O3
70.
Дихромат калия (хромпик) широко применяется как окислитель
органических соединений:
3С2H5OH + K2Cr2O7 + 4H2SO4
CH3– CHO + Cr2(SO4)3 + K2SO4 + 7H2O
3С3H7OH + K2Cr2O7 + 4H2SO4
3CH3– C–CH3 + Cr2(SO4)3 + K2SO4 + 7H2O
║
O
71.
Хроматы щелочных металлов плавятся без разложения, а
дихроматы при высокой температуре превращаются в хроматы
Дихромат аммония разлагается при нагревании:
(NH4)2Cr2O7
180°C
Cr2O3 + N2 + 4H2O
72.
В ряду гидроксидов хрома различных степеней окисления
Cr(ОН)2 — Cr(ОН)3 — Н2CrО4
закономерно происходит ослабление основных свойств и
усиление кислотных. Такое изменение свойств обусловлено
увеличением степени окисления и уменьшением ионных
радиусов хрома. В этом же ряду последовательно
усиливаются окислительные свойства.
Соединения Cr (II) — сильные восстановители, легко
окисляются, превращаясь в соединения хрома (III).
Соединения хрома(VI) — сильные окислители, легко
восстанавливаются в соединения хрома (III).
Соединения хрома (III), могут при взаимодействии с
сильными восстановителями проявлять окислительные
свойства, переходя в соединения хрома (II), а при
взаимодействии с сильными окислителями проявлять
восстановительные свойства, превращаясь в соединения
хрома (VI).
73.
Соединения хрома
Степень окисления хромa
Оксид
Гидроксид
+2
CrO
+3
+6
Cr2O3
CrO3
Cr(OH)2 Cr(OH)3 H2CrO4
H2Cr2O7
Кислотные и окислительные свойства возрастают
Основные и восстановительные свойства возрастают
74.
Начала химии. Современный курс для поступающих в
ВУЗы. – М.: 1Федеративная Книготорговая Компания.
Химия. Подготовка к ЕГЭ: учебно-методическое пособие /
Под ред. В.Н. Доронькина. – Ростов н/Дону: Легион
Химия. Пособие для поступающих в вузы /О.О.
Максименко. – М. : Филол. о-во СЛОВО: Изд-во Эксмо
Интернет-ресурсы (картинки, видеофрагменты: 1) Единая
образовательная коллекция цифровых ресурсов. Химия.
Неорганическая химия. Металлы побочных подгрупп. Хром.
Видеопыты. http://school-collection.edu.ru/
2) Образовательная коллекция
Химия для всех XXI
Химические опыты со взрывами и без
http://ppt4web.ru/khimija/khrom1.html
75. Техника безопасности при работе с соединениями хрома
ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С
СОЕДИНЕНИЯМИ ХРОМА
При работе с препаратами хрома не
допускать их попадания на кожу и внутрь
организма.
Соединения хрома высших степеней
окисления оказывают раздражающее и
сжигающее действие на слизистые оболочки
и кожу. В трещинах кожного покрова или
порезах оксид хрома (VI) СгО3 и дихроматы
способны вызывать долго не заживающие
язвы.
76.
Дихроматы более опасны, чем хроматы.
Менее опасны соединения хрома со
степенью окисления +3, однако
установлено, что пыль оксида хрома (III)
Cr2O3, которая образуется при разложении
дихромата аммония (NH4)2Cr2О7 и
алюмотермии оксидов хрома, взывает
раздражение и способна в конечном счете
привести к тяжелейшим заболеваниям
легких.
77. Лабораторный практикум
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Опыт 1. Получение и свойства хроматов и дихроматов
Смещение равновесия между хромат(VI)- и дихромат(VI)- ионами.
К раствору
прилейте 2 моль/л раствор серной кислоты, а к раствору
K2Cr2O7 – 2 моль/л раствор КOH.
Запишите наблюдения. Напишите в ионном виде уравнение реакции,
объясняющее изменение окраски растворов.
2K2CrO4 + H2SO4 ……….
K2Cr2O7 + 2KOH ………..
78.
Окислительные свойства соединений хрома (VI). К раствору дихромата
калия, подкисленному 2 моль/л раствором серной кислоты, прилейте раздельно в
2-х пробирках растворы NaNO2 и Na2S. Запишите наблюдения.
Напишите и уравняйте уравнения реакций ионно электронным методом:
K2Cr2O7+ NaNO2 +H2SO4
K2Cr2O7+H2SO4+Na2S
K2Cr2O7+H2SO4+С2Н5ОН
Cлайд 1
Соединения хрома в заданиях ЕГЭ уровня «С» Цель занятия: углубление и систематизация знаний по данной теме для подготовки к ЕГЭ
Cлайд 2
«Мыслящий ум не чувствует себя счастливым, пока не удастся связать воедино разрозненные факты, им наблюдаемые» Д. Хевеши
Cлайд 3
Поведение соединений хрома в различных средах Проверка теоретических знаний
Cлайд 4
Зависимость свойств соединений хрома от степени окисления. Заполните таблицу. Степень окисления +2 +3 +6 Оксид СrО Сr2О3 СrО3 Характер оксида Гидроксид Характер гидроксида Изменениесвойств соединений
Cлайд 5
Зависимость свойств соединений хрома от степени окисления. Степень окисления +2 +3 +6 Оксид СrО Сr2О3 СrО3 Характер оксида основной амфотерный кислотный Гидроксид Сr(ОН)2 Сr(ОН)3– Н3СrО3 Н2СrО4 Н2Сr2О7 Характер гидроксида основной амфотерный кислотный → ослабление основных свойств и усиление кислотных→
Cлайд 6
Дихромат и хромат — окислители K2Cr2O7 (кислая и нейтральная среда), K2Cr O 4 (щелочная среда) + восстановители всегда получается …..? кислая среда нейтральная среда щелочная среда ? в растворе …?. ? в расплаве …?.
Cлайд 7
K2Cr2O7 (кислая и нейтральная среда), K2Cr O 4 (щелочная среда) + восстановители всегда получается Cr+3 кислая среда нейтральная среда щелочная среда Соли тех кислот, которые участвуют в в растворе реакции: в расплаве Дихромат и хромат — окислители
Cлайд 8
Изменение степени окисления Cr+3 . Cr+3 + очень сильные окислители ( всегда независимо от среды!) образуются соединения ? + очень сильные окислители: KNO3. ( в щелочном растворе),кислородсодержащие соли хлора (в щелочном расплаве) Щелочная среда: Образуется ? Cr(OH)3, соли + очень сильные окислители: в кислой среде ( HNO3) Кислая среда: Образуется ? Cr2O3Сr(OH)3 соли, гидроксокомп лексы
Cлайд 9
Cr+3 + очень сильные окислители Cr+6 ( всегда независимо от среды!) + очень сильные окислители: KNO3. ( в щелочном растворе),кислородсодержащие соли хлора (в щелочном расплаве) Щелочная среда: Образуется хромат K2CrO4 Cr(OH)3, соли + очень сильные окислители: в кислой среде ( HNO3) Кислая среда: Образуется дихромат K2Cr2O 7 Изменение степени окисления Cr+3 Cr2O3Сr(OH)3 соли, гидроксокомп лексы
Cлайд 10
Дихроматы получаются при действии на хроматы ….? Na2CrO4 + ?= Na2Cr2O7 + ?+ ? Возможен и обратный переход при добавлении …. ? к растворам дихроматов Na2Cr2O7 + …? = Na2CrO4 + ? Превращение солей хрома
Cлайд 11
Превращение солей хрома Дихроматы получаются при действии на хроматы кислот 2 Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + Н2О Возможен и обратный переход при добавлении щелочей к растворам дихроматов Na2Cr2O7 + 2NaOH = 2Na2CrO4 + Н2О Равновесие в системе хромат-дихромат можно представить следующими уравнениями: 2СrО42- + 2Н+ = Сr2О72- + Н2О Сr2О72- + 2ОН- = 2 CrO 42- + Н2О
Cлайд 12
Поведение солей хрома в различных средах Работа с заданиями уровня С
Cлайд 13
Сr2(SO4)3 + KMnO4 + … = K2CrO4 + … K2SO4 + H2O К2Сr2О7 +Н2S + … = …+ Сr2(SО4)3 + …+ …. K2Cr2O7 + SO2 +… = K2SO4 +… + H2SO4 KCrO2 + Br2 +… =Na2CrO4 + KBr +… + H2O Cr(OH)3 + Ag2O + NaOH = Ag + ? +.. ? С1 Используя метод электронного баланса, составьте уравнения реакций , определите окислитель и восстановитель.
Cлайд 14
Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях: Na3 [Сг(OH)6] + Вг2 + NaOH →Na2CrO4 + HBr + Н2О Na2SO3 + К2Сг2О7 + H2SO4 →Na2SO4+Cr2(SO4)3 + КOH + H2O K2Cr2O7 + H2O2 +H2SO4→ Cr2(SO4)3+ КOH + O2 + H2O Работа экспертов :
Cлайд 15
Работа экспертов : Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях: Na3 [Сг(OH)6] + Вг2 + NaOH →Na2CrO4 + HBr + Н2О Na2SO3 + К2Сг2О7 + H2SO4 →Na2SO4+Cr2(SO4)3 + КOH + H2O K2Cr2O7 + H2O2 +H2SO4→ Cr2(SO4)3+ КOH + O2 + H2O
Cлайд 16
не может получиться такое вещество, которое вступает во взаимодействие со средой! а) в …среде не может получиться оксид металла, основание, аммиак; б) в …..среде не получится кислота или кислотный оксид; в) оксид или тем более металл, бурно реагирующие с водой, не образуются в …. растворе. Неверные с химической точки зрения продукты:
Cлайд 17
не может получиться такое вещество, которое вступает во взаимодействие со средой! а) в кислой среде не может получиться оксид металла, основание, аммиак; б) в щелочной среде не получится кислота или кислотный оксид; в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе. Неверные с химической точки зрения продукты:
Cлайд 18
Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным. составьте уравнения 4-х реакций Практическая часть С2
Cлайд 19
1. Cr2O3 + Br2 +NaOH→ 2. Cr(OH)3 +Cl2 +NaOH→ 3. CrCl3 +Br2 +KOH→ 4. CrCl3 +H2O2 +NaOH→ 5. Cr2(SO4)3 + Br2 +NaOH→ 6. Cr2(SO4)3 +KMnO4 +KOH→ 7. K2Cr2O7 + H2O2 +H2SO4→ 8. K2Cr2O7 + Fe +H2SO4 → Домашнее задание. ОВР. Соединения хрома. Закончить уравнения реакций.
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация на тему Соединения хрома в заданиях ЕГЭ уровня С
Содержание
-
1.
Соединения хрома в заданиях ЕГЭ уровня С -
2.
«Мыслящий ум не чувствует себя счастливым, пока -
3.
Поведение соединений хрома в различных средахПроверка теоретических знаний -
4.
Зависимость свойств соединений хрома от степени окисления. Заполните таблицу. -
5.
Зависимость свойств соединений хрома от степени окисления. -
6.
Дихромат и хромат — окислителиK2Cr2O7 (кислая и -
7.
K2Cr2O7 (кислая и нейтральная среда), K2Cr -
8.
Изменение степени -
9.
Cr+3 + очень сильные -
10.
Дихроматы получаются при действии на хроматы ….?Na2CrO4 -
11.
Превращение солей хромаДихроматы получаются при действии на -
12.
Поведение солей хрома в различных средах Работа с заданиями уровня С -
13.
Сr2(SO4)3 + KMnO4 + … = K2CrO4 -
14.
Найдите в реакциях ошибочные продукты, объясните, почему -
15.
Работа экспертов :Найдите в реакциях ошибочные продукты, -
16.
не может получиться такое вещество, которое вступает -
17.
не может получиться такое вещество, которое вступает -
18.
Серо-зелёный порошок оксида хрома (III) сплавили с -
19.
1. Cr2O3 + Br2 +NaOH→2. Cr(OH)3 +Cl2 -
20.
Скачать презентанцию
«Мыслящий ум не чувствует себя счастливым, пока не удастся связать воедино разрозненные факты, им наблюдаемые» Д. Хевеши
Слайды и текст этой презентации
Слайд 1Соединения хрома
в заданиях ЕГЭ уровня «С»
Цель занятия:
углубление и систематизация знаний по данной теме для подготовки
к ЕГЭ

Слайд 2«Мыслящий ум не чувствует себя счастливым, пока не удастся
связать воедино разрозненные факты, им наблюдаемые»
Д. Хевеши

Слайд 3Поведение соединений хрома в различных средах
Проверка теоретических знаний

Слайд 4 Зависимость свойств соединений хрома от степени окисления.
Заполните таблицу.

Слайд 5 Зависимость свойств соединений хрома от степени окисления.

Слайд 6Дихромат и хромат — окислители
K2Cr2O7 (кислая и нейтральная среда),
K2Cr O 4 (щелочная среда)
+ восстановители
всегда получается …..?
кислая среда нейтральная среда щелочная среда
? в растворе …?.
?
в расплаве …?.

Слайд 7K2Cr2O7 (кислая и нейтральная среда),
K2Cr O 4
(щелочная среда)
+ восстановители всегда получается Cr+3
кислая среда
нейтральная среда щелочная среда
Соли тех кислот,
которые участвуют в в растворе
реакции:
в расплаве
Дихромат и хромат — окислители

Слайд 8 Изменение степени окисления Cr+3
.
Cr+3 + очень сильные окислители
( всегда независимо от среды!) образуются соединения ?
+ очень сильные окислители:
KNO3. ( в щелочном растворе),кислородсодержащие
соли хлора (в щелочном расплаве)
Щелочная среда:
Образуется ?
Cr(OH)3,
соли
+ очень сильные окислители:
в кислой среде ( HNO3)
Кислая среда:
Образуется ?
Слайд 9
Cr+3 + очень сильные окислители
Cr+6 ( всегда независимо от
среды!)
+ очень сильные окислители:
KNO3. ( в щелочном растворе),кислородсодержащие
соли хлора (в щелочном расплаве)
Щелочная среда:
Образуется хромат
K2CrO4
Cr(OH)3,
соли
+ очень сильные окислители:
в кислой среде ( HNO3)
Кислая среда:
Образуется дихромат
K2Cr2O 7
Изменение степени окисления Cr+3

Слайд 10Дихроматы получаются при действии на хроматы ….?
Na2CrO4 + ?=
Na2Cr2O7 + ?+ ?
Возможен и обратный переход при добавлении
…. ? к растворам дихроматов
Na2Cr2O7 + …? = Na2CrO4 + ?
Превращение солей хрома

Слайд 11Превращение солей хрома
Дихроматы получаются при действии
на хроматы кислот
2 Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 +
Н2О
Возможен и обратный переход при добавлении щелочей к растворам дихроматов
Na2Cr2O7 + 2NaOH = 2Na2CrO4 + Н2О
Равновесие в системе хромат-дихромат можно представить следующими уравнениями:
2СrО42- + 2Н+ = Сr2О72- + Н2О
Сr2О72- + 2ОН- = 2 CrO 42- + Н2О

Слайд 12Поведение солей хрома в различных средах
Работа с заданиями
уровня С

Слайд 13Сr2(SO4)3 + KMnO4 + … = K2CrO4 + …
K2SO4 + H2O
К2Сr2О7 +Н2S + … = …+ Сr2(SО4)3 +
…+ ….
K2Cr2O7 + SO2 +… = K2SO4 +… + H2SO4
KCrO2 + Br2 +… =Na2CrO4 + KBr +… + H2O
Cr(OH)3 + Ag2O + NaOH = Ag + ? +.. ?
С1 Используя метод электронного баланса, составьте уравнения реакций , определите окислитель и восстановитель.

Слайд 14Найдите в реакциях ошибочные продукты, объясните, почему они не
могут получаться в этих условиях:
Na3 [Сг(OH)6] + Вг2 + NaOH
→Na2CrO4 + HBr + Н2О
Na2SO3 + К2Сг2О7 + H2SO4 →Na2SO4+Cr2(SO4)3 + КOH + H2O
K2Cr2O7 + H2O2 +H2SO4→ Cr2(SO4)3+ КOH + O2 + H2O
Работа экспертов :
![Соединения хрома в заданиях ЕГЭ уровня С Найдите в реакциях ошибочные продукты, объясните, почему они не Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:Na3 [Сг(OH)6] + Вг2](https://theslide.ru/img/thumbs/a198918a9a230a78e9749d0a27aeb6e9-800x.jpg)
Слайд 15Работа экспертов :
Найдите в реакциях ошибочные продукты, объясните, почему
они не могут получаться в этих условиях:
Na3 [Сг(OH)6] + Вг2
+ NaOH →Na2CrO4 + HBr + Н2О
Na2SO3 + К2Сг2О7 + H2SO4 →Na2SO4+Cr2(SO4)3 + КOH + H2O
K2Cr2O7 + H2O2 +H2SO4→ Cr2(SO4)3+ КOH + O2 + H2O
![Соединения хрома в заданиях ЕГЭ уровня С Работа экспертов :Найдите в реакциях ошибочные продукты, объясните, почему Работа экспертов :Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:Na3 [Сг(OH)6]](https://theslide.ru/img/thumbs/fa2728f195d72c058ef5bceba3b2b1ed-800x.jpg)
Слайд 16не может получиться такое вещество, которое вступает во взаимодействие
со средой!
а) в …среде не может получиться оксид
металла, основание, аммиак;
б) в …..среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в …. растворе.
Неверные с химической точки зрения продукты:

Слайд 17не может получиться такое вещество, которое вступает во взаимодействие
со средой!
а) в кислой среде не может получиться
оксид металла, основание, аммиак;
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.
Неверные с химической точки зрения продукты:

Слайд 18Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи,
полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор.
К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
составьте уравнения 4-х реакций
Практическая часть С2

Слайд 19
1. Cr2O3 + Br2 +NaOH→
2. Cr(OH)3 +Cl2 +NaOH→
3. CrCl3
+Br2 +KOH→
4. CrCl3 +H2O2 +NaOH→
5. Cr2(SO4)3 + Br2 +NaOH→
6. Cr2(SO4)3
+KMnO4 +KOH→
7. K2Cr2O7 + H2O2 +H2SO4→
8. K2Cr2O7 + Fe +H2SO4 →
Домашнее задание.
ОВР. Соединения хрома.
Закончить уравнения реакций.

Хром
1. Положение хрома в периодической системе химических элементов
2. Электронное строение хрома
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид хрома (III)
- Способы получения
- Химические свойства
Оксид хрома (II)
- Химические свойства
Оксид хрома (VI)
- Способы получения
- Химические свойства
Гидроксид хрома (III)
- Способы получения
- Химические свойства
Гидроксид хрома (II)
- Способы получения
- Химические свойства
Соли хрома
Хром
Положение в периодической системе химических элементов
Хром расположен в 6 группе (или в побочной подгруппе VI группы в короткопериодной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома хрома
Электронная конфигурация хрома в основном состоянии:
+24Cr 1s22s22p63s23p63d54s1 1s 2s
2p
3s 3p
4s
3d
Примечательно, что у атома хрома уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Хром – твердый металл голубовато-белого цвета. Очень чистый хром поддается механической обработке. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Чаще всего хром применяется, как компонент сплавов, которые используются при изготовлении медицинского или химического технологического оборудования и приборов.
Изображение с портала top10a.ru
Температура плавления 1890оС, температура кипения 2680оС, плотность хрома 7,19 г/см3.
Нахождение в природе
Хром – довольно распространенный металл в земной коре (0,012 масс.%). Основной минерал, содержащий хром – хромистый железняк FeO·Cr2O3 (или Fe(CrO2)2).
Способы получения
Хром получают из хромита железа. Для восстановления используют кокс:
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Еще один способ получения хрома: восстановление из оксида алюминием (алюмотермия):
2Al + Cr2O3 → 2Cr + Al2O3
Качественные реакции
Качественная реакция на ионы хрома +2 – взаимодействие избытка солей хрома (II) с щелочами. При этом образуется коричневый аморфный осадок гидроксида хрома (II).
Например, хлорид хрома (II) взаимодействует с гидроксидом натрия:
CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl
Качественная реакция на ионы хрома +3 – взаимодействие избытка солей хрома (III) с щелочами. При этом образуется серо-зеленый аморфный осадок гидроксида хрома (III).
Например, хлорид хрома (III) взаимодействует с гидроксидом калия:
CrCl3 + 3KOH → Cr(OH)3 + 3KCl
При дальнейшем добавлении щелочи амфотерный гидроксид хрома (III) растворяется с образованием комплексной соли:
Cr(OH)3 + 3KOH → K3[Cr(OH)6]
Обратите внимание, если мы поместим соль хрома (III) в избыток раствора щелочи, то осадок гидроксида хрома (III) не образуется, т.к. в избытке щелочи соединения хрома (III) сразу переходят в комплекс:
CrCl3 + 6KOH → K3[Cr(OH)6] + 3KCl
Соли хрома можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей хрома (II) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (II).
CrCl2 + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4Cl
Cr2+ + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4+
При взаимодействии растворимых солей хрома (III) с водным раствором аммиака также образуется серо-зеленый осадок гидроксида хрома (III).
CrCl3 + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4Cl
Cr3+ + 3NH3 + 3H2O → Cr(OH)3 ↓ + 3NH4+
Химические свойства
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
1. При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором.
1.1. При взаимодействии хрома с галогенами образуются галогениды:
2Cr + 3Cl2 → 2CrCl3
1.2. Хром реагирует с серой с образованием сульфида хрома:
2Cr + 3S → Cr2S3
1.3. Хром взаимодействует с фосфором. При этом образуется бинарное соединение – фосфид хрома:
Cr + P → CrP
1.4. С азотом хром реагирует при нагревании до 1000оС с образованием нитрида:
2Cr + N2 → 2CrN
1.5. Хром не взаимодействует с водородом.
1.6. Хром взаимодействует с кислородом с образованием оксида:
4Cr + 3O2 → 2Cr2O3
2. Хром взаимодействует и со сложными веществами:
2.1. Хром реагирует с парами воды в раскаленном состоянии:
2Cr + 3H2O (пар) → Cr2O3 + 3H2
2.2. В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов минеральных кислот (соляной и разбавленной серной кислоты), образуя соли хрома (II).
Например, хром бурно реагирует с соляной кислотой:
Cr + 2HCl → CrCl2 + H2↑
В присутствии кислорода образуются соли хрома (III):
4Cr + 12HCl + 3O2 → 4CrCl3 + 6H2O
2.3. При обычных условиях хром не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат хрома (III) и вода:
2Cr + 6H2SO4 → Cr2(SO4)3 + 3SO2 + 6H2O
2.4. Хром не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации.
Только при сильном нагревании концентрированная азотная кислота растворяет хром:
Cr + 6HNO3 → Cr(NO3)3 + 3NO2 + 3H2O
2.5. Растворы щелочей на хром практически не действуют.
2.6. Однако хром способен вытеснять многие металлы, например медь, олово, серебро и др. из растворов их солей.
Например, хром реагирует с хлоридом меди с образованием хлорида хрома (III) и меди:
2Cr + 3CuCl2 → 2CrCl3 + 3Cu
Восстановительные свойства хрома также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами, хлоратами в щелочной среде.
Например, при сплавлении хрома с хлоратом калия в щелочи хром окисляется до хромата калия:
Cr + KClO3 + 2KOH → K2CrO4 + KCl + H2O
Хлорат калия и нитрат калия также окисляют хром:
2Cr + KClO3 → Cr2O3 + KCl
2Cr + 3KNO3 → Cr2O3 + 3KNO2
Оксид хрома (III)
Способы получения
Оксид хрома (III) можно получить различными методами:
1. Термическим разложением гидроксида хрома (III):
2Cr(OH)3 → Cr2O3 + 3H2O
2. Разложением дихромата аммония:
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
3. Восстановлением дихромата калия углеродом (коксом) или серой:
2K2Cr2O7 + 3C → 2Cr2O3 + 2K2CO3 + CO2
K2Cr2O7 + S → Cr2O3 + K2SO4
Химические свойства
Оксид хрома (III) – типичный амфотерный оксид. При этом оксид химически довольно инертен. В высокодисперсном состоянии с трудом взаимодействует с кислотами и щелочами.
1. При сплавлении оксида хрома (III) с основными оксидами активных металлов образуются соли-хромиты.
Например, оксид хрома (III) взаимодействует с оксидом натрия:
Na2O + Cr2O3 → 2NaCrO2
2. Оксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—хромиты, а в растворе реакция практически не идет. При этом оксид хрома (III) проявляет кислотные свойства.
Например, оксид хрома (III) взаимодействует с гидроксидом натрия в расплаве с образованием хромита натрия и воды:
2NaOH + Cr2O3 → 2NaCrO2 + H2O
3. Оксид хрома (III) не взаимодействует с водой.
4. Оксид хрома (III) проявляет слабые восстановительные свойства. В щелочных расплавах окислителей окисляется до соединений хрома (VI).
Например, оксид хрома (III) взаимодействует с нитратом калия в щелочной среде:
Cr2O3 + 3KNO3 + 4KOH → 2K2CrO4 + 3KNO2 + 2H2O
Оксид хрома (III) окисляется бромом в присутствии гидроксида натрия:
Cr2O3 + 3Br2 + 10NaOH → 2Na2CrO4 + 6NaBr + 5H2O
Озоном или кислородом:
Сr2O3 + O3 + 4KOH → 2K2CrO4 + 2H2O
Cr2O3 + 3O2 + 4Na2CO3 → 2Na2CrO4 + 4CO2
Нитраты и хлораты в расплаве щелочи также окисляют оксид хрома (III):
Сr2O3 + 3NaNO3 + 2Na2CO3 → 2Na2CrO4 + 2CO2 + 3NaNO2
Cr2O3 + KClO3 + 2Na2CO3 → 2Na2CrO4 + KCl + 2CO2
5. Оксид хрома (III) в высокодисперсном состоянии при сильном нагревании взаимодействует с сильными кислотами.
Например, оксид хрома (III) реагирует с серной кислотой:
Cr2O3 + 3H2SO4 → Cr2(SO4)3 + 3H2O
6. Оксид хрома (III) проявляет слабые окислительные свойства при взаимодействии с более активными металлами.
Например, оксид хрома (III) реагирует с алюминием (термит):
2Al + Cr2O3 → Al2O3 + 2Cr
Реакция очень экзотермическая, сопровождается выделением большого количества света:

Если сжечь большой объем термита в тигле, то можно получить металлический хром:

7. Оксид хрома (III) – твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната калия:
Cr2O3 + K2CO3 → 2KCrO2 + CO2
Оксид хрома (II)
Химические свойства
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
1. При обычной температуре устойчив на воздухе, выше 100°С окисляется кислородом. Все соединения хрома (II) – сильные восстановители.
4CrO + O2 → 2Cr2O3
2. При высоких температурах оксид хрома (II) диспропорционирует:
3CrO → Cr + Cr2O3
3. Оксид хрома (II) не взаимодействует с водой.
4. Оксид хрома (II) проявляет основные свойства. Взаимодействует с сильными кислотами и кислотными оксидами.
Например, оксид хрома (II) взаимодействует с соляной кислотой:
CrO + 2HCl → CrCl2 + H2O
И с серной кислотой:
CrO + H2SO4 → CrSO4 + H2O
Оксид хрома (VI)
Оксид хрома (VI) CrO3 – темно-красное кристаллическое вещество. Гигроскопичен, расплывается на воздухе, малоустойчив, разлагается при нормальных условиях.
Способы получения
Оксид хром (VI) можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
Na2Cr2O7 + 2H2SO4 → 2CrO3 + 2NaHSO4 + H2O
Химические свойства
Оксид хрома (VI) – кислотный. Сильно ядовит. Оксиду хрома (VI) соответствуют хромовая (H2CrO4) и дихромовая (H2Cr2O7) кислоты.

1. При взаимодействии оксида хрома (VI) с водой образуется хромовые кислоты:
CrO3 + Н2O → Н2CrO4
2CrO3 + Н2O → Н2Cr2O7
2. Оксид хрома (VI) проявляет кислотные свойства. Взаимодействует с основаниями и основными оксидами.
Например, оксид хрома (VI) взаимодействует с гидроксидом калия с образованием хромата калия:
CrO3 + 2KOH → K2CrO4 + H2O
Или с оксидом лития с образованием хромата лития:
CrO3 + Li2O → Li2CrO4
3. Оксид хрома (VI) – очень сильный окислитель: окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III).
Например, сера окисляется до оксида серы (IV):
4CrO3 + 3S → 2Cr2O3 + 3SO2↑
Оксид хрома (VI) также окисляет сложные вещества, например, сульфиты:
2CrO3 + 3K2SO3 + 3H2SO4 → 3K2SO4 + Cr2(SO4)3 + 3H2O
И некоторые органические веществ, например, этанол:
2CrO3 + 3C2H5OH + 3H2SO4 → Cr2(SO4)3 + 3CH3CHO + 6H2O
Гидроксид хрома (III)
Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
Например, хлорид хрома (III) реагирует с водным раствором аммиака с образованием гидроксида хрома (III) и хлорида аммония:
CrCl3 + 3NH3 + 3H2O → Cr(OH)3 + 3NH4Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
K3[Cr(OH)6] + 3CO2 → Cr(OH)3↓ + 3KHCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например, хлорид хрома (III) реагирует с недостатком гидроксида калия с образованием гидроксида хрома (III) и хлорида калия:
CrCl3 + 3KOH(недост) → Cr(OH)3↓ + 3KCl
4. Также гидроксид хрома (III) образуется при взаимодействии растворимых солей хрома (III) с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе.
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
2CrBr3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 3CO2↑ + 6NaBr
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид хрома (III) реагирует с растворимыми кислотами. При этом образуются средние соли.
Например, гидроксид хрома (III) взаимодействует с соляной кислотой с образованием хлорида хрома (III):
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O
Cr(OH)3 + 3HBr → CrBr3 + 3H2O
2. Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид хрома (III) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (III):
2Cr(OH)3 + 3SO3 → Cr2(SO4)3 + 3H2O
3. Гидроксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в растворе образуются комплексные соли. При этом гидроксид хрома (III) проявляет кислотные свойства.
Например, гидроксид хрома (III) взаимодействует с избытком гидроксидом натрия с образованием гексагидроксохромата:
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6]
4. Гидроксид хрома (III) разлагается при нагревании:
2Cr(OH)3 → Cr2O3 + 3H2O
5. Под действием окислителей в щелочной среде переходит в хромат.
Например, при взаимодействии с бромом в щелочной среде гидроксид хрома (III) окисляется до хромата:
2Cr(OH)3 + 3Br2 + 10KOH → 2K2CrO4 + 6KBr + 8H2O
Гидроксид хрома (II)
Способы получения
1. Гидроксид хрома (II) можно получить действием раствора аммиака на соли хрома (II).
Например, хлорид хрома (II) реагирует с водным раствором аммиака с образованием гидроксида хрома (II) и хлорида аммония:
CrCl2 + 2NH3 + 2H2O → Cr(OH)2 + 2NH4Cl
2. Гидроксид хрома (II) можно получить действием щелочи на соли хрома (II).
Например, хлорид хрома (II) реагирует с гидроксидом калия с образованием гидроксида хрома (II) и хлорида калия:
CrCl2 + 2KOH → Cr(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид хрома (II) проявляет основные свойства. В частности, реагирует с растворимыми кислотами.
Например, гидроксид хрома (II) взаимодействует с соляной кислотой с образованием хлорида хрома (II). Соли хрома (II) окрашивают раствор в синий цвет.
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
2. Гидроксид хрома (II) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид хрома (II) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (II):
Cr(OH)2 + SO3 → CrSO4 + H2O
3. Гидроксид хрома (II) – сильный восстановитель.
Например, под действием кислорода воздуха гидроксид хрома (II) окисляется до гидроксида хрома (III):
4Cr(OН)2 + O2 + 2Н2О → 4Cr(OН)3
Соли хрома
Соли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
Например, хлорид хрома (II) окисляется кислородом в растворе в присутствии щелочи до соединений хрома (III):
4CrCl2 + O2 + 20KOH + 2H2O → 4K3[Cr(OH)6] + 8KCl
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
CrCl2 + 4HNO3(конц) → Cr(NO3)3 + NO2↑ + 2HCl↑ + H2O
2CrCl2 + 4H2SO4(конц) → Cr2(SO4)3 + SO2↑ + 4HCl↑ +2H2O
Соли хрома (III)
Хром с валентностью III образует два типа солей:
- Соли, в которых хром (III) является катионом. Например, хлорид хрома (III) CrCl3.
- Соли, в которых хром (III) входит в состав кислотного остатка – хромиты и гидроксокомплексы хрома (III). Например, хромит калия, KCrO2. или гексагидроксохромат (III) калия K3[Cr(OH)6].
1. Соли хрома (III) проявляют слабые восстановительные свойства. окисляются под действием сильных окислителей в щелочной среде.
Например, бром в присутствии гидроксида калия окисляет хлорид хрома (III):
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Cr2(SO4)3 + 3Br2 + 16NaOH → 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8H2O
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
2CrCl3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 6NaCl + 8H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Cr2(SO4)3 + 6KMnO4 + 16KOH → 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Например, гексагидроксохроматы окисляются бромом в щелочи:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH → 2Na2CrO4 + 6NaBr + 8H2O
2K3[Cr(OH)6] + 3Br2 + 4KOH → 2K2CrO4 + 6KBr + 8H2O
Оксид свинца (IV) также окисляет хромиты:
2KCrO2 + 3PbO2 + 8KOH → 2K2CrO4 + 3K2PbO2 + 4H2O
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
Cr(OH)3 + 3KOH → K3[Cr(OH)6]
3. Более активные металлы вытесняют хром (III) из солей.
Например, цинк реагирует с хлоридом хрома (III):
2CrCl3 + Zn → 2CrCl2 + ZnCl2
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr3+ + H2O = CrOH2+ + H+
II ступень: CrOH2+ + H2O = Cr(OH)2+ + H+
III ступень: Cr(OH)2+ + H2O = Cr(OH)3 + H+
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Например, при сливании растворов солей хрома (III) и сульфита, гидросульфита, карбоната или сульфида натрия протекает взаимный гидролиз:
Cr2(SO4)3 + 6NaHSO3 → 2Cr(OH)3 + 6SO2 + 3Na2SO4
2CrBr3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + CO2↑ + 6NaBr
2Cr(NO3)3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 6NaNO3 + 3CO2↑
2CrCl3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 6NaCl + 3CO2↑
Cr2(SO4)3 + 3K2CO3 + 3H2O → 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами:
Cr2O3 + Na2O → 2NaCrO2
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
Например, хромит натрия мы поделим мысленно на два вещества: оксид хрома (III) и оксид натрия.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl (недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl (избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HNO3 → Cr(NO3)3 + NaNO3 + 2H2O
2NaCrO2 + 4H2SO4 → Cr2(SO4)3 + Na2SO4 + 4H2O
Под действием избытка воды хромиты гидролизуются:
NaCrO2 + 2H2O → Cr(OH)3↓ + NaОН
Соли хрома (VI)
Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
Например, хромат калия K2CrO4 и дихромат калия K2Cr2O7.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
Например, хромат калия взаимодействует с серной кислотой и разбавленной соляной кислотой с образованием дихромата калия:
2K2CrO4 + H2SO4(разб.) → K2Cr2O7 + K2SO4 + H2O
2K2CrO4 + 2HCl(разб.) → K2Cr2O7 + 2KCl + H2O
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Например, дихромат калия взаимодействует с гидроксидом калия с образованием хромата калия:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
Видеоопыт взаимных переходов хроматов и дихроматов при добавлении кислоты или щелочи можно посмотреть здесь.
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Например, дихромат калия реагирует с сульфитом натрия в нейтральной среде:
K2Cr2O7 + 3Na2SO3 + 4H2O → 2Cr(OH)3↓ + 3Na2SO4 + 2KOH
Хромат калия окисляет сульфид аммония:
2K2CrO4 + 3(NH4)2S + 2H2O → 2Cr(OH)3↓ + 3S↓ + 6NH3↑ + 4KOH
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Например, хромат калия окисляет гидросульфид аммония в щелочной среде:
2K2CrO4 + 3NH4HS + 2H2O + 2KOH → 3S + 2K3[Cr(OH)6] + 3NH3
Хромат натрия окисляет сернистый газ:
2Na2CrO4 + 3SO2 + 2H2O + 8NaOH → 2Na3[Cr(OH)6] + 3Na2SO4
Хромат натрия окисляет сульфид натрия:
2Na2CrO4 + 3Na2S + 8H2O → 3S + 2Na3[Cr(OH)6] + 4NaOH
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Например, дихромат калия окисляет сероводород в присутствии серной кислоты:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту:
K2Cr2O7 + 7H2SO4 + 6KI → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
8K2Cr2O7 + 3Ca3P2 + 64HCl → 3Ca3(PO4)2 + 16CrCl3 + 16KCl + 32H2O
K2Cr2O7 + 7H2SO4 + 6FeSO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 4H2SO4 + 3KNO2 → Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
K2Cr2O7 + 3SO2 + 8HCl → 2KCl + 2CrCl3 + 3H2SO4 + H2O
K2Cr2O7 + 14HCl → 3Cl2 + 2CrCl3 + 7H2O + 2KCl
1
СОЕДИНЕНИЯ ХРОМА Составитель: И.Н. Пиялкина, учитель химии МБОУ СОШ 37 города Белово
2
Соединения хрома Соединения хрома(II) Соединения хрома(III) Соединения хрома(VI) CrO – основный оксид Cr(OH) 2 — основание CrO 3 — кислотный оксид H 2 CrO 4 — хромовая H 2 Cr 2 O 7 — дихромовая кислоты Cr 2 O 3 — амфотерный оксид Cr(OH) 3 — амфотерный гидроксид
3
CrO Оксид хрома (II) – кристаллы черного цвета, имеет основный характер При осторожном нагревании гидроксида хрома (II) в отсутствии кислорода получают оксид хрома (II). Составьте уравнение реакции. Cr(OH) 2 = CrO + H 2 O 3CrO = Cr + Cr 2 O 3 При более высоких температурах оксид хрома (II) диспропорционирует: 700° Соединения хрома (II)
4
Оксида хрома (II) реагирует с соляной и серной кислотами. Рассмотрите реакции с точки зрения ТЭД. CrO + H 2 SO 4 = CrSO 4 + H 2 O CrO + 2H + + Cl – = Cr Cl – + H 2 O CrO + 2H + = Cr 2+ + H 2 O CrO + 2HCl = CrCl 2 + H 2 O CrO + 2H + + SO 4 2– = Cr 2+ + SO 4 2– + H 2 O CrO + 2H + = Cr 2+ + H 2 O
5
Оксид хрома (II) – сильный восстановитель. Кислородом воздуха окисляется до оксида хрома (III) Cr +2 O + O 2 0 Cr 2 +3 O 3 –2 Cr +2 – 1e Cr +3 4 O e 2O –2 1 4CrO + O 2 = 2Cr 2 O 3 CrO (за счет Cr +2 ) – восстановитель, процесс окисления O 2 – окислитель, процесс восстановления
6
Cr(OH) 2 Гидроксид хрома (II) Гидроксид хрома (II) получают в виде желтого осадка действием растворов щелочей на соли хрома (II) без доступа воздуха. CrCl 2 + 2NaOH = Cr(OH) 2 + 2NaCl Cr Cl – +2Na + +2OH – = Cr(OH) 2 + 2Na + +2Cl – Cr OH – = Cr(OH) 2
7
Гидроксид хрома (II) обладает основными свойствами Cr(OН) 2 + 2HCl = CrCl 2 + 2H 2 O Cr(OН) 2 + 2H + + 2Cl – = Cr Cl – + 2H 2 O Cr(OН) 2 + 2H + = Cr H 2 O
8
Гидроксид хрома (II) – сильный восстановитель Кислородом воздуха окисляется до гидроксида хрома (III) Cr +2 (ОН) 2 + O Н 2 О Cr +3 (O –2 Н) 3 Cr +2 – 1e Cr +3 4 O e 2O –2 1 4Cr(OН) 2 + O 2 + 2Н 2 О = 4Cr(OН) 3 Cr(OН) 2 (за счет Cr +2 ) – восстановитель, процесс окисления O 2 – окислитель, процесс восстановления
9
Соли хрома (II) Водные растворы солей хрома (II) получают без доступа воздуха растворением металлического хрома в разбавленных кислотах в атмосфере водорода или восстановлением цинком в кислой среде солей трехвалентного хрома. Безводные соли хрома (II) белого цвета, а водные растворы и кристаллогидраты синего цвета. Соединения хрома (II) – сильные восстановители. Легко окисляются. Именно поэтому очень трудно получать и хранить соединения двухвалентного хрома. Реагируют с концентрированными серной и азотной кислотами: 4CrCl 2 + O 2 + 4HCl 4CrCl 3 + 2H 2 O 2CrCl 2 +4H 2 SO 4 Cr 2 (SO 4 ) +SO 2 + 4HCl + 2H 2 O CrCl 2 + 4HNO 3 Cr(NO 3 ) 3 + NO 2 + 2HCl + H 2 O
10
Cr 2 O 3 Оксид хрома (III) – тугоплавкий порошок темно-зеленого цвета. Получение^ В лабораторных условиях термическим разложением дихромата аммония: (NH 4 ) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 2H 2 O В промышленности восстановлением дихромата калия коксом или серой: K 2 Cr 2 O 7 + 3C = 2Cr 2 O 3 + 2K 2 CO 3 + CO 2 K 2 Cr 2 O 7 + S = 2Cr 2 O 3 + K 2 SO 4 t° Соединения хрома (III)
11
Оксид хрома (III) обладает амфотерными свойствами При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение реакции оксида хрома (III) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЭД. Cr 2 O 3 + 6HCl = 2CrCl 3 + 3H 2 O Cr 2 O 3 + 6H + + 6Cl – = 2Cr Cl – + 3H 2 O Cr 2 O 3 + 6H + = 2Cr H 2 O
12
При сплавлении оксида хрома (III) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуются хромиты: Сr 2 O 3 + Ba(OH) 2 = Ba(CrO 2 ) 2 + H 2 O Сr 2 O 3 + Na 2 CO 3 = 2NaCrO 2 + CO 2 t° Оксид хрома (III) нерастворим в воде.
13
В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель и переходит в хромат: Cr 2 O 3 + KOH + KMnO 4 K 2 CrO 4 + MnO 2 + H 2 O Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. Cr 2 O 3 + KOH +Сa(ClO) 2 K 2 CrO 4 + CaCl 2 + H 2 O Cr 2 O 3 + O 2 + Na 2 CO 3 Na 2 CrO 4 + CO 2 Cr 2 O 3 + KClO 3 + Na 2 CO 3 Na 2 CrO 4 + KCl + CO 2 Cr 2 O 3 +NaNO 3 + Na 2 CO 3 Na 2 CrO 4 +NaNO 2 + CO 2
14
Оксид хрома (III) – катализатор В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида азота, который в избытке кислорода окисляется до бурого диоксида азота.
15
Каталитическое окисление этанола Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома (III) Реакция окисления спирта протекает с выделением энергии. Продукт реакции окисления спирта — уксусный альдегид. Cr 2 O 3, t° 2СН 3 –СН 2 –ОН +О 2 2СН 3 – С О +2H 2 O H
16
Гидроксид хрома (III) Cr(OH) 3 Получают гидроксид хрома (III) действием растворов щелочей или аммиака на растворы солей хрома (III). Составьте уравнение реакции получения Cr(OH) 3 действием раствора аммиака на хлорид хрома (III): CrCl 3 + 3(NH 3 ·H 2 O) = Cr(OH) 3 + 3NH 4 Cl Лабораторный опыт 1 К раствору хлорида хрома (III) прилейте раствор аммиака. Что наблюдаете?
17
Лабораторный опыт 2 Осадок, полученный в опыте 1 разделите на две части, к одной из них добавьте раствор соляной кислоты, а к другой – щелочь. Что происходит? Какими свойствами обладает гидроксид хрома (III)? Cr(OH) 3 CrCl 3 Na 3 [Cr(OH) 6 ] NaOH HCl
18
+H 2 SO 4 +NaOH Осадок, полученный в опыте 1 разделите на две части, к одной из них добавьте серной кислоты, а к другой – щелочь. Что происходит?
19
Гидроксид хрома (III) обладает амфотерными свойствами. При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение реакции гидроксида хрома (III) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЭД. Cr(OH) 3 + 3HCl = CrCl 3 + 3H 2 O Cr(OH) 3 + 3H + + 3Cl – = Cr Cl – + 3H 2 O Cr(OH) 3 + 3H + = Cr H 2 O
20
Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ] Cr(OH) 3 + 3Na + + 3OH – = 3Na + + [Cr(OH) 6 ] 3– Cr(OH) 3 + 3OH – = [Cr(OH) 6 ] 3– 2Cr(OH) 3 = Cr 2 O 3 + 3H 2 O t° Гидроксид хрома (III) растворяется в щелочах При нагревании гидроксид хрома (III) разлагается: гексагидроксохромат (III) натрия (изумрудно-зеленый)
21
Соли хрома (III) Бывают двух видов: CrCl 3 — хроматы (III) и хромиты NaCrO 2 или гидроксокомплексы Na 3 [Cr(OH) 6 ] СВОЙСТВА: 1. Хроматы (III) в щелочной среде образуют гидроксид хрома(III), который сразу растворяется, образуя гидроксокомплексы. CrCl 3 + 3KOH (нед.) Cr(OН) 3 + 3KCl CrCl 3 + 6KOH (изб.) К 3 [Cr(OH) 6 ] + 3KCl 2. Хромиты устойчивы в щелочной среде, в кислой разрушаются: NaCrO 2 + HCl (нед.) + H 2 O = Cr(OH) 3 + NaCl NaCrO 2 + 4HCl (изб.) = CrCl 3 + NaCl + 2H 2 O с угольной кислотой Na 3 [Cr(OH) 6 ] + 3CO 2 = Cr(OH) 3 + 3NaHCO 3
22
Соли хрома (III) 3. Взаимный гидролиз: при смешивании солей хрома (III) с растворами сульфидов, сульфитов, карбонатов происходит выпадение осадка гидроксида хрома (III) и выделение газа Cr 2 S 3 + 6H 2 O = 2Cr(OH) 3 + 3H 2 S В водных растворах катион Cr 3+ встречается только в виде гидратированного иона [Cr(H 2 O) 6 ] 3+, который придает раствору сине-фиолетовый цвет. 2CrCl 3 +3Na 2 S + 6H 2 O 2Cr(OН) 3 +3Н 2 S +3NaCl 4. В растворе подвергаются полному гидролизу:
23
Сульфат хрома (III) образует двойные соли – хромовые квасцы Из смешанного раствора сульфата хрома (III) и сульфата калия кристаллизуется двойная соль – KCr(SO 4 ) 2 ·12H 2 O сине-фиолетового цвета. Применяются в качестве дубящего вещества при изготовлении эмульсий, а также в дубящих растворах и дубящих фиксажах.
24
Соединения хрома (III) могут проявлять как окислительные так и восстановительные свойства. Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. Назовите окислитель и восстановитель. K 3 [Cr(OH) 6 ] +Br 2 +KOH K 2 CrO 4 + KBr + H 2 O CrCl 3 + H 2 O 2 + KOH K 2 CrO 4 +KCl + H 2 O KCrO 2 +PbO 2 + KOH K 2 CrO 4 +K 2 PbO 2 + H 2 O Cr 2 (SO 4 ) 3 +Cl 2 +NaOH Na 2 CrO 4 +NaCl +H 2 O +Na 2 SO 4 CrCl 3 + Zn CrCl 2 + ZnCl 2
25
Получают CrO 3 действием избытка концентрированной серной кислоты на насыщенный водный раствор дихромата натрия: Na 2 Cr 2 O 7 + 2H 2 SO 4 = 2CrO 3 + 2NaHSO 4 + H 2 O Оксид хрома (VI) очень ядовит. 4CrO 3 2Cr 2 O 3 + 3O 2. При нагревании выше 250 °C разлагается: Оксид хрома (VI) CrO 3 хромовый ангидрид, представляет собой темно-красные игольчатые кристаллы. Соединения хрома (VI)
26
CrO 3 кислотный оксид С избытком воды образуется хромовая кислота H 2 CrO 4 CrO 3 + Н 2 O = Н 2 CrO 4 При большой концентрации CrO 3 образуется дихромовая кислота Н 2 Cr 2 О 7 2CrO 3 + Н 2 O = Н 2 Cr 2 O 7 которая при разбавлении переходит в хромовую кислоту: Н 2 Cr 2 О 7 + Н 2 О = 2Н 2 CrO 4 При растворении в воде образует кислоты. Эти кислоты – неустойчивые. Существуют только в растворе. Между ними в растворе устанавливается равновесие 2Н 2 CrO 4 Н 2 Cr 2 O 7 + Н 2 O При взаимодействии CrO 3 со щелочами образуются хроматы CrO 3 + 2KOH K 2 CrO 4 + H 2 O.
27
CrO 3 является сильным окислителем Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним. Окисляет йод, серу, фосфор, уголь. 4CrO 3 + 3S = 2Cr 2 O 3 + 3SO 2 4CrO 3 + C 2 H 5 OH 2CO 2 + 2Cr 2 O 3 + 3H 2 O
28
Если поместить оксид хрома на фарфоровую пластинку и капнуть на него несколько капель ацетона,то через несколько секунд ацетон загорается. При этом оксид хрома (VI) восстанавливается до оксида хрома (III), а ацетон окисляется до углекислого газа и воды. Окисление ацетона хромовым ангидридом (видео)(видео) 16CrO 3 +3CH 3 – С – CH 3 9CO 2 + 8Cr 2 O 3 + 9H 2 O О
29
Оксиду хрома (VI) соответствуют две кислоты – хромовая Н 2 CrO 4 и дихромовая Н 2 Cr 2 O 7
30
Хромовая кислота кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов CrO 3 ; хромовая кислота электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет
31
хроматы – соли хромовой кислоты устойчивы в щелочной среде, при подкислении переходят в оранжевые дихроматы, соли двухромовой кислоты. Реакция обратима, поэтому при добавлении щелочи желтая окраска хромата восстанавливается. 2CrO 4 2– + 2H+ Cr 2 O 7 2– + H 2 O хроматы дихроматы соли ОН – Н+Н+
32
Лабораторный опыт 3 К раствору дихромата калия добавьте гидроксид калия. Как изменилась окраска? Чем это вызвано? К полученному раствору добавьте серной кислоты до восстановления желтой окраски. Напишите уравнения реакций.
33
2K 2 CrO 4 + H 2 SO 4(разб.) = K 2 Cr 2 O 7 +K 2 SO 4 +H 2 O K 2 Cr 2 O 7 + 2KOH = 2K 2 CrO 4 + H 2 O 2K 2 CrO 4 +2HCl (разб.) = K 2 Cr 2 O 7 + 2KCl + H 2 O 2K 2 CrO 4 + H 2 O + CO 2 = K 2 Cr 2 O 7 + KHCO 3
34
Взаимопревращение хроматов и дихроматов Оксиду хрома (VI) соответствуют две кислоты – хромовая Н 2 CrO 4 и дихромовая Н 2 Cr 2 O 7, Хромат калия K 2 CrO 4 и дихромат калия K 2 Cr 2 O 7 – соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым. 2K 2 CrO 4 + H 2 SO 4 = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы. K 2 Cr 2 O 7 + 2KOH = 2K 2 CrO 4 + H 2 O
35
Соединения хрома (VI) – сильные окислители Cr 2 O 7 2 – Cr 3+ Cr(OH) 3 [Cr(OH) 6 ] 3 – H+ H2OH2O OH – Cr 2 O 7 2– + 14H + + 6e 2Cr H 2 O Cr 2 O 7 2– + 7Н 2 О + 6e 2[Cr(OH) 6 ] 3– + 2ОН –
36
Окислительные свойства дихроматов Дихроматы, например дихромат калия K 2 Cr 2 O 7 – сильные окислители. Под действием восстановителей дихроматы в кислой среде переходят в соли хрома (III). Примером такой реакции может служить окисление сульфита натрия раствором дихромата калия в кислой среде. К раствору дихромата калия добавляем серную кислоту и раствор сульфита натрия. K 2 Cr 2 O 7 +3Na 2 SO 3 +4H 2 SO 4 =Cr 2 (SO 4 ) 3 +3Na 2 SO 4 +K 2 SO 4 + 4H 2 O Оранжевая окраска, характерная для дихроматов, переходит в зеленую. Образовался раствор сульфата хрома (III) зеленого цвета. Соли хрома — ярко окрашены, именно поэтому элемент получил такое название: «хром», что в переводе с греческого означает «цвет, краска». опыт
37
1. Zn + K 2 Cr 2 O 7 +H 2 SO 4 ZnSO 4 + Cr 2 (SO 4 ) 3 +K 2 SO 4 +H 2 O 2. K 2 Cr 2 O 7 + H 2 S +H 2 SO 4 S + Cr 2 (SO 4 ) 3 +K 2 SO 4 +H 2 O 3. K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 O 2 + Cr 2 (SO 4 ) 3 + K 2 SO 4 +H 2 O 4. K 2 Cr 2 O 7 + H 2 O + H 2 S S + Cr(OH) 3 + KOH 5. K 2 Cr 2 O 7 + H 2 O + K 2 S S + K 3 [Cr(OH) 6 ] + KOH Дихроматы проявляют окислительные свойства не только в растворах, но и в твердом виде: K 2 Cr 2 O 7 + S K 2 SO 4 + Cr 2 O 3 K 2 Cr 2 O 7 + С K 2 СO 3 + СО + Cr 2 O 3 K 2 Cr 2 O 7 + Al Cr + KAlO 2 + Al 2 O 3 Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. K 2 Cr 2 O 7 + KOH + (NH 4 ) 2 S S + K 3 [Cr(OH) 6 ] + NH 3
38
Дихромат калия (хромпик) широко применяется как окислитель органических соединений: 3С 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 CH 3 – CHO + Cr 2 (SO 4 ) 3 + K 2 SO 4 + 7H 2 O 3С 3 H 7 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 3CH 3 – C–CH 3 + Cr 2 (SO 4 ) 3 + K 2 SO 4 + 7H 2 O O
39
Хроматы щелочных металлов плавятся без разложения, а дихроматы при высокой температуре превращаются в хроматы. Дихромат аммония разлагается при нагревании: (NH 4 ) 2 Cr 2 O 7 Cr 2 O 3 + N 2 + 4H 2 O 180°C
40
В ряду гидроксидов хрома различных степеней окисления Cr(ОН) 2 Cr(ОН) 3 Н 2 CrО 4 закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловлено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства. Соединения Cr (II) сильные восстановители, легко окисляются, превращаясь в соединения хрома (III). Соединения хрома(VI) сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
41
Степень окисления хромa Оксид CrO Cr 2 O 3 CrO 3 Гидроксид Cr(OH) 2 Cr(OH) 3 H 2 CrO 4 H 2 Cr 2 O 7 Кислотные и окислительные свойства возрастают Основные и восстановительные свойства возрастают Соединения хрома
42
Домашнее задание: Выполнить ОВР! Используем презентацию «ОВР по теме «ХРОМ»
43
СПАСИБО ЗА РАБОТУ!
44
Начала химии. Современный курс для поступающих в ВУЗы. – М.: 1Федеративная Книготорговая Компания. Химия. Подготовка к ЕГЭ: учебно-методическое пособие / Под ред. В.Н. Доронькина. – Ростов н/Дону: Легион Химия. Пособие для поступающих в вузы /О.О. Максименко. – М. : Филол. о-во СЛОВО: Изд-во Эксмо Интернет-ресурсы (картинки, видеофрагменты: 1) Единая образовательная коллекция цифровых ресурсов. Химия. Неорганическая химия. Металлы побочных подгрупп. Хром. Видеопыты. 2) Образовательная коллекция Химия для всех XXI Химические опыты со взрывами и без