Индивидуальный образовательный маршрут ЕГЭ-2020
Предмет химия Класс 11 ФИ уч-ся _______________
№ задания
Проверяемые
элементы
содержания
Уровень сложности
Кол-во баллов
Результат
контрольной работы (дата)
Форма работы/
дата
Результат работы
над ошибками
Результат
контрольной работы (дата)
Форма работы/
дата
Результат работы
над ошибками
Часть 1
1
Строение электронных оболочек атомов
элементов первых четырёх периодов: s-, p- и d-элементы. Электронная
конфигурация атома. Основное и возбуждённое состояния атомов
Б
1
2
Закономерности изменения химических
свойств элементов и их
соединений по периодам и группам. Общая
характеристика металлов IА–IIIА групп в связи с их положением в
Периодической системе химических элементов Д.И. Менделеева и
особенностями строения их атомов. Характеристика переходных элементов –
меди, цинка, хрома, железа – по их положению в Периодической системе
химических элементов Д.И. Менделеева и особенностям строения их атомов.
Общая характеристика неметаллов IVА–VIIА групп в связи с их
положением в Периодической системе
химических элементов
Д.И. Менделеева и особенностями строения
их атомов
Б
1
3
Электроотрицательность. Степень окисления
и валентность химических элементов
Б
1
4
Ковалентная химическая связь, её
разновидности и механизмы образования. Характеристики ковалентной связи
(полярность и энергия связи). Ионная связь. Металлическая связь.
Водородная связь. Вещества молекулярного и немолекулярного строения. Тип
кристаллической решётки. Зависимость свойств веществ от их состава и
строения
Б
1
5
Классификация неорганических веществ.
Номенклатура неорганических веществ (тривиальная и международная)
Б
1
6
Характерные химические свойства простых
веществ–металлов: щелочных, щелочноземельных, магния, алюминия;
переходных металлов: меди, цинка, хрома, железа. Характерные химические
свойства простых веществ–неметаллов: водорода, галогенов, кислорода, серы,
азота, фосфора, углерода, кремния. Характерные химические свойства
оксидов: основных, амфотерных, кислотных
Б
1
7
Характерные химические свойства оснований
и амфотерных гидроксидов. Характерные химические свойства кислот.
Характерные химические свойства солей:
средних, кислых, основных; комплексных (на примере гидроксосоединений
алюминия и цинка). Электролитическая диссоциация электролитов в водных
растворах. Сильные и слабые электролиты. Реакции ионного обмена
Б
2
8
Характерные химические свойства
неорганических веществ:
– простых веществ–металлов: щелочных,
щелочноземельных,
магния, алюминия, переходных металлов
(меди, цинка, хрома, железа);
– простых веществ–неметаллов: водорода,
галогенов, кислорода, серы, азота, фосфора, углерода, кремния;
– оксидов: основных, амфотерных,
кислотных;
– оснований и амфотерных гидроксидов;
– кислот;
– солей: средних, кислых, основных;
комплексных (на примере гидроксосоединений алюминия и цинка)
П
2
9
Характерные химические свойства
неорганических веществ: простых веществ–металлов: щелочных,
щелочноземельных,
магния, алюминия, переходных металлов
(меди, цинка, хрома, железа);
– простых веществ–неметаллов: водорода,
галогенов, кислорода, серы, азота, фосфора, углерода, кремния;
– оксидов: основных, амфотерных,
кислотных;
– оснований и амфотерных гидроксидов;
– кислот;
– солей: средних, кислых, основных;
комплексных (на примере гидроксосоединений алюминия и цинка)
П
2
10
Взаимосвязь неорганических веществ
Б
2
11
Классификация органических веществ.
Номенклатура органических веществ (тривиальная и международная)
Б
1
12
Теория строения органических соединений:
гомология и изомерия (структурная и пространственная). Взаимное влияние
атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация
атомных орбиталей углерода. Радикал. Функциональная группа
Б
1
13
Характерные химические свойства
углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов,
ароматических углеводородов (бензола и гомологов бензола, стирола). Основные
способы получения углеводородов (в лаборатории)
Б
1
14
Характерные химические свойства предельных
одноатомных и многоатомных спиртов, фенола. Характерные химические свойства
альдегидов, предельных карбоновых кислот, сложных эфиров. Основные
способы получения кислородсодержащих органических соединений (в
лаборатории).
Б
1
15
Характерные химические свойства
азотсодержащих органических соединений: аминов и аминокислот. Важнейшие
способы получения аминов и аминокислот.
Биологически важные вещества: жиры,
углеводы (моносахариды, дисахариды, полисахариды), белки
Б
1
16
Характерные химические свойства
углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов,
ароматических углеводородов (бензола и гомологов бензола, стирола).
Важнейшие способы получения углеводородов. Ионный (правило В.В.
Марковникова) и радикальные механизмы реакций в органической химии
П
2
17
Характерные химические свойства
предельных одноатомных и многоатомных спиртов, фенола, альдегидов,
карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих
органических соединений
П
2
18
Взаимосвязь углеводородов,
кислородсодержащих и азотсодержащих органических соединений
Б
2
19
Классификация химических реакций в
неорганической и органической химии
Б
1
20
Скорость реакции, её зависимость от
различных факторов
Б
1
21
Реакции окислительно-восстановительные
Б
1
22
Электролиз расплавов и растворов (солей,
щелочей, кислот)
П
2
23
Гидролиз солей. Среда водных растворов:
кислая, нейтральная,
щелочная
П
2
24
Обратимые и необратимые химические реакции.
Химическое равновесие. Смещение равновесия под действием различных факторов
П
2
25
Качественные реакции на неорганические
вещества и ионы. Качественные реакции органических соединений
П
2
26
Правила работы в лаборатории. Лабораторная
посуда и оборудование. Правила безопасности при работе с едкими, горючими
и токсичными веществами, средствами бытовой химии. Научные методы
исследования химических веществ и превращений. Методы разделения
смесей и очистки веществ. Понятие о металлургии: общие способы получения
металлов. Общие научные принципы химического производства (на примере
промышленного получения аммиака, серной кислоты, метанола). Химическое
загрязнение окружающей среды и его последствия. Природные источники
углеводородов, их переработка. Высокомолекулярные соединения. Реакции
полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
Б
1
27
Расчёты с использованием понятия
«массовая доля вещества в растворе»
Б
1
28
Расчёты объёмных отношений газов при
химических реакциях. Расчёты по термохимическим уравнениям
Б
1
29
Расчёты массы вещества или объема газов
по известному количеству вещества, массе или объёму одного из участвующих в
реакции веществ
Б
1
Часть 2
30
Реакции окислительно-восстановительные
В
2
31
Электролитическая диссоциация электролитов
в водных растворах. Сильные и слабые электролиты. Реакции ионного
обмена.
В
2
32
Реакции, подтверждающие взаимосвязь
различных классов неорганических веществ
В
4
33
Реакции, подтверждающие взаимосвязь
органических соединений
В
5
34
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе». Расчёты массы (объёма, количества
вещества) продуктов реакции, если одно из веществ дано в избытке (имеет
примеси). Расчеты массы (объема, количества вещества) продукта реакции,
если одно из веществ дано в виде раствора с определенной массовой долей
растворенного вещества Расчёты массовой или объёмной доли выхода
продукта реакции от теоретически возможного. Расчёты массовой доли (массы)
химического соединения в смеси
В
4
35
Установление молекулярной и структурной
формулы вещества
В
3
ИТОГО
60
Тестовый
балл
100
Всего заданий – 35; из них по уровню
сложности: Б – 21; П – 8; В – 6.
Максимальный первичный балл за работу – 60.
По теме: методические разработки, презентации и конспекты
Индивидуальный образовательный маршрут как форма педагогической поддержки одарённых детей в образовательном учреждении (презентация)
Материал содержит методические рекомендации по организации индивидуального образовательного маршрута для одарённых детей, основанные на опыте работы с такими детьми ….
Индивидуальный образовательный маршрут как форма педагогической поддержки одарённых детей в образовательном учреждении (статья)
В статье рассказывается об особенностях организации индивидуального образовательного маршрута для одарённых детей в сельской школе. Приводятся примеры различных форм образовательных маршрутов….
ИНДИВИДУАЛЬНАЯ ОБРАЗОВАТЕЛЬНАЯ ТРАЕКТОРИЯ И ИНДИВИДУАЛЬНЫЙ ОБРАЗОВАТЕЛЬНЫЙ МАРШРУТ ВОСПИТАНИЯ И РАЗВИТИЯ ЛИЧНОСТИ МЛАДШЕГО ШКОЛЬНИКА
В своей статье я хочу рассказать об опыте выстраивания индивидуального образовательного маршрута в период внедрения ФГОС второго поколения, который реализуется в образовательных условиях нашей школы. …
Построение индивидуального образовательного маршрута с использованием дистанционных образовательных технологий.
Построение индивидуального образовательного маршрута с использованием дистанционных образовательных технологий является одним из эффективных способов внедрения личностно-ориентированного подхода …
Доклад на тему «Разработка примерных индивидуальных образовательных траекторий (ИОТ), индивидуальных образовательных маршрутов»
Индивидуальная образовательная траектория (ИОТ) – это персональный путь творческой реализации личностного потенциала каждого ученика в образовании, смысл, значение, цель и компоненты каждого пос…
Презентация на тему «Разработка примерных индивидуальных образовательных траекторий (ИОТ), индивидуальных образовательных маршрутов»
Индивидуальная образовательная траектория (ИОТ) – это персональный путь творческой реализации личностного потенциала каждого ученика в образовании, смысл, значение, цель и компоненты каждого пос…
Индивидуальный образовательный маршрут и индивидуальный учебный план: разница понятий для успешной практики
В статье приведено сравнение нескольких понятий «индивидуальный образовательный маршрут», которое педагоги лицея №373 Московского района проводили при выборе для использования в работе. Пр…
Муниципальное казённое образовательное учреждение
Венгерская средняя общеобразовательная школа
Методическая разработка
«Индивидуальный образовательный маршрут обучающейся
по химии ….
Составитель: Лубошников А.В
учитель химии
П. Венгерка
Аннотация
Данная методическая разработка предназначена для учителей общеобразовательной школы, реализующих основную образовательную программу и работающих нестандартно, стремящимся находить индивидуальный подход к способностям каждого обучающегося.
Цель разработки: раскрытие и описание работы с детьми через реализацию индивидуального образовательного маршрута.
В методической разработке представлен индивидуальный образовательный маршрут ребенка, готовящегося хорошо сдать ЕГЭ в овладении естественных наук и даны рекомендации по его реализации.
Пояснительная записка
Мы ничему не можем научить человека.
Мы можем только помочь ему открыть это в себе.
Галилео Галилей
Современное состояние образования характеризуется интенсивным поиском наиболее эффективных форм образовательной деятельности, созданием таких условий обучения и развития одаренной личности, которые способствовали бы максимальному раскрытию их способностей.
Проблема одаренности в настоящее время становится все более актуальной. Раннее выявление, обучение и воспитание одаренных и талантливых детей составляет одну из главных задач совершенствования системы образования в целом.
Важно отметить, что целью деятельности учреждений дополнительного образования детей – это создание условий для жизненного, личностного и профессионального самоопределения обучающихся, что способствует развитию детской одаренности.
Традиционные формы и методы обучения, ведущие одаренную личность по обобщенному, стандартному, единому для всех образовательному пути, направленные на пассивное усвоение, требуют от ребенка лишь усидчивости, не развивая в нем стремление к активности и самореализации. Очевидно, что при максимальном учете индивидуальных особенностей ребенка, для формирования комплекса умений его самосовершенствования в образовании идеальным может считаться индивидуализация образования.
Принято считать, что процесс индивидуализации образования, ориентируется на интересы, активность, инициативность обучающегося и открыто-рефлексивную позицию педагога. Совместная работа педагога и обучающегося направлена на формирование предметных умений и универсальных умений, на получение учебных результатов в продуктивной форме.
Индивидуализированное образование осуществимо с помощью индивидуального образовательного маршрута обучения.
Индивидуальный образовательный маршрут – это целенаправленно проектируемая дифференцированная образовательная программа, обеспечивающая обучающемуся позиции субъекта выбора, разработки и реализации образовательной программы при осуществлении педагогической поддержки его самоопределения и самореализации.
Индивидуальный образовательный маршрут определяется образовательными потребностями, индивидуальными особенностями и возможностями обучающегося, а также содержанием образования.
Эффективность разработки индивидуального образовательного маршрута обуславливается рядом условий:
— осознанием всеми участниками образовательного процесса необходимости и значимости индивидуального образовательного маршрута, как одного из способов самоопределения, самореализации и проверки правильности выбора направления дальнейшего обучения;
— осуществлением психолого-педагогического сопровождения и информационной поддержки процесса разработки индивидуального образовательного маршрута обучающегося;
— активным включением обучающегося в деятельность по созданию индивидуального образовательного маршрута;
— организацией рефлексии как основы коррекции индивидуального образовательного маршрута.
Цель индивидуального образовательного маршрута: создание условий для самовыражения и самореализации подростка в образовательной деятельности.
Задачи индивидуального образовательного маршрута:
— овладение глубокими знаниями, умениями и навыками в области познания химических процессов, условия их течения и продуктов химической реакции;
— развитие интереса обучающегося к освоению явлений происходящих в природе и хозяйственной деятельности человека;
— разработка и создание собственных проектов;
— осуществление образовательного процесса в соответствии с познавательными потребностями;
— способствование развитию научного мышления и глубокого понимания.
Ожидаемые результаты индивидуального образовательного маршрута:
— владеет глубокими знаниями, умениями и навыками в области химии;
— привит интерес обучающегося к освоению научных изысканий.
— разрабатывает авторские работы и создает собственные проекты;
— осуществлен образовательный процесс в соответствии с познавательными потребностями;
— развито научное мышление посредством изучения новых технологий.
Индивидуальный образовательный маршрут
Р… К… обучающейся МКОУ Венгерской СОШ
Сроки реализации — сентябрь – май 2017- 2018 г.
Возраст обучающейся — 17 лет
Представленный индивидуальный образовательный маршрут ориентирован на выявление и развитие интеллектуально-творческого потенциала обучающейся 11 класса. И в качестве «поля» для научной деятельности нами было выбрано направление работы – «природа течения химических реакций»
Цель: создание условий для самовыражения и самореализации обучающейся через познание природы течения химической реакции.
Задачи:
— познакомиться с основными процессами происходящими с веществами при химических реакциях ;
— изучение особенностей строения вещества;
— научить самостоятельно готовиться к сдаче экзамена;
— развить умение целеполагания, планирования и рефлексии собственных действий по созданию продукта химических процессов.
Ожидаемые результаты
— имеет представление об основных особенностях течения химических реакций;
— владеет практическими навыками ;
— самостоятельно готовится к сдаче экзамена;
— умеет ставить цель, планировать и осознавать собственные действия по созданию и описанию продукта реакции.
|
№ |
Тема занятий |
Количество часов |
||
|
теория |
практика |
итого |
||
|
1 |
Особенности строения веществ — Строение, свойства — Место нахождения в природе. |
2 |
1 |
3 |
|
2 |
Особенности течения химических реакций — Изучение особенностей условий течения реакций — Проведение химических реакций при различных условиях |
6,5 |
1 |
7,5 |
|
3 |
Разнообразие химических свойств — у веществ с одними и теми же атомами |
6 |
2 |
8 |
|
4 |
Химические реакции в быту — наиболее часто встречаемые — опасные химические реакции |
3 |
1 |
4 |
|
5 |
Проектная работа «Генетическая связь между классами органических и неорганических соединений» |
2 |
1 |
3 |
|
№ |
Тема |
Кол-во часов |
Методы и формы работы |
Критерии оценки |
Результат |
|
1 |
Особенности строения веществ |
3 |
Соответствие уровня теоретических знаний. Развитость практических навыков работы с материалами. Технологичность практической деятельности. |
Владение теоретическими знаниями о строении веществ. Образцы веществ |
|
|
1.1 1.2 1.3 |
Строение и свойства веществ |
0,5 |
Самостоятельная работа: изучение литературы, используя интернет-ресурсы |
||
|
Место нахождения в природе |
1,5 |
||||
|
Опыты с веществами |
1 |
Индивидуальное занятие |
|||
|
2 |
Особенности течения химических реакций |
7,5 |
|||
|
2.1 2.2 |
Изучение особенностей течения химических реакций |
1 |
Самообразование |
Соответствие уровня теоретических знаний. Качество выполнения практического задания. Осмысленность и свобода использования специальной терминологией |
Владение теоретическими знаниями об особенностях течения химических реакций |
|
Проведение химических реакций при различных условиях |
2 |
Индивидуальное занятие |
Серия работ на лабораторном оборудовании |
||
|
Химическое равновесие, условие его смещения |
2 |
Индивидуальное занятие |
|||
|
2.5 |
Демонстрация опытов |
0,5 |
Подготовка и оформление опытов |
||
|
3 |
Разнообразие химических свойств |
1 |
|||
|
3.1 |
У веществ с одними и теми же атомами |
1 |
Частично-поисковая и исследовательская работа |
Соответствие уровня теоретических знаний Творческое отношение к выполнению практической деятельности. Аккуратность, ответственность в работе |
Владение теоретическими знаниями о разнообразии химических свойств |
|
4 |
Химические реакции в быту |
4 |
|||
|
4.1 |
Наиболее часто встречаемые химические реакции |
1 |
Самостоятельная работа |
Творческое отношение к выполнению практической деятельности. Аккуратность, ответственность в работе |
|
|
4.2 |
Опасные химические реакции |
1 |
|||
|
5 |
Проектная работа «Важнейшие классы неорганических соединений» |
4,5 |
|||
|
5.4 |
Особенности химических свойств неорганических соединений |
4 |
Индивидуальное занятие |
Творческий проект на тему «Важнейшие классы неорганических соединений» |
|
|
5.6 |
Защита проекта |
0,5 |
Организационно-педагогические условия реализации программы
Формы организации образовательного процесса
Основными формами организации образовательного процесса являются:
1. Индивидуальные занятия проводятся для удовлетворения познавательного интереса с отдельным обучающимся, на которых решаются задачи повышенной трудности, которые выходят за рамки дополнительной образовательной программы, даются рекомендации по самостоятельному освоению интересующих тем.
2. Проектная деятельность способствует развитию таких качеств, как коммуникабельность, самостоятельность, предприимчивость, а так же творческих способностей. В ходе проектирования перед обучающимся всегда стоит задача представить себе внутреннюю природу строения вещества.
Требования к учебно-методическому и материально-техническому обеспечению образовательного процесса
Для реализации данного индивидуального образовательного маршрута должны быть привлечены следующие материально-технические ресурсы и средства обучения: учебный кабинет, компьютер, лабораторное оборудование химические реактивы, бумага формата А 4.
Заключение
Дополнительное образование детей, не имеющее фиксированных сроков завершения обучения и последовательно переходящее из одной стадии в другую, может в отличие от общеобразовательных учреждений, предоставить каждому ребенку возможность свободного выбора образовательной области, профиля программ, времени их освоения, включения в разнообразные виды деятельности с учетом их индивидуальных склонностей.
Особенность обучения детей в системе дополнительного образования заключается в том, что ребенок идет на занятия, исходя из своих интересов и возможностей. То, что ребенок делает с любовью, он постоянно совершенствует, реализует новые замыслы.
Индивидуально-личностная основа деятельности МКОУ Венгерской СОШ позволяет удовлетворять запросы конкретных детей и решать одну из основных задач дополнительного образования – выявление, развитие и поддержку одаренных детей.
Как показывает практика наиболее эффективный метод взаимодействия педагога с одаренным ребенком – это индивидуальные занятия с акцентом на его самостоятельную работу.
Таким образом, индивидуальный образовательный маршрут реально становится персональным путем реализации личностного потенциала обучающихся в образовании.
Рекомендации для педагога по внедрению и реализации индивидуального образовательного маршрута:
— педагог СОШ организует аудиторную и самостоятельную работу обучающегося в соответствии с индивидуальным образовательным маршрутом (ИОМ), контролирует деятельность обучающегося, диагностирует изменения, фиксирует результаты (проводит мониторинг достижений), корректирует маршрут (если требуется), создает ситуацию успеха ребенка в ходе реализации ИОМ;
— педагог СОШ организует взаимодействие с педагогами ОУ ,
— в ходе реализации ИОМ оформляет (ведет) карту сопровождения (классным руководителем и/или учителем-предметником, родителями) (приложение 1);
— обучающийся работает на занятиях по индивидуальной программе, заполняет маршрутный лист (приложение 2), создает запланированные образовательные продукты, оформляет портфолио достижений и демонстрирует их на мероприятиях (мастер-классы, конкурсы, выставки, олимпиады и т. д.) различного уровня;
— родители фиксируют изменения в ребенке, его достижения в карте сопровождения;
— классный руководитель (и/или учитель-предметник) фиксирует изменения в ребенке, его достижения в карте сопровождения и использует данные при планировании своей работы с ребенком.
Используемая литература
1. Джумагулова Т.Н., Соловьева И.В. Одаренный ребенок: дар или наказание. — СПб.: Речь; М.: Сфера, 2009
2. Кунаш М.А. Индивидуальный образовательный маршрут школьника. Методический конструктор. Модели. Анализ . – Волгоград: УЧИТЕЛЬ, 2013
3. Пахомова Н.Ю. метод учебного проекта в образовательном учреждении. – М.: АРКТИ, 2012
4. Сергеев И.С. как организовать проектную деятельность учащихся. – М.: АРКТИ, 2012
Электронные образовательные ресурсы
CD – диск. Одаренные дети. Система работы в школе. Изд. «УЧИТЕЛЬ»
http: //www.uchitel-izd.ru
Приложение 1.
Карта индивидуального сопровождения ребёнка
Наименование учреждения
-
Сведения о ребёнке
-
Ф.И.О. Р… К…
-
Дата рождения …
-
Адрес …
-
Краткая характеристика ребёнка, сильные стороны ребёнка
-
… ответственная , трудолюбивая
-
Информация для контакта с родителями
-
Мать (Ф.И.О., контактный телефон, e-mail)
…
Запрос родителей
Развитие разностороннего интереса .
-
Цель сопровождения
Развить потребность в научном подходе к изучению предмета
-
Возможные риски
Нехватка времени для изучения.
-
Ресурсы учреждений, в т.ч. кадровый ресурс (группа сопровождения и координатор)
Литература, химическая лаборатория, учитель химии.
-
Мероприятия (примерный перечень мероприятий с указанием конкретных сроков и распределением обязанностей)
-
Получение образования – 2014-2017 год
-
Психолого – педагогическая коррекционная работа:
|
Наименование мероприятия |
Сроки |
Ответственные |
Промежуточные результаты |
Оценка результатов |
Перспективные задачи развития/рекомендации |
|
Психологическая и педагогическая диагностика |
Соц. педагог |
||||
|
Скрининговые исследования |
2 раза в год |
Педагог |
|||
|
Психолого-педагогическое консультирование педагогов группы: Консультация «Организация условий для совместной деятельности» |
Педагог |
||||
|
Психолого-педагогическое просвещение родителей: Информирование о результатах диагностических исследований
|
Педагог |
||||
|
Индивидуальная работа по ИОМ |
1 раз в неделю |
Педагог |
|||
|
Обеспечение посещаемости кружка |
педагог |
||||
|
Организация участия в конкурсах различного уровня |
Раз в квартал |
Педагог |
Маршрутный лист обучающегося
ФИО Р…. К…
Руководитель Лубошников Андрей Васильевич
Ожидаемые результаты: Более глубокое понимание химических процессов, развитие интереса.
Рефлексия индивидуальной образовательной деятельности:
-
Полученные результаты _______________ соответствуют (указывается в какой степени) поставленным целям
-
Мне удалось __________________________________________________
-
Я создал (достиг, участвовал и т.п.)_______________________________
-
Я научился ___________________________________________________
-
Самооценка результатов на основании критериев
|
№ |
Полученные образовательные продукты |
Критерии оценки |
||
|
1 критерий |
2 критерий |
3 критерий |
||
В дальнейшем мне бы хотелось изучить (научиться, освоить) ______________________________________________________________________________________________________________________________________________________________________________________________________
Методическая разработка.
«Методические рекомендации по использованию индивидуальных образовательных маршрутов на уроках химии»
Тема: «Методические рекомендации по использованию индивидуальных образовательных маршрутов на уроках химии»
Карташова Любовь Александровна,
учитель первой квалификационной категории,
Почетный работник общего образования
Российской Федерации,
Муниципальное бюджетное образовательное учреждение
средняя общеобразовательная школа №24 г.Костромы
СОДЕРЖАНИЕ
-
Введение………………………………………………………………………..……..2
-
Основная часть
-
Значение организации работы учащихся по маршрутам
на уроках химии в формировании системы знаний………………………….3 -
Методика проведения уроков на основе реализации принципа личностно-ориентированного подхода в образовательном процессе………………………………………………………………………….3
-
Роль самоанализа в формировании адекватной самооценки учащимися имеющихся знаний………………………………………………………..……………….….4
-
Разнообразие форм обобщения материала как основа его эффективного закрепления………………………………………………………………….…..5
-
Средства достижения цели учителем……………………..………….…….……………………………..….5
-
Критерии эффективности проведения урока с личностно ориентированной направленностью……………………………………………………..………….…6
-
-
Заключение………………………………………………………………………….6
-
Приложения
-
Индивидуальный образовательный маршрут на уроке химии по теме «Серная кислота», 9 класс. Приложение №1……………………………………..………………………………………..7
-
Индивидуальный образовательный маршрут на уроке химии по теме «Строение, классификация и изомерия спиртов», 10 класс. Приложение №2………………………………………………………………………..….…11
-
Маршрутные листы для учащихся. Приложение №3………………….……………………………………………………….…..14
-
Список используемой литературы………………………………………………………………….………18
ВВЕДЕНИЕ.
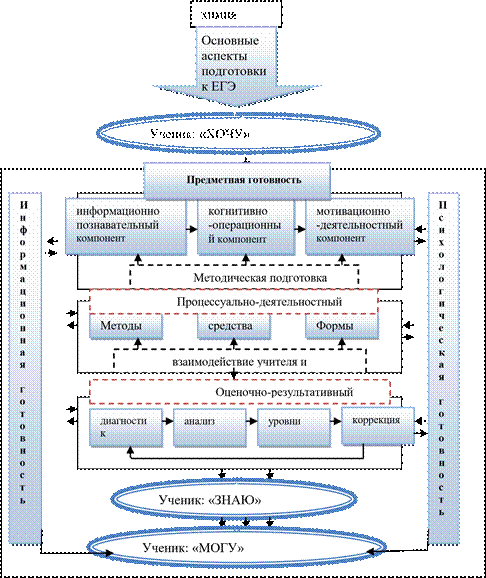
Традиции в образовании, наверное, самые устойчивые. Урок строится по привычному плану: оргначало, опрос, новый материал, закрепление. Есть в педагогике понятие «нетрадиционный урок», но это совсем не значит, что на таком уроке меняется что-либо существенно: вносятся изменения в содержание знаний, меняется отношение к ним учеников, устанавливаются новые взаимоотношения между учителем и учениками. На самом деле без обращения к необычному на уроке по существу, а не по форме, мы готовим не активную и творческую личность, а пассивного и инфантильного потребителя, привыкающего в процессе такого обучения к тому, что учителя обязаны давать ему знания, развлекая, увеселяя, приплясывая у доски. В реальной жизни всего придется добиваться самому. Изменившееся качество жизни требует от выпускника не столько умений выполнять указания, сколько решать проблемы самостоятельно.
Организация учителем индивидуальной деятельности школьников в условиях массовости обучения в образовательных учреждениях и отсутствии в стандартных программах дифференциации подхода к ребёнку как индивидууму со своими склонностями, интересами и способностями обеспечивает сведение к минимуму негативных последствий общепринятой формы реализации учебно-воспитательного процесса. Подобные изменения в построении занятий способствуют реализации принципа личностно-ориентированного подхода и обеспечивают формирование познавательного интереса у учащихся, стимулирует стремление школьников к самосовершенствованию и самопознанию, что в настоящее время является исключительно актуальным. Такие «необычные» уроки привлекают не только формой, но и возможностью для учеников участвовать в его содержании. Наиболее эффективное средство соединения знаний учителя с ценностным содержанием сознания ученика – это включение его в совместную деятельность и по созданию урока, и по его проведению.
Одним из вариантов такой деятельности является создание системы работы по использованию индивидуальных образовательных маршрутов учащихся. Применение на уроках химии маршрутных листов позволяет значительно повысить эффективность усвоения учебного материала, его запоминания и, что не менее важно, научить школьников использовать полученные знания и умения в новых ситуациях, развивать их творческий потенциал.
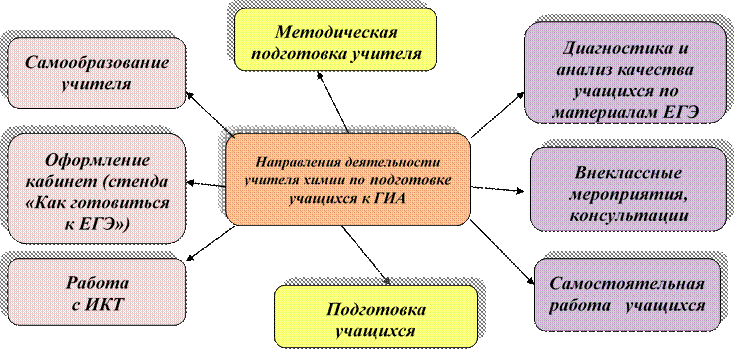
Цель настоящей методической разработки показать возможности использования индивидуальных маршрутов на занятиях разного типа: изучения нового материала, повторительно-обобщающих, контрольно-зачётных на уроках химии в 9 – 11 классах.
В основной части отслеживаются основные моменты, затрагивающие вопросы организации и методики проведения уроков с использованием индивидуальных маршрутов, средства достижения цели учителем, критерии проведения урока с личностно ориентированной направленностью, значение самоанализа в закреплении усвоенного материала и проблемы применения различных форм обобщения на уроках разного типа.
Значение организации работы учащихся по маршрутам
на уроках химии в формировании системы знаний
Химия как предмет школьного цикла наук воспринимается большинством учащихся серьезно и адекватно. Его считают не простым и требующим больших усилий к изучению, практически значимым. Необходимо отметить, что знание химии в современном мире является насущной необходимостью.
Основная задача учителя – сформировать познавательный интерес у учащихся к изучению химической дисциплины. Решить эту задачу возможно только в том случае, если знания школьников организованы, систематизированы и представляют собой единый понятийный комплекс.
Индивидуально-личностный подход позволяет учитывать специфические особенности и возможности ребёнка при изучении различных разделов школьной программы и работа по маршрутам значительно облегчает решение учителем проблемы по реализации этого подхода на практике.
Работа с маршрутными листами позволяет учащимся самостоятельно выделять, вычленять важнейшие элементы в содержании изучаемого материала и рассматривать его, используя заданную учителем структуру, в той последовательности, которая обеспечивает максимально эффективное запоминание и последующее воспроизведение.
Методика проведения уроков на основе реализации принципа личностно-ориентированного подхода в образовательном процессе
Принцип индивидуально-личностного подхода предусматривает организацию индивидуального обучения, учёта личных особенностей и склонностей ученика в условиях массовости учебно-воспитательного процесса.
Методика предполагает предварительное ознакомление учащихся с её особенностями. Это осуществляется в форме собеседования и выполнения пробного задания.
На первом этапе задача учителя состоит в проектировании нескольких альтернативных маршрутов, каждый из которых обеспечивает решение всего комплекса образовательных задач урока. Определение образовательных маршрутов осуществляется педагогом исходя из особенностей учащихся класса, содержания учебного материала и типа урока. Тем не менее, в любом маршруте должны быть представлены задания всех трех уровней сложности – репродуктивного, конструктивного и творческого. Каждый маршрут должен задавать четкий алгоритм деятельности учащегося на уроке от постановки задачи до презентации конечного продукта и рефлексии. Результатом деятельности учителя на данном этапе являются маршрутные листы, включающие формулировку темы урока, цели и задачи, совокупность заданий, представленную в определенной логике и обеспечивающую достижение результата.
Второй этап – этап создания организационных условий для самостоятельного выбора учащимися маршрутов деятельности на уроке. Задачей учителя на данном этапе будет – обеспечить выбор каждым учащимся собственной траектории образовательной деятельности, учитывающей не только его интересы, но и учебные возможности. Результатом на данном этапе будет оформление рабочих групп учащихся, пар, объединенных общим маршрутом или индивидуальный выбор.
Третий этап характеризуется преобладанием самостоятельной деятельности учеников по выполнению выбранных заданий. Основной задачей учителя на данном этапе урока является консультирование и поддержка учащихся в процессе учебной деятельности. Учитель реализует такие роли, как: консультант, помощник, наставник, партнер.
На четвертом этапе презентации продуктов деятельности учащихся главная функция учителя состоит в стимулировании мыслительной деятельности учеников по обобщению результатов работы. Это может осуществляться в форме проблемных вопросов, выявления противоречий, приведения спорных фактов и т. п.
На завершающем этапе важной задачей для учителя будет организация рефлексии. Выбор приемов организации рефлексивной деятельности учащихся будет зависеть от форм организации образовательного процесса на уроке, особенностей учащихся. Рефлексия должна осуществляться как на групповом уровне (класс и рабочая группа), так и на индивидуальном.
Применение в собственной педагогической практике организации уроков на основе индивидуальных маршрутов позволяет обнаружить ряд преимуществ данной методики перед традиционным уроком:
-
обеспечивает дифференциацию учебно-воспитательного процесса;
-
содействует реализации личностно-ориентированного подхода к образованию;
-
стимулирует познавательную активность учащихся и их интерес к предмету;
-
позволяет реализовать деятельностный подход к образованию;
-
способствует развитию конструктивных умений и творческих способностей учащихся.
В то же время, опыт использования индивидуальных маршрутов на уроке показывает, что главным недостатком предлагаемой методики является ее затратность как с точки зрения времени подготовки учителя, так и с точки зрения материального обеспечения. Однако, указанные недостатки не умаляют достоинств организации образовательной деятельности на основе индивидуальных маршрутов.
Примером использования маршрутных листов является урок химии в
9 классе по изучению новой темы «Серная кислота» (см. Приложение). После осуществления организационного этапа и этапа подготовки к восприятию нового материала, постановки проблемы, реализуются задачи этапа усвоения новых знаний учащимися, на котором они осуществляют выбор индивидуального образовательного маршрута по цели и задачам урока, учитель направляет работу учащихся. Выбор маршрута происходит сообразно оценке своих возможностей и учёта предпочитаемой формы представления результатов. На данном уроке это четыре блока заданий или маршрута, которые включают как теоретические вопросы, так и выполнение лабораторного эксперимента. Учитель консультирует учащихся по отдельным моментам и особенностям прохождения индивидуального маршрута, но при этом стремится избежать прямого указания на решение возникшей проблемы, предоставляя возможность школьнику искать пути её решения. Обязательным этапом работы является самооценка учеником результатов и коллективное обсуждение проблемной ситуации обозначенной педагогом, а в классах с высоким уровнем подготовки – выявленной самостоятельно.
При обобщении материала, обсуждении результатов урока и степени решения поставленных задач, учащиеся осознанно и целенаправленно систематизируют свои знания по изучаемой теме, что повышает качество образовательного процесса.
Роль самоанализа в формировании адекватной самооценки учащимися имеющихся знаний
Одним из важнейших этапов урока, в первую очередь в 9 — 11 классах, способствующего решению задачи формирования познавательного интереса, является самоанализ. Организация учащимися самопроверки способствует снижению уровня тревожности, так как результаты не влияют на оценку и поэтому полученные данные позволяют ребёнку и учителю более объективно оценить качество обучения. Адекватная самооценка учащимися своих возможностей, знаний помогает им акцентировать свои усилия на тех моментах, которые требуют дополнительного внимания. Это позволяет педагогу точнее планировать учебный процесс, учитывать особенности каждого ученика.
Завышенная, так же как и заниженная, самооценка школьника препятствует обучению, так как в первом случае ученик не считает нужным пополнять запас знаний («я и так всё знаю»), во втором – считает, что у него всё равно ничего не получится, у него нет «особых» способностей к этому предмету. В связи с этим учителю следует стремиться к тому, чтобы ученик адекватно оценивал себя, и работа на индивидуальных маршрутах этому способствует.
Разнообразие форм обобщения материала как основа его эффективного закрепления
Использование на занятии маршрутных листов позволяет применять различные формы изучения и обобщения материала. Во-первых, анализ проблемных ситуаций, связанных с ними противоречий, поиск объяснений и возможных причин возникновения той или иной проблемы. Эти проблемные вопросы на индивидуальных маршрутах по своему содержанию и характеру зависят от особенностей данного маршрута, в качестве примера можно привести материал урока в 9 классе по теме «Серная кислота» [см. Приложение], где на маршруте № 2 ставится вопрос: «Какие химические свойства серной кислоты являются общими с другими кислотами?», и ответ на него можно дать лишь при условии выполнения всех заданий маршрута и проведения опытов, написания уравнений химических реакций. Во-вторых, особое место отводится химическому эксперименту, который позволяет более эффективно реализовывать поставленные задачи, где создание учащимися отчёта по маршруту существенно облегчало процесс закрепления и обобщения учебной информации, а также стимулировало интерес у детей к выполнению поставленного задания. И, наконец, третья форма, которая использовалась на занятиях – это совместное обсуждение в группах результатов работы на индивидуальных маршрутах с последующим представлением доклада от группы на обсуждение класса (подобная форма позволяет отследить основные трудности в восприятии отдельных блоков учебного материала, а совместное обсуждение помогает яснее сформулировать общую идею, результат учебной деятельности).
Средства достижения цели учителем
-
Использование разнообразных форм и методов организации учебной деятельности, позволяющих раскрыть субъектный опыт учащихся.
-
Создание атмосферы заинтересованности каждого ученика в работе класса.
-
Стимулирование учащихся к высказываниям, использование различных способов выполнения заданий без боязни ошибиться, получить не правильный ответ.
-
Использование в ходе уроков дидактического материала, позволяющего ученику выбирать наиболее значимые для него вид и форму учебного содержания.
-
Оценка деятельности ученика не только по конечному результату (правильно-неправильно), но и по процессу его достижения.
-
Поощрение стремления находить свой способ работы (решения задач); анализировать способы работы других учеников в ходе урока, выбирать и осваивать наиболее рациональные.
-
Создание педагогических ситуаций общения на уроке, позволяющих каждому ученику проявлять инициативу, самостоятельность, избирательность в способах работы; создание обстановки для естественного самовыражения ученика.
Критерии эффективности проведения урока с личностно ориентированной направленностью
-
Наличие у учителя учебного плана проведения уроков в зависимости от готовности класса.
-
Использование проблемных творческих заданий, дифференциация их в маршруте учащегося по уровням.
-
Применение заданий, позволяющих ученику самому выбирать тип, вид и форму материала (словесную, графическую, условно-символическую, экспериментальную).
-
Создание положительного, эмоционального настроя на работу всех учеников в ходе урока.
-
Сообщение в начале урока не только темы, но и организации учебной деятельности в ходе урока.
-
Обсуждение с детьми в конце урока не только того, «что мы узнали» (чем овладели), но и того что понравилось (не понравилось) и почему; что бы хотелось выполнить еще раз, а что сделать по-другому.
-
Стимулирование учеников к выбору и самостоятельному использованию разных способов выполнения заданий.
-
Оценка (поощрение) при опросе на уроке не только правильного ответа ученика, но и анализ того, как ученик рассуждал, какой способ использовал, почему и в чем ошибся.
-
Отметка, выставляемая ученику в конце урока, должна аргументироваться по ряду параметров: правильности, самостоятельности, оригинальности.
-
При задании на дом называется не только тема и объем задания, но подробно разъясняется, как следует рационально организовать свою учебную работу при выполнении домашнего задания.
Заключение
Обобщая результаты по внедрению в образовательный процесс работы по индивидуальным маршрутам можно отметить следующие:
-
Использование маршрутных листов на уроках химии значительно повышает качество учебного процесса, позволяет более эффективно использовать учебное время.
-
Применение данной технологии способствует повышению интереса учащихся к химии.
-
Материалы разработки были представлены на областном семинаре директоров (октябрь 2006 года), где получили положительную оценку коллег.
-
В настоящее время продолжается работа по совершенствованию этого метода с целью предложения к внедрению его в другие образовательные дисциплины.
ПРИЛОЖЕНИЯ
Приложение №1
Индивидуальный образовательный маршрут на уроке химии.
Тема урока: «Серная кислота»
Класс: 9
Курс: неорганическая химия
Место урока в курсе: изучение нового материала
Цель: изучить серную кислоту.
Задачи:
-
Изучить строение молекулы и физические свойства серной кислоты.
-
Систематизировать знания об общих свойствах кислот, на примере H2SO4.
-
Рассмотреть качественную реакцию на сульфат – ион.
-
Изучить окислительно-восстановительные реакции серной кислоты, специфические свойства концентрированной H2SO4.
Форма урока: организация по индивидуальным образовательным маршрутам.
Главным методом обучения является организация исследовательской и познавательной деятельности учащихся.
Предлагаемые маршруты:
Маршрут 1. «Строение молекулы и физические свойства серной кислоты ».
-
Составьте молекулярную и структурную формулы серной кислоты.
-
В какой степени окисления находится сера? Какие свойства будет проявлять H2SO4 в химических реакциях?
Маршрут 2. «Общие с другими кислотами свойства H2SO4 ».
-
Какие химические свойства H2SO4 являются общими с другими кислотами?
-
Существует ли отличие во взаимодействии H2SO4 (концентрированной) с солями сильных, но летучих кислот?
Маршрут 3. « Соли серной кислоты».
-
Какие 2 ряда солей образует H2SO4, как двухосновная кислота?
-
Какой ион является реактивом на сульфат – ион?
Маршрут 4. «Окислительно-восстановительные свойства H2SO4. Специфические реакции концентрированной серной кислоты».
-
В чем отличие во взаимодействии с металлами концентрированной и разбавленной серной кислоты?
-
Какие специфические свойства проявляет концентрированная серная кислота?
Продукт урока: оформление маршрутных листов, проведение химического эксперимента
Ход урока.
Проблема: серная кислота является неорганической.
Можно ли сказать, что H2SO4 имеет одни и те же свойства, общие с другими кислотами?
|
Этапы |
Деятельность ученика |
Деятельность учителя |
Время |
|
1. Организационный |
Самопроверка |
1.Проверяет готовность к занятию. 2.Организует внимание школьников. |
1 мин. |
|
2. Подготовка к |
Осмысление проблемы, выявление противоречий. |
1.Сообщает тему, 2.Информирует об |
1 мин. |
|
3. Усвоение новых знаний |
1. Выбор маршрута, разделение на группы. 2. Работа групп по избранному маршруту. 3. Создание собственного образовательного продукта – подготовка отчёта. |
1.Знакомит с общими требованиями по выполнению заданий индивидуальных маршрутов, инструктирует о порядке их выполнения. 2.Знакомит с 3.Проводит консультирование по выполнению заданий на индивидуальных маршрутах. 4.Реализует личностно-ориентированный подход через оказание индивидуальной помощи ученикам. |
15 мин. |
|
4. Первичная проверка понимания нового материала |
Обсуждение результатов работы в группе (доклад представителя от группы о проделанной работе). |
Участвует в коллективном обсуждении отчета группы. |
10 мин. |
|
5. Обобщение и |
1. Изучение, анализ поставленного проблемного вопроса, поиск ответа. 2. Обсуждение результатов. |
1. В завершении отчетов групп проводит фронтальную беседу по проблеме, поставленной в начале урока. 2.Участвует в коллективном обсуждении проблемы. |
5 мин. |
|
6. Контроль усвоения нового материала |
1. Выполняют задания по листу индивидуальной работы. 2. Продолжение создания собственного образовательного продукта – отчёта. |
1. Информирует о порядке работы с листом индивидуальных заданий и форме представления отчёта. 2.Проводит консультирование по выполнению заданий на индивидуальных маршрутах. 3.Осуществляет контроль результатов деятельности учащихся. |
10 мин. |
|
7. Рефлексия |
Ответ на основную проблему урока |
1.Проводит консультирование учащихся по выполнению задания. 2. Заслушивает отчет части учащихся по выполненному заданию. |
|
|
8. Подведение итогов урока |
Совместное обсуждение результатов урока и степени решения поставленных учебных задач. |
1. Совместно с учащимися обсуждает результаты урока и достижения поставленной цели. 2. Инструктирует о выполнении домашнего задания. |
3 мин. |
План – действий для работы по индивидуальному маршруту.
-
Прочитать название маршрута.
-
Изучить задачи, поставленные перед вами.
-
Выполнить уровневые задания.
-
Оформить маршрутный лист.
-
Рассказать о выполненной работе классу.
-
Сделать вывод по поставленной перед вами задаче.
Перечень заданий для решения проблемы, сформулированной в маршруте 1.
Уровень А.
-
Запишите молекулярную и структурную формулы серной кислоты, расставьте степени окисления элементов.
-
В какой степени окисления находится сера?
-
Какие свойства будет проявлять серная кислота в химических реакциях?
Уровень В.
-
Какие степени окисления могут быть у серы в соединениях: H2S, S, SO2, SO3, H2SO4?
-
Допишите предложения:
-
Элементы, находящиеся в низшей степени окисления, могут только … электроны, т.е. быть …
-
Элементы, находящиеся в промежуточной С.О., могут и …, и … электроны, т.е. быть и …, и …
-
Элементы, находящиеся в высшей С.О., могут только … электроны, т.е. быть …
Уровень С.
-
Запишите физические свойства H2SO4.
-
Каковы правила разбавления серной кислоты? Помните, что ρ (H2O) – 1 г/мл, а ρ (H2SO4) – 1,8 г/мл.
-
При растворении H2SO4 образуются гидраты разного состава. Напишите их формулы.
Перечень заданий для решения проблемы, сформулированной в маршруте 2.
Уровень А.
Допишите молекулярные, составьте к ним полные и краткие ионные уравнения:
-
H2SO4 =
-
CuO + H2SO4 =
-
Cu(OH)2 + H2SO4 =
-
Na2CO3 + H2SO4 =
Уровень В.
На основании эксперимента (см. карточку для проведения опытов), составьте молекулярные, ионные полные и краткие уравнения химических реакций.
Уровень С.
Серная кислота вытесняет и сильные, но летучие кислоты из их солей. Допишите уравнения химических реакций:
-
NaNO3 + H2SO4 (конц). =
-
NaCl + H2SO4 (конц). =
Перечень заданий для решения проблемы, сформулированной в маршруте 3.
Уровень А.
Допишите молекулярные, составьте к ним полные и краткие ионные уравнения:
-
BaCl2 + H2SO4=
-
BaCl2 + Na2SO4 =
-
BaCl2 + ZnSO4 =
Уровень В.
На основании эксперимента (см. карточку для проведения опытов), составьте молекулярные, ионные полные и краткие уравнения химических реакций.
Уровень С.
Приведите примеры солей, образованных H2SO4 . Сделайте вывод: какой ион является реактивом на соли серной кислоты?
Перечень заданий для решения проблемы, сформулированной в маршруте 4.
Уровень А.
Допишите уравнения химических реакций, разберите их как О.В.Р.
-
Al + H2SO4 (разб) =
-
Zn + H2SO4 (разб) =
-
Cu + H2SO4 (конц) =
Уровень В.
На основании эксперимента (см. карточку для проведения опытов), составьте уравнения ОВ реакций взаимодействия разбавленной серной кислоты с металлами.
Уровень С.
На основании опыта, составьте уравнение ОВ реакции взаимодействия концентрированной серной кислоты с медью. Объясните результаты испытаний.
На основании опытов (обугливание сахара и лучинки), сделайте вывод о специфических свойствах концентрированной серной кислоты.
Индивидуальный образовательный маршрут на уроке химии.
Приложение №2
-
Тема: «Строение, классификация и изомерия спиртов»
Класс: 10
Курс: органическая химия
Место урока в курсе: изучение нового материала
Цель: рассмотреть классификацию спиртов и на ее основе изучить гомологические ряды спиртов, номенклатуру, изомерию, строение и физические свойства
Ход урока:
-
Организационный момент
-
Изучение нового материала
Кроме углерода и водорода в состав многих органических соединений могут входить атомы кислорода, серы, фосфора, азота. Эти элементы называют органогенами (рождающие органические вещества).
Понятно, что если соединение включает кроме углерода и водорода – кислород, его называют кислородосодержащим.
Простейшими представителями являются спирты.
-
История знакомства с этим классом давняя (презентация)
-
Рассмотрим схему «Классификация спиртов» (презентация)
-
Какая функциональная группа атомов присутствует во всех формулах?
-
С чем она соединена?
-
Радикалы, каких углеводородов вы видите в формулах?
-
Количество гидроксильных групп?
-
Какие атомы углерода называют первичными, вторичными и третичными?
-
Назовите виды номенклатуры, которые приведены в таблице?
-
Как осуществляется название спиртов по систематической номенклатуре?
Вывод: родоначальником спиртов являются предельные одноатомные, поэтому при дальнейшем изучении темы приоритет остается за ними.
-
Самостоятельная деятельность. Строение, классификация и изомерия спиртов.
Все спирты являются кислородосодержащими органическими веществами.
Можно ли сказать, что все кислородосодержащие органические соединения – спирты?
Маршрут 1. Строение спиртов.
Составьте гомологический ряд предельных одноатомных спиртов и выведите их общую формулу. ___________ при нормальных условиях – газообразные вещества, а ______________________ — жидкости? Обоснуйте зависимость растворимости спирта от его молекулярной массы и строения.
Маршрут 2. Классификация спиртов.
Какие признаки легли в основу классификации спиртов? Можем ли мы считать спиртами соединения, в которых одна или несколько гидроксильных групп соединены с бензольным кольцом?
Маршрут 3. Многообразие спиртов.
Каковы причины многообразия органических соединений. Каким образом многообразие спиртов зависит от этих причин? *Почему разные спирты с различной скоростью вступают в химическую реакцию с металлическим натрием?
Перечень заданий для решения проблемы, сформулированной в Маршруте 1.
УРОВЕНЬ А
-
Запишите сокращенные формулы первых 6 представителей гомологического ряда предельных одноатомных спиртов.
______
______
______
-
Назовите вещества по систематической и тривиальной номенклатурам.
-
Создайте шаростержневые модели молекул спиртов, формулы которых были составлены.
-
Дайте определение понятия «Спирты – это…»
УРОВЕНЬ В
-
Выведите общие формулы гомологического ряда предельных одноатомных спиртов
_____
_____
_____
-
Какие из предложенных формул органических соединений являются предельными одноатомными спиртами ____________________________________________________________ Ответ обоснуйте.
УРОВЕНЬ С
-
На основании эксперимента объясните зависимость растворимости спиртов от их молекулярной массы и строения. Сформулируйте выводы.
Перечень заданий для решения проблемы, сформулированной в Маршруте 2.
УРОВЕНЬ А
Предложите признаки, на основании которых можно рассмотреть классификацию спиртов. Занесите их в таблицу. Запишите формулы спиртов, иллюстрирующие первую классификацию.
УРОВЕНЬ В
Запишите примеры формул спиртов на 2 вида классификации. Назовите вещества по систематической номенклатуре.
УРОВЕНЬ С
Запишите примеры формул спиртов на все виды классификации. Назовите вещества по систематической номенклатуре. Какое из веществ является спиртом: _____________________________________________________________? Ответ обоснуйте.
|
Классификация спиртов |
||||
|
… |
… |
… |
||
|
Предельные |
Непредельные |
Ароматические |
Одноатомные — … Двухатомные — … Многоатомные – … |
Первичные — … Вторичные — … Третичные — … |
Перечень заданий для решения проблемы, сформулированной в Маршруте 3.
УРОВЕНЬ А
Составьте все возможные изомеры состава ________ . Какие виды изомерии характерны для предельных одноатомных спиртов?
УРОВЕНЬ В
Назовите вещества, формулы которых были составлены по систематической номенклатуре
УРОВЕНЬ С
Какой из спиртов более энергично взаимодействует с металлическим натрием и почему: метанол, этанол, пропанол-1, 2-метилпропанол-1, 2,2-диметилпропанол-1?
-
Подведение итогов урока.
Маршрутные листы для учащихся
Приложение №3
Тема урока: «Серная кислота»
Класс: 9
Курс: неорганическая химия
Место урока в курсе: изучение нового материала
Цель: изучить серную кислоту.
Задачи:
-
Изучить строение молекулы и физические свойства серной кислоты.
-
Систематизировать знания об общих свойствах кислот, на примере H2SO4.
-
Рассмотреть качественную реакцию на сульфат – ион.
-
Изучить окислительно-восстановительные реакции серной кислоты, специфические свойства концентрированной H2SO4.
Фамилия, имя, класс:
Маршрут№1. «Строение и физические свойства серной кислоты».
Уровень А.
-
Запишите молекулярную и структурную формулы серной кислоты, расставьте степени окисления элементов.
-
В какой степени окисления находится сера?
-
Какие свойства будет проявлять серная кислота в химических реакциях?
Уровень В.
-
Какие степени окисления могут быть у серы в соединениях: H2S, S, SO2, SO3, H2SO4?
-
Допишите предложения:
-
Элементы, находящиеся в низшей степени окисления, могут только … электроны, т.е. быть …
-
Элементы, находящиеся в промежуточной С.О., могут и …, и … электроны, т.е. быть и …, и …
-
Элементы, находящиеся в высшей С.О., могут только … электроны, т.е. быть …
Уровень С.
-
Запишите физические свойства H2SO4.
-
Каковы правила разбавления серной кислоты? Помните, что ρ (H2O) – 1 г/мл, а ρ (H2SO4) – 1,8 г/мл.
-
При растворении H2SO4 образуются гидраты разного состава. Напишите их формулы.
Маршрутные листы для учащихся
Фамилия, имя, класс:
Маршрут№2. Общие с другими кислотами свойства H2SO4
Уровень А.
Допишите молекулярные, составьте к ним полные и краткие ионные уравнения:
-
H2SO4 =
-
CuO + H2SO4 =
-
Cu(OH)2 + H2SO4 =
-
Na2CO3 + H2SO4 =
Уровень В.
На основании эксперимента (см. карточку для проведения опытов), составьте молекулярные, ионные полные и краткие уравнения химических реакций.
Уровень С.
Серная кислота вытесняет и сильные, но летучие кислоты из их солей. Допишите уравнения химических реакций:
-
NaNO3 + H2SO4 (конц). =
-
NaCl + H2SO4 (конц). =
Инструктивная карточка для проведения лабораторных опытов.
Заполните таблицу к уровню В
|
№ опыта, ход опыта |
Наблюдения |
Уравнения хим. реакций |
Вывод |
|
1. В 2 пробирки прилейте по 1мл р-ра H2SO4, в первую пробирку по каплям прилейте лакмус, во вторую – м/о. |
|||
|
2. В пробирку насыпьте немного оксида меди (11), прилейте 1мл H2SO4 , осторожно, нагрейте. |
|||
|
3. В пробирку прилейте 1 мл СuSO4, по каплям добавьте NaOH, затем H2SO4 |
|||
|
4. В пробирку прилейте 1мл Na2CO3, осторожно, по каплям добавьте H2SO4 |
Помните о правилах по ТБ при работе с кислотами и щелочами!
Маршрутные листы для учащихся
Фамилия, имя, класс:
Маршрут №3. «Соли серной кислоты».
Уровень А.
Допишите молекулярные, составьте к ним полные и краткие ионные уравнения:
-
BaCl2 + H2SO4=
-
BaCl2 + Na2SO4 =
-
BaCl2 + ZnSO4 =
Уровень В.
На основании эксперимента (см. карточку для проведения опытов), составьте молекулярные, ионные полные и краткие уравнения химических реакций.
Уровень С.
Приведите примеры солей, образованных H2SO4. Сделайте вывод: какой ион является реактивом на соли серной кислоты?
Инструктивная карточка для проведения лабораторных опытов.
Проведите реакции, заполните таблицу.
|
№ опыта, ход опыта |
Наблюдения |
Уравнения хим. реакций |
Вывод |
|
1. В пробирку прилейте 1мл BaCl2, по каплям добавьте р-р H2SO4 |
|||
|
2. В пробирку прилейте 1мл Na2SO4, по каплям добавьте BaCl2 |
|||
|
3. В пробирку прилейте 1мл ZnSO4, добавьте BaCl2 |
Помните о правилах по ТБ при работе с кислотами и солями!
Маршрутные листы для учащихся
Фамилия, имя, класс:
Маршрут №4. « Окислительно-восстановительные свойства H2SO4 Специфические реакции концентрированной серной кислоты ».
Уровень А.
Допишите уравнения химических реакций, разберите их как О.В.Р.
-
Al + H2SO4 (разб) =
-
Zn + H2SO4 (разб) =
-
Cu + H2SO4 (конц) =
Уровень В.
На основании эксперимента (см. карточку для проведения опытов), составьте уравнения ОВ реакций взаимодействия разбавленной серной кислоты с металлами.
Уровень С.
На основании опыта, составьте уравнение ОВ реакции взаимодействия концентрированной серной кислоты с медью. Объясните результаты испытаний.
На основании опытов (обугливание сахара и лучинки), сделайте вывод о специфических свойствах концентрированной серной кислоты.
Инструктивная карточка для проведения лабораторных опытов.
Проведите реакции, заполните таблицу.
|
№ опыта, ход опыта |
Наблюдения |
Уравнения хим. реакций |
Вывод |
|
1. В сухую пробирку поместите 1 – 2 гранулы цинка, прилейте 1 мл раствора серной кислоты |
|||
|
2. В сухую пробирку поместите гранулу алюминия, прилейте 1мл раствора серной кислоты, осторожно, нагрейте. |
Помните о правилах по ТБ при работе с кислотами!
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
-
Альтернативные педагогические технологии Г.К. Селевко.
-
Методические семинары И.Г. Норенко.
-
Педагогические советы Л.А. Вагина.
-
Школа педагогического мастерства И.С. Белова.
-
Проектирование учебного занятия Т.А. Сергеева.
-
Технология оформления педагогического опыта Н.М. Уварова.
-
Педагогика. Современная технология учебного занятия Н.А. Морева.
-
Интернет-ресурсы.
21
Полный курс подготовки к ЕГЭ по химии-2023. Здесь приведена теория по каждому заданию в соответствии с спецификацией и кодификатором ЕГЭ по химии. Учебные материалы и теория, необходимые для подготовки к ЕГЭ по химии.
Вы можете поддержать работу сайта, разработку новых материалов и тестов. Донаты принимаются через форму:
Обратите внимание! Форма выше — это не оплата курса по химии, это форма для сбора донатов на работу сайта)
Кодификатор ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| |
1.1. | Современные представления о строении атома |
| 1.1.1. | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
|
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1. | Закономерности изменения свойств элементов и их соединений по периодам и группам
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами) |
|
| 1.2.2. | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3. | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | |
| 1.2.4. | Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | |
| 1.3. | Химическая связь и строение вещества |
|
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.3.2. | Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| 1.3.3. | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. | Химическая реакция | |
| 1.4.1. | Классификация химических реакций в неорганической и органической химии
Тренировочные тесты в формате ЕГЭ по теме «Классификация реакций» ( с ответами) |
|
| 1.4.2. | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3. | Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» ( с ответами) |
|
| 1.4.4. | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» ( с ответами) |
|
| 1.4.5. |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | |
| 1.4.6. | Реакции ионного обмена | |
| 1.4.7. |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (с ответами) |
|
| 1.4.8. |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 19 ЕГЭ по химии) ( с ответами) |
|
| 1.4.9. |
Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами) |
|
| 1.4.10. |
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1. | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2.2. | Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | |
| 2.3. | Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 2.4. | Характерные химические свойства оксидов: основных, амфотерных, кислотных | |
| 2.5. | Характерные химические свойства оснований и амфотерных гидроксидов | |
| 2.6. | Характерные химические свойства кислот | |
| 2.7. | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | |
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1. | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тренировочные тесты в формате ЕГЭ по теме «Теория строения орг. соединений» ( с ответами) |
|
| 3.2. | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3. | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация орг. соединений» ( с ответами) |
|
| 3.4. | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | |
| 3.5. | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6. | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | |
| 3.7. | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Тренировочные тесты в формате ЕГЭ по теме «Свойства азотсодержащих соединений» ( с ответами) |
|
| 3.8. | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | |
| 3.9. | Взаимосвязь органических соединений | |
| 4. | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1. | Экспериментальные основы химии | |
| 4.1.1. | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2. | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | |
| 4.1.3. | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4. | Качественные реакции на неорганические вещества и ионы | |
| 4.1.5. | Качественные реакции органических соединений | |
| 4.1.6. | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | |
| 4.1.7. | Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов | |
| 4.1.8. | Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот | |
| 4.2.1. | Понятие о металлургии: общие способы получения металлов | |
| 4.2.2. | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | |
| 4.2.3. | Природные источники углеводородов, их переработка | |
| 4.2.4. | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | |
| 4.3. | Расчеты по химическим формулам и уравнениям реакций | |
| 4.3.1. | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2. | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3. | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4. | Расчеты теплового эффекта реакции | |
| 4.3.5. | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | |
| 4.3.6. | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества | |
| 4.3.7. | Установление молекулярной и структурной формулы вещества | |
| 4.3.8. | Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9. | Расчеты массовой доли (массы) химического соединения в смеси |
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами)
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.3. Химическая связь и строение вещества
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами)
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами)
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.4. Химическая реакция
1.4.1. Классификация химических реакций в неорганической и органической химии
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения
1.4.3. Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» (задание 20 ЕГЭ по химии) ( с ответами)
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
1.4.6. Реакции ионного обмена
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 21 ЕГЭ по химии) ( с ответами)
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 22 ЕГЭ по химии) ( с ответами)
1.4.10. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
2.8. Взаимосвязь различных классов неорганических веществ
3. ОРГАНИЧЕСКАЯ ХИМИЯ
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
3.6. Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
3.8. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
3.9. Взаимосвязь органических соединений
4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1. Экспериментальные основы химии
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
4.1.4. Качественные реакции на неорганические вещества и ионы
4.1.5. Качественные реакции органических соединений
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
4.1.7. Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов
4.1.8. Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот
4.2.1. Понятие о металлургии: общие способы получения металлов
4.2.2. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
4.2.3. Природные источники углеводородов, их переработка
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
4.3. Расчеты по химическим формулам и уравнениям реакций
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе»
4.3.2. Расчеты объемных отношений газов при химических реакциях
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
4.3.4. Расчеты теплового эффекта реакции
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
4.3.7. Установление молекулярной и структурной формулы вещества
4.3.8. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчеты массовой доли (массы) химического соединения в смеси
Курс подготовки к ЕГЭ или ОГЭ (ГИА) по химии:
Общая химия
Часть 1. Строение вещества
1. Строение атома. Электронные формулы атомов
2. Периодический закон
3. Строение молекул. Типы химических связей. Основные характеристики ковалентной связи. Межмолекулярные связи
4. Строение вещества (кристаллические решетки). Основные физические свойства различных кристаллов
5. Степень окисления и валентность химических элементов.
Часть 2. Основы неорганической химии
1. Классификация неорганических веществ
2. Номенклатура неорганических веществ
3. Способы получения оксидов
4. Химические свойства основных оксидов
5. Химические свойства кислотных оксидов
6. Химические свойства амфотерных оксидов
7. Химические свойства и способы получения кислот
8. Химические свойства и способы получения солей
9. Химические свойства и способы получения оснований
10. Взаимосвязь основных классов неорганических веществ
11. Бинарные соединения — гидриды.
12. Реакции разложения в неорганической химии
Часть 3. Физико-химия растворов:
1. Понятие о растворах, растворимость
2. Теория электролитической диссоциации
3. Реакции ионного обмена
4. Гидролиз.
Часть 4. Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции.
2. Электролиз солей. Электролиз солей карбоновых кислот. Коррозия.
Часть 5. Особенности работы в лаборатории
Часть 6. Химические реакции. Закономерности их протекания
1. Классификация химических реакций.
2. Кинетика (скорость) химических реакций и ее зависимость от разных факторов.
3. Термодинамика химических реакций: химическое равновесие и его смещение.
Органическая химия
1. Теория строения органических веществ. Классификация органических веществ. Гомологи и изомеры. Виды изомерии.
2. Алканы: химические и физические свойства, строение, получение, изомерия.
3. Алкены: химические и физические свойства, строение, получение, изомерия.
4. Алкины: химические и физические свойства, строение, получение, изомерия.
5. Алкадиены: химические и физические свойства, строение, получение, изомерия.
6. Арены: химические и физические свойства, строение, получение, изомерия.
7. Циклоалканы: химические и физические свойства, строение, получение, изомерия.
8. Спирты: химические и физические свойства, строение, изомерия и способы получения. Фенолы: химические свойства, способы получения, строение и изомерия.
9. Альдегиды и кетоны: химические и физические свойства, строение и изомерия, получение.
10. Карбоновые кислоты: химические и физические свойства, строение, номенклатура и изомерия, способы получения.
11. Сложные эфиры: химические и физические свойства, строение, получение, изомерия.
12. Жиры: химические и физические свойства, строение, получение.
13. Углеводы: химические и физические свойства, строение, получение.
14. Амины: химические и физические свойства, строение, получение, изомерия.
15. Аминокислоты: химические и физические свойства, строение, получение, изомерия.
16. Белки: химические и физические свойства, строение и получение.
17. Взаимосвязь разных классов органических веществ.
18. Качественные реакции в органической химии.
Характерные реакции в органической химии:
Реакция Дюма Электролиз солей карбоновых кислот Пиролиз метана Реакция Вагнера
Химия элементов
Часть 1. Химия щелочных металлов и их соединений. Пероксиды щелочных металлов. Гидроксиды щелочных металлов.
Часть 2. Химия щелочноземельных металлов. Оксиды щелочноземельных металлов. Гидроксиды щелочноземельных металлов.
Часть 3. Химия алюминия и его соединений. Оксид алюминия. Гидроксид алюминия. Соли алюминия.
Часть 4. Химия углерода. Оксид углерода (II) и оксид углерода (IV). Угольная кислота и ее соли (карбонаты и гидрокарбонаты).
Часть 5. Химия кремния. Оксид кремния (IV). Кремниевая кислота. Силан. Силикаты.
Часть 6. Химия азота и его соединений. Оксиды азота. Аммиак. Нитриды. Азотная кислота и азотистая кислота. Нитраты.
Часть 7. Химия фосфора и его соединений. Фосфин. Фосфиды металлов. Оксиды фосфора III и V. Фосфорные кислоты и их соли (фосфаты, гидрофосфаты и дигидрофосфаты, пирофосфаты и метафосфаты). Фосфористая кислота.
Часть 8. Химия кислорода и его соединений.
Часть 9. Химия серы и ее соединений. Сероводород и сульфиды. Оксиды серы – сернистый газ и серный ангидрид. Серная кислота и ее свойства. Сернистая кислота. Особенности химии сульфатов и сульфитов.
Часть 10. Химия галогенов и их соединений.
Часть 11. Химия d-элементов: железа, хрома, цинка, меди.
Часть 12. Химия водорода и его соединений.
Задачи: базовый блок
1. Атомно -молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Диагностические и тренировочные работы
Все реальные варианты КИМ ЕГЭ по химии
Тренировочная работа по химии в формате ЕГЭ 26 октября 2017 года
Тренировочная работа по химии для 11 классов 30 ноября 2017 года
Досрочный ЕГЭ по химии 25.03.2019
Видеоопыты
Видеоопыты по общей и неорганической химии
Видеоопыты по органической химии
Спецификация ЕГЭ по химии-2022
Актуальность темы
Химия занимает одно из ведущих
мест в системе школьного образования как важное средство формирования
химических знаний в прикладных направлениях развития общества и духовно-мировоззренческой
сфере людей. В соответствии с этим преподавание химии должно быть направлено на
овладение системой знаний о живой природе, так и на овладение обучающимися
умений и практических навыков, необходимых для подготовки к жизни и продолжению
образования. Единый государственный экзамен по химии выпускники сдают по
выбору, его результаты востребованы абитуриентами ВУЗов, где химия считается
обязательным предметом. Сдающие экзамен по биологии оказываются в особо сложном
положении: от них требуется видение всей химии, как единой, целостной системы.
Поэтому особенности подхода к целям, структуре и содержанию ЕГЭ по биологии во
многом определяют и особенности подготовки к нему всех участников
образовательного процесса.
Главным условием подготовки к экзаменам
является тесное сотрудничество между учащимися, педагогами, родителями
(законными представителями), психологами и классными руководителями. Но
ведущая роль в подготовке к ЕГЭ отводится тандему «учитель — предметник –
ученик». Чтобы ученик успешно сдал экзамен, учитель должен вдохновить его своей
неутомимостью и применением многочисленного ряда форм и методов работы по
подготовке к итоговой аттестации.
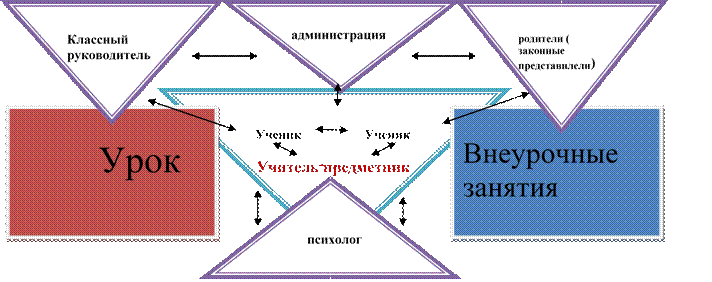 |
Цель: создание
условий для качественной подготовки обучающихся к итоговой аттестации в формате
ЕГЭ по химии, способствующей успешной аттестации и конкурентоспособности при
поступлении в ВУЗы.
Для реализации поставленной цели были
определены следующие задачи:
1.осуществить информационное, методическое
обеспечение итоговой аттестации выпускников 11 классов;
2.
выявить
соответствие подготовки выпускников требованиям
образовательных стандартов;
3.
обеспечить
психологический комфорт и правовую защищенность
выпускников 11 класса;
4.
продемонстрировать
алгоритм формирования и совершенствования у обучающихся знаний и умений по
биологии в ходе подготовки к экзамену по биологии
Планируемый
результат
1. применение инновационных
технологий в учебном процессе; 2.обновление содержания образования по
предметам,
положительные мотивационные,
психологические установки на ЕГЭ всеми участниками образовательного процесса;
3.высокое качество
знаний выпускников старшей школы, стабильно высокие показатели ЕГЭ и призовые
места в олимпиадах и конкурсах, исследовательских конференциях;
Учебная
деятельность по подготовке к ЕГЭ реализуется через:
1.урочную систему;
2.внеурочную работу (индивидуальные и
групповые консультации, занятия факультатива);
3. элективные курсы «Неорганика»,
«Решение некоторых вопросов», « Вопросы и ответы».
Формы
контроля:
-многовариантное тематическое
тестирование; —
применение онлайн тестирования на уроке и
дома.
— самостоятельная работа учащихся на
уроке и дома;
Подготовка
к экзамену базируется на принципах:
1.системность (подготовка
ведется последовательно, функционирует команда специалистов, подготавливающая
учащихся по разным направлениям) 2.гибкость (отслеживание изменений нормативно
— правовой базы, накопление научно — методических материалов по вопросам ЕГЭ,
индивидуальный подход к каждому учащемуся)
Качественная подготовка выпускников к
экзаменационным испытаниям предусматривает проведение не отдельных мероприятий,
а целого комплекса последовательных и взаимосвязанных направлений работы.
Поэтому для подготовки к ЕГЭ в школе сложилась определенная система,
учитывающая все аспекты этой работы.
1.Информационная готовность
(информированность о порядке проведения государственной итоговой аттестации, о
правилах заполнения бланков и т.д.)
2.Предметная готовность или
содержательная (готовность к сдаче предмета, успешного усвоения учащимися
новых знаний, умений и компетенций)
3.Психологическая готовность
(состояние готовности – «настрой», внутренняя настроенность на определенное
поведение, ориентированность на целесообразные действия, позволяющие
обучающимся успешно сдать экзамены)
1.Содержание
информационной работы в процессе подготовки к ГИА с учащимися ( Информационная
готовность) :
•
инструктаж
учащихся: процедура проведения ГИА; правила поведения на экзамене; знакомство
со структурой и содержанием КИМов; правильное заполнение бланков;
•
информирование
o порядке проведения подготовки к экзамену;
•
информирование
об основных требованиях, предъявляемых к знаниям, умениям и навыкам выпускников
основной и средней школы;
•
информирование
о необходимых материалах для занятий (учебники, рабочие тетради , сборники
тестов и т.д.);
•
информирование
учащихся о сроках, формах (тесты, практические задания) и содержании контроля
(периодичность, тематика);
•
расписание
работы кабинета (часы дополнительных индивидуально-групповых занятий,
факультативов);
•
оформление
информационного стенда «Готовимся к экзамену» (нормативные документы, бланки,
правила заполнения бланков, ресурсы сети Интернет по вопросам ГИА;
•
наличие
папки с Материалами по ГИА (нормативные документы, инструкции, демоверсии
КИМов).
Содержание
информационной работы с родителями учащихся:
1) Родительские
собрания:
•
информирование
родителей о процедуре ГИА, особенностях подготовки к тестовой форме сдачи
выпускных экзаменов, информирование о ресурсах сети Интернет;
•
ознакомление
родителей с нормативными документами по подготовке к ГИА;
•
информирование
о посещении индивидуальных и групповых занятий и выполнении заданий;
•
информирование
о результатах пробных внутришкольных экзаменов ГИА;
•
о
пункте проведения экзамена и о подготовке к пробным внутришкольным экзаменам
ГИА в школе.
2) Индивидуальное
консультирование родителей учителем-предметником
Не следует забывать об информационной
поддержке учащихся. На стенде «Как готовиться к ЕГЭ» в кабинете биологии я
размещаю сменяемые образцы ученических решений, задания с развернутым ответом и
их оценку с комментариями, тексты тестов ЕГЭ по биологии с ответами, список
пособий, которыми учащиеся могут воспользоваться при подготовке к ЕГЭ,
кодификатор заданий ЕГЭ по биологии и перечень проверяемых заданиями ЕГЭ
умений, а также знакомлю учащихся с элементами спецификации
контрольно-измерительных материалов. На стенде размещаются образцы бланков ЕГЭ,
проводятся консультации по их заполнению. 2.Система работы при подготовке к
ЕГЭ (Предметная готовность):
В ходе подготовки учащихся к итоговой
аттестации у меня сложилась следующая система работы:
Система
работы по подготовке к вступительным экзаменам ежегодно пересматривается. План
действий, направления и формы работы корректируются.
I этап – Диагностический
(сентябрь)
Реализация проекта начинается в сентябре,
когда уточняется список обучающихся 10 – 11 классов, выбирающих биологию как
предмет итоговой аттестации за курс средней школы, как предмет, необходимый для
продолжения дальнейшего образования.
После уточнения списков, формирования
групп
|
1 |
2 |
3 |
|
Группа «риска минимальное образовательных программ |
Учащиеся, отношении могут набрать минимальное образовательных программ среднего (основного и полного) общего |
Учащиеся-претенденты |
|
Дополнительные по предмету; индивидуальные планы на месяц. |
Составление |
и составления
расписания разрабатывается система подготовки к ЕГЭ,
которая включает в себя следующие пункты:
1.Планирование занятий по подготовке к ЕГЭ
во внеурочной деятельности
2.
Комплектование
промежуточных диагностических материалов по разделам
3.
Самообразование
учителя
4.
Создание
и внедрение элективных курсов
5.Совершенствование методики проведения
уроков через применение современных образовательных технологий
6.
Просвещение
родителей
7.
Формирование
библиотеки дополнительной литературы
II
этап – Деятельностный (содержательный) (октябрь – май)
На внедренческом этапе идёт, непосредственно, реализация разработанной системы
по подготовке к ЕГЭ. Рассмотрим каждый пункт действия.
1. Планирование
внеурочных дополнительных занятий по подготовке к олимпиадам, к сдаче ЕГЭ содержит
учебный материал за курс 6-9,10-11 классы по биологии, и вопросы повышенной
трудности, непредусмотренные школьной программой. Занятия рекомендуется
проводить с учетом возможностей и способностей каждого обучающегося. При этом
необходимо использовать дифференцированный подход к обучению.
Структура
дополнительных занятий:
1.Обзор темы или раздела в целом
2.Детальное изучение некоторых
особенностей и тонкостей темы
3.Самостоятельная работа с дополнительными
источниками информации
4.Отработка материала в режиме проверочных
работ, промежуточного тестирования, проговаривания основных моментов темы
5.Изучение вопросов повышенной трудности,
непредусмотренных школьной программой.
6.Тренинг полученных знаний на тестах с
1по 29вопросы.
7.Итоговый контроль в виде зачетной работы
(в форме ЕГЭ)
8.Рефлексия (по необходимости доработка
пробелов по изучаемой теме)
Для выработки стратегии подготовки
учащихся к ЕГЭ на первом занятии обучающиеся 10 – 11
классов знакомятся с кодификатором, спецификой предстоящего
экзамена, знакомятся с памяткой самостоятельной подготовки к
ЕГЭ.
1.
ПОМНИТЕ!
Фундамент биологических знаний закладывается на обычных уроках биологии и при
систематической подготовке к ним.
2.
Необходимо
внимательно выслушивать теоретический материал, который учитель объясняет на
уроках.
3.
Старайтесь
не пропускать без уважительной причины уроки биологии, потому что качественно
восполнить пропущенный теоретический или практический материал самостоятельно
сложно.
4.
Не
допускайте формального усвоения программного материала.
5.
Все
биологические понятия и утверждения нужно обязательно понимать и уметь
самостоятельно воспроизводить.
6.
Выполняйте
все домашние задания самостоятельно, консультируйтесь с учителем.
7.
Составьте
свой, личный справочник теоретического материала и старайтесь постепенно все
выучить наизусть, регулярно повторяя выученное.
8.
Чем
больше информации Вы запомните, тем лучше и быстрее будете выполнять как устные
задания, так и задания, требующие значительных умственных усилий.
9.
Составьте
свой личный план подготовки к экзамену. Покажите его учителю или другому
квалифицированному специалисту для подтверждения его правильности и
соответствия вашим индивидуальным способностям.
10.
Регулярно
занимайтесь по личному плану, не реже 1 раза в неделю.
Помните: вся
подготовка к экзамену зависит лично от каждого из вас. Как вы относитесь к
учебе, какой интерес проявляете к учебе, самостоятельно ли выполняете все
учебные задания, как используете при этом учебные пособия, какие мысли и
чувства вызывает у вас изучение биологии, используете ли вы полученные знания и
умения по биологии в своей жизненной практике, и если используете то как.
Из структуры последовательности
проведения внеурочных занятий по биологии, видно, что занятия начинаются не с
рассматривания вариантов экзаменационных работ, а с повторения, потому
как материал экзаменационных работ распределён в соответствии с их целями, а не
в соответствии со структурой и программой курса школьной биологии. Именно
поэтому следует придерживаться обычного оглавления действующих учебников и
учебных пособий (Приложение 1)
2. Комплектование
промежуточных диагностических материалов по разделам.
Вовремя устранить возникающие проблемы в
знаниях и определить объём изученного материала помогает комплект промежуточных
диагностических материалов по разделам.
Результаты тестирования фиксируются в
диагностическую карту результативности, после чего идёт анализ, и организуются
индивидуальные консультации для обучающихся (Приложение 2)
3. Самообразование
учителя
Учитель должен хорошо знать
спецификацию экзаменационной работы. Спецификация включает в себя назначение и
структуру экзаменационной работы, распределение заданий экзаменационной работы
по частям, тематическим разделам (блокам), видам деятельности и уровню
сложности, систему оценивания отдельных заданий и работы в целом, условия
проведения и проверки результатов экзамена. На основе спецификации формируется
общий план экзаменационной работы, который является основой содержания
контрольно – измерительных материалов (КИМов).
Кроме того, с целью самообразования,
необходимо изучить кодификатор элементов содержания, в котором представлены
вопросы, которые выносятся на проверку основного учебного содержания. Следует
учитывать изменения в кодификаторах, которые будут внесены в текущем учебном
году. Методическую
помощь мне как учителю при подготовке к ЕГЭ оказывают:
̶ материалы сайта ФИПИ (www.fipi.ru):
–
документы,
определяющие структуру и содержание КИМов ЕГЭ (кодификатор элементов
содержания, спецификация и демонстрационный вариант КИМов);
–
открытый
сегмент Федерального банка тестовых заданий;
–
аналитические
отчеты о результатах ЕГЭ и методические письма прошлых лет.
4. Создание и
внедрение элективных курсов
Элективные курсы – обязательные курсы
по выбору учащихся из компонента образовательного учреждения, входящие в состав
профиля обучения.
Элективные курсы выполняют три
основных функции:
1.
«надстройки»
профильного курса, когда такой дополненный профильный курс становится в полной
мере углубленным;
2.
развивают
содержание одного из базисных курсов, изучение которого осуществляется на
минимальном общеобразовательном уровне, что позволяет поддерживать изучение
смежных учебных предметов на профильном уровне или получить дополнительную
подготовку для сдачи единого государственного экзамена по выбранному предмету
на профильном уровне; 3. способствует удовлетворению познавательных интересов в
различных областях деятельности человека. (Приложение 3)
Консультации. В школе консультации
проводятся согласно общешкольному плану проведения консультаций для подготовки
обучающихся к сдаче ЕГЭ. В
2018-2019 учебном году консультации
проходят 2 раза в неделю
(понедельник, четверг).
5.
Совершенствование методики преподавания уроков через внедрения современных
образовательных технологий и применения разнообразных форм работы.
Чтобы ориентироваться в вопросах
биологической направленности и успешно сдать ЕГЭ, обучающимся необходимо
удержать в памяти огромный объём информации и поэтому неотъемлемой частью своей
работы считаю усовершенствование методики урока и применение современных
образовательных технологий (информационно-коммуникационные, проблемные,
дискуссионные, зачетные).
1. Методические
приёмы, используемые на уроках химии
а) На протяжении всего курса обучения
биологии, начиная с 8 класса, вводится тестовый материал аналогичного
содержания. Этот метод помогает сформировать у обучающихся такие умения, как
описание, распознавание, определение, классифицирование, объяснение, сравнение,
анализирование.
б) В методике обучения с 8 по 9 классы,
особое внимание уделяется развитию информационных компетенций, школьники
учатся работать с текстом учебника по алгоритму:
Алгоритм действий
по развитию информационных компетенций
1
шаг.
Прочесть текст
2
шаг.
Разбить его на абзацы
3
шаг.
В каждом абзаце выделить главную мысль
3
шаг.
Рассмотреть рисунки к теме
4
шаг.
Ответить на вопросы в конце изучаемого материала
5
шаг.
Определить сложные зоны, требующие уточнения, разъяснения.
Конструирование учащимися текстов с
биологическими ошибками по различным темам способствует усвоению ими учебного
материала по данному разделу, развитию мотивации и внимательности при чтении и
поиске ошибок, а также сотрудничества при работе в малых группах. Предлагаю
учащимся разбиться на пары, и каждый из них составляет текст (6 предложений) по
заданной теме с биологическими ошибками (3 ошибки), затем они обмениваются
текстами, находят и справляют найденные ошибки, обсуждают в парах результаты.
С целью развития логического
мышления, умения анализировать, делать выводы, конструировать логически
связанный текст предлагаю школьникам из предложенных предложений (8 — 10
предложений), которые записаны на отдельных карточках одинакового размера,
составить текст. Это же задание один из учащихся выполняет на интерактивной
доске, затем обсуждаются результаты.
С 9 класса работа по данному алгоритму
усложняется. Теперь школьникам при ответе на вопросы предлагается проявить
творчество — выразить свои мысли в виде рисунков, схем, тезисов. Данная работа
требует определенных усилий, т.к. далеко не все обучающиеся умеют строить
схемы, таблицы.
в) Методика
«Опорные конспекты», автор В.И. Нахаева.
Опорные конспекты — эффективная
методика, обеспечивающая лёгкое запоминание материала, включающая в работу все
виды памяти, особенно ассоциативную, которая способствует прочному сохранению
знаний. Ассоциации подкрепляют память не только на уровне подсознания, но и на
уровне сознания. Опорные конспекты помогают школьникам воссоздать в памяти
пройденный материал два-три года назад. Они лаконичные, и в то же время
наглядные, образные и информативные.
г)
Работа с терминами.
При подготовке к ЕГЭ уделяю огромное
внимание работе с терминами и основными понятиями. Это позволяет сформировать
прочную теоретическую базу знаний, что очень важно при выполнении заданий
первой части ЕГЭ. Кроме того, важны знания основных биологических законов. Для
освоения терминов использую различные методы: словарная работа,
терминологический диктант, составление и решение кроссвордов и тестовые
задания. Практикую уроки «Работа с биологическими терминами», структура которых
состоит из заданий: упражнение на проговаривание терминов, объяснение значения
термина, конструирование понятий, анализ и синтез. Например: Установите
соответствия. А) Растения:1) ветроопыляемые (анемофилия – опыление ветром),2)
насекомоопыляемые (энтомофилия – опыление насекомыми). Перечисляются признаки
растениий. Вывод: Как видно на проверочной работе появляются новые
термины-синонимы уже хорошо сформированным биологическим понятиям.
2. Применение
современных образовательных технологий
Использование современных образовательных
технологий открывает для учителя новые возможности в преподавании своего
предмета, а школьникам дает возможность для размышления и участия в создании
элементов урока.
а) Технологии «Развитие критического
мышления через чтение и письмо», ( Ч. Темпл, Д. Стил) применяется в 9-10-11
классах. На уроках отрабатываются умения выносить обоснованные суждения,
решения, применяя полученных знаний, как в стандартных, так и в нестандартных
ситуациях, что способствует дальнейшей успешной социализации школьников.
б) Тестовые и
творческие задания
Обратная связь происходит через систему
тестовых и творческих заданий. Именно с них я рекомендую ребятам начать работу
с текстовым материалом, потому как такой прием является хорошим целеполаганием
(мотивацией). Задания: входные, текущие и итоговые.
в). Проблемное обучение.
Позволяет развить и закрепить умения и навыки работы с рисунками, составления
схем и таблиц, решения проблемных задач, оказания первой доврачебной помощи.
Использование анимационных фильмов и текстов, в которых допущены ошибки, даёт
возможность в интересной игровой форме отрабатывать навык нахождения и
исправления биологических ошибок.
г). Продуктивное обучение. Для
закрепления, систематизации и глубокого усвоения знаний использую
видеофрагменты и 3-D анимации без звукового комментария, например,
«Движение воды и органических веществ по стеблю», «Внутренняя
жизнь клетки» и другие. Цель учащихся: после просмотра видеофрагмента
определить и прокомментировать увиденные процессы.
Примерный
учебный план мероприятий
Не секрет, что успешнее сдает экзамен
тот, кто в полном объеме владеет материалом, хорошо знаком с процедурой
проведения экзамена, психологически готов к экзамену и адекватно реагирует на
нестандартные ситуации.
Задача учителя помочь ученику как
можно лучше решить первые две проблемы, и уменьшить третью. Экзамен в новой
форме не похож на обычные школьные контрольные, к которым привыкли и ученики, и
учителя, и родители. Именно поэтому к нему надо начинать специально готовить
даже тех, кто неплохо пишет обычные контрольные работы, а уж тем более тех, кто
испытывает затруднения в математике.
Для того, что бы учитель заранее мог
систематизировать и определить курс работы с учащимися, ему стоит составить
примерный учебный план:
|
№ п/п |
Мероприятие |
Срок |
|
Информационная |
||
|
1 |
Изучение |
Сентябрь, |
|
2 |
Ознакомление родителей учащихся с новым положением занятий (под роспись) |
В |
|
3 |
Оформление |
Информационный стенд с сентября |
|
4 |
Оформление папки |
Сентябрь, |
|
Аналитико — |
||
|
5 |
Диагностика затруднений учащихся 11-х классов по |
В |
|
6 |
Разработка |
Сентябрь |
|
консультационных дополнительных занятий с |
||
|
7 |
Проверка результативности дополнительных занятий по |
В |
|
8 |
Корректировка плана |
Сентябрь |
|
9 |
Уточнение наличия детей с ограниченными |
Сентябрь |
|
10 |
Осуществление контроля посещения учащимися уроков, |
В |
|
11 |
Информирование классного руководителя и родителей о |
В |
|
Учебная и |
||
|
12 |
Организация дополнительных |
С |
|
13 |
Проведение |
В |
|
14 |
Использование заданий из КИМов и |
В |
|
15 |
Проведение ежеурочного |
В течение года |
|
16 |
Проведение ЕГЭ |
В течение года |
|
17 |
Индивидуальное консультирование |
В течение года |
|
18 |
Оказание |
В течение года |
3.
По данному направлению должна проводиться совместная работа с психологом
(Психологическая готовность).
Можно использовать:
Памятки для учащихся и родителей,
помогающие снизить стрессовость экзаменационной ситуации.
Советы
выпускникам и родителям (законным представителям): как подготовиться к сдаче
ЕГЭ (Приложение 4) тест «Измерение уровня тревожности при подготовке выпускников
к ЕГЭ».
Заключение
В заключение хочу остановиться на
пяти принципах, которые помогают в работе. Это немного, на то они и
принципы. Зато каждый из них реализуется с помощью гаммы конкретных приёмов.
Принцип
свободы выбора.
В любом обучающем или управляющем
действии, где только возможно, предоставлять ученику право выбора. С одним
важным условием — право выбора всегда уравновешивается осознанной
ответственностью за свой выбор. Принцип открытости.
«Я знаю, что я ничего не знаю», —
говорил мудрый грек. Печально то, что ученик не знает главного: ОН НЕ ЗНАЕТ,
ЧЕГО ОН НЕ ЗНАЕТ. Весьма смутно представляет сегодня школьник границы своей
информированности, границы познания наук. Поэтому необходимо показывать
границы, сталкивать ученика с проблемами, решения которых лежат за пределами
курса.
Принцип
деятельности.
Бернард Шоу утверждал: «Единственный
путь, ведущий к знанию, — это деятельность».
Освоение учениками знаний, умений,
навыков преимущественно в форме деятельности.
Принцип обратной связи.
Регулярно контролировать процесс
обучения с помощью развитой системы приёмов обратной связи.
Принцип
идеальности (высокого КПД).
Максимально использовать возможности,
знания, интересы самих учащихся с целью повышения результативности, уменьшения
затрат в процессе образования.
Как правило, каждый из вас имеет свои
профессиональные хитрости, приёмы. Они поддерживают друг друга, складываясь в
нечто целое, в систему у каждого из вас.
Работа в режиме «Система
работы учителя при подготовке обучающихся к итоговой аттестации в формате ЕГЭ
по биологии» дает положительные результаты (увеличение качества знаний,
победители олимпиад, высокие баллы при сдаче ЕГЭ и, как конечный результат,
успешное поступление обучающихся в высшие учебные заведения.
Приложение 1
Тематическое планирование
индивидуального занятия « Биомаршрут -11»
|
№ |
Название |
|
Биология. |
|
|
1. |
Биология |
|
2. |
Сравнительная |
|
Ботаника. |
|
|
3. |
Растительная |
|
4. |
Ткани |
|
5. |
Систематика |
|
6. |
Одноклеточные |
|
7. |
Папоротники, |
|
8. |
Органы |
|
9. |
Грибы. |
|
10. |
Подробная |
|
Зоология. |
|
|
11. |
Зоология. |
|
12. |
Систематика |
|
13. |
Систематика |
|
14. |
Тип |
|
15. |
Тип |
|
Анатомия |
|
|
16. |
Общий |
|
17. |
Строение |
|
18. |
Строение |
|
19. |
Строение |
|
20. |
Развитие |
|
21. |
Итоговый |
|
Общая |
|
|
22. |
Признаки |
|
23. |
Химический |
|
24. |
Химический |
|
25. |
Размножение |
|
26. |
Закономерности |
|
27. |
Решение |
|
28. |
Решение |
|
29. |
Генетика |
|
Эволюция |
|
|
30. |
Механизмы |
|
31. |
Развитие |
|
Основы |
|
|
32. |
Экосистемы. |
|
33. |
Биосфера. |
|
34. |
Решение |
|
35. |
Глобальные |
Приложение 2
Маршрутный
лист по подготовке к ЕГЭ по биологии
(групповой)
|
Ф.И. |
1 |
2 |
||
|
Кодификатор |
Отметка |
Консультация |
Отметка |
Консультация |
|
1.Биология |
||||
|
1.1. |
||||
|
1.2. |
||||
|
1.3. |
||||
|
2. |
||||
|
2.1. |
||||
|
2.2. Клетка. Многообразие |
||||
|
6.Экосистемы |
||||
|
6.1 |
||||
|
… 6.5 Глобальные изменения |
Маршрутный
лист по подготовке к ЕГЭ по биологии
(
индивидуальный)
Ф И учащегося
_____________________________________________ Класс
______________________________________________________
Предмет
____________________________________________________
Учитель
______________________________________________________
|
Разделы |
Даты прове дения индиви дуальных занятий |
Формы ликвидации пробелов |
Что задано |
% выпол нения |
Отмет ка |
Подпись учащегося, родителя |
||
Приложение
3
Тематическое планирование элективного
курса «Молекулярная биология»
|
№ |
Название |
|
Введение. |
|
|
1 |
Введение. |
|
Белки. |
|
|
2 |
Белки- |
|
3 |
Решение |
|
4 |
Решение |
|
Нуклеиновые |
|
|
5 |
Строение, |
|
6 |
Сравнительная |
|
7 |
Решение |
|
Биосинтез |
|
|
8 |
Код |
|
9 |
Трансляция |
|
10 |
Решение |
|
Энергетический |
|
|
11 |
Этапы |
|
12 |
Решение |
|
13 |
Решение |
|
14 |
Рубежная |
|
Законы |
|
|
15 |
Закономерности |
|
16 |
Неполное |
|
17 |
Решение |
|
Дигибридное |
|
|
18 |
Закономерности |
|
19 |
Решение |
|
20 |
Решение |
|
Полигибридное |
|
|
21 |
Математические |
|
22 |
Решение |
|
Сцепленное |
|
|
23 |
Закономерности |
|
24 |
Решение |
|
25 |
Решение |
|
Наследование |
|
|
26 |
Кодоминирование. |
|
Наследование, |
|
|
27 |
Цитологические |
|
28 |
Решение |
|
29 |
Решение |
|
Взаимодействие |
|
|
30 |
Эпистаз. |
|
31 |
Комплементарность. |
|
32 |
Полимерия. |
|
33 |
Решение |
|
34 |
Обобщение |
|
35 |
Обобщение |
Приложение 4
Уважаемые родители выпускников!
Вы, вероятно, почувствовали, что этот
учебный год особенный для вас и ваших детей. Особенный он тем, что вам
предстоит определиться в выборе экзаменов, будущей профессии ребёнка, тем, что
ваши дети сдают ЕГЭ!. Экзамены – это испытание для личности в любом возрасте,
особенно – в подростковом. Психологическая
подготовка и поддержка ребенка со стороны семьи – важнейшая составляющая его
успеха на экзаменах. Примите к сведению
несколько простых рекомендаций.
ü Учитывая особенности вашего
ребёнка, помогите ему выбрать наиболее оптимальную тактику подготовки к
экзаменам.
ü Помогите отрегулировать режим дня,
режим сна, режим питания. В экзаменационный период ребенку нужен хороший отдых:
прогулки на свежем воздухе, чередование умственной деятельности с двигательной
активностью (танцы, игры, катание на велосипеде). И полноценный сон.
Установлено, что одна бессонная ночь снижает интенсивность работы мозга на 9%.
ü Чтобы снять тревожность ребенка
перед экзаменом, не увлекайтесь успокоительными лекарственными средствами.
Лучше предложить ребенку крепкий чай с лимоном, немного шоколада и банан, в
котором содержатся вещества, успокаивающе действующие на организм. ü
Психологи
подчеркивают, что детям свойственно «настраиваться» на эмоциональную волну
своих родителей. Они копируют не только поступки, но и чувства. Поэтому
постарайтесь строже контролировать не только слова, но и свои эмоциональные
«всплески». Иногда разногласия в семье порождают стрессовое состояние ребенка.
ü Постарайтесь быть терпимыми друг к
другу и сохранять мир и согласие в семье. Проявите чуть больше, чем обычно,
внимания к ребенку. Дружеское похлопывание по плечу, прикосновение рукой
вызывает успокаивающий эффект. Недаром в народе говорят: «Любую беду рукой
разведу!» Поведение родителей
В экзаменационную пору основная задача родителей — создать оптимальные
комфортные условия для подготовки ребенка и… не мешать ему. Поощрение,
поддержка, реальная помощь, а главное — спокойствие взрослых помогают ребенку
успешно справиться с собственным волнением. Не запугивайте ребенка, не
напоминайте ему о сложности и ответственности предстоящих экзаменов. Это не
повышает мотивацию, а только создает эмоциональные барьеры, которые сам ребенок
преодолеть не может.Не повышайте тревожность ребёнка накануне экзаменов, это
отрицательно скажется на результате тестирования.
Очень важно скорректировать ожидания выпускника. Объясните: для хорошего результата
совсем не обязательно отвечать на все вопросы ЕГЭ. Гораздо эффективнее спокойно
дать ответы на те вопросы, которые он знает наверняка, чем переживать из-за
нерешенных заданий.
Не тревожьтесь о количестве баллов, которые ребёнок получит на экзамене.
Внушайте ему мысль, что количество баллов не является показателем его
возможностей.Независимо от результата экзамена, часто, щедро и от всей души
говорите ему о том, что он (она) — самый(ая) любимый(ая), и что все у него
(неё) в жизни получится! Вера в успех, уверенность в своем ребенке, его
возможностях, стимулирующая помощь в виде похвалы и одобрения очень важны, ведь
«от хорошего слова даже кактусы лучше растут».
Организация занятий
Помните: главное — снизить напряжение и тревожность ребёнка и обеспечить ему
необходимые условия для занятий.
Обеспечьте дома удобное место для занятий, проследите, чтобы никто из домашних
не мешал. Очень важно разработать ребёнку индивидуальную стратегию
деятельности при подготовке и во время экзамена. Именно индивидуальную, так как
все дети разные (есть медлительные, есть очень активные, есть аудиалы,
кинестетики, тревожные, есть с хорошей переключаемостью или не очень и т. д.)!
И вот именно в разработке индивидуальной стратегии родители должны принять
самое активное участие: помочь своим детям осознать свои сильные и слабые
стороны, понять свой стиль учебной деятельности (при необходимости доработать
его), развить умения использовать собственные интеллектуальные ресурсы и
настроить на успех!
Одна
из главных причин предэкзаменационного стресса — ситуация
неопределенности. Заблаговременное ознакомление с правилами проведения ЕГЭ и заполнения бланков, особенностями
экзамена
поможет разрешить
эту ситуацию.Тренировка в решении пробных тестовых заданий также снимает
чувство неизвестности
В процессе работы с заданиями приучайте ребёнка ориентироваться во времени и
уметь его распределять.Если у ребёнка нет часов, обязательно дайте их ему на
экзамен.
Помогите
распределить темы подготовки по дням.
Ознакомьте ребёнка с методикой подготовки к экзаменам (раздел — логические
приёмы изучения материала в буклете «Советы выпускникам»)
Питание и режим дня Позаботьтесь об организации
режима дня и полноценного питания. Такие продукты, как рыба, творог, орехи,
курага и т. д. стимулируют работу головного мозга. Кстати, в эту пору и
«от плюшек не толстеют!»Для активной работы мозга требуется много жидкости,
поэтому полезно больше пить простую или минеральную воду, зеленый чай.
Не допускайте перегрузок ребенка. Через каждые 40-50 минут занятий обязательно
нужно делать перерывы на 10-15 минут.Меняйте умственную деятельность на
двигательную (занятия
спортом, прогулки на свежем воздухе),стоит увеличить время сна на час.Накануне
экзамена ребенок должен отдохнуть и как следует выспаться.
С утра перед экзаменом дайте ребёнку шоколадку… разумеется, это не баловство,
а просто глюкоза стимулирует мозговую деятельность!
Чем
помочь себе в сложный период подготовки и сдачи экзаменов (для обучающихся)
Во-первых,
необходимо внушить себе, что легкое волнение перед экзаменом — это вполне
естественное и даже необходимое состояние. Оно мобилизует, настраивает на
интенсивную умственную работу.
Во-вторых,
стоит научиться никогда не думать о провале на экзамене..
В-третьих,
за несколько дней до экзамена стоит проиграть с кем-нибудь эту ситуацию
В-четвертых,
стоит помнить о том, что взрослые, в том числе и экзаменаторы, — это тоже люди.
Если ответ звучит уныло, неуверенно, невыразительно, это повлияет и на оценку .
В-пятых,
надо понять: уверенность в себе приходит от сознания того, что ты хорошо
подготовился и умеешь делать все, что от тебя требуется.
Как
повторять материал
Повторять материал нужно не «про себя».
Такой способ самопроверки неэффективен. Лучше составить план, схему ответа, и
обязательно на бумаге, а не в уме. Попробовать ответы на самые трудные вопросы
рассказать дома внимательному слушателю. Тем, кому не нужно много времени
«на раскачку», начинать подготовку следует с
более трудных вопросов и тем. Если же работоспособность нарастает постепенно,
лучше не терять времени и сначала быстро повторить более легкий материал. Через
каждые 50-60 минут занятий делать перерыв на 10 минут. После 2-3 часов работы
сделать перерыв на полчаса.
УПРАЖНЕНИЯ
ДЛЯ ТРЕНИРОВКИ ПАМЯТИ:
Упражнение
«Вечерний взгляд назад» – направлено на тренировку
долговременной памяти и обеспечение эмоционального равновесия.
Инструкция: Вечером, перед сном вспомните
весь прошедший день: от подъема до настоящей минуты. Этот обзор должен быть
образным и протекать перед глазами, как фильм. Важно при этом оставаться
наблюдателем дневных событий и самого себя. Вы видите себя читающим учебник,
разговаривающим с друзьями по телефону, отвечающим на вопросы родителей и т.п.
При этом воспоминания о событиях должны идти по порядку.
УПРАЖНЕНИЯ ДЛЯ ТРЕНИРОВКИ ВНИМАНИЯ:
Упражнение
«Спички» – Упражнение направлено на
тренировку наблюдательности, объема внимания и зрительной памяти.
Инструкция: Приготовьте коробок спичек и лист
газеты (или платок). Возьмите из коробка несколько спичек, не пересчитывая.
Бросьте их на стол перед собой. Сосчитайте до трех и накройте газетой.
Спросите
себя, сколько спичек Вы бросили? Восемь?
Возьмите из коробки восемь спичек и
на открытой части стола разложите их так, как те, что лежат под газетой (или
платком). Проверьте себя: откройте на две секунды лист, исправьте ошибки и
проверьте себя снова.
Составитель: Т.В. Хиневич учитель химии
МОБУ « Тюкалинский лицей» г. Тюкалинска Тюкалинского МР Омской области
Программа курса «Подготовка к ЕГЭ по химии» 11 класс
Пояснительная записка
Актуальность программы
Введение Единого Государственного Экзамена требует от учащихся прочного усвоения целого комплекса специальных и предметных знаний, умений, навыков, способов деятельности, понимания того, что такое тестовые формы контроля (виды тестовых заданий).
Актуальность данной программы состоит в том, что она дает возможность учащимся повторить основные химические понятия, обобщить знания по общей, неорганической и органической химии. Целенаправленное знакомство учащихся с принятыми сегодня тестовыми формами итогового контроля, со структурой КИМ, позволит учащимся успешно справиться с итоговой аттестацией в формате ЕГЭ.
Цели программы
- Познакомить учащихся с организационными и содержательными аспектами проведения ЕГЭ, с требованиями, предъявляемыми к учащимся, с типологией тестовых заданий.
- Создать условия для повторения и обобщения знаний по общей, неорганической и органической химии, формирования умений, необходимых для выполнения тестовых заданий, как репродуктивного, так и продуктивного, творческого характера.
Программа рассчитана на 68 часов и ориентирована на обучающихся 11 класса, предполагающих сдавать ЕГЭ по химии. Занятия проводятся в течение всего учебного года по 2 часа в неделю (68 часов).
Настоящий курс предназначен для подготовки выпускников школ к успешной сдаче Единого Государственного экзамена по химии
В программе предусмотрено повторение и обобщение основ общей, неорганической и органической химии по основным содержательным блокам. Наряду с теоретическими понятиями, которые можно углубить, обобщить и систематизировать в процессе изучения элективного курса, обучающиеся знакомятся со структурой ЕГЭ, особенностью заданий частей базового, повышенного и высокого уровня.
Содержание программы
Введение. Структура и формат КИМ ЕГЭ 2015г по химии. Назначение работы. Структура экзаменационной работы. Типы заданий:
— с выбором ответа
— с кратким ответом
— с развернутым ответом
Распределение заданий экзаменационной работы по уровню сложности, по основным содержательным блокам, по видам проверяемой деятельности. Оценивание экзаменационной работы: первичный балл, сертификационный балл, аттестационный балл. Демоверсии ЕГЭ 2015г. Кодификатор. Спецификация. Правила заполнения бланков ЕГЭ по химии. Правила поведения на экзамене. Интернет – ресурсы для подготовки к ЕГЭ по химии.
1. Строение электронных оболочек атомов элементов первых четырех периодов: s- p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов.
2. Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IА–IIIА групп в связи с их положе-
нием в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, желе-
за – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
3. Ковалентная химическая связь, ее разновидности и механизмы образования. Характерис тики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
4. Электроотрицательность. Степень окисления и валентность химических элементов.
5. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
6. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
7. Характерные химические свойства простых веществ-металлов: щелочных, щелочноземе льных, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные хими ческие свойства простых веществ-неметаллов: водорода, галогенов, кислорода, серы,
азота, фосфора, углерода, кремния.
8. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных.
9. Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот.
10. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
11. Взаимосвязь неорганических веществ.
12. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
13. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола)
14. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
15. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды).
16. Основные способы получения углеводородов (в лаборатории). Основные способы получения кислородсодержащих соединений (в лаборатории)
17. Взаимосвязь углеводородов и кислородосодержащих органических соединений
18. Классификация химических реакций в неорганической и органической химии.
19. Скорость реакции, ее зависимость от различных факторов.
20. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов.
21. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена.
22. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Качественные реакции на неорганические вещества и ионы. Идентификация органических соединений.
23. Понятие о металлургии: общие способы получения металлов. Общие научные принци пы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия.
Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки.
24. Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе.
25. Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции.
26. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
27. Классификация неорганических веществ. Классификация и номенклатура органических соединений.
28. Электроотрицательность. Степень окисления и валентность химических элементов.
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее.
29. Электролиз расплавов и растворов (солей, щелочей, кислот).
30. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
31. Характерные химические свойства неорганических веществ: – простых веществ – металлов: щелочных, щелочноземельных, алюминия, переходных металлов (меди,
цинка, хрома, железа); – простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных;
– оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка).
32. Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений.
33. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии.
34. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, предельных карбоновых кислот, сложных эфиров.
35. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки.
36. Реакции окислительно- восстановительные. Коррозия металлов и способы защиты от нее.
37. Реакции, подтверждающие взаимосвязь неорганических соединений.
38. Реакции, подтверждающие взаимосвязь органических соединений.
39. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси), если одно из веществ дано в виде раствора с
определенной массовой долей растворенного вещества. Расчеты массовой или объемной
доли выхода продукта реакции от теоретически возможного. Расчеты массовой доли (массы) химического соединения в смеси.
40. Нахождение молекулярной формулы вещества.
КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ. ХИМИЯ 11 КЛАСС (68ч)
|
№ занятия |
Тема занятия |
Кол-во часов |
|
1 |
Введение. Структура и формат КИМ ЕГЭ по химии. Демоверсии ЕГЭ 2014, 2015г. Кодификатор. Спецификация. |
2 |
|
2 |
Правила заполнения бланков ЕГЭ по химии. Правила поведения на экзамене. Интернет – ресурсы для подготовки к ЕГЭ по химии. |
2 |
|
3 |
1. Строение электронных оболочек атомов элементов первых четырех периодов: s- p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов. |
2 |
|
4 |
2. Закономерности изменения химических свойств элементов и их соединений по периодам и группам. |
2 |
|
5 |
2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. |
2 |
|
6 |
2. Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. |
2 |
|
7 |
3. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. |
2 |
|
8 |
4. Электроотрицательность. Степень окисления и валентность химических элементов. |
2 |
|
9 |
5. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения. |
2 |
|
10 |
6. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) |
2 |
|
11 |
6. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) |
2 |
|
12 |
7. Характерные химические свойства простых веществ-металлов: щелочных, щелочноземельных, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. |
2 |
|
13 |
8. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных. |
2 |
|
14 |
9. Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот. |
2 |
|
15 |
10. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка) |
2 |
|
16 |
11. Взаимосвязь неорганических веществ. |
2 |
|
17 |
12. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа |
2 |
|
18 |
13. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола) |
2 |
|
19 |
14. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. 15. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды). |
2 |
|
20 |
16. Основные способы получения углеводородов (в лаборатории). Основные способы получения кислородсодержащих соединений (в лаборатории) |
2 |
|
21 |
17. Взаимосвязь углеводородов и кислородосодержащих органических соединений |
2 |
|
22 |
18. Классификация химических реакций в неорганической и органической химии 30. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная |
2 |
|
23 |
19. Скорость реакции, ее зависимость от различных факторов. 20. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов. |
2 |
|
24 |
21. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена. 29. Электролиз расплавов и растворов (солей, щелочей, кислот). |
2 |
|
25 |
22. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Качественные реакции на неорганические вещества и ионы. Идентификация органических соединений. 32. Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений. |
2 |
|
26 |
23. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. |
2 |
|
27 |
24. Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. |
2 |
|
28 |
25. Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции. |
2 |
|
29 |
26. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. |
2 |
|
30 |
27. Классификация неорганических веществ. Классификация и номенклатура органических соединений. |
2 |
|
31 |
28. Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. 36. Реакции окислительно- восстановительные. Коррозия металлов и способы защиты от нее. |
2 |
|
32 |
31. Характерные химические свойства неорганических веществ: – простых веществ – металлов: щелочных, щелочноземельных, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка). |
2 |
|
33 |
33. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии. 34. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, предельных карбоновых кислот, сложных эфиров. 35. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки. |
2 |
|
34 |
37. Реакции, подтверждающие взаимосвязь неорганических соединений. 38. Реакции, подтверждающие взаимосвязь органических соединений. |
2 |
|
35 |
40. Нахождение молекулярной формулы вещества. |
2 |
|
Общее число часов по курсу – 70ч |