Всего: 289 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Электронная конфигурация соответствует частице
1)
2)
3)
4)
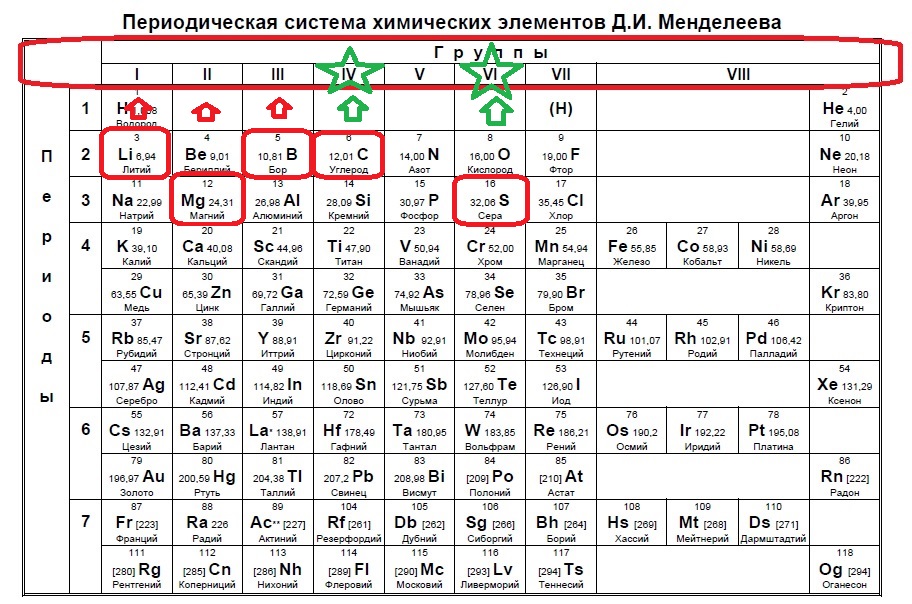
Определите два элемента, электронные конфигурации ионов которых соответствуют электронной конфигурации атома криптона. Запишите в поле ответа номера выбранных элементов.
Показать
1
Из указанных в ряду химических элементов выберите три р−элемента. Расположите выбранные элементы в порядке уменьшения их валентности в летучих водородных соединениях. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 2
2
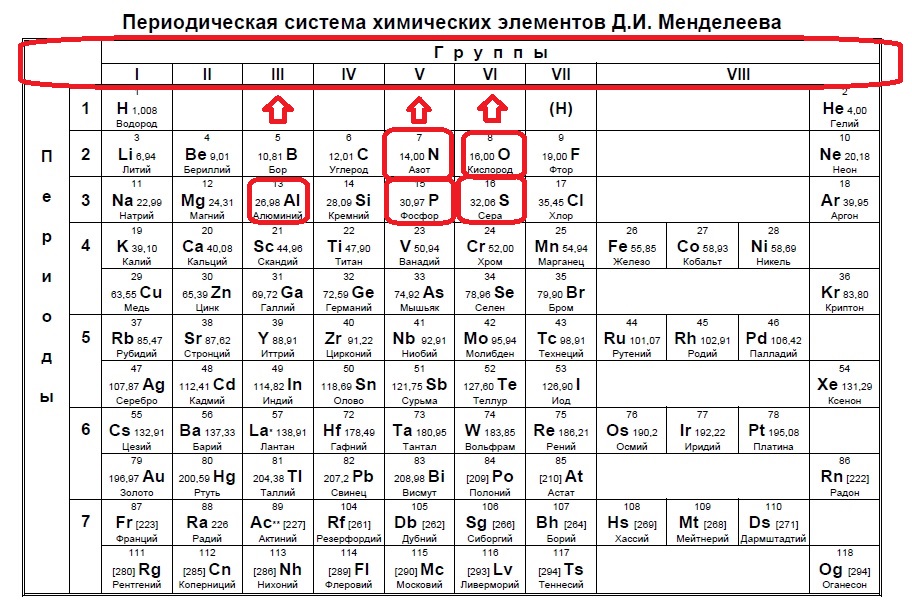
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в кислородсодержащих анионах может быть одинаковой. Запишите в поле ответа номера выбранных элементов.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 2
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 2
Задания Д1 № 833
Электронная конфигурациясоответствует иону
1)
2)
3)
4)
Электронная конфигурация соответствует иону
1)
2)
3)
4)
Электронную конфигурацию ls22s22p6 имеет ион
1) Mg2+
2) К+
3) Fe2+
4) С −
Задания Д1 № 188
Электронную конфигурацию инертного газа имеет ион
1)
2)
3)
4)
Задания Д1 № 876
Электронная конфигурация соответствует иону
1)
2)
3)
4)
Электронная конфигурация 1s22s22p6 соответствует
1) атому
2) иону
3) иону
4) иону
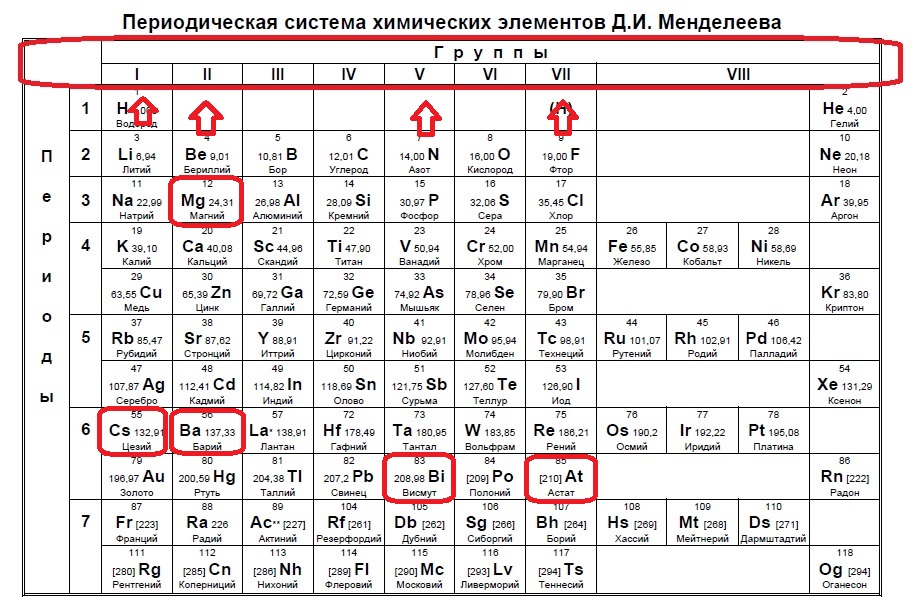
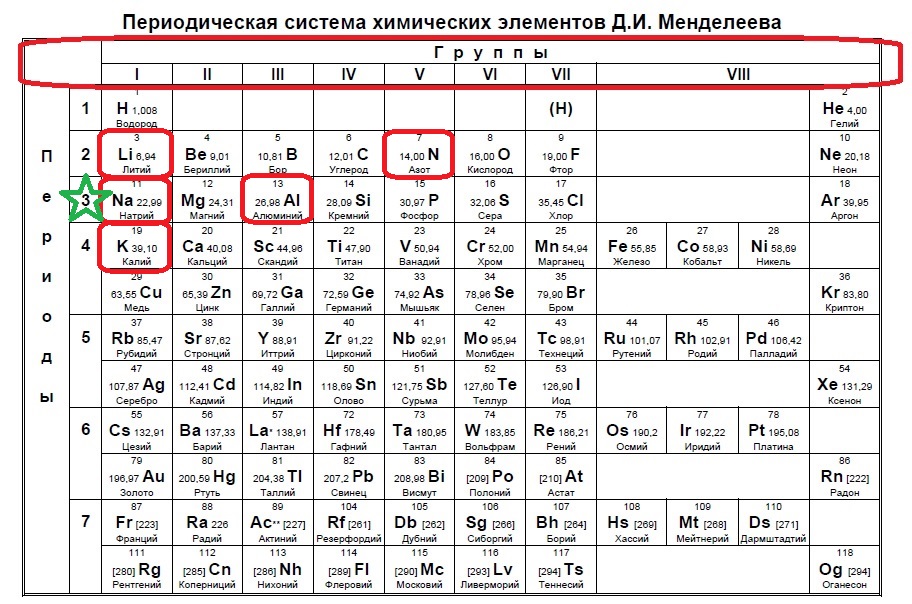
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает двух электронов. Запишите в поле ответа номера выбранных элементов.
Показать
1
Выберите три элемента, которые в периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения радиуса атома. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
2
Выберите два элемента, высшая степень окисления которых равна +4. Запишите в поле ответа номера выбранных элементов.
Задания Д1 № 446
Электронная конфигурация соответствует частице
1)
2)
3)
4)
Восьмиэлектронную внешнюю оболочку имеет ион
1)
2)
3)
4)
Электронная конфигурация 1s22s22p63s23p6 соответствует частице
1) N3-
2) Ca2+
3) F—
4) Al3+
Электронную конфигурацию 1s22s22p63s23p6 имеет ион
1) Cl−
2) Al3+
3) O2−
4) Mn2+
Электронная конфигурация 1s22s22p63s23p4 соответствует
1) атому
2) иону
3) иону
4) атому
Одинаковую электронную конфигурацию имеют
1) атомы и
2) ионы и
3) ион и атом
4) ионы и
Электронная конфигурация соответствует частице
1)
2)
3)
4)
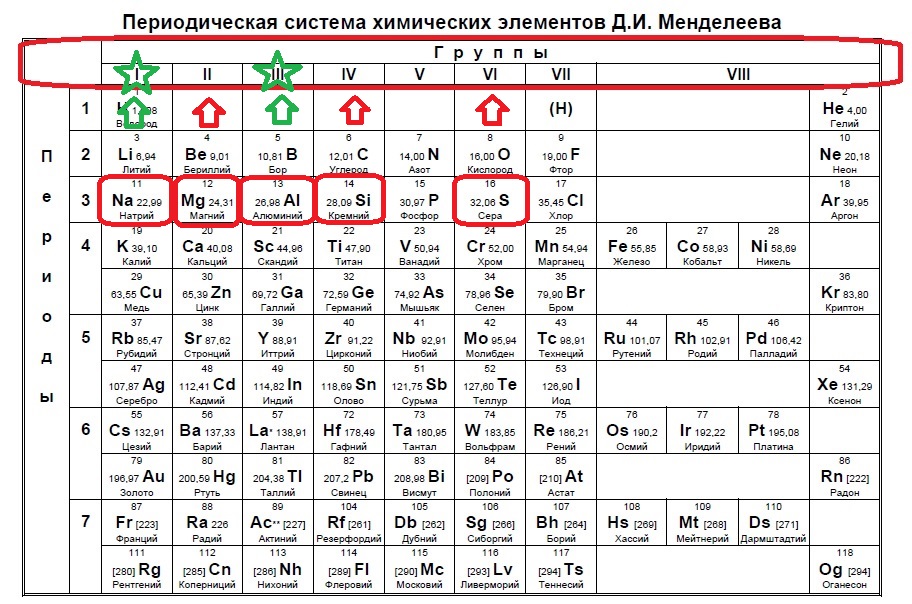
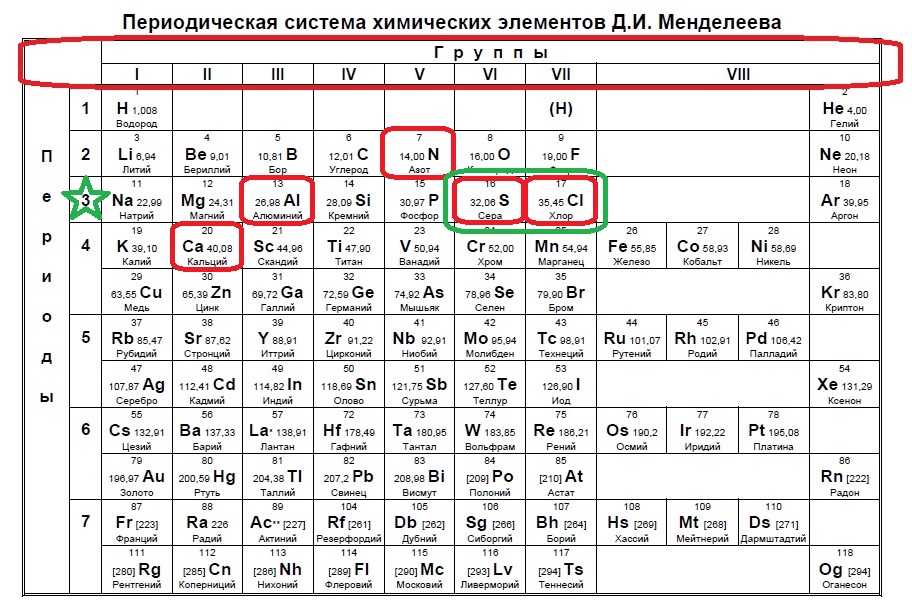
Определите, атомы каких двух из указанных элементов имеют в основном состоянии один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Показать
1
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения элекроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
2
Выберите два элемента, которые в соединениях могут иметь степень окисления –1. Запишите в поле ответа номера выбранных элементов.
Задания Д1 № 360
Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1)
2)
3)
4)
Электронную конфигурацию инертного газа имеет ион
1)
2)
3)
4)
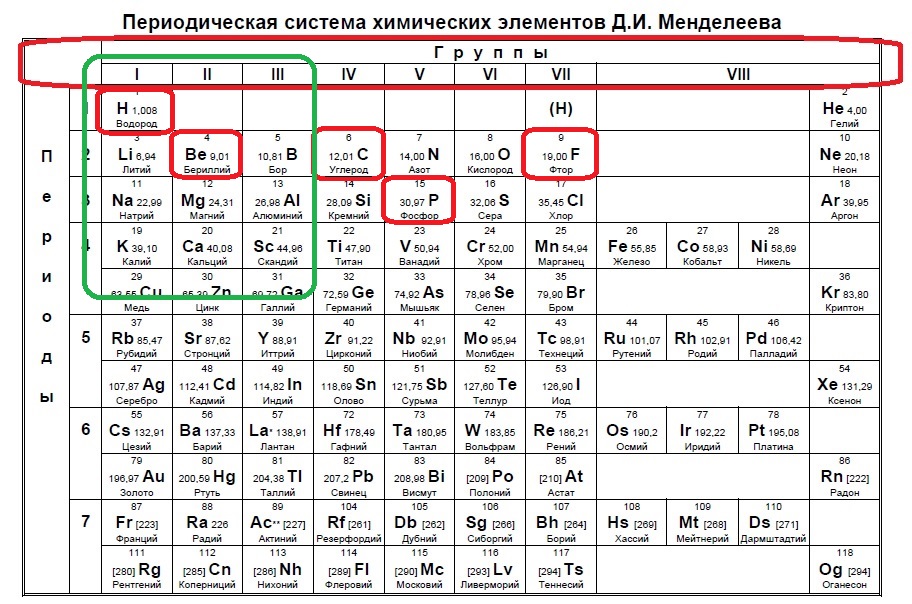
Какие две частицы имеют одинаковую электронную конфигурацию?
1) и
2) и
3) и
4) и
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2
Всего: 289 1–20 | 21–40 | 41–60 | 61–80 …
За это задание ты можешь получить 1 балл. На решение дается около 3 минут. Уровень сложности: базовый.
Средний процент выполнения: 79.2%
Ответом к заданию 1 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Задача 1
1) N 2) S 3) P 4) Se 5) As
Определите, атомы каких из указанных в ряду элементов имеют в возбуждённом состоянии электронную конфигурацию внешнего энергетического уровня ns1np3nd1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация ns1np3nd1 в возбужденном состоянии показывает, что на внешнем слое у атома будет расположено 5 электронов, значит нужны элементы из пятой группы главной подгруппы, таких три: азот, фосфор и мышьяк. Однако атом азота не может переходить в возбужденное состояние, так как на втором энергетическом уровне нет d — подуровня, следовательно, ответ: фосфор и мышьяк.
Ответ: 35
Задача 2
1) Te 2) I 3) O 4) S 5) Sr
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 5s25p6. Запишите в поле ответа номера выбранных элементов.
Решение
Анионы образуются из нейтральных атомов неметаллов при присоединении электронов:
$Э^0 + nē = Э^{n–}$
Электронную конфигурацию внешнего энергетического уровня $5s^{2}5p^{6}$ имеет ксенон Xe, который находится в главной подгруппе VIII группы пятого периода, следовательно, анионы с такой электронной конфигурацией могут образовывать атомы неметаллов, находящихся в пятом периоде, т. е. теллур (ответ — 1) и йод (ответ — 2).
Вывод: правильные ответы — 1, 2.
Ответ: 12
Задача 3
1) Al 2) S 3) P 4) Cr 5) Si
Определите, атомы каких из указанных в ряду элементов в основном состоянии во внешнем слое содержат один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Решение
Здесь лучше всего расписать конфигурации атомов, но можно и запомнить, что 1 неспаренный электрон на внешнем уровне имеют атомы элементов 1,3 и 7 групп или атомы элементы с провалом электрона. В 3 группе находится алюминий (3s2 3p1), а у хрома имеется провал электрона (3d5 4s1)
Ответ: 14
Задача 4
1) Mg 2) Bi 3) Ba 4) Sr 5) Al
Определите, катионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s0. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $3s^0$ описывает строение внешнего энергетического уровня, следовательно, элемент имеет три энергетических уровня, то есть находится в третьем периоде. Из предложенных элементов в третьем периоде находятся магний(Mg) и алюминий(Al). Обрати внимание, что речь идет про катионы!
Ответ: 15
Задача 5
1) I 2) N 3) Br 4) P 5) Cl
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np3. Запишите в поле ответа номера выбранных элементов.
Решение
Конфигурация внешнего энергетического уровня $ns^{2}np^{3}$ означает, что на внешнем энергетическом уровне атома находится 5 электронов, следовательно, это атом элемента, стоящего в главной подгруппе V группы таблицы Менделеева. Из предложенных элементов в главной подгруппе V группы находятся N и P.
Ответ: 24
Задача 6
1) Bi 2) N 3) Br 4) P 5) Cl
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np5. Запишите в поле ответа номера выбранных элементов.
Решение
Электронную конфигурацию $ns^{2}np^{5}$ имеют элементы, которые находятся в 7 группе главной подгруппы, такими элементами являются бром и хлор.
Ответ: 35
Задача 7
1) K 2) S 3) Na 4) Si 5) Se
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np4. Запишите в поле ответа номера выбранных элементов.
Решение
Конфигурация внешнего энергетического уровня $ns^{2}np^{4}$ означает, что на внешнем энергетическом уровне атома находится 6 электронов, а заполнение только s и p подуровней указывает на элементы главной подгруппы. Следовательно, это атомы элементов, стоящих в главной подгруппе VI группы таблицы Менделеева. Из предложенных элементов в главной подгруппе VI группы находятся S и Se.
Ответ: 25
Задача 8
1) S 2) Na 3) He 4) Cl 5) Se
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np4. Запишите в поле ответа номера выбранных элементов.
Решение
Электронную конфигурацию $ns^{2}np^{4}$ имеют элементы, которые находятся в 6 группе главной подгруппы, такими элементами являются сера и селен.
Ответ: 15
Задача 9
1) Mg 2) Al 3) Sb 4) N 5) Bi
Определите, катионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s0. Запишите в поле ответа номера выбранных элементов.
Решение
Конфигурация внешнего энергетического уровня КАТИОНА $3s^0$ означает, что данный элемент, образующий такой катион, имеет три энергетических уровня, следовательно, в таблице Менделеева находится в III периоде. Из представленных элементов в III периоде находятся Mg и Al.
Ответ: 12
Задача 10
1) Cu 2) Te 3) Se 4) Ag 5) O
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns1(n–1)d10. Запишите в поле ответа номера выбранных элементов.
Решение
Элементы с такой конфигурацией должны находиться в побочной подгруппе, поскольку заполняется d подуровень ( произошел перескок электрона в связи с устойчивостью полностью заполненного d подуровня), поскольку внешних электронов 1, то группа первая. Ищем элементы I группы побочной подгруппы.
Ответ: 14
Задача 11
1) Ti 2) Cl 3) Zr 4) I 5) F
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию энергетического уровня ns2(n–1)d2. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $ns^{2}(n–1)d^2$ указывает на то, что перед нами d-элемент, а значит, находится в побочной подгруппе. Галогены Cl, I и F находятся в главной подгруппе VII группы, а титан Ti и цирконий Zr — в побочной подгруппе IV группы, имеют 2 электрона на внешнем энергетическом слое.
Ответ: 13
Задача 12
1) S 2) K 3) O 4) Te 5) Na
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронную конфигурацию внешнего энергетического уровня $ns^1$ имеют элементы главной подгруппы I группы. Из представленных к ним относятся калий К и натрий Na.
Ответ: 25
Задача 13
1) N 2) S 3) P 4) Se 5) As
Определите, атомы каких из указанных в ряду элементов имеют в возбуждённом состоянии электронную конфигурацию внешнего энергетического уровня ns1np3nd1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация внешнего энергетического уровня $ns^1np^3nd^1$ означает, что на нём находится 5 электронов (в возбуждённом состоянии количество электронов не отличается от основного состояния), следовательно, элемент находится в V группе Периодической таблицы. Из предложенных элементов в главной подгруппе V группы находятся N, P и As, но азот не имеет d- подуровня, поэтому не может иметь такую конфигурацию внешнего энергетического уровня.
Ответ: 35
Задача 14
1) Mg 2) Cl 3) S 4) Br 5) Ca
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2np5. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация внешнего энергетического уровня $ns^{2}np^{5}$ свидетельствует о наличии на внешнем энергетическом слое 7 электронов, следовательно, искать нужно элементы VII группы, к ним относятся Cl и Br.
Ответ: 24
Задача 15
1) Te 2) Be 3) I 4) Ba 5) Sr
Определите, катионы каких из указанных в ряду элементов могут иметь электронную конфигурацию внешнего энергетического уровня 5s2. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $5s^2$ у катиона(!) показывает, что на внешнем слое было как минимум 3 электрона (часть от отдал, чтобы стать катионом), при этом внешний слой – пятый. Поэтому из всех элементов выбираем те, которые находятся в 5 периоде и в группах от третьей и дальше. Таких элементов два: теллур и иод, которые в степени окисления +4 и +5, соответственно, будут иметь конфигурацию $5s^2$.
Ответ: 13
Задача 16
1) Li 2) Se 3) K 4) S 5) Cs
Определите, атомы каких из указанных в ряду элементов в возбуждённом состоянии могут иметь электронную конфигурацию ns2np3nd1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $ns^{2}np^{3}nd^{1}$ говорит о наличии шести электронов на последнем энергетическом слое атома. В возбуждённом состоянии электроны переходят на другой энергетический подуровень, но количество их не меняется, поэтому оно равно номеру группы, следовательно, подходят элементы шестой группы — селен и сера.
Ответ: 24
Задача 17
1) O 2) S 3) N 4) Te 5) P
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s23p6. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $3s^{2}3p^6$ описывает строение внешнего энергетического уровня, следовательно, элемент имеет 3 энергетических уровня, то есть находится в третьем периоде. Из предложенных элементов в третьем периоде находятся фосфор (P) и сера (S). Фосфор принимает 3 электрона, чтобы образовать анион P$^{3-}$, а сера принимает 2 электрона, чтобы образовать анион S$^{2-}$
Ответ: 25
Задача 18
1) Ga 2) S 3) B 4) In 5) Se
Определите, атомы каких из указанных в ряду элементов в возбуждённом состоянии имеют электронную конфигурацию внешнего энергетического уровня ns1np3nd2. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация $ns^1np^3nd^2$ в возбужденном состоянии показывает, что на внешнем слое у атома будет расположено 6 электронов, значит нужны элементы из шестой группы главной подгруппы, таких два: сера и селен.
Ответ: 25
Задача 19
1) As 2) Cr 3) Na 4) V 5) Sc
Определите, атомы каких из указанных в ряду элементов имеют 1 неспаренный электрон во внешнем слое в основном состоянии. Запишите в поле ответа номера выбранных элементов.
Решение
Для определения количества неспаренных электронов на внешнем слое нужно представить электронную конфигурацию атома. Атом натрия находится в 3 периоде, поэтому имеет 3 слоя. Всего он имеет 11 электронов, поэтому на последнем слое атом натрия имеет один неспаренный электрон. Атом хрома находится в 4 периоде, он имеет 4 слоя, 3d подуровень заполняется после 4s, но у хрома происходит провал электрона, один электрон с 4s падает на 3d, чтобы быть более энергетически устойчивым, так как в таком случае атом не будет иметь пустых орбиталей на 3d. У мышьяка 3 неспаренных электрона на внешнем слое. У скандия и ванадия их нет.
Ответ: 23
[su_box title=”Описание задания” style=”soft” box_color=”#c1e8cc” title_color=”#0c0a0a”]
В Задании №1 нам необходимо уметь хорошо пользоваться таблицей Менделеева. Первое задание – это поиск атома или иона с заданной конфигурацией электронов, обычно это количество электронов на внешнем уровне (соответствует номеру группы).
Тематика заданий: электронная конфигурация атомов
Бал: 1
Сложность задания: ♦◊◊
Примерное время выполнения: 1 мин.
[/su_box]
Вариант 1ЕХ1
[su_note note_color=”#defae6″]
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
- P
- N
- S
- Al
- O
[/su_note]
Данный пример – типичный вариант первого задания – необходимо определить количество электронов на внешнем уровне. Вспоминаем, что на количество электронов на внешнем уровне указывает номер ГРУППЫ:
Напомню, что нам важно обращать внимание на то, в главной или побочной группе находится элемент. К сожалению, в таблице, которая дана на ЕГЭ нет деления на главные или побочные группы (какие-то элементы пишут правее, какие-то левее, но это не деление на главные и побочные группы), данная таблица не удобна, однако, по правилам можно пользоваться только ей. Обсуждать недостатки данной таблицы мы не будем, скажем лишь, что в условиях задания представлены всегда элементы главных групп, поэтому данный вопрос отпадает сам собой на экзамене (но нет гарантий, что не могут дать определить количество внешних электронов у кобальта, например, по номеру группы в данной таблице это не определишь).
Итак, находим наши пять элементов из условия:
Определяем номер группы – у алюминия 3 группа, у азота и фосфора – пятая, у кислорода и серы – шестая.
В условии нас спрашивают про пять электронов – значит выбираем элементы из пятой группы – азот и фосфор!
Ответ: 12
Вариант 1ЕХ2
[su_note note_color=”#defae6″]
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает шести электронов.
- Ba
- At
- Bi
- Mg
- Cs
[/su_note]
Данное задание немного другого типа, в нем необходимо определить элементы, которым не хватает какого-то количества электронов до завершения внешнего уровня. В этом случае наш алгоритм прост: мы знаем, что на внешнем уровне должно быть 8 электронов (2 и 3 период, или главные группы 4,5,6.. – в заданиях в основном фигурируют именно эти элементы), а значит вычитаем из 8 заданное число – в нашем случае 6: 8-6=2. Значит, в нашем элементе должно быть два электрона на внешнем уровне и, следовательно, расположен он во второй группе. Определяем группы элементов из условия:
В данном случае элементы второй группы – магний и барий.
Ответ: 14
Вариант 1ЕХ3
[su_note note_color=”#defae6″]
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
- S
- Na
- Al
- Si
- Mg
[/su_note]
Следующий вид задания на поиск элементов с неспаренным электроном. Тут все достаточно просто. Так как электроны у нас в орбиталях всегда располагаются по парам (если помните, то есть квадратик, в котором мы рисуем стрелочку вверх и низ), то логично, что неспаренный электрон образуется, когда количество электронов на внешнем уровне нечетно, то есть в элемент должен быть расположен в нечетной группе, а именно 1,3,5,7. Определяем группы указанных нам элементов:
Итак, натрий в первой группе, магний во второй, алюминий в третьей, кремний в четвертой, а сера в шестой.
Выбираем элементы в нечетных группах – это натрий и алюминий!
Ответ: 23
Вариант 1ЕХ4
[su_note note_color=”#defae6″]
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат два неспаренных электрона.
- S
- Mg
- C
- B
- Li
[/su_note]
В данном задании нужно найти два неспаренных электрона. Данное распределение можно найти, начиная с p-подуровня, а именно два неспаренных электрона образуются в четвертой группе, так как на s -подуровне два электрона + 2 должно быть на p-подуровне, и в шестой группе, где 2s+2p(спаренные)+2p(неспаренные) (так как в p-подуровне три орбитали по два электрона на каждой). Таким образом нужно найти элементы четвертой группы или шестой:
В нашем случае это углерод и сера.
Ответ: 13
Вариант 1ЕХ5
[su_note note_color=”#defae6″]
Определите, какие два из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
- Na
- K
- N
- Li
- Al
[/su_note]
В данном варианте задания речь идет уже об ионе, причем положительном, который содержит 10 электронов. В такого вида заданиях необходимо определить, сколько заполнено уровней у иона в зависимости от количества электронов. В нашем случае 10 электронов – это полностью заполненные первый (2) и второй (8) уровни (или периоды в таблице). Так мы говорим о положительном ионе – значит элемент потерял электроны, но у него их было больше чем 10, а значит, он расположен в третьем периоде. Ищем такие элементы:
Нам подходят натрий и алюминий.
Ответ: 15
Вариант 1ЕХ6
[su_note note_color=”#defae6″]
Определите, какие из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
- N
- Al
- S
- Cl
- Ca
[/su_note]
Отрицательный ион получается путем добавления электронов к атому. 18 электронов – это полностью заполненный третий уровень или период, значит, наши элементы расположены именно в нем (в отличии от предыдущего задания, где мы искали в следующем периоде, так как ион положительный). Смотрим на предоставленные в условии элементы:
В данном случае в третий период попали алюминий, сера и хлор. Алюминий не может принять электроны до 18, так как является металлом и отдает электроны. Наиболее типичные элементы-любители электронов расположены правее. Это сера и хлор для данного задания.
Ответ: 34
Вариант 1ЕХ7
[su_note note_color=”#defae6″]
Определите, какие из указанных элементов на внешнем уровне содержат больше s-электронов, чем p-электронов (в основном состоянии).
- H
- C
- F
- Be
- P
[/su_note]
Такие виды заданий часто встречаются в тренировочных вариантах, нужно либо определить кого меньше, когда равно или кого больше. Разберем для наглядности данный пример. s-электронов всего два, значит p-электронов должно быть 1, чтобы было меньше. В сумме у элемента на внешнем уровне получается максимум 3 электрона (но может быть и ноль p-электронов и один или два s!), а значит он в третьей, второй или первой группе:
Нам подходит водород и бериллий.
Ответ: 14.
Остальные задания очень похожи на разобранные, поэтому вы их точно сможете решить, разобравшись с выше представленными решениями.
Даниил Романович | Просмотров: 16.5k
Задание №1 ЕГЭ по химии
Описание задания
В Задании №1 нам необходимо уметь хорошо пользоваться таблицей Менделеева. Первое задание —
это поиск атома или иона с заданной конфигурацией электронов, обычно это количество электронов
на внешнем уровне (соответствует номеру группы).
Тематика заданий: электронная конфигурация атомов
Бал: 1
Сложность задания: ♦◊◊
Примерное время выполнения: 1 мин.
Разбор типовых вариантов заданий №1 ЕГЭ по химии
Вариант 1ЕХ1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом
уровне пять электронов.
1. P
2. N
3. S
4. Al
5. O
Данный пример — типичный вариант первого задания — необходимо определить количество
электронов на внешнем уровне. Вспоминаем, что на количество электронов на внешнем уровне
указывает номер ГРУППЫ:
Напомню, что нам важно обращать внимание на то, в главной или побочной группе находится
элемент. К сожалению, в таблице, которая дана на ЕГЭ нет деления на главные или побочные группы
(какие—то элементы пишут правее, какие—то левее, но это не деление на главные и побочные группы),
данная таблица не удобна, однако, по правилам можно пользоваться только ей. Обсуждать
недостатки данной таблицы мы не будем, скажем лишь, что в условиях задания представлены всегда
элементы главных групп, поэтому данный вопрос отпадает сам собой на экзамене (но нет гарантий,
что не могут дать определить количество внешних электронов у кобальта, например, по номеру
группы в данной таблице это не определишь).
Итак, находим наши пять элементов из условия:
Определяем номер группы — у алюминия 3 группа, у азота и фосфора — пятая, у кислорода и серы
— шестая.
В условии нас спрашивают про пять электронов — значит выбираем элементы из пятой группы —
азот и фосфор!
Ответ: 12
Вариант 1ЕХ2
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает
шести электронов.
1. Ba
2. At
3. Bi
4. Mg
5. Cs
Данное задание немного другого типа, в нем необходимо определить элементы, которым не хватает
какого—то количества электронов до завершения внешнего уровня. В этом случае наш алгоритм
прост: мы знаем, что на внешнем уровне должно быть 8 электронов (2 и 3 период, или главные группы
4,5,6.. — в заданиях в основном фигурируют именно эти элементы), а значит вычитаем из 8 заданное
число — в нашем случае 6: 8—6=2. Значит, в нашем элементе должно быть два электрона на внешнем
уровне и, следовательно, расположен он во второй группе. Определяем группы элементов из условия:
В данном случае элементы второй группы — магний и барий.
Ответ: 14
Вариант 1ЕХ3
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат один
неспаренный электрон.
1. S
2. Na
3. Al
4. Si
5. Mg
Следующий вид задания на поиск элементов с неспаренным электроном. Тут все достаточно просто.
Так как электроны у нас в орбиталях всегда располагаются по парам (если помните, то есть квадратик,
в котором мы рисуем стрелочку вверх и низ), то логично, что неспаренный электрон образуется,
когда количество электронов на внешнем уровне нечетно, то есть в элемент должен быть
расположен в нечетной группе, а именно 1,3,5,7. Определяем группы указанных нам элементов:
Итак, натрий в первой группе, магний во второй, алюминий в третьей, кремний в четвертой, а сера в
шестой.
Выбираем элементы в нечетных группах — это натрий и алюминий!
Ответ: 23
Вариант 1ЕХ4
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат два
неспаренных электрона.
1. S
2. Mg
3. C
4. B
5. Li
В данном задании нужно найти два неспаренных электрона. Данное распределение можно найти,
начиная с p-подуровня, а именно два неспаренных электрона образуются в четвертой группе, так как
на s —подуровне два электрона + 2 должно быть на p—подуровне, и в шестой группе, где
2s+2p(спаренные)+2p(неспаренные) (так как в p—подуровне три орбитали по два электрона на
каждой). Таким образом нужно найти элементы четвертой группы или шестой:
В нашем случае это углерод и сера.
Ответ: 13
Вариант 1ЕХ5
Определите, какие два из указанных элементов образуют устойчивый положительный ион,
содержащий 10 электронов.
1. Na
2. K
3. N
4. Li
5. Al
В данном варианте задания речь идет уже об ионе, причем положительном, который содержит 10
электронов. В такого вида заданиях необходимо определить, сколько заполнено уровней у иона в
зависимости от количества электронов. В нашем случае 10 электронов — это полностью заполненные
первый (2) и второй (8) уровни (или периоды в таблице). Так мы говорим о положительном ионе —
значит элемент потерял электроны, но у него их было больше чем 10, а значит, он расположен в
третьем периоде. Ищем такие элементы:
Нам подходят натрий и алюминий.
Ответ: 15
Вариант 1ЕХ6
Определите, какие из указанных элементов образуют устойчивый отрицательный ион, содержащий
18 электронов.
1. N
2. Al
3. S
4. Cl
5. Ca
Отрицательный ион получается путем добавления электронов к атому. 18 электронов — это
полностью заполненный третий уровень или период, значит, наши элементы расположены именно в
нем (в отличии от предыдущего задания, где мы искали в следующем периоде, так как ион
положительный). Смотрим на предоставленные в условии элементы:
В данном случае в третий период попали алюминий, сера и хлор. Алюминий не может принять
электроны до 18, так как является металлом и отдает электроны. Наиболее типичные элементы—
любители электронов расположены правее. Это сера и хлор для данного задания.
Ответ: 34
Вариант 1ЕХ7
Определите, какие из указанных элементов на внешнем уровне содержат больше s—электронов, чем
p-электронов (в основном состоянии).
1. H
2. C
3. F
4. Be
5. P
Такие виды заданий часто встречаются в тренировочных вариантах, нужно либо определить кого
меньше, когда равно или кого больше. Разберем для наглядности данный пример. s—электронов всего
два, значит p—электронов должно быть 1, чтобы было меньше. В сумме у элемента на внешнем уровне
получается максимум 3 электрона (но может быть и ноль p—электронов и один или два s!), а значит
он в третьей, второй или первой группе.
Нам подходит водород и бериллий.
Ответ: 14.
Остальные задания очень похожи на разобранные, поэтому вы их точно сможете решить,
разобравшись с выше представленными решениями.
Решать задание №1 ЕГЭ 2023 по химии, подборка из 61 тренировочное задание в новом формате с правильными ответами для проверки выполнения с теорией. Данные задания вы можете решать онлайн на сайте.
скачать 1 задание с теорией
Задание №1 ЕГЭ химия 2023 практика с ответами
1. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат на внешнем энергетическом слое семь электронов.
- 1) F
- 2) Li
- 3) Br
- 4) N
- 5) S
2. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют конфигурацию внешнего электронного уровня ns2 .
- 1) O
- 2) S
- 3) Sc
- 4) Be
- 5) Se
3. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат на внешнем энергетическом слое один электрон.
- 1) Be
- 2) Cr
- 3) C
- 4) K
- 5) N
4. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют конфигурацию внешнего энергетического уровня ns2np1 .
- 1) B
- 2) P
- 3) Sc
- 4) Al
- 5) Ca
5. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют конфигурацию внешнего электронного уровня ns2np3 .
- 1) Cs
- 2) Li
- 3) P
- 4) Sb
- 5) Na
Проскок электрона
6. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат на внешнем энергетическом уровне два электрона.
- 1) Cu
- 2) Al
- 3) Mg
- 4) Hе
- 5) Cl
7. Определите, в наиболее распространенных изотопах каких из указанных в ряду элементов число нейтронов больше, чем число электронов.
- 1) Mg
- 2) F
- 3) C
- 4) P
- 5) Ca
8. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число электронов на внешнем электронном слое.
- 1) Mn
- 2) N
- 3) F
- 4) Mg
- 5) Se
Сравнение конфигураций
9. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют схожую конфигурацию внешнего энергетического уровня.
- 1) Cl
- 2) Na
- 3) Mn
- 4) Cr
- 5) Si
10. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат на внешнем энергетическом слое один электрон.
- 1) P
- 2) Mg
- 3) Cl
- 4) Cu
- 5) H
[11] Определите, атомы каких из указанных в ряду элементов имеют в основном состоянии схожую конфигурацию внешнего электронного уровня.
- 1) Rb
- 2) Mg
- 3) P
- 4) Cr
- 5) Al
[12] Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковую конфигурацию внешнего энергетического уровня.
- 1) Cl
- 2) Сa
- 3) Mg
- 4) Al
- 5) Mn
[13] Определите, атомы каких из указанных в ряду элементов имеют одинаковую конфигурацию внешнего электронного слоя.
- 1) Zn
- 2) K
- 3) Mg
- 4) Cr
- 5) Cl
[14] Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют конфигурацию (n – 1)d 10ns2 .
- 1) Cu
- 2) Sr
- 3) S
- 4) Cd
- 5) Zn
[15] Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют конфигурацию предвнешнего электронного слоя (n−1)s 2 (n−1)p 6 .
- 1) K
- 2) Cr
- 3) Ne
- 4) P
- 5) Se
[16] Определите, атомы каких из указанных в ряду элементов содержат один валентный электрон.
- 1) S
- 2) Li
- 3) Al
- 4) Cl
- 5) Cs
Валентные и внешние электроны
[17] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число валентных электронов.
- 1) Cr
- 2) Mn
- 3) Si
- 4) Br
- 5) Na
[18] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат валентные электроны как на s-, так и на d-подуровнях.
- 1) Br
- 2) Cr
- 3) Se
- 4) Fe
- 5) Si
[19] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число валентных электронов.
- 1) Mn
- 2) S
- 3) Ca
- 4) Na
- 5) Cr
[20] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат валентные электроны только на s-подуровне.
- 1) K
- 2) Cu
- 3) Si
- 4) Mg
- 5) Br
[21] Определите, атомы каких из указанных в ряду элементов имеют в основном состоянии два неспаренных электрона.
- 1) Cl
- 2) O
- 3) Zn
- 4) Be
- 5) C
[22] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое (ненулевое) число неспаренных p-электронов на внешнем электронном уровне.
- 1) Na
- 2) Ga
- 3) Cl
- 4) Cr
- 5) S
[23] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое количество неспаренных электронов.
- 1) Cu
- 2) F
- 3) Mg
- 4) N
- 5) O
[24] Определите, атомы каких из указанных в ряду элементов имеют в основном состоянии два неспаренных электрона.
- 1) F
- 2) Cl
- 3) Ni
- 4) As
- 5) S
[25] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат только один неспаренный электрон.
- 1) O
- 2) Mg
- 3) Cr
- 4) Al
- 5) Cl
[26] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое (ненулевое) число неспаренных s-электронов на внешнем энергетическом уровне.
- 1) Na
- 2) As
- 3) Cr
- 4) Al
- 5) Se
[27] Определите, атомы каких из указанных в ряду элементов в основном состоянии не содержат неспаренных электронов. 1) Si 2) Zn 3) S 4) Mn 5) He
[28] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое количество неспаренных p-электронов. 1) Al 2) Cr 3) Se 4) Na 5) Br
[29] Определите, в атомах каких из указанных в ряду элементов в основном состоянии число неспаренных электронов равно числу валентных электронов. 1) Na 2) As 3) Cr 4) Al 5) Se
[30] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат шесть sэлектронов. 1) S 2) O 3) P 4) B 5) Se
[31] Определите, в атомах каких из указанных в ряду элементов в основном состоянии s-электронов содержится больше, чем p-электронов. 1) N 2) Sn 3) C 4) Ge 5) F
[32] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число d-электронов. 1) Cr 2) Ag 3) K 4) Mn 5) Cu
[33] Определите, атомы каких из указанных в ряду элементов содержат в основном состоянии ровно четыре s-электрона. 1) Al 2) F 3) Mg 4) B 5) Li
[34] Определите, атомы каких из указанных в ряду элементов содержат равное количество s- и pэлектронов. 1) Mg 2) С 3) Na 4) S 5) O
[35] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат только три полностью заполненных энергетических подуровня. 1) Na 2) As 3) Ne 4) F 5) Al
[36] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое количество полностью заселенных электронами энергетических подуровней. 1) Zn 2) P 3) Cl 4) Тi 5) F
[37] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое (ненулевое) количество d-электронов. 1) Cu 2) K 3) Ag 4) Se 5) S
[38] Определите, в атомах каких из указанных в ряду элементов общее число p-электронов не превышает общее число s-электронов. 1) С 2) F 3) O 4) Sn 5) Ge
[39] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число p-электронов. 1) Se 2) Ar 3) Cr 4) Br 5) S
[40] Определите, атомы каких из указанных в ряду элементов содержат одинаковое (ненулевое) число dэлектронов. 1) Se 2) Zn 3) Cl 4) S 5) Cd
[41] Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат ровно
четыре полностью заполненных энергетических подуровня.
1) Kr 2) Al 3) Na 4) P 5) Zn
Возбужденное состояние атома
[42] Определите, атомы каких из указанных в ряду элементов в первом возбужденном состоянии имеют электронную формулу внешнего энергетического уровня ns1np3 . 1) N 2) Si 3) Ti 4) C 5) Al
[43] Определите, атомы каких из указанных в ряду элементов в первом возбужденном состоянии имеют электронную формулу внешнего энергетического уровня ns1np2 . 1) Fe 2) N 3) F 4) Ga 5) B
[44] Определите, атомы каких из указанных в ряду элементов в первом возбужденном состоянии имеют конфигурацию внешнего электронного уровня ns2np3nd1 . 1) O 2) V 3) Se 4) Cr 5) S
[45] Определите, атомы каких из указанных в ряду элементов в возбужденном состоянии, соответствующем их высшей валентности, содержат неспаренные электроны как на s-, так и на pподуровнях, но не на d-подуровнях. 1) Na 2) Mn 3) Al 4) C 5) S
Образование ионов
[46] Определите, атомы каких из указанных в ряду элементов образуют устойчивый отрицательный ион, содержащий 18 электронов. 1) Br 2) F 3) P 4) S 5) Mg
[47] Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию аргона. 1) Cl 2) Ca 3) F 4) S 5) Mg
[48] Определите, стабильные анионы каких из указанных в ряду элементов имеют электронную конфигурацию 3s 23p 6 . 1) Ca 2) Cl 3) C 4) Al 5) P
[49] Определите, атомы каких из указанных в ряду элементов образуют устойчивый отрицательный ион, содержащий десять электронов. 1) N 2) Cl 3) Al 4) F 5) S
[50] Определите, стабильные трехзарядные ионы каких из указанных в ряду элементов имеют восьмиэлектронную внешнюю оболочку. 1) Si 2) Al 3) P 4) Fe 5) B
[51] Определите, двухзарядные катионы каких из указанных в ряду элементов имеют электронную конфигурацию инертного газа. 1) Mg 2) Sr 3) C 4) O 5) Zn
[52] Определите, двухзарядные ионы каких из указанных в ряду элементов имеют электронную конфигурацию аргона. 1) Mg 2) S 3) Ba 4) Ca 5) Si
[53] Определите, атомам каких из указанных в ряду элементов не хватает одного электрона до завершения внешнего электронного слоя. 1) S 2) H 3) Ag 4) K 5) Br
[54] Определите, атомам каких из указанных в ряду элементов не хватает одного электрона до завершения внешнего электронного слоя. 1) O 2) Al 3) H 4) Na 5) Cl
[55] Определите, атомам каких из указанных в ряду элементов необходимо отдать два электрона, чтобы приобрести электронную конфигурацию инертного газа. 1) S 2) He 3) Mg 4) Si 5) Be
[56] Определите, атомам каких из указанных в ряду элементов необходимо отдать два электрона, чтобы приобрести электронную конфигурацию инертного газа. 1) Be 2) Si 3) Zn 4) S 5) Mg
[57] Определите, атомам каких из указанных в ряду элементов необходимо отдать три электрона, чтобы приобрести восьмиэлектронную конфигурацию внешнего электронного уровня. 1) Al 2) Sc 3) N 4) Fe 5) B
[58] Определите, трехзарядные катионы каких из указанных в ряду элементов имеют электронную конфигурацию инертного газа. 1) Cl 2) N 3) Al 4) Sc 5) Fe
[59] Определите, стабильные двухзарядные ионы каких из указанных в ряду элементов имеют электронную конфигурацию 3s 23p 6 . 1) Ca 2) S 3) Fe 4) P 5) As
Катионы переходных металлов
[60] Определите, атомы каких из указанных в ряду элементов образуют устойчивый ион, содержащий двадцать три электрона. 1) Fe 2) Ca 3) P 4) Mn 5) As
[61] Определите, двухзарядные ионы каких из указанных в ряду элементов в основном состоянии имеют восьмиэлектронную внешнюю оболочку. 1) Fe 2) S 3) Ba 4) As 5) P
[62] Определите, стабильные ионы каких из указанных в ряду элементов имеют электронную конфигурацию 3s 23p 6 . 1) Na 2) Ge 3) Cl 4) S 5) Mg
Тренировочные варианты ЕГЭ 2023 по химии
20 сентября 2022 Тренировочная работа №1 статград по химии 11 класс ЕГЭ 2023 варианты с ответами
ПОДЕЛИТЬСЯ МАТЕРИАЛОМ
ЕГЭ по химии задание 1
План
- Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы.
- Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов
Главное квантовое число и энергетический уровень
Квантовые числа — это своеобразный код записи положения электрона в атоме. Если сравнить атом с домом, то квантовые числа – это адрес электрона: этаж, квартира, комната.
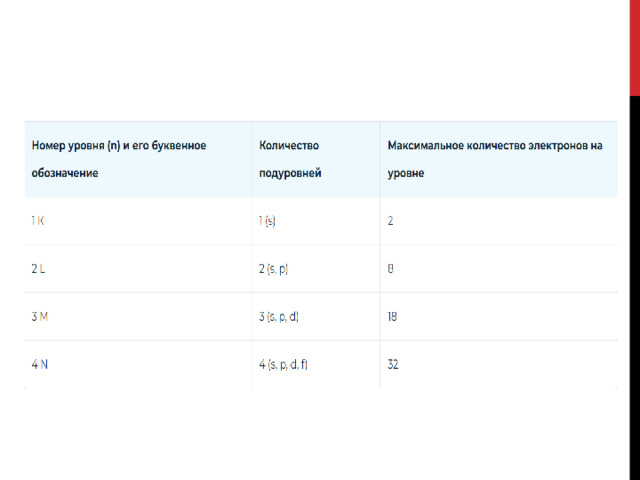
Электроны в атоме сосредоточены на энергетических уровнях – «этажах». Их нумеруют числами 1, 2, 3, … или буквами K, L, M, N, O, P, Q. Главное квантовое число n – это и есть номер энергетического уровня.
С удалением от ядра число электронов возрастает. Чем выше энергетический уровень, тем больше электронов на нём находится. Их максимальное число для каждого уровня определяется по формуле:
N = 2n 2
N – максимальное число электронов
n – номер уровня (главное квантовое число)
На внешнем энергетическом уровне не может находиться больше 8 электронов.
В энергетических уровнях также выделяют подуровни. Их количество также соответствует главному квантовому числу. Это напоминает расположение квартир в доме: на первом этаже располагается одна квартира, на втором – две, на третьем – три и т.д.
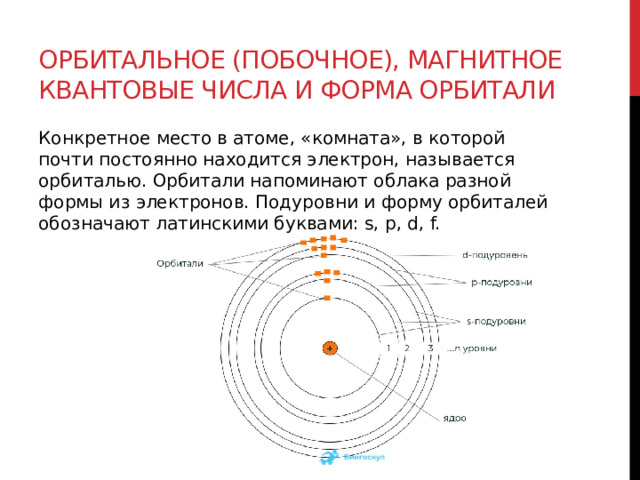
Орбитальное (побочное), магнитное квантовые числа и форма орбитали
Конкретное место в атоме, «комната», в которой почти постоянно находится электрон, называется орбиталью. Орбитали напоминают облака разной формы из электронов. Подуровни и форму орбиталей обозначают латинскими буквами: s, p, d, f.
Эту схему предложил Бор, она помогает разобраться в строении атома, но не отражает реальной картины. Наши представления об атоме расходятся с реальностью. И выглядит это примерно так:
Магнитное квантовое число ml показывает, какие проекции есть у орбитали. Количество таких вариантов определяется по формуле 2l+1.
Для s-орбитали l = 0 и ml = 0, так и получается, что сфера принимает только одно положение в пространстве.
Для p-орбитали l = 1, ml принимает три значения -l, 0, +l. При l = 3, магнитный момент принимает семь (2l + 1 = 7) значений: -3, -2, -1, 0, +1, +2, +3.
Спин электрона
Еще два квантовых числа – спиновое и проекция спина – характеризуют уникальное квантовое свойство электрона. Спин не имеет аналогов в классической механике. Можно представить, что электрон вращается вокруг своей оси в одну или другую сторону.
В атомах первого периода таблицы Менделеева есть один энергетический уровень. В нём один или два электрона движутся по s-единственной орбитали.
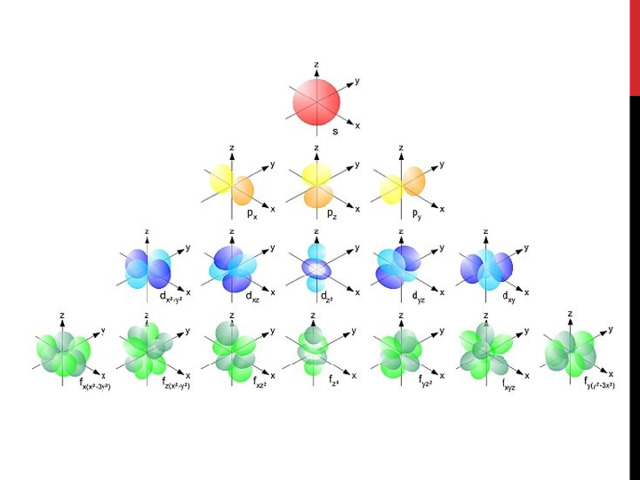
В атомах второго периода появляется второй уровень. Он состоит из s-и p-подуровней. Второй s-подуровень – это тоже s-орбиталь, на p-подуровне есть три орбитали, которые по-разному расположены в пространстве. Каждая p-орбиталь вмещает 1 или 2 электрона, поэтому максимально на p-подуровне их может быть 6.
В атомах третьего периода появляется d-подуровень с пятью d-орбиталями, в атомах четвёртого периода – f-подуровень с семью f-орбиталями.
Как заполняются орбитали?
Принцип минимума энергии . Электрон «стремится» занять положени в атоме с наименьшей энергией. То есть электроны сначала «заселяют» низкоэнергетические орбитали. Рейтинг желаемых орбиталей выглядит так: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5р 6 6s 2 5d 1 4f 14 … Как будто электроны сначала выбирают малозаселённые этажи с небольшим количеством квартир. Принцип Паули . В атоме не может быть двух электронов с одинаковыми свойствами. То есть на каждой орбитали может находиться либо один неспаренный электрон, либо два электрона с разными спинами. Это похоже на дорогу с двусторонним движением: либо едет один автомобиль, либо два, но навстречу друг другу. Правило Хунда . Наиболее устойчивое (основное) состояние атома достигается тогда, когда на одном уровне находится как можно больше неспаренных электронов. Можно провести такую аналогию: электроны сначала селятся по одному, а потом ищут себе пару.
Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов
Электронная конфигурация атомов
Запись по электронным оболочкам (схема электронного строения)
Показывает заряд ядра и количество электронов на каждом энергетическом уровне.
Легче всего начинать с неё, потому что она показывает структуру атома «крупным планом».
Запись с обозначением энергетических уровней и подуровней
Каждая орбиталь обозначается квадратной ячейкой. Электрон обозначается стрелкой. Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.
Буквенно-числовое обозначение такого «адреса» электрона – это электронная формула . Электронная конфигурация – это электронная формула, которая показывает распределение электронов по энергетическим уровням.
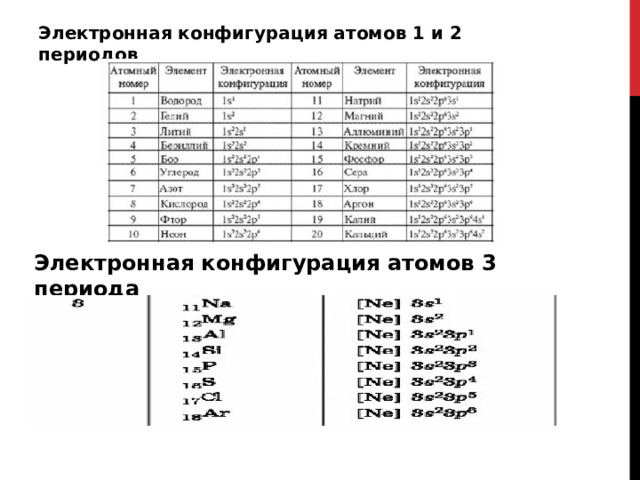
Электронная конфигурация атомов 1 и 2 периодов
Электронная конфигурация атомов 3 периода
Электронная конфигурация атомов 4 периода
Заполнение орбиталей атомов 4 периода имеет свои особенности.
На движение электрона влияют поле ядра и поле других электронов. Поэтому в атомах с большим количеством электронов энергия электрона определяется главным и орбитальным квантовыми числами.
Здесь уже надо смотреть на сумму обоих квантовых чисел (n+l). Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Поэтому в 4 периоде сначала заполняется подуровень 4s, а потом подуровень 3d.
Есть ещё одна особенность, которая появляется в 4 периоде. Хром и медь имеют на 4s-орбитали по одному электрону. Всё дело в заполнении d-оболочек. Полузаполненные или заполненные d-оболочки устойчивее частично заполненных. В атоме хрома на каждой из 5 3d-орбиталей есть по одному электрону. В атоме меди на каждой на каждой 3d-орбитали есть по два электрона.
Алгоритм записи электронной конфигурации атома
- По порядковому номеру химического элемента в таблице Менделеева определяем количество электронов в атоме.
- Распределяем электроны по энергетическим уровням, то есть составляем схему электронного строения.
- Выписываем s-, p-, d-подуровни в каждом энергетическом уровне.
- Заполняем подуровни электронами: сначала по одному электрону на орбиталь, потом достраиваем электронные пары.
Электронная конфигурация ионов
Электронная конфигурация ионов составляется по тем же принципам. Нужно учитывать изменения количества электронов на внешнем энергетическом уровне.
Атом электронейтрален, то есть сколько протонов ядре, столько же электронов в атоме. Если атом принимает электроны, он становится отрицательно заряженным ионом (анионом), если отдаёт электроны – положительно заряженным ионом (катионом).
Атому легче всего отдать электроны внешнего энергетического уровня, «чужие» электроны он тоже примет на внешний энергетический уровень. На внешнем энергетическом уровне не может находиться более 8 электронов. Теория «октета» была предложена в 1916 году Гилбертом Ньютоном Льюисом и Вальтером Косселем
Атом «стремится» добрать электроны на внешний уровень или избавиться от них, поэтому и становится ионом. Полное заполнение s- и p-подуровней внешнего уровня придаёт атому стабильность. Только атом гелия имеет на единственном внешнем энергетическом уровне 2 электрона, а не 8, потому что первый энергетический уровень состоит только из одной s-орбитали.
Запись по электронным оболочкам (схема электронного строения)
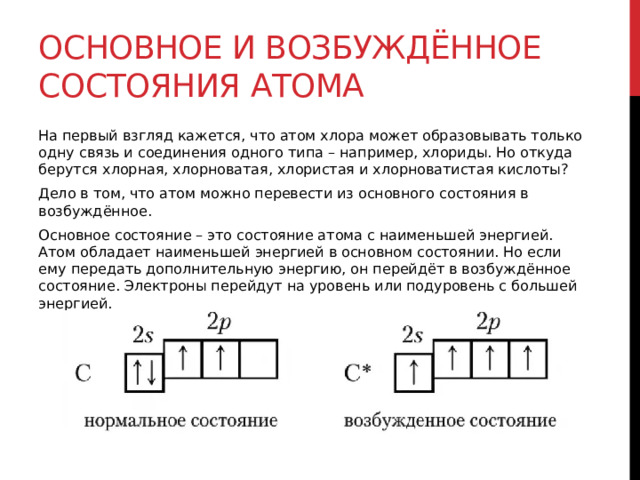
Основное и возбуждённое состояния атома
На первый взгляд кажется, что атом хлора может образовывать только одну связь и соединения одного типа – например, хлориды. Но откуда берутся хлорная, хлорноватая, хлористая и хлорноватистая кислоты?
Дело в том, что атом можно перевести из основного состояния в возбуждённое.
Основное состояние – это состояние атома с наименьшей энергией. Атом обладает наименьшей энергией в основном состоянии. Но если ему передать дополнительную энергию, он перейдёт в возбуждённое состояние. Электроны перейдут на уровень или подуровень с большей энергией.
Сначала разрываются электронные пары на 3p-подуровне, электроны переходят на 3d-подуровень. Если атом хлора получит ещё больше энергии, спаренный электрон покинет даже 3s-орбиталь и перейдёт на 3d-подуровень.
Благодаря этому атом хлора может образовывать больше химических связей. Затраты энергии, потраченные на распаривание электронов, окупаются при образовании новых химических связей.
Но в возбуждённое состояние могут перейти атомы, у которых есть неспаренные электроны и свободные орбитали. Длится возбуждённое состояние недолго: атом отдаст энергию и вернётся в основное состояние. Хотя если сообщить атому слишком много энергии, электрон покинет его и атом станет ионом.
Электронная конфигурация атомов
1. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
Ответ: 35
2. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
Ответ: 12
Электронная конфигурация ионов
1. Определите, какие два из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
Ответ: 23
2. Определите, какие из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
Ответ: 15
Домашняя работа
Вариант № 5508754
Ссылка — https:// chem-ege.sdamgia.ru/test?id=5508754
Подборка экзаменационных заданий 1-4 с ответами.
Задание 1 (без ответов): 1_zadania.pdf
Задание 1 (с ответами): 1_otvety.pdf
Задание 2 (без ответов): 2_zadania.pdf
Задание 2 (с ответами): 2_otvety.pdf
Задание 3 (без ответов): 3_zadania.pdf
Задание 3 (с ответами): 3_otvety.pdf
Задание 4 (без ответов): 4_zadania.pdf
Задание 4 (с ответами): 4_otvety.pdf