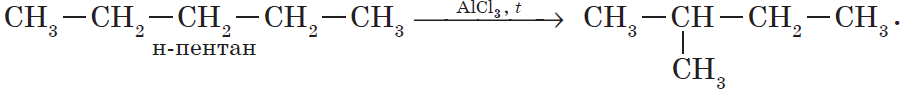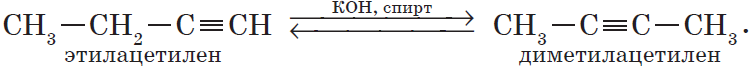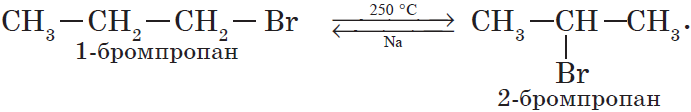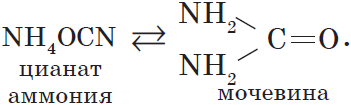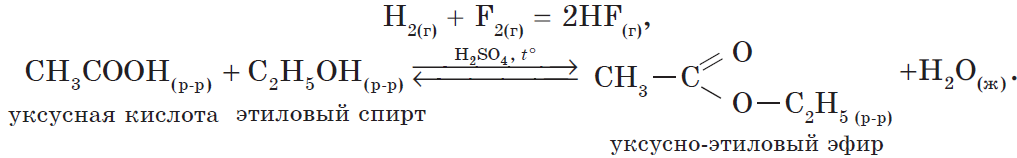Темы кодификатора ЕГЭ: Классификация химических реакций в органической и неорганической химии.
Химические реакции — это такой вид взаимодействия частиц, когда из одних химических веществ получаются другие, отличающиеся от них по свойствам и строению. Вещества, которые вступают в реакцию — реагенты. Вещества, которые образуются в ходе химической реакции — продукты.
В ходе химической реакции разрушаются химические связи, и образуются новые.
В ходе химических реакций не меняются атомы, участвующие в реакции. Меняется только порядок соединения атомов в молекулах. Таким образов, число атомов одного и того же вещества в ходе химической реакции не меняется.
Химические реакции классифицируют по разным признакам. Рассмотрим основные виды классификации химических реакций.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
В органической химии к таким реакциям относятся реакции изомериза-ции, когда из одного изомера под действием катализатора и внешних факторов получается другой (как правило, структурный изомер).
Например, изомеризация бутана в 2-метилпропан (изобутан):
CH3-CH2-CH2-CH3 → CH3-CH(CH3)-CH3.
2. Реакции, протекающие с изменением состава
- Реакции соединения (A + B + … → D) — это такие реакции, в которых из двух и более веществ образуется одно новое сложное вещество. В неорганической химии к реакция соединения относятся реакции горения простых веществ, взаимодействие основных оксидов с кислотными и др. В органической химии такие реакции называются реакциями присоединения. Реакции присоединения — это такие реакции, в ходе которых к рассматриваемой органической молекуле присоединяется другая молекула. К реакциям присоединения относятся реакции гидрирования (взаимодействие с водородом), гидратации (присоединение воды), гидрогалогенирования (присоединение галогеноводорода), полимеризация (присоединение молекул друг к другу с образованием длинной цепочки) и др.
Например, гидратация :
CH2=CH2 + H2O → CH3-CH2-OH
- Реакции разложения (A → B + C + …) — это такие реакции, в ходе которых из одной сложной молекулы образуется несколько менее сложных или простых веществ. При этом могут образовываться как простые, так и сложные вещества.
Например, при разложении пероксида водорода:
2H2O2 → 2H2O + O2.
В органической химии разделяют собственно реакции разложения и реакции отщепления. Реакции отщепления (элиминирования) — это такие реакции, в ходе которых происходит отрыв атомов или атомных групп от исходной молекулы при сохранении ее углеродного скелета.
Например, реакция отщепления водорода (дегидрирование) от пропана:
C3H8 → C3H6 + H2
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
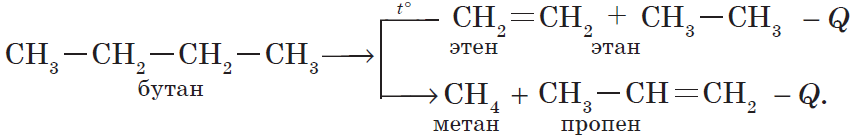
Например, реакция крекинга бутана (расщепление на более простые молекулы при нагревании или под действием катализатора):
C4H10 → C2H4 + C2H6
- Реакции замещения — это такие реакции, в ходе которых атомы или группы атомов одного вещества замещаются на атомы или группы атомов другого вещества. В неорганической химии эти реакции происходят по схеме:
AB + C = AC + B.
Например, более активные галогены вытесняют менее активные из соединений. Взаимодействие йодида калия с хлором:
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
Например, при сплавлении менее летучие оксиды вытесняют более летучие из солей. Так, нелетучий оксид кремния вытесняет оксид углерода из карбоната натрия при сплавлении:
Na2CO3 + SiO2 → Na2SiO3 + CO2
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
Например, реакция хлорирования метана:
CH4 + Cl2 → CH3Cl + HCl
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
- Реакции обмена — это такие реакции, в ходе которых два сложных вещества обмениваются своими составными частями:
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — взаимодействие уксусной кислоты с щелочью:
CH3-CООH + KOH = CH3-CООК + H2O
Классификация химических реакций по изменению степени окисления элементов, образующих вещества
По изменению степени окисления элементов химические реакции делят на окислительно-восстановительные реакции, и реакции, идущие без изменения степеней окисления химических элементов.
- Окислительно-восстановительные реакции (ОВР) — это реакции, в ходе которых степени окисления веществ изменяются. При этом происходит обмен электронами.
В неорганической химии к таким реакциям относятся, как правило, реакции разложения, замещения, соединения, и все реакции, идущие с участием простых веществ. Для уравнивания ОВР используют метод электронного баланса (количество отданных электронов должно быть равно количеству полученных) или метод электронно-ионного баланса.
В органической химии разделяют реакции окисления и восстановления, в зависимости от того, что происходит с органической молекулой.
Реакции окисления в органической химии — это реакции, в ходе которых уменьшается число атомов водорода или увеличивается число атомов кислорода в исходной органической молекуле.
Например, окисление этанола под действием оксида меди:
CH3-CH2-OH + CuO → CH3-CH=O + H2O + Cu
Реакции восстановления в органической химии — это реакции, в ходе которых увеличивается число атомов водорода или уменьшается число атомов кислорода в органической молекуле.
Например, восстановление уксусного альдегида водородом:
CH3-CH=O + H2 → CH3-CH2-OH
- Протолитические реакции и реакции обмена — это такие реакции, в ходе которые степени окисления атомов не изменяются.
Например, нейтрализация едкого натра азотной кислотой:
NaOH + HNO3 = H2O + NaNO3
Классификация реакций по тепловому эффекту
По тепловому эффекту реакции разделяют на экзотермические и эндотермические.
Экзотермические реакции — это реакции, сопровождающиеся выделением энергии в форме теплоты (+Q). К таким реакциям относятся почти все реакции соединения.
Исключения — реакция азота с кислородом с образованием оксида азота (II) — эндотермическая:
N2 + O2 = 2NO – Q
Реакция газообразного водорода с твердым йодом также эндотермическая:
H2 + I2 = 2HI – Q
Экзотермические реакции, в ходе которых выделяется свет, называют реакциями горения.
Например, горение метана:
CH4 + O2 = CO2 + H2O
Также экзотермическими являются:
- реакции щелочных металлов с водой;
- реакции, сопровождающиеся взрывом;
- разложение дихромата аммония («вулканчик»);
- образование аммиака: N2 + 3H2 = 2NH3;
- реакции нейтрализации;
- синтез метанола;
- алюмотермия;
- реакции, в которых из менее стабильных веществ образуются более стабильные;
- в органической химии — реакции присоединения, реакции горения, окисления и др.
Эндотермические реакции — это реакции, сопровождающиеся поглощением энергии в форме теплоты (— Q). Как правило, с поглощением теплоты идет большинство реакций разложения (реакции, требующие длительного нагревания).
Например, разложение известняка:
CaCO3 → CaO + CO2 – Q
Также эндотермическими являются:
- реакции гидролиза;
- реакции, идущие только при нагревании;
- реакции, протекающие только при очень высоких температурах или под действием электрического разряда.
Например, превращение кислорода в озон:
3O2 = 2O3 — Q
В органической химии с поглощением теплоты идут реакции разложения. Например, крекинг пентана:
C5H12 → C3H6 + C2H6 – Q
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Вещества могут существовать в трех основных агрегатных состояниях — твердом, жидком и газообразном. По фазовому состоянию разделяют реакции гомогенные и гетерогенные.
- Гомогенные реакции — это такие реакции, в которых реагирующие вещества и продукты находятся в одной фазе, и столкновение реагирующих частиц происходит во всем объеме реакционной смеси. К гомогенным реакциям относят взаимодействия жидкость-жидкость и газ-газ.
Например, окисление сернистого газа:
2SO2(г) + O2(г) = 2SO3(г)
- Гетерогенные реакции — это реакции, в которых реагирующие вещества и продукты находятся в разных фазах. При этом столкновение реагирующих частиц происходит только на границе соприкосновения фаз. К таким реакциям относятся взаимодействия газ-жидкость, газ-твердая фаза, твердая-твердая, и твердая фаза — жидкость.
Например, взаимодействие углекислого газа и гидроксида кальция:
CO2(г) + Ca(OH)2(р-р) = CaCO3(тв) + H2O
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Например, получение синтез-газа происходит при очень высоких температурах, при которых вода — пар:
CH4(г) + H2O(г) = CO(г) + 3H2(г)
Таким образом, паровая конверсия метана — гомогенная реакция.
Классификация химических реакций по участию катализатора
Катализатор — это такое вещество, которое ускоряет реакцию, но не входит в состав продуктов реакции. Катализатор участвует в реакции, но практически не расходуется в ходе реакции. Условно схему действия катализатора К при взаимодействии веществ A + B можно изобразить так:
A + K = AK;
AK + B = AB + K.
В зависимости от наличия катализатора различают каталитические и некаталитические реакции.
- Каталитические реакции — это реакции, которые идут с участием катализаторов.
Например, разложение бертолетовой соли: 2KClO3 → 2KCl + 3O2. - Некаталитические реакции — это реакции, которые идут без участия катализатора.
Например, горение этана: 2C2H6 + 5O2 = 2CO2 + 6H2O.
Все реакции, протекающие с участием в клетках живых организмов, протекают с участием особых белковых катализаторов — ферментов. Такие реакции называют ферментативными.
Более подробно механизм действия и функции катализаторов рассматриваются в отдельной статье.
Классификация реакций по способности протекать в обратном направлении
Обратимые реакции — это реакции, которые могут протекать и в прямом, и в и обратном направлении, т.е. когда при данных условиях продукты реакции могут взаимодействовать друг с другом.
К обратимым реакциям относятся:
- большинство гомогенных реакций,
- этерификация;
- реакции гидролиза;
- гидрирование-дегидрирование,
- гидратация-дегидратация;
- получение аммиака из простых веществ,
- окисление сернистого газа,
- получение галогеноводородов (кроме фтороводорода) и сероводорода;
- синтез метанола;
- получение и разложение карбонатов и гидрокарбонатов, и т.д.
Необратимые реакции — это реакции, которые протекают преимущественно в одном направлении, т.е. продукты реакции не могут взаимодействовать друг с другом при данных условиях.
Примеры необратимых реакций:
- горение;
- реакции, идущие со взрывом;
- реакции, идущие с образованием газа, осадка или воды в растворах;
- растворение щелочных металлов в воде; и др.
112
Создан на
11 января, 2022 От Admin
Классификация химических реакций
Тренажер задания 17 ЕГЭ по химии
1 / 10
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие этилбензола с бромом при облучении и нагревании.
1) электрофильная
2) радикальная
3) отщепления
4) присоединения
5) замещения
2 / 10
Из предложенного перечня выберите два вещества, реакция разложения которых является окислительно-восстановительной.
1) NН4NО2
2) Fе(ОН)3
3) NaHCO3
4) АgNО3
5) Н2SiO3
3 / 10
Из перечисленных типов реакций выберите два типа, которым соответствует взаимодействие оксида серы(IV) с кислородом.
1) обмена
2) окислительно-восстановительным
3) каталитическим
4) замещения
5) необратимым
4 / 10
Из предложенного перечня выберите два вещества, разложение которых является окислительно-восстановительной реакцией.
1) нитрат железа(III)
2) гидрокарбонат натрия
3) кремниевая кислота
4) карбонат кальция
5) перманганат калия
5 / 10
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие оксида фосфора(V) с водой.
1) реакция обмена
2) гетерогенная реакция
3) реакция соединения
4) экзотермическая реакция
5) окислительно-восстановительная реакция
6 / 10
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие спиртового
раствора этилата натрия с водой.
1) присоединения
2) гомогенная
3) гидролиза
4) гидратации
5) отщепления
7 / 10
Из предложенного перечня веществ выберите два вещества, взаимодействие которых с азотной кислотой не является окислительно-восстановительной реакцией.
1) аммиак
2) гидроксид алюминия
3) серебро
4) магний
5) медь
8 / 10
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие изопрена с водородом.
1) реакция гидратации
2) реакция нейтрализации
3) реакция обмена
4) реакция присоединения
5) реакция гидрирования
9 / 10
Из предложенного перечня веществ выберите два вещества, взаимодействие которых с гидроксидом натрия является окислительно-восстановительной реакцией.
1) хлороводород
2) оксид азота(IV)
3) азотная кислота
4) хлор
5) хлорная кислота
10 / 10
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие карбоната кальция с соляной кислотой.
1) обмена
2) гетерогенная
3) замещения
4) необратимая
5) окислительно-восстановительная
Ваша оценка
The average score is 43%
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
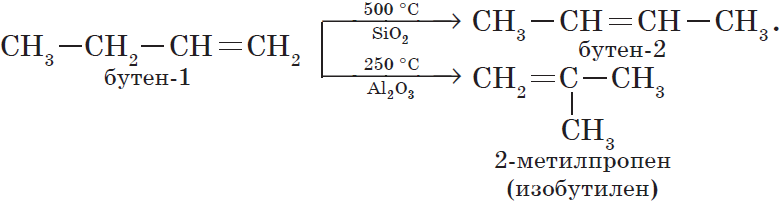
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.}2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат.,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
3) реакция крекинга (расщепления) пропана:
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑.$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
$NaOH+HNO_3=NaNO_3+H_2O$
или в ионном виде:
$OH^{–}+H^{+}=H_2O$;
2) реакция между щелочью и солью, идущая с образованием газа:
$2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$
или в ионном виде:
$NH_4^{+}+OH^{–}=NH_3↑+H_2O$;
3) реакция между щелочью и солью, идущая с образованием осадка:
$CuSO_4+2KOH=Cu(OH)_2↓+K_2SO_4$
или в ионном виде:
$Cu^{2+}+2OH^{-}=Cu(OH)_2↓$
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
$CH_3COOH+NaOH⇄NaCH_3COO+H_2O$
или
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$;
2) реакция, идущая с образованием газа:
$2CH_3COOH+CaCO_3=2CH_3COO^{–}+Ca^{2+}+CO_2↑+H_2O$;
3) реакция, идущая с образованием осадка:
$2CH_3COOH+K_2SiO_3=2KCH_3COO+H_2SiO_3↓$
или
$2CH_3COOH+SiO_3^{−}=2CH_3COO^{−}+H_2SiO_3↓$.
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1.${Mg}↖{0}+{2H}↖{+1}+SO_4^{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{text»уксусный альдегид»}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{text»этиловый спирт»}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{text»уксусный альдегид»}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{text»этиловый спирт»}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92.3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Тема 2. СТРОЕНИЕ АТОМА.
Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Электронная оболочка – совокупность движущихся вокруг ядра электронов.
Атомное ядро – центральная, положительно заряженная, часть атома, состоящая из протонов и нейтронов, связанных между собой ядерными силами.
|
Протон р+ |
Нейтрон n0 |
Электрон е |
|
|
Заряд частицы |
+1 |
0 |
-1 |
|
Масса частицы |
1,00728 а.е.м. |
1,00866 а.е.м. |
1/1840 от массы протона |
Заряд ядра атома Z равен порядковому номеру элемента в периодической системе.
Химический элемент – вид атомов, с определённым зарядом ядра.
Так как атом – электронейтрален (не заряжен), то число протонов в атоме равно числу электронов (число + = числу — ): N(e—) = N(p) = Z
Массовое число атома А складывается из числа протонов и нейтронов в ядре данного изотопа. Число нейтронов можно найти, вычитая заряд ядра атома из массового числа. А = N(p) + N(n) N(n) = A – Z
Oдин и тот же химический элемент может существовать в виде двух или нескольких изотопов.
Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом, т.е разным числом нейтронов в ядре.
Нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Пример 1: Определить число нейтронов у изотопов углерода: 12С и 14С.
Решение: у 12С – 6 нейтронов (12-6=6), у 14С – 8 нейтронов (14-6=8).
Пример 2: определить число протонов и нейтронов в ядре изотопа мышьяка с массовым числом 75.
Решение: порядковый номер у As – 33. Следовательно, заряд ядра Z= +33, число протонов – 33. Число нейтронов: A – Z = 75 – 33 = 42.
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА.
В 1913 г датский физик Н. Бор предложил модель атома, в которой электроны вращаются вокруг ядра атома, как планеты обращаются вокруг Солнца.
|
|
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Электронные орбиты в модели Бора обозначаются целыми числами: 1, 2, …, n, начиная от ближайшей к ядру. |
Такие орбиты называют электронными уровнями (слоями).
Уровни состоят из близких по энергии подуровней (электронных оболочек).
Их обозначают s, p, d, f.
Подуровни состоят из одинаковых по энергии орбиталей.
На каждой орбитали может быть не больше двух электронов.
Они отличаются так называемым СПИНОМ, упрощенно – направлением вращения.
Принцип Паули (запрет Паули) ограничивает число электронов, которые могут находиться на одной орбитали.
Согласно принципу Паули, на любой орбитали может находиться не более двух электронов и лишь если они имеют противоположные спины.
Правило Хунда определяет порядок заселения электронами орбиталей, имеющих одинаковую энергию. Оно было выведено немецким физиком-теоретиком Ф. Хундом в 1927 г. на основе анализа атомных спектров.
Согласно правилу Хунда, заполнение орбиталей одного и того же подуровня происходит таким образом: сначала каждую орбиталь занимают по одному электрону, а затем уже по второму, с противоположным спином.
Пример: атом азота имеет три электрона, находящиеся на 2р-подуровне. Согласно правилу Хунда, они должны располагаться поодиночке на каждой из трех 2р-орбиталей. При этом все три электрона должны иметь параллельные спины:
Связь между уровнем и подуровнями.
|
Номер электронного слоя (уровня) |
Электронные подуровни |
Максимальное число электронов |
|
n = 1 |
1s ◻ |
2e |
|
n = 2 |
2s ◻ 2p ◻◻◻ |
2e 6e |
|
n = 3 |
3s ◻ 3p ◻◻◻ 3d ◻◻◻◻◻ |
2e 6e 10e |
|
n = 4 |
4s ◻ 4p ◻◻◻ 4d ◻◻◻◻◻ 4f ◻◻◻◻◻◻◻ |
2e 6e 10e 14e |
ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ АТОМОВ
Изображение орбиталей с учетом их энергии называется энергетической диаграммой атома.
На каждом s-подуровне (одна орбиталь) могут находиться два электрона, на каждом p-подуровне (три орбитали) — шесть электронов, на каждом d-подуровне (пять орбиталей) — десять электронов.
Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию.
Энергия подуровней растет в ряду:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f∼5d < 6p < 7s <5f∼6d…
Оказалось, что у одних элементов более низкую энергию имеет 4f-подуровень, а у других — 5d-подуровень.
То же самое наблюдается для 5f- и 6d-подуровней.
ПОСЛЕДОВАТЕЛЬНОСТЬ ЗАПОЛНЕНИЯ ОРБИТАЛЕЙ У ПЕРВЫХ 36 АТОМОВ.
Электронная формула атома – запись распределения электронов по орбиталям в основном (невозбужденном) состоянии атома или его ионов: 1s22s22p63s23p6… и т.д.
Заполнение электронных оболочек атомов первых 4-х периодов.
Водород (1е): Н 1s1 – заполняется первый уровень.
Гелий (2е) Не 1s2
ПЕРВЫЙ ЭЛЕКТРОННЫЙ УРОВЕНЬ ЗАПОЛНЕН.
Литий (3е) — начинает заполняться второй уровень: Li 1s22s1
Бериллий на 2s-подуровень приходит второй электрон.
Затем у бора начинается заполнение 2p-подуровня:
В 1s22s22p1
У следующих за бором пяти атомов продолжается заполнение 2р-подуровня, вплоть до неона: Ne 1s22s22p6
ВТОРОЙ ЭЛЕКТРОННЫЙ УРОВЕНЬ ПОЛНОСТЬЮ ЗАВЕРШЕН.
Начинается третий период – сначала происходит заполнение 3s-подуровня у натрия и магния (это s-элементы), а потом заполняется 3р-подуровень у шести р-элементов: от алюминия до аргона.
Na 1s22s22р63s1 Mg 1s22s22р63s2
Al 1s22s22р63s23p1 ….. Ar 1s22s22р63s23p6
У аргона — инертного газа на внешнем слое 8 электронов.
Распределение электронов по электронным уровням у атома № 18 — аргона выглядит так: 2,8,8.
При этом третий электронный уровень ещё не заполнен: в нём есть 3d-подуровень.
Однако атом № 19 – калий является первым элементом 4 периода, у него идёт заполнение 4s-подуровня.
Калий — это s-элемент.
K 1s22s22p63s23p64s1
3d-подуровень пока остаётся незаполненным.
4s-подуровень заполняется и у кальция: Са 1s22s22p63s23p64s2
И вот ТОЛЬКО у следующих 10 элементов (от скандия до цинка) происходит заполнение 3d-подуровня. Это d-элементы.
Sc 1s22s22p63s23p63d14s2
Ti 1s22s22p63s23p63d24s2
V 1s22s22p63s23p63d34s2
У ванадия на d-подуровне 3 электрона, на 4s — 2 электрона.
Казалось бы, у хрома должно получиться: Сr …3d44s2
Однако у хрома происходит переход одного электрона с s-подуровня на d-подуровень: Сr…3d54s1
Это явление называется ПРОВАЛ ЭЛЕКТРОНА, причина такого явления — более выгодная по энергии полузаполненная d-оболочка.
Дальше у марганца снова происходит «возвращение» электрона на 4s-подуровень: Mn…3d54s2
У атомов с №26 (железо) до № 28 (никель) происходит дальнейшее заполнение 3d-подуровня.
У никеля на d-подуровне 8 электронов, на 4s — 2 электрона. У меди вновь происходит переход одного электрона с s на d-подуровень: Сu …3d104s1
Это снова ПРОВАЛ ЭЛЕКТРОНА, причина которого — более выгодная по энергии полностью заполненная d-оболочка.
И наконец, цинк завершает ряд из 10 d-элементов 4 периода:
Zn 1s22s22p63s23p63d104s2
ТРЕТИЙ ЭЛЕКТРОННЫЙ УРОВЕНЬ только теперь ЗАВЕРШЕН – на нем 18 электронов.
Со следующего элемента 4 периода — галлия вновь начинается заполнение внешнего электронного уровня (№4), теперь уже 4p-подуровня – от галлия до криптона.
Ga 1s22s22p63s23p63d104s24p1 ……… Kr 1s22s22p63s23p63d104s24p6
Для краткости записи электронной конфигурации атома вместо орбиталей, полностью заселенных электронами, иногда записывают символ благородного газа, имеющего соответствующую электронную формулу: 1s2 = [He] 1s22s22p6 = [Ne]
Пример: электронная формула атома хлора 1s22s22p63s23p5, или [Ne]3s23p5.
ЭЛЕКТРОННЫЕ ФОРМУЛЫ ИОНОВ.
Ионы – заряженные частицы; катионы – положительно заряженные ионы, анионы – отрицательно заряженные ионы.
Ионы получаются из атомов путем отдачи электронов (тогда образуются катионы) или принятия электронов (образуются анионы).
S0 (атом серы)+ 2e → S2−(сульфид-анион)
Cu0(атом меди) -2е →Cu2+ (катион меди)
Электронная формула иона получается путём добавления или отнятия электронов в электронной формуле атома.
Электроны сначала уходят с внешнего электронного уровня!
Пример: составить электронные формулы ионов: As3- ; Cu2+.
1) As0 1s22s22p63s23p63d104s24p3 → As3- 1s22s22p63s23p63d104s24p6 (добавились ещё 3 электрона на внешний уровень – их стало 8, а всего – 36е: оболочка инертного газа криптона)
2) Cu01s22s22p63s23p63d104s1 → Cu2+1s22s22p63s23p6 3d9 (уходят 2 электрона, сначала ВНЕШНИЙ 4s-электрон, а потом – 3d-электроны! )
Изоэлектронные частицы – это атомы и ионы, имеющие одинаковое строение электронной оболочки. Например, ион Са2+ и атом аргона – имеют одинаковую 18- электронную оболочку.
Пример: какие из этих солей образованы изоэлектронными ионами: хлорид натрия, фторид бария, бромид магния, сульфид кальция.
NaCl Na+(10e), Cl —(18e), BaF2 Ba2+(54 e), F — (10e);
MgBr2 Mg2+(10e),Br — (36e) CaS Ca2+(18e),S2-(18e)–ионы изоэлектронны. Ответ: CaS
ОСНОВНОЕ И ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМА.
Основное состояние атома — это наиболее выгодное по энергии состояние, которое получается в результате последовательного заполнения оболочек электронами согласно правилу Хунда и принципу минимума энергии.
Поэтому ПРИ НАЛИЧИИ СВОБОДНЫХ ОРБИТАЛЕЙ и при наличии некоторой ЭНЕРГИИ (энергия возбуждения) электроны атома могут РАСПАРИВАТЬСЯ и атом переходит в возбужденное состояние. При этом число неспаренных электронов, а, следовательно, ЧИСЛО СВЯЗЕЙ, образуемых атомом, УВЕЛИЧИВАЕТСЯ.
Пример: у атома углерода на внешнем валентном слое есть 4 электрона. В невозбуждённом (основном) состоянии число неспаренных электронов равно ДВУМ: С … 2s2 2p2
|
↑↓ |
↑ |
↑ |
При переходе одного электрона с s-оболочки на р – оболочку число неспаренных электронов становится равным ЧЕТЫРЁМ: С* …2s12p3
|
↑ |
↑ |
↑ |
↑ |
Это возбужденное состояние углерода.
Тема 3. ПЕРИОДИЧЕСКИЙ ЗАКОН
Д.И. Менделеев в 1869 году так сформулировал Периодический закон: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел находятся в периодической зависимости от их атомного веса«.
Менделеев учитывал, что для некоторых элементов атомные массы могли быть определены недостаточно точно. После того, как было доказано ядерное строение атома и равенство порядкового номера элемента заряду ядра его атома, Периодический закон получил новую формулировку:
«Свойства элементов, а также образуемых ими веществ находятся в периодической зависимости от заряда их атомных ядер».
Современная Периодическая система состоит из 7 периодов (седьмой период заканчивается 118-м элементом).
Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы — 18 групп, имеющих те же обозначения, что и в короткопериодном.
В группах, обозначенных буквой А (главных подгруппах), содержатся элементы, в которых идет заселение s- и р-оболочек: s-элементы (IA- и IIA-группы) и р-элементы (IIIA-VIIIA-группы). В группах, обозначенной буквой Б (побочных подгруппах), находятся элементы, в которых заселяются d-подуровни — d-элементы.
Номер периода в Периодической системе соответствует числу энергетических уровней атома данного элемента, заполненных электронами.
Номер периода = Число энергетических уровней, заполненных электронами = номер последнего энергетического уровня
Номер группы в Периодической системе определяет число валентных электронов в атомах s- и p-элементов.
ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ.
1) Атомные и ионные радиусы.
Радиус атома – это расстояние от центра ядра до внешнего уровня (области максимальной электронной плотности внешнего уровня).
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра уменьшаются, т.к. растет заряд ядра и => притяжение внешнего электронного уровня к ядру.
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных слоёв.
У s- и p-элементов изменение радиусов как в периодах, так и в подгруппах более заметно, чем у d- и f-элементов, поскольку d- и f-электроны находятся на внутренних, а не внешних уровнях.
Уменьшение радиусов у d- и f-элементов в периодах называется d- и f-сжатием.
Образование ионов приводит к изменению ионных радиусов по сравнению с атомными.
Радиусы катионов всегда меньше, а радиусы анионов всегда больше соответствующих атомных радиусов.
Изоэлектронные ионы – это ионы, имеющие одинаковое электронное строение.
Радиус изоэлектронных ионов уменьшается слева направо по периоду, т.к. заряд ядра увеличивается и растёт притяжение внешнего электронного уровня к ядру.
Пример: изоэлектронные ионы с электронной оболочкой, соответствующей аргону – (18 е): S2-, Cl—, K+, Ca2+ и т.п. В этом ряду радиус уменьшается, т.к. растёт заряд ядра.
2) Электроотрицательность— это способность атома элемента к притягивать к себе электроны в химической связи.
Электроны в общей электронной паре смещены к атому того элемента, который имеет большую электроотрицательность.
Слева направо по периоду происходит увеличение электроотрицательности, т.к. растёт заряд ядра и внешний уровень притягивается к ядру сильнее.
Сверху вниз по подгруппе электроотрицательность уменьшается, т.к. увеличивается число электронных уровней и увеличение радиуса. Внешние электроны слабее притягиваются к ядру.
На рис. приведены значения электроотрицательности различных элементов по Полингу.
Металлами являются:
-все элементы побочных подгрупп (d-элементы);
— лантаноиды, актиноиды;
-все s- элементы, кроме водорода и гелия.
р-элементы делятся диагональю на металлы и неметаллы:
|
Ве |
В |
||||
|
Al |
Si |
||||
|
Ge |
As |
неметаллы |
|||
|
металлы |
Sb |
Te |
22 штуки |
||
|
Po |
At |
Каждый период начинается щелочным металлом (или водородом), а заканчивается инертным газом.
3) Валентность – число связей, которые образует атом в молекуле.
Высшая валентность как правило равна номеру группы (исключения – элементы второй половины второго периода – азот, кислород, фтор, инертные газы – гелий, неон, аргон, а также металлы побочных подгрупп первой и VIIIB группы (второй и третий элемент «триады»)).
4) Степень окисления – условный заряд у атома в молекуле, рассчитанный, исходя из предположения, что все связи в молекуле – ионные (т.е. электроны полностью смещены от менее электроотрицательного атома к более электроотрицательному.
Высшая положительная степень окисления определяется числом валентных электронов и равна номеру группы. У s- и р-элементов она равна числу внешних электронов. У d-элементов (кроме групп IB,IIB и VIIIB) — она равна числу d+s электронов.
Исключения: 1) фтор, кислород
2) инертные газы – гелий, неон, аргон.
3) медь, серебро, золото
4) кобальт, никель, родий, палладий, иридий, платина.
Для неметаллов также характерна низшая (отрицательная) степень окисления:
Отрицательная степень окисления неметалла = 8 – номер группы.
5) Высшие оксиды и гидроксиды.
1) Степень окисления элемента в высшем оксиде и гидроксиде равна номеру группы:
SeO3 – высший оксид селена.
2) Чем активнее металл, тем более выражены основные свойства высшего оксида и гидроксида.
3) Чем активнее неметалл и чем больше высшая степень окисления – тем сильнее выражены кислотные свойства.
6) ВОДОРОДНЫЕ СОЕДИНЕНИЯ.
Существует два типа водородных соединений:
- Ионные солеобразные гидриды
Это соединения активных металлов с водородом, в которых водород имеет отрицательную степень окисления: СаН2 – гидрид кальция. Это кристаллические вещества, похожие по виду на соли, поэтому их называют СОЛЕОБРАЗНЫМИ.
- ЛЕТУЧИЕ водородные соединения – их образуют только НЕМЕТАЛЛЫ.
В них отрицательную степень окисления имеет неметалл, а водород имеет степень окисления +1. Все газы, кроме воды.
Особенности свойств летучих водородных соединений.
все каталитические неорганические реакции в егэ
N2 + 3H2 —> 2NH3 (kat, t)
Click the card to flip 👆
Sets found in the same folder
Other sets by this creator
Other Quizlet sets
Как на глаз можно определить каталитическую реакцию, просто в егэ встречается, или список какой то их есть?
ну да, а где их можно взять может быть посоветуете книгу или другой источник?
я тоже в это году сдаю егэ, мне интересно на каком задание вы хотите использовать католизаор
в 19 задании встречается иногда каталитическая это реакция или там обмена, замещения итд
аааа, можно не учив катализаторы делать это задание, методом исключение. 1 Помоему каждый умеет находить и определять это реакция обменазамешение итд, 2 реакция гомогенная или гетерогенная .3 этерефикация или нет. иттттд
пытайся решать задние методом исключение
Светило науки — 3 ответа — 4 помощи
Если у тебя скоро егэ, зайди в этот паблик. Там сливают все ответы за пару дней до теста. На все регионы
Вот ссылка
Это не реклама, просто хочу помочь

Остались вопросы?
Новые вопросы по предмету Математика
Каталитические и некаталитические реакции. Самоподготовка к ЕГЭ и ЦТ по химии
Смотреть видео:
СМОТРЕТЬ ВИДЕОРОЛИК:
youtu.be/_eWoa0H3UtU
#химия #химияпросто #неорганика #егэпохимии #эксперименты #химик #егэхимия #химияегэ #chemistry
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Экзотермические и эндотермические реакции. Самоподготовка к ЕГЭ и ЦТ по химии
Your system education

Гомогенные и гетерогенные реакции. Самоподготовка к ЕГЭ и ЦТ по химии
Your system education

Обратимые и необратимые химические реакции. Самоподготовка к ЕГЭ и ЦТ по химии
Your system education

НЕОЧЕВИДНЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ В ОРГАНИКЕ | ЕГЭ Химия | Лия Менделеева
Лия Менделеева — ЕГЭ химия
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
27.06.2019
- Комментарии
RSS
Написать комментарий
Нет комментариев. Ваш будет первым!
Ваше имя:
Загрузка…