04.11.2022
37668
Как сдать ОГЭ по химии — 2023? Запомнить все химические формулы, научиться решать уравнения и задачи и верно отвечать на вопросы из тестовой части. Разбираемся в структуре экзамена и изменениях, а также изучаем самые сложные задания.
Зачем нужен ОГЭ по химии в 9 классе
Причин несколько:
- Во-первых, это предмет по выбору для тех, кто любит химию, понимает ее и уверен в своих силах.
- Во-вторых, химия необходима для поступления в химико-биологические или медицинские 10-е классы.
- В-третьих, результаты ОГЭ могут понадобиться при поступлении в колледжи после 9-го класса на медицинские специальности и ветеринарное дело.
- И конечно же, ОГЭ в 9-м классе — это отличная репетиция ЕГЭ по химии, а подготовка к нему по кирпичикам складывает знания в прочную основу.
Поэтому к ОГЭ по химии в 9 классе нужно готовиться основательно. Например, стоит четко разобрать основные темы экзамена, научиться решать типовые задания и выяснить, как правильно оформлять ответы. Для всего этого необходима четкая система подготовки: вам нужно сочетать изучение теории с практикой, отслеживать прогресс и отмечать слабые места, чтобы работать над ними дополнительно.
Приходите на курсы подготовки к ОГЭ по химии в MAXIMUM Education: и я, и другие наши преподаватели отлично знаем структуру экзамена и умеем подавать сложные темы просто и доступно. Благодаря нашим занятиям ваши знания по химии выстроятся в систему, а на экзамене вы не запутаетесь в хитрых вопросах составителей. Готовьтесь к ОГЭ осознанно и заранее, и тогда высокий балл вам гарантирован.
Структура ОГЭ по химии
Экзаменационная работа по химии состоит из 2 частей, включающих в себя 24 задания:
- Часть 1 содержит 19 заданий с кратким ответом. Максимальное количество баллов — 24.
- Часть 2 содержит 3 задания с развернутым ответом. Это задание на расстановку коэффициентов методом электронного баланса в заданном уравнении, цепочка превращений из трех неорганических реакций и расчетная задача. Максимальный балл — 10.
- В Части 2 присутствуют 2 экспериментальных задания. Сначала необходимо выполнить задание 23: записать уравнения реакций и описать предполагаемые качественные признаки превращений. Затем следует изучить инструкцию и сообщить организатору в аудитории о своей готовности приступить к выполнению самого эксперимента (задание 24). Максимальный балл — 6.
На выполнение всей экзаменационной работы по химии отводится 3 часа (180 минут).
Разбалловка такая:
- 5 выставляется при получении 31-40 баллов.
- 4 выставляется при получении 21-30 баллов.
- 3 выставляется при получении 10-20 баллов.
Если у вас меньше 10 баллов, вы не сдали экзамен.
Изменения в ОГЭ по химии — 2023
В 2023 году изменений в ОГЭ не было, то есть экзамен остался прежним.
Какие задания входят в ОГЭ по химии — 2023
Чтобы успешно сдать ОГЭ по химии, необходимо осилить важнейшие темы курса:
- Теоретические основы в химии (№ 1-6, 15, 20). Если вы понимаете, что такое атом и молекула, из чего состоит атом, как атомы соединяются между собой и почему элементы располагаются в таблице Менделеева именно в таком порядке, эти задания не вызовут у вас затруднений.
- Неорганическая химия. На какие классы делятся вещества в неорганической химии? Как они взаимодействуют между собой? Какие процессы протекают в растворах этих веществ? Знаете ответы на эти вопросы? Тогда баллы за задания 7-14, 21 у вас в кармане.
- Химия и жизнь (№16, 17, 23, 24). Этот блок тем проверяет, насколько вы знакомы с применением химических веществ в лаборатории, на промышленном производстве и в быту. Вам могут встретиться задания об условиях хранения и использования, свойствах от агрегатного состояния до запаха и цвета, а также о технике безопасности, лабораторной посуде и разделении смесей.
- Куда же без расчетных задач в химии? Они расположились в ОГЭ под номерами 18, 19 и 22. Вам предстоит рассчитать массовую долю элемента в соединении, массу лекарственного вещества в таблетке или массу удобрения, необходимого для заданной площади почвы. В задании 22 нужно не только провести расчеты, но и предварительно записать уравнение протекающей реакции с коэффициентами.
Самые сложные задания ОГЭ по химии — 2023
ОГЭ по химии 2023 года включает немало подводных камней. На первый взгляд, ответ на поверхности, но часто это не так. Рассмотрим самые сложные задания по версии учеников.
Задание 1
Как отличить химический элемент от простого вещества по высказываниям? Чтобы не ошибаться, стоит перенестись на уроки русского языка. Да-да. Мы будем выбирать утверждения с необходимыми словами-указателями:
Задания 9-10
Задания на установление соответствия ученики считают сложными вполне заслуженно. Нужно:
- записать уравнения реакций;
- подобрать соответствующие реагенты;
- вспомнить об условиях их протекания;
- дополнить все это исключениями;
- …и потерять кучу времени на экзамене.
Все не так страшно. Помните, всегда можно воспользоваться методом исключения и задать себе вполне логичный вопрос: а с чем данное вещество вообще не реагирует? Вот увидите, это позволит если не дать ответ сразу, то порядком сократить возможные варианты.
Кстати, в заданиях этого типа могут встретиться реакции с концентрированными кислотами, реакции щелочей с простыми веществами, а также образование комплексных и кислых солей.
Задание 16
У кого-то возникнет вопрос, почему это задание попало в список сложных, ведь оно посвящено химии в жизни: что можно, а чего нельзя делать с веществами и лабораторной посудой. Сложность заключается в том, что нам неизвестно количество зашифрованных правильных ответов, то есть может получиться как один, так и два, три и даже четыре правильных ответа.
Вспомните себя на контрольной работе: если у вас в ответе получается комбинация 1234, что вы решите? Правильно, что вы ошиблись и нужно срочно все исправить. Увы, на этом вас и пытаются поймать составители КИМов.
Задание 19
Во-первых, многих смущает тематика задания: расчет массы удобрений, лекарственных препаратов, минералов и горных пород и т. п. Во-вторых, не все дружат с математикой и калькулятором. И хоть никого не заставляют считать в уме или в столбик, задание осложнено последним предложением:
«Дайте ответ с точностью до целых, десятых, сотых» означает, что вам, кроме записи очевидных формул, необходимо применить правила округления. Берите себе на заметку 🤓
Задание 24
Все о нем слышали, но немногие делали его своими руками. Речь о химическом эксперименте. Не волнуйтесь! Никто не даст вам выполнять опыты с поджогами, агрессивными растворами или ядовитыми газами. Все будет безопасно и просто. Кроме того, в спецификации к демоверсии приведены наборы реактивов, которые могут достаться каждому из вас. Если вас очень пугает перспектива выполнения опыта, подготовьтесь заранее и придумайте различные варианты реакций для этих комплектов.
Обратите внимание на то, что сам опыт оценивается 2 баллами. Снять их могут только за грубые нарушения техники безопасности или за неправильно подобранные реактивы для опыта.
Как успешно сдать ОГЭ по химии — 2023
- Составьте план подготовки или чек-лист важных тем, которые вам нужно освоить за год. Эти темы вы можете найти в кодификаторе к демоверсии.
- Обязательно добавьте в этот чек-лист выходные и каникулы, ведь отдых — немаловажная часть подготовки.
- Грамотно распределите время между остальными экзаменами. Сдать химию на отлично — это прекрасная цель, но при этом не забывайте про русский язык и математику.
- Регулярно пишите пробные экзамены. Именно так вы узнаете, есть ли прогресс или стоит поднажать.
И последний совет: разберитесь в критериях оценивания каждого задания. Нужно четко понимать, чего именно от вас ждут составители ОГЭ по химии 2023. Что нужно внести в бланк ответов? Как это сделать без ошибок? Как оформить ответ так, чтобы к нему никто не придрался?
Все эти вопросы я разбираю со своими учениками на курсах подготовки к ОГЭ. Например, мы тщательно изучаем структуру экзамена и тренируемся отвечать на вопросы быстро и без ошибок. Конечно же, не забываем об оформлении. И вдобавок ко всему этому я даю своим ученикам много полезных лайфхаков решения заданий, чтобы на настоящем экзамене потратить как можно меньше времени на легких моментах и справиться со сложными. После такой подготовки мои ученики запросто пишут экзамен и получают высокий результат. Так что если вы хотите сдать ОГЭ на 5, приходите ко мне на занятия. С удовольствием вам помогу 😉
Лайфхаки экзамена
К рубрике
Химия – достаточно популярный среди девятиклассников предмет по выбору для сдачи на ОГЭ. Чаще всего на этот экзамен идут школьники, которые планируют поступать в вузы, связанные с медициной, фармацевтикой, нефтегазовой или пищевой отраслью. О том, сложно ли сдавать ОГЭ по химии и что для этого нужно, – в материале ниже.
Сейчас существует множество бесплатных инструментов, которые позволяют подготовиться к ОГЭ и увеличить балл на 40% с минимальными временными затратами.
Наиболее эффективными являются подписки на видеокурсы. Попробовать можно с
компанией Twostu
,
тем более здесь это ничего не стоит.
Содержание
- Как подготовиться
- Демоверсия
- Кодификатор
- Ресурсы для подготовки
- Как сдать
- Как оценивают работы
- Видео по теме
- Комментарии
Как подготовиться
Подготовка к ОГЭ по химии – непростая задача. Наскоком этот предмет взять трудно, нужна системная предварительная работа. Простое зазубривание вряд ли поможет, необходимо понимать суть процессов. Обычно репетиторы гарантируют четверку тем девятиклассникам, которые начинают готовиться за 4-5 месяцев до экзамена. Чтобы претендовать на высшую оценку, нужно целенаправленно заниматься весь учебный год.
Большую часть проверяемых на экзамене тем проходят в 9 классе. Это положительный момент – знания не успевают забыться, и их можно быстро актуализировать, просто перечитав нужный параграф учебника. Готовиться к ОГЭ по химии можно по следующему алгоритму:
- Повторить теорию, начиная с самых азов: строение молекул и атомов, классы веществ и связи между ними, степени окисления и т.д. Полезно просматривать тематические вебинары и лекции, которые можно найти в интернете. Это поможет глубже разобраться в сложных вопросах.
- Завести специальную тетрадь и постепенно, по мере изучения тем, систематизировать информацию в виде схем и таблиц. Формулы для расчёта величин, химические константы (число Авогадро, молярный объем газа при нормальных условиях и т.д.) лучше вынести в отдельный блок.
- Закреплять пройденное на практике путем выполнения заданий из сборников. Для этого также важно отточить математические навыки, поскольку решение химических задач напрямую связано с расчетами.
Для выполнения некоторых заданий нужно обладать широким кругозором, поэтому стоит время от времени читать дополнительные статьи в интернете. При этом важно обращать внимание, из какого источника черпал информацию автор. Лучше опираться на уважаемые научные журналы с высоким уровнем цитирования.
Демоверсия
Отличный способ подготовиться к итоговой аттестации – воспользоваться демоверсией контрольно-измерительных материалов. Она содержит инструкцию по выполнению экзаменационной работы и даёт представление о том, сколько и каких заданий будет на ОГЭ по химии. В КИМ реального испытания включаются схожие упражнения. Работая с демонстрационным вариантом, можно довести навык их решения до автоматизма.
Кодификатор
Ежегодно для экзамена по каждому предмету утверждаются кодификаторы. Они нужны для того, чтобы учащиеся могли точно знать, по каким темам будут задания. Кодификатор ОГЭ по химии для 9 класса – это две таблицы, в которых систематизированы все требования к знаниям школьников. От девятиклассников, в частности, требуется:
- знание химической символики (уравнений, формул), основных понятий (анион, катион, восстановление, окисление и др.) и химических законов;
- умение разбираться в химических элементах, объяснять смысл их атомных номеров, строение и свойства, характеризовать по положению в таблице Менделеева;
- способность классифицировать вещества, исходя из их формул, определять виды связи в соединениях, а также типы химических реакций, составлять формулы неорганических соединений и схемы строения атомов;
- понимание механизма проведения опытов, способов вычисления массовой доли, объема, количества и массы вещества, принимающего участие в реакции;
- умение пользоваться оборудованием и химической посудой, применять полученные знания на практике.
Все требования привязаны к Федеральному компоненту госстандарта основного общего образования.
Задания ОГЭ по химии относятся исключительно к разделу неорганики. Об органических веществах в 9 классе даются лишь первоначальные представления, поэтому проверка по этим темам не проводится.
Ресурсы для подготовки
Каждый школьник сам определяет, как ему удобнее готовиться к ОГЭ по химии. Некоторым больше подходит индивидуальная работа. Другие предпочитают подготовительные курсы и групповые занятия, где поддерживается постоянная связь с преподавателем, коллективная динамика и чувство здоровой конкуренции. Но в каком бы формате не проходила подготовка, без методических пособий не обойтись. Среди них можно выделить:
- «Большой сборник тематических заданий по химии для подготовки к ОГЭ» под редакцией А.С. Корощенко;
- Ю.Н. Медведев, Г.Н. Молчанова, А.С. Корощенко «ОГЭ 2020. Химия. Типовые варианты экзаменационных заданий» (на 30 или 32 варианта);
- Г.Ю. Добротин «Химия. ОГЭ 2020» (на 10 или 30 вариантов);
- О.С. Габриелян, Т.Е. Деглина «Химия. Трудные задания ОГЭ. Химический эксперимент».
Тем, кто больше любит работать с компьютером, можно порекомендовать проверенные интернет-ресурсы с качественно составленными тренировочными вариантами ОГЭ. В первую очередь, речь идет о сайтах «Сдам ГИА» и «ЯндексРепетитор». Они дают возможность подбирать упражнения по нужным темам и типам, а также формировать собственные варианты экзамена для тренировки.
Не стоит обходить вниманием и официальные ресурсы. Нередко школьники начинают готовиться по материалам ОГЭ, размещенным на малоизвестных частных сайтах, а через некоторое время узнают, что этот вариант уже устарел и не учитывает новых требований. Поэтому такие кодификатор, спецификацию и демоверсию однозначно следует скачивать с порталов Федерального института педагогических измерений и «ГИА9». Там содержится только самая достоверная и проверенная информация в форме текстовых материалов, а также проводятся видеоконсультации.
Как сдать
С 2020 года экзамен состоит из 24 упражнений, разделенных на две части. В первой 19 задач с кратким ответом. Во второй 5 заданий: на 3 из них нужно дать развернутый ответ, а еще 2 представляют собой лабораторную работу. Возможность выбрать вариант ОГЭ с экспериментом или без него, как это было раньше, теперь отсутствует.
Общее время, отведенное на испытание – 3 часа (180 минут). Школьникам разрешается пользоваться дополнительным оборудованием и материалами:
- Периодическая таблица химических элементов Л.И. Менделеева;
- электрохимический ряд напряжения металлов;
- таблица растворимости кислот, солей и оснований в воде;
- непрограммируемый калькулятор.
Ответы на задания 1–19 даются в виде цифр или их последовательности на бланке ответов №1. Каждая символ вносится в отдельную клеточку. Развернутые ответы второй части записываются в бланке ответов №2.
Порядок прохождения экзамена следующий. Сначала необходимо выполнить задания с 1 по 23, и только после этого экзаменуемый допускается к выполнению эксперимента. Он проводится в лаборатории под наблюдением экспертов. С начала испытания до этого момента должно пройти не меньше 30 минут. В комплект лабораторного оборудования входят:
- три пробирки;
- штатив;
- ложечка или шпатель для набора сыпучих веществ;
- шесть склянок для реактивов;
- лоток раздаточный.
Специалисты рекомендуют тщательно подготовиться к эксперименту. В демоверсии приведена подробная инструкция по его выполнению: как переливать жидкости, пересыпать порошок, перемешивать реактивы, определять запах вещества, нагревать пробирку на спиртовке, закрывать емкости и т.д.
После завершения каждой реакции свои наблюдения необходимо записывать в черновик и сверять признаки с ответом на задание 23. Особое внимание следует обратить на соблюдение норм техники безопасности, а при ухудшении самочувствия немедленно сообщить об этом эксперту, который контролирует процесс.
Как оценивают работы
Максимальный балл ОГЭ по химии – 40. «Стоимость» каждого правильного ответа зависит от сложности задания.
| Уровень сложности задачи | Число заданий | Максимальный первичный балл | Процент от максимального общего результата |
|---|---|---|---|
| Базовый | 14 | 14 | 35 |
| Повышенный | 5 | 10 | 25 |
| Высокий | 5 | 16 | 40 |
| Итого | 24 | 40 | 100 |
Баллы могут сниматься за ошибки в написании элементов и в перечислении их основных свойств, за погрешности при математических вычислениях, а также за неполный ответ. Начисление идет по такой схеме:
- Задачи с кратким ответом 1-5, 7-9, 12, 14-17, 19 оцениваются в 1 балл, в случае ошибки ставят 0.
- Вопросы первой части 6, 10, 11, 13, 18, а также экспериментальное задание 24 при правильном выполнении могут принести по 2 балла. За одну ошибку снимается 1 пункт, за две и более выставляется 0.
- Задания 20 и 22 стоят по 3 балла. Ответ в каждом из них состоит из 3 элементов. Соответственно, за каждый неправильно найденный элемент снимается 1 пункт.
- Задачи 21 и 23 наиболее сложные и ценные, за них можно получить по 4 балла. За каждый из четырех верных элементов ответа ставится 1 балл.
Первичные баллы становятся основой для выставления итоговых экзаменационных оценок. Их пересчет осуществляется по специально разработанной шкале.
| Первичные баллы | Отметка за экзамен |
|---|---|
| 0-9 | 2 |
| 10-20 | 3 |
| 21-30 | 4 |
| 31-40 | 5 |
Скажем откровенно, даже для получения четверки по химии придется изрядно попотеть. Но и ценность этой четверки велика – ее может хватить для зачисления в профильный класс (по рекомендации ФИПИ для этого достаточно 27 первичных баллов). Поэтому все усилия талантливых и целеустремленных учеников будут вознаграждены. По сути, ОГЭ по химии – отличная «проверка на прочность» перед предстоящей через 2 года сдачей ЕГЭ и поступлением в университет.
Химия
В помощь сдающим ОГЭ
методическое пособие по химии
для учащихся 9-х классов,
Тема №1: «Строение атомов первых 20 химических элементов
ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
Строение атома: ядро (протоны и нейтроны) + электроны.
Число протонов (p+) – равно порядковому номеру химического элемента (Z).
Число нейтронов (n0) – равно A-Z, где А – массовое число.
Число электронов (е—) — равно порядковому номеру химического элемента (Z).
Заряд ядра = число протонов = число электронов (+Z = p+ = е—).
Номер периода показывает – число электронных слоев в электронной оболочке атома.
Номер группы показывает – число электронов на внешнем электронном слое атома + число валентных электронов.
Валентные электроны – электроны, участвующие в образовании химической связи.
Распределение электронов по энергетическим уровням: на 1-м максимум 2 электрона, на 2-м – 8 электронов, на 3-м – 18 электронов (если уровень последний – то число электронов на нём равно номеру группы или высчитывается как разница общего числа электронов и электронов на предыдущих уровнях). Если последний (внешний) уровень атома имеет максимальное число электронов, то такой электронный слой называется завершенным (его имеют атомы благородных газов – элементы 8 группы).
Тема №2: «Периодический закон и ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
Закономерности изменения свойств элементов и их соединений.
В периоде слева направо:
-
Радиус атома уменьшается;
-
Металлические свойства ослабевают;
-
Неметаллические свойства возрастают;
-
Восстановительные свойства ослабевают;
-
Окислительные свойства возрастают;
-
Электроотрицательность возрастает;
-
Число валентных электронов возрастает;
-
Основные оксиды через амфотерные сменяются кислотными.
В группе сверху вниз:
-
Радиус атома возрастает;
-
Металлические свойства возрастают;
-
Неметаллические свойства ослабевают;
-
Восстановительные свойства возрастают;
-
Окислительные свойства ослабевают;
-
Электроотрицательность уменьшается;
-
Число валентных электронов постоянно и равно номеру группы.
Тема №3: «Химическая связь».
Обязательный минимум знаний.
Типы химических связей:
-
Ковалентная полярная химическая связь (образуется между атомами неметаллов с разным значением электроотрицательности или между атомами металла и неметалла с небольшой разностью в значении электроотрицательности). Например: H2S, NH3.
-
Ковалентная неполярная химическая связь (образуется между атомами неметаллов с одинаковым значением электроотрицательности). Например: H2, O2, P4, S8.
-
Ионная химическая связь (образуется между атомами неметалла и металла). Например: NaCl, CaO, K2S.
-
Металлическая химическая связь – характерна для металлов и сплавов. Например: Al, Cu, бронза, чугун, латунь.
Тема №4: «Степень окисления химических элементов».
Обязательный минимум знаний.
Правила расчета степени окисления:
-
С.о. водорода = +1 в соединениях с неметаллами и = -1 в соединениях с металлами (гидриды металлов);
-
С.о. кислорода = -2, кроме пероксидов (-1) и фторидов (+2);
-
С.о. металла = заряду его иона (в таблице растворимости);
-
С.о. простого вещества = 0;
-
Сумма с.о. всех элементов в сложном веществе = 0;
-
С.о. иона = заряду иона (в таблице растворимости).
Алгоритм определения степени окисления элементов в бинарных соединениях:
-
Выбрать более электроотрицательный элемент и найти его степень окисления, как № группы – 8. Написать над ним степень окисления.
-
Умножить степень окисления на индекс у этого элемента. Полученное число со знаком «минус» подписать под другим элементом.
-
Такое же число со знаком «плюс» подписать под другим элементом.
-
Разделить это число на индекс другого элемента. Полученную степень окисления написать над элементом.
Алгоритм определения степени окисления неметалла в кислотах и солях:
-
Отделить кислород вертикальной чертой, записать сверху его степень окисления – 2 и умножить на индекс. Полученное число написать под кислородом.
-
Такое же число с противоположным знаком записать под левой частью формулы.
-
Вычесть из него число атомов водорода (для кислот) или заряд металла*индекс металла (для солей). Полученное число написать над знаком центрального элемента.
Тема №5: «Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура органических соединений».
Обязательный минимум знаний.
Классификация веществ
Металлы Неметаллы Оксиды Основания Кислоты Соли
Оксиды – бинарные соединения кислорода, в котором он проявляет степень окисления –2 (CaO, Al2O3).
Классификация оксидов.
Оксиды
несолеобразующие солеобразующие
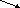
основные амфотерные кислотные
Несолеобразующие оксиды – не взаимодействуют с кислотами и щелочами и, как следствие, не образуют солей. Основные оксиды – образованы металлом в с.о.+1 и +2 (Na2O, MgO). Амфотерные оксиды – образованы металлами в с.о. +3 и +4 (Al2O3, PbO2). Исключения: ZnO, PbO, SnO, BeO (у них с.о. металла равна +2). Кислотные оксиды – образованы металлом в с.о.+5,+6,+7 или неметаллов, исключая несолеобразующие (SO3, CO2).
Основания – сложные соединения, в составе которых катион металла соединен с гидроксид-анионами: Me(OH)n. Например: NaOH, Ca(OH)2. Основания могут быть растворимыми и нерастворимыми. Растворимые в воде основания – щелочи (они окрашивают индикаторы).
Кислоты – сложные соединения, в составе которых атом водорода соединен с кислотным остатком (HCl, H2SO4). Кислотный остаток может состоять из одного элемента (Cl—) и быть сложным (SO4—).
Соли – сложные вещества, в составе которых катион металла соединен с кислотным остатком (NaCl, CaSO4).
Формулы и названия кислот и солей.
|
Формула кислоты |
Название кислоты |
Название соли |
Пример соли |
|
HF |
Фтороводородная (плавиковая) |
Фторид |
FeF3, фторид железа (III) |
|
HCl |
Хлороводородная (соляная) |
Хлорид |
CuCl2, хлорид меди (II) |
|
HBr |
Бромоводородная |
Бромид |
MgBr2, бромид магния |
|
HI |
Йодоводородная |
Йодид |
NaI, йодид натрия |
|
H2S |
Сероводородная |
Сульфид |
FeS, сульфид железа (II) |
|
H2SO3 |
Сернистая |
Сульфит |
Na2SO3, сульфит натрия |
|
H2SO4 |
Серная |
Сульфат |
BaSO4, сульфат бария |
|
HNO2 |
Азотистая |
Нитрит |
KNO2, нитрит калия |
|
HNO3 |
Азотная |
Нитрат |
Cu(NO3)2, нитрат меди (II) |
|
H2CO3 |
Угольная |
Карбонат |
CaCO3, карбонат кальция |
|
H2SiO3 |
Кремниевая |
Силикат |
Na2SiO3, силикат натрия |
|
H3PO4 |
Фосфорная |
Фосфат |
Ca3(PO4)2, фосфат кальция |
Тема №6: «Условия и признаки протекания химических реакций. Химические уравнения».
Обязательный минимум знаний.
Физические явления – явления, при которых состав вещества остается постоянным, а изменяется лишь его агрегатное состояние или форма и размеры тел. Примеры: плавление парафина, таяние льда, испарение воды.
Химические явления (химические реакции)– явления, при которых одни химические вещества превращаются в другие. Примеры: горение древесины, ржавление металлов, скисание молока.
Химическое уравнение – это условная запись химической реакции с помощью химических формул и коэффициентов.
Признаки химических реакций:
-
Изменение цвета;
-
Выделение тепла и света;
-
Выделение газа;
-
Растворение осадка;
-
Изменение запаха;
-
Выпадение осадка.
.
Тема №7: «Классификация химических реакций».
Обязательный минимум знаний.
Типы химических реакций по числу и составу исходных и полученных веществ:
-
Реакция разложения – это реакции, при которых из одного вещества образуется несколько других. Например: Cu(OH)2 → CuO + H2O
-
Реакция соединения – это реакции, при которых из нескольких веществ образуется одно. Например: S + O2 → SO2
-
Реакция обмена – это реакции, при которых два сложных вещества обмениваются своими составными частями. Например:
CuSO4 + BaCl2 → BaSO4 + CuCl2
-
Реакция замещения – это реакция между простым и сложным веществом, при которой атомы простого вещества, замещают атомы одного из элементов в сложном веществе. Например:
Zn + 2HCl → ZnCl2 + H2
Типы химических реакций по тепловому эффекту:
-
Экзотермические – протекают с выделением теплоты;
-
Эндотермические – протекают с поглощением теплоты.
По изменению степени окисления исходных веществ и продуктов реакции:
-
Окислительно-восстановительные реакции (ОВР) – реакции, протекающие с изменением степени окисления;
-
Не окислительно-восстановительные реакции – реакции, протекающие без изменением степени окисления;
По участию катализатора:
-
Каталитические – протекают с участием катализатора;
-
Некаталитические – протекают без участия катализатора.
По обратимости:
-
Обратимые – протекают в двух противоположных направлениях;
NaCl + HNO3 ↔ HCl +NaNO3
-
Необратимые – протекают только в одном направлении.
NaCl + AgNO3 → AgCl↓ + NaNO3
Тема №8: «Электролиты и неэлектролиты. Катионы и анионы».
Обязательный минимум знаний.
Электролиты – вещества, растворы которых проводят электрический ток. К электролитам относятся – растворимые кислоты, щелочи, соли.
Неэлектролиты – вещества, растворы которых не проводят электрический ток. К неэлектролитам относятся – нерастворимые кислоты, основания, соли; оксиды; органические вещества: раствор сахарозы, метанол, этанол, глюкоза.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 35.
Тема №9: «Электролитическая диссоциация кислот, щелочей и солей».
Обязательный минимум знаний.
Положения ТЭД:
-
При растворении в воде электролиты диссоциируют на положительные ионы (катионы) и отрицательные ионы (анионы).
-
Под действие электрического тока катионы движутся к катоду (-), анионы – к аноду (+).
-
Диссоциация – обратимый процесс.
-
Не все электролиты диссоциируют в равной мере.
-
Химические свойства электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Кислоты – электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Например: HCl → H+ + Cl—
Основания – электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. Например: NaOH → Na+ + OH—
Соли — электролиты, которые при диссоциации образуют катионы металла и анионы кислотного остатка. Например: NaCl → Na+ + Cl—
Это важно! При диссоциации индексы выносятся вперед ионов. Например: Al2(SO4)3 → 2Al3+ + 3SO42-
Тема №10: «Реакции ионного обмена и условия их осуществления».
Обязательный минимум знаний.
Взаимодействие кислот, оснований и солей

1р р
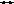
р
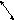
Алгоритм составления реакций ионного обмена:
-
Записать исходные вещества. Подписать классы веществ.
-
Проверить, являются ли они электролитами (по таблице растворимости). По схеме определить, возможна ли такая реакция.
-
Если возможно, над ионами в исходных веществах проставить заряды (по таблице растворимости).
-
Поменять правые части формул местами и записать, таким образом продукты реакции.
-
Правильно составить формулы продуктов. Для этого поставить заряды ионов, снести их крест-накрест и сократить, если нужно.
-
Расставить коэффициенты в уравнении
-
Под формулами продуктов реакции подписать, являются ли они электролитами или неэлектролитами.
-
Записать электролиты в виде ионов с учетом индексов и коэффициентов; неэлектролиты оставить в молекулярном виде.
-
В левой и правой части сократить одинаковые частицы.
-
Записать оставшиеся после сокращения ионы и молекулы.
Условия протекания реакций ионного обмена до конца (необратимо):
-
Образуется осадок.
-
Образуется газ.
-
Образуется малодиссоциируемое вещество, например вода.
Тема №11: «Химические свойства простых веществ: металлов и неметаллов».
Обязательный минимум знаний.
+ неметалл → соль или оксид (1)
+ Н2О → Ме(ОН)n+H2 (если Ме от Li-Al) (2)
+ Н2О → Ме2Оn+H2 (если Ме от Mn-Cd) (3)
Металл + кислота → соль (растворимая) + Н2 (Ме левее Н) (4)
+ соль → соль’ (растворимая)+ Ме (5)
+ Ме2Оn → Ме’ + Ме2Om (6)
-
. Образуется бинарное соединение. Металл пишется слева, неметалл справа. У металла с.о. равна +№ группы (есть исключения), у неметалла с.о. равна № группы — 8.Например: 2Са + О2 → 2Са+2О-2.
-
. Металлы от лития до натрия реагируют с водой при комнатной температуре, остальные – при нагревании. 2Na + 2H2O → 2NaOH + H2.
-
. Данная реакция протекает при нагревании. Zn + H2O → ZnO + H2.
-
.Данная реакция характерна только для разбавленных кислот. Металлы, стоящие в ряду напряжений после водорода, с разбавленными кислотами не взаимодействуют. Ещё одно условие данной реакции: в результате неё должна быть образована растворимая соль. Mg + 2HCl → MgCl2 + H2. Это важно!: азотная кислота по особому взаимодейстует с металлами (см. А.14).
-
. Zn + CuCl2 → ZnCl2 +Cu.
-
. 2Al + Cr2O3 → Al2O3 + 2Cr
Это важно! Особенности химических свойств некоторых металлов:
1. Особенности щелочных металлов (Li, Na, K):
-
При взаимодействии с кислородом литий образует оксид Li2O, натрий образует пероксид Na2O2: 2Na + O2 → Na2O2.
-
С растворами кислот и солей не взаимодействуют, т.к. в первую очередь будут вступать в реакцию с водой.
2. Особенности алюминия:
-
При обычных условиях малоактивен, т.к. покрыт прочной оксидной пленкой Al2O3 (большинство реакций идут при нагревании);
-
Является амфотерным металлом, поэтому взаимодействует не только с растворами кислот, но и с щелочами, образуя соль — алюминат:
2Al+2NaOH+2H2O→2NaAlO2+3H2↑
-
На холоду не взаимодействует с концентрированными серной и азотной кислотами (пассивируется).
3. Особенности железа:
-
Для железа характерно образование двух соединений: Fe2+ и Fe3+;
-
Образование соединений железа:
|
+2 |
+3 |
|
1). С неметаллами |
|
|
Fe + S → FeS |
2Fe + 3Cl2 → 2FeCl3 |
|
3Fe + 2O2 → Fe3O4 |
|
|
2). C водой: |
|
|
3Fe + 4H2O → Fe3O4 + 4H2↑ |
|
|
3). С кислотами |
|
|
Fe + 2HCl → FeCl2 + H2↑ |
|
|
4). С солями: |
|
|
Fe + СuSO4 → FeSO4 + Cu |
Тема №12: «Химические свойства оксидов: основных, амфотерных, кислотных».
Обязательный минимум знаний.





Это важно! Амфотерные оксиды будут сочетать свойства основных и кислотных оксидов, т.е. будут вступать в реакции с щелочами и кислотами.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 40.
Тема №13: «Химические свойства оснований».
Обязательный минимум знаний.
+ кислотный оксид → соль + H2O
Щелочи + кислота → соль + H2O
Основания + соль → соль + основание (↑,↓)
Нерастворимые + кислота → соль + H2O
нагревание → МеО + H2O
Тема №14: «Химические свойства кислот».
Обязательный минимум знаний.
+ Ме (до Н) → соль + Н2
+ основный/амфотерный оксид → соль + Н2О
Кислота + основание/амфотерный гидроксид → соль + Н2О
+ соль → соль + кислота (↓,↑)
!Особенности взаимодействия азотной кислоты с металлами:
-
Водород никогда не выделяется;
-
Металл в полученном нитрате имеет максимальную степень окисления;
-
На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni.
-
Продукты реакции зависят от двух факторов:
-
Активность металла;
-
Концентрация кислоты.
HNO3 (к) + Ме (I, II группа, гл.подгр.) → нитрат + N2O + H2O
HNO3 (к) + Ме (остальные) → нитрат + NO2 +H2O
HNO3 (р) + Ме (I, II группа, гл.подгр.) → нитрат + NH3 (или NH4NO3) + H2O
HNO3 (р) + Ме (остальные) → нитрат + NO + H2O
Например:
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 38.
Ag + 2HNO3 (к) → AgNO3 + NO2 + H2O.
!Особенности химических свойств концентрированной серной кислоты:
-
С металлами:
-
Может взаимодействовать с металлами, стоящими в ряду напряжений после водорода;
-
Металл в полученном сульфате имеет максимальную с.о.
-
Водород никогда не выделяется;
-
На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni.
H2SO4 (к) + Me (I, II группа, гл.подгр, Zn) → сульфат + H2S/S/SO2 +H2O
H2SO4 (к) + Me (остальные) → сульфат + SO2 + H2O.
-
С неметаллами:
2H2SO4 (к) + C → CO2 + 2SO2 + 2H2O
2H2SO4 (к) + S → 3SO2 + 2H2O
-
С органическими веществами: обугливает бумагу, ткань, древесину, сахарозу.
Тема №15: «Химические свойства солей».
Обязательный минимум знаний.
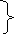
+ кислота → соль + кислота’
Соли + щелочь → соль + основание’ (↑,↓).
+ соль → соль + соль’
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 41.
Тема №16: «Первоначальные представления об органических веществах».
Обязательный минимум знаний.
Общие признаки органических веществ:
-
Наличие углерода;
-
Наличие в молекулах только ковалентных связей;
-
Валентность углерода всегда равна четырем.
Основные классы органических веществ.
-
Предельные углеводороды (алканы). Общая формула CnH2n+2. Важнейшие представители алканов:
|
Формула |
Название |
|
CH4 |
Метан |
|
C2H6 |
Этан |
|
C3H8 |
Пропан |
|
C4H10 |
Бутан |
|
C5H12 |
Пентан |
Характерные реакции: замещение и окисление.
-
Непредельные углеводороды (алкены). Общая формула CnH2n. Важнейшие представители:
|
Формула |
Название |
|
C2H4 |
Этен (этилен) |
|
C3H6 |
Пропен (пропилен) |
|
C4H8 |
Бутен |
|
C5H10 |
Пентен |
Особенность строения: наличие двойной С-С связи. Характерные реакции: присоединения и окисления.
-
Непредельные углеводороды (алкины). Общая формула CnH2n-2. Важнейшие представители:
|
Формула |
Название |
|
C2H2 |
Этин (ацетилен) |
|
C3H4 |
Пропин |
|
C4H6 |
Бутин |
|
C5H8 |
Пентин |
Особенность строения: наличие тройной С-С связи. Характерные реакции: присоединения и окисления.
-
Спирты. Общая формула CnH2n+1ОН. Важнейшие представители:
|
Формула |
Название |
|
CH3ОН |
Метанол (метиловый спирт) |
|
C2H5ОН |
Этанол (этиловый спирт) |
|
C3H5(ОН)3 |
Глицерин |
-
Карбоновые кислоты. Общая формула CnH2n+1СООН. Важнейшие представители:
|
Формула |
Название |
|
НСООН |
Муравьиная кислота |
|
CH3СООН |
Уксусная кислота |
|
C17H35СООН |
Стеариновая кислота |
Характерны все свойства кислот (взаимодействие с металлами, оксидами металлов, основаниями, солями).
Тема №17: «Чистые вещества и смеси. Правила безопасной работы в школьной лаборатории. Разделение смесей и очистка веществ».
Обязательный минимум знаний.
Химические формулы соответствуют чистым веществам. Все изучаемы в школьном курсе способы разделения смесей относятся к физическим.
Смесь – многокомпонентная система (воздух, нефть, морская вода, стекло, бронза, молоко, лимонад).
Смеси бывают однородными (нельзя увидеть границу раздела между веществами): раствор сахара в воде и неоднородными (видна граница раздела между веществами): взвесь мела в воде.
Способы разделения неоднородных смесей:
-
Отстаивание (этим же методом можно разделить две несмешивающиеся жидкости с помощью делительной воронки). Ускоряют отстаивание центрифугированием;
-
Фильтрование;
-
Некоторые твердые смеси можно разделить при помощи магнита (смесь железных и медных опилок, смесь железных опилок и серы).
Способы разделения однородных смесей:
-
Выпаривание;
-
Перегонка (дистилляция).
Некоторые правила безопасной работы в химической лаборатории:
-
При растворении серной кислоты нужно вливать её тонкой струей в воду и перемешивать;
-
При работе с растворами едких веществ необходимо надевать защитные перчатки и очки;
-
Воспламенившиеся ЛВЖ (нефть, спирт, ацетон) необходимо тушить песком;
-
Опыты с получением токсичных газообразных веществ (SO2, H2S, NO2) необходимо проводить в вытяжном шкафу.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008 г., § 23.
Тема №18: «Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе и на газообразные вещества».
Обязательный минимум знаний.
Индикаторы
|
Кислая |
Нейтральная |
Щелочная |
|
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
Лакмус |
красный |
фиолетовый |
синий |
|
Метилоранж |
розовый |
оранжевый |
желтый |
Качественные реакции
|
Хлорид-ион Cl— |
+ Ag+ → AgCl↓ белый творожистый осадок |
|
Сульфат-ион SO42- |
+ Ba2+ → BaSO4↓ белый осадок |
|
Карбонат-ион CO32- |
+ H+ → CO2↑+H2O выделение газа + Ca2+ → CaCO3↓ белый осадок |
|
Ион аммония NH4+ |
+ OH— → NH4OH при нагревании запах аммиака |
|
Кислород O2 |
Загорание тлеющей лучины |
|
Водород H2 |
Хлопок при поднесении горящей лучины |
|
Углекислый газ CO2 |
Горящая лучина гаснет |
|
Аммиак NH3 |
По запаху; посинение влажной лакмусовой бумаги; появление белого дыма при внесении палочки, смоченной соляной кислотой («дым без огня»). |
Тема №19: «Вычисление массовой доли химического элемента в веществе».
Обязательный минимум знаний.
Вычисления производятся по следующей формуле:
ω = Ar∙n/Mr ∙ 100%, где Ar – атомная масса химического элемента; n – число атомов того элемента, массовая доля которого находится; Mr – молярная масса молекулы. Например: вычислите массовую долю кислорода в карбиде натрия. Решение:
1. Составляем формулу карбида натрия: Na4C.
2. Ar(Na)=23 г/моль; n(Na)=4; Mr(Na4C)=104г/моль.
3. Подставляем в формулу и вычисляем: ω(Na)=23∙4/104 ∙100% = 88,5%
4. Ответ: 88,5%.
Задания части В.
Тема №1: «Периодический закон Д. И. Менделеева».
Обязательный минимум знаний.
См. тема №2 части А.
Тема №2: «Химические свойства простых веществ и оксидов».
Обязательный минимум знаний.
Химические свойства неметаллов.
|
Как окислитель |
Как восстановитель |
|
|
H2 |
Щелочные металлы |
НеМе и МеО |
|
O2 |
Ме, неМе (большинство), неМеО (в которых степень окисления неМе не max) |
F2 |
|
Галогены (F2, Cl2, Br2) |
Ме, H2 |
— |
|
S |
Ме, H2 |
O2, галогены, H2SO4 (к), HNO3(к) |
|
N2 |
Ме (в обычных условиях только с литией, с остальными – при нагревании), H2(при нагревании и давлении) |
O2 (при температуре электрической дуги), галогены. |
|
P |
Ме, H2 |
O2, галогены, HNO3(к) |
|
C |
Ме, H2 |
O2, галогены, МеО, H2SO4(к), HNO3(к) |
|
Si |
Ме, H2 |
O2, галогены, щелочи |
+ см. тема № 12 части А.
Тема №3: «Окислительно-восстановительные реакции».
Обязательный минимум знаний.
Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых атомы меняют степени окисления.
Восстановитель – элемент, отдающий электроны (в ОВР его степень окисления повышается). Им может быть атом, ион, имеющий минимальную или промежуточную степень окисления. Например: Zn0 – 2e— = Zn+2.
Окислитель – элемент, принимающий электроны (в ОВР его степень окисления понижается). Им может быть атом, ион, максимальную или промежуточную степень окисления. Например: S0 + 4e— = S+4.
Атом или ион, имеющий промежуточную степень окисления, может проявлять как восстановительные, так и окислительные свойства, т.е. проявлять окислительно-восстановительную двойственность. Для элементов главных подгрупп максимальная степень окисления = +№ группы; минимальная № группы – 8.
Восстановление – процесс принятия электронов.
Окисление – процесс отдачи электронов.
+ см. тема №4 части А.
Тема №4: «Химические свойства кислот, оснований и солей».
Обязательный минимум знаний.
см. тема №13, 14, 15 части А.
Задания части С.
Тема №1: «Взаимосвязь различных классов неорганических веществ».
Обязательный минимум знаний.
Схема генетической связи веществ.
+O2 +H2O
металл основной оксид основание соль
неметалл кислотный оксид кислота соль
+O2 +H2O
Дополнительная информация: Габриэлян О. С., Химия 8 кл., 2008г., § 42.
Тема №2: «Вычисление массовой доли растворенного вещества в растворе».
Обязательный минимум знаний.
Алгоритм решения расчетных задач на нахождение массы выпавшего осадка по уравнению реакции:
-
Составить уравнение реакции, уравнять его.
-
По таблице растворимости определить в правой части реакции осадок, обозначить его ↓.
-
Рассчитать массу вещества в растворе по формуле:
m(вещества) = m(раствора)∙ω.
-
Рассчитать количество вещества по формуле: n = m/M.
-
По уравнению реакции определить количество вещества того вещества, которое выпало в осадок.
-
Рассчитать массу осадка по формуле: m = M·n.
Пример. К 80 г раствора с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди (II). Определите массу выпавшего осадка.
Решение.
-
Составляем уравнение реакции: NaOH + CuSO4 → Na2SO4 + Cu(OH)2.
-
По таблице растворимости определяем, что в осадок выпадает гидроксид меди(II), тогда уравнение реакции принимает вид: NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓.
-
Рассчитаем массу NaOH по формуле m(вещества) = m(раствора)∙ω:
m(NaOH)=80г · 0,05= 4г.
-
Рассчитаем количество вещества NaOH по формуле m = M·n:
n(NaOH)= 4г/40г/моль=0,1моль.
-
По уравнению реакции определяем (по коэффициентам перед веществами), что n(Cu(OH)2)=1/2n(NaOH)→n(Cu(OH)2)=0,05моль.
-
Рассчитаем массу Cu(OH)2 (осадок) по формуле m = M·n:
m(Cu(OH)2)= 98г/моль∙0,05моль = 4,9г.
Ответ: 4,9 г.
Необходимые формулы:
-
m = M·n; n = m/M.
-
m(в-ва)=m(р-ра)·ω; m(р-ра)=m(в-ва)/ω.
-
V=Vm·n; n=V/Vm.
В статье мы подготовили правила и советы для подготовки к ОГЭ по химии. Вы узнаете, как лучше готовиться — самостоятельно или на онлайн-курсах. А также расскажем, что лучше повторить за год, 1-2 месяца и неделю до экзамена.
В 2023 году химия по-прежнему остается предметом по выбору. Работа по ней состоит из 2 частей и 24 вопросов с кратким или развернутым ответом, в том числе 14 – базового уровня сложности, 5 – повышенного, 5 – высокого. Примеры заданий:
- Выбрать правильные варианты из предложенных.
- Установить последовательность или соответствие.
- Написать уравнение реакции.
- Составить химическую формулу.
- Вычислить массовую долю вещества и т. д.
Самое сложное задание – пункт 24, проведение химического эксперимента. Под наблюдением экспертов школьнику необходимо смешать реактивы, зафиксировать реакции и сделать выводы.
В структуру экзамена входят тематические блоки:
- Периодическая система Менделеева.
- Строение химических элементов.
- Электроотрицательность, валентность, ионная и металлическая связь.
- Основы неорганической химии.
- Безопасное использование химических веществ в жизни.
На ОГЭ по химии можно пользоваться:
- непрограммируемым калькулятором;
- таблицами – периодической системой Менделеева, электрохимическим рядом напряжения металлов, растворимостью в воде солей, кислот и оснований;
- черновиком.
Время выполнения ОГЭ – 180 минут. Чтобы сдать экзамен, нужно не только хорошо знать теорию, но и иметь практические навыки для проведения лабораторной работы (п. 24). Ниже расскажем подробнее, как подготовиться к ОГЭ по химии.
В каких случаях можно готовиться к экзамену по химии самостоятельно:
- Вы хорошо знаете школьную программу за 7-8 классы.
- Вы начинаете подготовку заранее – за несколько месяцев до ОГЭ.
- Разобраться со сложной темой вам помогут родители или учитель в школе.
Не все школьники могут хорошо подготовиться к экзаменам без помощи преподавателя или репетитора. По каким причинам самоподготовка оказывается неэффективной:
- Нет самодисциплины – сложно заставить себя заниматься регулярно, скучно сидеть над учебниками, нет желания долго разбираться с ошибками и трудными задачами и т. д. Кроме того, не всегда удается объективно оценить уровень своих знаний.
- Нет понимания того, как нужно выполнять задания с развернутым ответом. Важно не только, к примеру, составить уравнение химической реакции, но и правильно оформить решение (аргументировать или описать процесс). Некоторые нюансы ОГЭ знают только опытные педагоги.
- Нет подходящих учебных материалов. Учебников, пособий, онлайн-сервисов много. Трудно выбрать те, которые действительно подходят для подготовки к ОГЭ. Часто в интернете публикуют электронные книги с устаревшей информацией.
Подборка курсов
Онлайн-курсы подготовки к ОГЭ по химии в 2023 году
Посмотреть подборку
Чтобы изучить всю школьную программу по химии за 7-9 классы с нуля и подготовиться к ОГЭ, нужно:
- Начинать подготовку заранее, желательно с первых месяцев 9 класса.
- Заниматься регулярно – хотя бы 1 раз в неделю по 2 часа.
- Пользоваться литературой, которая одобрена или составлена экспертами ФИПИ. В ней содержится актуальная достоверная информация, в то время как в других источниках могут быть ошибки и разночтения.
Вы можете учиться самостоятельно или с репетитором, но самый удобный и эффективный способ подготовки к ОГЭ – это онлайн-курсы. Расскажем об их преимуществах:
- Занятия ведут опытные педагоги. Они доступным языком, подробно и последовательно объяснят все темы из кодификатора, покажут примеры решения задач, разберут экзаменационные задания прошлых лет, расскажут о специфике ОГЭ и проведут эксперименты в прямом эфире.
- На курсах у вас будет не только теория, но и практика: домашние задания после каждой темы, промежуточные проверочные работы, пробные варианты ОГЭ, по которым вы получите обратную связь (разбор ошибок и рекомендации).
- График может быть индивидуальным. Занятия не только проводят онлайн, но и записывают. Если вы не сможете подключиться к прямой трансляции, то посмотрите запись урока в свободное время. Такой формат обучения удобно совмещать с основной учебой, спортивными секциями, хобби и т. д.
- Все видеозаписи хранятся в личном кабинете, доступ к ним остается навсегда. Для просмотра нужен только ноутбук или планшет с выходом в интернет, поэтому заниматься можно в любых условиях (дома, в выходные на даче и т. д.). Если у вас возникнут вопросы, то вы сможете написать в чат куратору и в течение дня получите ответ.
Инструкция о том, как быстро подготовиться к ОГЭ:
- Изучите официальные документы – кодификатор, спецификацию и демонстрационную версию прошлого и 2023 года. Их можно скачать на сайте ФИПИ.
- Сделайте чек-лист – какие темы из кодификатора вы знаете хорошо, а какие нужно повторить или разобрать с нуля.
- Выполните все задания из демоверсии и посчитайте, сколько баллов вы набрали. Сопоставьте результаты с вашим чек-листом и при необходимости дополните его.
- Составьте план подготовки – в каком порядке вы будете проходить темы, сколько раз в неделю заниматься, как именно готовиться (самостоятельно, с репетитором и т. д.).
- Выберите литературу: учебники, рабочие тетради, сборники схем и таблиц и т. д. На онлайн-курсах все учебные материалы и конспекты будут в вашем личном кабинете – в этом случае ничего дополнительно покупать или скачивать не нужно.
- Регулярно проверяйте свои знания. Для этого можно проходить онлайн-тесты на сайтах «Яндекс.Репетитор» или «Сдам ГИА». Если вы постоянно ошибаетесь в одних и тех же заданиях, значит, плохо разобрались с теорией – еще раз прочитайте параграф и посмотрите примеры.
Можно ли выучить химию за год
Опытные педагоги и эксперты по ОГЭ рекомендуют начинать подготовку к химии за год:
- За это время вы успеете вспомнить пройденный материал за предыдущие пару лет и изучить новые темы девятого класса.
- Вы научитесь решать задачи повышенного и высокого уровня сложности, сможете потренироваться на олимпиадных или вузовских заданиях.
- У вас будет несколько месяцев, чтобы подготовиться не только к ОГЭ по химии, но и к экзаменам по другим предметам. Вам не придется в спешке заниматься несколькими предметами параллельно – достаточно будет посвятить каждой дисциплине 1-2 часа в неделю.
Несколько рекомендаций о том, как выучить химию за год:
- Проходите темы последовательно, начиная с 7 класса – в первую очередь повторите азы.
- Сначала разберитесь с теорией, потом приступайте к практике. Не стоит сразу проходить тесты, так как вы рискуете ответить наугад.
- Ведите конспекты. Информацию можно вносить в таблицу, составлять графики, схемы, рисунки. Во-первых, так вы лучше запомните материал, во-вторых, формулы, свойства веществ и другие важные сведения будут собраны в одном месте.
Большинство онлайн-курсов рассчитаны на 8-9 месяцев, то есть длятся с начала и до конца 9 класса. Вы сможете готовиться к экзаменам параллельно с основной учебой, разберетесь со сложными темами и заданиями и пройдете несколько пробных вариантов ОГЭ. Главный плюс курсов – это структурированная подача материала и последующая отработка на практике. На занятиях дают только те знания, которые понадобятся на экзамене, без «воды».
Что повторить за 1-2 месяца до экзамена
Что можно сделать за один или два месяца до ОГЭ по химии:
- Устройте себе пробный экзамен по заданиям из демоверсии прошлых лет. Во-первых, вы проверите, успеваете ли решить все задачи за 3 часа. Во-вторых, узнаете, какие темы вызывают сложности. За 4-6 недель вы успеете закрыть пробелы в знаниях.
- Научитесь пользоваться разрешенными шпаргалками. На экзамене у вас будет несколько таблиц: Менделеева, растворимость солей/кислот и др. Почитайте, как и в каких задачах они вам помогут.
- Пройдите экспресс-курсы, если не уверены в своих знаниях. Для этого выбирайте программу, которая состоит из уроков в записи. Так вы сможете заниматься в ускоренном темпе – 2-3 раза в неделю. Доступ к новой теме открывают сразу после того, как вы сдаете домашнее задание по прошлому уроку. За 1,5-2 месяца повторите школьный материал и потренируетесь решать все задачи из кодификатора.
Как готовиться за неделю до ОГЭ
Как лучше готовиться за неделю до экзамена:
- Почитайте конспекты, которые вы составили самостоятельно или получили на онлайн-курсах. Важные таблицы, схемы, графики повесьте над рабочим столом, чтобы они были у вас перед глазами.
- Посмотрите видеоразборы демонстрационных версий за прошлый и 2023 год. Возможно, вы узнаете новую информацию: распространенные ошибки, правила оформления, лайфхаки и т. д.
- Если какие-то темы до сих пор вызывают у вас сложности, обратитесь за помощью к репетитору или школьному учителю.
Не стоит откладывать подготовку на последний день. Накануне экзамена лучше как следует отдохнуть, выспаться, морально подготовиться, чтобы из-за невнимательности, волнения или недосыпа не наделать ошибок.
Нас с детства интересуют различные опыты. Задумываемся ли мы над тем, что, заваривая себе чай, мы проводим один из них?
Химия – это увлекательный и интересный предмет, именно поэтому его выбирают девятиклассники. К тому же, он начинается в восьмом классе. Но предмет достаточно сложный. В этой статье мы расскажем, как сдать химию на «пятерку».
Содержание
- Структура экзамена
- Оценивание заданий ОГЭ по химии
- План подготовки к ОГЭ по химии в 2021
- Система подготовки к экзамену
- Темы для подготовки к ОГЭ по химии
- Материалы для подготовки

Структура экзамена
В новом учебном году появилась практическая часть по химии, которая является обязательной для всех учеников, сдающих экзамен по химии.
По данным ФИПИ в КИМе этого года предусмотрено увеличение числа заданий на сопоставление и уменьшение тестов с выбором ответа. Всего имеется 24 задания, 14 из них относятся к базовому, пять к повышенному, оставшиеся – к высокому уровню сложности.
Каждый ученик хочет получить максимальный результат. Как подготовиться к химии, чтобы его достичь? Этот вопрос интересует многих. В 2021 году максимум равняется 40 баллам. Для выпуска из школы необходимо набрать не менее 10. Всё очень просто!
Оценивание заданий ОГЭ по химии
Подготовиться к ОГЭ по химии, не зная критерии проверки невозможно! Но они достаточно просты и понятны.
За каждый верный ответ ученики получают «первичные баллы». Вы получаете два первичных балла за 4, 9-10, 12, 17. 3 балла начисляются за 20, 22. За задание с практической частью — 4 основных балла. Остальные оцениваются в один.
Для того, чтобы набрать желаемое количество, нужно составить план, как подготовиться к ОГЭ по химии.
План подготовки к ОГЭ по химии в 2021
Сдать «на отлично» можно! Нужно как можно скорее начинать учить. Логичнее всего разбирать каждую тему постепенно.
- Прежде всего рекомендуем изучить и разобрать актуальную демоверсию, а также кодификатор;
- Соберите все необходимые материалы;
- Составьте примерный график подготовки к экзамену с учетом прописанных в кодификаторе тем;
- Далее – изучение тем и закрепление информации на практике.
Мы советуем вам вести учет вашего прогресса, а также систематически решать пробные варианты.
Система подготовки к экзамену
Как подготовиться к ОГЭ по химии, если не учили ничего до этого? Начните с основных понятий. Изучите степени окисления веществ и связи между ними. А также другие вопросы. Освоив это, трудные темы станут намного легче.
Не стоит упускать из виду учебник 8 класса, например, под редакцией Н. Е. Кузнецовой или В. В. Ерёмина, ведь именно в этот учебный год изучаются все основные темы, знания по которым могут пригодиться. Тем, кто планирует продолжить обучение в школе и собирается сдавать ЕГЭ, рекомендуем сборник К. А. Егорова «Репетитор по химии», с подробными темами всего курса.
После изучения теории, знания нужно закрепить на практике.
Сейчас мы расскажем вам, как последовательно подготовиться к ОГЭ по химии.
Этапы подготовки:
- пройдитесь по теории на каждую тему;
- просмотрите видеоуроки по ней;
- решайте всевозможные упражнения по выбранному разделу.
Если при выполнении заданий вы все еще допускаете неточности, вернитесь к изучению теоретического материала и разберите с учителем вопросы, которые вызывают у вас трудности. Поняв структуру химических процессов, представленных в задачах, вы заметите, что ваш балл заметно возрастет.

Темы для подготовки к ОГЭ по химии
Сама тематика не изменялась уже очень давно, так как основана на проверке теоретических знаний и умений, которые были получены в последние годы обучения.
Как эффективнее подготовиться к ОГЭ по химии?
Вам следует повторить названия всех элементов, их положение в таблице Менделеева. Знать условия изменения свойств атомов элементов, формулы веществ, а также виды связей в различных соединениях. Повторить органические и неорганические вещества и всё, что связано с ними. Полностью пройтись по разделу, связанному с химическими реакциями. Для успешного выполнения 8 и 22 заданий следует уделить внимание реакциям ионного обмена.
Особую сложность может возникнуть при решении задания под номером 13. В его состав множество тем: правила безопасности в лаборатории, обращение с различными веществами, приготовление растворов, а также загрязнение окружающей среды.
Это основные темы, которые нужно рассмотреть перед экзаменом, следует повторить каждый раздел, любой вопрос может встретиться в КИМе. Поэтому следует как можно тщательнее подготовиться к ОГЭ по химии.
Материалы для подготовки
Книги и справочники очень важны в процессе изучения. Что следует знать и учить, чтобы как можно лучше подготовиться к ОГЭ по химии? Нужно повторить весь школьный курс, поэтому советуем начать подготовку как можно раньше:
- Соберите проверенные теоретические материалы. Специалисты-разработчики рекомендуют для приобретения расширенную версию ФИПИ. В них анализируются наиболее сложные задания, представлены пояснения и ответы на часто задаваемые вопросы. Хорошим дополнением станут издательства Н. Е. Кузнецова или В. В. Еремина. Кроме того, материал хорошо представлен в учебнике А. Егорова.
- Выделяйте наиболее сложные темы.
- Материал лучше всего моментально закреплять на практике.
- При возникновении сложных ситуаций с конкретными темами, найдите репетитора.
Обращаем внимание на сборник «Типовые варианты экзаменационных заданий», разработанный Ю. Н. Медведевым, А.С. Корощенко, Г. Н. Молчановой, а также Елены Савинковой. С помощью вышеупомянутых пособий вы узнаете, как правильно подготовиться к ОГЭ по химии.
Больше читайте и практикуйте полученные знания. Изучайте каждый день что-то новое и повторяйте пройденное. Это поможет вам как можно лучше подготовиться к ОГЭ по химии. Кроме того, хорошие знания обеспечат вам уверенность и вы легче справитесь с волнением.













