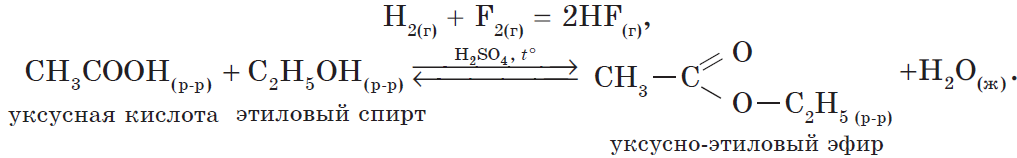Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли.
Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В
этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении
химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты
(в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются
исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными
оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
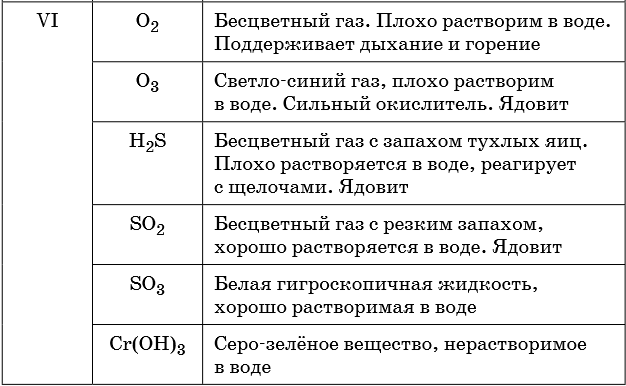
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3,
Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и
кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что
СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2,
SO3, P2O5, N2O3, NO2, N2O5, SiO2,
MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять
степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой,
так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)

Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования.
К таким оксидам относят:
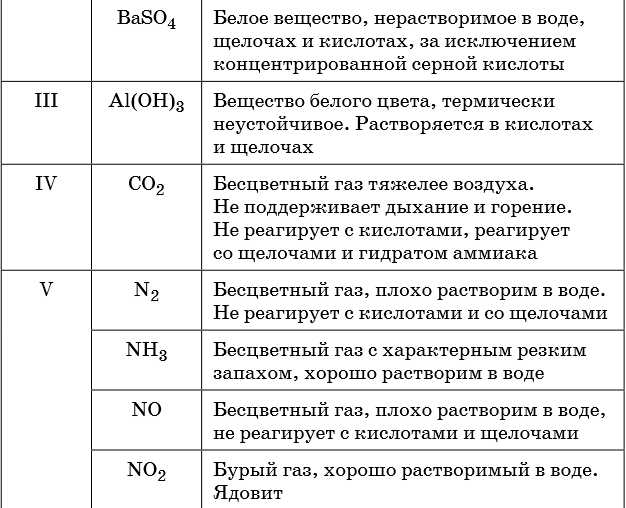
- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей.
Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов.
Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания
способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет.
Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH,
которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли
и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких
температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации
кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию
с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз.
В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не
обманешь 
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными
гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается
металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат
лития, дигидрофосфат и гидрофосфат натрия) - Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4]
(тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)

Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в
избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода),
то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
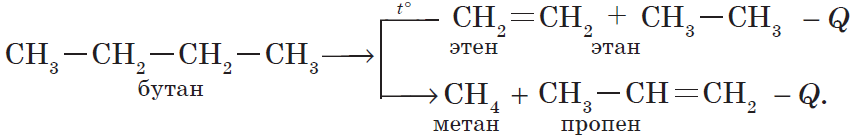
1.4.1. Классификация химических реакций в неорганической и органической химии.
Классификация химических реакций на основании их признаков.
Классификационный признак |
Тип реакции |
Число и состав реагентов и продуктов |
соединенияв результате таких реакций из двух или более исходных веществ образуется только один продукт, например: С + O2 = CO2 4NO2 + O2 + 2H2O = 4HNO3 |
разложенияв таких реакциях из одного вещества образуется два или больше других веществ: 2KMnO4 = K2MnO4 + MnO2 + O2 CaCO3 = CaO + CO2 |
|
замещенияВсе реакции, в результате которых из простого и сложного веществ образуется другое простое и другое сложное вещества. Например: Zn + CuSO4 = ZnSO4 + Cu
|
|
обменаРеакциями обмена называют такие реакции, в результате которых вещества меняются своими составными частями. Например: 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 Частный случай реакции обмена между кислотой и основанием носит также название реакции нейтрализации: NaOH + HCl = NaCl + H2O
|
|
Изменение степеней окисления химических элементов |
окислительно-восстановительныев результате таких реакций изменяются степени окисления одного или более химических элемента. Например: |
Реакции, протекающие с сохранением степеней окисления атомов всех химических элементов |
|
Обратимость |
обратимыетакие реакции обладают способностью протекать как в прямом, так и обратном направлении. Реакции, про которые обязательно нужно знать, что они обратимые: |
необратимыеТакие реакции протекают только в прямом направлении. Если речь идет о реакциях между электролитами, то необратимой реакция является в том случае, если образуется осадок, газ или малодиссоциирующее вещество. Например: Na2CO3 + 2HCl = 2NaCl + H2O + CO2 В качестве малодиссоциирующих веществ в реакциях ионного обмена могут образоваться вода, слабые кислоты, гидроксид аммония. |
|
Тепловой эффект |
экзотермическиеВ результате таких реакций выделяется энергия в виде теплоты. Обозначают такие реакции, добавляя «+Q» к уравнению реакции, например: |
эндотермическиеПри протекании таких реакций поглощается тепло. Для обозначения таких реакций пишут «-Q» в уравнении реакции. Практически все реакции разложения являются эндотермическими: Исключения: реакции разложения HI и NO являются экзотермическими. |
|
Количество фаз |
гомогенныеГомогенными реакциями называют такие реакции, реагенты в которых находятся в одной фазе. Примерами таких реакций могут быть многие реакции протекающие в растворах, реакции между газообразными веществами: NaOH (р-р) + HCl(р-р) = NaCl + H2O 2CO + O2 = 2CO2 В гомогенных реакциях не наблюдаются границы раздела между реагентами |
гетерогенныегетерогенными реакциями называют такие реакции, в которых реагирующие вещества находятся в разных фазах. Примерами таких реакций являются, взаимодействие цинка с раствором соляной кислоты, взаимодействие углекислого газа с известковой водой, и т.д.: |
|
По участию катализатора |
каталитическиереакции, протекающие в присутствии катализатора:
|
некаталитическиереакции, протекающие без катализатора: |
Классификация химических реакций в органической химии:
Реакции присоединения |
В зависимости от того, какое соединение присоединяется органическим веществом различают:
Гидрирование — присоединение водорода:Гидратация — присоединение воды:Гидрогалогенирование — присоединение галогеноводорода:
|
Реакции замещения |
Под реакциями замещения в органической химии подразумевают такие реакции, в результате протекания которых происходит замена одного заместителя (или атома водорода) непосредственно прикрепленного к углеродному скелету на другой заместитель. Так, например, реакциями замещения являются: Галогенирование алканов:Нитрование углеводородов:Реакция спиртов с галогеноводородными кислотами:C2H5OH + HBr = C2H5Br + H2O и т.д. |
Реакции отщепления (элиминирования) |
Все реакции, в названии которых присутствует приставка «де-«: дегидрирование:дегидратация:дегидрогалогенирование:(от исходной молекулы бромэтана отщепляется бромоводород, который нейтрализуется щелочью) дегалогенирование:Также к реакциям отщепления (элиминирования) относят крекинг — процесс термического превращения углеводородов в соединения с меньшей длинной углеродного скелета. Например, крекинг алканов, уравнение которого в общем виде можно записать как: |
Окислительно-восстановительные реакции |
Реакции, при которых изменяется степень окисления одного или нескольких атомов углерода углеродного скелета. Окисление органического соединенияВ таких реакциях отдельные атомы углерода повышают свою степень окисления. Например: Восстановление органического соединенияЧаще всего под восстановлением органических веществ понимают их взаимодействие с водородом. Например: CH3-CH=O + H2 => CH3-CH2-OH |
Реакции с сохранением качественного и количественного состава веществ |
Изомеризация |
Реакции протекающие по тем или иным механизмам |
Реакции протекающие по ионному механизмуВ таких реакциях активными действующими частицами являются ионы. Следует помнить, что по ионному механизму протекают такие реакции как:
|
Реакции протекающие по радикальному механизмуВ таких реакциях активными действующими частицами являются свободные радикалы:
|
Все реакции из заданий 32, которые могут вызвать затруднения при составлении. На ЕГЭ 99% реакций в заданиях 32 будут либо они, либо аналогичные.
1) Si + 2Cl2 SiCl4
2) SiCl4 + 3H2O H2SiO3 + 4HCl
3) Ca3(PO4)2 + 5C + 3SiO2 2P + 5CO + 3CaSiO3
4) Ca3N2 + 6H2O 3Ca(OH)2 + 2NH3↑
5) 2NH3 + 3CuO 3Cu + 3H2O + N2↑
6) Cu + 4HNO3(конц.) Cu(NO3)2 + 2NO2↑ + 2H2O
7) 2Cu(NO3)2 2CuO + 4NO2 + O2↑
4FeS + 7O2
2Fe2O3 + 4SO2↑
9) 2H2S + SO2 3S↓ + 2H2O
10) S + 6HNO3 H2SO4 + 6NO2↑ + 2H2O
11) 4Al(NO3)3 2Al2O3 + 12NO2↑ + 3O2↑
12) 2Al2O3 4Al + 3O2↑ (электролиз раствора Al2O3 в расплаве криолита)
13) 3KNO3 + 8Al + 5KOH + 18H2O 3NH3↑ + 8K[Al(OH)4]
14) CrO3 + 2KOH K2CrO4 + H2O
15) 2K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O
16) 14HBr + K2Cr2O7 2CrBr3 + 3Br2 + 7H2O + 2KBr
17) H2S + Br2 S↓ + 2HBr
18) 3Mg + N2 Mg3N2
19) Mg3N2 + 6H2O 3Mg(OH)2↓ + 2NH3↑
20) Cr2(SO4)3 + 6NH3 + 6H2O 2Cr(OH)3↓ + 3(NH4)2SO4
21) 2Cr(OH)3 + 4KOH + 3H2O2 2K2CrO4 + 8H2O
22) 2Ag + 2H2SO4(конц.) Ag2SO4 + SO2↑ + 2H2O
23) 2KClO3 2KCl + 3O2↑ (в присутствии кат-ра)
24) 3Fe + 2O2 Fe3O4
25) Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O
26) 6FeCl2 + 14HCl + K2Cr2O7 6FeCl3 + 2CrCl3 + 2KCl + 7H2O
27) 2Na + H2 2NaH
28) NaH + H2O NaOH + H2↑
29) 2NO2 + 2NaOH NaNO2 + NaNO3 + H2O
30) 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2↑
31) Cu + 2H2SO4 CuSO4 + SO2↑ + 2H2O
32) 2CuSO4 + 4KI 2CuI↓ + I2↓ + 2K2SO4
33) 2NaCl + 2H2O H2↑ + Cl2↑ + 2NaOH (электролиз раствора)
34) Fe2O3 + 6HI 2FeI2 + I2↓ + 3H2O
35) Na[Al(OH)4] + CO2 NaHCO3 + Al(OH)3↓
36) Al2O3 + Na2CO3 (тв.) 2NaAlO2 + CO2↑ (сплавление)
37) Al4C3 + 12HBr 4AlBr3 + 3CH4↑
38) 2AlBr3 + 3K2SO3 + 3H2O 2Al(OH)3↓ + 3SO2↑ + 6KBr
39) 3SO2 + K2Cr2O7 + H2SO4 K2SO4 + Cr2(SO4)3 + H2O
40) Zn + 2KOH + 2H2O K2[Zn(OH)4] + H2↑
41) K2[Zn(OH)4] K2ZnO2 + 2H2O
42) K2ZnO2 + 4HCl 2KCl + ZnCl2 + 2H2O
43) HI + KHCO3 KI + H2O + CO2↑
44) 6KI + K2Cr2O7 + 7H2SO4 4K2SO4 + 3I2↓ + Cr2(SO4)3 + 7H2O
45) 2AlI3 + 3Na2S + 6H2O 2Al(OH)3↓ + 3H2S↑ + 6NaI
46) Fe3O4 + 10HNO3 3Fe(NO3)3 + NO2↑ + 5H2O
47) Fe2O3 + Fe 3FeO
48) 2Na + O2 Na2O2 (горение)
49) Na2O2 + 4HCl 2NaCl + 2H2O + Cl2↑
50) 3Cl2 + 10KOH + Cr2O3 2K2CrO4 + 6KCl + 5H2O
51) K2CrO4 + BaCl2 BaCrO4↓ + 2KCl
52) 2Cu(NO3)2 + 2H2O 2Cu + O2↑ + 4HNO3 (электролиз раствора)
53) 6KOH + 3S K2SO3 + 2K2S + 3H2O
54) 6KHCO3 + Fe2(SO4)3 2Fe(OH)3↓ + 3K2SO4 + 6CO2↑
55) KH + H2O KOH + H2↑
56) K2ZnO2 + 2H2SO4 K2SO4 + ZnSO4 + 2H2O
57) FeSO4 + 2NH3 + 2H2O Fe(OH)2↓ + (NH4)2SO4
58) Fe(OH)2 + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 3H2O
59) 2Fe(NO3)3 + 3K2CO3 + 3H2O 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
60) 4NO2 + 2Ca(OH)2 Ca(NO3)2 + Ca(NO2)2 + 2H2O
61) 3Ca + 2P Ca3P2
62) Ca3P2 + 6H2O 3Ca(OH)2 + 2PH3↑
63) PH3 + 8NaMnO4 + 11NaOH 8Na2MnO4 + Na3PO4 + 7H2O
64) Na2MnO4 + Na2SO3 + H2O MnO2↓ + Na2SO4 + 2NaOH
65) P + 5HNO3 H3PO4 + 5NO2↑ + H2O
66) 4Zn + 2NO2 4ZnO + N2↑
67) 2NaNO3 2NaNO2 + O2↑
68) NaNO2 + NH4I NaI + N2↑ + 2H2O
69) 2NaI + H2O2 + H2SO4 Na2SO4 + I2↓ + 2H2O
70) 3I2 + 6NaOH(р−р) NaIO3 + 5NaI + 3H2O
71) H2O2 + Ag2O 2Ag↓ + O2↑ + H2O
72) 2ZnS + 3O2 2ZnO + 2SO2↑
73) Na2[Zn(OH)4] Na2ZnO2 + 2H2O
74) 3Cu2O + Na2Cr2O7 + 10H2SO4 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
75) NaHCO3 + NaOH Na2CO3 + H2O
76) K2Cr2O7(тв.) + 14HCl(конц.) 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
77) 3NaNO2 + 2KMnO4 + H2O 2MnO2↓ + 2KOH + 3NaNO3
78) MnO2 + 4HCl(конц.) MnCl2 + Cl2↑ + 2H2O
79) 2Fe(OH)3 + 6HI 2FeI2 + I2↓ + 6H2O
80) 3Na2CO3 + 2CrBr3 + 3H2O 2Cr(OH)3↓ + 6NaBr + 3CO2↑
81) 5FeCl2 + KMnO4 + 8HCl 5FeCl3 + MnCl2 + KCl + 4H2O
82) K2SiO3(р—р) + 2H2O + 2CO2 H2SiO3↓ + 2KHCO3
83) Ba(OH)2 + 2NaHCO3 = Na2CO3 + BaCO3↓ + 2H2O (при избытке NaHCO3)
либо
Ba(OH)2 + NaHCO3 = BaCO3 + NaOH + H2O (при избытке Ba(OH)2)
84) 6KOH + 3Cl2 KClO3 + 5KCl + 3H2O
85) Cr2O3 + KClO3 + 4KOH 2K2CrO4 + KCl + 2H2O
86) 4NH3 + 5O2 4NO + 6H2O (кат. Pt, Cr2O3, t, p)
87) 2NO + O2 2NO2
88) NaNO2 + 2KMnO4 + 2KOH 2K2MnO4 + NaNO3 + H2O
89) 8KI(тв.) + 9H2SO4(конц.) 8KHSO4 + 4I2↓ + H2S↑ + 4H2O
90) Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4]
91) Na[Al(OH)4] + 4HNO3 NaNO3 + Al(NO3)3 + 4H2O
92) 2Ca(OH)2 + 4NO2 + O2 2Ca(NO3)2 + 2H2O
93) K[Al(OH)4] + SO2 KHSO3 + Al(OH)3↓
94) 8KOH + PCl5 K3PO4 + 5KCl + 4H2O
95) 2KBr(тв) + 2H2SO4(конц., гор.) K2SO4 + Br2 + SO2↑ + 2H2O
96) 3Br2 + 6KOH 5KBr + KBrO3 + 3H2O
97) Br2 + K2SO3 + 2NaOH 2NaBr + K2SO4 + H2O
98) Fe2O3 + 6HI 2FeI2 + I2 + 3H2O
99) Fe2O3 + 2NaOH(тв.) 2NaFeO2 + H2O (сплавление)
100) 4NO2 + O2 + 2H2O 4HNO3
101) NaFeO2 + 4HNO3(изб.) NaNO3 + Fe(NO3)3 + 2H2O
102) FeO + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 2H2O
103) Ca2Si + 4H2O 2Ca(OH)2 + SiH4↑
104) 3Na2SO3 + Na2Cr2O7 + 4H2SO4 Cr2(SO4)3 + 4Na2SO4 + 4H2O
105) 4Mg + 5H2SO4(конц.) 4MgSO4 + H2S↑ + 4H2O
106) CuS + 10HNO3 Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
CuS + 8HNO3(конц.) CuSO4 + 8NO2↑ + 4H2O
107) 3Cu + 8HNO3(разб.) 3Cu(NO3)2 + 2NO↑ + 4H2O
108) 2Cu(NO3)2 + 2H2O 2Cu↓ + O2↑ + 4HNO3 (электролиз раствора)
109) Cu2O + 3H2SO4(конц.) 2CuSO4 + SO2↑ + 3H2O
110) 2NaI + 2NaMnO4 I2↓ + 2Na2MnO4 (в щелочном растворе)
111) 2Na2O2 + 2CO2 2Na2CO3 + O2
112) 8NaOH(р-р, изб.) + Al2S3 2Na[Al(OH)4] + 3Na2S
113) 4Ca + 5H2SO4(конц.) H2S↑ + 4CaSO4↓ + 4H2O
114) 2Fe(OH)2 + H2O2 2Fe(OH)3
115) Na2O2 + 2H2O(хол.) H2O2 + 2NaOH
116) Ag2S + 10HNO3(конц.) = 2AgNO3 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
Ag2S + 8HNO3 → Ag2SO4 + 8NO2 + 4H2O
Материал по химии
- Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
- 1) Взаимодействие металлов с кислородом
- 2) Взаимодействие металлов с водой
- 3) Амфотерные металлы
- 4) Амфотерные оксиды и гидроксиды
- 5) Комплексные соли
- 6) Амфотерные соли
- 7) Углерод на ЕГЭ
-
Азот на ЕГЭ
- 9) Фосфор на ЕГЭ
- 10) Сера на ЕГЭ
- 11) Замещение неметаллов
- 12) Взаимодействие неметаллов с другими неметаллами
- 13) Медь и её соединения
- 14) Серебро и его соединения
- 15) Хром и его соединения
- 16) Железо и его соединения
- 17) Соединения марганца
- 18) Неметаллы с щелочами
- 19) Кислотные оксиды с щелочами
- 20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
- 21) Гидролиз бинарных соединений с ковалентной полярной связью
- 22) Взаимный гидролиз
В данном материале мы рассмотрим только те реакции неорганической химии, что выходят за пределы свойств классов (солей, кислот, оксидов, оснований) и часто встречаются в 8 задании. В материале Вы познакомитесь с самыми популярными реакциями, которые встречаются на экзамене.
Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
1) Взаимодействие металлов с кислородом
- Натрий, как и другие щелочные металлы (кроме лития), а также барий, при взаимодействии с кислородом образуют пероксиды или надпероксиды:
2Na + O2 = Na2O2
Причем, для натрия более характерен пероксид, а для калия – надпероксид:
K + O2 = KO2
- Пероксиды реагируют с холодной и горячей водой по-разному: с холодной водой происходит реакция обмена:
Na2O2 + 2H2O = 2NaOH + H2O2
В горячей воде происходит окислительно-восстановительная реакция:
2Na2O2 + H2O = 4NaOH + O2↑
2) Взаимодействие металлов с водой
Основные продукты при взаимодействии металлов с водой можно представить в виде следующей схемы:
Задание 8 ЕГЭ по химии
- Активные металлы, такие как натрий, калий, кальций, легко реагируют с водой, вытесняя водород. Реакции относятся к экзотермическим (проходят с выделением большого количества тепла), натрий и калий так активно реагируют с водой, что при контакте происходит их возгорание.
2Na + 2H2O = 2NaOH + H2↑
- Магний и алюминий тоже образуют гидроксиды, но для реакции необходимо нагревание. Алюминий берут в виде амальгамы.
Mg + 2H2O = Mg(OH)2 + H2↑
- Металлы средней активности требуют нагревания для взаимодействия с водой, при этом образуется оксид, а не гидроксид:
Zn + H2O = ZnO + H2↑
- Железо при взаимодействии с водой образует окалину (смесь оксида железа II и оксида железа III):
3Fe + 4H2O = Fe3O4 + 4H2
- На влажном воздухе железо превращается в бурый гидроксид железа III:
2Fe + 3H2O + 3O2 = 2Fe(OH)3
Задание в формате ЕГЭ с ответом:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- K + H2O →
- K2O + H2O →
- K + O2 →
- K2O2 + H2Oхолод. →
- KOH
- K2O
- KOH + H2O2
- KOH + H2
- KO2
Пример задания из КИМ ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba + O2 →
- BaO + H2O →
- Ba + H2O →
- BaO2 + H2O (горяч.) →
- Ba(OH) 2 + O2
- BaO2
- Ba(OH) 2
- BaO
- Ba(OH) 2 + H2
От активности металла зависит продукт реакции
3) Амфотерные металлы
Алюминий, цинк и бериллий отличаются от других металлов тем, что могут вступать во взаимодействие с концентрированными растворами щелочей, понятие «амфотерные металлы» использовано для облегчения поиска, такое понятие не совсем верно.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4) Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды реагируют с концентрированными растворами щелочей, причем продукт зависит от агрегатного состояния исходной щелочи: если она твердая, то применяют сплавление и образуется средняя соль, если же щелочь дана в растворенном виде, то образуется комплексная соль. Эти различия очень часто встречаются в задании 8 на ЕГЭ по химии!
- При сплавлении:
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O↑
- При растворении в концентрированной щелочи:
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH = K2[Be(OH)4]
Можно брать любую щелочь и любой амфотерный оксид или гидроксид.
- Амфотерные оксиды, при сплавлении с солями, вытесняют летучие кислотные оксиды:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
K2SO3 + ZnO = K2ZnO2 + SO2↑
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Be + KOH р-р →
- BeO + KOH р-р →
- BeO + KOH тв. →
- Be(OH) 2 + KOH тв. →
- K2 [Be(OH) 4] + H2O
- K2 [Be(OH) 4] + H2
- K2O + Be(OH) 2
- K2 [Be(OH) 4]
- K2BeO2 + H2O
5) Комплексные соли
- Комплексные соли разлагаются при нагревании с потерей воды:
Na[Al(OH)4] = NaAlO2 + 2H2O
K2[Zn(OH)4] = K2ZnO2 + 2H2O
- Комплексные соли реагируют с сильными кислотами в двух вариантах (при избытке и при недостатке кислоты):
Na[Al(OH)4] + HCl = NaCl + H2O + Al(OH)3↓ (при недостатке кислоты)
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O (при избытке кислоты)
- Комплексные соли реагируют со слабыми кислотами и летучими кислотными оксидами, получаемые сульфиды, карбонаты, сульфиты алюминия неустойчивы, поэтому вместо них записывают гидроксид амфотерного металла:
2Na[Al(OH)4] + H2S = Na2S + 2Al(OH)3 + 2H2O (при недостатке сероводородной кислоты)
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O (при избытке сероводородной кислоты)
2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3 + H2O (при недостатке углекислого газа)
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 (в условиях избытка углекислого газа)
Попробуйте решить задание ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2 [Zn(OH) 4] нагревание →
- Na2 [Zn(OH) 4] + H2S изб. →
- Na2 [Zn(OH) 4] + H2S нед. →
- NaOH тв. + Zn(OH) 2 →
- NaHS + ZnS + H2O
- Na2S + Zn(OH) 2 + H2O
- Na2ZnO2 + H2O
- Na2S + Zn + H2O
- Na2ZnO2 + H2
6) Амфотерные соли
Термин «амфотерные соли» некорректен, однако за последний месяц было более четырех тысяч запросов с таким сочетанием слов, под амфотерными солями школьник понимает соли, в анионе которого стоит амфотерный металл, а также комплексные соли, описанные выше. На самом деле, соли в которых амфотерный металл принадлежит аниону следует относить к самым обычным средним солям. Рассмотрим свойства некоторых из них, например, цинката натрия (Na2ZnO2) и алюмината калия (KAlO2).
- Реагируют с сильными кислотами:
Na2ZnO2 + 4HCl = 2NaCl + ZnCl2 + 2H2O
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Б) Растворяются в воде с образованием соответствующей комплексной соли:
KAlO2 + 2H2O = K[Al(OH)4]
- Также под амфотерными солями школьники подразумевают соли, содержащие в катионе металл в третьей валентности (что тоже является неверным, это средние соли) или цинк и бериллий, такие соли могут по-разному реагировать с растворами щелочей, например:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 (недостаток щелочи, разбавленный раствор щелочи)
AlCl3 + 4NaOH = NaCl + Na[Al(OH)4] (избыток щелочи, концентрированный раствор щелочи)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2BeO2 + H2SO4 →
- Na2 [Be(OH) 4] + H2SO4 изб. →
- Na2 [Be(OH) 4] + H2SO4 нед. →
- Na2BeO2 + H2O →
- Na2SO4 + BeSO4 + H2O
- Na2SO4 + Be(OH) 2
- Na2SO4 + Be(OH) 2 + H2O
- Na2 [Be(OH) 4]
- NaOH + BeSO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + KOH разб. →
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH конц. →
- Al2O3 + K2CO3 тв. →
- Al(OH) 3 + KCl
- KCl + KAlO2 + H2O
- KAlO2 + CO2
- K[Al(OH) 4] + KCl
- Al(OH) 3 + KCl + CO2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba(OH) 2 нед. + AlCl3 →
- Ba(OH) 2 изб. + AlCl3 →
- Ba(AlO2)2 + HCl →
- Ba[Al(OH) 4]2 + HCl изб. →
- Ba(OH) 2 + AlCl3 + H2O
- BaCl2 + Ba[Al(OH) 4]2
- BaCl2 + AlCl3 + H2O
- BaCl2 + Al(OH) 3 + H2O
- BaCl2 + Al(OH) 3
7) Углерод на ЕГЭ
В задании 8 часто встречаются гидрокарбонаты, рассмотрим их важнейшие свойства на примере гидрокарбоната кальция.
Гидрокарбонаты, как и другие кислые соли, при взаимодействии с щелочами, оксидами, солями, кислотами и при нагревании часто превращаются в средние соли.
- Разложение при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Взаимодействие с щелочами:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Взаимодействие с кислотами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Реакция с карбонатами. Эти реакции идут с образованием кислых солей, необходимый для их образования водород поступает из воды, поэтому составители используют такие обозначения как CO2 р-р или CaCO3 влажн., реакция идет по следующей схеме:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ
Восстановление углерода активными металлами и углеродом:
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
- Реакции с монооксидом углерода:
- CO или угарный газ – хороший восстановитель, реагирует с окислителями:
CO + CuO = CO2 + Cu
CO + Cl2 = COCl2
CO + Br2 = COBr2
2CO + O2 = 2CO2
- Монооксид углерода проявляет и окислительные свойства:
СO + H2 = CH3OH
- Вступает в реакции без изменения степени окисления:
CO + NaOHтв. = HCOONa (при сплавлении)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KHCO3 + Ca(OH) 2 →
- Mg(HCO3)2 + H2CrO4 →
- MgCO3 + H2CrO4 →
- Ca(HCO3)2 + KOH →
- Cr2O3 + MgCO3 + H2O
- KOH + Ca(HCO3)2
- CaCO3 + K2CO3 + H2O
- MgCrO4 + H2O + CO2
- CaO + K2CO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Mg + CO2 →
- MgO + CO2 →
- Mg(HCO3)2 + NaOH →
- MgCl2 + Na2CO3 →
- MgO + C
- MgCO3
- Mg + CO
- MgCO3 + Na2CO3 + H2O
- MgCO3 + NaCl
![8)]() Азот на ЕГЭ
Азот на ЕГЭ
Очень популярной в заданиях ЕГЭ по химии является азотная кислота, в отличие от обычных кислот, в качестве окислителя выступает не протон водорода, а азот в высшей степени окисления.
В общем, схему реакции кислоты с металлами можно представить в следующем виде:
HNO3 + Me → Me+x(NO3)x + H2O + особый продукт
Особые продукты зависят от характера металла, приведем из в виде таблицы:
Таблица – свойства азотной кислоты
|
Реагент |
HNO3 концентрированная |
HNO3 разбавленная |
|
Активные металлы (металлы IA и IIА-группы в таблице Менделеева) |
N2O (редко NO) |
NH4NO3 (редко N2 или NH3) |
|
Неактивные металлы Cu, Ag, Hg |
NO2 |
NO |
|
Cr, Al, Fe |
На холоде реакция не идёт в следствие пассивации, При нагревании образуется NO2, а металл приобретает степень окисления +3 |
NO (редко N2, N2O) |
|
Металлы средней активности (все остальные металлы, например, Zn, Ni, Co) |
NO2 |
NO (редко N2, N2O) |
|
Au, Pt |
Реакция не идет |
Реакция не идет |
- Примеры реакций металлов с азотной кислотой:
4HNO3 разб. + Al = Al(NO3)3 + NO + 2H2O (при любой температуре)
6HNO3 конц. + Al = Al(NO3)3 + 3NO2 + 3H2O (реакция идет только при нагревании)
10HNO3 разб. + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3 конц. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- C другими восстановителями азотные кислоты ведут себя аналогичным образом: у концентрированной продуктом является NO2, а у разбавленной – NO:
FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O
3FeO + 10HNO3 разб. = 3Fe(NO3)3 + NO + 5H2O
- Азотная кислота реагирует и с неметаллами, например, с серой и углеродом:
6HNO3 конц. + S = H2SO4 + 6NO2 + 2H2O
4HNO3 конц. + С = CO2 + 4NO2 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CuO + HNO3 конц. →
- CuO + HNO3 разб. →
- Cu + HNO3 конц. →
- Cu + HNO3 разб. →
- Cu(NO3)2 + H2O + NO2
- CuO + NO2 + O2
- Cu(NO3)2 + H2O
- Cu(NO3)2 + H2O + NO
- CuNO3 + H2O + NO
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- FeO + HNO3 конц. →
- Fe + HNO3 конц. tºC →
- Fe(NO3)2 + HNO3 конц. →
- FeO + HNO3 разб. →
- Fe(NO3)2 + H2O + NO2
- Fe(NO3)3 + H2O + NO2
- Fe(NO3)2 + H2O + NO
- Fe(NO3)3 + H2O + NO
- Fe(NO3)2 + H2O
9) Фосфор на ЕГЭ
- Фосфор выступает в роли окислителя и восстановителя в реакции с щелочами:
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
Это одна из самых популярных окислительно-восстановительных реакций с фосфором на ЕГЭ по химии.
- оксид фосфора III реагирует с холодными растворами щелочей и водой без изменения степени окисления:
P2O3 + 2KOH + H2O → 2KH2PO3
P2O3 + 3H2O → 2H3PO3 (или HPO2)
- Соединения фосфора III – хорошие восстановители, стремятся превратиться в соединения фосфора V:
P2O3 + окислитель → PO43‒ + продукты восстановления
P2O3 + 4KMnO4 + 10KOH → 2K3PO4 + 4K2MnO4 + 5H2O
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
- Оксид фосфора V реагирует с водой, образуя ряд кислот:
P2O5 + H2O → 2HPO3 – метафосфорная (в сильном недостатке воды)
P2O5 + 2H2O → H4P2O7 – пирофосфорная (в небольшом недостатке воды)
P2O5 + 3H2O → 2H3PO4 – ортофосфорная (в избытке воды)
- Фосфаты могут образовывать кислые соли, при взаимодействии с фосфорной кислотой:
2K3PO4 + H3PO4 → 3K2HPO4
K3PO4 + 2H3PO4(большой избыток) → 3KH2PO4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaH2PO4 + NaOH нед. →
- NaH2PO4 + NaOH изб. →
- NaH2PO4 изб. + NaOH →
- NaH2PO4 нед. + NaOH →
- Na3PO4 + H2O
- NaH2PO3 + H2O
- Na3PO4 + P2O5
- NaH2PO2 + H2O
- Na2HPO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P2O5 + H2O нед. →
- P2O3 + KOH →
- P + KOH →
- P2O5 нед. + H2O →
- K2HPO3 + H2O
- KH2PO2 + PH3
- HPO3
- H3PO4
- HPO2
10) Сера на ЕГЭ
Таблица ‒ Серная кислота
|
Свойства |
Разбавленная H2SO4 |
Концентрированная H2SO4 |
|
Окислительные свойства |
Окислитель за счет протона водорода |
Окислитель за счет серы |
|
Активные металлы |
2Na + H2SO4 = Na2SO4 + H2 |
8Na + 5H2SO4 = 4Na2SO4 + 4H2O + H2S↑ |
|
Металлы средней активности |
Zn + H2SO4 = ZnSO4 + H2 |
3Zn + 4H2SO4 = 3ZnSO4 + 4H2O + S↓ (в зависимости от концентрации кислоты может выделиться SO2 или H2S) |
|
Al, Cr, Fe |
Как с другими металлами до водорода: Fe + H2SO4 = FeSO4 + H2 |
На холоде реакция не идет (пассивация), при нагревании: 2Fe + 6H2SO4 = Fe2(SO4)3 + 6H2O + 3SO2 |
|
Металлы средней активности |
Реакция не идет, так как эти металлы не могут вытеснить водород |
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 |
- Обменная реакция с концентрированной серной кислотой:
NaCl + H2SO4 конц. = NaHSO4 + HCl↑ (при сильном нагревании)
Остальные обменные реакции стандартны и в этом материале рассмотрены не будут.
- Сероводород:
SO2 + 2H2S = 3S↓ + 2H2O
2H2S + 3O2 = 2H2O + 2SO2 (кислород в избытке)
2H2S + O2 = 2H2O + 2S↓ (кислород в недостатке)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KCl тв. + H2SO4 конц. →
- KI + H2SO4 конц. →
- Fe + H2SO4 конц. tºC →
- FeO + H2SO4 конц. →
- Cl2 + K2SO4 + H2O
- KHSO4 + HI
- KHSO4 + HCl
- I2 + K2SO4 + H2S
- Fe2 (SO4)2 + H2O + SO2
- FeSO4 + H2O
11) Замещение неметаллов
Часто в задании 8 ЕГЭ по химии встречается замещение брома на хлор, или йода на хлор или бром. Галогены могут вытеснять друг друга и другие неметаллы из соединений. Чтобы понимать, какие неметаллы могут вытеснить другие неметаллы, нужно помнить о том, что в ПС Д.И. Менделеева элементы стоят таким образом, что чем правее и выше стоит элемент, тем сильнее проявляются его неметаллические свойства, и тем выше его электроотрицательность. Более электроотрицательные неметаллы могут вытеснять менее электроотрицательные. Так, хлор и бром стоят выше в таблице Менделеева, чем йод, поэтому могут вытеснить его из соединений:
2NaI + Br2 = 2NaBr + I2
2KI + Cl2 = 2KCl + I2
Хлор может вытеснить бром:
2NaBr + Cl2 = 2NaCl + Br2
Йод не может вытеснить другие галогены, так как расположен в ПС ниже хлора, брома и фтора, но йод может вытеснить те элементы-неметаллы, что стоят левее в Периодической системе, например, серу:
H2S + I2 = 2HI + S
Можно использовать ряд электроотрицательности неметаллов, на реальном ЕГЭ его не будет, легче запомнить Периодический закон, тем более что эти знания также нужны для выполнения задания 2 ЕГЭ по химии.
12) Взаимодействие неметаллов с другими неметаллами
Более электроотрицательные неметаллы могут окислить менее электроотрицательные неметаллы. То есть те элементы, которые стоят в ПС выше и правее отнимают электроны у тех неметаллов, которые стоят ниже и левее.
Например, хлор, бром и фтор могут окислить йод, серу, фосфор (наиболее популярные на ЕГЭ реакции). В таблице представлены наиболее популярные продукты:
Таблица – взаимодействие неметаллов
|
Восстановители |
Окислители |
|||||
|
F2 |
Cl2 |
Br2 |
I2 |
O2 |
S |
|
|
I2 |
IF7 IF5 |
ICl5 ICl3 ICl |
IBr5 IBr3 IBr |
‒ |
‒ |
‒ |
|
S |
SF6 |
SCl4 |
SBr4 |
‒ |
SO2 |
‒ |
|
P |
PF5 |
PCl5 PCl3 |
PBr5 PBr3 |
PI3 |
P2O3 P2O5 |
P2S3 P2S5 |
|
Si |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiO2 |
SiS2 |
|
H2 |
HF |
HCl |
HBr |
HI |
H2O |
H2S |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + O2 →
- SO2 + O2 →
- H2S + SO2 →
- S + P →
- S + H2O
- SO2
- P2S3
- SO3
- S3P2
13) Медь и её соединения
2CuCl2 + 4KI = 2CuI↓ + I2 + 4KCl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 – темно-синий комплекс
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH – прозрачный раствор
3CuO + 2NH3 = 3Cu + N2 + 3H2O
14) Серебро и его соединения
AgCl + 2NH3 = [Ag(NH3)2]Cl
8AgNO3 + PH3 + 4H2O = H3PO4 + 8Ag + 8HNO3
15) Хром и его соединения
- Соединения хрома II – хорошие восстановители, при взаимодействии с окислителями превращаются в соединения хрома III
4CrO + O2 = 2Cr2O3
CrO + 4HNO3 = Cr(NO3)3 + 2H2O + NO2
- соединения хрома III проявляют как окислительные, так и восстановительные свойства:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 6NaBr + 8H2O + 2Na2CrO4 (хром в степени окисления +3 является восстановителем)
2CrCl3 + H2 = 2CrCl2 + 2HCl (хром в степени окисления +3 является восстановителем)
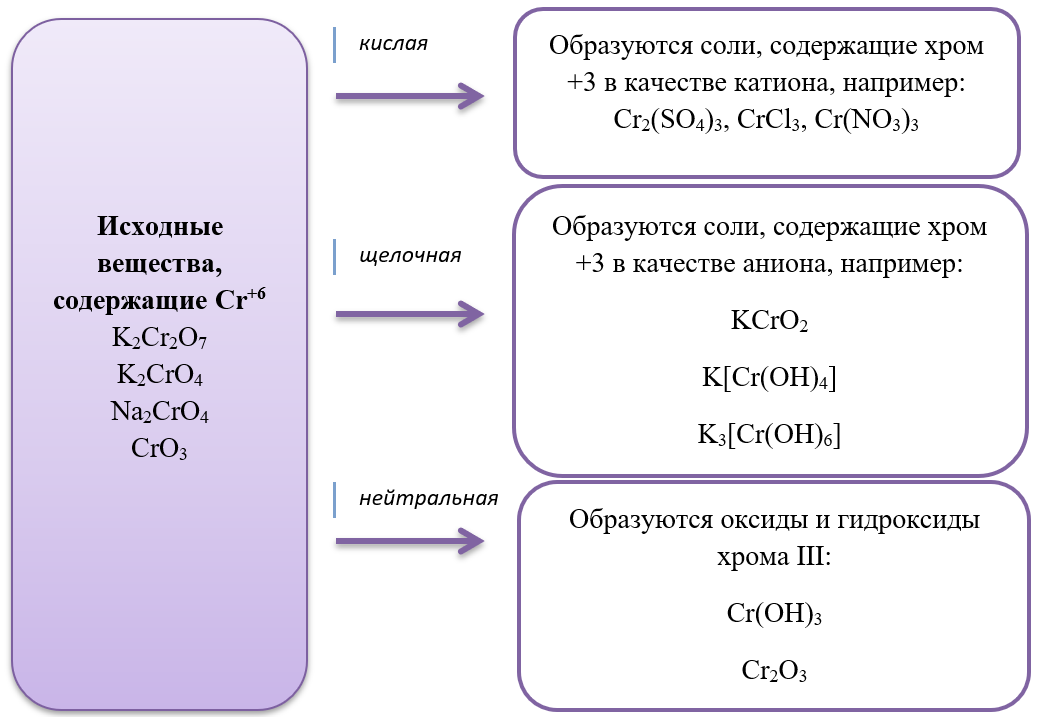
- Дихроматы – соли, окрашивающие растворы в оранжевый цвет и хроматы – соли желтого цвета устойчивы в разных средах: в кислой среде устойчивы оранжевые дихроматы, а в щелочной – желтые хроматы. В зависимости от среды, они могут взаимно превращаться:
Хромат превращается в дихромат в кислой среде, раствор меняет цвет с желтого на оранжевый.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Дихромат превращается в хромат в щелочной среде, раствор меняет цвет с оранжевого на желтый.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
В ЕГЭ по химии стали уже традиционными задания с соединениями хрома, особенно с дихроматами, в основном встречается их окислительно-восстановительные свойства:
16) Железо и его соединения
- Железо реагирует с концентрированной азотной и серной кислотой только при нагревании, с разбавленными кислотами реагирует при нормальных условиях, например:
Fe + 6HNO3 конц = Fe(NO3)3 + 3NO2 + 3H2O (при нагревании)
- Взаимодействие железа с галогенами и галогенводородами:
Таблица – Железо с галогенами и галогеноводородами
|
С галогенами |
С галогенводородом |
|
2Fe + 3Cl2 = 2FeCl3 |
Fe + 2HCl = FeCl2 + H2 |
|
2Fe + 3Br2 = 2FeBr3 |
Fe + 2HBr = FeBr2 + H2 |
|
Fe + I2 = FeI2 |
Fe + 2HI = FeI2 + H2 |
- Соединения двухвалентного железа – хорошие восстановители, с окислителями превращаются в соединения трехвалентного железа:
FeO + 4HNO3 конц = Fe(NO3)3 + NO2 + 2H2O
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- Железная окалина – двойной оксид Fe3O4 или FeO·Fe2O3, проявляет как окислительные (за счет оксида железа III), так и восстановительные (за счет железа II) свойства, а также растворяется в кислотах, образуя две соли (железа II и железа III)
Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O (оксиды железа растворились в разбавленной серной кислоте без изменения степени окисления)
Fe3O4 + 8KI + 4H2SO4 = 3FeI2 + 4K2SO4 + I2 + 4H2O (железная окалина проявляет окислительные свойства за счет наличия железа III)
Fe3O4 + 10HNO3конц = 3Fe(NO3)3 + NO2 + 5H2O (железная окалина проявляет восстановительные свойства за счет железа II)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + I2 →
- Fe + Cl2 →
- Fe + HCl →
- Fe + O2 →
- FeI3
- FeCl2
- FeI2
- FeCl3
- FeO
- Fe3O4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + CuSO4 →
- Fe + H2SO4 р-р →
- Fe + H2SO4 конц. tºC →
- Fe + H2O + O2 →
- FeSO4 + Cu
- FeSO4 + H2
- Fe2(SO4)3 + Cu
- Fe2 (SO4)3 + H2
- Fe2(SO4)3 + SO2 + H2O
- Fe(OH) 3
17) Соединения марганца
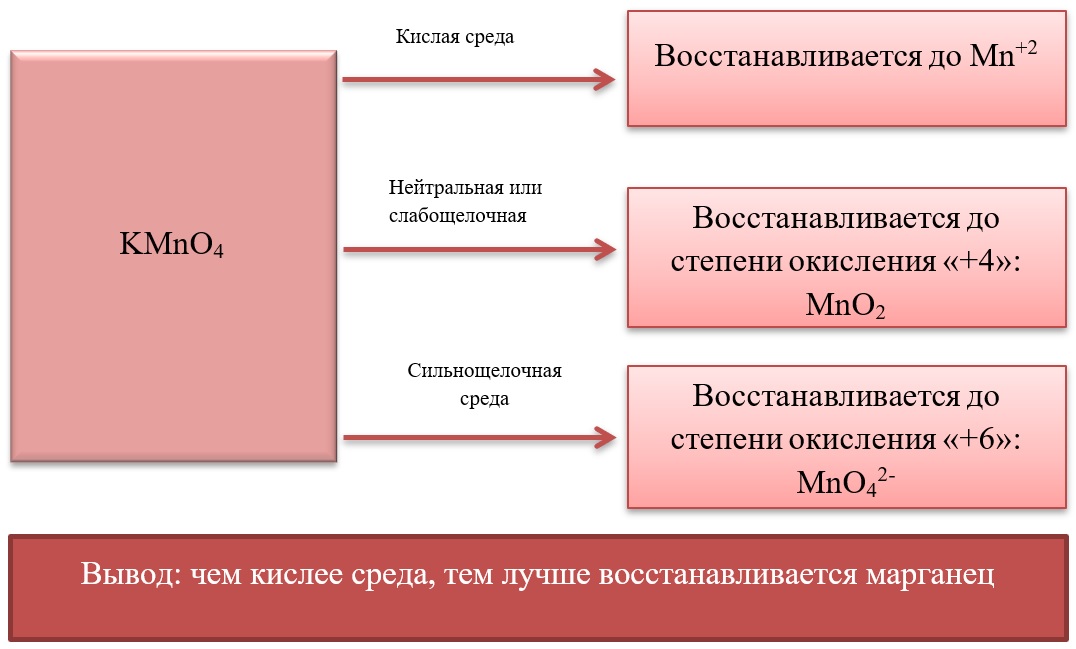
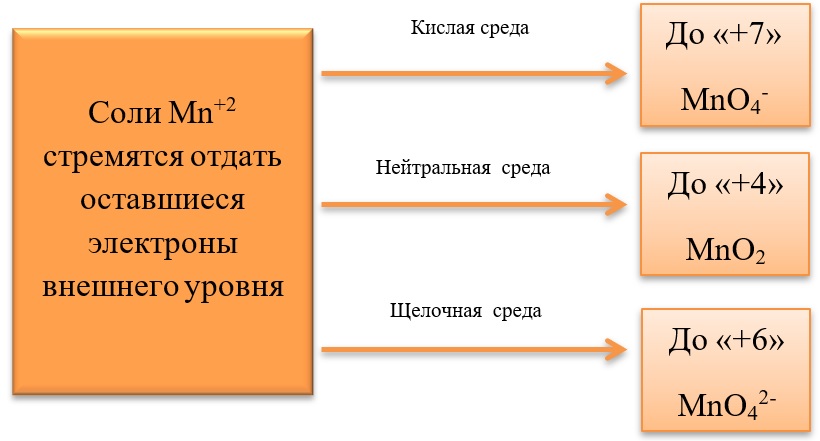
- Марганец в степени окисления +7 проявляет окислительные свойства. Продукты его восстановления зависят от среды:
Примеры реакция перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2KMnO4 + SO2 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
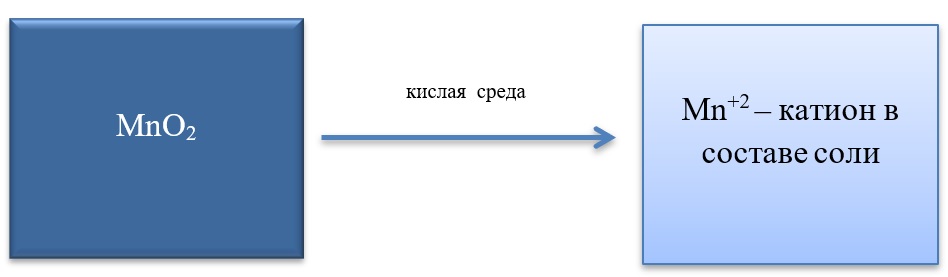
- Марганец в степени окисления +4 проявляет как окислительные. Так и восстановительные свойства.
Окислительные свойства чаще проявляет в кислой среде, восстанавливаясь до катиона +2.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + H2O2 + H2SO4 → O2 + MnSO4 + 2H2O
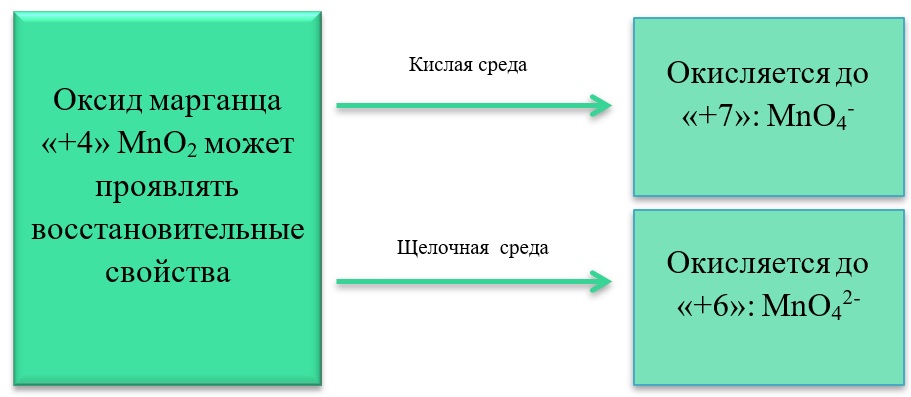
В) Марганец в степени окисления +4 проявляет и восстановительные свойства, окисляясь до +6 в щелочной среде, и до +7 в кислой:
MnO2 + Br2 + 4KOH = K2MnO4 + 2KBr + 2H2O
- Соединения марганца II, например, MnSO4 проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства проявляет в реакциях с более активными металлами, например, с алюминием:
3MnSO4 + 2Al = 3Mn + Al2(SO4)3
Восстановительные свойства проявляет при взаимодействии с типичными окислителями.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
18) Неметаллы с щелочами
- Галогены с щелочами:
Хлор, бром и йод реагируют с щелочами при разных условиях. На холоде окисления галогена происходит чаще до степени окисления +1 (восстановление в любых условиях происходит до степени окисления ‒1). Описать данную реакцию можно уравнением:
Г2 + 2NaOH = NaГ + NaГO + H2O (вместо гидроксида натрия можно взять любую щелочь, содержащую одновалентный металл: K, Cs, Rb)
2Г2 + 2Ca(OH)2 = CaГ2 + Ca(ГO)2 + 2H2O (вместо гидроксида кальция можно брать гидроксид бария и стронция).
Где Г = I, Cl, Br
Например:
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
При нагревании окисление галогена часто проходит до степени окисления +5:
3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O
6Г2 + 6Ca(OH)2 = 5CaГ2 + Ca(ГO3)2 + 6H2O
Например:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
6Cl2 + 6Ca(OH)2 = 5CaCl2 + Ca(ClO3)2 + 6H2O
Обращайте внимание на температуру, от Вашей внимательности зависят Ваши баллы на ЕГЭ по химии!
- Сера, селен и теллур тоже реагируют с щелочами по одной схеме:
3Э + 6NaOH = 2Na2Э + Na2ЭO3 + 3H2O
3Э + 3Ca(OH)2 = 2CaЭ + CaЭO3 + 3H2O
Например:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O
- Фосфор с щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Кремний с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + NaOH →
- SO2 + NaOH →
- SO3 + NaOH →
- H2S + NaOH →
- NaHS + S + H2O
- Na2SO4 + H2O
- Na2S + Na2SO3 + H2O
- Na2SO3 + H2O
- Na2S + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P + NaOH →
- P2O3 + NaOH →
- P2O5 + NaOH изб. →
- P2O5 + NaOH нед. →
- NaH2PO2
- NaH2PO3
- Na3P
- Na3PO4
- NaH2PO4
19) Кислотные оксиды с щелочами
Кислотные оксиды реагируют с щелочами, образуя соль и воду, к нестандартным реакциям относят взаимодействие диоксида азота с щелочами, продукты которого зависят от наличия в среде кислорода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + Cl2O →
- NaOH + NO2 + O2 →
- NaOH + Cl2O3 →
- NaOH + HNO3 →
- NaClO + H2O
- NaCl + HCl
- NaClO2 + H2O
- NaNO3 + H2O
- NaNO2 + NaNO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + SO2 →
- NaOH + SO3 →
- NaOH + NO2 →
- NaOH + P2O5 →
- NaNO3 + NaNO2 + H2O
- Na2SO4 + H2O
- NaNO2 + H2O
- NaH2PO4
- NaH2PO3
- Na2SO3 + H2O
20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
Многие неметаллы реагируют с активными металлами, образуя соли или солеподобные вещества, легко гидролизующиеся в воде или кислотах.
Для начала рассмотрим схемы образования этих веществ. В них неметалл часто проявляет низшую степень окисления (значение низшей степени окисления легко определяется по номеру группы: для этого от номера группы нужно отнять 8, например, для азота это будет 5 ‒ 8 = ‒3)
Таблица – Степени окисления, которые принимают неметаллы при взаимодействии с активными металлами:
|
С |
Si |
N и P |
S, Se, Te |
F, Cl, Br, I |
|
‒4 (с Na, K, Al) ‒1 (с Ca, Mg) |
‒4 |
‒3 |
‒2 |
‒1 |
|
Карбиды |
Силициды |
Нитриды и фосфиды |
Сульфиды, селениды, теллуриды |
Фториды, хлориды, бромиды, йодиды |
Степени окисления активных металлов равны номеру группы, в которой они стоят в ПС.
4Na + C = Na4C
4Al + 3C = Al4C3
Ca + 2C = CaC2
4K + Si = K4Si
3Ca + N2 = Ca3N2
3K + P = K3P
2Al + 3S = Al2S3
Ba + Cl2 = BaCl2
Практически все эти вещества, за исключением некоторых сульфидов и галогенидов (хлоридов, бромидов, йодидов, фторидов) неустойчивы в растворах и подвергаются мгновенному гидролизу, который стоит рассматривать как обычную обменную реакцию с водой:
K3P + 3HOH = 3KOH + PH3↑
Na4Si + 4HOH = 4NaOH + SiH4↑
Ca3N2 + 6HOH = 3Ca(OH)2 + 2NH3↑
Продукт гидролиза карбидов зависит от степени окисления углерода в исходном веществе: если она равна ‒1, то образуется ацетилен (C2H2), а если ‒4, то метан (CH4).
Al4C3 + 12HOH = 4Al(OH)3 + 3CH4↑
CaC2 + 2HOH = Ca(OH)2 + C2H2↑
Так же происходит их кислотный гидролиз:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Ba3P2 + 3H2SO4 = 3BaSO4 + 2PH3↑
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- MgC2 + H2O →
- Na4C + H2O →
- Mg3P2 + H2O →
- Na3P + H2O →
- NaOH + C2H2
- Mg(OH) 2 + CH4
- Mg(OH) 2 + PH3
- NaOH + CH4
- Mg(OH) 2 + C2H2
- NaOH + PH3
21) Гидролиз бинарных соединений с ковалентной полярной связью
При гидролизе бинарных соединений неметаллов важно помнить, что степень окисления неметаллов не изменяется, из неметалла с положительной степенью окисления образуется кислотный гидроксид (кислородсодержащая кислота), из отрицательно заряженного неметалла образуется бескислородная кислота:
PCl5 + 4H2O = H3PO4 + 5HCl
SF6 + 4H2O = H2SO4 + 6HF
ICl3 + 2H2O = HIO2 + 3HCl
Для образования гидроксидов неметаллов можно воспользоваться следующей таблицей:
|
Степень окисления неметалла |
Э+1 |
Э+3 |
Э+4 |
Э+5 |
Э+6 |
Э+7 |
|
Соответствующая кислота (кислотный гидроксид) |
НЭО |
HЭO2 Или H3ЭO3 |
H2ЭO3 |
HЭO3 Или H3ЭO4 |
H2ЭO4 |
HЭO4 |
|
Примеры |
HClO |
HClO2 H3PO3 |
H2SO3 |
HIO3 H3PO4 |
H2SO4 |
HClO4 |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- ICl + H2O →
- ICl3 + H2O →
- ICl5 + H2O →
- ICl7 + H2O →
- HClO3 + HI
- HIO + HCl
- HIO4 + HCl
- HIO2 + HCl
- HIO3 + HCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- PCl3 + H2O →
- SCl4 + H2O →
- SiCl4 + H2O →
- PCl5 + H2O →
- H2SO4 + HCl
- H2SiO3 + HCl
- H3PO3 + HCl
- SO2 + HCl
- HPO3 + HCl
22) Взаимный гидролиз
При взаимодействии некоторых солей могут образоваться новые соли, неустойчивые в растворах, в таких случаях в таблице растворимости на пересечении катиона и аниона мы видим прочерк (не существует или необратимо разлагается водой), например, сульфид алюминия:
Сульфид алюминия образуется в реакциях между растворимыми сульфидами и солями алюминия:
3Na2S + 2AlCl3 = 6NaCl + Al2S3
Но данная запись неверна, так как сульфида алюминия не существует в растворах, записываем уравнение гидролиза этой соли:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Объединим первое уравнение со вторым(левую часть первого уравнение соединяем с левой частью второго уравнения, а правую с правой, все коэффициенты сохраняем):
3Na2S + 2AlCl3 + Al2S3 + 6H2O = 6NaCl + Al2S3 + 2Al(OH)3↓ + 3H2S↑
Сокращаем сульфид алюминия, так как он есть и в правой части реакции, и в левой:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3H2S↑ — так выглядит реакция взаимодействия растворов сульфида натрия и хлорида алюминия.
Рассмотрим еще один пример — взаимодействие карбоната калия и нитрата железа III:
3K2CO3 + 2Fe(NO3)3 = Fe2(CO3)3 + 6KNO3
Образовавшийся карбонат железа III разлагается в воде:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Соединяем два уравнения:
3K2CO3 + 2Fe(NO3)3 + Fe2(CO3)3 + 3H2O = Fe2(CO3)3 + 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Сокращаем карбонат железа III с обеих сторон:
3K2CO3 + 2Fe(NO3)3 + 3H2O = 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Взаимный гидролиз попался мне на реальном досрочном ЕГЭ по химии 2022 во второй части!
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CrCl3 + NaOH изб. →
- CrCl3 + NaOH нед. →
- CrCl3 + Na2S р-р →
- Cr2O3 + Na2SO3 →
- Cr(OH) 3 + NaCl + SO2
- NaCl + Cr(OH) 3
- Cr(OH) 3 + NaCl + H2S
- NaCrO2 + SO2
- Na3 [Cr(OH) 6] + NaCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH изб. →
- AlCl3 + KOH нед. →
- Al2O3 + K2CO3 →
- KCl + K[Al(OH) 4]
- Al(OH) 3 + KCl + CO2
- Al2 (CO3)3 + KCl
- KAlO2 + CO2
- Al(OH) 3 + KCl
библиотека химических реакций
ОГЛАВЛЕНИЕ
v Азот. Оксиды. Аммиак. Кислоты. Соли
v Алюминий и его соединения
v Благородные газы
v Ванадий, Ниобий, Тантал и их соединения
v Бор. Борная кислота
v Вода и Пероксид водорода
v Водород
v Галогенов соединения. Кислоты
v Галогены
1. Фтор
2. Хлор
3. Бром
4. Йод
v Германий, Олово, Свинец и их соединения
v Железо, Кобальт, Никель и их соединения
v Кислород. Озон
v Кремний. Оксиды. Силикаты. Силициды. Силаны
v Марганец. Перманганаты. Манганаты
v Медь, Серебро, Золото и их соединения
v Мышьяк, Сурьма, Висмут и их соединения
v Селен, Теллур и их соединения
v Семейство платины
v Сера. Сероводород. Сульфиды
v Серы оксид (IV). Сернистая кислота. Тиосульфат
v Серы оксид (VI). Серная кислота
v Скандий, Иттрий, Лантан и их соединения
v Титан, Цирконий, Гафний и их соединения
v Углерод. Оксиды. Карбонаты. Карбиды
v Фосфор. Фосфин. Галогениды. Кислоты. Соли
v Хром. Хромат. Дихромат. Молибден и вольфрам
v Цинк, Кадмий, Ртуть и их соединения
v Щелочные металлы
v Щелочноземельные металлы
Азот. Оксиды. Аммиак. Кислоты. Соли
N2 + 3H2 ó 2NH3
N2 + 6Li = 2Li3N + 39 кДж
NH4NO2 (t°) = N2 + 2H2O
(NH4)2Cr2O7 (t°) = N2 + Cr2O3 + 4H2O (горит как вулкан)
AlN + 4HCl = AlCl3 + NH4Cl
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3 (часто нитриды щелочных и щелочноземельных металлов – бертоллиды)
Na3N + 3H2O = 3NaOH + NH3
Li3N + AlN (t°) = Li3AlN2
Li3N + BN (t°) = Li3BN2
NO3— + 2H+ + 1e à NO2 + H2O
NO3— + 4H+ + 3e à NO + 2H2O
2NO3— + 10H+ + 8e à N2O + 5H2O
2NO3— + 12H+ + 10e à N2 + 6H2O
NO3— + 10H+ + 8e à NH4+ + 3H2O
3Cu + 2KNO3 + 4H2SO4 = 3CuSO4 + K2SO4 + 2NO + 4H2O
4NH3 + 5O2 (t°) = 4NO + 6H2O
HNO3 (раств) + Cu = NO + Cu(NO3)2 + H2O
2NO + Cl2 (t°,hv) = 2NOCl (нитрозил-галогениды)
5NO + 3KMnO4 + 6H2SO4 = 5HNO3 + 3MnSO4 + 3KHSO4 + 2H2O
NO + 5CrCl2 + 4H2O = 5Cr(OH)Cl2 + NH3
NO + 3CrCl2 + 3HCl = NH2OH + 3CrCl3
2NO + SO2 = N2O + SO3
Note Bene: [Cr(NH3)5NO]Cl2 [Fe(OH2)5NO]SO4 (часто NO группа – лиганд)
2NO + O2 (мгновенно окисляется) = 2NO2 – бурый газ
2Cu(NO3)2 (t°) = 2CuO + 4NO2 + O2
2N2O5 ó 4NO2 + O2
NO2 + H2O + O2 = 2HNO3
3NO2 + H2O (t°) = 2HNO3 + NO – бесцветный газ
2NO2 + 2KOH = KNO3 + KNO2 + H2O
2NO2 + C = CO2 + 2NO
2NO2(г) (охлаждение) à N2O4(ж)
2NO2(г) + H2O ó HNO2 + HNO3 (растворение на холоде)
3NO2 + H2O (t°) = 2HNO3 + NO
4NO2 + 2H2O + O2 = 4HNO3 (применяют в промышленности)
NO2 + SO2 + H2O = H2SO4 + NO
NO2 + O3 à NO3 + O2
2NO3 à O2NO─ONO2 (N2O6)
N2O6 + 2H2O = 2HNO3 + H2O2
NO2 + F2 = 2NO2F
NaNO2 + F2 = NO2F + NaF
Нестабильная и стабильная форма
NO + NO2 (-t°) ó N2O3 – синяя жидкость
N2O3 + H2O = 2HNO2
P2O3 + 2HNO3 = N2O3 + 2HPO3
N2O3 + Na2O = 2NaNO2
N2O3 + Ca(OH)2 = Ca(NO2)2 + H2O
2HNO3 + P2O5 = 2HPO3 + N2O5 – прозрачные бесцветные кристаллы
N2O5 + H2O = 2HNO3
N2O5 + 2H2O2 (100%) = 2H─O─O─NO2 + H2O
H─O─O─NO2 + H2O = H2O2 + HNO3
2NO2 ó N2O4 – бледно-желтая жидкость
NH4NO3 (t°) = N2O + 2H2O – бесцветный газ
5N2O + 8KMnO4 + 7H2SO4 = 3MnSO4 + 5Mn(NO3)2 + 4K2SO4 + 7H2O
2N2 + O2 (t°) = 2N2O
Соли: первая форма – легкие металлы, вторая – тяжелые!
2HNO2 ó NO + NO2 + H2O (k = 6*10-4 при 25 °C)
AgNO2 + HCl = AgCl + HNO2
2HNO2 + 2HI =I2 + 2NO + 2H2O
HNO2 + H2O2 = HNO3 + H2O
3HNO2 (τ) = HNO3 + 2NO + H2O
2HNO2 + H2S = 2H2O + S + 2NO
2NaNO2 + Na2S + 2H2SO4 = 2Na2SO4 + S + 2NO + 2H2O
5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + K2SO4 + 2MnSO4 + 3H2O
NaNO3 + H2SO4 (τ) = HNO3 + NaHSO4
8HNO3 (разб) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
2HNO3 + S = H2SO4 + 2NO
2HNO3 (конц) + 6HCl ó 3Cl2 + 2NO + 4H2O возможны варианты этой реакции:
HNO3 (конц) + 3HCl = NOCl + Cl2 + 2H2O
4HNO3 (hν) à 4NO2 + 2H2O + O2 (частичное разложение HNO3)
4HNO3 + 3C = 3CO2 + 4NO + 2H2O
5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO
8HNO3 (конц) + ZnS = ZnSO4 + 8NO2 + 4H2O
HNO3 + 3HCl + Au = AuCl3 + NO + 2H2O
HNO3 + 4HCl + Au = H[AuCl4] (золотохлороводородная к-та) + NO + 2H2O
MeNO3 (t°) à до Mg à MeNO2 + O2
MeNO3 (t°) à от Mg до Cu à MeO + NO2 + O2
MeNO3 (t°) à после Cu à Me + NO2 + O2
2KNO3 (t°) = 2KNO2 + O2
2KNO3 + 4H2SO4 + 3Cu = 3CuSO4 + K2SO4 + 2NO + 4H2O (нитраты способны растворять в кисл. среде металлы)
4LiNO3 (t°) = 2Li2O + 4NO2 + O2
AgNO3 (t°) = Ag + NO2 + O2
Hg(NO3)2 (t°) = Hg + 2NO2 + O2
2Cu(NO3)2 (t°) = 2CuO + 4NO2 +O2
2NH3 + 3Br2 = N2 + 6HBr
NH3 + Na = NaNH2 + H0 (амид натрия)
2NH3 + 3CuO = 3Cu + N2 + 3H2O
2NH3 + H2O2 = N2 + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
4NH3 + 5O2 (Pt) = 4NO + 6H2O
NH3 + H2O ó NH4OH ó NH4+ + OH—
2NH3 + H2SO4 = (NH4)2SO4
2NH3 + NaOCl = N2H4 + NaCl + H2O
4NH3 + 3F2 = 3NH4F + NF3
2NF3 + 3H2O (пар, 7) = 6HF + NO + NO2
2NF3 + Cu = CuF2 + N2F4
NH4Cl + 3Cl2 = 4HCl + NCl3
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3
NH4NO2 (t°) = N2 + 2H2O
NH4NO3 (t°) = N2O + 2H2O
(NH4)3PO4 (t°) = 3NH3 + H3PO4
(NH4)2SO4 + 2KOH = 2NH3 + K2SO4 + 2H2O
2KNH2 + Zn(NH2)2 = K2[Zn(NH2)4]
NaNH2 + N2O = NaN3 + H2O
3NaNH2 + NaNO3 = NaN3 + 3NaOH + NH3
(молекула полярна)
N2H4 + O2 (воздух) = N2 + 2H2O
N2H4 + 2I2 = N2 + 4HI
2N2H4 + 2Na = 2NaN2H3 + H2
NaN2H3 + H2O = NaOH + N2 + 2H2
Note Bene: N2H5Cl N2H6Cl2
HNO3 + 6H0 = NH2OH + 2H2O (крист., t°пл = 33°, 100 t° = взрыв!)
NH2OH + HCl = [NH3OH]Cl
NH2OH + HNO2 = [NH3OH]NO2
[NH3OH]NO2 = N2O + 2H2O
2NH2OH + 2HI (при pH ~ = I2 + N2H4 + 2H2O
2NH2OH + I2 (pH>9) = 2HI + N2 + 2H2O
азотистоводородная кислота (~ pK уксусной кислоты)
2HN3 = H2 + 3N2 => в безводном состоянии взрывается от сотрясения и +t°
N2H4 + HNO2 = HN3 + 2H2O
HN3 + H2O (τ) = N2 + NH2OH
3HN3 + Cu = Cu(N3)2 + N2 + NH3
HN3 + 2HI = I2 + NH3 + N2
HN3 + 3HCl = 2Cl0 + N2 + NH4Cl
4HN3 + F2 = 4N2 + NH4F + FN3
AgN3 + Cl2 = AgCl + ClN3 + H2O
ClN3 + H2O ó HOCl + HN3
Note Bene: AgN3; Pb(N3)2; Hg(N3)2 – малорастворимые соли тяжелых металлов
NaN3; KN3 – растворимые и более устойчивые соли щелочных металлов
Pb(N3)2 – взрывается при ударе – детанатор
азотноватистая кислота
Ag2N2O2 + 2HCl = 2AgCl +H2N2O2
H2N2O2 (t°) = N2O + H2O
3Na2N2O2 (t°) = 2NaNO2 + 2N2 + 2H2O
Hg(ONC)2 – ртутный детанатор
2HCN + 2K = 2KCN + H2
KCN + S = KCNS
Алюминий и его соединения
2Al + 6H2O = 2Al(OH)3↓ + 3H2↑ + 836 кДж (Алюминий амальгамированный! т.е. очищеный от оксидной пленки ртутью)
4Al + 3O2 (700°) = 2Al2O3 + 1676 кДж
2Al + Cr2O3 (800°) = 2Cr + Al2O3 + 539 кДж
10Al + 3V2O5 (900-1100°) = 5Al2O3 + 6V
2Al + 3F2 (600°) = 2AlF3
2Al (порошок) + 3Hal2 (25°) = 2AlHal3
2Al + 3S (150-200°) = Al2S3
2Al + N2 (800-1200°) = 2AlN
Al + P (500-800°) = AlP
4Al + 3C (1500-1700°) = Al4C3
8Al + 3(FeIIFe2III)O4 (>2000°) = 4Al2O3 + 9Fe (термитная смесь)
Al + H2 ≠
3Li[AlH4] + AlCl3 (в эфире) = 4AlH3 + 3LiCl
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H2SO4 (конц) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3 (конц) = Al(NO3)3 + 3NO2 + 3H2O
2Al + 3H2SO4 (разб) = Al2(SO4)3 + 3H2
Al + 4HNO3 (разб) = Al(NO3)3 + NO + 2H2O
8Al +30HNO3 (оч. разб.) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
2Al + 2NaOH + 6H2O (80°) = 2Na[Al(OH)4] + 3H2
2Al + 6NaOH (450°) = 2NaAlO2 + 3H2 + 2Na2O
8Al + 18H2O + 5KOH + 3KNO3 (100°) = 8K[Al(OH)4] + 3NH3↑
2Al2O3 + 9C (1800°) = Al4C3 + 6CO
Al2O3 + 6HCl (конц) (τ, 80°) = 2AlCl3 + 3H2O
Al2O3 + 2NaOH (900-1100°) = 2NaAlO2 + H2O
Al2O3 + 2NaOH + 3H2O (τ, 80°) = 2Na[Al(OH)4]
Al2O3 + CoO (1100°, KCl) = (CoAl2)O4 (синий)
Al2O3 + Na2CO3 (1000-1200°) = 2NaAlO2 (метаалюминат натрия) + CO2
Al2O3 + MgO (1600°) = (MgAl2)O4
Al2O3 + 6KHSO4 = Al2(SO4)3 + 3K2SO4 + 3H2O
Al(OH)3 (170-200°) = AlO(OH) + H2O
2AlO(OH) (360-575°)= Al2O3 + H2O
Al(OH)3 + KOH (конц) = K[Al(OH)4] (р) (на деле имеем K[Al(OH)4(H2O)2] )
Al(OH)3 + 3HCl (разб) = AlCl3 + 3H2O
Al(OH)3 + NaOH (1000°) = NaAlO2 + 2H2O
Al(OH)3 + 3HF (конц) + 3NaF = Na[AlF6]↓ + 3H2O (синтез криолита)
Na[Al(OH)4] + CO2 = Al(OH)3 + NaHCO3
Na[Al(OH)4] + HCl = Al(OH)3 + NaCl + H2O
Na[Al(OH)4] (800°) = NaAlO2 + 2H2O
Na[Al(OH)4] (τ) = Al(OH)3↓ + NaOH (разбавление водой)
Na[Al(OH)4] + 4HCl = AlCl3 + NaCl + 4H2O
Na[Al(OH)4] + EO2 = Al(OH)3↓ + NaHEO3 (E = C, S)
3Na[Al(OH)4] + AlCl3 (конц) = 4Al(OH)3↓ + 3NaCl
2Na[Al(OH)4] + (NH4)2CO3 (100°) = 2AlO(OH)↓ + Na2CO3 + 2NH3↑ + 4H2O
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S
AlN + 3H2O = Al(OH)3↓ + NH3
AlP + 3H2O = Al(OH)3↓ + PH3
Al4C3 + 12H2O = 4Al(OH)3↓ + 3CH4
AlBr3 + 3KOH = Al(OH)3↓ + 3KBr
AlCl3 + 3NH3 + 3H2O (20°) = Al(OH)3↓ + 3NH4Cl
AlCl3 + 3NH3 + 3H2O (100°) = AlO(OH)↓ + 3NH4Cl + H2O
2Al(NO3)3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl
Сульфат алюминия-калия – алюмокалиевые квасцы
KAl(SO4)2*12H2O (120°) = KAl(SO4)2 + 12H2O
4KAl(SO4)2 (800-900°) = 2Al2O3 + 2K2SO4 + 6SO2 + 3O2
KAl(SO4)2 + 3KOH (конц) = K[Al(OH)4] + 2K2SO4
KAl(SO4)2 + 2Ba(NO3)2 = 2BaSO4↓ + Al(NO3)3 + KNO3
2KAl(SO4)2 + 3H2O + 3K2CO3 = 2Al(OH)3↓ + 3CO2↑ + 4K2SO4
2KAl(SO4)2 + 6H2O + 3K2S = 2Al(OH)3↓ + 3H2S↑ + 4K2SO4
KAl(SO4)2 + 4KOH (500°) = KAlO2 + 2K2SO4 + 2H2O
238U à 234Th + 4He
41H à 4He + 2β+ + 2
Xe + PtF6 = Xe[PtF6]
Xe + F2 = XeF2
Xe + F2O2 (-120°С) = XeF2 + O2
Xe + 2F2 (400°, 6 атм) = XeF4
Xe + 3F2 (250°, 50 атм) = XeF6
XeF2 + 2OH— = Xe + 1/2O2 + 2F— + H2O
2XeF2 + 4KOH = 2Xe + 4KF + O2 + 2H2O
5XeF2 + 2MnSO4 + 8H2O = 5Xe + 2H2SO4 + 10HF + 2HMnO4
XeF4 + Pt = PtF4 + Xe
XeF4 + 2Hg = 2HgF2 + Xe
6XeF4 + 12H2O = 2XeO3 + 24HF + 4Xe + 3O2
2XeF6 + SiO2 = 2XeOF4 + SiF4
XeF6 + H2O = XeOF4 + 2HF
XeF6 + RbF (-t°) = RbXeF7
2RbXeF7 (20°) = XeF6 + Rb2XeF8
2CsXeF7 (50°) = XeF6 + Cs2XeF8
Me2XeF8 (>400°) = Xe + 2Me + 4F2
H2XeF8 – октафторксеноновая кислота
XeO3 + H2O ó H2XeO4 ó H+ + HXeO4—
XeO3 + O3 + 4NaOH = Na4XeO6 + O2 + 2H2O
Ba2XeO6 + 2H2SO4(безводная, -t°) = 2BaSO4 + XeO4↑ + 2H2O
3XeO4 (t°>0°C, взрыв) = 2XeO3 + Xe + 3O2
Note Bene: KrF2, KrF4, RnF2, RnF4, RnF6, RnO3, Ar*6H2O, H6XeO6, H4XeO6, BaKrO4, Na4XeO6, Ba3XeO6, Na6XeO6, Ba2XeO6
Ванадий, Ниобий, Тантал и их соединения
4V + 5O2 = 2V2O5 (яд!)
2V + 5F2 = 2VF5
2V + 10HNO3 (конц, t°) = V2O5 + 10NO2 + 5H2O
V2O5 + 2KOH = 2KVO3 (метаванадат) + H2O
V2O5 + 4KOH = K2V2O7 (пированадат) + 2H2O
V2O5 + 6KOH = 2K3VO4 (ортованадат) + 3H2O
V2O5 + 6HCl (конц) = 2(VO)Cl2 (хлорид ванадила) + Cl2 + 3H2O
3V2O5 + 10Al = 6V + 5Al2O3
V2O5 + 6HCl (конц) = 2(VO)Cl2 + Cl2 + 3H2O
VO2 + H2SO4 = (VO)SO4 (сульфат ванадила) + H2O
4VO2 + 2NaOH = Na2V4O9 + H2O
2VCl2 + 2HCl (разб) = 2VCl3 + H2
2VCl3 + H2 (400°) = 2VCl2 + 2HCl
2VCl3 + H2SO4 (конц) = 2(VO)Cl2 + SO2↑ + 2HCl
(VO)SO4 + 3HCl + H0(Zn) = VCl3 + H2SO4 + H2O
10(VO)SO4 + 7H2O + 2KMnO4 = 5V2O5 + 2MnSO4 + 7H2SO4 + K2SO4
Шкала степеней окисления
+V V2O5 à NH4VO3 Ca(VO3)2 Na3VO4 Ag2V2O7
+IV VO2 à VO(OH)2 à Na2VO3 K4VO4 Ca4V4O9
à (VO)SO4 (VO)Cl2
+III V2O3 à V(OH)3 à KVO2 Cs[VCl4O]
à V2(SO4)3 VCl3
+II VO à V(OH)2 à VSO4 VCl2
Nb и Ta содержатся в рудах вместе, принцип разделения основан на разнице кипения их хлоридов:
NbCl5 t°кип = 247,5° TaCl5 t°кип = 236°
NbF5 + 2HF = H2[NbF7]
H2[NbF7] + [O] = H2[NbOF7]
TaF5 + 2HF = H2[TaF7]
H2[TaF7] + [O] ≠
[Промышленный способ получения (из буры):
[Na2B4O7*10H2O + H2SO4 = 4H3BO3↓ + Na2SO4 + 5H2O
[2H3BO3 (t°) = B2O3 + 3H2O
[B2O3 + 3Mg (t°) = 3MgO + 2B
2B + 3H2 ≠ (только косвенным путем)
4B + 3O2 (>700 °С) = 2B2O3
2B + N2 (>1200 °С) = 2BN (нитрид бора, огнеупорные материалы)
2B + 3F2 = 2BF3
2B + 3Cl2 (400 °С) = 2BCl3
2B + 3Br2 (600 °С) = 2BBr3
B + 2Ni = Ni2B
2B + 6KOH (t°) = 2KBO2 + 2K2O + 3H2
2B + 6H2O (пар) = 2H3BO3 + 3H2
B + 3HNO3 = H3BO3 + 3NO2
Mg3B2 + HCl = B2H6 B4H10 B5H11 B6H10 B10H11 Бораны – очень токсичные вещества
6MgB2 + 12HCl = H2 + B4H10 + 6MgCl2 + 8B
диборан тетраборан
B2H6 +6H2O = 2H3BO3 + 6H2
Note Bene: Cr4B Cr2B CrB Cr3B4 CrB2
BHal3 + 3H2O = H3BO3 + 3HHal
2BCl3 + 3H2 = 2B + 6HCl
BCl3 + NH3 = NH3─BCl3 (рассматривается как кислота Льюиса)
смотри также реакции с фтором
B2O3 + 3H2O = 2H3BO3 (B(OH)3 – в разной литературе по разному…)
H3BO3 ó H+ + H2BO3— ó 2H+ + HBO3— ó 3H+ + BO3— (k1=5,8*10-10 k2=4*10-13 k3=4*10-14)
4H3BO3 + 2NaOH = Na2B4O7 (тетраборат натрия) + 7H2O
H3BO3 + 3HOC2H5 = B(OC2H5)3 + 3H2O
Na2B4O7 + 10H2O = Na2B4O7*10H2O
Na2B4O7 + H2SO4 + 5H2O = Na2SO4 + 4H3BO3
H3BO3 (t°)à HBO2 + H2O↑
4HBO2 (t°)à H2B4O7 + H2O↑
H2B4O7 (t°)à 2B2O3 + H2O↑
H2 + O2 = H2O «гремучая смесь» – 4-74% H2 по объему
NH3 + H2O ó NH3*H2O ó NH4OH
CuSO4 + 5H2O = CuSO4*5H2O
FeSO4 + 7H2O = FeSO4*7H2O
CuO + H2 = H2O + Cu
Cu(OH)2 (t°) = CuO + H2O
BaO + H2O = Ba(OH)2
P2O5 + 3H2O = 2H3PO4
CaCl2 + 6H2O = CaCl2*6H2O
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
2K + H2O = 2KOH + H2↑
2Al + 6H2O = 2Al(OH)3 + 3H2↑
3Fe + 4H2O ó (FeIIFe2III)O4 + 4H2↑
2Cl2 + 2H2O = O2 + 4HCl
2BaO + O2 (изб) (<500°) = 2BaO2
BaO2 + H2SO4 = BaSO4↓ + H2O2
3F2 + 3H2O = F2O↑ + 4HF + H2O2 (взрывной характер реакции)
Na2O2 + 2H2O = 2NaOH + H2O2
H2O2 + Cl2 = 2HCl + O2
2H2O2 (>150°, кат. MnO2) = 2H2O + O2
H2O2 (разб) + 2NaOH (разб) =NaHO2 + H2O
H2O2 + Ag2O = H2O + O2 + 2Ag
5H2O2 (30%) + I2 (т) = 2HIO3 + 4H2O
H2O2 (10%) + SO32- = SO42- + H2O
PbS (черн.) + 4H2O2 = PbSO4 (бел.)↓ + 4H2O
H2O2 + OH— + [Sn(OH)3]— = [Sn(OH)6]2-
H2O2 (конц) + Ag2O = 2Ag↓ + O2↑ + H2O
2H2O2 (конц) + Ca(ClO)2 = CaCl2 + 2H2O + 2O2↑
HNO2 + H2O2 = HNO3 + H2O
2NH3 + H2O2 = N2 + 6H2O
2HIO3 + 5H2O2 = 5O2 + I2 + 6H2O
Ba(OH)2 + H2O2 = BaO2 + 2H2O
2NaOH (т) + H2O2 (конц) (0°C) = Na2O2↓ + 2H2O
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 8H2O
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
2CH4 + O2 ó 2CO + 4H2
2H3O+ + 2e = H2↑ + 2H2O
2KH (t°) = 2K + H2↑
Ca + 2H2O = Ca(OH)2 + H2↑
CO + H2O ó CO2 + H2↑
CH4 + H2O (1000°) ó CO2 + 3H2
NaH + H2O = NaOH + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2↑
H2O + C ó H2 + CO
2H2 + O2 (550°) = 2H2O
3H2 + N2 (500°, p, кат. Fe, Pt) ó 2NH3
2H2 + CO (400°/300атм. ZnO/Cr2O3) → CH3OH
2Li + H2 = 2LiH
CH2=CH2 + H2 = CH3-CH3
CO + 2H2 ó CH3OH
CuO+H2 (150-250°) = Cu + H2O
H2 + Ca (500-700°) = CaH2
H2 (Ni) = 2H0
Mg + 2H+ = Mg2+ + 2H0 (водород in statu nascendi, лат. – в момент возникновения, время жизни 0,5 секунд)
5H0 + 3H+ + MnO4— = Mn2+ + 4H2O
2H0 (Zn, разб. HCl) + KNO3 = KNO2 + H2O
2H0 (Zn, разб. HCl) + O2 = H2O2
Использование амфигенов в щелочной среде
Zn + 2OH— + 2H2O = [Zn(OH)4]2- + 2H0
8H0 + KNO3 (100°) = NH3↑ + KOH + 2H2O
Реакция Зинина:
Fe + 2H+ = Fe2+ + 2H0
C6H5NO2 + 6H0 = C6H5NH2 + 2H2O
Галогенов соединения. Кислоты
В одном объеме воды можно растворить около 400 объемов HCl, 530 объемов HBr и около 400 объемов HI. Именно поэтому HCl и HF получают действием концентрированной (безводной!) серной кислоты на твердые галогениды:
KF + H2SO4(конц) = HF + KHSO4
KCl + H2SO4(конц) = HCl + KHSO4
Аналогично HBr и Hl получить не удается, т.к. они являются сильными восстановителями и окисляются концентрированной серной кислотой. Их получают иным способом (например, гидролизом галогенидов фосфора):
2P (красный) + 3Br2 + 6H2O = 6HBr + 2H3PO3
2P (красный) + 3I2 + 6H2O = 6HI + 2H3PO3
Ag+ + Hal— = AgHal↓
AgCl – белый, AgBr – желтовато-белого и AgI – ярко-желтого цвета осадок.
2NaNO3(насыщ) + CaCl2(насыщ) = 2NaCl(тв)↓ + Ca(NO3)2(р-р)
SiO2 + 4HF = SiF4↑ + 2H2O
2AgHal(тв) (hν) à 2Ag(тв) + Hal2↑
AgBr + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaBr
6FeSO4 + KClO3 + 12KOH + 3H2O = 6Fe(OH)3↓ + KCl + 6K2SO4 (по последним данным вещество Fe(OH)3 не сушествует)
6FeSO4 + KClO3 + 12KOH = 3Fe2O3 + KCl + 6K2SO4 + 6H2O (Fe2O3*H2O)
6I2 + 6Ba(OH)2 = 5BaI2 + Ba(IO3)2 + 6H2O
6KClO3 + 5S + 2H2O = 3Cl2 + 3K2SO4 + 2H2SO4
5KBr + KBrO3 + 3H2SO4 = 3Br2 + 3K2SO4 + 3H2O
F2 + 2Cl — = 2F — + Cl2
Cl2 + 2Br — = 2Cl — + Br2
Br2 + 2I — = 2Br — + I2
2Al + 3F2 = 2AlF3 + 2989 кДж
2Fe + 3F2 = 2FeF3 + 1974 кДж
3F2 + 3H2O = F2O↑ + 4HF + H2O2 (взрывной характер реакции)
H2 + F2 = 2HF + 547 кДж
Hal2 + F2 = 2HalF
см. реакции с благородными газами
3BrF5 + Br2 = 5BrF3
2ClF3 + Br2 = 2BrF3 + Cl2
5ClF3 + 4I2 = 3IF5 + 5ICl
Note Bene: ClF, ClF3, ClF5, BrF3, BrF5, IF5, IF7
Si + 2F2 = SiF4 + 1615 кДж
Xe + F2 = XeF2 + 152 кДж
RClm + SbF3 = RClm-nFn (реакция Свартса)
C6H5NH2 (HNO2, HBF4) à C6H5─N2+BF4— (t°) à C6H5F + N2 + BF3 (реакция Шимана)
CHClF2 (t°, -HCl) à CF2=CF2 à (-CF2-)n
nC + 2nF2 à CF4, C2F6, C3F8, C6F12, C6F12 (циклич.) – не ядовиты
nC (графит) + n/2F2 (200-450°) à (CF)n «твердая смазка» (туда же MoS2 и графит)
(CF)n (t°) à C + CF4 + C2F6 + C3F8
CaF2 + H2SO4 (конц., 96-99%) = CaSO4 + 2HF
HF (4000°) à H + F (40% от общ.)
TlF3 + H2O = Tl(OH)3 + 3HF
трифтор бороксин
3R─Mg─Hal (реактив Гриньяра) + BF3 = R3B + 3Mg(Hal)F
Na2B4O7*10H2O + 6CaF2 + 8H2SO4 = 4BF3 + 2NaHSO4 + 6CaSO4 + 17H2
Na2B4O7*10H2O + 12HF = Na2[O(BF3)4] + 16H2O
2B2O3 + 12NH4F = (NH4)2[O(BF3)4] + 10NH3 + 5H2O
(NH4)2[O(BF3)4] + H2S2O7 = 4BF3 + 2H2SO4 + 2NH3 (H2S2O7 = H2SO4*SO3)
2(BO)n + 2nSF4 = nB2F4 (газ) + 2nSOF2
CH2=CH2 + B2F4 = F2BCH2CH2BF2
Note Bene: KBF4, NaBF4, NH4BF4
H3BO3 + 3HF ó HBF3(OH) + 2H2O
HBF3(OH) + HF ó HBF4 + H2O α20 (HBF4) = 1,38
Note Bene: AlF3*nH2O n=9, 3.5, 3, 1, 0.5
4Al + 6OF2 = 4AlF3 + 3O2
3CF2=CF2 + 2OF2 = 2CF3CF3 + 2COF2
3HF + Al(OH)3 = AlF3 + 3H2O
H2SiF6 + 2Al(OH)3 + 2H2O = 2AlF3*3H2O + SiO2
Al2O3*3H2O + H2SiF6 = 2AlF3 + SiO2 + 4H2O
SiO2 + 2CaF2 + 2H2SO4 = SiF4 + 2CaSO4 + 2H2O
3SiF4 + 2H2O = 2H2SiF6 + SiO2
3SiF4 + (x+2)H2O = 2H2SiF6 + SiO2*xH2O
SiF4 + 2NaF = Na2SiF6
SiF4 + 3RMgHal (реактив Гриньяра) = R3SiF + 3Mg(Hal)F
SiO2 + 6HF = H2SiF6 + H2O
Na2SiF6 + 6NaOH = 6NaF + Na2SiO3 + 3H2O
H2SiF6 + 2NaOH = Na2SiF6 + 2H2O
H2SiF6 + MgCO3 = MgSiF6 + CO2 + H2O
H2SiF6 + 2NaCl = Na2SiF6 + 2HCl
SiF62- + 2H2O ó SiO2 + 4H+ + 6F— K=5,4*10-27
H2SiF6 + 6NaOH + (x-4)H2O = 6NaF + SiO2*xH2O
3Na2SiF6 + 4Al (t°) = 2Na3AlF6 + 2AlF3 + 3Si Na3AlF6 – фторирование водопроводной воды
Note Bene: PF3, PF5, P2F4, O=PF3
Cu + 2NF3 = CuF2 + N2F4
SO2 + NF3 = SOF2 + NOF
SOF2 + 2NOF = SF4 + NO2 + NO
SO2 + 2NF3 = SO2F2 + N2F4
V2O5 + 3NF3 = 2VOF3 + 3NOF
VOF3 + NOF = NO+(VOF4)—
V2O5 + 6NOF = 2VOF3 + 3NO + 3NO2
N2F4 + N2O5 = ONNF2 + …
N2F4 + SF4 = SF5NF5 + …
P2O5 + 2HF + H2O = 2H2PO3F – монофторангидрид фосфорной кислоты
2NaOH + H2PO3F = 2H2O + Na2PO3F – компонент зубных паст
Диизопропиловый
эфир фторангидрида
фосфорной кислоты
Натриевая соль фторангидрида
фосфорной кислоты
HPO2F2 + H2O = H2PO3F + HF (такие кислоты иногда называют сверхкислотами)
HSO3F – жидкость с t°кип 162,7°C и плотностью 1,7264 (25°), термически устойчива (до 900°).
S + 2HSO3F (t°) = 3SO2 + 2HF
NaCl + HSO3F = NaSO3F + HCl
MgCl2 + 2HSO3F = Mg(SO3F)2 + 2HCl
AlCl3 + 2HSO3F = ClAl(SO3F)2 + 2HCl
C6H6 + HSO3F à C6H5SO2F + H2O à C6H5SO3H + HF
C6H5SO2F + C6H6 = C6H5SO2C6H5
RNH2 + HSO3F = RNHSO3H + HF
RCOOH + HSO3F = RCOF + H2SO4
HF + SO3 = HSO3F η – 98,5%
2FClO3 (>470°) = 2FCl + 3O2
FClO3 + KOH = KClO4 + HF
FClO3 + AlCl3 ó ClO3+ + AlCl3F—
C6H6 + ClO3+ = C6H5ClO3 + H+
C6H6 + FClO3 (кат.: AlCl3) = C6H6ClO3 перхлорилбензол
KClO3 + F2 = FClO3 + KF
KClO4 + 2HSO3F = KF + H2SO4 + FClO3
KClO4 + 2HF + SbF5 (40-50°) = FClO3 + KSbF6 + H2O (лабораторный способ)
Токсично! = COCl2 Яд! 10 x COCl2
Номенклатура фторуглеродных соединений:
-
В связи с тем, что весь водород может быть заменен фтором, применяют приставку перфтор, которая избавляет от перегруженности названия и его трудности в плане понимания:
CF3CF2CF2I перфтор – н – пропилиодид (1,1,1,2,2,3,3 – гептафторид – 3 – иодпропан)
-
В случае присутствия водорода (но не тогда когда его больше фтора!), его обозначают приставкой гидро, с указанием его положения:
CHF2CClFCF3 – 1 – гидро – 2 – хлор – перфторпропан
-
Часто названия дают исходя из функциональных групп (тут, правда, мне не все понятно):
C6F5NH2 – перфторанилин (а как же водород при азоте…)
CF2Br2 – 2 – бром – перфторметан
Цифровое обозначение фреонов:
-
Пишем фреон или букву F.
-
Указываем количество углерода минус один, если ноль то не пишем.
-
Указываем количество водорода плюс один.
-
Указываем количество фтора.
-
Наличие брома указывают буквой B с количеством атомов в соединении.
-
Циклическую структуру указываем буквой C.
-
Под остатком неиспользуемых атомов подразумеваем хлор.
-
Более распространенный изомер (в плане получения) помечаем буквой «а».
Фреон – 12B2; Фреон – 12; Фреон – 11; Фреон – 22; F – 113; F – 114B2; F – C318.
CClF2CClF2 F-114
CCl2FCClF2 F-113
CHClF2 F-22
[2CaOCl2 + CO2 + H2O = CaCO3 + CaCl2 + 2HOCl
[2Cl2 + Ca(OH)2 = CaCl2 + Ca(OCl)2 + 2H2O (Хлорная известь)
2Cl2 + Si = SiCl4 (ж) + 662 кДж
3Cl2 + 2Al = 2AlCl3 (кр) + 1405 кДж
3Cl2 + 2Fe = 2FeCl3 (кр) + 804 кДж
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O (при нагревании)
Cl2 + 2HBr = 2HCl + Br2
Cl2 + 2HI = 2HCl + I2
Cl2 + 2KBr = 2KCl + Br2
3Cl2 + KBr + 6KOH = KBrO3 + 6KCl + 3H2O
Cl2 + 2NaOH = NaCl + NaClO + H2O (на холоде)
Cl2 + CH2=CH2 = CH2Cl─CH2Cl
Cl2 + CH3─CH3 = CH3─CH2Cl + HCl
Cl2 + H2 = 2HCl (г) + 185 кДж
Cl2 + H2O ó HCl + HClO – 25 кДж
Cl2 + HCOOH = CO2 + 2HCl
Cl2O + H2O = 2HClO
8HCl + K2MnO4 = 2Cl2 + 2KCl + MnCl2 + 4H2O
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
2HCl + CaOCl2 = CaCl2 + Cl2 + H2O
Si + 2Br2 = SiBr4 (ж) + 433 кДж
2Fe + 3Br2 = 2FeBr3 + 538 кДж
H2 + Br2 = 2HBr (г) + 73 кДж
6KBr + K2Cr2O7 + 7H2SO4 = 3Br2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
AgBr + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaBr
Fe + I2 = FeI2 + 116 кДж
Fe + 2HI = FeI2 + H2
H2 + I2 ó 2HI – 53 кДж
2HIO3 (t°) = I2O5 + H2O
Германий, Олово, Свинец и их соединения
Ge + 4H2SO4 = Ge(SO4)2 + 2SO2 + 4H2O
Ge + 4HNO3 = H2GeO3 + 4NO2 + H2O
Sn + 2NaOH + 2H2O = Na2[Sn(OH)4] + H2
SnO + 2HCl = SnCl2 + H2O
SnO + 2KOH + H2O = K2[Sn(OH)4]
Sn + 2H2SO4 = SnSO4 + SO2 + 2H2O
Sn + 4HNO3 = H2SnO3 + 4NO2 + H2O
5SnSO4 + 2KMnO4 + 8H2SO4 = 5Sn(SO4)2 + 2MnSO4 + K2SO4 + 2H2O
SnCl2 + H2O = Sn(OH)Cl↓ + HCl
SnCl2 + 2FeCl3 = SnCl4 + 2FeCl2
SnCl2 + HgCl2 + 2HCl = Hg + H2[SnCl6] см. также ртуть
Pb + 2NaOH + 2H2O = Na2[Pb(OH)4] + H2
2PbO + PbO2 (t°) = Pb3O4 – свинцовый сурик
Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2H2O
Pb(OH)2 + KOH = K2[Pb(OH)4]
Железо, Кобальт, Никель и их соединения
Шкала степеней окисления
+VII FeO4
+VI FeO42- K2FeO4 BaFeO4
+III Fe3+ Fe2O3 FeO(OH) Fe2(SO4)3 FeCl3 NaFeO2 Na3[Fe(OH)6]
+II Fe2+ FeO Fe(OH)2 FeSO4 FeCl2 FeS
0 Fe
3Fe + 2O2 (160°) = (FeIIFe2III)O4
2Fe + 3Cl2 (200°) = 2FeCl3
Fe + S (600°) = FeS
Fe + 2S (700°) = FeII(S2-I)
3Fe + 4H2O (пар) (800°) = (FeIIFe2III)O4 + 4H2
2Fe + 3H2O (пар) (t°) = Fe2O3 + 3H2
Процесс ржавления (поэтапно):
(I) 2Fe + 2H2O (влага) + O2 (τ) = 2Fe(OH)2
(II) 2Fe + 2H2O (влага) + O2 + 4CO2 (τ) = 2Fe(HCO3)2
Fe(HCO3)2 (τ) = Fe(OH)2 + 2CO2
(III) 4Fe(OH)2 + O2 + (2n-4)H2O (влага) (τ) = 2(Fe2O3*nH2O)
Fe2O3*nH2O (τ) = 2FeO(OH) + (n-1)H2O
(IV) Fe(OH)2 + 2FeO(OH) (τ) = 2H2O + (FeIIFe2III)O4 (ржавчина)
2Fe + 3Br2 = 2FeBr3
Fe + H2SO4 (разб) = FeSO4 + H2
2Fe + 6H2SO4 (конц) = Fe2(SO4)3 + 3SO2 + 6H2O
2Fe + 6HNO3 (конц) = Fe(NO3)3 + 3NO2 + 6H2O
Fe + 4HNO3 (разб) = Fe(NO3)3 + NO↑ + 2H2O
Fe + 2NaOH (50%) + 2H2O (100°) = Na2[Fe(OH)4]↓ + H2↑
Fe + 2KOH + 2KNO3 (420°) = K2FeO4 + 3KNO2 + H2O
Fe + 5CO (>150°) à [Fe(CO)5] (250°) à Fe + 5CO
2(FeIIFe2III)O4 (>1538°) = 6FeO + O2
(FeIIFe2III)O4 + 8HCl (разб) = FeCl2 + 2FeCl3 + 4H2O
(FeIIFe2III)O4 + 10HNO3 (конц) = 3Fe(NO3)3 + NO2 + 5H2O
4(FeIIFe2III)O4 + O2 (450-600°) = 6Fe2O3
(FeIIFe2III)O4 + 4H2 (1000°) = 4H2O + 3Fe (особо чистое)
(FeIIFe2III)O4 + CO (500-800°) = 3FeO + CO2
(FeIIFe2III)O4 + Fe (900-1000°) à 4FeO
4FeO (560-700°) à (FeIIFe2III)O4 + Fe
(FeIIFe2III)O4 + 8Al (>2000°) = 4Al2O3 + 9Fe
3Fe2O3 + C (t°) = 2(FeIIFe2III)O4 + CO
6Fe2O3 (1200-1300°) = 4(FeIIFe2III)O4 + O2
Fe2O3 + 6HCl (разб) (τ, 600°, p) = 2FeCl3 + 3H2O
Fe2O3 + 2NaOH (конц) (τ) = H2O + 2NaFeO2 (красн.) диоксоферрат (III)
Fe2O3 + MO = (MIIFe2III)O4 (M = Cu, Mn, Fe, Ni, Zn)
3Fe2O3 + H2 (400°) = 2(FeIIFe2III)O4 + H2O
Fe2O3 + 3H2 (1050-1100°) = 3H2O + 2Fe (особо чистое)
Fe2O3 + Fe (900°) = 3FeO
Fe2O3 + 3H2S (750°) = 2FeS + 3H2O + S
3Fe2O3 + CO (400-600°) = 2(FeIIFe2III)O4 + CO2
FeO – бертоллид (Fe0,89O, Fe0.91O, Fe0.93O)
FeO(OH) + 3HCl (разб) = FeCl3 + 2H2O
FeO(OH) (NaOH, 75°, τ) à Na3[Fe(OH)6], Na5[Fe(OH)8]
2FeO(OH) + 3Ba(OH)2 + 2H2O (τ, 90°) = Ba3[Fe(OH)6]2↓ (желт.) – гексагидроксоферрат (III)
2FeO(OH) + Fe(OH)2 (600-1000°) = (FeIIFe2III)O4 + 2H2O
2FeO(OH) + 3H2 (500-600°) = 4H2O + 2Fe (особо чистое)
2FeO(OH) + 3Br2 + 10KOH = 2K2FeO4 + 6H2O + 6KBr
Fe(OH)2 (150-200°, в атм. N2) = FeO + H2O
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe(OH)2 + 2HCl (разб) = FeCl2 + 2H2O
Fe(OH)2 + 2NaOH (>50%) = Na2[Fe(OH)4]↓ (сине-зеленый)
Fe(OH)2 + 2NH4Cl (конц) (τ, 100°) = FeCl2 + 2NH3 + 2H2O
4Fe(OH)2 (суспензия) + O2 (τ) = 4FeO(OH)↓ + 2H2O
2Fe(OH)2 (суспензия) + H2O2 (разб) = 2FeO(OH)↓ + 2H2O
Fe(OH)2 + KNO2 (конц) (60°) = FeO(OH)↓ + NO↑ + KOH
Fe(OH)3 + 3KOH = K3[Fe(OH)6]
Fe(OH)3 + 2HNO3 = FeOH(NO3)2 + 2H2O
Fe(OH)3 + HNO3 = Fe(OH)2NO3 + H2O
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
2FeCl3 + 3K2S = 2FeS + S + 6KCl
2FeS + 10H2SO4 (конц) = Fe2(SO4)3 + 9SO2 + 10H2O
2FeS + 36HNO3 (разб) = 10Fe2(SO4)3 + 10S + 3N2 + 18H2O
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
2Fe2(SO4)3 (t°) = 2Fe2O3 + 6SO2 + 3O2
Fe2(SO4)3 (500-700°) = Fe2O3 + 3SO3
4Fe(NO3)3 (t°) = 2Fe2O3 + 12NO2 + 3O2
4[Fe(NO3)3*9H2O] (600-700°) = 2Fe2O3 + 12NO2 + 3O2 + 36H2O
FeCO3 (490-550°) = FeO + CO2
4K2FeO4 (700°) = 4KFeO4 + 3O2 + 2K2O
4K2FeO4 + 6H2O (гор) = 4FeO(OH)↓ + 8KOH + 3O2↑
K2FeO4 + 2(NH3*H2O) (80°) = 2FeO(OH)↓ + N2↑ + 2H2O + 4KOH
K2FeO4 + 3C2H5OH (40°) = Fe2O3 + 3CH3C(H)O↑ + 4KOH + H2O
K3[Fe(CN)6], K4[Fe(CN)6] – красная и желтая кровяная соль, реактив для качественного определения ионов Fe2+ и Fe3+ соответственно (гексацианоферрат II и III).
K4[Fe(CN)6] + Fe3+ = KFeIII [FeII(CN)6]↓ + 3K+ – берлинская лазурь
K3[Fe(CN)6] + Fe2+ = KFeII [FeIII(CN)6]↓ + 2K+ – турнбуллевая синь
KFeII [FeIII(CN)6] ó KFeIII [FeII(CN)6] => одно и тоже вещество
Co3O4 + 4C = 3Co + 4CO
Co + H2SO2 = CoSO2 + H2
Co + 2HCl = CoCl2 + H2
CoCl2 + 2NaOH = Co(OH)2 + 2NaCl
2Co(OH)2 + Br2 + 2H2O = 2Co(OH)3 + 2HBr
Ni + H2SO4 = NiSO4 + H2
Ni + 4CO = Ni(CO)4
2BaO2 (t°) = 2BaO +O2
2H2O2 (t°) = 2H2O + O2
2HgO (t°) = 2Hg + O2
2KClO3 (150-300°, кат. MnO2) = 2KCl + 3O2
2KMnO4 (200-240°) = K2MnO4 + MnO2 + O2
2KNO3 (400-520°) = 2KNO2 + O2
2Pb3O4 (t°) = 6PbO + O2
4K2Cr2O7 (t°) = 4K2CrO4 + 2Cr2O3 + 3O2
2HgO (450-500°) = 2Hg + O2
2H2S + 3O2 = 2SO2 + 2H2O
2H2S + O2 = 2S + 2H2O
2NO + O2 = 2NO2
C + O2 (600-700°) = CO2
2C + O2 (1000°) = 2CO
N2 + O2 ó 2NO — Q
S + O2 (280-360°) = SO2
5O2 + 4P (240-400°) = 2P2O5
O2 + 4Li (>200°) = 2Li2O
O2 + Na (250-400°) = Na2O2
O2 + 2Hg (250-350°) = 2HgO (красн)
Атомарный кислород
KNO3 (t°) = KNO2 + O0 (кислород in statu nascendi, лат. – в момент возникновения)
O0 + C (графит) = CO2
3O2 (УФ-изл. или 250°, кат. MnO2, Pt) ó 2O3
Электрический разряд в озонаторе:
O2 ó 2O0
O2 + O0 ó O3
O3 + MO2 = O2 + MO3 (озониды) (ниже 0°C, M = K, Rb, Cs)
4O3 + 4KOH = 4KO3 + O2 + 2H2O
O3 + NO ó NO2 + O2
O3 + H2O + Mn2+ = MnO2↓ + O2↑ + 2H+
4O3 + 3PbS (влажн.) = 3PbSO4
O3 (Al, Ag, Cl2) à Al2IIIO3, (AgIAgIII)O2, ClVIO3
2KI + O3 + H2O = I2 + 2KOH + O2 (качественная реакция на озон)
H2C=CH2 + O3 = (H2CO)2O
Кремний. Оксиды. Силикаты. Силициды. Силаны
H2SiO3 ó H+ + HSiO3— (k1 = 2,2 *10-10)
H2SiO3 – метакремниевая кислота
H4SiO4 – ортокремневая кислота
H2Si2O5 – двуметакремниевая кислота
Si + O2 = SiO2
2Si + O2 = 2SiO
Si + SiO2 = 2SiO
4Si + S8 = 4SiS2
Si + C = SiC (карборунд)
3Si + 4HNO3 + 12HF = 3SiF4↑ + 4NO + 8H2O
Si + 2NaOH + H2O = Na2SiO3 + H2
3Si + 2MgO = Mg2Si + 2SiO
Si + 2Mg = Mg2Si
SiO2 + 2KOH = K2SIO3 + H2O
SIO2 + 4HF = SiF4 + 2H2O
SiO2 + CaO (t°) = CaSiO3
SiO2 + Na2CO3 (t°) = Na2SIO3 + CO2
6SiO2 + Na2CO3 + CaCO3 = Na2O*CaO*6SiO2 (стекло) + 2CO2↑
Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓
K2SiO3 + H2O ó 2KOH + H2SiO3↓ (жидкое стекло)
CaO*SiO2 + CO2 + H2O = CaSO3↓ + H2SiO3↓ (обычный цемент)
[Ca3SiO5 + H2O = Ca2SiO4 + Ca(OH)2 (портландский цемент)
[Ca2SiO4 + 4H2O = Ca2SiO4*4H2O
2CaH2 + Si = Ca2Si + 2H2
Ca2Si + 4HCl = 2CaCl2 + SiH4 (моносилан, запах плесени)
SinH2n+2 где n от 1 до 6
SiH4 + 2O2 = SiO2 + 2H2O (самопроизвольно воспламеняется)
SiH4 + 2KOH + H2O = K2SiO3 + 4H2
SiH4 + 2H2O = SiO2 + 4H2
SiH4 = Si + 2H2
2SiH3Cl + Ca = Si2H6
Кремневая органика – соединения, в которых углерод непосредственно связан с кремнием Si-C
Si(CH3)4 Si(C2H5)4 Si(CH3)3OCH3 Si(CH3)2(OCH3)2 – при гидролизе этих соединений получаются гидроксильные производные, которые далее могут конденсироваться с образованием полимерных соединений:
Высокомолекулярные соединения, содержащие группировки –Si-O-Si-O-, называют силиконами.
От соотношения количества радикальных групп и кремния зависят свойства силиконов:
R/Si > 2 – вязкие жидкости
R/Si ~ 2 – эластичные каучукоподобные массы
R/Si < 2 – твердые вещества с различной степенью жесткости
Марганец. Перманганаты. Манганаты
Шкала степеней окисления
+VII Mn2O7 MnO4— HMnO4 KMnO4
+VI Mn42- K2MnO4
+IV MnO2 Mn(SO4)2 MnF4 K4[MnF8]
+III Mn2O3 MnO(OH) Mn2(SO4)3 MnF3 K3[MnF6]
+II Mn2+ MnO Mn(OH)2 MnSO4 MnCl2
Mn + O2 (<450°) = MnO2
4Mn+3O2 (<800°) =2Mn2O3
5Mn + 3O2 (>800°) = 2MnO + (MnIIMnIII2)O4 – «окалина»
Mn + Cl2 (200°) = MnCl2
Mn + S (<1580°) = MnS
Mn + 2HCl = MnCl2 + H2
MnCl2 + 2AgNO3 = 2AgCl↓ + Mn(NO3)2
MnO2 + 4HCl (конц) = MnCl2 + Cl2 + 2H2O
4MnO2 (530-585°) = 2Mn2O3 + O2
2MnO2 + 2H2SO4 (конц) = MnSO4 + O2↑ + 2H2O (кипячение)
MnO2 + H2SO4 (гор) + KNO2 = MnSO4 + KNO3 + H2O
MnO2 + 2H2SO4 + 2FeSO4 = MnSO4 + Fe(SO4)3 + 2H2O
MnO2 + SO2 (450°) = MnSO4
MnO2 + 2KOH + KNO3 (350-450°) = K2MnO4 + KNO2 + H2O
3MnO2 + 3K2CO3 + KClO3 (400°) = 3K2MnO4 + KCl + 3CO2
MnO4— + 5e (кислая среда) à Mn2+
MnO4— + 3e (нейтральная среда) à MnO2
MnO4— + 1e (щелочная среда) à K2MnO4
2MnSO4 + 2H2O (электролиз, 40°) = 2Mn↓ + O2↑ + 2H2SO4
2Mn(NO3)2 + 5PbO2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O
Mn(NO3)2 (t°) = MnO2 + 2NO2
2KMnO4 (200-240°) = K2MnO4 + MnO2 + O2
2KMnO4 + 2H2O (τ) = MnO2↓ + 3O2↑ + 4KOH
2KMnO4 + 16HCl (конц, 80°) = 2MnCl2 + 5Cl2↑ + 8H2O + 2KCl
2KMnO4 + 2H2SO4 (96%) = 2KHSO4 + Mn2O7 + H2O (на холоде)
4KMnO4 (насыщ) + 4KOH (15%) (100°) = 4K2MnO4 + O2↑ + 2H2O
2KMnO4 + 2(NH3*H2O) (50°) = 2MnO2↓ + N2↑ + 4H2O + 2KOH
2KMnO4 + Na2SO3 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
2KMnO4 + 6NaCl + 4H2O = 3Cl2 + 2MnO2 + 6NaOH + 2KOH
2KMnO4 + 10KI + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
2KMnO4 + 2NaI + 2KOH = 2K2MnO4 + I2 + 2NaOH
2KMnO4 + 5SnSO4 + 8H2SO4 = 5Sn(SO4)2 + 2MnSO4 + K2SO4 + 8H2O
2KMnO4 + 3SO2 + 2H2O = K2SO4 + 2H2SO4 + 2MnO2
2KMnO4 + 3H2S (насыщ) = 2MnO2↓ + 3S↓ + 2H2O + 2KOH
2KMnO4 + 2H2O + 3Mn2+ = 5MnO2↓ + 4H+
3K2MnO4 (конц) + 2H2O (τ) = 2KMnO4 + MnO2↓ + 4KOH
3K2MnO4 + 4HCl (разб) = 2KMnO4 + MnO2↓ + 2H2O + 4KCl
K2MnO4 + 8HCl (конц) = MnCl2 + 2Cl2↑ + 4H2O + 2KCl
3K2MnO4 + 2H2O + 4CO2 = 2KMnO4 + MnO2↓ + 4KHCO3
2K2MnO4 + Cl2 (насыщ) = 2KMnO4 + 2KCl
K2MnO4 + C2H5OH (τ, 30-50°) = MnO2↓ + CH3C(H)O↑ + 2KOH
2K2MnO4 + 2H2O (электролиз) = H2↑ + 2KMnO4 + 2KOH
Медь, Серебро, Золото и их соединения
CuCl2 + Cu = 2CuCl
Cu + 2H2SO4 (конц) = CuSO4 + SO2 + 2H2O
Cu + 4HNO3 (конц) = Cu(NO3)3 + 2NO2 + 2H2O
3Cu + 8 HNO3 (разб) = 3Cu(NO3)3 + 2NO + 4H2O
Cu2S + 14HNO3 = 2Cu(NO3)2 + H2SO4 + 10NO2 + 6H2O
CuCl + 2NH3 = [Cu(NH3)2]Cl
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
[Cu(H2O)6]Cl2 (сине-голубая окраска р-ра) + 2NaOH = [Cu(OH)2(H2O)4]↓ (голубой осадок) + 2NaCl + 2H2O
[Cu(OH)2(H2O)4] + 4NH3 = [Cu(NH3)4(H2O)4] (ярко-синий) + 2H2O
2[Cu(NH3)2]Cl + K2S = Cu2S↓ + 4NH3 + 2KCl
2Ag + 2H2SO4 (конц) = Ag2SO4 + SO2 + 2H2O
Ag + 2HNO3 (конц) = AgNO3 + NO2 + 2H2O
3Ag + 4HNO3 (разб) = 3AgNO3 + NO + 2H2O
4Ag + 8NaCN + O2 + 2H2O = 4Na[Ag(CN)2] + 4NaOH
Ag+ + Hal— = AgHal↓
2AgNO3 + 2NaOH = Ag2O↓ + 2NaNO3 + H2O
AgCl + 2NH3 = [Ag(NH3)2]Cl
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH
Ag2S + 4NaCN = 2Na[Ag(CN)2] + Na2S
Hg(Z = 80, M = 197) + e(Z = -1, M = 0) à Au(Z = 79, M = 197) Мечта алхимика! J
Au2Cl2 (Метью и Уотерс 1900г)
[AuBr3(P(C6H5)3)] (1946г)
AuI; Au2Cl6 (1960г)
AuF5 (1972г)
Минералы:
AuTe2 калаверит
Au2Te3 монтбрайит
AuAgTe4 сильванит
2Au + 3Br2 (t°) = Au2Br6
2Au + 3Cl2 (>200°) = 2AuCl3
Au + S ≠
3H2S + [Au2Cl6] (в эфире) = Au2S3 + 6HCl
H2S + 2K[Au(CN)2] = Au2S + 2HCN + 2KCN
Au2O3 + 4NH3 = «Гремучее золото» взрывается!
Au(OH)3 + KOH = K[Au(OH)4]
2CsAu + O2 (400°) = 2CsAuO
AuCl + CO (90°) = [AuCl(CO)]
Au2Cl6 + 2C6H6 = [(AuCl2C6H5)2] + 2HCl
[AuCl(CO)] + C6H5N = [C6H5N→AuCl] + CO
Au(OH)3 + HCl = H[AuCl4] + 3H2O (золотохлороводородная к-та)
Au(OH)3 + HCl (150°, 2 недели) = AuOCl
AuOCl (290°) = 2Au + O2 + Cl2
Au(OH)3 + KOH = KAuO2*3H2O (ион [Au(OH)4]— ?)
2Au(OH)3 (t°) = Au2O3 + 3H2O
4Au + 8NaCN + O2 + 2H2O = 4Na[Au(CN)2] + 4NaOH
nK[Au(CN)2] + nHCl = (-Au-CN-)n + nKCl + nHCN
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au
HNO3 + 3HCl + Au = AuCl3 + NO + 2H2O
см. также растворение в селеновой кислоте
2AuCl3 + 3H2O2 + 6KOH = 2Au + 3O2 + 6KCl + 6H2O
Мышьяк, Сурьма, Висмут и их соединения
As2O3 + 3H2O = 2H3AsO3
As2O3 + 3C = 2As + 3CO
As2O5 + H2O = H3AsO4
2As2S3 + 9O2 = 2As2O3 + 6SO2
3Sb + 5HNO3 = 3HSbO3 + 5NO + H2O
2Mn(NO3)2 + 5NaBiO3 (сильный окислитель) + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7H2O
Bi + 4HNO3 = Bi(NO3)3 + NO + 2H2O (сравни с Sb)
Селен, Теллур и их соединения
SeO2 + 2SO2 + 2H2O = Se + 2H2SO4
Se + 2Cu = Cu2Se
3Se + 6NaOH ó 2Na2Se + Na2SeO3 + 3H2O
SeO2 + 2NaOH = Na2SeO3 + H2O
5H2SeO3 + 2KMnO4 + 3H2SO4 = 5H2SeO4 + 2MnSO4 + K2SO4 + 3H2O
H2SeO4 + 2HCl = Cl2 + H2SeO3 + H2O
2Au + 6H2SeO4 = Au2(SeO4)3 + 3SeO2 + 6H2O
2H2SeO4 + 4HCl + Pt = PtCl4 + 2SeO2 + 4H2O
K2SeO4 + SO3 = K2SO4 + SeO3 (тв)
SeO3 + 2HCl = Cl2 + H2SeO3
FeSe + 2HCl = FeCl2 + H2Se
H2Se + H2O ó H3O+ + HSe—
Note Bene: Na2Se4 SeF6 SeF4 SeCl4 SeBr4 SeF2 Se2Cl2 Se2Br2
Te + 2H2O = TeO2 + 2H2
2Ag + Te = Ag2Te
Note Bene: H6TeO6; Ag6TeO6; Hg3TeO6 Na2Te6 TeF6 TeF4 TeCl4 TeBr4 TeI4 TeCl2 TeBr2
H6TeO6 (t°) = 3H2O + TeO3
Al2Te3 + 6H2O = 3H2Te + 2Al(OH)3
2Pt + O2 (>500°) = 2PtO
Pt + Cl2 (>500°) = PtCl2
Pt + 2HNO3 + 2HCl = PtCl2 + 2NO2 + 2H2O
PtCl4 + 2KCl = K2[PtCl6]
PtCl2 + 4NH3 = [Pt(NH3)4]Cl2
см. также растворение платины в селеновой кислоте + HCl
Os + 8HNO3 (конц) (t°) = OsO4 + 8NO2 + 4H2O
Ru, Ro, Ir + кислота или «царская водка» ≠
Pd + 2H2SO4 (конц) (t°) = PdSO4 + SO2 + 2H2O
Сера. Сероводород. Сульфиды
5S + 2P (400°) = P2S5
3S + 4HNO3 (конц) = 3SO2 + 4NO + 2H2O
3S + 6KOH (конц) = K2SO3 + 2K2S + 3H2O
S +2Na (130°) = Na2S
3S + 2Al (200°) = Al2S3
S + Fe (600°) = FeS
S + H2 (150°) = H2S + 20,6 кДж
S + Hg (25°) = HgS
S + 2H2SO4 (конц) = 3SO2 + 2H2O
S + 3F2 (20°) = SF6 (инертное соединение, весьма устойчивое)
S + Cl2 = SCl2
S + O2 (280°) = SO2
S + Na2SO3 = Na2S2O3
2S + C (700°) = CS2
S + 2H2SO4 (конц) = 3SO2↑ + 2H2O
S + 2HI (газ) = I2 + H2S
I2 + H2S (раствор) = 2HI + S↓
Pb2+ + H2S = PbS↓ + 2H+
Al2S3 (тв) + 6H2O (ж) = 2Al(OH)3 + 3H2S
FeS + 2HCl = FeCl2 + H2S
P2S5 + 8H2O = 2H3PO4 + 5H2S↑
H2S (400-1700°) = H2 + S
H2 + S (150-200°) = H2S
H2S + O2 (τ) = 2S↓ + 2H2O (при свете)
H2S + 3O2 (250-300°) = 2SO2 + 2H2O
H2S + 2NaOH = Na2S + 2H2O
H2S + NaOH = NaHS + H2O
2H2S + [Pb(OH)]2CO3 = 2PbS + CO2 + 3H2O
2H2S + 2FeCl3 = FeS2 + FeCl2 + 4HCl↑
H2S + 2FeCl3 = 2FeCl2 + S + 2HCl
2H2S + H2SO3 = 3S↓ + 3H2O
2H2S + SO2 (25°, кат. – капля H2O) = 3S + 2H2O
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
H2S (насыщ) + Br2 (р-р) = S↓ + 2HBr
H2S + 4Br2 + 4H2O = H2SO4 + 8HBr
H2S + H2SO4 (конц) = S + SO2 + 2H2O
H2S + 3H2SO4 (конц) = 4SO2 + 4H2O
5H2S + 2KMnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8H2O
H2S + 6HNO3 = SO2 + 6NO2 + 4H2O
H2S (г) + NH3*H2O (конц) = NH4HS + H2O
H2S (г) + NH3 (ж) (-40°) = (NH4)2S
H2S + ZnO (800-1000°) = ZnS + H2
H2S (влажн.) + Zn (700-800°) = ZnS + H2
Na2SO4 + 4H2 (500°, Fe2O3) = Na2S + 4H2O (Na2SO4*10H2O – минерал мирабилит)
Na2SO4 + 4C (800-1000°) = Na2S + 4CO
Na2SO4 + 4CO (600-700°) = Na2S + 4CO2
Na2S + nS (t°) = Na2Sn+1 где n от 1 до 8 (цвет меняется от желто-оранжевого до красного)
2HCl + Na2Sn = 2NaCl + H2Sn
Na2S + 3H2SO4 (конц) (<50°) = SO2↑ + S↓ + 2H2O + 2NaHSO4
Na2S + 4HNO3 (конц) (60°) = 2NO2↑ + S↓ + 2H2O + 2NaNO3
Na2S + H2S (насыщ) = 2NaHS
Na2S + 2O2 (>400°) = Na2SO4
Na2S + H2O2 (конц) = Na2SO4 + 4H2O
K2S + S = K2S2
FeS + S = FeS2
S2O (желтый газ) + H2O = H2S2O2 тиосернистая кислота
Серы оксид (IV). Сернистая кислота. Тиосульфат
H2O + SO2 ó H2SO3 (k1)ó H+ + HSO3— (k2)ó 2H+ + SO32- (K1=1,6*10-2 K2=6,3*10-8)
Na2SO4 + SO3 = Na2S2O7
Na2S2O7 + 2NaOH = 2Na2SO4 + H2O
SCl2 + 2H2O = 2HCl + H2SO2 сульфоксиловая кислота
Co + H2SO2 = CoSO2 + H2 (одно из устойчивых соединений сульфоксиловой к-ты)
2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
Na2SO3 + H2SO4 = Na2SO4 + SO2 +H2O
2ZnS + 3O2 = 2ZnO + 2SO2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
4FeSO4 (t°) = 2Fe2O3 + 4SO2 + O2
Ag2SO4 (t°) = 2Ag + SO2 + O2
Cu + 2H2SO4 (конц) = CuSO4 + SO2 + 2H2O
HgSO4 = Hg + SO2 + O2
Zn + 2H2SO4 (конц) = ZnSO4 + SO2 + 2H2O
3Zn + 4H2SO4 = S + 3ZnSO4 + 4H2O (условия протекания не известны…)
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
3SO2 + 2KMnO4 + 2H2O = K2SO4 + 2H2SO4 + 2MnO2
SO2 + Ca(OH)2 = CaSO3 + H2O
SO2 + 2H2S = 3S + 2H2O
SO2 + 2NaOH = Na2SO3 + H2O
SO2 + Na2SO3 + H2O = 2NaHSO3
SO2 + H2 (кат)à S + H2O
SO2 + Cl2 (hv) = SO2Cl2 (бесветная жидкость, резкопахнущая)
SO2 + C = CO2 + S
SO2 + PCl5 = POCl3 + SOCl2 (тионилхлорид)
2SO2 + MnO2 = MnS2O6
SO2 + 2CO = S + 2CO2
2SO2 + Zn (пыль) = ZnS2O4
SOCl2 + 2H2O = 2HCl + H2SO3
SO2Cl2 + 2H2O = H2SO4 + 2HCl
2Na2SO3 + O2 (постепенное окисление) = 2Na2SO4
Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl
Na2SO3 + 2HCl = 2NaCl + H2SO3
Na2SO3 + H2S = S + H2O
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
Na2SO3 + S (тонко измельченая, +t°) = Na2S2O3
4Na2SO3 (t°, кат) = 3Na2SO4 + Na2S (?)
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
2KHSO3 + H2SO4 = K2SO4 + 2SO2 + 2H2O
2KHSO3 = K2S2O5 + H2O
Серы оксид (VI). Серная кислота
2SO2 + O2 (400-450°, p, V2O5/NO) ó 2SO3 + Q
SO3 + H2O = H2SO4
2SO3 + C = CO2 + 2SO2
SO3 + 2KOH = K2SO4 + H2O
SO3 + KOH = KHSO4
SO3 + 3H2S = 4S + 3H2O
SO3 + Na2SO4 = Na2S2O7
2KMnO4 + 3SO2 + 2H2O = K2SO4 + 2H2SO4 + 2MnO2
H2SO4 ó H+ + HSO4— (K1=1*103)
HSO4— ó H+ + SO42- (K2=1,1*10-2)
H2SO4(изб) + KOH = KHSO4 + H2O
Zn + H2SO4 (разб) = ZnSO4 + H2
H2SO4 + SO3 = H2S2O7 (олеум)
Ba2+ + SO42- = BaSO4↓ (качественная реакция)
ZnSO4 (t°) = ZnO + SO3
2NaHSO4 (t°) = Na2S2O7 + H2O
C12H22O11 (H2SO4 конц. -11H2O) à 12C
C2H5OH (H2SO4 конц. -H2O) à CH2=CH2
хлорсульфоновая кислота сульфурилхлорид
HSO3Cl + H2O2 = HCl + H2SO3(O2) пероксомоносерная (кислота Коро) H2SO5
2HSO3Cl + H2O2 = 2HCl + HSO3(O2)SO3H пероксодисерная H2S2O8
H2S2O8 + H2O = H2SO5 + H2SO4
H2SO5 + H2O = H2SO4 + H2O2 (?)
Скандий, Иттрий, Лантан и их соединения
4Sc + 3O2 = 2Sc2O3
2Y + 3Cl2 = 2YCl3
4La + 3O2 = 2La2O3
2La + 6H2O = 2La(OH)3 + 3H2
При н.у. или при небольшом нагревании реагируют с O2, S, Hal, HCl, H2SO4, HNO3
Титан, Цирконий, Гафний и их соединения
Ti + 2Cl2 (t°) = TiCl4
Ti + C (t°) = TiC
2Ti + N2 (t°) = 2TiN
2Ti + 6HCl (t°) = 2TiCl3 + 3H2
Ti + 6HF = H2[TiF6] + 2H2
Ti + 2I2 (t°) = TiI4
TiO2 + H2SO4 (t°) = Ti(SO4)O + H2O (оксид титана – бертоллид: TiO1,7 … TiO2,3)
TiO2 + 2KOH = K2TiO3 (титанат калия) + H2O
TiO2 + BaO (t°) = BaTiO3
TiO2 + 2Cl2 + C (t°) = TiCl4 + CO2
2Ti(SO4)O + Zn + 2H2SO4 = Ti2(SO4)3 + ZnSO4 + 2H2O
TiCl4 + 2Mg = Ti + MgCl2
TiI4 (1300-1500 t°) = Ti + 2I2
2Zr + O2 = 2ZrO (бертоллид – от TiO0,7 до TiO1,3)
2ZrO + O2 = 2ZrO2 (бертоллид – от TiO1,9 до TiO2)
Zr + 6HF = H2[ZrF6] + 2H2
ZrO2 + 2KOH = K2ZrO3 (цирконат калия) + H2O
2Zr + N2 (t°) = 2ZrN (бертоллид – от ZrN0.59 до ZrN0.89)
Hf(OH)4 + 2HCl (t°) = Hf(Cl)2O + 3H2O
Углерод. Оксиды. Карбонаты. Карбиды
H2O + CO2 ó H2CO3 ó H+ + HCO3— ó 2H+ +CO32- (k1 = 4*10-7 k2 = 5*10-11 при 25°)
H+ + HCO3— ó H2CO3 ó H2O + CO2↑ (качественная реакция)
2H+ + CO32- ó H2CO3 ó H2O + CO2↑ (качественная реакция)
C + H2O (пар, +t°) ó CO + H2
C + 2S (700-1000°) = CS2
C + 2F2 (>900°) = CF4
2C + Ca = CaC2 (часто карбиды щелочных и щелочноземельных металлов – бертоллиды)
2C + N2 (t° или 7) = C2N2 (циан, яд!)
2C + O2 = 2CO
3C + 4HNO3 = 3CO2 + NO + 2H2O
3C + CaO = CaC2 + CO
4C + CaCO3 = CaC2 + 3CO
9C + 2Al2O3 = Al4C3 + 6CO
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
C + CuO = Cu + CO
C + O2 = CO2
C + 2H2 (600-1000°) = CH4
2C + H2 (1500-2000°) = C2H2
HCOOH (H2SO4 или P2O5) à CO + H2O
2CO (кат) = C + CO2
2CO + O2 = 2CO2
4CO + Ni = Ni(CO)4
CO + 2H2 ó CH3OH
CO + Cl2 = COCl2 (яд!)
CO + FeO = Fe + CO2
CO + H2O (пар) ó CO2 + H2
CO + KOH (под давлением) = HCOOK
CO + PdCl2 + H2O = Pd + 2HCl + CO2
HCOOH (H2SO4 конц) à CO + H2O
CO2 + Zn (t°) = ZnO + CO
CO2 + 2Mg (600°) = 2MgO + C
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CO2 + KOH = KHCO3
MgO + 2CO2 + H2O = Mg(HCO3)2
CaCO3 (взвесь) + H2O + CO2 (избыток) = Ca(HCO3)2
MgCO3 (t°) = MgO + CO2
Na2CO3 (t°) ≠
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
Na2CO3 + CaCO3 + 6SiO2 = Na2O*CaO*6SiO2 (стекло) + 2CO2
2NaHCO3 (t°) = Na2CO3+ H2O + CO2
NaHCO3 + CaCl2 ≠
NaHCO3 + HCl = NaCl + CO2 + H2O
KHCO3 + KOH = K2CO3 + H2O
Ca(HCO3)2 + Ba(OH)2 = BaCO3↓ + CaCO3↓ + 2H2O
[Метод Сольвэ (получение питьевой и кальцинированной соды):
[CO2 + NH3 + H2O = NH4HCO3
[NH4HCO3 + NaCl = NaHCO3↓ + NH4Cl
[2NH4Cl + Ca(OH)2 = 2NH3 + CaCl2 + H2O
[NaHCO3↓ – нерастворим в холодном насыщенном растворе
[2NaHCO3 = Na2CO3 + CO2 + H2O
CaC2 + 2H2O = Ca(OH)2 + C2H2
Al4C3 + 12H2O = Al(OH)3↓ + 3CH4
Ag2C2 + 2HCl = 2AgCl + C2H2
Фосфор. Фосфин. Галогениды. Кислоты. Соли
Метафосфорная кислота – HPO3
Ортофосфорная кислота – H3PO4
Пирофосфорная кислота – H4P2O7
Фосфористая кислота – H3PO3 (двухосновная! O=P(OH)2H; k1 = 2*10-2, k2 = 2*10-7) – соли фосфиты.
Фосфорноватистая кислота – H3PO2 (k = 9*10-2) – соли гипофосфиты.
Ca3(PO4)2 + 3SIO2 + 5C = 2P(белый) + 5CO + 3CaSiO3
P4 + 10Cl2 = 4PCl5
6P + 5KClO3 = 3P2O5 + 5KCl (взрыв!)
P4 + 10N2O = P4O10 + 10N2
P4 + 3O2 = 2P2O3
P4 + 5O2 = P4O10
P4 + 6Br2 = 4PBr3
P4 + 6Cl2 = 4PCl3
P4 + 6Mg = 2Mg3P2 (часто фосфиды щелочных и щелочноземельных металлов – бертоллиды)
P4 + 6S = 2P2S3
P4(белый) + 3KOH + 3H2O = 3KH2PO2 + PH3
3P + 2H2O + 5HNO3 = 3H3PO4 + 5NO
2AlP + 6HCl = 2AlCl3 + 2PH3
2PH3 + 4O2 (самопроизвольно) = 2H3PO4
PH3 + 8AgNO3 + 4H2O = 8Ag + H3PO4 + 8HNO3
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3
PH3 + HI = PH4I
PH3 + HClO4 = (PH4)ClO4
H4P2O7 = HPO3 + H3PO4
P2O5 + 2H2O = H4P2O7
P2O5 + 3H2O = 2H3PO4
P2O5 + H2O = 2HPO3
2P2O5 + 4HClO4 = (HPO3)4 + 2Cl2O7
P4O6 + 6H2O = PH3 + 3H3PO4
P4O6 + 6HCl = 2H3PO3 + 2PCl3
PCl3 + 3H2O = H3PO3 + 3HCl
PCl3 + Cl2 ó PCl5
PCl5 + 4H2O = H3PO4 + 5HCl
PCl5 + CH3CHO = CH3CHCl2 + POCl3
PCl5 + CH3COCH3 = CH3CCl2CH3 + POCl3
4H3PO3 = PH3 + 3H3PO4
Хром. Хромат. Дихромат. Молибден и вольфрам
Хром. Массовая доля хрома в земной коре составляет 0,02%. Важнейшими минералами, входящими в состав хромовых руд, являются хромит, или хромистый железняк, (Cr2FeII)O4или Fe(CrO2)2 и его разновидности, в которых железо частично замещено на магний, а хром – на алюминий.
Хром – серебристо-серый металл. Температура плавления его составляет 1890°, плотность 7,19 г/см3. Чистый хром достаточно пластичен, а технический – самый твердый из всех металлов.
Хром химически малоактивен. В обычных условиях он реагирует только со фтором (из неметаллов), образуя смесь фторидов. В азотной и концентрированной серной кислотах он пассивируется, покрываясь защитной оксидной пленкой. В хлороводородной и разбавленной серной кислотах растворяется, при этом, если кислота полностью освобождена от растворенного кислорода, получаются соли хрома (II), а если реакция протекает на воздухе – то соли хрома (III).
Соли хрома (III) разнообразны по окраске, например, CrCl3 имеет фиолетовую окраску, CrF3 – зеленую, Cr(NO3)3*9H2O – пурпурную.
Гидроксидами хрома (VI) являются две кислоты: хромовая H2CrO4 и дихромовая H2Cr2O7. Обе кислоты существуют только в водных растворах.
Cr + 2HCl (разб) = CrCl2 + H2
4Cr + 12HCl + O2 = 4CrCl3 + 4H2 + 2H2O
4Cr (порошок) + 3O2 (τ, 600°) = 2Cr2O3
2Cr (порошок) + 3Cl2 (1100°) = 2CrCl3
2Cr (порошок) + 3S (τ, 1000°) = Cr2S3
2Cr + 3H2O ó Cr2O3 + 3H2
2Cr + 3Hal2 = 2CrHal3
2Cr + 6H2SO4 (конц) = Cr2(SO4)3 + 3SO2 + 6H2O
Cr + 6HNO3 (конц) = Cr(NO3)3 + 3NO2 + 3H2O
Cr + H2SO4 (разб) = CrSO4 + H2
CrO + H2SO4 = CrSO4 + H2O
Cr2O3 + 6NaOH + 3H2O = 2Na3[Cr(OH)6]
Cr2O3 + 2NaOH = 2NaCrO2 + H2O
Cr2O3 + HCl = 2CrCl3 + 3H2O
Cr2O3 + Na2CO3 = 2NaCrO2 + CO2
Cr2O3 + 6KHSO4 = Cr2(SO4)3 + 3K2SO4 + 3H2O
CrO3 + 2KOH = K2CrO4 + H2O (CrO4-2 желтые хроматы)
CrCl2 + 2NaOH = Cr(OH)2↓ + 2NaCl (желтый осадок)
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl
Cr(OH)2 (t°) = CrO + H2O
Cr(OH)3 + NaOH (300-400°) = NaCrO2 (зеленый) + 2H2O
Cr(OH)3 + NaOH (конц) + 3H2O2 (конц) = 2Na2CrO4 + 8H2O
Cr(OH)3 + KOH = K[Cr(OH)4] – тетрагидроксихромит калия
2Cr(OH)3 (t°) = Cr2O3 + 3H2O
2Cr(OH)3 + 3Br2 + 10KOH = 2K2CrO4 + 6KBr + 8H2O
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
2CrO4-2 + 2H+ ßЩелочная среда ─ Кислая среда à Cr2O72- + H2O
H2CrO4 + 2H2O2 = 3H2O + CrO5
4(Cr2FeII)O4 + 8K2CO3 + 7O2 (1000°) = 8K2CrO4 + 2Fe2O3 + 8CO2 (спекание хромита с поташем)
2K2CrO4 + H2SO4 (30%) = K2Cr2O7 + K2SO4 + H2O
2K2CrO4 + 3KNO2 + 2KOH + 5H2O = 3KNO3 + 2K3[Cr(OH)6]
2K2CrO4 + 16HCl (конц, гор.) = 2CrCl3 + 3Cl2 + 8H2O + 4HCl
2K2CrO4 + 2H2O + 3H2S = 2Cr(OH)3↓ + 3S↓ + 4KOH
2K2CrO4 + 8H2O + 3K2S = 2K3[Cr(OH)6] + 3S↓ + 4KOH
2K2CrO4 + 2AgNO3 = 2KNO3 + Ag2CrO4 (красный)↓
Cr2O72- (конц) + 2Ag+ (разб) = Ag2Cr2O7 (темно-красный ↓)
Cr2O72- (разб) + H2O + 2Pb2+ = 2H+ + 2PbCr2O7 (красный ↓)
Cr2O72- + 14H+ + 6I— = 2Cr3+ + 3I2↓ + 7H2O
Cr2O72- + 2H+ + 3SO2 = 2Cr3+ + 3SO42- + H2O
Cr2O72- + 8H+ + 3C2H5OH = 2Cr3+ + 3CH3C(H)O↑ + 7H2O
Cr2O72- + 8H+ + 3H2C2O4 = 2Cr3+ + 6CO2↑ + 7H2O
K2Cr2O7 (насыщ) + H2SO4 (конц) = 2CrO3 + K2SO4 + H2O (?)
K2Cr2O7 + 2H2SO4 (96%) ó 2KHSO4 + 2CrO3 + H2O («хромовая смесь»)
K2Cr2O7 + 6HCl + 8H0(Zn) = 2CrCl2 (синий) + 7H2O + 2KCl
4K2Cr2O7 (500-600°) = 2Cr2O3 + 4K2CrO4 + 3O2
K2Cr2O7 + H2O + 3H2S = 3S + 2KOH + 2Cr(OH)3↓
K2Cr2O7 + 3H2 (500°) = Cr2O3 + 2KOH + 2H2O
Na2Cr2O7 + 3C (800°) = Na2O + Cr2O3 + 3CO
K2Cr2O7 + 4Al (800-900°) = 2Cr + 2KAlO2 + Al2O3
K2Cr2O7 + S (800-1000°) = Cr2O3 + K2SO4
K2Cr2O7 + 3SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O
K2Cr2O7 + 3Zn + 7H2SO4 = 3ZnSO4 + Cr2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
K2Cr2O7 + 3Na2SO3 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
K2Cr2O7 + H2SO4 = K2SO4 + 2CrO3 + H2O
K2Cr2O7 + 14HCl (конц, кипячение) = 2KCl + 2CrCl3 + 3Cl2 + 7H2O
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8H2O
5Cr2(SO4)3 + 6KMnO4 + 11H2O = 3K2Cr2O7 + 2H2Cr2O7 + 6MnSO4 + 9H2SO4
Cr2(SO4)3 + 6NH4OH = 2Cr(OH)3 + 3(NH4)2SO4
Cr2(SO4)3 + 6NaOH = Cr(OH)3↓ + 3Na2SO4 (зеленый студенистый осадок)
Cr2(SO4)3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4 + 8H2O
Хромовые квасцы (KCr(SO4)2) – полная аналогия с алюминиевыми квасцами (искл. температуру)
Молибден и вольфрам. Молибден и вольфрам относятся к редким металлам, их массовые доли в земной коре равны соответственно 3*10-4 и 1*10-4%. Важнейшими минералами молибдена и вольфрама являются: молебденит MoS2, шеелит CaWO4 и вольфрамит (Fe, Mn)WO4.
Молибден и вольфрам представляют собой светло-серебристые металлы. Плотности их равны 10,22 г/см3 (Mo) и 19,32 г/см3 (W), а температуры плавления составляют 2660° и 3387° соответственно. Вольфрам имеет наибольшую температуру плавления из всех металлов.
Молибден и вольфрам химически менее активны, чем хром. С неметаллами они реагируют при сильном нагревании. Не растворяются в хлороводородной, азотной и серной кислотах, растворяются в смеси азотной и фтороводородной кислот:
W + 6HNO3 + 8HF = H2[WF8] + 6NO2 + 6H2O
Наиболее устойчивы соединения, в которых молибден и вольфрам имеют степень окисления +6. Оксид молибдена (VI) MoO3 и оксид вольфрама (VI) WO3 проявляют кислотные свойства:
MoO3 + 2NaOH = Na2MoO4 + H2O молибдат натрия
WO3 + 2NH4OH = (NH4)2WO4 + H2O вольфрамат аммония
Молибдаты и вольфраматы являются солями кислот молибденовой H2MoO4 (белое малорастворимое вещество) и вольфрамовой H2WO4 (желтое малорастворимое вещество).
W + 3NaNO3 + 2NaOH = Na2WO4 + 3NaNO2 + H2O (то же для Mo)
WO2(OH)2 + 2HCl = WO2Cl2 + 2H2O (то же для Mo)
Note Bene: (NH4)6Mo7O24 Na10W12O41 (вольфрамовые и мольбденовые «бронзы» – проявляют полупроводниковые свойства)
Цинк, Кадмий, Ртуть и их соединения
Zn + 2HCl = ZnCl2 + H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Zn(OH)2 + 6NH3 = [Zn(NH3)6](OH)2
Cd(OH)2 + 6NH3 = [Cd(NH3)6](OH)2 (соли кадмия ядовиты!)
Hg + HCl ≠ (почти все соли ртути ядовиты, канцерогены)
Hg + H2SO4 (разб) ≠
Hg + NaOH (разб) ≠
Hg + S (25°) = HgS
Hg + Me (Zn, Sb, Na, Cu, Au) = MeHg – амальгама
Hg + 2H2SO4 (конц) = HgSO4 + SO2 + 2H2O
6Hg + 8HNO3 (разб) = 3Hg(NO3)2 + 2NO + 4H2O
Hg(NO3)2 + 2NaOH = HgO↓ + 2NaNO3 + H2O
HgCl2 (сулема) + Hg = Hg2Cl2 (каломель)
2HgCl2 + SnCl2 = Hg2Cl2↓ + SnCl4
Hg2Cl2 + SnCl2 = 2Hg + SnCl4
4Li + O2 = 2Li2O
2Li + H2 (25°) = 2LiH
2Li + 2H2O = 2LiOH + H2
2LiOH (t°) = Li2O + H2O↑
2Na + O2 (>250°) = Na2O2 (воспламеняется на воздухе при умеренном нагревании)
2Na + Cl2 = 2NaCl
6Na + N2 = 2Na3N
2Na + H2 = 2NaH
2Na + S = Na2S
2Na + 2C = Na2C2
3Na + 2O2 = Na2O2 + NaO2
2Na + 2H2O = 2NaOH + H2 + 368 кДж
2Na + 2NH3 = H2 + 2NaNH2
8Na + 10HNO3 (разб) = 8NaNO3 + NH4NO3 + 3H2O
2Na + 2NaOH (600°) = 2Na2O + H2
2Na + Na2O2 (130-200°) = 2Na2O
2Na2O (>700° длительно) = Na2O2 + 2Na
Na2O + H2O = 2NaOH + 236 кДж
Na2O + M2O3 = 2NaMO2 (1200°, M = Al, Cr)
Na2O + O2 (250-350°, p) = 2Na2O2
Na2O + CO2 (450-550°) = Na2CO3
2Na2O2 + 2H2O = 4NaOH + O2
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na2O2 + CO = Na2CO3
Na2O2 + 2H2SO4 = 2NaHSO4 + H2O2
Na2O2 + 2NaI + 2H2SO4 = I2 + 2Na2SO4 + 2H2O
2Na + 2NH3 = 2NaNH2 + H2
NaNH2 + H2O = NaOH + NH3
NaOH (t°) ≠
NaOH + H2O = NaOH*H2O + 56 кДж
2NaOH + SiO2 (t°) = Na2SiO3 + H2O
NaOH (разб) + H3PO4 (конц) = NaH2PO4 + H2O
2NaOH (разб) + H3PO4 (разб) = Na2HPO4 + 2H2O
3NaOH (конц) + H3PO4 (разб) = Na3PO4 + 3H2O
2NaOH (тв) + M2O3 = 2NaMO2 + H2O (1000°, M = Al, Cr)
2NaOH (конц) + 3H2O + Al2O3 (кипячение) = 2Na[Al(OH)4]
2NaOH (тв) + M(OH)2 = Na2MO2 + 2H2O (500°, M = Be, Zn)
2NaOH (конц) + Zn(OH)2 = Na2[Zn(OH)4]
6NaOH (разб. горяч.) + 3S = 2Na2S + Na2SO3 + 3H2O
2NaOH (конц. холодн.) + Cl2 = NaCl + NaClO + H2O
2K + 2H2O = 2KOH + H2 + 392 кДж
8K + 10HNO3 (конц) = 8KNO3 + N2O + 5H2O
K2O + 2HCl = 2KCl + H2O
2K2O + 2NH3 = 2KOH + N2 + 2H2O
2KO2 + 2H2O = 2KOH + H2O2 + O2
2KO2 + S = K2SO4
K2O2 + 2K = 2K2O
2K2O2 + 2CO2 = 2K2CO3 + O2 (регенерация кислорода – космические станции, применяется ли в настоящее время?)
KNH2 + H2O = KOH + NH3
BeF2 + Mg = Be + MgF2
2Be + O2 = 2BeO
Be + 2HCl = BeCl2 + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] +H2
Be + H2SO4 + 4H2O = [Be(H2O)4]SO4 + H2↑
BeO + 2Na = Be + Na2O
BeO + 2KOH + H2O = K2[Be(OH)4}
BeO + 2HCl + 3H2O = [Be(H2O)4]Cl2
BeO + SiO2 (t°) = BeSiO3
BeO + Na2O = Na2BeO2
Be(OH)2 + 2KOH = K2[Be(OH)4]
Be(OH)2 + 2HCl = BeCl2 + 2H2O
BeCl2 + 2LiH (эфир) = BeH2 + 2LiCl
BeF2 + 2KF = K2[BeF4]
BeF2 + SiF4 = Be[SiF6]
Соли Be ядовиты (опаснее солей Ba, вызывают воспаление кожи)!
Mg + Cl2 = MgCl2
3Mg + N2 (t°) = Mg2N2
Mg + 2H2O = Mg(OH)2 + H2
MgO + C (t°) = Mg + CO
TiCl4 + 2Mg = Ti + 2MgCl2
MgO + 2CH3COOH = (CH3COO)2Mg + H2O
R─Hal + Mg = R─Mg─Hal (реактив Гриньяра, используется в органике)
Note Bene: MgCl2*6H2O Mg(NO3)2*6H2O
Ca + 2H2O = Ca(OH)2 + H2 + 413 кДж
Ca + S = CaS
Ca + H2 (t°) = CaH2
Ca + V2O5 = 2V + 5CaO
Ca + 3Sn (t°) = CaSn3
2Ca + Sn (t°) = Ca2Sn
Ca + 10HNO3 (разб) = 4Ca(NO3)2 + NH4NO3 + 3H2O
4Ca + 10HNO3 (конц) = 4Ca(NO3)2 + N2O + 5H2O
4Ca + 5H2SO4 (конц) = 4CaSO4 + H2S + 4H2O
CaO + H2O = Ca(OH)2 + 64 кДж
3CaO + 2Al = 3Ca + Al2O3
Ca(OH)2 (t°) = CaO (негашеная известь) + H2O↑
Ca3P2 + 6HCl = 3CaCl2 + 2PH3
Ca + 2C = CaC2
CaC2 + 2H2O = Ca(OH)2 + C2H2
CaC2 + N2 = CaCN2 + C
CaCO3 (t°) = CaO + CO2
CaCl2 + 2Na = Ca + 2NaCl
3BaO + 2Al = 3Ba + Al2O3
BaO2 + 2H2O = Ba(OH)2 + H2O2
Ba(OH)2 (t°) = BaO + H2O↑
BaH2 + 2H2O = Ba(OH)2 + 2H2
Соли Ba ядовиты!
Источник информации
100 ОВР, котрые помогут учащимся при сдаче ЕГЭ по химии.
1) 2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
2) 2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 8H2O + 2KCl
3) 5NaNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
4) 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
5) 2KMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
6) 2KMnO4 + 5Na2SO3 + 3H2SO4 = MnSO4 + K2SO4 + 5Na2SO4 + 3H2O
7)SO2 + 2KMnO4 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + 7H2O
9) K2Cr2O7 + 3NaNO2 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
10) K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
11) 4Mg + 10HNO3(оч.разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
12) Cr2(SO4)3 + 3Br2 + 16NaOH = 6NaBr + 2Na2CrO4 + 3Na2SO4 + 8H2O
13)Al2S3 + 30HNO3(конц.) = 2Al(NO3)3 + 3H2SO4 + 24NO2 + 12H2O
14) 6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O
15) FeCl2 + 4HNO3(конц.) = Fe(NO3)3 + 2HCl + NO2 + H2O
16) AlP + 11HNO3(конц.) = H3PO4 + 8NO2 + Al(NO3)3 + 4H2O
17) 6FeSO4 + KClO3 + 3H2SO4 = 3Fe2(SO4)3 + KCl + 3H2O
18) 3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
19) 2Al + K2Cr2O7 + 7H2SO4 = Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
20) 3P2O3 + 2HClO3 + 9H2O = 6H3PO4 + 2HCl
21) Cr2(SO4)3 + 6KMnO4 + 16KOH = 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O
22) Cr2O3 + 3KNO3 + 4KOH = 2K2CrO4 + 3KNO2 + 2H2O
23) 2NaNO2 + 2NaI + 2H2SO4 = 2NO + I2 + 2Na2SO4 + 2H2O
24) 8KI + 9H2SO4(конц.) = 4I2 + H2S + 8KHSO4 + 4H2O
25) Cu + 2FeCl3 = CuCl2 + 2FeCl2
26) 3PH3 + 4HClO3 = 3H3PO4 + 4HCl
27) 3NO2 + H2O = NO + 2HNO3
28) I2 + K2SO3 + 2KOH = 2KI + K2SO4 + H2O
29) 2NH3 + 3KClO = N2 + 3KCl + 3H2O
30) 6P + 5HClO3 + 9H2O = 5HCl + 6H3PO4
31) 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
32) Ca(ClO)2 + 4HCl = CaCl2 + 2Cl2 + 2H2O
33) 3H2S + HClO3 = 3S + HCl + 3H2O
34) Fe2(SO4)3 + 2KI = 2FeSO4 + I2 + K2SO4
35) 2KMnO4 + KI + H2O = 2MnO2 + KIO3 + 2KOH
36) I2 + 10HNO3(конц.) = 2HIO3 + 10NO2 + 4H2O
37) 3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 28NO + 9H2SO4
38) 4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S + 4H2O
39) MnO2 + 2KBr + 2H2SO4 = MnSO4 + Br2 + K2SO4 + 2H2O
40) 5HCOH + 4KMnO4 + 6H2SO4 = 5CO2 + 2K2SO4 + 4MnSO4 + 11H2O
41) 3KNO2 + 2KMnO4 + H2O = 3KNO3 + 2MnO2 + 2KOH
42) NaClO + 2KI + H2SO4 = I2 + NaCl + K2SO4 + H2O
43) 2KNO3 + 6KI + 4H2SO4 = 2NO + 3I2 + 4K2SO4 + 4H2O
44) 14HCl + K2Cr2O7 = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
45) 2Cr(OH)3 + 3Cl2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O
46) K2MnO4 + 8HCl = MnCl2 + 2Cl2 + 2KCl + 4H2O
47) K2Cr2O7 + 3Na2SO3 + 4H2O = 2Cr(OH)3 + 3Na2SO4 + 2KOH
48) 2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
49) 4Zn + KNO3 + 7KOH = NH3 + 4K2ZnO2 + 2H2O
50) 2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O
51) P2O3 + 6KOH + 2NO2 = 2NO + 2K3PO4 + 3H2O
52) 2KMnO4 + 2NH3 = 2MnO2 + N2 + 2KOH + 2H2O
53) 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
54) 3NaNO2 + Na2Cr2O7 + 8HNO3 = 5NaNO3 + 2Cr(NO3)3 + 4H2O
55) B + HNO3(конц.) + 4HF = NO + HBF4 + 2H2O
56) 2CuCl2 + SO2 + 2H2O = 2CuCl + 2HCl + H2SO4
57) PH3 + 8AgNO3 + 4H2O = 8Ag + H3PO4 + 8HNO3
58) 2NH3 + 6KMnO4 + 6KOH = N2 + 6K2MnO4 + 6H2O
59) 5Zn + 2KMnO4 + 8H2SO4 = 5ZnSO4 + 2MnSO4 + K2SO4 + 8H2O
60) 3KNO2 + K2Cr2O7 + 8HNO3 = 5KNO3 + 2Cr(NO3)3 + 4H2O
61) FeS + 12HNO3(конц.) = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O
62) KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
63) 2NaCrO2 + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 4H2O
64) Fe2(SO4)3 + Na2SO3 + H2O = 2FeSO4 + Na2SO4 + H2SO4
65) 3P2O3+ 2H2Cr2O7 + H2O = 2H3PO4 + 4CrPO4
66) 3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O
67) 5Na2SO3(нед.) + 2KIO3 + H2SO4 = I2 + K2SO4 + 5Na2SO4 + H2O
68) 2CrBr3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaBr + 8H2O
69) 8 KMnO4 + 5 PH3 + 12H2SO4 = 5H3PO4 + 8MnSO4 + 4K2SO4 + 12H2O
70) 3SO2 + K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O
71) 3P2O3 + 4HNO3 + 7H2O = 6H3PO4 + 4NO
72) 2NO + 3KClO + 2KOH = 2KNO3 + 3KCl + H2O
73) 5PH3 + 8KMnO4 + 12H2SO4 = 5H3PO4 + 4K2SO4 + 8MnSO4 + 12H2O
74) 5AsH3 + 8KMnO4 + 12H2SO4 = 5H3AsO4 + 4K2SO4 + 8MnSO4 + 12H2O
75) 2CuI + 4H2SO4(конц.) = 2CuSO4 + I2 + 4H2O + 2SO2
76) Si + 2KOH + H2O = K2SiO3 + 2H2 (to)
77) B + 3HNO3 = H3BO3 + 3NO2
78) 8NH3 + 3Br2 = N2 + 6NH4Br
79) P4 + 3KOH + 3H2O = PH3 + 3KH2PO2
80) Al2O3 + 3C + 3Cl2 = 2AlCl3 + 3CO(to)
81) H2S + HClO = S + HCl + H2O
82) 5KNO3(расплав) + 2P = 5KNO2 + P2O5
83) I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
84) H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
85) 8Zn + 5H2S2O7 = 8ZnSO4 + 2H2S + 3H2O
86) 2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
87) Na2S + 8NaNO3 + 9H2SO4 = 10NaHSO4 + 8NO2 + 4H2O
88) Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
89) 5C + Ca3(PO4)2 + 3SiO2 = 2P + 5CO + 3CaSiO3 (to)
90) 2NaI + H2O2 + H2SO4 = Na2SO4 + I2 + 2H2O
91) 14HBr + K2Cr2O7 = 2CrBr3 + 3Br2 + 7H2O + 2KBr
92) 2NH3 + 2KMnO4(тв.) = N2 + 2MnO2 + 2KOH + 2H2O (to)
93) 2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl
94) 2HMnO4 + 5H2S + 2H2SO4 = 5S + 2MnSO4 + 8H2O
95) 3KNO3 + 8Al + 5KOH + 18H2O = 3NH3 + 8K[Al(OH)4]
96) 5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
97) P4 + 20HNO3 = 4H3PO4 + 20NO2 + 4H2O
98) 3NaClO + 4NaOH + Cr2O3 = 2Na2CrO4 + 3NaCl + 2H2O
99) Na2SO3 + 2KMnO4 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
100) Cr2(SO4)3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4 +8H2O
Реакции, которые встречаются в ЕГЭ по химии
Подготовили список реакций, которые часто встречаются и в первой, и во второй части ЕГЭ по химии! Не забывай, что без коэффициентов реакции не засчитываются и баллы не ставятся, поэтому обрати на них особое внимание!

Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
Вам также будет интересно
Номенклатура солей
Кислые соли образуется, если катион металла замещает протоны кислоты не полностью.
📌 Например,…
0 комментария
Авторизуйтесь, чтобы оставить комментарий.
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
- Разложения
- Замещения
- Обмена
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно
сложное вещество. Примеры:
4Na + O2 = 2Na2O
P2O5 + 3H2O = 2H3PO4
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
2KMnO4 = K2MnO4 + MnO2 + 2O2
Сa(OH)2 = CaO + H2O
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
CuSO4 + Fe = FeSO4 + Cu
2KI + Cl2 = 2KCl + I2
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами.
Часто обмен происходит анионами/катионами:
2KOH + MgCl2 = Mg(OH)2↓ + 2KCl
AgF + NaCl = AgCl↓ + NaF
Реакция нейтрализации — реакция обмена между основанием и кислотой, в ходе которой получаются соль и вода:
KOH + H2SO4 = K2SO4 + H2O

Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав
исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
- Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
- Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
K2SO3 + K2Cr2O7 + H2SO4 → K2SO4
+ Cr2(SO4)3 + H2O
KMnO4 → K2MnO4 + MnO2 + O2
KClO3 → KCl + O2
KOH + Cl2 → (t) KCl + KClO3 + H2O
KOH + Cl2 → KCl + KClO + H2O

Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО,
принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив
эту информацию таким образом, вы не будете путаться.

ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном.
При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
N2 + 3H2 ⇆ 2NH3
CH3COOH + C2H5OH ⇆ CH3COOC2H5 + H2O
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от
обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение.
В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl (выпадает осадок)
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)

Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому
составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой,
твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на
границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество,
твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Zn(тв.) + 2HCl(р-р.) = ZnCl2(р-р.) + H2(газ.)↑

Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером
такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
NaOH(р-р.) + CH3COOH(р-р.) = CH3COONa(р-р.) + H2O(р-р.)

Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся
или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются
воспламенением или взрывом (натрий с водой).
- Экзотермические реакции
- Эндотермические реакции
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой
энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное
количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
Большинство реакций нейтрализации относятся к экзотермическим:
NaOH + HCl = NaCl + H2O + 56 кДж

К экзотермическим реакциям часто относятся реакции горения, соединения.
4NH3 + 5O2 = 4NO + 6H2O + Q
Исключением является взаимодействие азота и кислорода, при
котором тепло поглощается:
N2 + O2 ⇄ 2NO — Q
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому
не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания»
в реакции вместо явного +Q при экзотермической реакции могут написать ΔH < 0. Например:
2Na + 2H2O = 2NaOH + H2; ΔH < 0 (это значит, что тепло выделяется — реакция экзотермическая)

Эндотермические реакции (греч. ἔνδον — внутри) — химические реакции, сопровождающиеся поглощением тепла, в результате которых образуются
вещества с более высоким энергетическим уровнем (их внутренняя энергия увеличивается).
К таким реакциям наиболее часто относятся реакции разложения. При написании эндотермических реакций в конце ставят «-Q», либо указывают точное
количество поглощенной энергии. Примеры таких реакций:
2HgO = Hg + O2 — Q
CaCO3 = CaO + CO2↑ — Q
С целью «запутывания» может быть дана энтальпия, она при таких реакциях всегда: ΔH > 0, так как внутренняя
энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)

Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик»)
является примером экзотермического разложения, при котором тепло выделяется.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
-
Главная
-
Теория ЕГЭ
-
Химия — теория ЕГЭ
-
Неорганические реакции в ЕГЭ по химии
Неорганические реакции в ЕГЭ по химии
- 20.01.2020
Сборник неорганических реакций из реальных заданий ЕГЭ прошлых лет (по химии).
Собрано более 100 реакций, а также правильных ответов к ним.
Ценность в том, что задания взяты именно из реальных кимов ЕГЭ.
- Другая теория по химии для ЕГЭ
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Комментарии (0)
Добавить комментарий
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Имя (обязательное)
Подписаться на уведомления о новых комментариях
Отправить
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.}2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат.,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
3) реакция крекинга (расщепления) пропана:
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑.$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
$NaOH+HNO_3=NaNO_3+H_2O$
или в ионном виде:
$OH^{–}+H^{+}=H_2O$;
2) реакция между щелочью и солью, идущая с образованием газа:
$2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$
или в ионном виде:
$NH_4^{+}+OH^{–}=NH_3↑+H_2O$;
3) реакция между щелочью и солью, идущая с образованием осадка:
$CuSO_4+2KOH=Cu(OH)_2↓+K_2SO_4$
или в ионном виде:
$Cu^{2+}+2OH^{-}=Cu(OH)_2↓$
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
$CH_3COOH+NaOH⇄NaCH_3COO+H_2O$
или
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$;
2) реакция, идущая с образованием газа:
$2CH_3COOH+CaCO_3=2CH_3COO^{–}+Ca^{2+}+CO_2↑+H_2O$;
3) реакция, идущая с образованием осадка:
$2CH_3COOH+K_2SiO_3=2KCH_3COO+H_2SiO_3↓$
или
$2CH_3COOH+SiO_3^{−}=2CH_3COO^{−}+H_2SiO_3↓$.
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1.${Mg}↖{0}+{2H}↖{+1}+SO_4^{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{text»уксусный альдегид»}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{text»этиловый спирт»}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{text»уксусный альдегид»}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{text»этиловый спирт»}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92.3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Темы кодификатора ЕГЭ: Классификация химических реакций в органической и неорганической химии.
Химические реакции — это такой вид взаимодействия частиц, когда из одних химических веществ получаются другие, отличающиеся от них по свойствам и строению. Вещества, которые вступают в реакцию — реагенты. Вещества, которые образуются в ходе химической реакции — продукты.
В ходе химической реакции разрушаются химические связи, и образуются новые.
В ходе химических реакций не меняются атомы, участвующие в реакции. Меняется только порядок соединения атомов в молекулах. Таким образов, число атомов одного и того же вещества в ходе химической реакции не меняется.
Химические реакции классифицируют по разным признакам. Рассмотрим основные виды классификации химических реакций.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
В органической химии к таким реакциям относятся реакции изомериза-ции, когда из одного изомера под действием катализатора и внешних факторов получается другой (как правило, структурный изомер).
Например, изомеризация бутана в 2-метилпропан (изобутан):
CH3-CH2-CH2-CH3 → CH3-CH(CH3)-CH3.
2. Реакции, протекающие с изменением состава
- Реакции соединения (A + B + … → D) — это такие реакции, в которых из двух и более веществ образуется одно новое сложное вещество. В неорганической химии к реакция соединения относятся реакции горения простых веществ, взаимодействие основных оксидов с кислотными и др. В органической химии такие реакции называются реакциями присоединения. Реакции присоединения — это такие реакции, в ходе которых к рассматриваемой органической молекуле присоединяется другая молекула. К реакциям присоединения относятся реакции гидрирования (взаимодействие с водородом), гидратации (присоединение воды), гидрогалогенирования (присоединение галогеноводорода), полимеризация (присоединение молекул друг к другу с образованием длинной цепочки) и др.
Например, гидратация :
CH2=CH2 + H2O → CH3-CH2-OH
- Реакции разложения (A → B + C + …) — это такие реакции, в ходе которых из одной сложной молекулы образуется несколько менее сложных или простых веществ. При этом могут образовываться как простые, так и сложные вещества.
Например, при разложении пероксида водорода:
2H2O2 → 2H2O + O2.
В органической химии разделяют собственно реакции разложения и реакции отщепления. Реакции отщепления (элиминирования) — это такие реакции, в ходе которых происходит отрыв атомов или атомных групп от исходной молекулы при сохранении ее углеродного скелета.
Например, реакция отщепления водорода (дегидрирование) от пропана:
C3H8 → C3H6 + H2
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
Например, реакция крекинга бутана (расщепление на более простые молекулы при нагревании или под действием катализатора):
C4H10 → C2H4 + C2H6
- Реакции замещения — это такие реакции, в ходе которых атомы или группы атомов одного вещества замещаются на атомы или группы атомов другого вещества. В неорганической химии эти реакции происходят по схеме:
AB + C = AC + B.
Например, более активные галогены вытесняют менее активные из соединений. Взаимодействие йодида калия с хлором:
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
Например, при сплавлении менее летучие оксиды вытесняют более летучие из солей. Так, нелетучий оксид кремния вытесняет оксид углерода из карбоната натрия при сплавлении:
Na2CO3 + SiO2 → Na2SiO3 + CO2
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
Например, реакция хлорирования метана:
CH4 + Cl2 → CH3Cl + HCl
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
- Реакции обмена — это такие реакции, в ходе которых два сложных вещества обмениваются своими составными частями:
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — взаимодействие уксусной кислоты с щелочью:
CH3-CООH + KOH = CH3-CООК + H2O
Классификация химических реакций по изменению степени окисления элементов, образующих вещества
По изменению степени окисления элементов химические реакции делят на окислительно-восстановительные реакции, и реакции, идущие без изменения степеней окисления химических элементов.
- Окислительно-восстановительные реакции (ОВР) — это реакции, в ходе которых степени окисления веществ изменяются. При этом происходит обмен электронами.
В неорганической химии к таким реакциям относятся, как правило, реакции разложения, замещения, соединения, и все реакции, идущие с участием простых веществ. Для уравнивания ОВР используют метод электронного баланса (количество отданных электронов должно быть равно количеству полученных) или метод электронно-ионного баланса.
В органической химии разделяют реакции окисления и восстановления, в зависимости от того, что происходит с органической молекулой.
Реакции окисления в органической химии — это реакции, в ходе которых уменьшается число атомов водорода или увеличивается число атомов кислорода в исходной органической молекуле.
Например, окисление этанола под действием оксида меди:
CH3-CH2-OH + CuO → CH3-CH=O + H2O + Cu
Реакции восстановления в органической химии — это реакции, в ходе которых увеличивается число атомов водорода или уменьшается число атомов кислорода в органической молекуле.
Например, восстановление уксусного альдегида водородом:
CH3-CH=O + H2 → CH3-CH2-OH
- Протолитические реакции и реакции обмена — это такие реакции, в ходе которые степени окисления атомов не изменяются.
Например, нейтрализация едкого натра азотной кислотой:
NaOH + HNO3 = H2O + NaNO3
Классификация реакций по тепловому эффекту
По тепловому эффекту реакции разделяют на экзотермические и эндотермические.
Экзотермические реакции — это реакции, сопровождающиеся выделением энергии в форме теплоты (+Q). К таким реакциям относятся почти все реакции соединения.
Исключения — реакция азота с кислородом с образованием оксида азота (II) — эндотермическая:
N2 + O2 = 2NO – Q
Реакция газообразного водорода с твердым йодом также эндотермическая:
H2 + I2 = 2HI – Q
Экзотермические реакции, в ходе которых выделяется свет, называют реакциями горения.
Например, горение метана:
CH4 + O2 = CO2 + H2O
Также экзотермическими являются:
- реакции щелочных металлов с водой;
- реакции, сопровождающиеся взрывом;
- разложение дихромата аммония («вулканчик»);
- образование аммиака: N2 + 3H2 = 2NH3;
- реакции нейтрализации;
- синтез метанола;
- алюмотермия;
- реакции, в которых из менее стабильных веществ образуются более стабильные;
- в органической химии — реакции присоединения, реакции горения, окисления и др.
Эндотермические реакции — это реакции, сопровождающиеся поглощением энергии в форме теплоты (— Q). Как правило, с поглощением теплоты идет большинство реакций разложения (реакции, требующие длительного нагревания).
Например, разложение известняка:
CaCO3 → CaO + CO2 – Q
Также эндотермическими являются:
- реакции гидролиза;
- реакции, идущие только при нагревании;
- реакции, протекающие только при очень высоких температурах или под действием электрического разряда.
Например, превращение кислорода в озон:
3O2 = 2O3 — Q
В органической химии с поглощением теплоты идут реакции разложения. Например, крекинг пентана:
C5H12 → C3H6 + C2H6 – Q
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Вещества могут существовать в трех основных агрегатных состояниях — твердом, жидком и газообразном. По фазовому состоянию разделяют реакции гомогенные и гетерогенные.
- Гомогенные реакции — это такие реакции, в которых реагирующие вещества и продукты находятся в одной фазе, и столкновение реагирующих частиц происходит во всем объеме реакционной смеси. К гомогенным реакциям относят взаимодействия жидкость-жидкость и газ-газ.
Например, окисление сернистого газа:
2SO2(г) + O2(г) = 2SO3(г)
- Гетерогенные реакции — это реакции, в которых реагирующие вещества и продукты находятся в разных фазах. При этом столкновение реагирующих частиц происходит только на границе соприкосновения фаз. К таким реакциям относятся взаимодействия газ-жидкость, газ-твердая фаза, твердая-твердая, и твердая фаза — жидкость.
Например, взаимодействие углекислого газа и гидроксида кальция:
CO2(г) + Ca(OH)2(р-р) = CaCO3(тв) + H2O
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Например, получение синтез-газа происходит при очень высоких температурах, при которых вода — пар:
CH4(г) + H2O(г) = CO(г) + 3H2(г)
Таким образом, паровая конверсия метана — гомогенная реакция.
Классификация химических реакций по участию катализатора
Катализатор — это такое вещество, которое ускоряет реакцию, но не входит в состав продуктов реакции. Катализатор участвует в реакции, но практически не расходуется в ходе реакции. Условно схему действия катализатора К при взаимодействии веществ A + B можно изобразить так:
A + K = AK;
AK + B = AB + K.
В зависимости от наличия катализатора различают каталитические и некаталитические реакции.
- Каталитические реакции — это реакции, которые идут с участием катализаторов.
Например, разложение бертолетовой соли: 2KClO3 → 2KCl + 3O2. - Некаталитические реакции — это реакции, которые идут без участия катализатора.
Например, горение этана: 2C2H6 + 5O2 = 2CO2 + 6H2O.
Все реакции, протекающие с участием в клетках живых организмов, протекают с участием особых белковых катализаторов — ферментов. Такие реакции называют ферментативными.
Более подробно механизм действия и функции катализаторов рассматриваются в отдельной статье.
Классификация реакций по способности протекать в обратном направлении
Обратимые реакции — это реакции, которые могут протекать и в прямом, и в и обратном направлении, т.е. когда при данных условиях продукты реакции могут взаимодействовать друг с другом.
К обратимым реакциям относятся:
- большинство гомогенных реакций,
- этерификация;
- реакции гидролиза;
- гидрирование-дегидрирование,
- гидратация-дегидратация;
- получение аммиака из простых веществ,
- окисление сернистого газа,
- получение галогеноводородов (кроме фтороводорода) и сероводорода;
- синтез метанола;
- получение и разложение карбонатов и гидрокарбонатов, и т.д.
Необратимые реакции — это реакции, которые протекают преимущественно в одном направлении, т.е. продукты реакции не могут взаимодействовать друг с другом при данных условиях.
Примеры необратимых реакций:
- горение;
- реакции, идущие со взрывом;
- реакции, идущие с образованием газа, осадка или воды в растворах;
- растворение щелочных металлов в воде; и др.
112
Создан на
11 января, 2022 От Admin
Классификация химических реакций
Тренажер задания 17 ЕГЭ по химии
1 / 10
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие этилбензола с бромом при облучении и нагревании.
1) электрофильная
2) радикальная
3) отщепления
4) присоединения
5) замещения
2 / 10
Из предложенного перечня выберите два вещества, реакция разложения которых является окислительно-восстановительной.
1) NН4NО2
2) Fе(ОН)3
3) NaHCO3
4) АgNО3
5) Н2SiO3
3 / 10
Из перечисленных типов реакций выберите два типа, которым соответствует взаимодействие оксида серы(IV) с кислородом.
1) обмена
2) окислительно-восстановительным
3) каталитическим
4) замещения
5) необратимым
4 / 10
Из предложенного перечня выберите два вещества, разложение которых является окислительно-восстановительной реакцией.
1) нитрат железа(III)
2) гидрокарбонат натрия
3) кремниевая кислота
4) карбонат кальция
5) перманганат калия
5 / 10
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие оксида фосфора(V) с водой.
1) реакция обмена
2) гетерогенная реакция
3) реакция соединения
4) экзотермическая реакция
5) окислительно-восстановительная реакция
6 / 10
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие спиртового
раствора этилата натрия с водой.
1) присоединения
2) гомогенная
3) гидролиза
4) гидратации
5) отщепления
7 / 10
Из предложенного перечня веществ выберите два вещества, взаимодействие которых с азотной кислотой не является окислительно-восстановительной реакцией.
1) аммиак
2) гидроксид алюминия
3) серебро
4) магний
5) медь
8 / 10
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие изопрена с водородом.
1) реакция гидратации
2) реакция нейтрализации
3) реакция обмена
4) реакция присоединения
5) реакция гидрирования
9 / 10
Из предложенного перечня веществ выберите два вещества, взаимодействие которых с гидроксидом натрия является окислительно-восстановительной реакцией.
1) хлороводород
2) оксид азота(IV)
3) азотная кислота
4) хлор
5) хлорная кислота
10 / 10
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие карбоната кальция с соляной кислотой.
1) обмена
2) гетерогенная
3) замещения
4) необратимая
5) окислительно-восстановительная
Ваша оценка
The average score is 43%
Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и NaOH
Б) Cu(NO3)2 и Na2S
В) Cu(NO3)2 и HNO3
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и NaOH
Б) HCl и Al(OH)3
В) AgNO3 и KI
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и H3PO4
Б) Zn(OH)2 и HCl
В) MnO2 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) K2CrO4 и H2SO4
Б) Cu(OH)2 и HCl
В) HCl и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaCl
Б) NaI и AgNO3
В) CuCl2 и Na2S
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) K2S и H2SO4
Б) Fe(OH)2 и HCl
В) FeSO4 и Ba(NO3)2
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и KOH
Б) K2CO3 и BaCl2
В) Na2CO3 и HNO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) CaCl2 и AgNO3
Б) CuCl2 и Ba(OH)2
В) FeCl3 и Ba(OH)2
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Al(NO3)3 и NaOH
Б) K2CO3 и HNO3
В) HBr и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NH4Cl
Б) NH4Cl и Ca(OH)2
В) CuSO4 и KOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Fe(NO3)2 и NaOH
Б) KOH и CuCl2
В) ZnCl2 и Na2S
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и H2SO4(конц.)
Б) NaOH и NH4Cl
В) Na2CO3 и HI
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) CuSO4 и BaCl2
Б) CuSO4 и NaOH
В) FeSO4 и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) FeCl3 и AgNO3
Б) CaCl2 и Na2CO3
В) KOH и H3PO4
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) H2SO4 и Na2SO3
Б) HCl и Na2CO3
В) Cr(OH)3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) HNO3 и K2SiO3
Б) H2SO4 и BaCl2
В) Cu и H2SO4
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) BaI2 и AgNO3
Б) Ag и HNO3 (конц.)
В) Ag и H2SO4 (конц.)
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
Ответы
Приложение
Основный оксид
+ вода (оксиды активных металлов)
щёлочь Me(OH)x
Основный оксид
+ кислотный, амфот. оксид
сольMexKOy
Основный оксид
+ кислота
соль MexKOy + Н2О
Кислотный оксид
+ вода (кроме SiO2 – речной песок)
кислота НxKO
Кислотный оксид
+ основный, амфотерный оксид
соль MexKOy
Кислотный оксид
+ щёлочь
соль MexKOy + Н2О
Кислотный оксид
+ соль более слабых кислот с t°
соль MexKOy + оксид неМе
Амфотерный оксид
+ кислота (реаг. как основный оксид)
соль MexKOy + Н2О
Амфотерный оксид
+ щёлочь (реаг. как кислотный оксид)
соль MexKOy + Н2О
Амфотерный оксид
+ оксид неметалла
соль MexKOy
Кислота
+ металл, до Н в активности мет.
соль + Н2↑ (кроме HNO3)
Кислота
+ основный, амфотерный оксид
соль + Н2О
Кислота
+ основание, амфот. гидроксид
соль + Н2О
Кислота
+ соль (если образ.слаб. кисл. или осад.)
новая кислота + новая соль
Кислота
+ индикатор
изменение окраски
Щёлочь (Растворимое основание)
+ металл (для Be, Zn, Al)
соль + Н2↑
Щёлочь (Растворимое основание)
+ кислотный, амфотерный оксид
соль + Н2О
Щёлочь (Растворимое основание)
+ кислота, амфотерный гидроксид
соль + Н2О
Щёлочь (Растворимое основание)
+ растворимая соль (если обр. осадок)
новое основание + новая соль
Щёлочь (Растворимое основание)
+ индикатор
изменение окраски
Нерастворимое основание
+ кислота
соль + Н2О
Нерастворимое основание
разлагается при нагревании (t°)
оксид металла + Н2О
Растворимая соль
+ более активный Me чем в исх соли
соль + металл
Растворимая соль
+ кислота (если обр. слаб.кисл или осад.)
новая соль + новая кислота
Растворимая соль
+ щёлочь (идёт, если образуется осадок)
новая соль + новое основание
Растворимая соль
+ растворимая соль (если обр. осадок)
новая соль + новая соль
Нерастворимая соль
+ кислота (если обр. слаб.кисл или осадок)
новая соль + новая кислота
Нерастворимая соль
разлагается при нагревании (t°)
оксид металла + оксид немет.