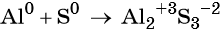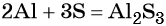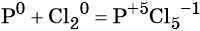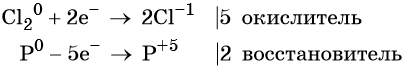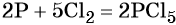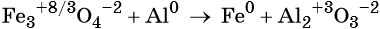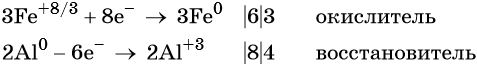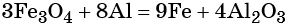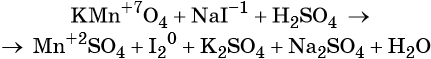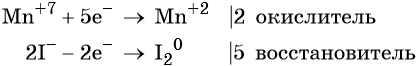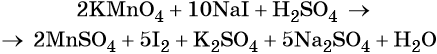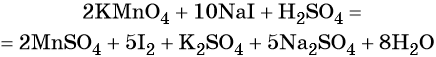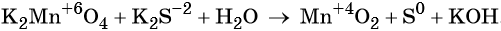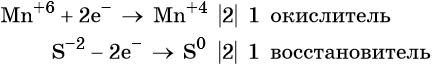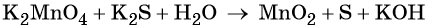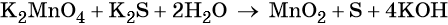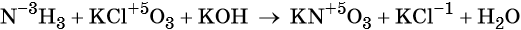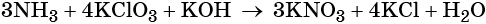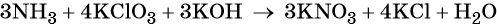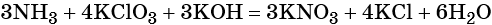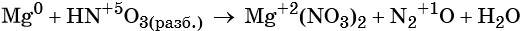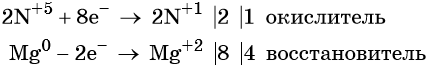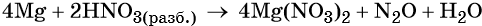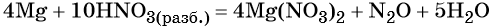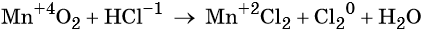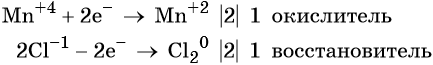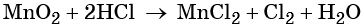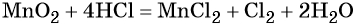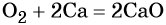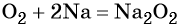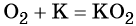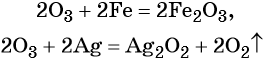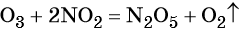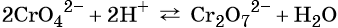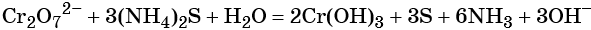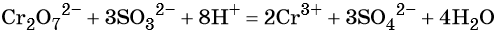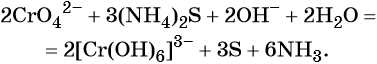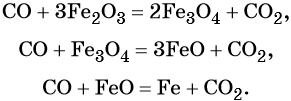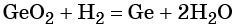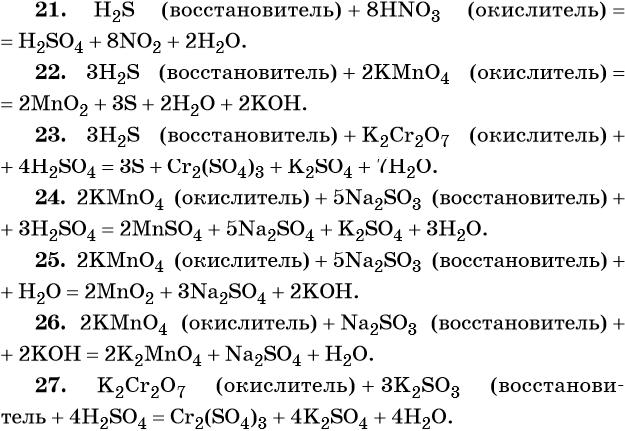1. Окислители и восстановители
2. Классификация окислительно–восстановительных реакций
3. Основные правила составления ОВР
4. Общие закономерности протекания ОВР
5. Основные схемы ОВР
5.1. Схема восстановления перманганатов
5.2. Схема восстановления хроматов/бихроматов
5.3. Разложение нитратов
5.4. Окислительные свойства азотной кислоты
5.5. Взаимодействие металлов с серной кислотой
5.6. Пероксид водорода
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN+5O3, HCl+7O4), соли (KN+5O3, KMn+7O4), оксиды (S+6O3, Cr+6O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4+, Fe3+, Au3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2+, Fe2+, Cr2+), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S+4O3)2–, (НР+3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители:
-
перманганат калия (KMnO4);
-
дихромат калия (K2Cr2O7);
-
азотная кислота (HNO3);
-
концентрированная серная кислота (H2SO4);
-
пероксид водорода (H2O2);
-
оксиды марганца (IV) и свинца (IV) (MnO2, PbO2);
-
расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов .
К восстановителям, которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
2Al0 + Fe+32O3 → Al+32O3 + 2Fe0,
C0 + 4HN+5O3(конц) = C+4O2 ↑ + 4N+4O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
(N-3H4)2Cr+62O7 → N20 ↑+ Cr+32O3 + 4 H2O,
2 NaN+5O-23 → 2 NaN+3O2 + O02↑.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
2H2S-2 + S+4O2 = 3S + 2H2O
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается, а восстановитель окисляется.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Рассмотрим подробно метод электронного баланса.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
K+2S-2 + 2K+Mn+7O-24 = 2K+2Mn+6O-24 + S0
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
S-2 -2e = S0
Mn+7 + 1e = Mn+6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций.
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn+7 в кислой среде восстанавливается до Mn+2, а в щелочной — до Mn+6);
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N+5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N-3);
- либо окислитель практически не подвержен изменениям среды.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Если среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ. Например, при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстанавливается азот N+5.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества. Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn2+. Оксид марганца в степени окисления +2 проявляет основные свойства, поэтому в кислой среде образуется соль. Соли марганца +2 бесцветны. В нейтральном растворе марганец восстанавливается до степени окисления +4, с образованием амфотерного оксида MnO2 — коричневого осадка, нерастворимого в кислотах и щелочах. В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления +6. Соединения марганца +6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты. Манганаты придают раствору зеленую окраску.
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S0.
5 K2S + 2 KMnO4 + 8 H2SO4 = 5 S + 2 MnSO4 + 6 K2SO4 + 8 H2O,
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
K2S + 2 KMnO4 –(KOH)= 2 K2MnO4 + S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
- неметаллы с отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк — до +5;
- неметаллы с промежуточной степенью окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 + неМе (низшая с.о.) = неМе0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме0 = Ме (стабильная с.о.) + др. продукты
KMnO4 + P-3, As-3= P+5, As+5 + др. продукты
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде.
Восстанавливаются соединения хрома (VI) до соединений хрома (III). Соединения хрома Cr+3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3, и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K3[Cr(OH)6].
Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As+5 + другие продукты
Разложение нитратов
Соли-нитраты содержат азот в степени окисления +5 — сильный окислитель. Такой азот может окислять кислород (О-2). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярного кислорода O2.
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород.
Например:
2NaNO3 → 2NaNO2 + O2.
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь), то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
2Zn(NO3)2 → 2ZnО + 4NO2 + O2.
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов, расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N+5, участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород.
Например, разложение нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2.
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония:
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления +5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 оС образуется оксид азота (I) («веселящий газ») и вода:
NH4NO3 → N2O + 2H2O
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N+3 и восстановителя N-3
NH4NO2 → N2 + 2H2O
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Mn(NO3)2 = MnO2 + 2NO2
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
2Fe(NO3)2 → 2FeO + 4NO2 + O2 при 60°C
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 при >60°C
Нитрат никеля (II) разлагается до нитрита при нагревании до 150оС под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород, в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N+4); оксид азота (II) NO (N+2); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3. Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются.
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например, взаимодействие цинка с очень разбавленной азотной кислотой:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
- концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe. При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платиной Pt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами и металлами средней активности азотная кислота восстанавливается до оксида азота (IV) NO2;
Например, окисление меди концентрированной азотной кислотой:
Cu+ 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота (I) N2O;
Например, окисление натрия концентрированной азотной кислотой:
8Na+ 10HNO3 = 8NaNO3 + N2O + 5H2O
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
NO2; NO; N2O; N2; NH4NO3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например, взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H+, которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальной степени окисления.
Например:
Fe + H2SO4(разб) = FeSO4 + H2
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S+4O2, молекулярная сера S либо сероводород H2S-2, в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Например, медь окисляется концентрированной серной кислотой:
Cu0 + 2H2S+6O4(конц) = Cu+2SO4 + S+4O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S2- (в зависимости от температуры, степени измельчения и активности металла).
Например, взаимодействие концентрированной серной кислоты с цинком:
8Na0 + 5H2S+6O4(конц) → 4Na2+SO4 + H2S—2 + 4H2O
Пероксид водорода
Пероксид водорода H2O2 содержит кислород в степени окисления -1. Такой кислород может и повышать, и понижать степень окисления. Таким образом, пероксид водорода проявляет и окислительные, и восстановительные свойства.
При взаимодействии с восстановителями пероксид водорода проявляет свойства окислителя, и восстанавливается до степени окисления -2. Как правило, продуктом восстановления пероксида водорода является вода или гидроксид-ион, в зависимости от условий проведения реакции. Например:
S+4O2 + H2O2-1 → H2S+6O4-2
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например:
2KMn+7O4 + 5H2O2-1 + 3H2SO4 → 5O20 + 2Mn+2SO4 + K2SO4 + 8H2O
-
Теоретические сведения.
-
Перманганат калия как окислитель.
-
Дихромат и хромат как окислители.
-
Повышение степеней окисления хрома и марганца.
-
Азотная кислота с металлами.
-
Серная кислота с металлами.
-
Диспропорционирование.
-
Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).
-
Диспропорционирование оксида азота (IV) и солей.
-
Активность металлов и неметаллов.
-
Электрохимический ряд напряжений металлов.
-
Особенности поведения некоторых окислителей и восстановителей.
-
Необходимые навыки.
-
Последовательность расстановки коэффициентов в уравнении.
-
Возможные ошибки.
-
Ответы и решения к заданиям с пояснениями.
Автор статьи — профессиональный репетитор О. В. Овчинникова.
Вторая часть на ЕГЭ по химии включает 6 заданий, и каждое из них требует развёрнутого ответа. Для сдачи экзамена на высокий балл потребуется научиться решать все. Первым идёт задание 29, где нужно составить окислительно-восстановительную реакцию, используя вещества из списка. Вот один из вариантов формулировки:
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выделение осадка или газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительновосстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Это задание в последние годы заметно усложнили. Если ранее было достаточно найти любые два вещества, между которыми протекает окислительно-восстановительная реакция (ОВР), записать её и уравнять методом электронного баланса, то теперь необходимо также знать визуальные признаки взаимодействия этих веществ.
Нам подойдёт реакция, которая описана в условии, любую другую не зачтут. Из-за этого для выполнения данного задания на ЕГЭ требуется не только научиться уравнивать ОВР методом электронного баланса, проработать огромное количество материала, связанного с химическими свойствами веществ, но и запомнить, что происходит в процессе большинства из данных реакций внешне. Звучит страшно, но надо понимать: всё это пригодится вам и в других заданиях.
Приведённая ниже информация поможет понять, на что обратить внимание.
к оглавлению ▴
Теоретические сведения.
Перманганат калия как окислитель.
| Среда, куда переходит | в кислой среде |
в нейтральной среде |
в щелочной среде |
| Образующееся соединение марганца | (соль той кислоты, которая участвует в реакции) |
Манганат |
|
| Внешние признаки реакции | Обесцвечивание тёмно-фиолетового раствора | Обесцвечивание тёмно-фиолетового раствора и выпадение бурого осадка | Раствор из тёмно-фиолетового становится зелёным |
к оглавлению ▴
Дихромат и хромат как окислители.
| кислая среда | нейтральная среда | щелочная среда |
| Соли тех кислот, которые участвуют в реакции: |
||
| Раствор из оранжевого (жёлтого) становится зелёным | Выпадение зелёного осадка, обесцвечивание оранжевого раствора |
к оглавлению ▴
Повышение степеней окисления хрома и марганца.
к оглавлению ▴
Азотная кислота с металлами.
— не выделяется водород, образуются продукты восстановления азота.
| Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот | ||||
| Неактивные металлы (правее алюминия включительно) + конц. Кислота; Неметаллы + конц. Кислота |
Активные металлы (левее Mg включительно) + конц. Кислота | Активные металлы (левее Mg включительно) + разб Кислота | Металлы от алюминия до железа включительно + разб. кислота | Неактивные металлы (правее кобальта включительно) + разб. Кислота |
| Пассивация: с холодной концентрированной азотной кислотой не реагируют: |
||||
| Не реагируют с азотной кислотой ни при какой концентрации: |
к оглавлению ▴
Серная кислота с металлами.
— разбавленная серная кислота реагирует как обычная минеральная кислота с металлами левее в ряду напряжений, при этом выделяется водород;
— при реакции с металлами концентрированной серной кислоты не выделяется водород, образуются продукты восстановления серы.
к оглавлению ▴
Диспропорционирование.
Реакции диспропорционирования — это реакции, в которых один и тот же элемент является и окислителем, и восстановителем, одновременно и повышая, и понижая свою степень окисления:
к оглавлению ▴
Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).
| Сера + щёлочь |
|
| Фосфор + щелочь |
|
| Хлор, бром, иод + вода (без нагревания) Хлор, бром, иод + щелочь (без нагревания) |
|
| Бром, иод + вода (при нагревании) Хлор, бром, иод + щелочь (при нагревании) |
к оглавлению ▴
Диспропорционирование оксида азота (IV) и солей.
к оглавлению ▴
Активность металлов и неметаллов.
Для анализа активности металлов используют либо электрохимический ряд напряжений металлов, либо их положение в Периодической таблице. Чем активнее металл, тем легче он будет отдавать электроны и тем более хорошим восстановителем он будет в окислительно-восстановительных реакциях.
Электрохимический ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au
Активность неметаллов так же можно определить по их положению в таблице Менделеева.
В заданиях ЕГЭ считается, что азот — более активный неметалл, чем хлор.
На самом деле по поводу того, кто имеет большую электроотрицательность – азот или хлор, давно идут споры. Мы придерживаемся позиции, что хлор в данном противостоянии побеждает – он находится в седьмой группе, до устойчивого состояния ему не хватает одного электрона, в отличие от азота, которому не хватает трёх.
Более активный неметалл будет окислителем, а менее активный будет довольствоваться ролью восстановителя, если они реагируют друг с другом.
Данные из справочника: CRS Handbook of Chemistry and Physics (издание 2007 года).
Таблица электроотрицательности (Х) некоторых атомов
|
Элемент |
X |
Элемент |
X |
|
Cs |
0,79 |
H |
2,20 |
|
K |
0,82 |
C |
2,55 |
|
Na |
0,93 |
S |
2,58 |
|
Li |
0,98 |
I |
2,66 |
|
Ca |
1,0 |
Br |
2,96 |
|
Mg |
1,31 |
N |
3,04 |
|
Be |
1,57 |
Cl |
3,16 |
|
Si |
1,90 |
O |
3,44 |
|
B |
2,04 |
F |
3,98 |
|
P |
2,19 |
к оглавлению ▴
Особенности поведения некоторых окислителей и восстановителей.
а) кислородсодержащие соли и кислоты хлора в реакциях с восстановителями обычно переходят в хлориды:
б) если в реакции участвуют вещества, в которых один и тот же элемент имеет отрицательную и положительную степени окисления — они встречаются в нулевой степени окисления (выделяется простое вещество).
к оглавлению ▴
Необходимые навыки.
- Расстановка степеней окисления.
Необходимо помнить, что степень окисления — это гипотетический заряд атома (т.е. условный, мнимый), но он должен не выходить за рамки здравого смысла. Он может быть целым, дробным или равным нулю.Задание 1: Расставьте степени окисления в веществах:
- Расстановка степеней окисления в органических веществах.
Помните, что нас интересуют степени окисления только тех атомов углерода, которые меняют своё окружение в процессе ОВР, при этом общий заряд атома углерода и его неуглеродного окружения принимается за 0.Задание 2: Определите степень окисления атомов углерода, обведённых рамкой вместе с неуглеродным окружением:
2-метилбутен-2:
–
=
ацетон:
уксусная кислота:
–
- Не забывайте задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает, и во что они переходят? Чтобы не получалось, что электроны прилетают из ниоткуда или улетают в никуда.
Пример:
В этой реакции надо увидеть, что иодид калия
может являться только восстановителем, поэтому нитрит калия
будет принимать электроны, понижая свою степень окисления.
Причём в этих условиях (разбавленный раствор) азот переходит изв ближайшую степень окисления
.
- Составление электронного баланса сложнее, если формульная единица вещества содержит несколько атомов окислителя или восстановителя.
В этом случае это необходимо учитывать в полуреакции, рассчитывая число электронов.
Самая частая проблема — с дихроматом калия, когда он в роли окислителя переходит в
:
Эти же двойки нельзя забыть при уравнивании, ведь они указывают число атомов данного вида в уравнении.
Задание 3: Какой коэффициент нужно поставить перед
и перед
Задание 4: Какой коэффициент в уравнении реакции будет стоять перед магнием?
- Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция.
Это можно сделать либо про продуктам восстановления марганца и хрома, либо по типу соединений, которые получились в правой части реакции: например, если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая. Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты.Задание 5: Определите среду и вещества в каждой реакции:
- Помните, что вода — вольный путешественник, она может как участвовать в реакции, так и образовываться.
Задание 6: В какой стороне реакции окажется вода? Bо что перейдёт цинк?
Задание 7: Мягкое и жесткое окисление алкенов.
Допишите и уравняйте реакции, предварительно расставив степени окисления в органических молекулах:(хол. р-р.)
- Иногда какой-либо продукт реакции можно определить, только составив электронный баланс и поняв, каких частиц у нас больше:
Задание 8: Какие продукты ещё получатся? Допишите и уравняйте реакцию:
- Во что переходят реагенты в реакции?
Если ответ на этот вопрос не дают выученные нами схемы, то нужно проанализировать, какие в реакции окислитель и восстановитель — сильные или не очень?
Если окислитель средней силы, вряд ли он может окислить, например, серу изв
, обычно окисление идёт только до
.
И наоборот, если— сильный восстановитель и может восстановить серу из
до
, то
— только до
.
Задание 9: Во что перейдёт сера? Допишите и уравняйте реакции:
(конц.)
- Проверьте, чтобы в реакции был и окислитель, и восстановитель.
Задание 10: Сколько ещё продуктов в этой реакции, и каких?
- Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Задание 11: Кто из этих галогенов окислитель, а кто восстановитель?
- Если же один из реагентов — типичный окислитель или восстановитель — тогда второй будет «выполнять его волю», либо отдавая электроны окислителю, либо принимая у восстановителя.
Пероксид водорода — вещество с двойственной природой, в роли окислителя (которая ему более характерна) переходит в воду, а в роли восстановителя — переходит в свободный газообразный кислород.
Задание 12: Какую роль выполняет пероксид водорода в каждой реакции?
к оглавлению ▴
Последовательность расстановки коэффициентов в уравнении.
Сначала проставьте коэффициенты, полученные из электронного баланса.
Помните, что удваивать или сокращать их можно только вместе. Если какое-либо вещество выступает и в роли среды, и в роли окислителя (восстановителя) — его надо будет уравнивать позднее, когда почти все коэффициенты расставлены.
Предпоследним уравнивается водород, а по кислороду мы только проверяем!
-
Задание 13: Допишите и уравняйте:
Не спешите, пересчитывая атомы кислорода! Не забывайте умножать, а не складывать индексы и коэффициенты.
Число атомов кислорода в левой и правой части должно сойтись!
Если этого не произошло (при условии, что вы их считаете правильно), значит, где-то ошибка.
к оглавлению ▴
Возможные ошибки.
- Расстановка степеней окисления: проверяйте каждое вещество внимательно.
Часто ошибаются в следующих случаях:а) степени окисления в водородных соединениях неметаллов: фосфин
— степень окисления у фосфора — отрицательная;
б) в органических веществах — проверьте ещё раз, всё ли окружение атомаучтено;
в) аммиак и соли аммония — в них азот всегда имеет степень окисления;
г) кислородные соли и кислоты хлора — в них хлор может иметь степень окисления;
д) пероксиды и надпероксиды — в них кислород не имеет степени окисления, бывает
, а в
— даже
;
е) двойные оксиды:— в них металлы имеют две разные степени окисления, обычно только одна из них участвует в переносе электронов.
Задание 14: Допишите и уравняйте:
Задание 15: Допишите и уравняйте:
- Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот.
Пример: в реакции
свободный хлор часто теряется. Получается, что электроны к марганцу прилетели из космоса…
- Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.Задание 16: Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:
к оглавлению ▴
Ответы и решения к заданиям с пояснениями.
Задание 1:
Задание 2:
2-метилбутен-2: –
=
ацетон:
уксусная кислота: –
Задание 3:
Так как в молекуле дихромата 2 атома хрома, то и электронов они отдают в 2 раза больше — т.е. 6.
Задание 4:
Так как в молекуле два атома азота, эту двойку надо учесть в электронном балансе — т.е. перед магнием должен быть коэффициент
.
Задание 5:
Если среда щелочная, то фосфор будет существовать в виде соли — фосфата калия.
Если среда кислая, то фосфин переходит в фосфорную кислоту.
Задание 6:
Так как цинк — амфотерный металл, в щелочном растворе он образует гидроксокомплекс. В результате расстановки коэффициентов обнаруживается, что вода должна присутствовать в левой части реакции:
Задание 7:
Электроны отдают два атома в молекуле алкена. Поэтому мы должны учесть общее количество отданных всей молекулой электронов:
(хол. р-р.)
Обратите внимание, что из 10 ионов калия 9 распределены между двумя солями, поэтому щелочи получится только одна молекула.
Задание 8:
В процессе составления баланса мы видим, что на 2 иона приходится 3 сульфат-иона. Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
Задание 9:
(перманганат не очень сильный окислитель в растворе; обратите внимание, что вода переходит в процессе уравнивания вправо!)
(конц.)
(концентрированная азотная кислота очень сильный окислитель)
Задание 10:
Не забудьте, что марганец принимает электроны, при этом хлор их должен отдать.
Хлор выделяется в виде простого вещества.
Задание 11:
Чем выше в подгруппе неметалл, тем более он активный окислитель, т.е. хлор в этой реакции будет окислителем. Йод переходит в наиболее устойчивую для него положительную степень окисления , образуя йодноватую кислоту.
Задание 12:
(пероксид — окислитель, т.к. восстановитель — )
(пероксид — восстановитель, т.к. окислитель — перманганат калия)
(пероксид — окислитель, т.к. роль восстановителя более характерна для нитрита калия, который стремится перейти в нитрат)
Задание 13:
Задание 14:
Задание 15:
Задание 16:
(водный раствор)
(щелочная среда)
(водный раствор)
(кислая среда)
Читаем дальше: Задача С2 на ЕГЭ по химии.
Задачи на сплавы и смеси на ЕГЭ по химии.
Задача С5 на ЕГЭ по химии. Определение формул органических веществ.
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Задание 29 на ЕГЭ по химии. Особенности, советы, рекомендации.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.03.2023
Основные правила составления окислительно-восстановительных реакций
(скачать pdf файл)
Существует несколько основных правил, которые сильно упрощают составление окислительно-восстановительных реакций. Более подробно эти и другие правила рассматривается на других страницах этого раздела, но для ЕГЭ достаточно знать правила из этого списка.
Правило 1. Реакции простых веществ: металлов и неметаллов с щелочами, кислотами и солями:
1.1) Из металлов только Al, Zn и Be взаимодействуют со щелочами с выделением водорода:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
1.2) Из неметаллов только S, P, Si и галогены реагируют с щелочами:
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
P4 + 3NaOH + 3H2O → PH3
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2.1) Металлы (стоящие в ряду активности металлов до H2) реагируют с кислотами-неокислителями с выделением водорода:
2HCl + Fe → FeCl2 + H2
H2SO4(р) + Fe → FeSO4 + H2
2.2) Все металлы, кроме Pt и Au, реагируют с кислотами-окислителями без выделения водорода:
2H2SO4(к) + 2Ag → Ag2SO4 + SO2
6H2SO4(к) + 2Fe → Fe2(SO4)3 + 3SO2
2.3) Более сильные металлы вытесняют более слабые из растворов их солей:
Fe + CuSO4 → FeSO4 + Cu
3) Неметаллы не реагируют с кислотами-неокислителями:
C + HCl → реакция не идет
4) Такие неметаллы, как S, C, P могут реагировать с солями, проявляющими окислительные свойства (KClO3, KNO3 в расплавленном состоянии):
6P + 5KClO3 → 3P2O5 + 5KCl
C + 2KNO3 (расплав) → CO2
S + 2KNO3 (расплав) → SO2
5) Важная реакция получения фосфора:
5C + 3SiO2 + Ca3(PO4)2 → 5CO
6) Из неметаллов только S, C, и P реагируют с кислотами-окислителями (в рамках ЕГЭ), а также I2 с HNO3(к):
Правило 2. Фосфор
1) Наиболее устойчивая степень окисления фосфора +5, следовательно, любые другие соединения фосфора окисляются сильными окислителями до этой степени окисления (с образованием P2O5 или фосфат-иона):
PH3 + 8KMnO4 + 11KOH → K3PO4 + 8K2MnO4 + 7H2O
6P + 5KClO3 → 5KCl + 3P2O5
3P2O3 + 4HNO3 + 7H2O → 6H3PO4 + 4NO
Правило 3. Азот
1) Аммиак, как правило, окисляется до азота N2:
8NH3 + 3KBrO4 → 3KBr + 4N2
2NH3 + 3CuO → 3Cu + N2
Исключением является каталитическое окисление аммиака:
4NH3 + 5O2 → 4NO
Обычное горение аммиака протекает с образованием N2 (как и горение любых органических азотсодержащих соединений):
4NH3 + 3O2 → 2N2
2) Нитрит-ионы окисляются до нитрат-ионов:
3KNO2 + K2Cr2O7 + 4H2SO4 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2
3) Нитрит-ионы восстанавливаются до азота в реакциях с солями аммония:
NaNO2 + NH4Cl → N2
Ca(NO2)2 + (NH4)2SO4 → 2N2
4) Нитрит-ионы восстанавливаются до оксида азота (II) в реакциях с типичными восстановителями: HI, йодидами, солями Fe+2 и др.:
2KNO2 + 2KI + 2H2SO4 → 2NO
HNO2 + 2HI → 2NO
Следующий тип реакций встречается в вариантах Ю.Н. Медведева.
5) Нитрат-ионы являются сильными окислителями при сплавлении с соединениями Cr, Mn, Fe в щелочной среде и с некоторыми неметаллами (восстанавливаются до нитритов):
3NaNO3 + Cr2O3 + 4KOH → 3NaNO2 + 2K2CrO4 + 2H2O
KNO3 + MnO2 + K2CO3 → KNO2 + K2MnO4 + CO2
2NaNO3 + FeSO4 + 4NaOH → 2NaNO2 + Na2FeO4 + Na2SO4 + 2H2O
2KNO3(расплав) + C → 2KNO2 + CO2
2KNO3(расплав) + S → 2KNO2 + SO2
6) Нитрат-ионы являются сильными окислителями в кислотной среде:
2KNO3 + Cu + 2H2SO4 → CuSO4 + 2NO2
7) Восстановление нитратов до аммиака в реакциях с такими металлами, как Al, Zn, Mg (встречается очень редко):
3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3
NaNO3 + 4Zn + 7NaOH + 6H2O → NH3
KNO3 + 4Mg + 6H2O → NH3


Правило 4. Кислород
1) Перекись водорода окисляется до кислорода O2 типичными окислителями:
KMnO4, K2Cr2O7, галогены, соли кислородсодержащих кислот хлора (например, KClO3) и некоторыми другими.
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO

2) Перекись водорода восстанавливается до H2O типичными восстановителями:
KI (HI, йодиды), K2SO3 (SO2, сульфиты), KNO2 (нитриты), PbS (H2S, сульфиды), соединения Cr+3 в щелочной среде, соединения Fe+2, NH3 и некоторыми другими.
H2O2 + Na2SO3 → Na2SO4 + H2O
H2O2 + KNO2 → KNO3 + H2O
3H2O2 + 2NaCrO2 + 2NaOH → 2Na2CrO4 + 4H2O
Свойства пероксида водорода с примерами
Правило 5. Галогены
1) Галогены диспропорционируют в щелочах:
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2) Простые вещества галогены и соединения галогенов в любой положительной степени окисления восстанавливаются, как правило, до галогенид-ионов (т.е. до ст. ок. -1) в реакциях с типичными восстановителями:
5HClO3 + 6P + 9H2O → 5HCl + 6H3PO4
KClO3 + 6Fe(OH)2 + 18HCl → 6FeCl3 + KCl + 15H2O
2Cl2 + H3PO2 + 7KOH → K3PO4 + 4KCl + 5H2O
2Br2 + CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
3) Галогенид-ионы окисляются, как правило, до простых веществ: Cl2, Br2, I2:
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
16HCl + 2KMnO4 → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
4) Йодид меди восстанавливает серную кислоту до SO2, тогда как йодиды активных металлов до H2S:
2CuI + 4H2SO4(конц.) → I2 + 2SO2 + 2CuSO4 + 4H2O
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
5) Концентрированной серной кислотой окисляются только бромид- и йодид-ионы. В первом случае образуется SO2, во втором H2S.
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O.
6) Более сильные галогены вытесняют менее сильные из галогенидов. В ряду F2, Cl2, Br2, I2 окислительные свойства ослабевают.
Cl2 + 2NaI → I2 + 2NaCl
Cl2 + NaF → реакция не идет, так как Cl2 — более слабый окислитель чем F2.
Все галогены вытесняют серу из сульфидов:
(NH4)2S + Br2 → S + 2NH4Br.
Правило 6. Сера
1) Сульфид-ионы обычно окисляются до S типичными окислителями: Br2, I2, растворами солей K2Cr2O7, KMnO4 и др.:
3Na2S + K2Cr2O7 + 7H2SO4 → 3S
5Na2S + 2KMnO4 + 16HCl → 5S
H2S + Br2 → S
H2S + H2O2 → S
2) С H2SO4(к) сероводород и сульфиды реагируют с образованием SO2, аналогично реакции кислоты с серой:
S + H2SO4(конц.) → 3SO2
H2S + 3H2SO4(конц.) → 4SO2
K2S + 4H2SO4(конц.) → K2SO4 + 4SO2
В этой реакции сульфид-ион окисляется до SO2: S–2 -6e → S+4.
Часть сульфат-ионов восстанавливается также до SO2 и часть остается для образования соли K2SO4.
3) Окисление H2S и сульфидов до сульфат-ионов протекает в реакциях с такими окислителями, как Cl2 в воде, H2O2, HNO3(конц.) при нагревании:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
H2S + 8HNO3(конц.) → H2SO4 + 8NO2
PbS + 4H2O2 → PbSO4 + 4H2O (черный сульфид свинца превращается в белый сульфат)
4) Сульфит-ионы любыми окислителями окисляются до сульфат-иона:
3Na2SO3 + 2KMnO4 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
3K2SO3 + 2K2CrO4 + 5H2O → 2Cr(OH)3 + 3K2SO4 + 4KOH.
5) Взаимодействие серной кислоты с простыми и сложными веществами
Правило 7. Медь
1) Соединения Cu+2 окисляют соединения S+4 и I– (восстанавливаясь до Cu+1):
2CuCl2 + SO2 + 2H2O → 2CuCl
2Cu(NO3)2 + 4KI → 2CuI

В реакции с аммиаком выделяется металлическая медь:
3CuO + 2NH3 → N2
2) Йодиды меди реагируют с H2SO4(к) с образованием SO2, тогда как йодиды щелочных металлов с образованием H2S:
2CuI + 4H2SO4 → 2CuSO4 + I2 + 2SO2 + 4H2O
8KI + 5H2SO4(конц.) → 4K2SO4 + 4I2 + H2S + 4H2O
3) Медь по-разному реагирует с галогенами:
Cu + Cl2 → CuCl2
Cu + Br2 → CuBr2
2Cu + I2 → 2CuI (соль меди +1)
4) Медь в степени окисления +2 восстанавливается самой медью:
CuO + Cu → Cu2O (t)
CuCl2 + Cu → 2CuCl (t).
Правило 8. Железо
1) Соединения Fe+3 окисляют соединения S–2, S+4, I– и некоторые слабые металлы (восстанавливаясь до Fe+2):
Fe2O3 + 6HI → 2FeI2 + I2
2FeCl3 + 3Na2S → 2FeS

2FeCl3 + H2S → 2FeCl2 + S
2FeCl3 + Na2SO3 +H2O → 2FeCl2 + Na2SO4 + 2HCl
2FeCl3 + Cu → CuCl2 + 2FeCl2 (соль железа +2)
Fe2(SO4)3 + Cu → CuSO4 + 2FeSO4 (соль железа +2)
2Fe(NO3)3 + Fe → 3Fe(NO3)2 (соль железа +2)
2) В кислой среде соединения Fe+2 окисляются такими окислителями, как KMnO4, K2Cr2O7, Na2O2, HNO3, H2SO4(к) и др. до солей Fe+3:
6FeCl2 + Na2Cr2O7 + 14HCl → 6FeCl3 + 2CrCl3 + 2NaCl + 7H2O
2FeSO4 + Na2O2 + 2H2SO4 → Fe2(SO4)3 + Na2SO4 + 2H2O
3) В щелочной среде образуется гидроксид железа (III):
FeCl2 + KMnO4 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2FeSO4 + 2KMnO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
4) Железо по-разному реагирует с галогенами:
2Fe + 3F2 → 2FeF3
2Fe + 3Cl2 → 2FeCl3
2Fe + 3Br2 → 2FeBr3
Fe + I2 → FeI2 (соль железа +2)
5) Соединения Fe+2, Fe+3 также могут быть окислены до степени окисления +6 (до ферратов, например, Na2FeO4) очень сильными окислителями, но на ЕГЭ знание этих реакций не проверяется (источник: вебинары от разработчиков экзамена):
3FeSO4 + 2NaClO3 + 12NaOH → 3Na2FeO4 + 2NaCl + 3Na2SO4 + 6H2O.
Правило 9. Марганец
1) В кислой среде образуются соли Mn+2:
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
2) В щелочной среде образуется манганат-ион MnO42– (зеленого цвета):
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3
3) В нейтральной среде образуется осадок бурого цвета MnO2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2
2KMnO4 + 3K2S + 4H2O → 2MnO2

K2MnO4 + Na2S + 2H2O → S

Правило 10. Хром
1) Восстановление дихроматов в кислой среде протекает с образованием солей Cr+3:
Na2Cr2O7 + 6NaI + 7H2SO4 → Cr2(SO4)3 + 3I2
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
2) Окисление соединений Cr+2 в кислой среде протекает с образованием солей Cr+3:
6CrCl2 + K2Cr2O7 + 14HCl → 8CrCl3 + 2KCl + 7H2O
2CrCl2 + 4H2SO4(конц.) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
3) Окисление соединений Cr+3 очень сильными окислителями с щелочами или с карбонатами щелочных металлов протекает с образованием хроматов (типичные окислители: KNO3, Cl2, KClO3, H2O2 и др. в щел. среде):
Cr2O3 + 3KNO3 + 2K2CO3 → 2K2CrO4 + 3KNO2 + 2CO2
Cr2(SO4)3 + 3Cl2 + 16KOH → 2K2CrO4 + 6KCl + 3K2SO4 + 8H2O
2Cr(OH)3 + KClO3 + 4NaOH → 2Na2CrO4 + KCl + 5H2O
2Cr(OH)3 + 3H2O2 + 4KOH → 2K2CrO4 + 8H2O
4) Соединения Cr+6 в различных средах:
В щелочной среде устойчивы соли хромовой кислоты (хроматы, желтого цвета), например, Na2CrO4.
В кислой среде устойчивы соли дихромовой кислоты (дихроматы, оранжевого цвета), например, Na2Cr2O7.
CrO3 + 2KOH → K2CrO4 + H2O
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O (в кислотной среде желтая окраска переходит в оранжевую).
Na2Cr2O7 + 2NaOH → 2Na2CrO4 + H2O (в щелочной среде оранжевая окраска переходит в желтую).
Правило 11. Среда раствора
1) С карбонатами щелочных металлов реакции протекают аналогично щелочной среде реакции:
Cr2O3 + 3KNO3 + 2K2CO3 → 2K2CrO4 + 3KNO2 + 2CO2
MnO2 + KNO3 + K2CO3 → K2MnO4 + KNO2 + CO2
2) Если в реакцию вступает оксид серы (IV) SO2 в нейтральном растворе, то реакция протекает аналогично кислой среде раствора:
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4.
Поэтому очень важно не зубрить окислительно-восстановительные реакции, а знать какие соединения проявляют окислительные, а какие восстановительные свойства, и знать основные правила, приведенные выше.
Окислительно – восстановительные реакции в неорганической химии.
|
Восстановители |
Продукты окисления |
Условия |
|
1. Металлы , м |
М+, М2+, М3+ |
кислая и нейтральная среда |
|
2. Металлы, образующие амфотерные гидроксиды: Ве, Zn, Al |
[Zn(OH)4]2-, [Al(OH)4]—, ZnO22-, AlO2— |
(сплавление) |
|
3. Углерод, С |
СО СО2 |
в кислой среде |
|
4. Оксид углерода (II), СО |
СО2 |
|
|
5. Сера, S |
SO2, SO42-, SO32- |
|
|
6. Сероводород, H2S, cульфиды, S2- |
S SO2 H2SO4, SO42- |
|
|
7. Оксид серы (IV), SO2, cернистая кислота H2SO3, сульфиты SO32-(Na2SO3) |
SO3 H2SO4, SO42-(Na2SO4) |
|
|
8. Фосфор, Р, фосфорин РН3, фосфиты РО33- |
Р2О5 Н3РО4, РО43- |
|
|
9. Аммиак, NH3 |
N2 NO |
|
|
10.Азотистая кислота, HNO2, нитриты NO2—(KNO2) |
HNO3 NO3—(KNO3) |
|
|
11. Галогеноводороды, кислоты HCl, HBr, HI и их соли |
Cl2, Br2, I2 |
|
|
12. Катионы Cr3+ |
CrO42 — Cr2O72 — |
|
|
13. Катионы Fe2+, Cu+ |
Fe3+, Cu2+ |
|
|
14. Катионы Mn2+ |
MnO2 MnO42- MnO4— |
|
|
15. Пероксид водорода, Н2О2 |
О2 + Н+ О2 + Н2О |
|
|
Окислители |
Продукты восстановления |
Условия |
|
1. Галогены, F2, Cl2, Br2, I2 |
F —, Cl —, Br —, I — |
|
|
2. Оксокислоты, хлора, брома и их соли: HClO, HBrO, HClO3,HBrO3 |
Cl —, Br — |
|
|
3. Кислород, О2 |
O2- |
|
|
4. Озон, О3 |
Н2О + О2 ОН — + О2 |
|
|
5. Сера, S |
S2- |
|
|
6. Оксид серы (VI), SO3 |
SO2 |
|
|
7. Оксид серы (IV), SO2 |
S |
|
|
8. Азотистая кислота, HNO2, нитриты, NO2— |
NO N2 |
|
|
9. Оксид азота (IV), NO2 более сильный окислитель, чем HNO3, |
NO N2 NH3 |
|
|
10. Нитраты, NO3— |
NO2— NH3 |
|
|
11. Хроматы, CrO42-, дихроматы, Cr2O72- |
[Cr(OH)6]3- Cr(OH)3 Cr3+ |
|
|
12. Катионы, Fe3+, Cu2+ |
Fe2+, Cu+ |
|
|
13. Перманганаты, MnO4 — |
Mn2+ + H2O MnO2 + щелочь MnO42- + H2O |
|
|
14. Пероксид водорода, Н2О2 |
Н2О ОН — |
|
|
15. H2SO4 (конц.), HNO3 |
рассмотрены отдельно |
При составлении уравнений ОВР важно уверенно находить среди реагирующих веществ окислитель и восстановитель. Некоторые вещества могут быть только восстановителями. Это металлы и вещества, которые содержат элемент, изменяющий степень окисления, в низшей степени окисления (например: NH3, PH3, H2S, HCl, HBr, HI и их соли). Фтор и сложные вещества, содержащие элемент в высшей степени окисления, могут быть только окислителями (например: HNO3, H2SO4, SO3, KMnO4, K2CrO4, K2Cr2O7).
Вещества, которые содержат элементы в промежуточной степени окисления, могут проявлять, в зависимости от природы реагента – партнёра, как окислительные, так и восстановительные свойства. Это – все неметаллы (кроме фтора): N2, NO, HNO2, KNO2, H2O2, S, SO2 и другие.
Пользуясь данными таблицы 1, составим некоторые уравнения ОВР:
2KI + 2SO3 = I2 + SO2 + K2SO4
восст. — ль окисл. – ль продукт продукт побочный
окисл. – я восст. – я продукт
SO2 + NO2 = SO3 + NO
восст. – ль окисл. – ль продукт продукт
окисл. – я восст. – я
В этой реакции оксид серы (IV) проявляет восстановительные свойства, т.к. реагирует с сильным окислителем – NO2.
2H2S + SO2 = 3S + 2H2O
восст. – ль окисл. – ль продукт побочный
окисл. – я продукт
и восст. – я
В данной реакции SO2 проявляет окислительные свойства, т.к. реагирует с более сильным восстановителем – H2S.
На ход окислительно – восстановительных реакций в растворах влияет среда, в которой протекает реакция и, поэтому, окислительно – восстановительный процесс между одними и теми же веществами в разных средах приводит к образованию различных продуктов. Для создания кислой среды обычно используют разбавленную серную кислоту.
Азотную и соляную применяют редко, т.к. первая является сильным окислителем, а вторая способна окисляться. Для создания щелочной среды применяют растворы гидроксидов калия или натрия.
Примеры влияния среды на характер продуктов ОВР:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
восст.-ль окисл.-ль среда продукт продукт побочные
окисл.-я восст.-я продукты
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2↓ + 2KOH
восст.-ль окисл.-ль среда продукт продукт побочный
окисл.-я восст.-я продукт
Na2SO3 + 2KMnO4 + 4KOH = Na2SO4 + 2K2MnO4 + 2H2O
восст.-ль окисл.-ль среда продукт продукт побочный
окисл.-я восст.-я продукт
16HBr + 2NaMnO4 = 5Br2 + 2MnBr2 + 2NaBr + 8H2O
восст.-ль окисл.-ль продукт продукт побочные
≈ среда окисл.-я восст.-я продукты
4KMnO4 + 4KOH = 4K2MnO4 + O2 + 2H2O
Остановимся на некоторых, наиболее часто встречающихся в заданиях ЕГЭ. окислительно – восстановительных реакциях.
✱ Кислоты – сильные окислители.
Это серная кислота концентрированная и азотная кислота в любом виде. Они окисляют почти все металлы и такие неметаллы, как углерод, фосфор, серу, и многие сложные вещества.
Возможные продукты восстановления этих кислот:
H2SO4 → SO2 → S → H2S
HNO3 → NO2 → NO → N2O → N2 → NH3(NH4NO3)
При взаимодействии с металлами получаются три вещества: соль, вода и продукт восстановления кислоты, который зависит от концентрации кислоты, активности металла и температуры.
Чем меньше концентрация кислоты. А металл более активен, тем больше степень восстановления кислоты.
Представим возможные направления взаимодействия этих кислот с различными веществами в виде схем:
H2SO4 концентр.
не реагирует не реагирует восстанавливается восстанавливается
с Au, Pt и на холоде до SO2 с неактивными до SO2, S или H2S
некоторыми с Fe,Al, Cr металлами и с металлами средней
другими неметаллами активности и активными,
металлами со сложными
веществами
Cu + H2SO4 концентр. = CuSO4 + SO2 + 2H2O
Zn + 2H2SO4 концентр.= ZnSO4 +SO2 + 2H2O
3Zn + 4H2SO4 концентр. = 3ZnSO4 + S↓ + 4H2O
4Zn + 5H2SO4 концентр. = 4ZnSO4 + H2S + 4H2O
HNO3 концентр.
не реагирует не реагирует восстанавливается восстанавливается
с Au, Pt и на холоде до NO2 с неактив — до NO, N2O, N2 или
некоторыми с Fe, Al, Cr ными металлами, NH4NO3 (если кислота
другими неметаллами, очень разбавлена или
металлами сложными сказано, что газ
веществами не выделялся) с металлами
средней активности и
активными
Cu + 4HNO3 концентр. = Cu (NO3)2 + 2NO2 + 2H2O
HNO3 разбавл.
не реагирует не реагирует восстанавливается восстанавливается
с Au, Pt и на холоде до NO с неактивными до NO, N2O, N2 или
некоторыми с Fe, Al, Cr металлами, неметаллами, NH4NO3 (если кислота
другими сложными веществами очень разбавлена или
металлами сказано, что газ не вы –
делялся) с металлами
средней активности и
активными
3Cu + 8HNO3 разбавл.. = 3Cu (NO3)2 + 2NO + 4H2O
Al + 4HNO3 разбавл. = Al (NO3)3 + NO + 2H2O
8Al + 30HNO3 разбавл. = 8Al (NO3)3 + 3N2O + 15H2O
10Al + 36HNO3 разбавл. = 10Al (NO3)3 + 3N2 + 18H2O
8Al + 30HNO3 разбавл. = 8Al (NO3)3 + 3NH4NO3 + 5H2O
Концентрированные H2SO4 и HNO3 реагируют с Fe, Al, Cr только при нагревании:
2Fe + 6H2SO4 концентр. = Fe2 (SO4)3 + 3SO2 + 3H2O
Fe + 6HNO3 концентр. = Fe (NO3)3 + 3NO2 + 3H2O
Концентрированная H2SO4 и HNO3 в любом виде окисляют неметаллы — восстановители — углерод, фосфор, серу — до соответствующих кислот.
C + 4HNO3 концентр. = CO2 + 2H2O + 4NO2
3C + 4HNO3 разбавл. = 3CO2 + 2H2O + 4NO
C + 2H2SO4 концентр. = CO2 + 2H2O + 2SO2
P + 5HNO3 концентр. = H3PO4 + 5NO2 + H2O
3P + 5HNO3 разбавл. + 2H2O = 3H3PO4 + 5NO
2P + 5H2SO4 концентр. = 2H3PO4 + 5SO2 + 2H2O
S +6HNO3 концентр. = H2SO4 + 6NO3 + 2H2O
S + 2HNO3 разбавл. = H2SO4 + 2NO
S +2H2SO4 концентр. = 3SO2 +2H2O
Концентрированная азотная кислота окисляет йод до йодноватой кислоты:
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
Взаимодействие этих кислот со сложными веществами рассмотрим в следующем разделе.
Особое значение имеет ОВР между соляной и азотной кислотами. Смесь трёх объёмов соляной кислоты и одного объёма концентрированной азотной называют «царская водка», в ней растворяется даже золото, которое алхимики считали царём металлов:
3HCl +HNO3 = Cl2 + NOCl + 2H2O
✱ Окислительно – восстановительные реакции, а не реакции обмена.
В ряде случаев между веществами, которые проявляют сильные восстановительные и окислительные свойства, возможны только ОВР, а не реакции обмена.
Рассмотрим следующие варианты:
1. Окислители – соединения железа (III), восстановители – сульфиды, йодиды. При этом катион Fe3+ восстанавливается до катиона Fe2+, сульфид – анион S2-окисляется до серы S0, а йодид – анион I— окисляется до йода I2.
В зависимости от количественного соотношения реагирующих веществ могут получиться различные соединения железа (II):
2FeCl3 + H2S = S↓ + 2FeCl2 + 2HCl
2FeCl3 + Na2S = S↓ + 2FeCl2 + 2NaCl
или 2FeCl3 + 3Na2S = S↓ + FeS + 6NaCl
Fe2(SO4)3 + H2S = S↓ + 2FeSO4 +H2SO4
Fe(OH)3 + 6HI = 2FeI2 + I2↓ + 6H2O
Fe2O3 + 6HI = 2FeI2 + I2↓ + 3H2O
2FeCl3 +2HI = 2FeCl2 + I2↓ + 2HCl
2FeCl3 + 2KI = 2FeCl2 + I2↓ + 2KCl
или 2FeCl3 + 6KI = 2FeI2 + I2↓ + 6KCl
Fe2(SO4)3 + 2KI = 2FeSO4 + I2↓ + K2SO4
Fe2(SO4)3 + BaI2 = 2FeSO4 + I2↓ + BaSO4↓
2. Окислители – соединения меди (II), восстановители — йодиды. При этом катион Cu2+ восстанавливается до катиона Cu+, а йодид – анион окисляется до йода I2 :
2CuSO4 + 4KI = 2CuI↓ + I2↓ + 2K2SO4
2CuCl2 + 4KI = 2CuI↓ + I2↓ + 4KCl
2CuCl2 + 4HI = 2CuI↓ + I2↓ + 4HCl
3. Окислитель – азотная кислота, восстановитель – сульфиды, йодиды, сульфиты. При этом азотная кислота, в зависимости от концентрации, восстанавливается до NO2 (концентрированная), до NO (разбавленная); сульфид – анион S2- окисляется до серы S0 или сульфат – аниона SO42-, йодид – анион – до йода I2, a сульфит – анион SO32- — до сульфат – аниона SO42- :
8HNO3 концентр. + CuS = CuSO4 + 8NO2 + 4H2O
или 4HNO3 концентр.+ CuS = S↓ + 2NO2 + Cu(NO3)2 + 2H2O
8HNO3 разбавл.+ 3CuS = 3S↓ + 2NO + 3Cu(NO3)2 + 4H2O
4HNO3 концентр.+ Na2S = S↓ + 2NO2 + 2NaNO3 + 2H2O
24HNO3 концентр.+ Al2S3 = Al2(SO4)3 + 24NO2 + 12H2O
2HNO3 разбавл.+ H2S = 3S↓ + 2NO + 4H2O
8HNO3 концентр.+ H2S = H2SO4 + 8NO2 + 4H2O
или 2HNO3 концентр.+ H2S = S↓ + 2NO2 + 2H2O
2HNO3 разбавл.+ 3K2SO3 = 3K2SO4 + 2NO + H2O
6HNO3 концентр.+ HI = HIO3 + 6NO2 + 3H2O
2HNO3 концентр.+ 2KI = I2 + 2NO2 + H2O
4. Окислитель – азотная кислота или серная концентрированная кислота, восстановитель – соединения железа (II). При этом азотная кислота восстанавливается до NO2 или NO, серная – до SO2, а катион Fe2+ окисляется до катиона Fe3+ :
Fe(OH)2 + 4HNO3 концентр. = Fe(NO3)3 + NO2 + 3H2O
FeO + 4HNO3 концентр. = Fe(NO3)3 + NO2 + 2H2O
3Fe(NO3)2 + 4НNO3 разбавл. = 3Fe(NO3)2 + NO + 2H2O
2Fe(OH)2 + 4H2SO4 концентр. = Fe2(SO4)3 + SO2 + 6H2O
5. Окислитель – серная кислота концентрированная, восстановитель – сульфиды, йодиды и бромиды. При этом серная кислота восстанавливается до SO2, S или
H2S; сульфид – анион S2- окисляется до серы S, SO2 или H2SO4; йодид – анион до йода I2, бромид – анион до брома Br2 :
CuS + 4H2SO4 концентр. = CuSO4 + 4SO2 + 4H2O
H2S + H2SO4 концентр. = S↓ + SO2 + 2H2O
или H2S + H2SO4 концентр. = 4SO2 + 4H2O
8HI + H2SO4 концентр. = 4I2↓ + H2S + 4H2O
или 6HI + H2SO4 концентр.= 3I2↓ + S↓ + 4H2O
2HI + H2SO4 концентр. = I2↓ + SO2 + 2H2O
8KI + 9H2SO4 концентр. = I2↓ + H2S + 8KHSO4 + 4H2O —
наиболее вероятный вариант подуктов,
или 6KI + 2H2SO4 концентр. = 3I2↓ + H2S + 3K2SO4 + 4H2O
2HBr + H2SO4 концентр. = Br2 + SO2 + 2H2O
2KBr + 2H2SO4 концентр. = Br2 + SO2 + K2SO4 + 2H2O
6KBr + 2H2SO4 концентр. = 3Br2 + S↓ + 3K2SO4 + 2H2O
6. Железная окалина – Fe3O4, это смесь двух оксидов — FeO и Fe2O3. Поэтому при взаимодействии с сильными окислителями она окисляется до соединения железа (III) за счёт катионов Fe2+ — восстановителей, а при взаимодействии с сильными восстановителями восстанавливается до соединения железа (II) за счёт катионов Fe3+ — окислителей:
Fe3O4 + 10HNO3 концентр. = 3Fe(NO3)3 + NO2 + 5H2O
3Fе3O4 + 28HNO3 разбавл. = 9Fe(NO3)3 + NO + 14H2O
Fe3O4 + 8HI = 3FeI2 + I2↓ + 4H2O
При взаимодействии с большинством кислот происходит реакция обмена, получаются две соли:
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
Fe3O4 + 4H2SO4 разбавл. = FeSO4 + Fe2(SO4)3 + 4H2O
✱ Реакции диспропорционирования.
Это реакции, в которых атомы одного и того же элемента, входящие в состав одного и того же исходного вещества, повышают и понижают степень окисления. Они очень часто встречаются в заданиях С-2, поэтому их нужно запомнить тем, кто хочет сдать ЕГЭ на высокий балл.
- Все галогены, кроме F2, диспропорционируют в растворах всех щелочей. При комнатной температуре или на холоде получаются две соли – МГ, МГО и Н2О; при нагревании – две соли: МГ, МГО3 и Н2О.
Cl2 +2KOH = KCl + KClO + H2O – на холоде,
3Cl2 + 6KOH = 5KCl +KClO3 + 3H2O – при нагревании,
2Br2 + 2Sr(OH)2 = SrBr2 + Sr(BrO)2 + H2O – на холоде,
6Br2 + 6Sr(OH)2 = 5SrBr2 + Sr(BrO3)2 + 6H2O – при нагревании
Аналогично происходят реакции с растворами карбонатов:
Cl2 + K2CO3 = KCl + KClO + CO2 – на холоде,
3Cl2 + 3K2CO3 = 5KCl + KClO3 + 3CO2 – при нагревании.
2. Диспропорционирование серы в растворах щелочей:
3S + 6KOH = 2K2S + K2SO3 + 3H2O или 4S + 6KOH = K2S2O3 + 2K2S +3H2O
3. Диспропорционирование фосфора в растворах щелочей.
4P + 3KOH + 3H2O = PH3 + 3KH2PO2
8P + 3Ba(OH)2 + 6H2O = 2PH3 + 3Ba(H2PO2)2
P4 (белый фосфор) + 3KOH + 3H2O = PH3 + 3KH2PO2
4. Диспропорционирование оксида азота (IV) в воде и щелочах:
2NO2 + H2O = HNO2 + HNO3
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
5. Другие реакции диспропорционирования:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH
4NaClO3 = 3NaClO4 + NaCl
4K2SO3 = 3K2SO4 + K2S
ClO2 + H2O = HCl + HClO3
В завершении этой статьи хочу отметить, что не так уж страшны окислительно – восстановительные уравнения, как это кажется на первый взгляд. Знание основных закономерностей поможет их составлении.
Открытый урок элективного курса
«Решение задач повышенной сложности по химии. Подготовка к ЕГЭ. 11 класс»
Тема урока: «Окислительно-восстановительные реакции. Электронно-ионный метод составления уравнений ОВР. Системный подход к решению задания ЕГЭ №30»
Тип урока: Изучение новой темы на основе комплексного применения ранее полученных знаний.
Основные цели и задачи:
А) Образовательные:
* сформировать у обучающихся понятия о важнейших окислителях и восстановителях;
* научить общим принципам составления уравнений ОВР, протекающих в растворах (электронно-ионный метод);
* научить прогнозировать окислительные или восстановительные свойства веществ, а также продукты их восстановления или окисления в зависимости от условий;
* научить системному подходу к решению задания №30 в формате ЕГЭ.
Б) Развивающие:
* развивать мышление учащихся, научить их делать логические выводы из наблюдений;
* развивать умение выделять общие и существенные признаки; отличать несущественные признаки; умение применять знания на практике;
* закрепить умения и навыки химического эксперимента, умение работать со справочным материалом (таблицы, опорные схемы, справочники и т.д.);
* развивать познавательные умения: выделять главное, вести конспект, делать выводы.
В) Воспитательные:
* формировать интерес учащихся к изучению химии, умение использовать приобретённые знания в практических целях (например, применение ОВР для получения металлов и других веществ; роль окислительно-восстановительных процессов в коррозии металлов и защита от неё и т.д.);
* воспитание мотивации к обучению, ответственного и серьёзного отношения к занятиям;
* воспитание дисциплинированности, умения работать в коллективе, уважения к учителю и одноклассникам.
Интегративная учебная проблема: «Почему одни вещества в реакции проявляют свойства восстановителя, а другие – окислителя? Как безошибочно определить роль того или иного вещества в ОВР, а также продукты их превращений?»
Тип урока: урок усвоения нового материала.
Технологии: проблемное, исследовательское, групповое и дифференцированное обучение; ИКТ.
Форма организации учебной деятельности учащихся: частично-поисковая деятельность, создание проблемных ситуаций; индивидуальная работа и в группах.
Учебно-методическое и материально-техническое обеспечение:
— учебник О.С. Габриеляна «Химия. 11 класс»;
— Комплекс материалов для подготовки учащихся к ЕГЭ по химии (под ред. Кавериной А.А.)
— таблица растворимости веществ в воде;
— электрохимический ряд напряжения металлов; опорные схемы по теории ОВР;
— мультимедийные средства (ПК, проектор и экран для демонстрации слайдов);
— доска ученическая, мел.
Оборудование: карточки задания для самостоятельной работы.
Ход урока
Учитель:
Мы продолжаем изучать окислительно-восттановительные процессы. Давайте вспомним основные положения теории ОВР:
-
Какие реакции относятся к ОВР?
-
Дайте определение понятия «степень окисления».
-
Как определяется степень окисления атома элемента в молекуле вещества?
-
Что такое окисление? Восстановление? Могут ли эти процессы существовать независимо друг от друга?
-
Что такое окислитель и восстановитель?
-
Как изменяется степень окисления в процессах окисления и восстановления?
-
Можно ли подбирать коэффициенты при составлении уравнений ОВР «на глазок»? Какие вам известны приемы при подборе коэффициентов?
Какое важнейшее правило лежит в основе составления электронного баланса?
Ответы учеников:
-
ОВР – это реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ.
-
Степень окисления (С.О.) – это условный заряд атома элемента в молекуле, вычисленный из предположения, что молекула состоит только из ионов. Положительная С.О. определяется числом электронов, оттянутых от данного атома, а отрицательная – числом электронов, смещённых от других атомов.
-
Чтобы рассчитать С.О. элемента в соединении, необходимо знать постоянные степени окисления некоторых химических элементов, а также то, что алгебраическая сумма степеней окисления всех атомов в молекуле вещества равна нулю. С.О. простых веществ равна нулю!
-
Окислением называется отдача электронов атомом, молекулой или ионом. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Эти два взаимопротивоположных процесса неразрывно связаны между собой: не существует окисления без восстановления и наоборот.
-
Вещество, атомы, молекулы или ионы которого в процессе реакции отдают электроны, называется восстановителем. Вещество, атомы, молекулы или ионы которого в процессе реакции принимают электроны, называется окислителем.
-
В процессе окисления С.О. восстановителя повышается. При восстановлении С.О. окислителя понижается.
-
Изменение С.О. элементов в ОВР обусловлено распространением электронов между окислителем и восстановителем. При этом число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Метод электронного баланса основан на сравнении С.О. атомов в исходных и конечных веществах, для чего составляют электронные уравнения и на их основе вычисляют коэффициенты.
Учитель:
Для ОВР, протекающих в растворах, существенную роль играет среда раствора, так как часто продукты восстановления большинства окислителей зависят от реакции среды, в которой протекает данная ОВР. Метод электронного баланса для таких ОВР имеет ряд недостатков: не учитывает реально существующие ионы в растворе; не позволяет прогнозировать продукты ОВР.
Влияние среды раствора, в котором протекает восстановление перманганат-иона, можно отразить следующей схемой:
Mn2+←(H+)← MnO4—→(OH—)→MnO42-
↓
(H2O)
↓
MnO2
Рассмотрим реакцию восстановления перманганата калия нитритом натрия в сернокислой среде. Нитрит натрия в результате окисления превращается в нитрат натрия. Катионы Mn2+, образующиеся в результате восстановления перманганата калия, связываются сульфат-ионами в сульфат марганца (II).
KMnO4 + NaNO2 + H2SO4 → MnSO4 + NaNO3 + K2SO4 + H2O.
Электронный баланс: Mn+7 (+5е—) → Mn+2│5 │2
N+3 (- 2e—) → N+5 │2 │5
2KMnO4 + 5 NaNO2 +3 H2SO4 → 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O.
Как видно, при составлении электронных уравнений мы вычленяем отдельные атомы, которые на самом деле в растворе отсутствуют.
В электронно-ионном методе (метод полуреакций) коэффициенты находят с помощью электронно-ионных уравнений. Последние отличаются от электронных уравнений (метод электронного баланса) тем, что в них учитывают ионы, образующиеся в результате диссоциации реагирующих веществ и реально существующие в водном растворе (учитель предлагает написать данное уравнение в полной ионной форме, после чего выписать из него частицы, несущие в себе окислитель и восстановитель и продукты их превращений).
При составлении электронно-ионных уравнений следует учитывать изменение не только зарядов ионов, но, весьма часто, и их состава, например, при восстановлении перманганат-иона по схеме: MnO4— → Mn2+, и во многих других случаях. Такие взаимные переходы сопряжены в общем случае с участием в них молекул воды или содержащихся в расвторе ионов Н+ и ОН—. Если реакция идет в кислой среде, то при составлении полуреакций используют ионы Н— или молекулы Н2О; в щелочной среде – ионы ОН— или молекулы Н2О; в нейтральной среде – ионы Н+, ОН— и молекулы Н2О.
При составлении электронно-ионных уравнений необходимо обратить внимание на число атомов кислорода в исходных и образующихся частицах – молекулах, ионах. В связи с этим целесообразно опираться на следующие правила:
Правило 1
Если исходная частица (А) содержит кислорода больше, чем образующаяся (Б), то освобождающийся кислород связывается в кислых растворах ионами Н+ в воду (1), а нейтральных и щелочных растворах – в гидроксид-ионы (2):
-
О2- + 2Н+ → Н2О или А + Н+ → Б + Н2О
-
О2- + Н2О → 2ОН— или А + Н2О → Б + ОН—
Правило 2
Если исходная частица (А) содержит кислорода меньше, чем образующаяся (Б), то недостаток атомов кислорода восполняется в кислых и нейтральных растворах за счет молекул воды (1), а в щелочных – за счет гидроксид-ионов (2):
-
Н2О → О2- + 2Н+ или А + Н2О → Б + 2Н+
-
2ОН— → О2- + Н2О или Б + ОН— → Б + Н2О
В соответствии с вышеописанными правилами составим электронно-ионные уравнения (полуреакции).
Рассмотрим последовательность, которой рекомендуется придерживаться при составлении окислительно – восстановительных реакций.
Пример 1. При окислении K2SO3 перманганатом калия в кислой среде последний восстанавливается в ионы 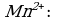
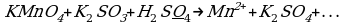
Решение. Составляем электронно-ионные уравнения по этапам.
1 этап.
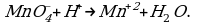
Так как в ионе 
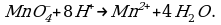
Чтобы стрелку заменить знаком равенства, надо, чтобы равенство было не только по числу атомов элементов, но и по зарядам.
Подсчитаем суммарные заряды в левой и правой частях полуреакции:
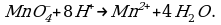
+7 +2
Для сохранения равенства зарядов левую часть схемы следует дополнить пятью электронами:

2 этап. Составляем полуреакцию процесса окисления:
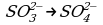
Так как в исходном ионе содержится меньше кислорода, чем в образующемся, то недостаток атомов кислорода восполним за счет молекулы воды:
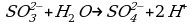
Число атомов каждого элемента одинаково в левой и правой частях схемы; для восполнения условия равенства зарядов из левой части вычитаем два электрона:

3 этап. Запишем две полуреакции вместе и по правилам нахождения наименьшего кратного определим множители, на которые надо умножить обе полуреакции:


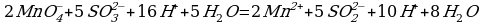
Производим сокращение:

Из этого уравнения видно, что окисление ионов 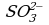
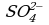
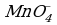
4 этап. Составляем молекулярное уравнение. Для этого к левой части ионного уравнения приписываем каждому иону противоион, такое же число ионов приписываем к правой части уравнения:
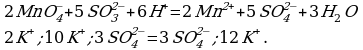
При написании продуктов реакции необходимо учитывать, что каждый ион из верхней строчки соединится с противоположным ионом из нижней (2 иона 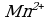
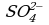
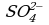
Записываем молекулярное уравнение:
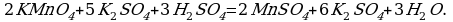
Как мы с вами убедились, данную реакцию можно уравнять как с помощью метода электронного баланса, так и с позиции метода полуреакций. Однако, существуют такие ОВР, уравнения которых невозможно составить, опираясь на метод электронного баланса:
FeSO4 + KMnO4 + H2O → ?
Метод полуреакций позволит нам правильно спрогнозировать продукты данной ОВР. Окислителем являются перманганат-ионы MnO4—, которые в нейтральной среде восстанавливается до MnO2↓, а восстановителем – ионы Fe2+, которые могут быть окислены в ионы Fe3+. Cоставим электронно-ионные уравнения и просуммируем их с учетом коэффициентов:
Fe2+ (-e—)→ Fe3+ │1│3
MnO4— + 2H2O (+3e—)→ MnO2↓ + 4OH— │3 │1
3Fe2+ + MnO4— + 2H2O → 3Fe3+ + MnO2↓ + 4OH— (суммарное уравнение в сокращенной ионной форме)
Как видно, в продуктах ОВР имеем одновременно ионы Fe3+ и OH—, которые будут взаимодействовать между собой с образованием гидроксокатиона FeOH+:
3Fe3+ + 4OH— → 3FeOH+ + OH—.
Cледовательно, правая часть суммарного уравнения преображается следующим образом:
… → 3FeOH+ + OH— + MnO2↓
Преобразуем сокращенную ионную форму ОВР в молекулярную и получим:
3FeSO4 + KMnO4 + 2H2O = 3FeOHSO4 + MnO2 + KOH
Задания для самостоятельного выполнения (раздается группам учеников на карточках):
Карточка 1.
Cоставьте уравнение реакции восстановления дихромата калия концентрированной соляной кислотой.
Решение:
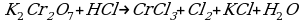
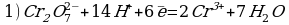
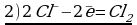
Сr2O72- + 14H+ + 6Cl— = 2Cr3+ + 3Cl2 + 7H2O
K2Сr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7H2O
Комментарий:
Восстановитель (HCl) в ходе реакции дополнительно выполняет функцию солеобразователя. Одна молекула K2Cr2O7 окисляет шесть модекул HCl, образуя три молекулы хлора (3Cl2), а восемь молекул HCl расходуются на образование солей (2KCl+2CrCl3).
Карточка 2.
Cоставьте уравнение реакции окисления хлорида хрома (III) бромной водой в щелочной среде.
Решение:
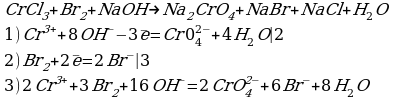
Комментарий:
Из этого ионного уравнения видна роль щелочи: окисление ионов Cr3+ в 

4)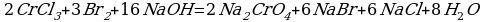
Учитель:
По опыту сдачи ЕГЭ в 2018 году мы знаем насколько усложнилось задание №30 второй части. Если раньше требовалось доставить пропущенные вещества в левой и правой частях уравнения и подобрать коэффициенты методом электронного баланса, то теперь перед выпускником стоит сложнейшая задача — самому выбрать окислитель, восстановитель и реакцию среды, в которой протекает ОВР, а также спрогнозировать продукты ОВР. Это на порядок усложняет данное задание.
Предлагаю разработать системный подход к решению данного задания. Для этого мы должны четко представлять себе, какие свойства (окислительные или восстановительные ?) способно проявлять то или иное вещество. В качестве вспомогательного материала будем использовать составленную ранее таблицу, в которой отражены не только важнейшие окислители и восстановители, но также наиболее типичные превращения веществ.
Важнейшие восстановители и окислители
|
Воссстановители |
Окислители |
|
Все металлы (Ме0): Ме0 – ne— → Me+n Уголь (углерод, кокс): С0 – 2е— → С+2 С0 – 4е— → С+4 Оксид углерода (II): С+2О – 2е— → С+4О2 Сульфид-ион (сероводород, сульфиды): S-2 – 2e— → S0 (часто) S-2 – 6e— → S+4 (реже) S-2 – 8e— → S+6 (реже) Сернистая кислота и ее соли (сульфиты): (SO3)-2 – 2e— → (SO4)-2 Галогенид-ионы Наl— (Cl—, Br—, I—): 2Hal— — 2e— → Hal02 Хлорид олова (II): SnCl2 -2e— → SnCl4 Сульфат железа (II); 2FeSO4 -2e— → Fe2(SO4)3 Cульфат марганца (II); (MnO4)-2 ß (+OH)Mn+2(+H+) à (MnO4)— ↓ (+H2O) MnO2 Сульфат хрома (II) CrSO4: 2CrSO4 – 2e— → Cr2(SO4)3 Сульфат хрома (III) Cr2(SO4)3: (CrO4)-2 ß (+OH—) Cr+3 (+H+) à (Cr2O7)-2 Азотистая кислота и ее соли (нитриты): (NO2)— — 2e— → (NO3)— Аммиак NH3: NO ß NH3 à N2 ↓ NO2 Фосфористая кислота Н3РО3 и ее соли (фосфиты): (РО3)-3 – 2е— → (РО4)-3 Перекись водорода Н2О2 и пероксиды щелочных и щелочноземельных металлов (Na2O2): (O2)-2 — 2e— → O20↑ Катод при электролизе |
Галогены Hal20 (F2, Cl2, Br2): Hal20 + 2e— → 2Hal— Перманганат-ион (MnO4)—: (MnO4)-2 ß (+OH—)(MnO4)—(+H+) à Mn+2 (+Н2О)↓ MnO2 Ди(би)хромат-ион (Сr2O7)-2: (CrO4)-2ß (+OH—)(Сr2 O7)-2(+H+) à Cr+3 (+H2O)↓ Cr(OH)3 Азотная кислота HNO3: HNO3 (конц.) + малоакт.Ме → NO2 HNO3 (разб.) + малоакт.Ме → NO HNO3 (разб.) + активный Ме → N2, N2O HNO3 (оч.разб.) + активный Ме → NH4NO3 Кислород О2: О2 +4е— → 2О-2 Перекись водорода Н2О2 и пероксиды щелочных и щелочноземельных металлов (Na2O2): (O2)-2 + 2e— → 2O-2 В кислой среде: Н2О2 + 2Н+ + 2е— → 2Н2О В щелочной среде: Н2О2 + 2е— → 2ОН— Концентрированная серная кислота: H2SO4 (конц.) + малоакт.Ме → SO2 H2SO4 (конц.) + среднеакт.Ме → S0 H2SO4 (конц.) + активныйМе → H2S Оксид меди (II): СuO + e → Cu+ СuO + 2e → Cu0 Оксид серебра: Ag2O +2e— → 2Ag0 Хлорид железа (III): FeCl3 + e— → FeCl2 Оксид свинца (IV): PbO2 + 2e— → Pb+2 ( в кислой среде, напр., PbCl2) Анионы (ClO)—, (ClO2)—, (ClO3)—, (ClO4)— при восстановлении переходят в Cl— или Cl20 Анод при электролизе |
Таким образом, решение задания №30 можно представить в виде следующего пошагового алгоритма:
1 ШАГ
На основании данной таблицы и понимания зависимости окислительно-восстановительных свойств сложных веществ от степени окисления элементов, входящих в состав молекул, делаем вывод об ОВ-свойствах данных в задании веществ. При этом присваиваем выбранным веществам «ярлычок»: «окислитель», «восстановитель», «ОВ-двойственность».
2 ШАГ
Помним, что в перечень веществ могут входить «лишние» вещества, которые не участвуют в предполагаемых ОВР (но участвуют в РИО, см. Задание №31), а также вещества, которые могут быть использованы в качестве среды раствора. Им мы тоже присваиваем «ярлычки»: «среда», «РИО», «лишнее».
3 ШАГ
После того как «развесили ярлычки» начинаем составлять левую часть уравнения ОВР: выбираем из перечня веществ восстановитель, окислитель и среду раствора.
4 ШАГ
Зватем, прогнозируя продукты ОВР, составляем правую часть уравнения. Для сложных реакций на стадии прогнозирования можно воспользоваться методом полуреакций.
5 ШАГ
Составляем электронные уравнения окисления и восстановления (электронный баланс) и определяем коэффициенты.
Пример решения задания №30 ЕГЭ
Задание:
Перечень веществ: водород, гидроксид магния, серная кислота (конц.), магний, перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Решение:
ШАГ 1.
Запишем химические формулы веществ из предложенного перечня:
H2, Mg(OH)2, H2SO4 (конц.), Mg, KMnO4.
Определим окислительно-восстановительные свойства веществ – присвоим веществам «ярлычки»:
H2 – восстановитель, но по отношению к магнию – окислитель (t0);
Mg(OH)2 – не будет проявлять ОВ-свойств, т.к. в состав вещества входят химические элементы с постоянной С.О. («РИО»);
H2SO4 (конц.) – окислитель (за счет S+6);
Mg – восстановитель;
KMnO4 – окислитель в растворе (за счет Mn+7).
ШАГ 2.
Выберем вещества, между которыми возможна ОВР: Mg и H2SO4 (конц.)
ШАГ 3.
Составим левую часть уравнения:
Mg + H2SO4(конц.)→ …
ШАГ 4.
Прогнозируем продукты:
Mg окисляется в ион Mg2+, который в условиях данной реакции входит в состав соли – сульфата магния MgSO4;
H2SO4 (конц.) восстанавливается металлом, расположенным в ряду напряжений до алюминия, до сероводорода H2S.
Концентрированная серная кислота в данной ОВР играет двоякую роль – окислителя и среды (солеобразователя), при этом в продуктах образуется также вода.
Таким образом, схема данной ОВР имеет вид:
Mg + H2SO4 (конц.) → MgSO4 + H2S + Н2О
ШАГ 5.
Составляем уравнения электронного баланса и определяем коэффициенты:
Mg0 – 2e— → Mg+2 │2 │8│4
S+6 + 8e— → S-2 │8 │2 │1
Окончательное уравнение ОВР:
4Mg + 5H2SO4 (конц.) → 4MgSO4 + H2S + 4Н2О
Задания для самостоятельного выполнения с последующим обменом между группами:
Вариант 1.
Перечень веществ: йодоводород, фтор,хлорат калия, йод, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Вариант 2.
Перечень веществ: оксид хрома (III), сероводород, гидроксид калия, серная кислота, хлор. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Задания Д30 C1 № 1
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
2
Задания Д30 C1 № 49
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
3
Задания Д30 C1 № 226
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
4
Задания Д30 C1 № 269
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
5
Задания Д30 C1 № 312
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
Пройти тестирование по этим заданиям
Окислительно-восстановительные реакции. Окислитель и восстановитель
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I20. Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S0. Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Основные коэффициенты в уравнении реакции равны единице:
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:
Проставляем найденные основные коэффициенты в уравнение реакции:
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl20, хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn2+, в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO42–. Данные переходы описываются следующими уравнениями
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr3+:
В щелочной — производные анионного комплекса [Cr(OH)6]3–:
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:
Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
2. KNO3 + Al → KAlO2 + Al2O3 + N2.
3. Na2O2 + H2SO4 + KMnO4 → O2↑ + MnSO4 + Na2SO4 + K2SO4 + H2O.
4. NaCl + H2SO4 + MnO2 → Cl2 + MnSO4 + Na2SO4 + H2O.
5. NaCl + H2SO4 + KMnO4 → Cl2 + MnSO4 + Na2SO4 + K2SO4 + H2O.
6. KNO2 + H2SO4 + MnO2 → MnSO4 + KNO + H2O.
7. KI + H2SO4 + KMnO4 → I2 + MnSO4 + K2SO4 + H2O.
8. KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O.
9. C + K2Cr2O7 + H2SO4 → CO2 + Cr2(SO4)3 + K2SO4 + H2O.
10. PbO2 + HNO3 + KI → Pb(NO3)2 + I2 + KNO3 + H2O.
11. PbO2 + HNO3 + Mn(NO3)2 → Pb(NO3)2 + HMnO4 + H2O.
12. NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + H2O.
13. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O.
14. KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O.
15. KNO2 + KI + H2SO4 → NO + I2 + K2SO4 + H2O.
16. KNO2 + FeSO4 + H2SO4 → NO + Fe2(SO4)3 + K2SO4 + H2O.
17. Ca3(PO4)2 + C + SiO2 → CaSiO3 + P + CO.
18. Sb + HNO3 → Sb2O5 + NO2 + H2O.
19. H2O2 + H2SO4 + KMnO4 → MnSO4 + O2 + H2O + K2SO4.
20. S + HNO3 → H2SO4 + NO2 + H2O.
21. H2S + HNO3 → H2SO4 + NO2 + H2O.
22. H2S + KMnO4 → MnO2 + S + H2O + KOH.
23. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
24. KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
25. KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH.
26. KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O.
27. K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
28. H2SO4 + C → SO2 + CO2 + H2O.
29. H2SO4 + Zn → ZnSO4 + H2S + H2O.
30. H2SO4 + KBr → SO2 + Br2 + KHSO4 + H2O.
31. H2SO4 + KI → H2S + I2 + K2SO4 + H2O.
32. PbO2 + HCl → PbCl2 + Cl2 + H2O.
33. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O.
34. KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O.
35. KClO3 + HCl → KCl + Cl2 + H2O.
36. HClO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + HCl + H2O.
37. NaBrO3 + NaBr + H2SO4 → Br2 + Na2SO4 + H2O.
38. HNO3 + I2 → HIO3 + NO2 + H2O.
39. HNO3 + I2 → HIO3 + NO + H2O.
40. H2SO4 + HI → I2 + H2S + S + H2O.
41. Fe2(SO4)3 + HI → FeSO4 + I2 + H2SO4.
42. HIO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + I2 + H2O.
43. NaIO3 + NaI + H2SO4 → I2 + Na2SO4 + H2O.
44. KMnO4 + Cu2O + H2SO4 → MnSO4 + CuSO4 + K2SO4 + H2O.
45. HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + NO2 + H2O.
46. H2SO4 + Cu2S → CuSO4 + SO2 + H2O.
47. Ag + HNO3 → AgNO3 + NO + H2O.
48. Zn + HNO3 → Zn(NO3)2 + N2O + H2O.
49. PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O.
50. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
51. H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
52. Ca3P2 + KMnO4 + H2SO4 → CaSO4 + H3PO4 + MnSO4 + K2SO4 + H2O.