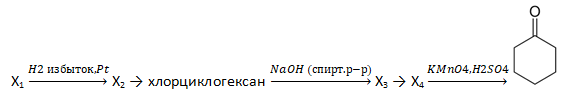Александр Есманский,
преподаватель Олимпиадных школ МФТИ по химии, репетитор ЕГЭ и ОГЭ,
автор и составитель методических разработок
Задание № 30
Что требуется
Из предложенного перечня веществ необходимо выбрать те, между которыми возможно протекание окислительно-восстановительной реакции (ОВР), записать уравнение этой реакции и подобрать в ней коэффициенты методом электронного баланса, а также указать окислитель и восстановитель.
Особенности
Это одно из самых сложных заданий ЕГЭ по предмету, поскольку оно проверяет знание всей химии элементов, а также умение определять степени окисления элементов. По этим данным нужно определить вещества, которые могут быть только окислителями (элементы в составе этих веществ могут только понижать степень окисления), только восстановителями (элементы в составе этих веществ могут только повышать степень окисления) или же проявлять окислительно-восстановительную двойственность (элементы в составе этих веществ могут и понижать, и повышать степень окисления).
Также в задании необходимо уметь самостоятельно (без каких-либо указаний или подсказок) записывать продукты широкого круга окислительно-восстановительных реакций. Кроме того, нужно уметь грамотно оформить электронный баланс, после чего перенести полученные в балансе коэффициенты в уравнение реакции и дополнить его коэффициентами перед веществами, в которых элементы не изменяли степеней окисления.
Советы
Окислительно-восстановительные реакции основаны на принципе взаимодействия веществ противоположной окислительно-восстановительной природы. Согласно этому принципу любой восстановитель может взаимодействовать практически с любым окислителем. В задаче № 30 окислители и восстановители часто подобраны таким образом, что между ними точно будет протекать реакция.
Для нахождения пары окислитель/восстановитель нужно, прежде всего, обращать внимание на вещества, содержащие элементы в минимальной и максимальной степени окисления. Тогда вещество с минимальной степенью окисления будет являться типичным восстановителем, а вещество с максимальной степенью окисления с большой долей вероятности окажется сильным окислителем.
Если в списке только одно вещество (вещество 1) содержит элемент в максимальной или минимальной степени окисления, нужно найти ему в пару вещество, в котором элемент находится в промежуточной степени окисления и может проявлять свойства и окислителя, и восстановителя (вещество 2). Тогда вещество 1 определит окислительно-восстановительную активность вещества 2.
Когда пара окислитель/восстановитель определена, нужно обязательно проверить, в какой среде (кислой, нейтральной или щелочной) может протекать эта реакция. Если нет особенных правил, связанных со средой протекания выбранной реакции, то в качестве среды следует выбрать водный раствор того вещества (кислоты или щелочи), которое есть в предложенном списке реагентов.
Чтобы верно записать продукты окислительно-восстановительной реакции, нужно знать теоретические сведения о химии того или иного вещества и специфику его свойств. Однако запоминать все реакции наизусть — дело утомительное, да и не очень полезное. Для того чтобы упростить задачу, можно выявить некоторые общие закономерности в протекании ОВР и научиться предсказывать продукты реакций. Для этого нужно следовать трем простым правилам:
- Процессы окисления и восстановления — это две стороны единого процесса: процесса передачи электрона. Если какой-либо элемент (восстановитель) отдает электроны, то в этой же реакции обязательно должен быть какой-то элемент (окислитель), который принимает эти электроны.
- Если в реакции участвует простое вещество, эта реакция — всегда окислительно-восстановительная.
- При взаимодействии сильных окислителей с различными восстановителями обычно образуется один и тот же основной продукт окисления. Многие окислители при взаимодействии с различными восстановителями также часто восстанавливаются до какого-то одного продукта, соответствующего их наиболее устойчивой степени окисления.
Задание № 31
Что требуется
Из предложенного перечня веществ (того же, что и в задании № 30) необходимо выбрать такие вещества, между которыми возможна реакция ионного обмена. Необходимо записать уравнение реакции в молекулярной форме и привести сокращенную ионную форму.
Особенности
Это задание значительно легче предыдущего, поскольку круг возможных реакций ограничен и определен условиями протекания реакций ионного обмена, которые школьники изучают еще в 8-9 классах.
Советы
Нужно помнить, что любая реакция ионного обмена — это обязательно реакция, протекающая в растворе. Все реакции ионного обмена являются неокислительно-восстановительными!
В реакциях ионного обмена могут участвовать:
- солеобразующие оксиды;
- основания и амфотерные гидроксиды;
- кислоты;
- соли (средние, кислые, основные). Теоретически можно составить реакцию ионного обмена с участием смешанных, двойных или комплексных солей, но это для задания № 31 — экзотика.
Чаще всего в этой задаче встречаются реакции ионного обмена с участием оснований, амфотерных гидроксидов, кислот и средних солей. Однако обмен ионами может осуществляться далеко не с любыми парами веществ. Для того чтобы протекала реакция ионного обмена, необходимо выполнение некоторых ограничительных условий, которые связаны с реагентами и продуктами реакции.
Для написания ионных форм уравнений нужно следовать правилам, согласно которым одни вещества представляются в диссоциированной форме (в виде ионов), а другие — в недиссоциированной (в виде молекул).
Расписываем на ионы в реакциях ионного обмена:
- растворимые сильные электролиты;
- малорастворимые сильные электролиты, если они являются реагентами.
Не расписываем на ионы в реакциях ионного обмена:
- неэлектролиты;
- нерастворимые в воде вещества;
- слабые электролиты;
- малорастворимые сильные электролиты, если они являются продуктами реакции.
Когда уже сокращенная форма реакции ионного обмена записана, будет нелишним проверить для нее выполнение материального и электрического баланса. Другими словами, верно ли расставлены в сокращенной форме коэффициенты и сохраняется ли общий электрический заряд в левой и правой частях уравнения. Это позволит избежать потерянных коэффициентов или зарядов ионов на пути от молекулярной формы через полную ионную — к сокращенной.
Задание № 32
Что требуется
По приведенному текстовому описанию необходимо записать уравнения четырех реакций.
Особенности
Это задание так же, как и задание № 30, проверяет знание всей химии элементов, которая содержится в спецификации ЕГЭ. Однако часто составление четырех уравнений, описанных в задании № 32, является более простой задачей, чем составление одного уравнения в вопросе № 30. Во-первых, здесь не нужно самостоятельно выбирать реагенты, поскольку они уже даны в условии, а продукты часто можно угадать, используя данные условия, которые, по сути, являются подсказками. Во-вторых, из четырех описанных в задании уравнений, как правило, два можно записать, используя знания 8-9 классов. Например, это могут быть реакции ионного обмена. Два других уравнения — посложнее, подобные тем, которые предлагаются в задании № 30.
Советы
Конечно, можно просто выучить всю химию элементов наизусть и с ходу записать все уравнения. Это самый верный способ. Если же возникают трудности с определением продуктов, то нужно по максимуму использовать подсказки, приведенные в условии. Чаще всего в задании указываются наблюдаемые химические явления: выпадение или растворение осадков, выделение газов, изменение цвета твердых веществ или растворов. А если еще и указан конкретный цвет осадка, газа или раствора, можно с высокой точностью определить, о каком веществе идет речь. Для этого необходимо всего лишь знать цвета наиболее часто использующихся в задачах школьной программы осадков и газов, а также цвета растворов солей. Это сильно облегчит написание проблемного уравнения реакции, и задание № 32 покажется очень даже простым.
Задание № 33
Что требуется
Необходимо записать уравнение пяти реакций с участием органических веществ по приведенной схеме (цепочке превращений).
Особенности
В этом задании предлагается классическая цепочка превращений, какие школьники учатся решать с первого года изучения химии, только здесь в каждом уравнении участвует хотя бы одно органическое вещество. Задача на каждой стадии цепочки может быть сформулирована в двух вариантах. В первом варианте даются один из реагентов и продукт реакции. В этом случае необходимо подобрать второй реагент, а также указать все условия осуществления реакций (наличие катализаторов, нагревание, соотношение реагентов). Во втором варианте известны все реагенты, а часто и условия реакции. Необходимо только записать продукты.
Советы
Лучший способ успешно выполнить цепочку по органике — это знать наизусть все типы реакций каждого класса соединений и специфические свойства органических веществ, содержащиеся в школьном курсе органической химии.
Главное правило задания № 33 — использование графических (структурных) формул органических веществ в уравнениях реакций. Это указание обязательно прописано в каждом варианте тренировочных работ и пробных вариантов ЕГЭ по химии, поэтому известно всем выпускникам. Однако некоторые школьники все равно иногда пренебрегают этим правилом и часть органических веществ записывают в молекулярном виде. Будьте внимательны! Уравнения реакций с молекулярными формулами органических веществ в этом задании не засчитываются.
В задачах № 32 и № 33 уравнение считается написанным верно, если в нем расставлены все коэффициенты и при необходимости указаны условия протекания реакции. Уравнения реакций, в которых хотя бы один коэффициент неверен или не указаны важные условия, не засчитываются.
Задание № 34
Что требуется
Решить расчетную задачу, тематика которой меняется от года к году и от варианта к варианту.
Особенности
В спецификации ЕГЭ под номером 34 заявлены задачи с использованием понятия доли (массовой, объемной, мольной) вещества в смеси. Частным случаем таких задач являются задачи «на массовую долю вещества в растворе», задачи «на примеси», то есть с использованием понятия доли чистого вещества в составе технического. Сюда же относятся расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного, а также расчеты по уравнению реакции, если один из реагентов дан в избытке.
Предсказать, какие задачи будут отобраны для ЕГЭ именно в этом году, практически невозможно. Единственное, что можно ожидать по опыту прошлых лет, — это то, что задача не окажется сложной и будет полностью соответствовать профильной школьной программе (не олимпиадной). Это значит, что такая задача по зубам любому школьнику, освоившему курс химии на профильном школьном уровне и обладающему обыкновенной математической и химической логикой.
Советы
Для того чтобы решить эту задачу, прежде всего, нужно знать базовые формулы и определения основных физических величин. Необходимо осознать понятие «математической доли» как отношения части к целому. И тогда все типы долей в химии принимают одинаковый внешний вид.
| Массовая доля вещества в смеси | ({omega_{1}} = {{m_{в-ва}} over m_{смеси}}) |
| Массовая доля вещества растворе | ({omega_{1}} = {{m_{в-ва}} over m_{р-ра}}) |
| Мольная доля вещества в смеси (растворе) | ({chi} = {{nu_{в-ва}} over nu_{смеси}}) |
| Объемная доля вещества в смеси (растворе) | ({varphi} = {{V_{в-ва}} over V_{смеси}}) |
| Доля чистого вещества в составе технического (степень чистоты) | ({omega_{чист}} = {{m_{чист}} over m_{техн}}) |
| Доля выхода продукта от теоретически возможного (выход продукта) |
({eta} = {{upsilon_{практ}} over upsilon_{теор}} = {{m_{практ}} over m_{теор}} )
(m_{практ}) — масса продукта, которая получилась в результате химической реакции (m_{теор}) — масса продукта, которая могла образоваться в соответствии с теоретическим расчетом по уравнению реакции |
| Количество вещества |
({v} = {m over M} )
([{v}] = моль ) ({nu} = {{V} over V_{m}}) Молярный объем, т.е. объем одного моля газа, одинаков для всех газов при одинаковых условиях |
| Молярная концентрация (молярность) вещества в растворе |
({C} = {{v_{в-ва}} over V_{р-ра}} )
([{C}] = {моль over л} = М) |
| Плотность раствора |
({rho} = {{m_{р-ра}} over V_{р-ра}} )
([{rho}] = {г over мл} = {г over см^3} ) |
Задание № 35
Что требуется
Решить расчетную задачу на установление молекулярной и структурной формулы вещества, записать предложенное уравнение реакции с данным веществом.
Особенности
Идеологическая часть задач на вывод формулы изучается школьниками еще в 8-9 классах, поэтому это наиболее простая задача части 2 ЕГЭ. Хотя в спецификации не указано, формулу какого вещества необходимо установить. Опыт показывает, что из года в год здесь традиционно участвуют органические вещества.
Советы
Все задачи на вывод формулы, встречающиеся в ЕГЭ, можно условно разделить на три типа. Первый тип — это установление формулы по массовым долям элементов в веществе. Здесь работает формула для массовой доли элемента в сложном веществе:
({omega} = {n times {A_{r}(элемента)} over {M_{r}(вещества)}} times 100 %)
где n — число атомов элемента в молекуле, то есть индекс элемента.
Иногда в этом типе задач нужно знать еще и общую формулу класса, к которому относится неизвестное органическое вещество. Затем следует выразить относительную молекулярную массу вещества через n и подставить в уравнение для массовой доли. Решением уравнения будет искомое значение n, а следовательно, и молекулярная формула вещества. Дополнительные сведений о веществе, указанные в условии задачи, позволяют установить структурную формулу вещества, с которой далее требуется записать уравнение реакции.
Второй тип задач — это установление формулы через расчеты по уравнению химической реакции. Здесь нужно обязательно знать еще общую формулу класса, к которому относится неизвестное органическое вещество, и записать с ним уравнение реакции. Иногда приходится расставлять коэффициенты в общем виде через n. Тем не менее это наиболее понятный тип задач на вывод формулы, поскольку он чаще всего сводится к одному уравнению с одним неизвестным n, решение которого дает нам искомую молекулярную формулу. Дополнительные сведения о веществе, указанные в условии задачи, позволяют установить структурную формулу вещества, с которой далее требуется записать уравнение реакции.
И, наконец, третий тип задач — это установление формулы по продуктам сгорания вещества. Этот вариант наиболее часто встречается на ЕГЭ в этом задании. Выглядит он чуть более громоздко, чем два предыдущих, однако решается также очень просто. План решения заключается в нахождении простейшей формулы вещества и переходе к истинной (то есть молекулярной) формуле через известную молярную массу вещества. Простейшая формула находится из закона, согласно которому индексы элементов относятся так же, как их количества вещества в молях. Если молярная масса вещества не дана в условии, то можно попробовать доказать единственность решения через соответствие формулы правилам валентности. Но такой подход часто бывает трудоемок, и его можно легко обойти, если использовать дополнительные сведения об искомом веществе, указанные в условии задачи. Это может быть класс соединения, наличие или отсутствие каких-либо типов изомерии и, наконец, химическая реакция, в которую это вещество способно вступать или с помощью которой оно может быть получено. Помимо молекулярной формулы, эти же дополнительные сведения позволяют однозначно определить и структурную формулу вещества, с которой далее требуется записать уравнение реакции.
ЕГЭ по химии — экзамен по выбору, который сдают абитуриенты медицинских вузов, а также выпускники, поступающие на химические и химико-технологические направления. Работа состоит из 35 заданий различной сложности. О том, как справиться с самыми сложными заданиями, за которые можно получить наибольшее количество баллов, мы побеседовали с преподавателем Олимпиадных школ МФТИ по химии Александром Есманским.
Содержание
- Задание № 30
- Что требуется
- Особенности
- Советы
- Задание № 31
- Что требуется
- Особенности
- Советы
- Задание № 32
- Что требуется
- Особенности
- Советы
- Задание № 33
- Что требуется
- Особенности
- Советы
- Задание № 34
- Что требуется
- Особенности
- Советы
- Задание № 35
- Что требуется
- Особенности
- Советы
Задание № 30
Что требуется
Из предложенного перечня веществ необходимо выбрать те, между которыми возможно протекание окислительно-восстановительной реакции (ОВР), записать уравнение этой реакции и подобрать в ней коэффициенты методом электронного баланса, а также указать окислитель и восстановитель.
Особенности
Это одно из самых сложных заданий ЕГЭ по предмету, поскольку оно проверяет знание всей химии элементов, а также умение определять степени окисления элементов. По этим данным нужно определить вещества, которые могут быть только окислителями (элементы в составе этих веществ могут только понижать степень окисления), только восстановителями (элементы в составе этих веществ могут только повышать степень окисления) или же проявлять окислительно-восстановительную двойственность (элементы в составе этих веществ могут и понижать, и повышать степень окисления).
Также в задании необходимо уметь самостоятельно (без каких-либо указаний или подсказок) записывать продукты широкого круга окислительно-восстановительных реакций. Кроме того, нужно уметь грамотно оформить электронный баланс, после чего перенести полученные в балансе коэффициенты в уравнение реакции и дополнить его коэффициентами перед веществами, в которых элементы не изменяли степеней окисления.
Советы
Окислительно-восстановительные реакции основаны на принципе взаимодействия веществ противоположной окислительно-восстановительной природы. Согласно этому принципу любой восстановитель может взаимодействовать практически с любым окислителем. В задаче № 30 окислители и восстановители часто подобраны таким образом, что между ними точно будет протекать реакция.
Для нахождения пары окислитель/восстановитель нужно, прежде всего, обращать внимание на вещества, содержащие элементы в минимальной и максимальной степени окисления. Тогда вещество с минимальной степенью окисления будет являться типичным восстановителем, а вещество с максимальной степенью окисления с большой долей вероятности окажется сильным окислителем.
Если в списке только одно вещество (вещество 1) содержит элемент в максимальной или минимальной степени окисления, нужно найти ему в пару вещество, в котором элемент находится в промежуточной степени окисления и может проявлять свойства и окислителя, и восстановителя (вещество 2). Тогда вещество 1 определит окислительно-восстановительную активность вещества 2.
Когда пара окислитель/восстановитель определена, нужно обязательно проверить, в какой среде (кислой, нейтральной или щелочной) может протекать эта реакция. Если нет особенных правил, связанных со средой протекания выбранной реакции, то в качестве среды следует выбрать водный раствор того вещества (кислоты или щелочи), которое есть в предложенном списке реагентов.
Чтобы верно записать продукты окислительно-восстановительной реакции, нужно знать теоретические сведения о химии того или иного вещества и специфику его свойств. Однако запоминать все реакции наизусть — дело утомительное, да и не очень полезное. Для того чтобы упростить задачу, можно выявить некоторые общие закономерности в протекании ОВР и научиться предсказывать продукты реакций. Для этого нужно следовать трем простым правилам:
- Процессы окисления и восстановления — это две стороны единого процесса: процесса передачи электрона. Если какой-либо элемент (восстановитель) отдает электроны, то в этой же реакции обязательно должен быть какой-то элемент (окислитель), который принимает эти электроны.
- Если в реакции участвует простое вещество, эта реакция — всегда окислительно-восстановительная.
- При взаимодействии сильных окислителей с различными восстановителями обычно образуется один и тот же основной продукт окисления. Многие окислители при взаимодействии с различными восстановителями также часто восстанавливаются до какого-то одного продукта, соответствующего их наиболее устойчивой степени окисления.
Задание № 31
Что требуется
Из предложенного перечня веществ (того же, что и в задании № 30) необходимо выбрать такие вещества, между которыми возможна реакция ионного обмена. Необходимо записать уравнение реакции в молекулярной форме и привести сокращенную ионную форму.
Особенности
Это задание значительно легче предыдущего, поскольку круг возможных реакций ограничен и определен условиями протекания реакций ионного обмена, которые школьники изучают еще в 8-9 классах.
Советы
Нужно помнить, что любая реакция ионного обмена — это обязательно реакция, протекающая в растворе. Все реакции ионного обмена являются неокислительно-восстановительными!
В реакциях ионного обмена могут участвовать:
- солеобразующие оксиды;
- основания и амфотерные гидроксиды;
- кислоты;
- соли (средние, кислые, основные). Теоретически можно составить реакцию ионного обмена с участием смешанных, двойных или комплексных солей, но это для задания № 31 — экзотика.
Чаще всего в этой задаче встречаются реакции ионного обмена с участием оснований, амфотерных гидроксидов, кислот и средних солей. Однако обмен ионами может осуществляться далеко не с любыми парами веществ. Для того чтобы протекала реакция ионного обмена, необходимо выполнение некоторых ограничительных условий, которые связаны с реагентами и продуктами реакции.
Для написания ионных форм уравнений нужно следовать правилам, согласно которым одни вещества представляются в диссоциированной форме (в виде ионов), а другие — в недиссоциированной (в виде молекул).
Расписываем на ионы в реакциях ионного обмена:
- растворимые сильные электролиты;
- малорастворимые сильные электролиты, если они являются реагентами.
Не расписываем на ионы в реакциях ионного обмена:
- неэлектролиты;
- нерастворимые в воде вещества;
- слабые электролиты;
- малорастворимые сильные электролиты, если они являются продуктами реакции.
Когда уже сокращенная форма реакции ионного обмена записана, будет нелишним проверить для нее выполнение материального и электрического баланса. Другими словами, верно ли расставлены в сокращенной форме коэффициенты и сохраняется ли общий электрический заряд в левой и правой частях уравнения. Это позволит избежать потерянных коэффициентов или зарядов ионов на пути от молекулярной формы через полную ионную — к сокращенной.
Задание № 32
Что требуется
По приведенному текстовому описанию необходимо записать уравнения четырех реакций.
Особенности
Это задание так же, как и задание № 30, проверяет знание всей химии элементов, которая содержится в спецификации ЕГЭ. Однако часто составление четырех уравнений, описанных в задании № 32, является более простой задачей, чем составление одного уравнения в вопросе № 30. Во-первых, здесь не нужно самостоятельно выбирать реагенты, поскольку они уже даны в условии, а продукты часто можно угадать, используя данные условия, которые, по сути, являются подсказками. Во-вторых, из четырех описанных в задании уравнений, как правило, два можно записать, используя знания 8-9 классов. Например, это могут быть реакции ионного обмена. Два других уравнения — посложнее, подобные тем, которые предлагаются в задании № 30.
Советы
Конечно, можно просто выучить всю химию элементов наизусть и с ходу записать все уравнения. Это самый верный способ. Если же возникают трудности с определением продуктов, то нужно по максимуму использовать подсказки, приведенные в условии. Чаще всего в задании указываются наблюдаемые химические явления: выпадение или растворение осадков, выделение газов, изменение цвета твердых веществ или растворов. А если еще и указан конкретный цвет осадка, газа или раствора, можно с высокой точностью определить, о каком веществе идет речь. Для этого необходимо всего лишь знать цвета наиболее часто использующихся в задачах школьной программы осадков и газов, а также цвета растворов солей. Это сильно облегчит написание проблемного уравнения реакции, и задание № 32 покажется очень даже простым.
Задание № 33
Что требуется
Необходимо записать уравнение пяти реакций с участием органических веществ по приведенной схеме (цепочке превращений).
Особенности
В этом задании предлагается классическая цепочка превращений, какие школьники учатся решать с первого года изучения химии, только здесь в каждом уравнении участвует хотя бы одно органическое вещество. Задача на каждой стадии цепочки может быть сформулирована в двух вариантах. В первом варианте даются один из реагентов и продукт реакции. В этом случае необходимо подобрать второй реагент, а также указать все условия осуществления реакций (наличие катализаторов, нагревание, соотношение реагентов). Во втором варианте известны все реагенты, а часто и условия реакции. Необходимо только записать продукты.
Советы
Лучший способ успешно выполнить цепочку по органике — это знать наизусть все типы реакций каждого класса соединений и специфические свойства органических веществ, содержащиеся в школьном курсе органической химии.
Главное правило задания № 33 — использование графических (структурных) формул органических веществ в уравнениях реакций. Это указание обязательно прописано в каждом варианте тренировочных работ и пробных вариантов ЕГЭ по химии, поэтому известно всем выпускникам. Однако некоторые школьники все равно иногда пренебрегают этим правилом и часть органических веществ записывают в молекулярном виде. Будьте внимательны! Уравнения реакций с молекулярными формулами органических веществ в этом задании не засчитываются.
В задачах № 32 и № 33 уравнение считается написанным верно, если в нем расставлены все коэффициенты и при необходимости указаны условия протекания реакции. Уравнения реакций, в которых хотя бы один коэффициент неверен или не указаны важные условия, не засчитываются.
Задание № 34
Что требуется
Решить расчетную задачу, тематика которой меняется от года к году и от варианта к варианту.
Особенности
В спецификации ЕГЭ под номером 34 заявлены задачи с использованием понятия доли (массовой, объемной, мольной) вещества в смеси. Частным случаем таких задач являются задачи «на массовую долю вещества в растворе», задачи «на примеси», то есть с использованием понятия доли чистого вещества в составе технического. Сюда же относятся расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного, а также расчеты по уравнению реакции, если один из реагентов дан в избытке.
Предсказать, какие задачи будут отобраны для ЕГЭ именно в этом году, практически невозможно. Единственное, что можно ожидать по опыту прошлых лет, — это то, что задача не окажется сложной и будет полностью соответствовать профильной школьной программе (не олимпиадной). Это значит, что такая задача по зубам любому школьнику, освоившему курс химии на профильном школьном уровне и обладающему обыкновенной математической и химической логикой.
Советы
Для того чтобы решить эту задачу, прежде всего, нужно знать базовые формулы и определения основных физических величин. Необходимо осознать понятие «математической доли» как отношения части к целому. И тогда все типы долей в химии принимают одинаковый внешний вид.
| Массовая доля вещества в смеси | ({omega_{1}} = {{m_{в-ва}} over m_{смеси}}) |
| Массовая доля вещества растворе | ({omega_{1}} = {{m_{в-ва}} over m_{р-ра}}) |
| Мольная доля вещества в смеси (растворе) | ({chi} = {{nu_{в-ва}} over nu_{смеси}}) |
| Объемная доля вещества в смеси (растворе) | ({varphi} = {{V_{в-ва}} over V_{смеси}}) |
| Доля чистого вещества в составе технического (степень чистоты) | ({omega_{чист}} = {{m_{чист}} over m_{техн}}) |
| Доля выхода продукта от теоретически возможного (выход продукта) | ({eta} = {{upsilon_{практ}} over upsilon_{теор}} = {{m_{практ}} over m_{теор}} )
(m_{практ}) — масса продукта, которая получилась в результате химической реакции (m_{теор}) — масса продукта, которая могла образоваться в соответствии с теоретическим расчетом по уравнению реакции |
| Количество вещества | ({v} = {m over M} )
([{v}] = моль ) ({nu} = {{V} over V_{m}}) Молярный объем, т.е. объем одного моля газа, одинаков для всех газов при одинаковых условиях |
| Молярная концентрация (молярность) вещества в растворе | ({C} = {{v_{в-ва}} over V_{р-ра}} )
([{C}] = {моль over л} = М) |
| Плотность раствора | ({rho} = {{m_{р-ра}} over V_{р-ра}} )
([{rho}] = {г over мл} = {г over см^3} ) |
Задание № 35
Что требуется
Решить расчетную задачу на установление молекулярной и структурной формулы вещества, записать предложенное уравнение реакции с данным веществом.
Особенности
Идеологическая часть задач на вывод формулы изучается школьниками еще в 8-9 классах, поэтому это наиболее простая задача части 2 ЕГЭ. Хотя в спецификации не указано, формулу какого вещества необходимо установить. Опыт показывает, что из года в год здесь традиционно участвуют органические вещества.
Советы
Все задачи на вывод формулы, встречающиеся в ЕГЭ, можно условно разделить на три типа. Первый тип — это установление формулы по массовым долям элементов в веществе. Здесь работает формула для массовой доли элемента в сложном веществе:
({omega} = {n times {A_{r}(элемента)} over {M_{r}(вещества)}} times 100 %)
где n — число атомов элемента в молекуле, то есть индекс элемента.
Иногда в этом типе задач нужно знать еще и общую формулу класса, к которому относится неизвестное органическое вещество. Затем следует выразить относительную молекулярную массу вещества через n и подставить в уравнение для массовой доли. Решением уравнения будет искомое значение n, а следовательно, и молекулярная формула вещества. Дополнительные сведений о веществе, указанные в условии задачи, позволяют установить структурную формулу вещества, с которой далее требуется записать уравнение реакции.
Второй тип задач — это установление формулы через расчеты по уравнению химической реакции. Здесь нужно обязательно знать еще общую формулу класса, к которому относится неизвестное органическое вещество, и записать с ним уравнение реакции. Иногда приходится расставлять коэффициенты в общем виде через n. Тем не менее это наиболее понятный тип задач на вывод формулы, поскольку он чаще всего сводится к одному уравнению с одним неизвестным n, решение которого дает нам искомую молекулярную формулу. Дополнительные сведения о веществе, указанные в условии задачи, позволяют установить структурную формулу вещества, с которой далее требуется записать уравнение реакции.
И, наконец, третий тип задач — это установление формулы по продуктам сгорания вещества. Этот вариант наиболее часто встречается на ЕГЭ в этом задании. Выглядит он чуть более громоздко, чем два предыдущих, однако решается также очень просто. План решения заключается в нахождении простейшей формулы вещества и переходе к истинной (то есть молекулярной) формуле через известную молярную массу вещества. Простейшая формула находится из закона, согласно которому индексы элементов относятся так же, как их количества вещества в молях. Если молярная масса вещества не дана в условии, то можно попробовать доказать единственность решения через соответствие формулы правилам валентности. Но такой подход часто бывает трудоемок, и его можно легко обойти, если использовать дополнительные сведения об искомом веществе, указанные в условии задачи. Это может быть класс соединения, наличие или отсутствие каких-либо типов изомерии и, наконец, химическая реакция, в которую это вещество способно вступать или с помощью которой оно может быть получено. Помимо молекулярной формулы, эти же дополнительные сведения позволяют однозначно определить и структурную формулу вещества, с которой далее требуется записать уравнение реакции.
Предыдущая
ОГЭ и ЕГЭСоветы эксперта: как сдать ОГЭ по географии
Следующая
ОГЭ и ЕГЭИнструкция: как сдать часть 2 ЕГЭ по обществознанию
Задание №1:
Установите соответствие между веществом и схемой его получения:
ВЕЩЕСТВО:
А) дивиниловый каучук
Б) фенолформальдегидная смола
В) нейлон
СХЕМА ПОЛУЧЕНИЯ:
1) nCH2=CHꟷCH=CH2 →
2) nCH2=C(CH3)ꟷCH=CH2 →
3) nC6H5OH + nCH2OH →
4) nHOOCꟷ(CH2)4ꟷCOOH + nH2Nꟷ(CH2)6ꟷNH2 →
5) nCH2(OH)ꟷCH2OH + nHOOCꟷC6H4ꟷCOOH→
Решение:
Первое вещество — дивиниловый каучук; создание этого полимера привело к огромному скачку в химической промышленности, отчасти благодаря синтезу Лебедева, который получил бутадиеновый(дивиниловый) каучук путем пиролиза этилового спирта(1926 г.); соответственно, этот каучук получают из дивинила, ответ 1.
Дивинил непосредственно связан с названием углеводородного непредельного радикала винила (CH2=CHꟷ) . Название «винил» с латинского vinum означает «вино»(указывает на связь с этиловым спиртом).
Второе соединение — фенолформальдегидная смола; по самому названию видно, что данная смола состоит из двух органических веществ — фенола(C6H5OH) и формальдегида(HCOH), которые в процессе поликонденсации образуют столь важное соединение, ответ 3.
Последнее вещество — нейлон(искусственное волокно, класса полиамидов, используется в качестве ткани для одежды), его получают поликонденсацией адипиновой кислоты(HOOCꟷ(CH2)4ꟷCOOH) и гексаметилендиамина(H2Nꟷ(CH2)6ꟷNH2), ответ 4.
Задание №2:
Установите соответствие между веществом, и процессом/оборудованием, который используется для его получения.
ВЕЩЕСТВО:
А) чугун
Б) сталь
В) алюминий
ПРОЦЕСС/ОБОРУДОВАНИЕ:
1) электролиз расплава поваренной соли
2) доменная печь
3) электролиз боксита в расплавленном криолите
4) мартеновская печь
Решение:
Итак, чугун, как ты знаешь, это сплав железа и углерода(С более 2,14%), для его получения используют доменную печь(1200 С), в которой происходит множество реакций, которые в совокупности приводят к образованию твердого, не пластичного, но хрупкого материала, ответ 2.
Сталь, как и чугун, имеет в своем составе углерод и железо, однако, имеет существенное различие в соотношении этих элементов(C до 2,14%), обладает легкостью, высокой пластичностью, стойкостью; сталь получают в мартеновской печи(1700 С), ответ 4.
Алюминий получают электролизом боксита в расплаве криолита, об этом я уже писала на предыдущем уроке, ответ 3.
Задание №3:
Установите соответствие между веществом и способом его получения:
ВЕЩЕСТВО:
А) полипропилен
Б) фторопласт
В) бутадиенстирольный каучук
СПОСОБ ПОЛУЧЕНИЯ:
1) вулканизация
2) полимеризация
3) поликонденсация
4) сополимеризация
Решение:
Полипропилен((C3H6)n) — это полимер, который образуется путем полимеризации соответствующего алкена пропилена(C3H6), ответ 2.
Фторопласт — общее название фторсодержащих полимеров, к которым, в частности, относится политетрафторэтилен(тефлон). Его можно получить реакцией полимеризации тетрафторэтилена, ответ 2.
Бутадиенстирольный каучук является важнейшим сырьем для изготовления таких продуктов, как шины, кабели, и жевательные резинки(!), получить в промышленности такой каучук можно сополимеризацией, ответ 4.
Сополимеризация — это процесс получения сополимеров, по сути представляет совместную полимеризацию нескольких мономеров, например, бутадиена и стирола(оба имеют кратную связь). Различают радикальную, анионную и катионную сополимеризацию.
Задание №4:
Установите соответствие между веществом и областью его применения:
ВЕЩЕСТВО:
А) целлюлоза
Б) фосфоритная мука
В) медь
Г) алюминий
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) производство суперфосфата
2) искусственные волокна
3) электротехническая промышленность
4) получение стекла
5) производство аммиака
Решение:
Целлюлоза, (C6H10O5)n — это органический полимер, растительный углевод, из которого делают искусственные волокна, ответ 2.
Фосфоритная мука представляет собой минеральное фосфорное удобрение с <30% ортофосфата кальция, используется в производстве суперфосфата(кристаллогидрат дигидрофосфата кальция), ответ 1.
Медь используется в электротехнической промышленности за счет идеальной электропроводности и высоких параметров проводимости тепла, ответ 3.
Алюминий, также как медь, нашел свое применение в электротехнической промышленности в качестве материала для кабелей, шинопроводов, выпрямителей переменного тока, ответ 1.
Задание №5:
Установите соответствие между веществом и его воздействием на организм:
ВЕЩЕСТВО:
А) аргон и азот
Б) метанол
В) этанол
Г) соли свинца
ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ:
1) наркотическое воздействие
2) токсическое воздействие, быстро приводящее к летальному исходу
3) токсическое воздействие, приводящее к тяжелым заболеваниям
4) не влияет на жизнеспособность организма
5) улучшает состояние организма
Решение:
Аргон и азот — это два газа, являются составными частями воздуха(азот>70%, аргон<1%), а значит, не имеют отрицательного влияния на организм, ответ 4.
Метанол — это яд, который в целом внешне похож на этанол, однако, употребление его перорально вызывает слепоту, а в дальнейшем смерть от удушья, ответ 2.
Этанол — это токсическое вещество, которое оказывает наркотическое действие на мозг, заставляя организм входить в непривычное и неестественное состояние опьянения, со временем оказывает только отрицательное влияние в виде проблем с почками, кожей, желудком, печенью, усугубляющее нормальное состояние человека, ответ 1.
Соли свинца воздействуют на организм человека отрицательно, приводя к тяжелым заболеваниям, ответ 3.
Задание №6:
Установите соответствие между схемой химической реакции и областью ее применения:
СХЕМА РЕАКЦИИ:
А) 2AgHal(облучение) → 2Ag + Hal2
Б) PbS + 4H2O2 = PbSO4 + 4H2O
В) 2(OCl—) = Cl2 + O2
Г) 2(NH4)2CO3 → 2NH3 + CO2 + H2O
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) реставрация картин
2) отбеливание тканей и дезинфекция
3) черно-белая фотография
4) хлебопекарная и кондитерская промышленность
5) получение синтетических красителей
Решение:
Первая реакция — облучение галогенида серебра применяется для черно-белых фотографий, ответ 3.
Вторая реакция — окисление сульфида свинца применяют в реставрации картин, ответ 1.
Третий процесс — получение чистого хлора и кислорода — всем известные процессы отбеливания и дезинфекции, ответ 2.
Последняя реакция — это разложение карбоната аммония, используется в хлебопекарной промышленности, ответ 4.
Задание №7:
Установите соответствие между раствором вещества и его применением в лаборатории:
РАСТВОР ВЕЩЕСТВА:
А) аммиачный раствор оксида серебра
Б) известковая вода
В) нитрат серебра
Г) бромная вода
ПРИМЕНЕНИЕ В ЛАБОРАТОРИИ:
1) обнаружение карбонат-ионов
2) обнаружение йодид-ионов
3) обнаружение альдегидов
4) обнаружение алкенов
5) обнаружение этанола
Решение:
Начнем с аммиачного раствора оксида серебра — это достаточно известная качественная реакция на альдегиды(в результате выделяется чистое серебра и аммоний — производное карбоновой кислоты), ответ 3.
!ВАЖНО: Муравьиная кислота(HCOOH) также может вступать в реакцию «серебрянного зеркала«.
Известковая вода(гашеная известь, Ca(OH)2) используется в качестве обнаружения карбонат-ионов(карбонат кальция — это осадок белого цвета), ответ 1.
Нитрат серебра — эта соль может обнаруживать йодид-ионы(за счет осадка AgI), ответ 2.
Бромная вода является качественным реагентом на кратные связи, в том числе на алкены, ответ 4.
Задание №8:
Установите соответствие между веществом/ группой веществ и правилами работы с ними в лаборатории:
ВЕЩЕСТВО:
А) приготовление растворов кислот
Б) пламя горящего натрия можно погасить, используя
В) приготовление растворов твердых щелочей проводят
Г) пламя горящих органических веществ можно погасить, используя
ПРАВИЛА РАБОТЫ:
1) песок или порошковый огнетушитель
2) растворение проводят осторожно и в фарфоровой посуде
3) песок или углекислотный огнетушитель
4) растворение проводят осторожно, приливая холодную воду к веществу
5) растворение проводят осторожно, приливая вещество к холодной кислоте
Решение:
Приготовление растворов кислот — это ответственный процесс, так как большинство минеральных кислот являются опасными для органических субъектов, это действие проводят ПРИЛИВАЯ ВЕЩЕСТВО К ВОДЕ! Ответ 5.
Пламя горящего натрия можно погасить с помощью песка или порошкового огнетушителя(горящие щелочные металлы водой тушить НЕЛЬЗЯ), ответ 1.
Приготовление растворов твердых щелочей проводят естественно осторожно и в фарфоровой посуде, ответ 2.
Пламя горящих органических веществ можно погасить, используя песок или углекислотный огнетушитель, ответ 3.
Задание №9:
Установите соответствие между формулой вещества и его токсическими свойствами:
ФОРМУЛА ВЕЩЕСТВА:
А) CO2
Б) CO
В) HCl
Г) N2
ТОКСИЧЕСКИЕ СВОЙСТВА:
1) ядовитый газ желто-зеленого цвета
2) ядовитый газ с резким запахом
3) ядовитый газ без цвета и запаха
4) не ядовитый газ без цвета и запаха
5) ядовитый газ с запахом тухлых яиц
Решение:
Первый в списке — углекислый газ, каждый знает его физические свойства, потому что он является составной частью воздуха, а также представляет собой тот газ, который мы выдыхаем, ответ 4.
Следующий газ — угарный, это ядовитый газ без цвета и запаха, ответ 3.
Хлороводород — это ядовитый газ с резким запахом, ответ 2.
Последним веществом является азот, этот газ входит в состав воздуха(>70%), это газ без запаха и цвета, ответ 4.
Задание №10:
Установите соответствие между формулой вещества и областью его применения:
ФОРМУЛА ВЕЩЕСТВА:
А) C3H8O3
Б) AlCl3
В) CCl4
Г) CH4
ОБЛАСТЬ ПРИМЕНЕНИЯ:
1) в качестве топлива
2) в качестве катализатора в органическом синтезе
3) в качестве растворителя
4) в медицине и в косметических средствах
5) получение каучука
Решение:
C3H8O3 это глицерин, трехатомный спирт, который используется в косметических средствах и медицине, ответ 4.
Хлорид алюминия является катализатором в реакции изомеризации алканов, ответ 2.
Тетрахлоруглерод — это галогенпроизводное алканов, используемое в качестве растворителя, ответ 3.
Последнее вещество из списка — метан, так как он входит в состав нефти, то из него получают топливо для двигателей внутреннего сгорания, ответ 1.На этом все!
Задания части С4 для подготовки к ЕГЭ,
подготовленные учителем МБОУ гимназии№2
Поляковой Галиной Андреевной
Задача
1.
После
выдерживания медной пластинки массой 14,72 г в растворе нитрата серебра масса
пластинки составила19,28 г. Определите объем раствора 96%-ной серной кислоты(p=1/86г/мл)
Решение:
Запишем
уравнение реакции: Cu +2AgNO3 =Cu(NO3)2 +2Ag; найдем изменение массы
пластинки:19,28-14,72=4,56 так как масса пластинки увеличилась серебра
выделилось на пластинке больше, чем растворилось меди .Пусть n(Cu)-x моль, тогда n(Ag) -2xмоль;m(Cu)=64x,a m(Ag)=216x.
216x-64x=4,56
152x=4,56
X=0,03моль
Исходное
количество вещества меди было: n(Cu)=14,72/64=0,23,следоваьельно меди
осталось 0,23-0,03=0,2моль,а серебра образовалось 0,06 моль. Оба металла
реагируют серной кислотой.
Cu+2H2SO4=CuSO4 +SO2 +2H2O
2Ag+2H2SO4 =Ag2SO4 + SO2 +2H2O по первому уравнению количества
вещества серной кислоты равно 0.4 моль, по второму-0,06 моль. Общее количество
вещества:n(H2SO4)=0/4,46 моль, масса(H2SO4)=0,46*98=46,958
m(H2SO4раствора)=45,08/0.96=46.958; объем раствора:V(H2SO4раствора)=46,958/1,86=25,246.
Задача
2.
Определите
массу Mg3N2, полностью подвергшегося разложению
водой, если для солеобразования с продуктами гидролиза потребовалось 150 мл
4%-го раствора соляной кислоты плотностью 1,02 г/мл.
Решение: Mg3N2 +6H2O=3Mg (OH)2 +2NH3
Mg (OH)2+2HCl=MgCl2+2H2O
NH3+HCl=NH4Cl
Определим
m(HCl раствора)=150*1,02=153 m(HCl)=153*0,04=6,12 n(HCl)=6,12/36,5=0,168 моль; пусть количество вещества Mg3N2-хмоль,тода п(3Mg(OH)2=3х моль, п1(HCl)=6х моль ;п(NH3)=2х моль, п2(HCl)=х моль, обще количество вещества(HCl)=7х моль ;составим уравнение:7х=0,
168 х=0,024 моль; масса( Mg3N2)=100*0.024=2.4 г.
Задача3.
Аммиак, выделившийся при взаимодействии 107 г 20%-ного
раствора хлорида аммония со 150 г 18%-ного раствора гидроксида натрия,
полностью прореагировал с 60%-ной ортофосфорной кислотой с образованием
дигидрофосфата аммония. Определите массовую долю хлорида натрия в растворе и
необходимую массу 60%-ного раствора фосфорной кислоты.
Решение: NH4Cl +Na OH=NH3 +NaCl
NH3+H3PO4=NH4H2PO4
m(NH4Cl)=107*0,2=21,4 m(NaOH)=150*0,18=27 n(NH4Cl)=2,14/53,5=0,4 n(NaOH)=27/40=0,675 n(NaCl)=0,4 m(NaCl)=0,4*58,5=23,4 m(NH3)=0,4*17=6,8
m(р-ра)= m(р-раNaCl)+ m(р-раNaCl)-m(NH3) m(р-ра)=107+150-6,8=250,2 w(NaCl)=6,8/250,2=0,027;
n(H3PO4)=0,4 моль, m(H3PO4) =0,4*98=39,2 , m(р-ра H3PO4)=39,2/0,6=65,333
Задача
4.
Пентахлорид
фосфора массой2,085 г осторожно внесли в 200 г 15-процентного раствора
карбоната натрия, при этом не наблюдали выделение газа. Запишите уравнение
реакции и рассчитайте массовую долю гидрофосфата натрия в полученном растворе.
Решение:
PCl5
+2Na2CO3 +4H2O=2Na2HPO4
+2NaHCO3 +5HCl
n(PCl5)=2,085/208,5=0,01
m(Na2CO3)=200*0,15=30 n(Na2CO3)=30/106=0,283
0(избыток) n(Na2HPO4)=0,02
m(Na2HPO4)=0,02*142=2,84
m (раствора)= m(PCl5)+ m(р-ра Na2CO3)
m (раствора)=2,085+200=202,085 W(Na2HPO4)=2,84/202,085=0,014
Чтобы поделиться, нажимайте
Предлагаем вашему вниманию задания и видео-объяснения второй части (С часть) пробного варианта №1 ЕГЭ 2020 по химии (аналог демонстрационного варианта ЕГЭ 2020 по химии).
Для вашего удобства, после каждого задания представлены видео-объяснения, а в конце страницы — возможность скачать этот вариант в формате pdf.
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
перманганат калия, гидрокарбонат калия, сульфит калия, сульфид меди (II), гидроксид калия, пероксид водорода. Допустимо использование водных растворов веществ.
30. Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выделение осадка или газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
31. Из предложенного перечня веществ выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
32. Оксид алюминия сплавили с карбонатом калия. Полученный продукт растворили в избытке серной кислоты. К образовавшемуся раствору добавили избыток аммиачной воды. Выпавший осадок отделили и обработали избытком раствора гидроксида натрия. Напишите уравнения четырёх описанных реакций.
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
34. При нагревании образца карбоната магния часть вещества разложилась. При этом выделилось 29,12 л (н.у.) углекислого газа. Масса твёрдого остатка составила 136 г. Этот остаток добавили к 763.6 г раствора бромоводородной кислоты, с массовой долей 53,04%. Определите массовую долю кислоты в полученном растворе, если растворимость соли, содержащейся в этом растворе, при данных условиях составляет 101,1 г га 100 г воды. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
35. При сгорании 26,2 г органического вещества получили 26,88 л углекислого газа (н.у.), 2,24 л азота (н.у.) и 23,4 г воды. При нагревании с бромоводородной кислотой данное вещество подвергается гидролизу, продуктами которого являются соединение состава C2H6NO2Br и третичный спирт.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение гидролиза вещества в присутствии бромоводородной кислоты (используйте структурные формулы органических веществ).
Также вы можете скачать:
- Пробный вариант №1 ЕГЭ 2020 г. (аналог демонстрационного варианта ЕГЭ 2020 г.) с ответами в формате pdf
- Демонстрационный вариант ЕГЭ 2020 (с сайта ФИПИ)
- Кодификатор ЕГЭ 2020 (с сайта ФИПИ)
- Спецификация ЕГЭ 2020 (с сайта ФИПИ)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
Задание С2 ЕГЭ по химии представляет собой описание химического эксперимента, в соответствии с которым нужно будет составить 4 уравнения реакции. По статистике, это одно из самых сложных заданий, очень низкий процент сдающих с ним справляется. Ниже приводятся рекомендации по поводу решения задания С2.
Во — первых, чтобы верно решить задание С2 ЕГЭ по химии нужно правильно представлять себе те действия, которым подвергаются вещества (фильтрование, выпаривание, обжиг, прокаливание, спекание, сплавление). Необходимо понимать, где с веществом происходит физическое явление, а где – химическая реакция. Наиболее часто используемые действия с веществами описаны ниже.
Фильтрование
– способ разделения неоднородных смесей с помощью фильтров – пористых материалов, пропускающих жидкость или газ, но задерживающих твёрдые вещества. При разделении смесей, содержащих жидкую фазу, на фильтре остается твердое вещество, через фильтр проходит
фильтрат
.
Выпаривание —
процесс концентрирования растворов путём испарения растворителя. Иногда выпаривание проводят до получения насыщенных растворов, с целью дальнейшей кристаллизации из них твердого вещества в виде кристаллогидрата, или до полного испарения растворителя с целью получения растворенного вещества в чистом виде.
Прокаливание –
нагревание вещества с целью изменения его химического состава. Прокаливание может проводиться на воздухе и в атмосфере инертного газа. При прокаливании на воздухе кристаллогидраты теряют кристаллизационную воду, например, CuSO
4
∙5H
2
O→CuSO
4
+ 5H
2
O
Термически нестойкие вещества разлагаются:
Cu(OH)
2
→CuO + H
2
O; CaCO
3
→ CaO + CO
2
Спекание, сплавление –
это нагревание двух и более твердых реагентов, приводящее к их взаимодействию. Если реагенты устойчивы к действию окислителей, то спекание можно проводить на воздухе:
Al
2
O
3
+ Na
2
CO
3
→ 2NaAlO
2
+ CO
2
Если же один из реагентов или продукт реакции могут окисляться компонентами воздуха, процесс проводят с инертной атмосфере, например: Сu + CuO → Cu
2
O
Вещества, неустойчивые к действию компонентов воздуха, при прокаливании окисляются, реагируют с компонентами воздуха:
2Сu + O
2
→ 2CuO;
4Fe(OH)
2
+ O
2
→2Fe
2
O
3
+ 4H
2
O
Обжиг
– процесс термической обработки, приводящий к сгоранию вещества.
Во-вторых, знание характерных признаков веществ (цвет, запах, агрегатное состояние) Вам послужит подсказкой или проверкой правильности выполненных действий. Ниже представлены наиболее характерные признаки газов, растворов, твердых веществ.
Признаки газов:
Окрашенные:
Cl
2
– желто-зеленый;
NO
2
– бурый;
O
3
– голубой (все имеют запахи). Все ядовиты, растворяются в воде,
Cl
2
и
NO
2
реагируют с ней.
Бесцветные без запаха:
Н
2
, N
2
, O
2
, CO
2
, CO (яд), NO (яд), инертные газы. Все плохо растворимы в воде.
Бесцветные с запахом:
HF, HCl, HBr, HI, SO
2
(резкие запахи), NH
3
(нашатырного спирта) –хорошо растворимы в воде и ядовиты, PH
3
(чесночный), H
2
S(тухлых яиц) — мало растворимы в воде, ядовиты.
Окрашенные растворы:
Желтые:
Хроматы, например K
2
CrO
4
, растворы солей железа (III), например, FeCl
3
.
Оранжевые:
Бромная вода, спиртовые и спиртово-водные растворы йода (в зависимости от концентрации от
жёлтого
до
бурого)
, дихроматы, например, K
2
Cr
2
O
7
Зеленые:
Гидроксокомплексы хрома (III), например, K
3
[Cr(OH)
6
], соли никеля (II), например NiSO
4
, манганаты, например, K
2
MnO
4
Голубые:
Соли меди (II), например СuSO
4
От розового до фиолетового:
Перманганаты, например, KMnO
4
От зеленого до синего:
Соли хрома (III), например, CrCl
3
Окрашенные осадки:
Желтые:
AgBr, AgI, Ag
3
PO
4
, BaCrO
4
, PbI
2
,CdS
Бурые:
Fe(OH)
3
, MnO
2
Черные, черно-бурые:
Сульфиды меди, серебра, железа, свинца
Синие:
Cu(OH)
2
, KFе[Fe(CN)
6
]
Зеленые:
Cr(OH)
3
– серо-зеленый, Fe(OH)
2
– грязно-зеленый, буреет на воздухе
Другие окрашенные вещества:
Желтые
:
сера, золото, хроматы
Оранжевые:
oксид меди (I) – Cu
2
O, дихроматы
Красные:
бром (жидкость), медь (аморфная), фосфор красный, Fe
2
O
3
, CrO
3
Черные:
СuO, FeO, CrO
Серые с металлическим блеском:
Графит, кристаллический кремний, кристаллический йод (при возгонке –
фиолетовые
пары), большинство металлов.
Зеленые:
Cr
2
O
3
, малахит (CuOH)
2
CO
3
, Mn
2
O
7
(жидкость)
В-третьих, при решении заданий С2 по химии для большей наглядности, можно порекомендовать составлять схемы превращений или последовательность получаемых веществ.
И наконец, для того, чтобы решать такие задачи, надо чётко знать свойства металлов, неметаллов и их соединений: оксидов, гидроксидов, солей. Необходимо повторить свойства азотной и серной кислот, перманганата и дихромата калия, окислительно-восстановительные свойства различных соединений, электролиз растворов и расплавов различных веществ, реакции разложения соединений разных классов, амфотерность, гидролиз солей.
Типовые задания С2 ЕГЭ по химии с решениями