Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса (или объем для газов) растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Как же решать задачи на растворимость? Я использую два способа. Давайте их рассмотрим на фрагменте задачи из реального ЕГЭ по химии 2019 года, где впервые появились задачи с упоминанием растворимости.
«Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды.»
Первый способ.
Растворимость не показывает реальное количество соли или количество воды. Это всего лишь способ выражения концентрации в насыщенных растворах, величина, которая показывает, как соотносятся масса растворенного вещества и масса воды (или другого растворенного вещества)! Например, в условии задачи растворимость карбоната натрия 31,8 г на 100 г воды означает, что для растворения каждых 31,8 г соли необходимо 100 г воды. Зато из этих данных можно определить массовую долю растворенного вещества. Рассмотрим этот эталонный раствор, в котором содержится 31,8 г соли и 100 г воды. Массовая доля соли в таком растворе составляет:
ωр.в. = mр.в./mр-ра = 31,8 г/131,8 г = 0,2413 или 24,13%
Но в нашем, реальном растворе, который получается при растворении карбоната натрия в 400 г воды, массовая доля соли такая же!
Зная массу воды и массовую долю соли, мы без труда составим уравнение и определим массу соли в реальном растворе:
ωр.в. = mр.в./(mр.в. + mр-ра)
0,2413 = mр.в./(mр.в. + 400)
mр.в. = 127,2 г
Получается, масса нитрата натрия в реальном растворе равна 127,2 г.
Второй способ.
Используя все тот же эталонный раствор, мы можем составить пропорцию, чтобы определить массу соли в реальном растворе.
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
Но будьте осторожны! Пропорции можно составить далеко не для всех величин. Но соотносить массу воды и массу растворенного вещества при неизменной концентрации (массовой доле) растворенного вещества можно и иногда очень удобно. Также пропорциональны масса раствора и масса растворенного вещества, масса воды и масса раствора и т.д.
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Ответ: χ = 31,6 г
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
Решение:
Примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,285 = 28,5 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 28,5 = 71,5 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 28,5/71,5⋅100 = 39,86 г вещества на 100 г воды.
Ответ: χ = 39,86 г вещества на 100 г воды.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500 г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9 г соли в 100 г воды?
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36 г соли в 100 г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Рассмотрим несколько примеров решения задач на растворимость из реальных ЕГЭ по химии.
10. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа(III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 2 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
Первый этап.
Определяем массу карбоната натрия, который растворится в 400 мл воды:
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
n(Na2CO3) = m(Na2CO3)/M = 127,2 г/106 г/моль = 1,2 моль
Массовая доля карбоната натрия в этом растворе:
ω(Na2CO3) = m(Na2CO3)/mр-ра = 127,2 г/(127,2 г + 400 г) = 0,2413 или 24,13%
Далее раствор карбоната натрия разделили на две порции. Как решать задачи с порциями (частями)? Очень просто. Во всем исходном растворе и в порциях (частях), которые мы отделили от основного раствора, кое-что не меняется. Давайте порассуждаем, что именно.
Меняется ли масса раствора? Без сомнения, мы же разделяем раствор на части.
Меняется ли масса растворенного вещества? Также без сомнения — часть вещества попадет в одну порцию, часть в другую.
А меняется ли массовая доля растворенного вещества? Или соотношение массы растворенного вещества и воды, или другое соотношение? Конечно, не изменяется, ведь раствор — это гомогенная система, в которой вещество распределено равномерно.
Второй этап.
В первой колбе протекает реакция:
3Na2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3Na2SO4
Это типичный пример реакции необратимого гидролиза.
Во второй колбе протекает реакция:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Пусть в первой колбе выделилось х моль углекислого газа. Количество вещества газов соотносится также, как объемы газов. Поэтому можно сказать, что во второй колбе выделится 2х моль углекислого газа.
Получается, что в первой колбе в реакцию вступает х моль карбоната натрия, а во второй колбе 2х моль карбоната натрия. Общее количество вещества карбоната натрия известно, получаем уравнение:
х + 2х = 1,2
Отсюда х = 0,4 моль.
Во второй колбе количество и масса карбоната натрия:
n2(Na2CO3) = 2х = 0,8 моль
m2(Na2CO3) = n2(Na2CO3)·M = 0,8 моль·106 г/моль = 84,8 г
Масса раствора карбоната во второй колбе (массовая доля соли в исходном растворе и в двух колбах не изменяется):
mр-ра,2(Na2CO3) = m2(Na2CO3)/ω = 84,8 г / 0,2413 = 351,47 г
Масса углекислого газа, который выделился во второй реакции:
m2(CO2) = n2(CO2)·M(СО2) = 0,8 моль·44 г/моль = 35,2 г
Масса нитрата натрия во второй колбе:
m2(NaNO3) = n2(NaNO3)·M(NaNO3) = 1,6 моль·85 г/моль = 136 г
Масса конечного раствора во второй колбе:
mр-ра,2 = mр-ра,2(Na2CO3) + mр-ра(HNO3) — m(CO2) = 351,47 г + 300 г — 35,2 г = 616,27 г
Массовая доля нитрата натрия в конечно растворе во второй колбе:
ω2(NaNO3) = m2(NaNO3)/mр-ра,2 = 136 г/616,27 г = 0,2207 или 22,07%
Ответ: ω(NaNO3) = 22,07%
11. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
3Na2S + 2AlCl3 + 6H2O = 2Al(OH)3 + 3H2S + 6NaCl
Na2S + 2HCl = 2NaCl + H2S
Ответ: ω(NaCl) = 13,336%
12. Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 306,8 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната калия. К раствору во второй колбе добавили 300 г раствора аммиака, также взятого в избытке. При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
2AlCl3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6KCl
AlCl3 + 3NH3∙H2O = Al(OH)3 + 3NH4Cl
Ответ: ω(NH4Cl) = 19,9255%
13. Растворимость безводного карбоната аммония при некоторой температуре составляет 96 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната аммония к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток твёрдого гидроксида натрия и нагрели. К раствору во второй колбе добавили 250 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе.
(NH4)2CO3 + 2NaOH = 2NH3 + 2H2O + Na2CO3
(NH4)2CO3 + 2HCl = 2NH4Cl + CO2 + H2O
Ответ: ω(NH4Cl) = 26,62%
14. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества карбоната натрия к 200 мл воды, разделили на две части. К первой части прилили избыток соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. Ко второй части насыщенного раствора добавили 222 г 25%-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в полученном растворе.
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
Ответ: ω(CaCl2) = 3,1%
15. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа(II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом образовалось 46,6 г осадка. К раствору во второй колбе добавили 50 г 34%-ного раствора аммиака. Определите массовую долю аммиака в конечном растворе во второй колбе.
FeSO4 + BaCl2 = BaSO4 + FeCl2
FeSO4 + 2NH3∙H2O = Fe(OH)2 + (NH4)2SO4
Ответ: ω(NH3) = 3,11%
16. Растворимость безводного сульфата алюминия при некоторой температуре составляет 34,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
Al2(SO4)3 + 6NH3∙H2O = 2Al(OH)3 + 3(NH4)2SO4
Al2(SO4)3 + 8NaOH = 2Na[Al(OH)4] + 3Na2SO4
Ответ: ω(Na2SO4) = 14,48%
17. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор карбоната натрия массой 395,4 г разделили на две части. К первой части прилили избыток раствора нитрата кальция. При этом образовалось 50 г осадка. Ко второй части насыщенного раствора добавили 252 г 30%-ного раствора азотной кислоты. Определите массовую долю азотной кислоты в образовавшемся растворе.
Na2CO3 + Ca(NO3)2 = CaCO3 + 2NaNO3
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Ответ: ω(HNO3) = 6,14%
18. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
FeSO4 + Ba(NO3)2 = BaSO4 + Fe(NO3)2
Ответ: ω(Ba(NO3)2) = 5,24%
19. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфида натрия к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. К раствору во второй колбе добавили 450 г 15%-ного раствора хлорида меди(II). Определите массовую долю хлорида меди(II) в конечном растворе во второй колбе.
Na2S + 2HCl = H2S + 2NaCl
Na2S + CuCl2 = CuS + 2NaCl
Ответ: ω(CuCl2) = 4,54%
21. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества хлорида кальция к 160 мл воды, разлили на две колбы. В первую колбу добавили избыток раствора карбоната натрия. При этом выпал осадок массой 30 г. Во вторую колбу добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в растворе, образовавшемся во второй колбе.
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2
Ответ: ω(AgNO3) = 11,2%
22. Растворимость безводного гидрокарбоната натрия при некоторой температуре составляет 12,6 г на 100 г воды. При этой температуре приготовили 450,4 г насыщенного раствора гидрокарбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида бария. При этом образовалось 39,4 г осадка. К раствору во второй колбе добавили 245 г 20%-ного раствора серной кислоты. При этом образовалась средняя соль. Определите массовую долю серной кислоты в конечном растворе во второй колбе.
NaHCO3 + Ba(OH)2 = BaCO3 + NaOH + H2O
2NaHCO3 + H2SO4 = Na2SO4 + 2CO2 + 2H2O
Ответ: ω(H2SO4) = 5,57%
23. Растворимость хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор хлорида алюминия массой 767 г разлили по двум колбам. В первую колбу добавили избыток раствора нитрата серебра, при этом выпало 344,4 г осадка. Во вторую колбу добавили 960 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю хлорида натрия в растворе, образовавшемся во второй колбе.
AlCl3 + 3AgNO3 = 3AgCl + Al(NO3)3
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Ответ: ω(NaCl) = 14,83%
24. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 27 г осадка. К раствору во второй колбе добавили 780 г 20%-ного раствора хлорида бария. Определите массовую долю хлорида бария в конечном растворе во второй колбе.
FeSO4 + 2NH3∙H2O = Fe(OH)2 + (NH4)2SO4
FeSO4 + BaCl2 = BaSO4 + FeCl2
Ответ: ω(BaCl2) = 5,255%
25. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество хлорида кальция к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 143,5 г осадка. К раствору во второй колбе добавили 1272 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе во второй колбе.
CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
Ответ: ω(Na2CO3) = 1,43%
26. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфита натрия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток концентрированной азотной кислоты. При этом выделился бурый газ. К раствору во второй колбе добавили 300 г раствора соляной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался равен объёму газа, выделившемуся из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
Na2SO3 + 2HNO3 = Na2SO4 + 2NO2 + H2O
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
Ответ: ω(NaCl) = 8,92%
27. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили 250,4 г насыщенного раствора сульфита натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата алюминия. К раствору во второй колбе добавили 200 г разбавленного раствора серной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе. (Учитывать образование только средних солей).
3Na2SO3 + Al2(SO4)3 + 3H2O = 3SO2 + 2Al(OH)3 + 3Na2SO4
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O
Ответ: ω(Na2SO4) = 5,54%
Расчеты с участием понятия растворимости солей в рамках ЕГЭ
В ходе подготовки к ЕГЭ по химии постоянно приходится сталкиваться с понятием «раствор». Обычно под этим словом подразумевают абсолютно однородную на любом уровне, гомогенную смесь веществ. Растворы бывают самые разные по агрегатному состоянию, но в рамках экзаменов встречаем в основном растворы жидкие. Среда, в которой что-то растворяем, в таком случае будет жидкостью. Давайте введем сразу несколько понятий, которые пригодятся в дальнейшем.
Растворитель – жидкость, которая выполняет роль среды, в которой что-то растворяют. В рамках задач ЕГЭ и ДВИ практически всегда используют воду.
Растворенное вещество – вещество, которое добавили в растворитель, и оно с ним полностью смешалось. Может быть в любом агрегатном состоянии.
Растворимость – способность вещества смешиваться с растворителем. Также под растворимостью понимают массу вещества, которое может раствориться в определенной массе раствора при данных условиях.
Разбавленный раствор – раствор, содержание растворителя в котором значительно превышает содержание растворенного вещества. Например, 0,1%-ный раствор хлорида натрия.
Концентрированный раствор – раствор, содержание растворенного вещества в котором сопоставимо или превышает содержание растворителя. Например, 65%-ный раствор азотной кислоты.
Насыщенный раствор – раствор, в котором больше нельзя растворить такое вещество. Достигнут предел по растворимости.
Пересыщенный раствор – неустойчивая система, в которой содержание растворенного вещества превышает растворимость при данных условиях. На экзаменах не встречается.
В расчетных задачах ЕГЭ или ДВИ часто фигурирует растворимость тех или иных веществ. Она зависит от многих факторов. Например, природы растворителя и растворенного вещества. Очень важным фактором является температура. Для подавляющего большинства солей растворимость в воде больше при высокой температуре и меньше при низкой. Например, у хлорида калия при 80˚С растворимость равна 51,3 г/100 г воды, а при 0˚С уже станет 28 г/100 г воды. Растворимость является индивидуальной физико-химической характеристикой вещества. Итого можно отметить следующие факты, значимые для решения задач:
- Растворимость вещества при определенных условиях является постоянной величиной и приведена в качестве справочного данного.
- Растворимость при заданной температуре обычно приводится в формате массы растворенного вещества в 100 г чистого растворителя (воды). Не раствора, а именно чистого растворителя!
- Горячий насыщенный раствор содержит больше растворенного вещества, чем холодный.
- При охлаждении горячего насыщенного раствора из него начнет выпадать избыток растворенного вещества до достижения значения растворимости при более низкой температуре.
- Избыток растворенного вещества может выпасть как в безводном состоянии, так и в виде кристаллогидрата. Во втором случае он уносит с собой часть растворителя.
Рассмотрим основные расчетные приемы с участием растворимости.
Задача №1
Растворимость хлорида калия при 0˚С равна 28 г/100 г воды. Вычислите массовую долю соли в таком растворе.
Решение:
Пусть было 28 г соли и 100 г воды. Тогда можно найти массу раствора:
m(p-pa) = m(соли) + m(воды) = 28 + 100 = 128 г
Вычислим массовую долю соли в растворе:
ω(соли) = m(соли)/m(p-pa)·100% = 28/128·100% = 21,88%
Ответ: 21,88%
Задача №2
Вычислите растворимость сульфата аммония при 20˚С, если массовая доля соли в его насыщенном растворе при данной температуре равна 42,86%. Плотность раствора равна 1,25 г/мл.
Решение:
Пусть было 100 мл раствора. Тогда можно вычислить его массу:
m(p-pa) = ρ(p-pa)·V(p-pa) = 1,25·100 = 125 г
Далее вычислим массу соли и воды в растворе:
m(соли) = m(p-pa)·ω(соли)/100% = 125·42,86%/100% = 53,58 г
m(воды) = m(p-pa) — m(соли) = 125 – 53,58 = 71,42 г
Растворимость соли на 100 г воды можно найти по пропорции:
53,58 г соли – 71,42 г воды
х г соли – 100 г воды
х = 53,58·100/71,42 = 75 г
Ответ: 75 г/100 г воды.
Задача №3
Насыщенный при 20˚С раствор нитрата бария массой 218 г нагрели до 60˚С. Вычислите массу соли, которую можно дополнительно растворить в горячем растворе, если растворимость нитрата бария при 20˚С равна 9 г/100 г воды, а при 60˚С – 20 г/100 г воды.
Решение:
Вычислим массы соли и воды в изначальном растворе:
9 г соли – 109 г раствора
х г соли – 218 г раствора
х = 18 г
m1(соли) = 18 г
m(воды) = m(p-pa) – m1(соли) = 218 – 18 = 200 г
Далее вычислим, сколько соли может раствориться в имеющемся количестве воды при 60˚С:
20 г соли – 100 г воды
х г соли – 200 г воды
х = 40 г
m2(соли) = 40 г
Найдем массу соли, которую можно дополнительно растворить в горячем растворе:
Δm = m2(соли) — m1(соли) = 40 – 18 = 22 г
Ответ: 22 г.
Задача №4
Рассчитайте массу безводной соли, которая получится при охлаждении до 10˚С насыщенного при 80˚С раствора дихромата аммония массой 430 г. Растворимость соли при 80˚С равна 115 г/100 г воды, а при 10˚С – 25,5 г/100 г воды.
Решение:
Вычислим массу соли и воды в исходном растворе:
115 г соли – 215 г раствора
х г соли – 430 г раствора
х = 230 г
m1(соли) = 230 г
m(воды) = m(p-pa) – m1(соли) = 430 – 230 = 200 г
Далее вычислим, сколько соли может раствориться в имеющемся количестве воды при 10˚С:
25,5 г соли – 100 г воды
х г соли – 200 г воды
х = 51 г
m2(соли) = 51 г
Найдем массу соли, которая выпадет при охлаждении горячего раствора:
Δm = m1(соли) – m2(соли) = 230 – 51 = 179 г
Ответ: 179 г.
Задача №5
При охлаждении до 0˚С 31 г горячего насыщенного раствора сульфата меди (II) в осадок выпал медный купорос (CuSO4·5H2O). Определите массу образовавшегося кристаллогидрата, если растворимость сульфата меди (II) при 80˚С равна 55 г/100 г воды, а при 0˚С равна 15 г/100 г воды.
Решение:
Выразим массовую долю сульфата меди в составе медного купороса:
ω(CuSO4) = m(CuSO4)/m(CuSO4·5H2O)·100% = М(CuSO4)/М(CuSO4·5H2O)·100%
ω(CuSO4) = 160/250·100% = 64% или 0,64
Пусть масса осадка была х г. Тогда в его составе оказалось 0,64х г безводной соли. Вычислим массу безводной соли в изначальном растворе:
55 г соли – 155 г раствора
у г соли – 31 г раствора
у = 11
m1(соли) = 11 г
При охлаждении часть безводной соли перешла в состав кристаллогидрата. Охлажденный раствор по растворимости должен соответствовать справочным данным. Можно записать это так:
(11 – 0,64х)/(31 – х) = 15/115
115·(11 – 0,64х) = 15·(31 – х)
1265 – 73,6х = 465 – 15х
800 = 58,6х
х = 13,65 г
Ответ: 13,65 г.
«Методика решения задач на растворимость и
массовую долю вещества в растворе».
Выполнена учителем химии МБОУ СОШ № 18 г.
Ногинска Московской области Ломать Светланой Петровной.
1. Растворимость
– это способность вещества растворяться в воде или
другом растворителе. Количественно растворимость определяют коэффициентом
растворимости или просто растворимостью вещества.
Растворимость вещества X
(s)
– это масса вещества, которая может раствориться при данных условиях в 100г
растворителя с образованием насыщенного раствора:
S=
m(x)
/ m(H2O)
× 100 (г).
Массовая доля безводного
вещества Х в насыщенном растворе связана с его растворимостью соотношением:
W(X)
= s / s
+100
Для вычисления массы безводного
вещества в определенной массе насыщенного раствора можно вывести формулу:
W(x) = m(x) / m(р—ра)
=> m(x) / m(р—ра)=
s / s + 100 ; откуда
m (x) = (s / s + 100 ) ∙
m(р—ра).
Пример 1. Определите,
какая масса нитрата бария может раствориться в воде объемом 500 мл при 300С.
Растворимость нитрата бария при данной температуре составляет 14,2 г.
Решение:
Плотность воды составляет
1 г/мл, поэтому
m(Н2О)
= 500 ∙ 1 = 500 г.
Определяем массу нитрата
бария.
По формуле:
s = m(Ba(NO3)2) / m(H2O) ∙ 100 =>
ð m(Ba(NO3)2)
= s ∙ m(H2O) / 100 = 14,2 ∙ 500 / 100 = 71г.
Ответ:
m(Ba(NO3)2)
=71 г.
Пример 2. Массовая
доля хлорида аммония в насыщенном растворе при 300С
. равна 29,5%. Определите растворимость NH4Cl
при данной температуре.
Решение:
1. Вычисляем
массу соли в растворе массой 100г:
m(NH4Cl)
= m(р-ра)
∙ w(NH4Cl)
= 100 ∙ 0,295 = 29,5 г.
2.
Находим массу воды в растворе массой 100
г:
m(H2O)
= m(р-ра)
— m(NH4Cl)
= 100 -29,5 =70,5 г
3.
Определяем растворимость NH4Cl.
S30
= m(NH4Cl) / m(H2O) ∙ 100 = 29,5 / 70,5 ∙ 100 = 41,84 г.
Ответ:
S30
= 41,84 г.
Пример 3. Вычислите,
какая масса нитрата калия выпадет в осадок, если 100
г . насыщенного при температуре
700С раствора KNO3
охладить до температуры 00С. .
Растворимость нитрата калия составляет 138г при t0=700
и 13,3г при t0
ρ=00C.
Решение:
1. Находим
массу соли в насыщенном растворе массой 100 г при 700С.
По формуле: s70
= m70(KNO3)
/ m(H2O)
∙ 100 = m70(KNO3)
/ (m(р-ра)
– m70(KNO3))
∙100 => m70(KNO3)
= (s70
∙ (m(р-ра)
– m70(KNO3))
/ 100 = 138 ∙ ( 100 – m70(KNO3))
/ 100 ; отсюда m70(KNO3)
= 57, 98 г.
2. Находим
массу воды в насыщенном растворе массой 100 г:
m(H2O)
= m(р-ра)
— m70(KNO3)
= 100 – 57,98 = 42,02 г.
3. Находим
массу соли, выпавшей в осадок:
m(
осадка KNO3)
= m70(KNO3)
– m0(KNO3)
= 57,98 – 5,59 = 52,39 г.
Ответ: m(осадка
KNO3)
= 52,39 г.
2. Массовая
доля растворенного вещества – это отношение массы
растворенного вещества к общей массе раствора:
W(раств.в-ва)
= m(раств.в-ва)
/ m(р-ра)
( в долях единицы), откуда
m(раств.в-ва)
= m(р-ра)
∙ w(раств.в-ва);
W(раств.в-ва)
= m(раств.в-ва)
/ m(р-ра)
∙ 100% ( в процентах).
Эта формула указывает
массу безводного вещества, содержащегося в 100 г раствора. Раствор состоит из
растворенного вещества и растворителя.
m(р-ра)
= m(раств.в-ва)
+ m(H2O)
W(раств.в-ва)
= m(раств.в-ва)
/ (m(раств.в-ва)
+ m(H2O))/
Массу раствора можно
выразить через объем раствора (V)и
его плотность (ρ): m(р-ра) = V ∙ ρ. Откуда:
W(раств.в-ва)
= m(раств.в-ва)
/ V ∙ ρ ;
m(раств.в-ва)
= V
∙ ρ ∙ w(раств.в-ва).
Пример 1. Определите
массовую долю (%) соли в растворе, полученном при растворении 50 г соли в 200 г
воды.
Решение:
W(соли)
= m(соли)
/ (m(соли)
+ m(H2O)
= 50 / (50+ 200) = 0,2 или 20%
Ответ: W(соли)
=0,2 или 20%.
Пример 2. Вычислите
массу гидроксида калия в растворе объемом 600 мл и плотностью 1,082 г/мл, если
массовая доля гидроксида калия составляет 10% .
Решение:
W(KOH)
= m(KOH)
/ V∙
ρ;
m(KOH)
= w(KOH)
∙ V
∙ ρ
= 0,1 ∙ 600 ∙ 1,082 = 64,92 (г).
Ответ:
m(KOH)
= 64,92 (г).
Пример 3. Какую
массу воды надо прибавить к раствору гидроксида натрия массой 150 г с массовой
долей 10%, чтобы получить раствор с массовой долей 2%?
Решение:
m2(р-ра)
= m1(р-ра)
+ m
(воды)
w2(NaOH)
= m(NaOH)
/ m2
(р-ра) = m1(р-ра)
∙ w1(NaOH)
/ (m1(р-ра)
+ m(H2O));
0,02 = 150 ∙ 0,1 / (150 +
m(H2O);
m(H2O)
= 600г.
Ответ:
m(Н2О)
=600 г.
Пример 4. Какую
массу раствора с массовой долей уксусной кислоты 40% надо прибавить к 500 г
воды для получения раствора с массовой долей уксусной кислоты 15%?
Решение:
W2(CH3COOH)
= m(р-ра)
∙ m1(CH3COOH)
/ (m(р-ра)
+ 500;
0,15 = m(р-ра)
∙ 0,4 / (m(р-ра) +500 ;
m(р-ра)
= 300 г.
Ответ:
m(р-ра)
= 300 г.
Пример 5. Какой
объем раствора с массовой долей гидроксида калия 50% ( плотностью 1,538 г/ мл)
требуется для приготовления 3 л раствора гидроксида калия с массовой долей 6% (
плотностью 1,048 г/мл)?
Решение:
W2
(KOH)
= V1
∙ ρ1
∙ w1(KOH)
/ V2
∙ ρ2 ;
0,06 = 0,5 ∙ 1,538 ∙ V1
/ 3000 ∙ 1,048;
0,06 ∙ 3000 ∙ 1,048 = 0,5
∙ 1,538 ∙ V1
;
V1
= 245,3 мл.
Ответ:
V1
= 245,3 мл.
3 марта 2022
В закладки
Обсудить
Жалоба
Методика решения задач на растворимость и массовую долю вещества в растворе
Основные формулы и несколько примеров задач с разбором.
mr-rast.docx
mr-rast.pdf
Определите, какая масса нитрата бария может раствориться в воде объемом 500 мл при 300С. Растворимость нитрата бария при данной температуре составляет 14,2 г.
Массовая доля хлорида аммония в насыщенном растворе при 300С равна 29,5%. Определите растворимость NH4Cl при данной температуре.
Вычислите, какая масса нитрата калия выпадет в осадок, если 100 г. насыщенного при температуре 700С раствора KNO3 охладить до температуры 00С. Растворимость нитрата калия составляет 138г при t0=700 и 13,3г при t0 ρ=00C.
Определите массовую долю (%) соли в растворе, полученном при растворении 50 г соли в 200 г воды.
Вычислите массу гидроксида калия в растворе объемом 600 мл и плотностью 1,082 г/мл, если массовая доля гидроксида калия составляет 10% .
Какую массу воды надо прибавить к раствору гидроксида натрия массой 150 г с массовой долей 10%, чтобы получить раствор с массовой долей 2%?
Какую массу раствора с массовой долей уксусной кислоты 40% надо прибавить к 500 г воды для получения раствора с массовой долей уксусной кислоты 15%?
Какой объем раствора с массовой долей гидроксида калия 50% (плотностью 1,538 г/ мл) требуется для приготовления 3 л раствора гидроксида калия с массовой долей 6% ( плотностью 1,048 г/мл)?
- Задачи на растворимость:
- Базовые знания (2 шт)
- Безводные соли (3 шт)
- Кристаллогидраты (4 шт)
- Задачи на кислые соли:
- Задачи (6 шт)
- Задачи на кристаллогидраты:
- Задача 1.
- Задача 2.
- Задача 3.
- Задача 4.
- Задачи на массовую долю и избыток-недостаток:
- Задача 1.
- Задача 2.
Тип 1. Задачи на базовые знания понятия «растворимость»
Задача 1. Массовая доля нитрата серебра в насыщенном при 20°С растворе равна 69,5%. Вычислите массу этой соли, которая растворится в 100 г воды при этой же температуре.
Источник: Н.Е. Кузьменко, В.В, Еремин. Задачник по химии. 1999 г. Задача 270.
Ответ: 228 г AgNO3.
Решение (pdf файл)
Задача 2. Растворимость хлорида натрия при 25°С равна 36,0 г в 100 г воды. Определите массовую долю соли в насыщенном растворе при этой температуре.
Источник: Н.Е. Кузьменко, В.В, Еремин. Задачник по химии. 1999 г. Задача 269.
Ответ: 26,5% NaCl.
Решение (pdf файл)
Решение задач на растворимость
В 2022г в ЕГЭ по химии произойдет ряд изменений. Одним из таких изменений будет замена задачи №27 на растворы на задачу с использованием понятия «растворимость». Данный тренажер предлагает разобрать задачи подобного типа, а также задачи для самостоятельного решения.
Задача 1. В таблице приведена растворимость бромида калия (в граммах KBr на 100 г воды) при различной температуре.
|
Температура,оС |
10 |
20 |
30 |
40 |
60 |
80 |
100 |
|
Растворимость, г на 100 г воды |
60 |
65 |
71 |
76 |
86 |
95 |
103 |
Определите, сколько граммов бромида калия выпадет в осадок при охлаждении 250 г насыщенного при 80 оС раствора до температуры 20 оС. (Запишите число с точностью до целых).
Решение: 1) Введем обозначения: m1 и m2 — масса раствора при температуре 80 и 20 градусов по Цельсию соответственно; m1 при этом по условию задачи равно 250 г.; m(c1) и m(c2) — масса растворенной соли в растворе при указанных температурах; m(в) — масса воды в растворах при обеих температурах (обратим внимание, что она постоянна); m(о) — масса осадка соли, выпавшего при охлаждении насыщенного раствора до 20 градусов по Цельсию. Зная максимальную растворимость соли в воде при 80 градусах, можем перевести массу воды в соответствующую массу раствора и найти m(c1): в (100+95) г. насыщенного раствора растворено 95 г. соли, а в 250 г. — m(c1) г. соли. Отсюда m(c1) = (95*250)/195 = 121,8 г. KBr 2) Найдем далее массу воды: m(в) = 250 — 121,8 = 128,2 г. 3) Теперь мы можем составить другую очевидную пропорцию для раствора, насыщенного при температуре 20 градусов по Цельсию: в 100 г воды растворено 65 г. соли, в 128,2 г. воды — m(c2) г. соли. То есть, m(c2) = (128,2*65)/100 = 83,33 г. KBr 4) Остается найти массу осадка как разность масс растворенной соли при двух температурах: m(о) = m(c1) – m(c2) = 121,8 — 82,33 = 38,47 г. или, округляя до целого числа, 38 г. KBr
Задача 2 Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
Определяем растворимость:
S =mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Задача 3 Растворимость карбоната натрия при 20*С составляет 21,8 г в 100 г воды, а при
40*С – 48,8 г. Вычислите массу кристаллической соды, которая выпадет в осадок, если 200
г насыщенного при 40*С раствора охладить до 20*С.
Решение:
Известна масса раствора, а не воды при 40*С, пропорцию необходимо
составлять для всего раствора. Имея растворимость 48,8 г соли на 100 г воды; получаем 48,8г соли на 148,8 г, всего раствора (100 + 48,8 = 148,8 г).
Составим пропорцию для первого раствора:
48,8 (соль) — 148,8 (раствор)
x (соль) — 200 (раствор)
Решим эту пропорцию: х = 65,59 г (масса соли в первом растворе). Вычтем массу соли из
массы всего раствора, чтобы получить массу воды:
m(воды) = 200 – 65,59 = 134,41 г.
M(Na2CO3) = 106 г/моль
M(Na2CO3*10H2O) = 286 г/моль.
Если в результате охлаждения раствора в осадок выпадает кристаллогидрат, то необходимо учитывать воду, входящую в его состав. Также необходимо помнить, что количество безводной соли равно количеству кристаллогидрата в молях, а количество воды будет в данном случае в 10 раз больше (так как образуется Na2CO3*10H2O):
n(Na2CO3) = n(Na2CO3*10H2O) и n(H2O) = 10*n(Na2CO3).
Для решения задачи обозначим за x количество Na2CO3, выпавшего в осадок (m = 106x).
Масса воды, которая идет в осадок: m = 10*18х г.
21,8 г (соль) — 100 г (H2O)
(65,59 – 106x) — (134,41 – 10*18х)
Решим её: (65,59 – 106x) = (134,41 – 10*18х) 21,8/100. В итоге находим, что х = 0,545 моль,
т.е. это количество соли выпало в осадок. Теперь можем легко найти массу осадка:
m(Na2CO3*10H2O) = nM = 0,545*286 = 155,87 г
Задача 4. 181,1 г раствора нитрата меди (II), содержащего 103,4 г соли, охладили до 10°С. Вычислите массу выкристаллизовавшейся шестиводной соли, если растворимость нитрата меди (II) при 10°С равна 100 г на 100 г воды.
Решение : Если в результате охлаждения раствора в осадок выпадает кристаллогидрат, то необходимо учитывать воду, входящую в его состав. Также необходимо помнить, что количество безводной соли равно количеству кристаллогидрата в молях, а количество воды будет в данном случае в 6 раз больше (так как образуется шестиводная соль, Cu(NO3)2×6H2O): n(Cu(NO3)2) = n(Cu(NO3)2×6H2O) и n(H2O) = 6×n(Cu(NO3)2). Для решения задачи обозначим за x количество Cu(NO3)2, выпавшего в осадок (m = 188×x). Масса воды, которая идет в осадок: m = (6×18×х) г. Следовательно, в растворе при 10°С осталось (103,4 – 188×x) г соли и (84,7 – 6×18×х) г воды. Составим пропорцию: 100 г (соль) — 100 г (H2O) (103,4 – 188×x) — (84,7 – 6×18×х) Решим её: (103,4-188×x) = (84,7 — 6×18×х) ×100/100. х = 0,234 моль, т.е. это количество соли выпало в осадок. Теперь можем легко найти массу осадка:
m(Cu(NO3)2×6H2O) = n×M = 0,234×(188+6×18) = 69,26 г. Ответ: m(осадка) = 69,26 г.
Задача 5 Растворимость сульфата натрия при 20°С составляет 19,2 г в 100 г воды, а при 30°С – 40,8 г воды. Вычислите массу глауберовой соли Na2SO4×10H2O, которая выпадет в осадок, если 500 г насыщенного при 30°С раствора охладить до 20°С.
Решение: Так как нам известна масса раствора, а не воды при 30°С, пропорцию необходимо составлять для всего раствора. Имея растворимость 40,8 г соли на 100 г воды; получаем 40,8 г соли на 140,8 г всего раствора (100 + 40,8 = 140,8 г). Составим пропорцию для первого раствора: 40,8 (соль) — 140,8 (раствор) x (соль) — 500 (раствор) х = 144,89 г (масса соли в первом растворе). Вычтем массу соли из массы всего раствора, чтобы получить массу воды: m(воды) = 500 – 144,89 = 355,11 г. M(Na2SO4) = 142 г/моль M(Na2SO4×10H2O) = 322 г/моль. Если в результате охлаждения раствора в осадок выпадает кристаллогидрат, то необходимо учитывать воду, входящую в его состав. Также необходимо помнить, что количество безводной соли равно количеству кристаллогидрата в молях, а количество воды будет в данном случае в 10 раз больше (так как образуется Na2SO4×10H2O): n(Na2SO4) = n(Na2SO4×10H2O) и n(H2O) = 10×n(Na2SO4). Для решения задачи обозначим за x количество Na2SO4, выпавшего в осадок (m = 142×x). Масса воды, которая идет в осадок: m = (10×18×х) г. Следовательно, в растворе при 20°С осталось (144,89 – 142×x) г соли и (355,11 – 10×18×х) г воды. Составим пропорцию для этого раствора: 19,2 г (соль) — 100 г (H2O) (144,89 – 142×x) — (355,11 – 10×18×х) Решим её: (144,89 – 142×x) = (355,11 – 10×18×х)×19,2/100. х = 0,71 моль, т.е. это количество соли выпало в осадок. Теперь можем легко найти массу осадка: m(Na2SO4×10H2O) = n×M = 0,71×322 = 228,62 г.
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор
Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.
Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
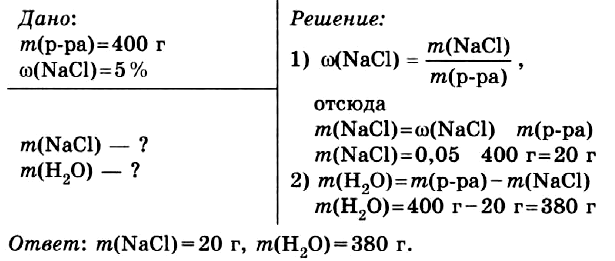
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради
Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради
Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии