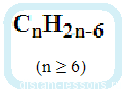- Назад
- 1
- 2
- Далее
- Страница 1 из 2
Рекомендуемые сообщения
Решение задач, рефераты, курсовые!
Онлайн сервис помощи учащимся.
Цены в 2-3 раза ниже!
-
- Поделиться
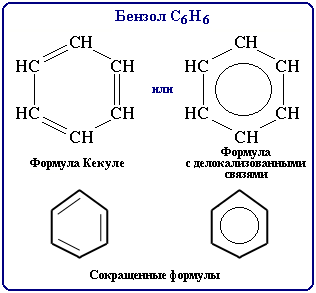
Здравствуйте! Я сдаю ЕГЭ. Нам в школе сказали, что строение бензола нельзя рисовать так (на рисунке 2 рисунок сверху справа, под рисунком написано «Формула с делокализованными связями). Во всех учебниках смотрела, нарисовано так. Не понимаю.
Ссылка на комментарий
-
- Поделиться
Здравствуйте! Я сдаю ЕГЭ. Нам в школе сказали, что строение бензола нельзя рисовать так (на рисунке 2 рисунок сверху справа, под рисунком написано «Формула с делокализованными связями). Во всех учебниках смотрела, нарисовано так. Не понимаю.
Можно рисовать. И так, и так, и так, и так.
Ссылка на комментарий
-
- Поделиться
Можно рисовать. И так, и так, и так, и так.
Можно. Но на ЕГЭ это считают ошибкой. Мне за это не поставили баллы за все задание.
P.s. Нужно поступать по внутренним экзаменам.
Ссылка на комментарий
-
- Поделиться
Можно. Но на ЕГЭ это считают ошибкой. Мне за это не поставили баллы за все задание.
Вот тут ничего не могу возразить. Территория ЕГЭ — это Искажённые Миры, где есть только один закон — «В Искажённых Мирах не действует ни один закон. В том числе и этот.»
Изменено 5 Декабря, 2017 в 17:59 пользователем yatcheh
Ссылка на комментарий
- Автор
-
- Поделиться
Можно. Но на ЕГЭ это считают ошибкой. Мне за это не поставили баллы за все задание.
P.s. Нужно поступать по внутренним экзаменам.
Без ЕГЭ же на внутренние экзамены не пускают. Это вроде только для тех, кто поступает после колледжей?
Ссылка на комментарий
-
- Поделиться
Без ЕГЭ же на внутренние экзамены не пускают. Это вроде только для тех, кто поступает после колледжей?
Нет. Это для всех кто нашел в себе внутренние силы сбросить с себя оковы ЕГЭ.
Ссылка на комментарий
-
- Поделиться
А как я, например, не сдав ЕГЭ пойду и скажу, что я хочу сдавать только внутренние экзамены у вас? Разве у меня есть выбор? Или вы имеете в виду через олимпиады школьников? Это тоже риск. Если не стать призером минимум, без подготовки к егэ я могу потерять все же.
Ссылка на комментарий
-
- Поделиться
Зачастую в работах на ЕГЭ можно увидеть такую формулу бензола:
А то и такую:
Вот такие писать нельзя
Проще обходиться скелетной
Что-то наш редактор формул картинок не показывает
Изменено 6 Декабря, 2017 в 21:15 пользователем M_GM
-
1
Ссылка на комментарий
-
- Поделиться
Что-то наш редактор формул картинок не показывает
Антивирь ругаеццо при попытке открыть изображение во вкладке — небезопасное, грит, соединение.
Ссылка на комментарий
- 4 недели спустя…
-
- Поделиться
Зачастую в работах на ЕГЭ можно увидеть такую формулу бензола:
А то и такую:
Вот такие писать нельзя
Проще обходиться скелетной
Что-то наш редактор формул картинок не показывает
Вот это я понимаю! На самом деле,как во 2 -м случае нельзя писать! А вот почему и как 1-й нельзя, непонятно…( В общем, yatcheh четко сказал!)))
Изменено 2 Января, 2018 в 17:23 пользователем Заряночка
Ссылка на комментарий
- Назад
- 1
- 2
- Далее
- Страница 1 из 2
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
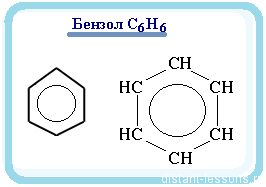
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец.
Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6.
Общая формула их гомологического ряда — CnH2n-6.
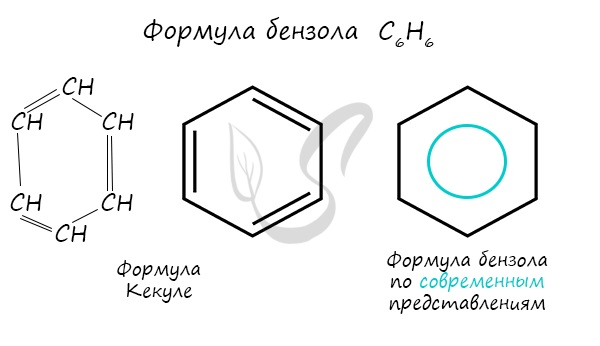
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла
объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям
двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
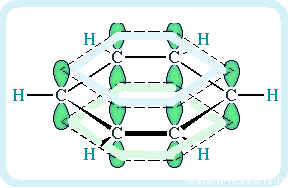
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2
гибридизации. Валентный угол — 120°.
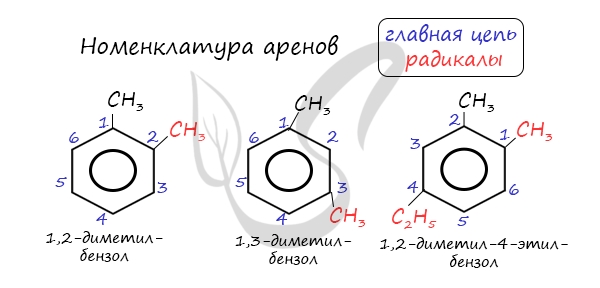
Номенклатура и изомерия аренов
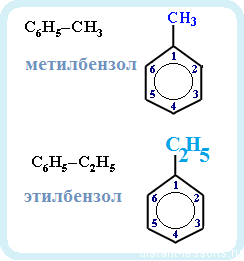
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол),
этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей,
то выбирают кратчайший путь между ними.
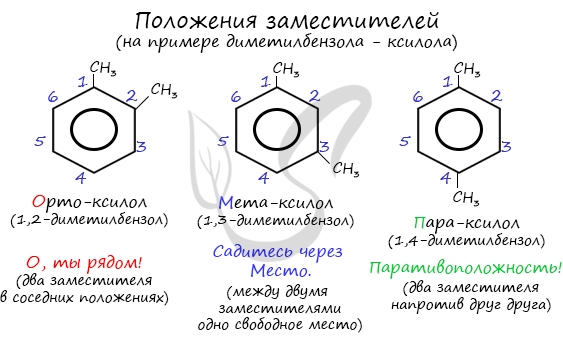
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном
кольце могут располагаться в разных положениях.
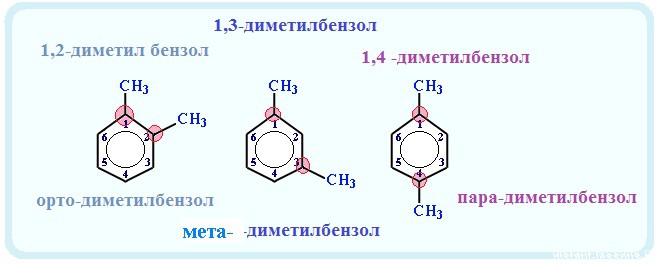
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается
приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 
Получение аренов
Арены получают несколькими способами:
- Реакция Зелинского (тримеризация ацетилена)
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический
углеводород — бензол.
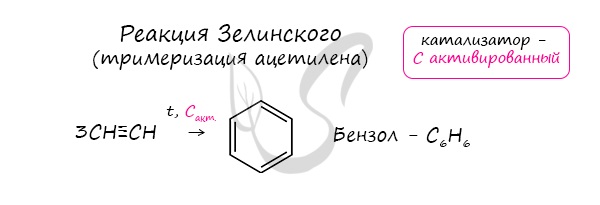
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге
можно добиться образования 1,3,5-триметилбензола.
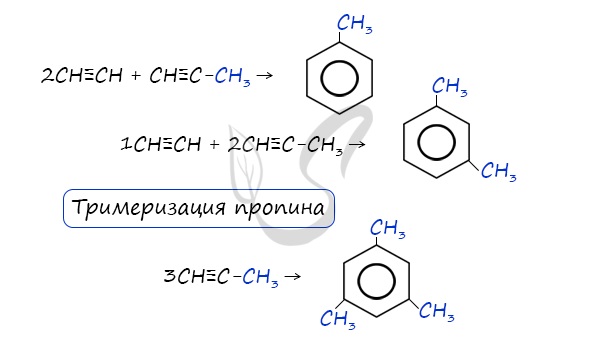
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная
структура алкана замыкается в цикл, отщепляется водород.
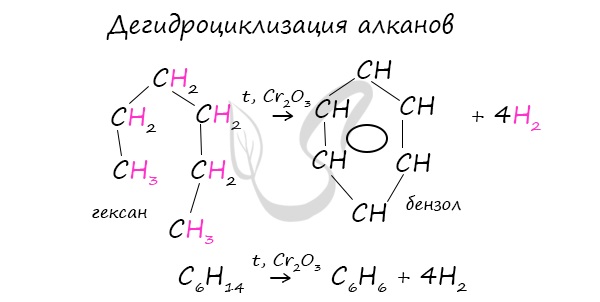
При дегидроциклизации гептана получается толуол.
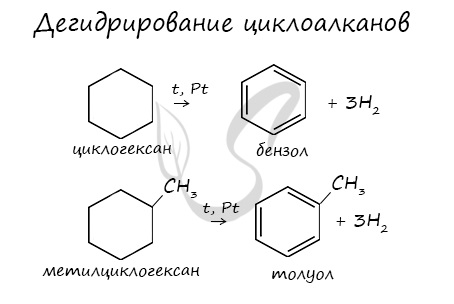
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен,
с теми же заместителями, которые были у циклоалкана.
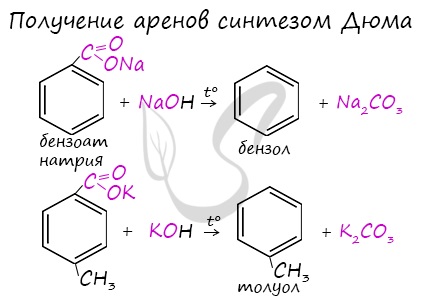
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность
делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и
раствор перманганата калия.
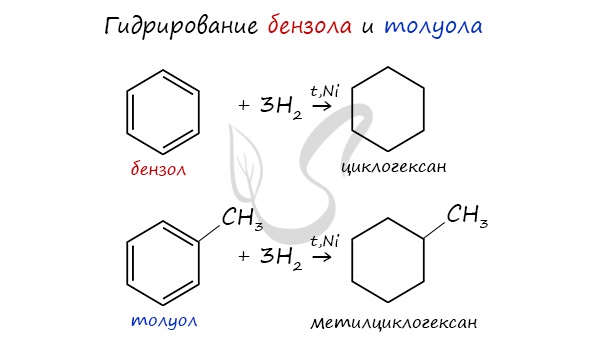
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце
и превратить арен в циклоалкан.
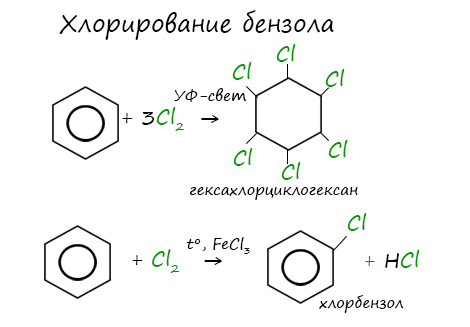
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор,
то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
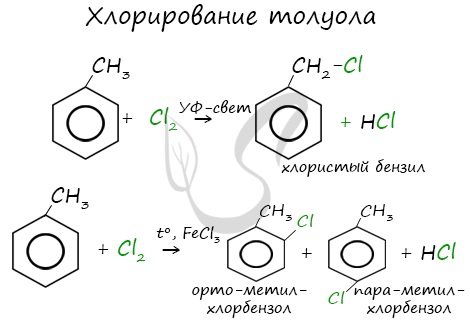
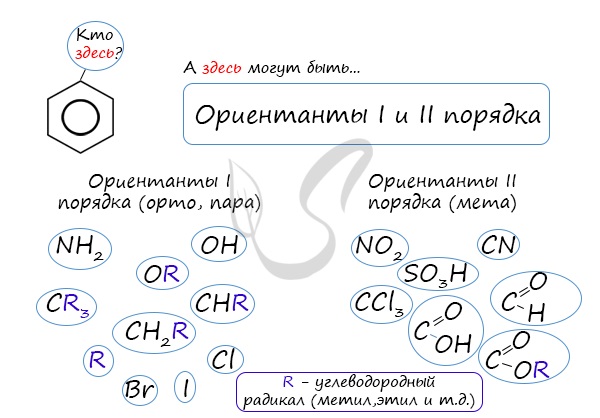
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2,
CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3,
CHO, COOH, COOR.
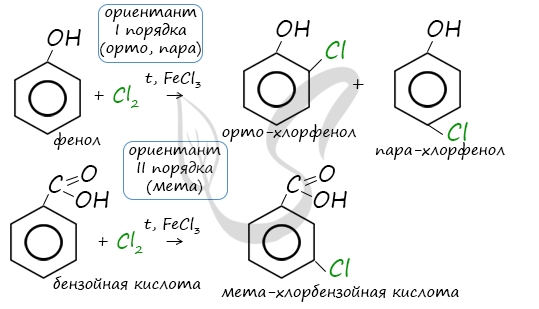
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях.
А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
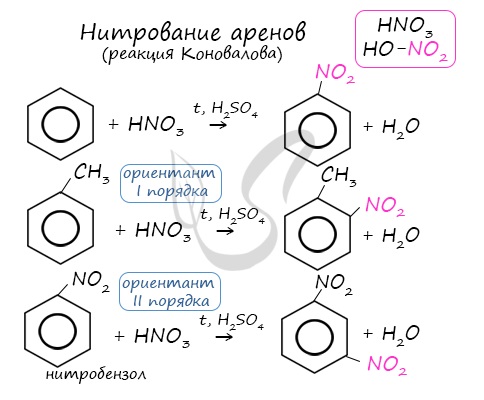
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты,
обладающей водоотнимающими свойствами.
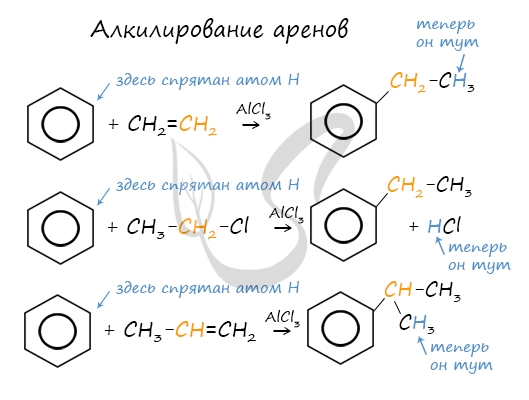
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще
всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом
углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
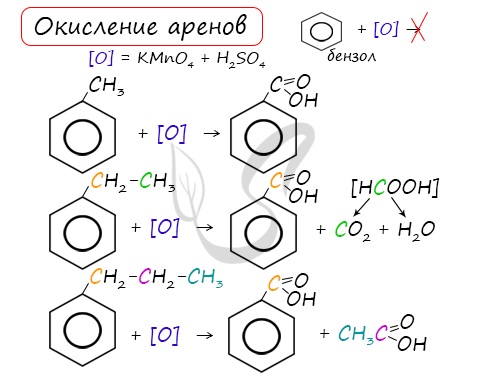
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
2C6H6 + 15O2 → 12CO2 + 6H2O
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной
кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
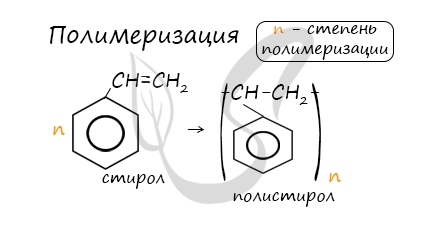
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Ароматические углеводороды имеют циклическое строение. Первый представитель этого ряда – бензол (C6H6). Формулу, отражающую строение вещества, впервые предложил химик Кекуле в 1865 году. По рассказам ученого, он долго размышлял над загадкой бензола. Однажды ночью ему приснился змей, укусивший себя за хвост. Утром структурная формула бензола уже была составлена. Она представляла собой кольцо, состоящее из 6 углеродных атомов. Три из них были при двойной связи.
Строение бензола
Углерод в составе ароматических углеводородов образует правильный шестиугольник. Иногда при записи уравнений реакций его изображают вытянутым в вертикальном направлении. Эта группа атомов получила специальное название – бензольное ядро. Подтверждением циклического строения бензола является его получение из трех молекул ацетилена – непредельного углеводорода с тройной связью. Ароматические углеводороды тоже являются непредельными и проявляют некоторые свойства, характерные для алкенов. По этой причине в бензольном кольце тремя черточками, идущими параллельно граням, отмечают наличие двойной связи. Такая формула бензола не в полной мере отражает состояние углеродных атомов в молекуле.
Бензол: формула, отражающая истинное строение
В реальности связи между углеродом в кольце равноценны между собой. Среди них не удалось выделить одинарные и двойные. Объясняется такая особенность электронным строением бензола, при котором углерод в ядре находится в sp2-гибридизованном состоянии, соединен с соседями по кольцу и водородом тремя обычными одинарными связями. В этом случае возникает шестиугольник, в котором находятся в одной плоскости 6 атомов углерода и 6 — водорода. Только электронные облака четвертых p-электронов, не участвующих в гибридизации, расположены иначе. Их форма напоминает гантели, центр приходится на плоскость кольца. А утолщенные части находятся сверху и снизу. В таком случае над бензольным ядром и под ним расположены две электронные плотности, возникшие при перекрывании облаков p-электронов. Возникает общая химическая связь для углерода в кольце.
Свойства бензольного кольца
За счет общей электронной плотности сокращаются расстояния между углеродом в кольце. Они равны 0,14 нм. Если бы в ядре бензола существовали одинарные и двойные связи, то было бы два показателя: 0,134 и 0,154 нм. Истинная структурная формула бензола не должна содержать простых и двойных связей. Поэтому ароматические углероды причисляют к непредельным органическим соединениям лишь формально. По составу они напоминают алкены, но могут вступать в реакции замещения, что характерно для предельных углеводородов. Ароматическое ядро бензола обладает значительной устойчивостью к окислителям. Все перечисленные особенности позволяют считать кольцо особым типом связи — не двойной и не одинарной.
Как изобразить формулу бензола?
Правильной является формула бензола не с тремя двойными связями, как у Кекуле, а в виде шестиугольника с кружком внутри. Он символизирует общую принадлежность 6 электронов.
Находит подтверждение симметрия строения и в свойствах вещества. Кольцо бензола является устойчивым, имеет значительную энергию сопряжения. Свойства первого представителя ароматических углеводородов проявляются у его гомологов. Каждый из них может быть представлен как производное, в котором происходит замещение водорода на различные углеводородные радикалы.
Бензол и его гомологи
04-Дек-2012 | комментариев 6 | Лолита Окольнова
Бензол и его гомологи
Бензол — первый представитель класса аренов — ароматических углеводородов.
Почему «ароматических«? Потому что большинство гомологов бензола, да и сам бензол, имеют сладковатый запах, при этом довольно ядовиты.
Обычно бензол рисуют вот таким «скворечником» или пишут общую формулу С6H6.
Почему рисуют кружок в шестиугольнике? Это обозначение того, что все связи в молекуле одинаковые.
Но! Каждая связь — это не просто черточки на бумаге. Каждая связь имеет определенные физические характеристики. Например, длинна связи.
Двойная связь короче одинарной. При исследовании молекулы бензола оказалось, что:
- все связи одинаковы, т.е. нет разделения на двойные и одинарные;
- эти связи представляют собой промежуточный вариант между двойной и одинарной
Поэтому рисуют кружок — обозначение одинаковых связей по всей молекуле.
Если рассмотреть строение молекулы более детально, с точки зрения электронной плотности, то картина будет примерно следующая — образуется общее ∏-электронное облако и оно распространено (=делокализовано) по всей молекуле:
Общая формула аренов:
Гомологический ряд : С6H6, C7H8, C8H10 и т.д.
Номенклатура гомологов бензола:
Название углеводорода складывается из двух частей:
(количество и указание места прикрепления) и название радикала + «бензол»
Если в молекуле арена есть несколько одинаковых радикала, то применяются приставки: орто-, мета— и пара-
- орто- (о-) — два радикала находятся рядом — при соседних атомах углерода (1,2-ди «радикал» бензол);
- мета- (м-) — два радикала находятся через один атом углерода (1,3 — ди «радикал» бензол)
- пара- (п-) — два радикала находятся друг против друга — через 2 атома углерода (1,4- ди «радикал» бензол)
Все эти вещества изомерны друг другу. У бензола и его гомологов довольно много изомеров — это обусловлено как количеством атомов, так и геометрией молекулы.
Названия радикалов:
С6H5 — фенил-
С6H5CH2- бензил-
Тривиальные названия:
- толуол = метилбензол (С6H5CH3);
- ксилол = все диметилбензолы ( C6H4(CH3)2 );
- кумол = изопропилбензол (C6H5-CH(CH3)2 )
Дальше мы рассмотрим:
- Химические свойства бензола и его гомологов
- Получение
- в ЕГЭ это вопрос А13 и А14 — Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Категории:
|
Обсуждение: «Бензол и его гомологи»
(Правила комментирования)
Урок №19. Электронное и пространственное строение бензола. Изомерия и номенклатура.
Ароматические углеводороды (Арены) – это органические соединения, в молекулах
которых имеется одно или несколько бензольных колец. Бензольное кольцо, или ядро, –
циклическая группа атомов углерода с особым характером связей.
Общая формула — CnH2n-6 , где n >=6
1. Представители:
МОНОЯДЕРНЫЕ
1. С6H6 – бензол, родоначальник гомологического
ряда аренов

2. С6H5 – CH3 – толуол (метилбензол)
3. С6H5 – CH=СH2 – стирол (винилбензол)
4. Ксилол (орто-, пара- , мета-ксилол)
МНОГОЯДЕРНЫЕ (КОНДЕНСИРОВАННЫЕ)
1. Нафталин
2. Антрацен
2. Строение ароматических углеводородов:
SP2 –гибридизация:
1.
Плоское тригональное строение
2.
Угол – HCH — 120°
3.
Связи σ, π
4.
В бензоле нет простых и двойных связей,
под влиянием единой π – электронной системы расстояние между центрами атомов
углерода становится одинаковым – 0,139 нм, ( нанометры = 10-9 метра), все связи
полуторные
Первую структурную
формулу бензола предложил в 1865 г. немецкий химик Ф.А.Кекуле:
Атомы С в молекуле
бензола образуют правильный плоский шестиугольник, хотя часто его рисуют
вытянутым.
Приведенная формула
правильно отражает равноценность шести атомов С, однако не объясняет ряд особых
свойств бензола. Например, несмотря на ненасыщенность, он не проявляет
склонности к реакциям присоединения: не обесцвечивает бромную воду и раствор
перманганата калия, т.е. ему не свойственны типичные для непредельных
соединений качественные реакции.
В структурной формуле
Кекуле – три одинарные и три двойные чередующиеся углерод-углеродные
связи. Но такое изображение не передает истинного строения молекулы. В
действительности углерод-углеродные связи в бензоле равноценны. Это объясняется
электронным строением его молекулы.
Каждый атом С в молекуле
бензола находится в состоянии sp2-гибридизации. Он связан с двумя
соседними атомами С и атомом Н тремя σ -связями. В результате
образуется плоский шестиугольник, где все шесть атомов С и все σ -связи С–С и С–Н лежат в одной плоскости
(угол между связями С–С равен 120o).
Рис. Схема образования
-связей в молекуле бензола.
Третья p-орбиталь атома
углерода не участвует в гибридизации. Она имеет форму гантели и ориентирована
перпендикулярно плоскости бензольного кольца. Такие p-орбитали соседних атомов
С перекрываются над и под плоскостью кольца.
Рис. Негибридные 2p-орбитали углерода в молекуле бензола
В результате шесть p-электронов
(всех шести атомов С) образуют общее π -электронное облако и единую
химическую связь для всех атомов С.
Рис. Молекула бензола. Расположение π -электронного облака
π -Электронное
облако обусловливает сокращение расстояния между атомами С.
В молекуле бензола они
одинаковы и равны 0,139 нм. В случае простой и двойной связи эти расстояния
составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет
чередования простых и двойных связей, а существует особая связь –
“полуторная” – промежуточная между простой и двойной, так называемая ароматическая
связь. Чтобы показать равномерное распределение p-электронного облака в
молекуле бензола, корректнее изображать ее в виде правильного шестиугольника с
окружностью внутри (окружность символизирует равноценность связей между атомами
С):
2. Номенклатура
3. Изомерия
Изомерия обусловлена
изомерией углеродного скелета имеющихся радикалов и их взаимным положением в
бензольном кольце.
Положение двух заместителей указывают с помощью приставок:
орто-
(о-), если они находятся у соседних углеродных атомов (положение 1, 2-),
мета-
(м-) для разделенных одним атомом углерода (1, 3-)
пара- (п-) для
находящихся напротив друг друга (1, 4-).
Например, для диметилбензола (ксилола):
орто-ксилол (1,2-диметилбензол)
мета-ксилол (1,3-диметилбензол)
пара-ксилол (1,4-диметилбензол)
Радикалы ароматических
углеводородов называют арильными радикалами.
Радикал С6Н5
— называется фенил.
ЦОР:
Ароматические углеводороды
Единая электронная система в молекуле бензола
ТРЕНАЖЁРЫ:
Изомерия гомологов бензола
Номенклатура гомологов бензола
Чтобы поделиться, нажимайте
Ароматические углеводороды (Арены) – это органические соединения, в молекулах которых имеется одно или несколько бензольных колец. Бензольное кольцо, или ядро, – циклическая группа атомов углерода с особым характером связей.
Общая формула — CnH2n-6
1. Представители:
МОНОЯДЕРНЫЕ
1. С6H6 – бензол, родоначальник гомологического ряда аренов
2. С6H5 – CH3 – толуол (метилбензол)
3. С6H5 – CH=СH2 – стирол (винилбензол)
4. Ксилол (орто-, пара- , мета-ксилол)
МНОГОЯДЕРНЫЕ (КОНДЕНСИРОВАННЫЕ)
1. Нафталин
2. Антрацен

2. Строение ароматических углеводородов
1. Плоское тригональное строение
2. Угол – HCH — 120°
3. Связи σ, π
4. В бензоле нет простых и двойных связей, под влиянием единой π – электронной системы расстояние между центрами атомов углерода становится одинаковым – 0,139 нм, все связи полуторные
Первую структурную формулу бензола предложил в 1865 г. немецкий химик Ф.А.Кекуле:
Атомы С в молекуле бензола образуют правильный плоский шестиугольник, хотя часто его рисуют вытянутым.
Приведенная формула правильно отражает равноценность шести атомов С, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, он не проявляет склонности к реакциям присоединения: не обесцвечивает бромную воду и раствор перманганата калия, т.е. ему не свойственны типичные для непредельных соединений качественные реакции.
В структурной формуле Кекуле – три одинарные и три двойные чередующиеся углерод-углеродные связи. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны. Это объясняется электронным строением его молекулы.
Каждый атом С в молекуле бензола находится в состоянии sp2-гибридизации. Он связан с двумя соседними атомами С и атомом Н тремя σ -связями. В результате образуется плоский шестиугольник, где все шесть атомов С и все σ -связи С–С и С–Н лежат в одной плоскости (угол между связями С–С равен 120o).
Рис. Схема образования -связей в молекуле бензола.
Третья p-орбиталь атома углерода не участвует в гибридизации. Она имеет форму гантели и ориентирована перпендикулярно плоскости бензольного кольца. Такие p-орбитали соседних атомов С перекрываются над и под плоскостью кольца.
Рис. Негибридные 2p-орбитали углерода в молекуле бензола
В результате шесть p-электронов (всех шести атомов С) образуют общее π -электронное облако и единую химическую связь для всех атомов С.
Рис. Молекула бензола. Расположение π -электронного облака
π -Электронное облако обусловливает сокращение расстояния между атомами С.
В молекуле бензола они одинаковы и равны 0,139 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – “полуторная” – промежуточная между простой и двойной, так называемая ароматическая связь. Чтобы показать равномерное распределение p-электронного облака в молекуле бензола, корректнее изображать ее в виде правильного шестиугольника с окружностью внутри (окружность символизирует равноценность связей между атомами С):
Гомологи бензола. Номенклатура и изомерия
Гомологи бензола – соединения, образованные заменой одного или
нескольких атомов водорода в молекуле бензола на углеводородные
радикалы (R):
С6Н5—R (алкилбензол), R—С6Н4—R (диалкилбензол) и т.д.
Общая формула гомологического ряда бензола СnH2n-6 (n не менее 6).
Номенклатура. Широко используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
С6Н5—СH3 С6Н5—С2H5 С6Н5—С3H7
метилбензол этилбензол пропилбензол
(толуол)
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими.
Для дизамещенных бензолов R-С6Н4—R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками:
орто— (о-) заместители у соседних атомов углерода кольца, т.е. 1,2;
мета— (м-) заместители через один атом углерода (1,3);
пара— (п-) заместители на противоположных сторонах кольца (1,4).
Ароматические одновалентные радикалы имеют общее название «арил«.
Из них наиболее распространены в номенклатуре органических соединений два: С6Н5— фенил и С6Н5-СH2— бензил.
Изомерия (структурная):
1) положения заместителей для ди-, три— и тетра-замещенных бензолов (например, о-, м— и п-ксилолы,;
2) углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода;
3) изомерия заместителей, начиная с С2Н5.
Например, молекулярной формуле С8Н10 соответствует 4 изомера: три ксилола СH3—С6Н4—СH3 (о-, м-, п-) и этилбензол С6Н5—С2H5.
Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
Строение аренов
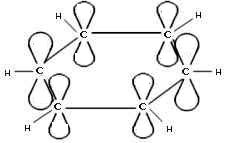
Рассмотрим подробно строение молекулы бензола. В ней присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н.
Структурная формула бензола:
Сокращенная структурная формула бензола:
Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp2-гибридизации.
Каждый атом углерода в молекуле бензола связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы равны 1200:
Атомы углерода и водорода в молекуле бензола, соединенные σ-связями, образуют правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
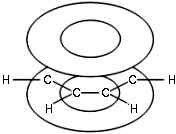
Негибридные р-орбитали атомов углерода образуют единую циклическую (ароматическую) π-систему – единое электронное облако над и под плоскостью кольца.
Соответственно, на самом деле все связи между атомами углерода в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной (полуторная связь).
Соответственно, в молекуле бензола между углеродными атомами нет обычных одинарных и двойных связей, а все они выравнены (делокализованы).
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника и кружка внутри него, который обозначает делокализованные π-связи:
Гомологический ряд аренов
Простейший представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
Еще один представитель гомологического ряда бензола – этилбензол:
Изопропилбензол (кумол):
Номенклатура аренов
Первый представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
При составлении названия ароматического соединения за главную цепь принимают молекулу бензола. Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше).
Например, 1,2-диметилбензол
Если в молекуле бензола присутствуют два заместителя, то также используют систему специальных приставок:
- орто— (о-) если заместители расположены у соседних атомов углерода в бензольном кольце (1,2-положения);
- мета— (м-) заместители расположены через один атом углерода (1,3-положения);
- пара— (п-) заместители расположены на противоположных сторонах кольца (1,4-положения).
Для названия многих производных бензола используют тривиальные названия:
| Структурная формула | Системное название | Тривиальное название |
 |
Метилбензол | Толуол |
 |
1,2-Диметилбензол | орто-Ксилол |
 |
Изопропилбензол | Кумол |
Названия радикалов, содержащих ароматическое кольцо:
Изомерия аренов
Структурная изомерия
Для гомологов бензола характерна структурная изомерия .
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
- Изомерия углеродного скелета в боковой цепи характерна для ароматических углеводородов, которые содержат три и более атомов углерода в боковой цепи.
Формуле С9Н12 соответствуют изомеры изопропилбензол и пропилбензол
- Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце.
Формуле С8Н10 соответствуют изомеры 1,3-диметилбензол, 1,2-диметилбензол и др.
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму
Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца.
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
Например, при хлорировании толуола на свету образуется бензилхлорид
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, этилбензол реагирует с хлором на свету
2. Реакции замещения
Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.).
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо.
Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения
Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
Серная кислота способствует образованию электрофила NO2+:
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
2C6H6 + 15O2 → 12CO2 + 6H2O + Q
Уравнение сгорания аренов в общем виде:
CnH2n–6 + (3n – 3)/2 O2 → nCO2 + (n – 3)H2O + Q
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. Окисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты.
Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ
Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода).
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода.
В уравнении реакции в качестве продукта записывается либо орто-хлортолуол, либо пара-хлортолуол.
Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-бромнитробензол. Нитро-группа — заместитель второго рода
5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации.
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
Например, при гидратации стирола образуется спирт:
Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Получение аренов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород
Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):