Привет! Многие студенты медицинских вузов сейчас разбирают биоорганическую химию (сокращённо-БОХ).
В некоторых вузах этот предмет заканчивается зачётом, в некоторых – экзаменом. Иногда бывает, что зачёт в одном вузе сравним по сложности с экзаменом в другом.
В моём университете биоорганическая химия сдавалась как раз экзаменом во время летней сессии — это был самый конец первого курса. Надо сказать, что БОХ относится к тем предметам, которые поначалу ужасают и могут вселять мысль — «это сдать невозможно». Особенно это касается людей со слабой базой органической химии (а таких в медицинских университетах, как ни странно, довольно много).
Программы изучения биоорганической химии в разных университетах могут очень сильно отличаться, а методики преподавания – ещё сильнее.
Однако, требования к студентам везде примерно одинаковые. Если очень упростить, то чтобы сдать биоорганическую химию на 5, вы должны знать названия, свойства, особенности строения и типичные реакции ряда органических веществ.
Наш преподаватель, уважаемый профессор, подавал материал так, будто бы каждый студент был самым лучшим в школе по органической химии (а биоорганическая химия по сути представляет собой усложнённый курс школьной органической химии). Наверное, он был прав в своём подходе, все должны тянуться наверх и стараться быть лучшими. Однако это привело к тому, что некоторые студенты, которые на первых 2-3 парах не понимали материал частично, ближе к середине семестра вообще перестали понимать всё.
Я решил написать этот материал по большей части из-за того, что я как раз и был таким студентом. В школе я очень любил неорганическую химию, а вот с органикой у меня всегда не складывалось. Даже во время подготовки к ЕГЭ я выбрал стратегию усиления всех своих знания по неорганике, в то же время закрепляя только базу органики. Мне кстати это чуть не вышло боком в плане вступительных баллов, но это другая история.
Я не зря сказал про методику преподавания, потому что у нас она была тоже весьма необычная. Нам сразу же, чуть ли не на первой паре, продемонстрировали методички, по которым мы должны были сдавать зачёты и затем экзамен.
Биоорганическая химия — зачёты и экзамен
Весь курс у нас делился на 4 крупных темы, каждая из которых заканчивалась зачётным занятием. Вопросы к каждому из четырёх зачётов у нас уже были с первых пар. Они, конечно же, пугали, однако в то же время они служили своеобразной картой, по которой следует двигаться.
Первый зачёт был совсем элементарный. Он был посвящён, в основном, номенклатуре, тривиальным (бытовым) и международным названиям, и, конечно же, классификации веществ. Также в том или ином виде затрагивались признаки ароматичности.
Второй зачёт после первого казался значительно более сложным. Там необходимо было расписывать свойства и реакции таких веществ, как кетоны, альдегиды, спирты, карбоновые кислоты. Например, одна из типичнейших реакций альдегидов — это реакция серебряного зеркала. Довольно красивое зрелище, скажу я вам. Если к какому-либо альдегиду вы добавите реактив Толленса, то есть [Ag(NH3)2]ОН, то на стенке пробирки вы увидите осадок, напоминающий зеркало, вот как это выглядит:
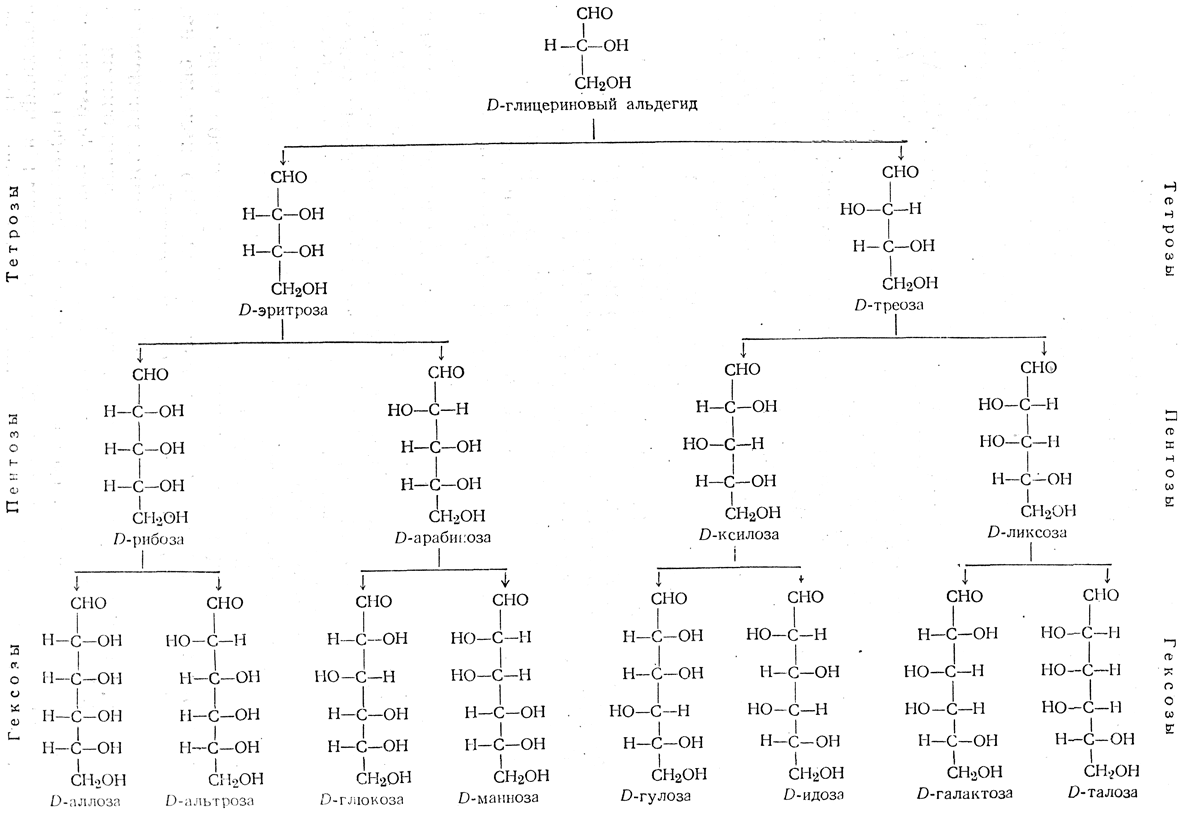
Третий зачёт на фоне второго не казался таким грозным. Все уже привыкли писать реакции и запоминать свойства по классификациям. В третьем зачёте речь шла о соединениях с двумя функциональными группами – аминофенолы, аминоспирты, оксокислоты и другими. Также в каждом билете был минимум один билет про углеводы.
Четвёртый зачёт по биоорганической химии был почти целиком и полностью посвящён белкам, аминокислотам и пептидным связям. Особой изюминкой были вопросы, на которых требовалось собрать РНК и ДНК.
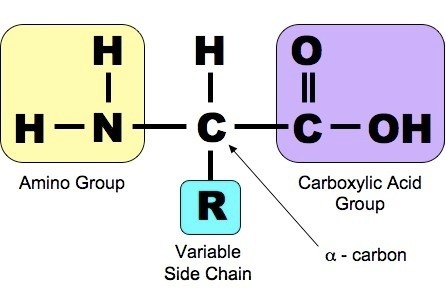
Кстати, как раз вот так выглядит аминокислота — вы можете увидеть аминогруппу (она подкрашена жёлтым на этом рисунке) и группу карбоксильной кислоты (она сиреневая). Именно с веществами этого класса приходилось иметь дело в четвертом зачёте.
Каждый зачёт сдавался у доски – студент должен без подсказок расписать и пояснить все необходимые свойства в виде реакций. Например, если вы сдаёте второй зачёт, и первым вопросом вашего билета указаны свойства спиртов. Преподаватель предлагает расписать свойства спиртов на примере пропанола. Вы пишете формулу пропанола и 4-5 типичных реакций, чтобы проиллюстрировать его свойства. Могла быть и экзотика, вроде серосодержащих соединений. Ошибка даже в индексе одного продукта реакции зачастую отправляла дальше учить этот материал до следующей попытки (которая была через неделю). Страшно? Сурово? Конечно!
Однако у такого подхода есть очень приятный побочный эффект. Во время регулярных семинарских занятий приходилось тяжко. Многие сдавали зачёты по 5-6 раз. Но зато на экзамене было очень легко, ведь каждый билет содержал 4 вопроса именно по одному из каждого уже выученного и решённого зачёта.
Поэтому я даже не буду расписывать тонкости подготовки к экзамену по биоорганической химии. В нашем случае вся подготовка сводилась к тому, как мы готовились к самим зачётам. Уверенно сдал каждый из четырёх зачётов – перед экзаменом просто просмотри свои же черновики, распиши ещё самые основные реакции и сразу всё восстановится. Дело в том, что органическая химия — это очень логичная наука. Запоминать нужно не огромные строки реакций, а сами механизмы.
Да, отмечу, что это работает далеко не со всеми предметами. Грозную анатомию не получится сдать, просто почитав свои записи накануне. Ряд других предметов также имеет свои особенности. Даже если в вашем медицинском университете биоорганическая химия преподаётся как-то иначе, возможно, вам нужно будет скорректировать вашу подготовку и осуществлять её немного не так, как делал я. В любом случае, удачи вам, понимайте и любите науку!
7
Министерство
здравоохранения Республики Беларусь
Учреждение
образования
«Гомельский
государственный медицинский университет»
Кафедра
общей и биоорганической химии
ВОПРОСЫ
для
подготовки к экзамену по биоорганической
химии
для
студентов
1 курса лечебного факультет и ФПСЗС
в
2009-2010 учебном году
Гомель
ВОПРОСЫ
ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ
ПО
БИООРГАНИЧЕСКОЙ ХИМИИ
1.
Биоорганическая химия как область
науки, изучающая строение и механизм
функционирования биологически активных
молекул с позиций теоретической
органической химии.
2.
Органическая химия природных соединений
– фундаментальная основа биоорганической
химии. Предмет и задачи биоорганической
химии.
3.
Теория строения органических соединений
А.М.Бутлерова и ее развитие на современном
этапе. Специфическое явление органической
химии – изомерия – и обусловленное ею
многообразие органических соединений.
Структурная изомерия.
4.
Принципы номенклатуры органических
соединений. Основные правила систематической
номенклатуры органических соединений:
заместительная и радикало-функциональная
номенклатура.
1.
Пространственное строение органических
соединений, его связь с типом гибридизации
атома углерода: sp3,
sp2,
sp. Стереохимические формулы. Важнейшие
понятия стереохимии – конфигурация и
конформация.
2.
Конформации открытых цепей. Вращение
вокруг одинарной связи как причина
возникновения различных конформаций.
Энергетическая характеристика
конформационных состояний: заслоненные,
заторможенные, скошенные конформации.
Проекционные формулы Ньюмена.
3.
Конформации (кресло, ванна) циклических
соединений (циклогексан, тетрагидропиран);
их относительная потенциальная энергия.
Аксиальные и экваториальные связи.
Связь пространственного строения с
биологической активностью.
4. Сопряжение (π,π- и р,π-сопряжение).
Сопряженные системы с открытой цепью:
1,3-диены (бутадиен, изопрен, аллильный
карбкатион); полиены (каротиноиды,
витамин А); гетеросопряженные системы
(α,β-непредельные карбонильные соединения,
карбоксильная группа).
5.
Сопряженные
системы с замкнутой цепью. Ароматичность.
Критерии ароматичности, правило
ароматичности Хюккеля.
6.
Ароматичность бензоидных (бензол,
нафталин, фенантрен), небензоидных
(циклопентадиенильный анион) и
гетероциклических (фуран, тиофен, пиррол,
имидазол, пиридин, пиримидин, пурин)
соединений. Энергия сопряжения
(делокализации).
7.
Пиррольный и пиридиновый атомы азота,
π-избыточные и π-не-достаточные
ароматические системы. Делокализация
электронов как один из важных факторов
повышения устойчивости молекул и ионов,
ее широкая распространенность в
биологически важных молекулах (порфин,
гем, хлорофилл, гемоглобин и др.).
8.
Поляризация связей. Электронные
эффекты – индуктивный и мезомерный –
как причина неравномерного распределения
электронной плотности и возникновения
реакционных центров в молекуле.
Электронодонорные и электроноакцепторные
заместители.
9. Теория Бренстеда. Общие закономерности
в изменении кислотных или основных
свойств во взаимосвязи с природой атомов
в кислотном или основном центре,
электронными эффектами заместителей
при этих центрах и сольватационными
эффектами.
10. Стабильность аниона кислоты –
качественный показатель кислотных
свойств. Кислотные свойства органических
соединений с водородсодержащими
функциональными группами (спирты,
фенолы, тиолы, карбоновые кислоты,
амины).
11. Основные свойства нейтральных молекул,
содержащих гетероатомы с неподеленными
парами электронов (спирты, тиолы, простые
эфиры, сульфиды, карбонильные соединения,
амины).
12.
Кислотно-основные
свойства азотсодержащих гетероциклов
(пиррол, имидазол, пиридин).
13.
Классификация
органических реакций по результату
(замещения, присоединения, элиминирования,
перегруппировки, окислительно-восстановительные)
и по механизму – радикальные, ионные
(электрофильные, нуклеофильные),
согласованные.
14.
Типы
реагентов: радикальные, кислотные,
основные, электрофильные, нуклеофильные.
Способы разрыва ковалентной связи в
органических соединениях и образующиеся
при этом частицы: свободные радикалы
(гомолитический разрыв), карбкатионы и
карбанионы (гетеролитический разрыв).
Электронное и пространственное строение
этих частиц и факторы, обусловливающие
их относительную устойчивость.
15. Реакционная способность углеводородов.
Реакции свободнорадикального замещения:
гомолитические реакции с участием С-Н
связей sp3—
гибридизированного атома углерода.
Механизм свободнорадикального замещения
на примере реакции галогенирования
алканов. Региоселективность реакций
свободнорадикального замещения. Понятие
о цепных процессах.
16. Реакции электрофильного присоединения
в ряду алкенов и алкадиенов: гетеролитические
реакции с участием π-связи между
гибридизированными атомами углерода.
Механизм реакций гидрогалогенирования
и гидратации. Кислотный катализ. Правило
Марковникова.
17. Особенности электрофильного
присоединения к сопряженным системам:
гидратация α,β-ненасыщенных карбоновых
кислот на примере акриловой кислоты.
18. Реакции электрофильного замещения:
гетеролитические реакции с участием
π-электронного облака ароматической
системы. Механизм реакций галогенирования,
нитрования, сульфирования и алкилирования
ароматических соединений. π- и σ-
комплексы. Роль катализаторов в
образовании электрофильной частицы.
19.
Влияние заместителей в бензольном ядре
и гетероатомов ароматических гетероциклов
на реакционную способность. Ориентирующее
влияние заместителей и гетероатомов.
20. Реакции нуклеофильного замещения у
sp3-гибридизованного
атома углерода: гетеролитические
реакции, обусловленные поляризацией
связи углерод – гетероатом
(галогенопроизводные, спирты). Легко и
трудно уходящие группы; связь легкости
ухода группы с ее строением.
21. Реакции гидролиза галогенопроизводных.
Реакции алкилирования спиртов, фенолов,
тиолов, аммиака и аминов. Роль кислотного
катализа в нуклеофильном замещении
гидроксильной группы. Галогенопроизводные,
спирты, эфиры серной и фосфорной кислот
как алкилирующие реагенты. Биологическая
роль реакций алкилирования.
22.
Реакции элиминирования (дегидрогалогенирование,
дегидратация). Повышенная СН-кислотность
как причина реакций элиминирования,
сопровождающих нуклеофильное замещение
у sp3—
гибридизованного атома углерода.
23.
Реакции
нуклеофильного замещения в ряду
карбоновых кислот (карбоновые кислоты
и их функциональные производные).
Электронное и пространственное строение
карбоксильной группы.
24. Характеристика кислотных свойств
карбоновых кислот: одно-, двухосновных,
предельных, непредельных, ароматических.
25. Реакции ацилирования – образования
ангидридов, сложных эфиров, сложных
тиоэфиров, амидов – и обратные им реакции
гидролиза.
26. Ацилирующие реагенты (ангидриды,
галогенангидриды, карбоновые кислоты,
сложные эфиры, сложные тиоэфиры),
сравнительная активность этих реагентов.
Ацилфосфаты и ацилкофермент А – природные
макроэргические ацилирующие реагенты.
Биологическая роль реакций ацилирования.
Понятие о реакциях фосфорилирования.
27. Реакции нуклеофильного присоединения:
гетеролитические реакции с участием
π-связи углерод-кислород (альдегиды и
кетоны).
28. Механизм реакций карбонильных
соединений с водой, спиртами, тиолами,
первичными аминами.
29. Реакции альдольного присоединения.
Основной катализ. Альдольное расщепление
как реакция обратная альдольному
присоединению. Биологическое значение
этих процессов.
30.
Реакции окисления и восстановления
органических соединений. Специфика
окислительно-восстановительных реакций
органических соединений. Понятие об
одноэлектронном переносе. Перенос
гидрид-иона в системе НАД+–НАДН.
31.
Реакции окисления спиртов, тиолов,
сульфидов, карбонильных соединений,
аминов. Дисмутация
формальдегида (реакция Канницаро-Тищенко),
ее механизм. Реакции
восстановления карбонильных соединений,
дисульфидов, иминов.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Загрузить PDF
Загрузить PDF
У органической химии не самая хорошая репутация — многие не раз слышали от студентов жуткие истории об этом предмете задолго до того, как сами начали знакомиться с ним. Действительно, предмет непростой, но и назвать его ужасным нельзя. В органической химии нужно больше разбираться в материале, чем просто запоминать его, а это — ключ к успешной сдаче экзамена.
-
1
Познакомьтесь с термином «органическая химия». Органическая химия изучает химические соединения на основе углерода.[1]
Углерод — шестой элемент периодической системы и один из важнейших «кирпичиков», из которых состоит все живое на земле. Живые организмы состоят из молекул, которые содержат углерод. Это означает, что органическая химия изучает и химические процессы, которые изо дня в день происходят в вашем организме. Кроме того, она включает в себя и химические процессы в организмах животных, в растениях и в природных экосистемах.- Однако органическая химия не ограничивается только живыми существами. К примеру, химические реакции, происходящие при горении природного топлива, также относятся к органической химии, поскольку при этих реакциях взаимодействуют органические вещества в топливе.
-
2
Научитесь изображать молекулы. В органической химии визуальное восприятие гораздо важнее, чем в общей химии. Вы будете рисовать молекулы и соединения чаще, чем на занятиях по общей химии, поэтому важно научиться расшифровывать и понимать эти рисунки.
- Вы уже знакомы со структурой Льюиса — этому учат на занятиях по общей химии. В структуре Льюиса атомы в молекуле обозначаются их химическим символом (то есть буквой в периодической таблице). Линии — это связи между атомами, а точки — валентные электроны. На WikiHow есть статьи, посвященные этой теме.
- Скорее всего, о скелетной формуле вы еще не слышали. В скелетной формуле атомы углерода не изображаются — есть только линия, которая используется для обозначения связи. Поскольку в органической химии очень много атомов углерода, так рисовать молекулы гораздо быстрее. Атомы прочих элементов изображаются их химическими символами. На этом сайте можно найти подробную информацию о скелетной формуле.[2]
-
3
Научитесь изображать связи. Чаще всего вы будете иметь дело с ковалентными связями, хотя вам также надо будет узнать, что такое ионная связь.[3]
При ковалентной связи два атома обмениваются непарными электронами. Если есть лишние непарные электроны, появляются двойные и тройные соединения.- Как в структуре Льюиса, так и в скелетной формуле единичные связи изображаются одной линией, двойные — двойной, тройные — тройной.
- В скелетной формуле связи между углеродом (С) и водородом (Н) не рисуются, поскольку они встречаются очень часто.
- За исключением особых случаев, у атомов может быть 8 валентных электронов (то есть электронов внешней оболочки). Таким образом, чаще всего атом может соединиться максимум с четырьмя другими атомами.
-
4
Ознакомьтесь с основами трехмерной молекулярной структуры. В органической химии вам нужно будет представлять молекулы в таком виде, в котором они существуют в действительности, а не только как на рисунке. Молекулы — это трехмерные образования. Форму молекулы определяет тип связей в ней, хотя и другие факторы могут оказывать на это влияние. Важно помнить о следующем:
- Углерод, связанный с другими атомами единичными связями, будет иметь форму тетраэдра (четырехгранной пирамиды). Примером может служить молекула метана (CH4).
- Углерод, связанный с другим атомом двойной связью и с двумя атомами единичными связями, имеет форму плоского треугольника. В качестве примера можно привести ион CO3-2.
- Углерод, соединенный с двумя атомами двойными связями или с одним атомом тройной связью, представляет собой прямую линию. Примером служит двуокись углерода — CO2.
-
5
Научитесь узнавать гибридизацию орбиталей. Звучит страшно, но все не так сложно, как кажется. Гибридные орбитали — это способ отображения валентных электронов атома на основе поведения атома (а не схемы). Если у атома есть несколько непарных электронов, но он предпочитает образовывать другое количество связей, считается, что у него есть гибридные орбитали.
- Углерод служит примером такого поведения. У атомов углерода четыре валентных электрона: два на орбитали 2s и два непарных на орбитали 2p. Поскольку у атома есть два непарных электрона, можно предположить, что он образует две связи. Однако в результате экспериментов было установлено, что связи формируют парные электроны на орбитали 2s. Таким образом, у углерода появляется 4 непарных электрона на гибридной орбитали sp.
-
6
Ознакомьтесь с основами электроотрицательности. Есть множество факторов, которые могут влиять на то, как молекулы будут взаимодействовать, но одним из важнейших факторов считается электроотрицательность. Электроотрицательность — это способ измерения того, с какой силой атом удерживает свои электроны. Атомы с высокой электроотрицательностью сильнее удерживают электроны, с низкой — слабее. На WikiHow есть статьи на эту тему.
- По мере продвижения вверх и направо в периодической системе элементов электроотрицательность атомов возрастает (исключение составляют водород и гелий). У фтора, крайнего элемента в верхнем правом углу, максимальная электроотрицательность.
- Поскольку электроотрицательные атомы стремятся получить больше электронов, они стараются схватиться за все доступные электроны других молекул. Например, атомы хлора и фтора часто становятся негативными ионами, потому что забирают электроны у других атомов.[4]
Реклама
-
1
Не бойтесь. В органической химии будет много новых понятий, и вы будете рассматривать некоторые явления с другой стороны. Вам нужно будет заучить много новых слов. Не переживайте — все в вашей группе пройдут через это. Учитесь прилежно и обращайтесь за помощью, если она вам потребуется, и все будет хорошо.
- Не позволяйте «страшилкам» студентов, которые сдавали экзамен по органической химии, запугать вас. Студенты часто гордятся тем, как им было сложно. Если на первой контрольной вы будете считать, что перед вами невыполнимая задача, вам будет еще сложнее.[5]
Лучше много занимайтесь и хорошо выспитесь накануне контрольной работы.
- Не позволяйте «страшилкам» студентов, которые сдавали экзамен по органической химии, запугать вас. Студенты часто гордятся тем, как им было сложно. Если на первой контрольной вы будете считать, что перед вами невыполнимая задача, вам будет еще сложнее.[5]
-
2
Старайтесь понимать, а не заучивать. Вы будете наблюдать за сотнями разных реакций. Запомнить их все практически нереально, поэтому не пытайтесь заучить их. Лучше сосредоточьтесь на основных принципах самых частых реакций. Многие реакции идут по одному и тому же сценарию, поэтому разберитесь в нем и знайте, как его применять, и это позволит вам решать уравнения без проблем.
- Если у вас хорошая память, используйте ее. Напишите основные механизмы реакций на карточках и заучивайте их. Конечно, вам придется изменить подход к уравнению, если вы увидите реакцию, которой раньше не видели, но знание основных принципов реакций поможет вам решить и такое уравнение.
-
3
Знайте необходимые функциональные группы. В органической химии используется один и тот же набор структур практически во всех молекулах. Эти структуры называются функциональными группами. Если вы научитесь узнавать их и будете знать, как они ведут себя при реакциях, вы сможете справиться с задачами по химии. Поскольку функциональные группы обычно всегда реагируют одинаково, знание их свойств поможет вам в самых разных упражнениях.
- В органической химии очень много функциональных групп, и перечислить все в этой статье невозможно. Найти учебные материалы по этой теме нетрудно. К примеру, можно почитать об этом здесь.
-
4
Если сомневаетесь, следите за движением электронов. На базовом уровне реакции в органической химии, как правило, подразумевают обмен электронами между двумя и более молекулами. Если вы не знаете, с чего начать в реакции, подумайте, куда переместились бы электроны. Иными словами, ищите атомы, которые могут принять электроны, и атомы, которые могут их отдать. Совершите обмен электронами и подумайте, что нужно сделать, чтобы привести молекулы к стабильному состоянию.
- Например, кислород (О) обладает большей электроотрицательностью, чем углерод, поэтому кислород с двойной связью с углеродом в кетонной группе будет стараться притянуть электроны ближе к себе. Из-за этого у углерода появится частично положительный заряд, и он сможет принимать электроны. Если в реакции участвует элемент, который готов отдавать электроны, он может напасть на кислород и образовать новую связь, в результате чего произойдет химическая реакция.
-
5
Готовьтесь к контрольным работам и делайте домашнее задание в группах. Не думайте, что вы обязаны заниматься в одиночестве, — попробуйте объединиться с одногруппниками. Они помогут вам разобраться в том, что вам сложно дается, а если вы сами будете объяснять что-то другим, вы лучше запомните материал.
Реклама
-
1
Познакомьтесь с преподавателем. Больше всего об этом предмете знает тот, кто его преподает, поэтому воспользуйтесь этим источником информации. Попросите преподавателя пояснить вам то, что вы не понимаете. Задавайте точные и четкие вопросы и объясняйте, что вам дается особенно тяжело. Будьте готовы пояснить ход своих мыслей, если дадите неверный ответ.
- Не стоит беспокоить преподавателя, если у вас нет четкого вопроса. Если вы просто скажете, что не понимаете задание на дом, это вам ничем не поможет.
- Важно не только получить ответы на вопросы, но и познакомиться с преподавателем. Помните, что хорошие оценки вам еще пригодятся. Преподаватели гораздо более благосклонны к тем, кто обращается к ним за помощью.
-
2
Используйте вспомогательные материалы для визуализации задач. В органической химии форма молекул влияет на то, как они реагируют. Поскольку изобразить трехмерные молекулы на плоскости сложно, можно использовать объемные фигуры при работе со сложными структурами.
- Наборы для построения молекул позволяют создавать трехмерные модели из пластиковых фигур. Стоят они недешево, но обычно они есть в кабинете химии, и ими можно пользоваться.
- Если у вас нет возможности воспользоваться специальным набором, попробуйте строить модели из мячиков, маркеров и деревянных палочек.
- Существуют специальные компьютерные программы (например, эта), которые позволяют строить трехмерные модели.[6]
-
3
Поищите ответы на свои вопросы на форумах. К счастью, в интернете многие ищут нужную им информацию по органической химии, и там есть люди, у которых есть ответы. Существуют форумы, посвященные органической химии, где обсуждаются сложные темы. Попробуйте разместить задачу, которую вы не можете решить, и пообщайтесь с людьми, которые вызовутся вам помочь.
- Если вы владеете английским языком, вам подойдет chemicalforums.com.[7]
- Если вы владеете английским языком, вам подойдет chemicalforums.com.[7]
-
4
Воспользуйтесь информацией интернет-ресурсов об органической химии. Есть много сайтов, посвященных этой теме. Ниже мы приводим список таких ресурсов (на английском языке):
-
Khan Academy: Здесь собраны видеозаписи лекций на самые разные темы.[8]
-
Chem Helper: Здесь есть тесты для тренировки, форумы, описания реакций и другая информация. Тут вы также найдете информацию о работе в лаборатории.[9]
- University of South Carolina Aiken: Здесь приводится список полезных ссылок на многие темы в рамках органической химии.
Реклама
-
Khan Academy: Здесь собраны видеозаписи лекций на самые разные темы.[8]
Советы
- Чем больше времени вы будете уделять органической химии, тем лучше вы будете знать предмет. Старайтесь выделять минмум час на изучение химии ежедневно, потому что регулярность важна не меньше, чем количество потраченного времени.
- Для понимания многих тем в органической химии будут полезны базовые знания физики. Старайтесь уделять достаточно времени этому предмету.
- На WikiHow есть статьи, которые помогут вам решать задачи по химии.
Реклама
Об этой статье
Эту страницу просматривали 28 644 раза.
Была ли эта статья полезной?
Биохимия (биологическая, или физиологическая химия) — наука о химическом составе живых клеток и организмов и о химических процессах, лежащих в основе их жизнедеятельности. О том, как выучить биохимию за неделю, я и хочу вам рассказать.
Итак, вопрос: как выучить биохимию за неделю?
Ответ: никак. Ни-как! Вообще. В принципе. Биохимия не учится ни за неделю, ни за две.
Термин «биохимия» эпизодически употреблялся с середины XIX века, в классическом смысле он был предложен и введен в научную среду в 1903 году немецким химиком Карлом Нойбергом.
Биохимия находится на стыке нескольких наук, прежде всего — биологии и химии. Кроме того — физика и математика. Это база. Основа, если хотите. Данные нарабатывались более ста лет учеными всего мира, систематизировались такими зубрами как Ленинджер и Страйер более двадцати лет — а вы ЭТО за неделю выучите?
Очень смешно…
Вот вам маленький кусочек из Biochemical Pathway Maps. Ниже него — сильно уменьшенная копия. В реальном размере это здоровенный постер площадью около 12 квадратных метров. У нас в лаборатории такой был. Посмотришь — и офигеешь от реального размера своих знаний…
В реальном размере на нее можно посмотреть на
сайте
— там склейка из кусков, потому что одним файлом такую картинку не один браузер не отрисует, повиснет.
Надеюсь, что я смог донести до вас мысль, что с нуля, «прокосив» и пропустив все занятия — за неделю биохимию выучить невозможно.
Ну а теперь можно поговорить о том, как нужно учить биохимию. Будет сложно, но это не тот предмет, который дается легко.
Что нам понадобится
Математика
Не высшая математика, а, в основном арифметика и таблица умножения — молекулы АТФ считать и реакции уравнивать. Но и «вышка» тоже понадобится, не расстраивайтесь…
Физика и физхимия
Обязательно понадобится, как только разговор пойдет о ферментах. Да и раньше тоже — конформации белка и ДНК, межмолекулярные взаимодействия… Да, держится всё на химических связях, но складывается в причудливые формы — за счет и химических, и физических взаимодействий. О, изомерию забыл! Левовращающие, правовращающие… брр!
Химия
О-о-о-о…да! Химии будет чуть менее, чем полностью. И самой пакостной из ее разновидностей — органической. Как вспомню, так вздрогну: водород, кислород, углерод, азот — а поди ж ты, из четырех элементов можно таааких жупелов навертеть! А если это добро еще немножечко сдобрить приправами в виде серы, железа, меди и редкоземельных металлов — ребята, я вам не завидую… головняк обеспечен.
Ну-ка, кто навскидку скажет, что такое реакции нуклеофильного замещения? Во-во… Проспали и прогуляли органику — готовьтесь к проблемам.
Импортные языки
Так исторически сложилось, что международными языками, из значимых, для накопления и обмена научной информацией по очереди были: латынь, голландский, немецкий, французский, английский. Латынь заняла свою нишу у медиков и биологов-систематиков, немецкий — до сих пор активно используется в публикациях у химиков-органиков и химиков-синтетиков, английский актуален и сейчас. Львиная доля терминологии в биохимии — либо химические классификаторы по ИЮПАК, либо тривиальные названия, а они, зачастую — калька с латыни или английского. Базовые знания этих языков вам очень сильно помогут.
Например: вазопрессин — от латинского vasa — сосуд и presso — давлю. Он же — антидеуретический гормон. Анти-диуретик. Против образования мочи, короче. Значит, влияет на всасывание воды в почках, значит, влияет на давление крови в сосудах. Из термина, зная происхождение слов, спокойно восстанавливается функционал. Вывод: свободно говорить и не надо, тем более на латыни — мертвый язык, носителей фонетики не осталось — но знание терминов и умение раскидать их на запчасти — пригодится.
Время
Это то, чего вам будет катастрофически не хватать. И не только вам. Это то, что утекает сквозь пальцы. Это то, что профукивается на всякую ерунду…
С одной стороны, на биохимию министерство образования сейчас щедро отстегнуло аж целых 36 часов. Тридцать шесть! Аж!..
Вы не поверите, но на биологическом факультете МГУ им. М.В.Ломоносова в начале 2000-х на биохимию отводилось 335 часов, из них — 240 аудиторных.
И этого было МАЛО! Это понимали все — и преподы, которые старались вколотить в нас за это время по максимуму, и даже такие раздолбаи, как я, понимали — мало…
95 часов было заложено на самоподготовку. Откуда, собственно, и разница: 335-240=95.
Я биохимию сдавал мучительно… Это один из тех предметов, где я не прогулял ни одного занятия — лекции, семинары, практикумы — посещалось все. И все равно — ощущение того, что я не догоняю чего-то оно все больше крепло. Тут и вылезли пробелы по органике. Потом оно навертело на себя, как снежный ком…
Да, биохимию я сдал. Но потом — все равно доучивал, то, что пропустил. И на курсовой пригодилось, и на дипломе очень сильно понадобилось, и на работе потом икнулось многократно все пробелы и дыры в знаниях.
Сейчас я могу сказать, что биохимия — самый сложный, и, пожалуй, самый интересный предмет за весь курс обучения.
Я серьезно.
Физиология в конечном итоге упирается в биохимию, биотехнология — это надстройка над биохимией, не более того. То, что изучают и «первооткрывают» биохимики, после первооткрытия и изучения, обкатав методику, передают биотехнологам, которые и варят изученное в промышленных масштабах, будь то пиво, йогурт, или новый вид клея или витаминов. Иммунология и фармакология — опять уперлись в биохимию.
Так вот, возвращаясь к министерству образования и учебным планам. Открою вам страшную тайну: количество часов урезали, а предмет — все тот-же, в том же самом объеме, каким был 10 лет назад. Нам тогда 335 часов было мало…
А сейчас считается, что современный студент сам в состоянии освоить этот курс. Да-да, поинтересуйтесь в учебной части, сколько часов на самообучение заложено в учебном плане. Вы будете сильно удивлены… Считается, что вы сами, добровольно, после занятий, вместо пития вкусного пива и сидения во вконтактике (танчиках, еще какой-нибудь игрухе) будете вдумчиво читать учебник по биохимии и прорешивать задачи.
А теперь о том, как выучить биохимию
Ходите на все занятия
Их и так очень мало, информация дается сжато. Десять лет назад, пропустив один час аудиторных занятий я бы пропустил 0,2% данных. Если вы сейчас пропустите один час — вы потеряете 2,7% данных. Десять часов прогулял — пропустил четверть курса. Нормально, чо… Без этой четверти курса еще половина курса просто пролетит мимо мозга, потому что постоянно будут отсылки и ссылки на предыдущий материал — а вы его прогуляли…
Приходите вовремя
Я не буду говорить о том, что опоздание это неуважение к преподу. Про то, что точность — вежливость королей, а неточность — вежливость снайперов. К чему изрекать банальности?
Еще раз — времени на предмет отведено не просто мало, а крайне мало. И каждый хронический опоздун крадет минуту-две не только у преподавателя, но и у своих одногруппников. Академический час — это 45 минут. Два опоздуна на каждом занятии «съедят» 72 минуты — к паре на минутку опоздал, и с перерыва задержался… Потом шумно и вальяжно, как боярин, неспешно прошествовал к своему месту и воссел на трон. В итоге опозданцы украдут у вас 72 минуты, а это 3,3% процента недополученных вами данных. Ваши «товарищи» украли у вас это время. Много это или мало?
Задумайтесь над этим…
Расчеты я вел, кстати, исходя из астрономического часа, так что цифры будут другие в сторону увеличения…
Задавайте вопросы
Всегда спрашивайте и переспрашивайте. Поймите, если вы не поняли что-то — всегда нужно переспросить. Лучше немедленно, если стесняетесь — спросите после занятия. Совсем стремно — на сайте вопрос задайте. Хотя как по мне — лучше в семестре выглядеть дураком, а в конце унести в клюве пятерку-автомат, чем важно молчать — и нифига не понимать.
Я протупил в свое время — нужно было задавать вопросы…
Сам дурак, сам себе геморрой на ровном месте обеспечил.
Но все равно обидно.
Ведите конспект
Конспект лекций — это ваша палочка-выручалочка. Именно ваш, написанный собственноручно. Чужой конспект это совсем не то.
Самая страшная ошибка, которую вы можете совершить — это скачать конспект лекций, написанный преподавателем, и искренне считать, что там есть ответы на все вопросы. Это не просто ошибка — это, блин фатал эррор… Конспект преподавателя, это его личный конспект. Препод писал конспект для себя, это его шпаргалка, если хотите. Это всего лишь содержание лекции. Если препод в своем конспекте наткнется на слова … и тут рассказать про гормоны, то он будет рассказывать про гормоны. А вы должны записывать. Потому что, если препод и так помнит все, что он должен рассказать про гормоны, ему достаточно увидеть свою пометку, просто чтобы не забыть.
А если вы, прогуляв все лекции, откроете чужой конспект (то есть преподский), то что вы там про гормоны найдете? Правильно — ни-че-го!
И, если уж на то пошло — препод не обязан вам раздавать свои конспекты. Лекции читать, занятия проводить, контрольные — обязан. Оценивать знания — обязан, это его работа. Но вот раздавать свои конспекты — этого ни в одной должностной инструкции нет. Это все от безысходности, если хотите… Времени мало, вот и раздают.
Прорабатывайте материал
Да — лениво. Да — пиво. Да — девки румяные… Да, права надо на авто получить, и в драмкружок записаться, и в КВД после румяных девок антибиотиками курс проколоть нужно — я все это прекрасно понимаю. Масса Очень Важных и Офигительно Нужных Дел… Но, обязательно, найдите время после лекции: ваш сегодняшний конспект, написанный собственноручно. Распечатка конспекта препода по этой же теме. Учебник Ленинджера. Найдите еще раз, все, что проговаривали сегодня. Сверьте информацию. Занесите в свой конспект то, что упустили, бывает. Выпишите те вопросы, которые появились и обязательно их задайте преподавателю. Биохимия, для биологического факультета это базовый предмет. Если вы на биофак попали случайно, типа пофиг где «учиться», лишь бы «корку» дали — биохимию все равно придется учить, хотя бы ради корки. Если вы на биофаке осознанно, и это ваш выбор — вам нужно учить биохимию, это ваш основной предмет. Как математика химия и физика нужна для понимания биохимии, так биохимия нужна для понимания все последующих спецкурсов, уже по вашей специальности.
Выбор, впрочем за вами. И я сильно надеюсь, что вы прочитаете это материал ДО поступления, или ДО начала первого курса, а не после того, как упустите и пропустите матан, физику и химию, ту базу, без которой действительно выучить, или хотя бы понять биохимию будет крайне непросто.
Поверьте, догонять колонну в пыли, плетясь в хвосте — не самое приятное занятие.
Одним из самых сложных предметов на первом курсе медицинского университета считается биоорганическая химия. Так сложилось, что химию школьники, мягко говоря, недолюбливают. Если с неорганической химией в 8 и 9 классах худо-бедно удавалось справляться, то когда в старших классах появляется органика – начинается сущий ад для учеников.
Биоорганическая химия – это продолжение органической химии. В начале вы повторите и усложните материал органической химии. Затем вы подробно остановитесь на органических веществах, встречающихся в живых организмах.
С чего начинается изучение биоорганической химии
Прежде, чем изучать биоорганическую химию вам придется ознакомиться с такими понятиями, как гибридизация, σ-связь, π-связь и сопряжение. Эти понятия относятся скорее к строению молекул, правда в нашем случае органических молекул.
Гибридизация
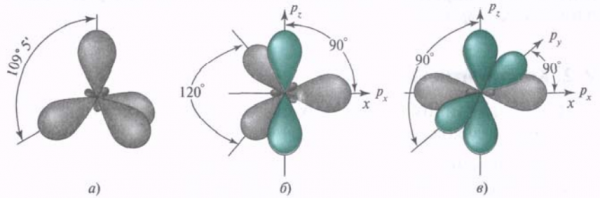
Теория гибридизации позволяет нам лучше представлять, какую форму имеют молекулы в пространстве. Существует 3 вида гибридизации атома углерода: sp3, sp2 и sp-гибридизация. В первом случае гибридизуются все орбитали углерода, во втором только 3, в третьем только 2 орбитали.
Негибридные орбитали показаны зеленым цветом.
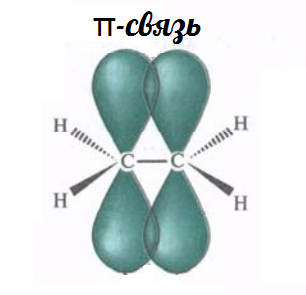
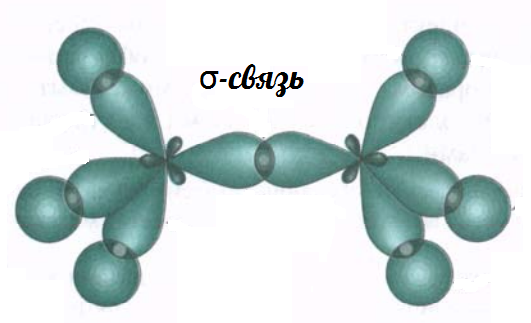
σ-связь, π-связь
σ-связь образуется при перекрывании гибридных орбиталей, π-связь при перекрывании негибридных орбиталей.
Сопряжение
Сопряжение – это объединение нескольких негибридных орбиталей в одну. Как, например, в молекуле бензола.
Индуктивный и мезомерный эффект
Индуктивный эффект – переход электронной плотности по σ-связям, мезомерный эффект – переход электронной плотности по π-связям. Электронная плотность всегда перетекает от менее электроотрицательного атома к более электроотрицательному.
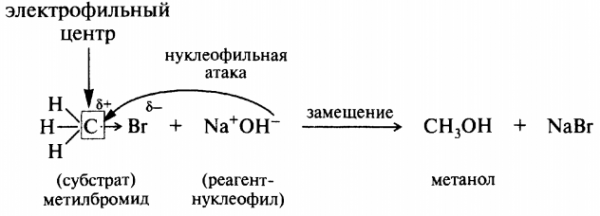
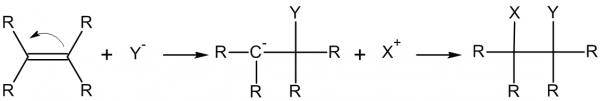
Одним из самых распространенных типов реакций является реакция нуклеофильного присоединения и нуклеофильного замещения.
Нуклеофил – атом с избытком электронной плотности.
Электрофил – атом с недостатком электронной плотности.
Они и будут соединяться между собой.
Пример реакции нуклеофильного замещения:
Реакция нуклеофильного присоединения в общем виде:
Эти понятия помогут вам лучше понимать то, как проходят реакции в органической химии. Любая химическая реакция – это перенос внешних электронов от одной молекулы к другой. Эти понятия всего лишь показывают общие закономерности этого принципа.
Предположим, мы поняли основные законы биоорганической химии. Что дальше?
Дальше вас начнут знакомить с основными классами органических веществ. Традиционно знакомство начинается с углеводородов – самых простых органических веществ, состоящих только из углерода и водорода.
Всегда помните главное правило органической химии – углерод образует 4 связи.
Итак, алканы — органические вещества, состоящие из углерода и водорода, содержат только одинарные связи. В отличии от алкенов – углеводородов с двойной связью, диенов – углеводородов с двумя двойными связями и алкинов – УВ с тройной связью.
Арены же немного другая история, эти углеводороды отличаются от всех остальных так как имеют в молекуле сопряженное бензольное кольцо. И несмотря на то что имеют кратные связи, по свойства близки к алканам, также довольно инертны, поскольку сопряженная система очень устойчива и не стремится к разрушению.
Кислородсодержащие органические вещества
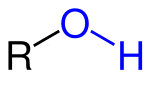
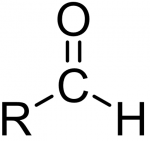
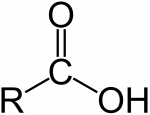
К ним относятся спирты, карбонильные и карбоксильные соединения.
Общий вид спиртов. R – углеводородный радкикал.
Общий вид альдегидов. Кетоны отличаются тем, что вместо Н у них еще один еще один R.
Карбоновые кислоты.
Очень большой раздел будет посвящен углеводам, вы узнаете все разнообразие представителей этого класса и то, чем все они отличаются.
Азотсодержащие органические вещества
Из азотсодержащих веществ вам встретятся уже известные амины и аминокислоты. Единственное, что вы будете изучать гетероциклы, изучение которых в полной мере не входит в школьную программу.
После изучения и повторения основных классов, вы узнаете из чего построена молекула РНК и ДНК, как происходит синтез белка и много другого интересного. Эти знания пригодятся вам для изучения биохимии.
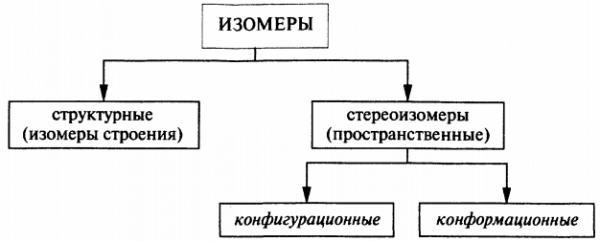
Стереоизомерия
Давайте подробно разберемся с пространственной изомерией, вызывающей самые большие сложности в понимании биоорганики.
Со структурными изомерами вас познакомили еще в школе, а вот стереоизомеры это что то новенькое.
Начнем с кофигурационных
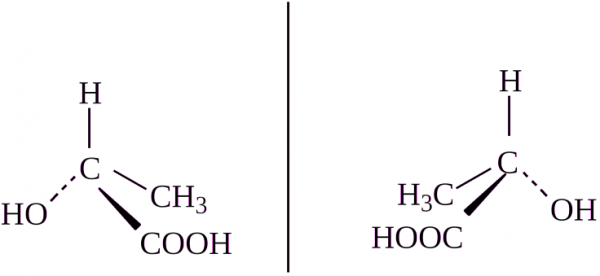
Во первых, углерод, имеющий 4 различных заместителя называется хиральным и может иметь изомеры. Например:
Это и называется конфигурационной изомерией, перед вами два изомера.
Не прогуливайте лекции и вы будете знать какой из них D, а какой L и как это определить.
Конформационные изомеры
В этих изомерах строение молекул одинаковое, да и все атомы углерода имеют одинаковую конфигурацию, но вот в пространстве они расположены по разному.
Взгляните:
Вещества не совместятся при наложении, как бы мы не пытались. У изомеров разная конформация.
PS
Посещайте лекции и семинары, во время выполняйте домашние работы и изучение биоорганической химии будет гладким.
Успехов!
ЗАКАЗАТЬ РЕШЕНИЕ
Вопросы для подготовки к экзамену по биоорганической химии для студентов ФМБФ
I.
Номенклатура органических
соединений
1.
Правила построения названия
органических соединений по номенклатуре ИЮПАК
2.
Построение названий
ациклических соединений.
3.
Построение названий
функциональных соединений.
4.
Структурная изомерия,
изомерия положения, мета- изомерия.
II.
Химическая
связь
1.
Индуктивный и мезомерный
эффект. Элекронодонорные и электроноакцепторные группы.
2.
Делокализованная химическая
связь. π
—
π
и π -Р
сопряжение.
3.
Метод резонанса. Построение
резонансных структур. Энергия сопряжения.
4.
Ароматичность органических
соединений. Правило ароматичности Хюккеля. Применение методов ВС и МО Хюккеля
для описания структуры бензола. Соединения, обладающие
ароматичностью.
III. Стериоизомерия
1.
Оптическая изомерия.
Хиральность. Энантиомеры.
2.
Правила построения проекции
Фишера для соединений с одним хиральным центром.
3.
Система
Кона-Ингольда-Прелога. R-S-номенклатура.
4.
Соединения с двумя хиральными
центрами Мезо-форма, Дихастереомеры.
5.
Прохиральность. Гомотопные,
энантиотопные и диастериотопные атомы или группы. Энантиотопные и
диастереотопные поверхности.
6.
Конформационный анализ.
Конформеры.
7.
Геометрическая изомерия.
Z,E-номенклатура. Физические свойства и устойчивость
Z,E-изомеров.
IV. Кислотность и основность органических
соединений.
1.
Кислотность и основность по
теории Бренстеда-Лоури. Определение рКа и рКаВН+
2.
Кислотность и основность по
теории Льюиса. Жесткие и мягкие кислоты и основания
3. Факторы,
определяющие кислотность карбоновых кислот, спиртов и
тиолов.
4. С-Н кислоты.
Устойчивость карбоанионов. Таутомерия.
5. Факторы,
определяющие основность аминов и
простых эфиров.
6.
Кислотно-основное равновесие α-аминокислот. Изолектрическая
точка.
V. Реакции органических соединений.
1. Классификация
реакций органических соединений
2. Нуклеофильное
замещение у насыщенного атома углерода. Общая характеристика механизма
моно-(SN1) и бимолекулярной-(SN2) реакции. Влияние заместителей в субстрате на
реакционную способность. Устойчивость карбокатионов. Влияние на скорость реакции
нуклеофила и уходящей группы. Влияние растворителей на скорость реакций
SN1 и SN2.
3.
Реакция элиминирования.
Классификация реакций элиминирования. Механизм β – элиминирования. Механизм
реакции Е2-элимирования, стериоспецифичность реакции. Правило
Зайцева. Правило Гофмана. Механизм реакции Е1. Механизм реакции
Е1св, Конкуренция замещения и элиминирования.
4.
Электрофильное замещение в
ароматическом ядре. Механизм реакции. Ориентация электрофильного замещения и
реакционная способность замещенных бензолов. Ориентация электрофильного
замещения дизамещенных бензолов.
5.
Электрофильное присоединение
к двойной связи углерод-углерода. Механизм реакции бромирования. Стериоизомерия
образовавшихся продуктов. Реакция присоединения хлористого водорода. Правило
Марковникова.
6.
Нуклеофильное присоединение к
двойной связи углерод-гетероатом. Влияние строения субстрата на скорость
реакции. Механизм катализированный кислотами и основаниями. Взаимодействие кетонов и альдегидов с
кислород и азот содержащими нуклеофилами. Альдольная и кротоновая
конденсация. Взаимодействие кислот
с кислород и азот содержащими нуклеофилами. Гидролиз производных карбоновых
кислот. Сложноэфирная конденсация.
Рекомендуемая литература
1 В.Л. Флорентьев. Органическая химия (ч I) МБ 1990г
2. Методические указания к практическим работам по
органической химии. МФТИ, М.1989
3. А. Терней. Современная органическая химия т.1,2, Изд.
«Мир».М.1981г
4. О.А. Реутов, А.Л. Курц, К.П. Бутин « Органическая
химия» т.1,2,3. Москва.2004
5. В.Л. Белобородов, С.Э.Зурабян, А.П. Лузин, Н.А.
Тюкавкина. Органическая химия. Основной курс т.1, Москва,
2004г.
6. И.И. Грандберг Органическая химия, ДРОФА, Москва
2001.