Загрузить PDF
Загрузить PDF
У органической химии не самая хорошая репутация — многие не раз слышали от студентов жуткие истории об этом предмете задолго до того, как сами начали знакомиться с ним. Действительно, предмет непростой, но и назвать его ужасным нельзя. В органической химии нужно больше разбираться в материале, чем просто запоминать его, а это — ключ к успешной сдаче экзамена.
-
1
Познакомьтесь с термином «органическая химия». Органическая химия изучает химические соединения на основе углерода.[1]
Углерод — шестой элемент периодической системы и один из важнейших «кирпичиков», из которых состоит все живое на земле. Живые организмы состоят из молекул, которые содержат углерод. Это означает, что органическая химия изучает и химические процессы, которые изо дня в день происходят в вашем организме. Кроме того, она включает в себя и химические процессы в организмах животных, в растениях и в природных экосистемах.- Однако органическая химия не ограничивается только живыми существами. К примеру, химические реакции, происходящие при горении природного топлива, также относятся к органической химии, поскольку при этих реакциях взаимодействуют органические вещества в топливе.
-
2
Научитесь изображать молекулы. В органической химии визуальное восприятие гораздо важнее, чем в общей химии. Вы будете рисовать молекулы и соединения чаще, чем на занятиях по общей химии, поэтому важно научиться расшифровывать и понимать эти рисунки.
- Вы уже знакомы со структурой Льюиса — этому учат на занятиях по общей химии. В структуре Льюиса атомы в молекуле обозначаются их химическим символом (то есть буквой в периодической таблице). Линии — это связи между атомами, а точки — валентные электроны. На WikiHow есть статьи, посвященные этой теме.
- Скорее всего, о скелетной формуле вы еще не слышали. В скелетной формуле атомы углерода не изображаются — есть только линия, которая используется для обозначения связи. Поскольку в органической химии очень много атомов углерода, так рисовать молекулы гораздо быстрее. Атомы прочих элементов изображаются их химическими символами. На этом сайте можно найти подробную информацию о скелетной формуле.[2]
-
3
Научитесь изображать связи. Чаще всего вы будете иметь дело с ковалентными связями, хотя вам также надо будет узнать, что такое ионная связь.[3]
При ковалентной связи два атома обмениваются непарными электронами. Если есть лишние непарные электроны, появляются двойные и тройные соединения.- Как в структуре Льюиса, так и в скелетной формуле единичные связи изображаются одной линией, двойные — двойной, тройные — тройной.
- В скелетной формуле связи между углеродом (С) и водородом (Н) не рисуются, поскольку они встречаются очень часто.
- За исключением особых случаев, у атомов может быть 8 валентных электронов (то есть электронов внешней оболочки). Таким образом, чаще всего атом может соединиться максимум с четырьмя другими атомами.
-
4
Ознакомьтесь с основами трехмерной молекулярной структуры. В органической химии вам нужно будет представлять молекулы в таком виде, в котором они существуют в действительности, а не только как на рисунке. Молекулы — это трехмерные образования. Форму молекулы определяет тип связей в ней, хотя и другие факторы могут оказывать на это влияние. Важно помнить о следующем:
- Углерод, связанный с другими атомами единичными связями, будет иметь форму тетраэдра (четырехгранной пирамиды). Примером может служить молекула метана (CH4).
- Углерод, связанный с другим атомом двойной связью и с двумя атомами единичными связями, имеет форму плоского треугольника. В качестве примера можно привести ион CO3-2.
- Углерод, соединенный с двумя атомами двойными связями или с одним атомом тройной связью, представляет собой прямую линию. Примером служит двуокись углерода — CO2.
-
5
Научитесь узнавать гибридизацию орбиталей. Звучит страшно, но все не так сложно, как кажется. Гибридные орбитали — это способ отображения валентных электронов атома на основе поведения атома (а не схемы). Если у атома есть несколько непарных электронов, но он предпочитает образовывать другое количество связей, считается, что у него есть гибридные орбитали.
- Углерод служит примером такого поведения. У атомов углерода четыре валентных электрона: два на орбитали 2s и два непарных на орбитали 2p. Поскольку у атома есть два непарных электрона, можно предположить, что он образует две связи. Однако в результате экспериментов было установлено, что связи формируют парные электроны на орбитали 2s. Таким образом, у углерода появляется 4 непарных электрона на гибридной орбитали sp.
-
6
Ознакомьтесь с основами электроотрицательности. Есть множество факторов, которые могут влиять на то, как молекулы будут взаимодействовать, но одним из важнейших факторов считается электроотрицательность. Электроотрицательность — это способ измерения того, с какой силой атом удерживает свои электроны. Атомы с высокой электроотрицательностью сильнее удерживают электроны, с низкой — слабее. На WikiHow есть статьи на эту тему.
- По мере продвижения вверх и направо в периодической системе элементов электроотрицательность атомов возрастает (исключение составляют водород и гелий). У фтора, крайнего элемента в верхнем правом углу, максимальная электроотрицательность.
- Поскольку электроотрицательные атомы стремятся получить больше электронов, они стараются схватиться за все доступные электроны других молекул. Например, атомы хлора и фтора часто становятся негативными ионами, потому что забирают электроны у других атомов.[4]
Реклама
-
1
Не бойтесь. В органической химии будет много новых понятий, и вы будете рассматривать некоторые явления с другой стороны. Вам нужно будет заучить много новых слов. Не переживайте — все в вашей группе пройдут через это. Учитесь прилежно и обращайтесь за помощью, если она вам потребуется, и все будет хорошо.
- Не позволяйте «страшилкам» студентов, которые сдавали экзамен по органической химии, запугать вас. Студенты часто гордятся тем, как им было сложно. Если на первой контрольной вы будете считать, что перед вами невыполнимая задача, вам будет еще сложнее.[5]
Лучше много занимайтесь и хорошо выспитесь накануне контрольной работы.
- Не позволяйте «страшилкам» студентов, которые сдавали экзамен по органической химии, запугать вас. Студенты часто гордятся тем, как им было сложно. Если на первой контрольной вы будете считать, что перед вами невыполнимая задача, вам будет еще сложнее.[5]
-
2
Старайтесь понимать, а не заучивать. Вы будете наблюдать за сотнями разных реакций. Запомнить их все практически нереально, поэтому не пытайтесь заучить их. Лучше сосредоточьтесь на основных принципах самых частых реакций. Многие реакции идут по одному и тому же сценарию, поэтому разберитесь в нем и знайте, как его применять, и это позволит вам решать уравнения без проблем.
- Если у вас хорошая память, используйте ее. Напишите основные механизмы реакций на карточках и заучивайте их. Конечно, вам придется изменить подход к уравнению, если вы увидите реакцию, которой раньше не видели, но знание основных принципов реакций поможет вам решить и такое уравнение.
-
3
Знайте необходимые функциональные группы. В органической химии используется один и тот же набор структур практически во всех молекулах. Эти структуры называются функциональными группами. Если вы научитесь узнавать их и будете знать, как они ведут себя при реакциях, вы сможете справиться с задачами по химии. Поскольку функциональные группы обычно всегда реагируют одинаково, знание их свойств поможет вам в самых разных упражнениях.
- В органической химии очень много функциональных групп, и перечислить все в этой статье невозможно. Найти учебные материалы по этой теме нетрудно. К примеру, можно почитать об этом здесь.
-
4
Если сомневаетесь, следите за движением электронов. На базовом уровне реакции в органической химии, как правило, подразумевают обмен электронами между двумя и более молекулами. Если вы не знаете, с чего начать в реакции, подумайте, куда переместились бы электроны. Иными словами, ищите атомы, которые могут принять электроны, и атомы, которые могут их отдать. Совершите обмен электронами и подумайте, что нужно сделать, чтобы привести молекулы к стабильному состоянию.
- Например, кислород (О) обладает большей электроотрицательностью, чем углерод, поэтому кислород с двойной связью с углеродом в кетонной группе будет стараться притянуть электроны ближе к себе. Из-за этого у углерода появится частично положительный заряд, и он сможет принимать электроны. Если в реакции участвует элемент, который готов отдавать электроны, он может напасть на кислород и образовать новую связь, в результате чего произойдет химическая реакция.
-
5
Готовьтесь к контрольным работам и делайте домашнее задание в группах. Не думайте, что вы обязаны заниматься в одиночестве, — попробуйте объединиться с одногруппниками. Они помогут вам разобраться в том, что вам сложно дается, а если вы сами будете объяснять что-то другим, вы лучше запомните материал.
Реклама
-
1
Познакомьтесь с преподавателем. Больше всего об этом предмете знает тот, кто его преподает, поэтому воспользуйтесь этим источником информации. Попросите преподавателя пояснить вам то, что вы не понимаете. Задавайте точные и четкие вопросы и объясняйте, что вам дается особенно тяжело. Будьте готовы пояснить ход своих мыслей, если дадите неверный ответ.
- Не стоит беспокоить преподавателя, если у вас нет четкого вопроса. Если вы просто скажете, что не понимаете задание на дом, это вам ничем не поможет.
- Важно не только получить ответы на вопросы, но и познакомиться с преподавателем. Помните, что хорошие оценки вам еще пригодятся. Преподаватели гораздо более благосклонны к тем, кто обращается к ним за помощью.
-
2
Используйте вспомогательные материалы для визуализации задач. В органической химии форма молекул влияет на то, как они реагируют. Поскольку изобразить трехмерные молекулы на плоскости сложно, можно использовать объемные фигуры при работе со сложными структурами.
- Наборы для построения молекул позволяют создавать трехмерные модели из пластиковых фигур. Стоят они недешево, но обычно они есть в кабинете химии, и ими можно пользоваться.
- Если у вас нет возможности воспользоваться специальным набором, попробуйте строить модели из мячиков, маркеров и деревянных палочек.
- Существуют специальные компьютерные программы (например, эта), которые позволяют строить трехмерные модели.[6]
-
3
Поищите ответы на свои вопросы на форумах. К счастью, в интернете многие ищут нужную им информацию по органической химии, и там есть люди, у которых есть ответы. Существуют форумы, посвященные органической химии, где обсуждаются сложные темы. Попробуйте разместить задачу, которую вы не можете решить, и пообщайтесь с людьми, которые вызовутся вам помочь.
- Если вы владеете английским языком, вам подойдет chemicalforums.com.[7]
- Если вы владеете английским языком, вам подойдет chemicalforums.com.[7]
-
4
Воспользуйтесь информацией интернет-ресурсов об органической химии. Есть много сайтов, посвященных этой теме. Ниже мы приводим список таких ресурсов (на английском языке):
-
Khan Academy: Здесь собраны видеозаписи лекций на самые разные темы.[8]
-
Chem Helper: Здесь есть тесты для тренировки, форумы, описания реакций и другая информация. Тут вы также найдете информацию о работе в лаборатории.[9]
- University of South Carolina Aiken: Здесь приводится список полезных ссылок на многие темы в рамках органической химии.
Реклама
-
Khan Academy: Здесь собраны видеозаписи лекций на самые разные темы.[8]
Советы
- Чем больше времени вы будете уделять органической химии, тем лучше вы будете знать предмет. Старайтесь выделять минмум час на изучение химии ежедневно, потому что регулярность важна не меньше, чем количество потраченного времени.
- Для понимания многих тем в органической химии будут полезны базовые знания физики. Старайтесь уделять достаточно времени этому предмету.
- На WikiHow есть статьи, которые помогут вам решать задачи по химии.
Реклама
Об этой статье
Эту страницу просматривали 28 644 раза.
Была ли эта статья полезной?
Download Article
Download Article
Organic Chemistry has a nasty reputation — it’s not uncommon for students to hear horror stories about the class’s difficulty before they have a chance to take it themselves. While the class can be a challenging one, «O Chem» isn’t the nightmare it’s often cracked up to be. There is less information to memorize but more processes to understand, so an understanding of the fundamentals and a good study regimen are key to getting a passing grade.
-
1
Learn the definition of «organic chemistry.» Generally speaking, organic chemistry is the study of carbon-based chemical compounds.[1]
Carbon is the sixth element in the periodic table and one of the most vital building blocks for life on earth. Living things are made up of molecules made mainly of carbon. This means that O chem includes the chemistry that goes on inside your body every day. It also includes the chemistry that occurs inside animals, plants, and natural ecosystems.- However, organic chemistry isn’t limited to living things. For example, the chemical reactions involved in the burning of fossil fuels fall under the O chem umbrella because these reactions involve carbon-based compounds in the fuels.
-
2
Learn the common ways of representing molecules. O chem is a more «visual» area of study than general chemistry. You will be relying on drawings of molecules and compounds more often than in previous chemistry classes. Knowing how to interpret these sorts of visual representations is one of the most basic, important O chem skills.
- You’ll need to be familiar with Lewis structures before you begin. These are typically taught as part of a general chemistry course. In a Lewis structure, atoms in a molecule are represented by their chemical symbol (their letters on the periodic table). Lines represent the bonds between them and dots represent their valence electrons. See our Lewis structure article for a refresher.
- One way of drawing molecules that will probably be new to you is the skeletal formula method. In a skeletal formula (also called «bond-line structure»), carbon atoms are not shown. Instead, there is just a line to represent the bond. Since there are so many carbon atoms in O chem, this makes it much quicker to draw molecules. Non-carbon atoms are still represented by their chemical symbols. A good guide to skeletal formations is available here.[2]
Advertisement
-
3
Learn how to represent bonds. Covalent bonds are by far the most common type of bonds you will be dealing with in O chem (though knowledge of ionic bonds, etc. is still valuable). In a covalent bond, two atoms share unpaired electrons to form a bond. If extra unpaired electrons are available, double- or triple-bonded atoms are possible.
- In both Lewis structures and skeletal formulas, single bonds are represented by one line, double lines by a double line, and triple bonds by a triple line.
- In skeletal formulas, the bonds between carbon (C) and hydrogen (H) atoms are not usually drawn because they are so common.
- Except in special circumstances, atoms are typically only allowed to have eight valence (outer shell) electrons. This means that most of the time an atom can bond to a maximum of four other atoms.
-
4
Learn the basics of 3-D molecular structure. Organic chemistry requires students to think about chemical molecules the way they actually exist in real life — not just the way they are drawn. Molecules take the form of three-dimensional structures. The nature of the bonds in the molecule is the most important thing for determining the 3-D shape of a molecule, though other factors can sometimes also play a role. Below are a few things to remember when it comes to the shapes of carbon-based molecules:
- A carbon bonded to four other atoms with single bonds will have the shape of a tetrahedron (four-pointed pyramid). A good example of this is the molecule methane (CH4)
- A carbon bonded to another atom with a double bond and two atoms with single bonds has a trigonal planar (flat triangle) shape. The ion CO3-2 is a good example here.
- A carbon bonded to two atoms with double bonds or bonded to one album with a triple bond has a linear (rigid line) shape. The molecule carbon dioxide (CO2) is one example.
-
5
Learn to decipher orbital hybridization. This topic has an intimidating name, but it’s not that hard to understand. Essentially, hybrid orbitals are just ways that chemists represent an atom’s valence electrons based on how that atom behaves (rather how it is drawn). If an atom has a certain number of unpaired electrons available for bonding but tends to form a different number of bonds, it is said that it has «hybrid orbitals» to make up the difference.
- Carbon is a perfect example of this. Carbon atoms have four valence electrons: two in the 2s orbital and two unpaired ones in the 2p orbital. Since there are two unpaired electrons, it might be expected that carbon will form two bonds. However, experiments show that the paired electrons in the 2s orbital form bonds even though they are not unpaired. Thus, we say that the carbon atom has four unpaired electrons in an sp hybrid orbital.
-
6
Learn the basics of electronegativity. There are many, many factors that can determine how two molecules react with each other in O chem. However, electronegativity is often one of the most important factors. Electronegativity is a way of measuring how «tightly» a given atom holds its electrons. Atoms with high electronegativity tend to hold their electrons tightly (and vice versa for atoms with low electronegativity). See our electronegativity article for detailed information.
- As you go up and to the right in the periodic table, atoms gain more electronegativity (hydrogen and helium are not included). Fluorine, the atom in the very top top right, has the highest electronegativity of all.
- Because electronegative atoms «want» more electrons, they tend to react by «grabbing» available electrons on other molecules. For example, atoms like chlorine and fluorine often appear as negative ions because they have taken electrons from other atoms.[3]
Advertisement
-
1
Don’t be intimidated. Organic chemistry introduces a lot of new concepts and forces you to think about chemistry problems in new ways. You will have to learn a whole new chemistry «vocabulary.» Relax — everyone in your class is facing the same challenges. Study diligently and get the help you need and you will likely be fine.
- Organic chemistry isn’t hard—you just have to reach a point where you can easily visualize it.[4]
- Don’t let horror stories from people who have taken O chem before get to you.[5]
Students tend to embellish how difficult their experiences were. Going into your first test terrified that you are facing an impossible challenge will only make things harder.[6]
Instead, boost your confidence by spending plenty of time studying and getting plenty of rest the night before. - O chem is not a math-heavy course. You will not have to do much arithmetic or algebra to pass this course. Rather, think of the subject more like learning a new language.[7]
- Organic chemistry isn’t hard—you just have to reach a point where you can easily visualize it.[4]
-
2
Focus on understanding rather than memorization. You will likely see hundreds of different reactions in your O chem class. It’s virtually impossible to memorize them all, so don’t waste your time memorizing any but the most important. Instead, focus on the basic principles behind the most common reactions. Most reactions follow one of just a few patterns, so understanding these patterns well and knowing how to apply them is a much more efficient way to get problems right.
- However, if you are good at memorization, you can still use this to your advantage. Try writing basic reaction mechanisms on flashcards and using these to memorize the reactions. You’ll still need to be able to adjust your knowledge when you see reactions that you’re not familiar with, but you can use the basic principles to guide you towards the correct mechanism.
- Repetition is a great way to better understand organic chemistry. As you study, grab a whiteboard and draw things over and over again.[8]
-
3
Know your functional groups. Basic O chem uses the same set of reactive structures in nearly all of its molecules. These structures are known as «functional groups.» Knowing how to identify these functional groups as well as how they tend to react it crucial for many O chem assignments. Since functional groups usually react in the same way with consistency, knowing their traits allows you to solve a wide variety of problems.
- There are too many functional groups in organic chemistry to list in this article. However, it’s not hard to find guides to the functional groups online. For example, a good guide from Purdue University is available here.
-
4
Learn the concepts of nucleophile and electrophile. Most organic reactions fall into three types: nucleophile/electrophile, pericyclic, and radical, and by far the most common are nucleophile/electrophile reactions. Some important classes of reagents you will need to know about are:
- Nucleophile: a species that’s got extra electrons to share. Look out for negatively charged species, double bonds, or neutral species with lone pairs. Examples include hydroxide, pyridine, iodide, alkenes, enolates, and Grignard reagents.
- Electrophile: a species that is looking for a pair of electrons. Look out for partial or fully positively charged species. Examples include carbocations, hydrogen halide acids, haloalkanes, hydronium ions, and carbonyls.
- The diatomic halogens (Cl2, Br2) do not bear positive charges, but the bond between the two halogen atoms is weak and they are able to make stable anions, rendering them susceptible to nucleophilic attack.
- Radical: any species with uncharged electrons. This could include a bromine atom, for example. When these species react, they tend to make one «normal» molecule, along with another radical.
- Diene: a species that has two double bonds separated by a single bond (conjugated double bonds); these participate in pericyclic reactions. Common compounds of this type include furan, Cyclopentadiene, and 1,3-butadiene.
- Dienophile: a species that reacts with dienes in a pericyclic reaction. Look out for an alkene conjugated to a carbonyl group (an α,β-unsaturated carbonyl compound) such as ethyl acrylate, methyl vinyl ketone, or cyanoacrylate.
-
5
When in doubt, follow the flow of electrons. At their most basic level, most organic chemistry reactions just involve two or more molecules exchanging electrons. If you can’t figure out how to get started on a reaction mechanism, start by looking for places where it makes sense for electrons to transfer. In other words, look for atoms that seem like especially good electron acceptors and atoms that look like especially good electron donors. Make the transfer and then ask, «what do I need to do now to get my new molecules to a stable state?»
- As one example, since oxygen (O) is more electronegative than carbon, the O that is double-bonded to C in a ketone group tends to hold the electrons in the bond closer to itself. This gives C a partially positive charge and makes it a good candidate to receive electrons. If you have a good electron donor involved in the reaction, it makes sense that it might attack the C, forming a new bond and kicking off your reaction.
-
6
Use study groups for homework and tests. Don’t ever feel like you need to tackle organic chemistry by yourself. Getting together to do your work with your fellow students is a fantastic idea. Not only can others help you with concepts you’re struggling with — you can also get a stronger grasp on material you already know by explaining it to someone else.
Advertisement
-
1
Get to know your professor. The person with the best knowledge of O chem in your classroom is the person teaching the class. Take advantage of this valuable resource. Visit your teacher’s office to discuss areas you are having trouble with. Try to have a few clear, succinct questions to ask or a problem or two that you are having trouble with. Be ready to explain the thought process that got you to the wrong answer.
- Avoid walking into your professor’s office without a clear idea of what you want. Simply saying «I don’t get the homework» won’t get you useful help.
- Not only is this a great way of getting your questions answered — it can also help you get to know your professor. Keep in mind that if you’re aiming for grad school, you will need a few academic references in the future. Professors are much more likely to write positively of people that took the time to talk to them.
- If you can’t get a hold of your professor, then look around for their research lab and student office. Most professors employ a few graduate students in their labs, and they may be willing to help you with questions.
-
2
Use tools to help visualize problems. In O chem, the shapes of molecules can determine how they react. Because it can be difficult to represent complex 3D molecules on a flat piece of paper, using physical building blocks is a great way to wrap your head around difficult structures.
- Molecular model sets allow you to build molecules out of plastic pieces. These can be somewhat expensive if you buy them from your school’s book store or a chemical supplier, but some professors will loan them out to students who ask for them at no cost.
- If you can’t get your hands on a «real» model set, try using foam balls, markers, and wooden dowels from your local craft store for a DIY alternative.
- Various computer programs (like the one available here) can also help you model molecules in three dimensions.[9]
-
3
Join the discussion on help forums. One of the silver linings of O chemistry’s high difficulty level is that there are lots of students looking for help online (as well as offering it). Various online chemistry forums have large communities of users willing to discuss difficult organic topics. Try posting a problem that you’re having trouble with on one of these forums, then work with the people who respond to get the help you need.
- Though there are many forums for these sorts of problems, chemicalforums.com is a good place to start.[10]
- Though there are many forums for these sorts of problems, chemicalforums.com is a good place to start.[10]
-
4
Use online O chem resources. A wide variety of sites can help with difficult O chem topics. Just a few good resources are listed below:
-
Khan Academy: Hosts numerous video lectures covering a variety of basic topics.[11]
-
Chem Helper: Has links to practice tests, help forums, reaction mechanisms, and more. Also includes laboratory help.[12]
- University of South Carolina Aiken: Includes its own directory of helpful websites covering a variety of O chem topics.
-
Khan Academy: Hosts numerous video lectures covering a variety of basic topics.[11]
Advertisement
Add New Question
-
Question
How do you finish a difficult homework problem?
Dr. Chris Hasegawa was a Science Professor and the Dean at California State University Monterey Bay. Dr. Hasegawa specializes in teaching complex scientific concepts to students. He holds a BS in Biochemistry, a Master’s in Education, and his teaching credential from The University of California, Davis. He earned his PhD in Curriculum and Instruction from The University of Oregon. Before becoming a professor, Dr. Hasegawa conducted biochemical research in Neuropharmacology at the National Institute of Health. He also taught physical and life sciences and served as a teacher and administrator at public schools in California, Oregon, and Arizona.
Retired Science Professor & Dean
Expert Answer
Take a picture of the homework problem and send it to someone who really understands the material. They can help walk you through whatever you’re struggling with.
-
Question
Is organic chemistry more difficult than general chemistry?
Dr. Chris Hasegawa was a Science Professor and the Dean at California State University Monterey Bay. Dr. Hasegawa specializes in teaching complex scientific concepts to students. He holds a BS in Biochemistry, a Master’s in Education, and his teaching credential from The University of California, Davis. He earned his PhD in Curriculum and Instruction from The University of Oregon. Before becoming a professor, Dr. Hasegawa conducted biochemical research in Neuropharmacology at the National Institute of Health. He also taught physical and life sciences and served as a teacher and administrator at public schools in California, Oregon, and Arizona.
Retired Science Professor & Dean
Expert Answer
Not necessarily! A lot of students make organic chemistry out to be one of the toughest classes in the world, but it really isn’t. You just need to take the time to draw things out so you can visualize them.
-
Question
How can I learn organic chemistry?
Studying organic chemistry is like studying a language. It has its own alphabet. First study the alphabet (i.e. basics). Then study, write down and now try to solve the problems.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
-
A basic physics background can be a big help when it comes to understanding numerous O chem topics. If your school allows you, try taking the introductory physics class series before enrolling in organic.
-
See our list of O chem articles for step-by-step help with many organic tasks.
-
The more time you devote to O chem, the more confident you’ll be in the most important basic concepts. Try to devote at least an hour or two each day to your O chem studies — consistency is just as important as the amount of time you spend.
Advertisement
References
About This Article
Article SummaryX
To pass organic chemistry, focus on understanding the basic principles behind the most common reactions, since most reactions follow one of just a few patterns. Additionally, see if you can get a molecular model set, or find an online molecule modeling program, then use it to help you visualize and solve problems. You might also want to consider forming a study group with classmates, who can help answer your questions and help you solidify your own knowledge as you answer theirs. For tips on how to follow the flow of electrons to figure out what’s going on in a chemical reaction, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 161,094 times.
Reader Success Stories
-
Amitanshu Ray
Sep 20, 2017
«I didn’t know about organic chemistry. Is it like everything has to rooted or can it be understood too? This…» more
Did this article help you?
Download Article
Download Article
Organic Chemistry has a nasty reputation — it’s not uncommon for students to hear horror stories about the class’s difficulty before they have a chance to take it themselves. While the class can be a challenging one, «O Chem» isn’t the nightmare it’s often cracked up to be. There is less information to memorize but more processes to understand, so an understanding of the fundamentals and a good study regimen are key to getting a passing grade.
-
1
Learn the definition of «organic chemistry.» Generally speaking, organic chemistry is the study of carbon-based chemical compounds.[1]
Carbon is the sixth element in the periodic table and one of the most vital building blocks for life on earth. Living things are made up of molecules made mainly of carbon. This means that O chem includes the chemistry that goes on inside your body every day. It also includes the chemistry that occurs inside animals, plants, and natural ecosystems.- However, organic chemistry isn’t limited to living things. For example, the chemical reactions involved in the burning of fossil fuels fall under the O chem umbrella because these reactions involve carbon-based compounds in the fuels.
-
2
Learn the common ways of representing molecules. O chem is a more «visual» area of study than general chemistry. You will be relying on drawings of molecules and compounds more often than in previous chemistry classes. Knowing how to interpret these sorts of visual representations is one of the most basic, important O chem skills.
- You’ll need to be familiar with Lewis structures before you begin. These are typically taught as part of a general chemistry course. In a Lewis structure, atoms in a molecule are represented by their chemical symbol (their letters on the periodic table). Lines represent the bonds between them and dots represent their valence electrons. See our Lewis structure article for a refresher.
- One way of drawing molecules that will probably be new to you is the skeletal formula method. In a skeletal formula (also called «bond-line structure»), carbon atoms are not shown. Instead, there is just a line to represent the bond. Since there are so many carbon atoms in O chem, this makes it much quicker to draw molecules. Non-carbon atoms are still represented by their chemical symbols. A good guide to skeletal formations is available here.[2]
Advertisement
-
3
Learn how to represent bonds. Covalent bonds are by far the most common type of bonds you will be dealing with in O chem (though knowledge of ionic bonds, etc. is still valuable). In a covalent bond, two atoms share unpaired electrons to form a bond. If extra unpaired electrons are available, double- or triple-bonded atoms are possible.
- In both Lewis structures and skeletal formulas, single bonds are represented by one line, double lines by a double line, and triple bonds by a triple line.
- In skeletal formulas, the bonds between carbon (C) and hydrogen (H) atoms are not usually drawn because they are so common.
- Except in special circumstances, atoms are typically only allowed to have eight valence (outer shell) electrons. This means that most of the time an atom can bond to a maximum of four other atoms.
-
4
Learn the basics of 3-D molecular structure. Organic chemistry requires students to think about chemical molecules the way they actually exist in real life — not just the way they are drawn. Molecules take the form of three-dimensional structures. The nature of the bonds in the molecule is the most important thing for determining the 3-D shape of a molecule, though other factors can sometimes also play a role. Below are a few things to remember when it comes to the shapes of carbon-based molecules:
- A carbon bonded to four other atoms with single bonds will have the shape of a tetrahedron (four-pointed pyramid). A good example of this is the molecule methane (CH4)
- A carbon bonded to another atom with a double bond and two atoms with single bonds has a trigonal planar (flat triangle) shape. The ion CO3-2 is a good example here.
- A carbon bonded to two atoms with double bonds or bonded to one album with a triple bond has a linear (rigid line) shape. The molecule carbon dioxide (CO2) is one example.
-
5
Learn to decipher orbital hybridization. This topic has an intimidating name, but it’s not that hard to understand. Essentially, hybrid orbitals are just ways that chemists represent an atom’s valence electrons based on how that atom behaves (rather how it is drawn). If an atom has a certain number of unpaired electrons available for bonding but tends to form a different number of bonds, it is said that it has «hybrid orbitals» to make up the difference.
- Carbon is a perfect example of this. Carbon atoms have four valence electrons: two in the 2s orbital and two unpaired ones in the 2p orbital. Since there are two unpaired electrons, it might be expected that carbon will form two bonds. However, experiments show that the paired electrons in the 2s orbital form bonds even though they are not unpaired. Thus, we say that the carbon atom has four unpaired electrons in an sp hybrid orbital.
-
6
Learn the basics of electronegativity. There are many, many factors that can determine how two molecules react with each other in O chem. However, electronegativity is often one of the most important factors. Electronegativity is a way of measuring how «tightly» a given atom holds its electrons. Atoms with high electronegativity tend to hold their electrons tightly (and vice versa for atoms with low electronegativity). See our electronegativity article for detailed information.
- As you go up and to the right in the periodic table, atoms gain more electronegativity (hydrogen and helium are not included). Fluorine, the atom in the very top top right, has the highest electronegativity of all.
- Because electronegative atoms «want» more electrons, they tend to react by «grabbing» available electrons on other molecules. For example, atoms like chlorine and fluorine often appear as negative ions because they have taken electrons from other atoms.[3]
Advertisement
-
1
Don’t be intimidated. Organic chemistry introduces a lot of new concepts and forces you to think about chemistry problems in new ways. You will have to learn a whole new chemistry «vocabulary.» Relax — everyone in your class is facing the same challenges. Study diligently and get the help you need and you will likely be fine.
- Organic chemistry isn’t hard—you just have to reach a point where you can easily visualize it.[4]
- Don’t let horror stories from people who have taken O chem before get to you.[5]
Students tend to embellish how difficult their experiences were. Going into your first test terrified that you are facing an impossible challenge will only make things harder.[6]
Instead, boost your confidence by spending plenty of time studying and getting plenty of rest the night before. - O chem is not a math-heavy course. You will not have to do much arithmetic or algebra to pass this course. Rather, think of the subject more like learning a new language.[7]
- Organic chemistry isn’t hard—you just have to reach a point where you can easily visualize it.[4]
-
2
Focus on understanding rather than memorization. You will likely see hundreds of different reactions in your O chem class. It’s virtually impossible to memorize them all, so don’t waste your time memorizing any but the most important. Instead, focus on the basic principles behind the most common reactions. Most reactions follow one of just a few patterns, so understanding these patterns well and knowing how to apply them is a much more efficient way to get problems right.
- However, if you are good at memorization, you can still use this to your advantage. Try writing basic reaction mechanisms on flashcards and using these to memorize the reactions. You’ll still need to be able to adjust your knowledge when you see reactions that you’re not familiar with, but you can use the basic principles to guide you towards the correct mechanism.
- Repetition is a great way to better understand organic chemistry. As you study, grab a whiteboard and draw things over and over again.[8]
-
3
Know your functional groups. Basic O chem uses the same set of reactive structures in nearly all of its molecules. These structures are known as «functional groups.» Knowing how to identify these functional groups as well as how they tend to react it crucial for many O chem assignments. Since functional groups usually react in the same way with consistency, knowing their traits allows you to solve a wide variety of problems.
- There are too many functional groups in organic chemistry to list in this article. However, it’s not hard to find guides to the functional groups online. For example, a good guide from Purdue University is available here.
-
4
Learn the concepts of nucleophile and electrophile. Most organic reactions fall into three types: nucleophile/electrophile, pericyclic, and radical, and by far the most common are nucleophile/electrophile reactions. Some important classes of reagents you will need to know about are:
- Nucleophile: a species that’s got extra electrons to share. Look out for negatively charged species, double bonds, or neutral species with lone pairs. Examples include hydroxide, pyridine, iodide, alkenes, enolates, and Grignard reagents.
- Electrophile: a species that is looking for a pair of electrons. Look out for partial or fully positively charged species. Examples include carbocations, hydrogen halide acids, haloalkanes, hydronium ions, and carbonyls.
- The diatomic halogens (Cl2, Br2) do not bear positive charges, but the bond between the two halogen atoms is weak and they are able to make stable anions, rendering them susceptible to nucleophilic attack.
- Radical: any species with uncharged electrons. This could include a bromine atom, for example. When these species react, they tend to make one «normal» molecule, along with another radical.
- Diene: a species that has two double bonds separated by a single bond (conjugated double bonds); these participate in pericyclic reactions. Common compounds of this type include furan, Cyclopentadiene, and 1,3-butadiene.
- Dienophile: a species that reacts with dienes in a pericyclic reaction. Look out for an alkene conjugated to a carbonyl group (an α,β-unsaturated carbonyl compound) such as ethyl acrylate, methyl vinyl ketone, or cyanoacrylate.
-
5
When in doubt, follow the flow of electrons. At their most basic level, most organic chemistry reactions just involve two or more molecules exchanging electrons. If you can’t figure out how to get started on a reaction mechanism, start by looking for places where it makes sense for electrons to transfer. In other words, look for atoms that seem like especially good electron acceptors and atoms that look like especially good electron donors. Make the transfer and then ask, «what do I need to do now to get my new molecules to a stable state?»
- As one example, since oxygen (O) is more electronegative than carbon, the O that is double-bonded to C in a ketone group tends to hold the electrons in the bond closer to itself. This gives C a partially positive charge and makes it a good candidate to receive electrons. If you have a good electron donor involved in the reaction, it makes sense that it might attack the C, forming a new bond and kicking off your reaction.
-
6
Use study groups for homework and tests. Don’t ever feel like you need to tackle organic chemistry by yourself. Getting together to do your work with your fellow students is a fantastic idea. Not only can others help you with concepts you’re struggling with — you can also get a stronger grasp on material you already know by explaining it to someone else.
Advertisement
-
1
Get to know your professor. The person with the best knowledge of O chem in your classroom is the person teaching the class. Take advantage of this valuable resource. Visit your teacher’s office to discuss areas you are having trouble with. Try to have a few clear, succinct questions to ask or a problem or two that you are having trouble with. Be ready to explain the thought process that got you to the wrong answer.
- Avoid walking into your professor’s office without a clear idea of what you want. Simply saying «I don’t get the homework» won’t get you useful help.
- Not only is this a great way of getting your questions answered — it can also help you get to know your professor. Keep in mind that if you’re aiming for grad school, you will need a few academic references in the future. Professors are much more likely to write positively of people that took the time to talk to them.
- If you can’t get a hold of your professor, then look around for their research lab and student office. Most professors employ a few graduate students in their labs, and they may be willing to help you with questions.
-
2
Use tools to help visualize problems. In O chem, the shapes of molecules can determine how they react. Because it can be difficult to represent complex 3D molecules on a flat piece of paper, using physical building blocks is a great way to wrap your head around difficult structures.
- Molecular model sets allow you to build molecules out of plastic pieces. These can be somewhat expensive if you buy them from your school’s book store or a chemical supplier, but some professors will loan them out to students who ask for them at no cost.
- If you can’t get your hands on a «real» model set, try using foam balls, markers, and wooden dowels from your local craft store for a DIY alternative.
- Various computer programs (like the one available here) can also help you model molecules in three dimensions.[9]
-
3
Join the discussion on help forums. One of the silver linings of O chemistry’s high difficulty level is that there are lots of students looking for help online (as well as offering it). Various online chemistry forums have large communities of users willing to discuss difficult organic topics. Try posting a problem that you’re having trouble with on one of these forums, then work with the people who respond to get the help you need.
- Though there are many forums for these sorts of problems, chemicalforums.com is a good place to start.[10]
- Though there are many forums for these sorts of problems, chemicalforums.com is a good place to start.[10]
-
4
Use online O chem resources. A wide variety of sites can help with difficult O chem topics. Just a few good resources are listed below:
-
Khan Academy: Hosts numerous video lectures covering a variety of basic topics.[11]
-
Chem Helper: Has links to practice tests, help forums, reaction mechanisms, and more. Also includes laboratory help.[12]
- University of South Carolina Aiken: Includes its own directory of helpful websites covering a variety of O chem topics.
-
Khan Academy: Hosts numerous video lectures covering a variety of basic topics.[11]
Advertisement
Add New Question
-
Question
How do you finish a difficult homework problem?
Dr. Chris Hasegawa was a Science Professor and the Dean at California State University Monterey Bay. Dr. Hasegawa specializes in teaching complex scientific concepts to students. He holds a BS in Biochemistry, a Master’s in Education, and his teaching credential from The University of California, Davis. He earned his PhD in Curriculum and Instruction from The University of Oregon. Before becoming a professor, Dr. Hasegawa conducted biochemical research in Neuropharmacology at the National Institute of Health. He also taught physical and life sciences and served as a teacher and administrator at public schools in California, Oregon, and Arizona.
Retired Science Professor & Dean
Expert Answer
Take a picture of the homework problem and send it to someone who really understands the material. They can help walk you through whatever you’re struggling with.
-
Question
Is organic chemistry more difficult than general chemistry?
Dr. Chris Hasegawa was a Science Professor and the Dean at California State University Monterey Bay. Dr. Hasegawa specializes in teaching complex scientific concepts to students. He holds a BS in Biochemistry, a Master’s in Education, and his teaching credential from The University of California, Davis. He earned his PhD in Curriculum and Instruction from The University of Oregon. Before becoming a professor, Dr. Hasegawa conducted biochemical research in Neuropharmacology at the National Institute of Health. He also taught physical and life sciences and served as a teacher and administrator at public schools in California, Oregon, and Arizona.
Retired Science Professor & Dean
Expert Answer
Not necessarily! A lot of students make organic chemistry out to be one of the toughest classes in the world, but it really isn’t. You just need to take the time to draw things out so you can visualize them.
-
Question
How can I learn organic chemistry?
Studying organic chemistry is like studying a language. It has its own alphabet. First study the alphabet (i.e. basics). Then study, write down and now try to solve the problems.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
-
A basic physics background can be a big help when it comes to understanding numerous O chem topics. If your school allows you, try taking the introductory physics class series before enrolling in organic.
-
See our list of O chem articles for step-by-step help with many organic tasks.
-
The more time you devote to O chem, the more confident you’ll be in the most important basic concepts. Try to devote at least an hour or two each day to your O chem studies — consistency is just as important as the amount of time you spend.
Advertisement
References
About This Article
Article SummaryX
To pass organic chemistry, focus on understanding the basic principles behind the most common reactions, since most reactions follow one of just a few patterns. Additionally, see if you can get a molecular model set, or find an online molecule modeling program, then use it to help you visualize and solve problems. You might also want to consider forming a study group with classmates, who can help answer your questions and help you solidify your own knowledge as you answer theirs. For tips on how to follow the flow of electrons to figure out what’s going on in a chemical reaction, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 161,094 times.
Reader Success Stories
-
Amitanshu Ray
Sep 20, 2017
«I didn’t know about organic chemistry. Is it like everything has to rooted or can it be understood too? This…» more
Did this article help you?
Автор:
Roger Morrison
Дата создания:
3 Сентябрь 2021
Дата обновления:
2 Март 2023
Содержание
- этапы
- Часть 1 Знание основных правил органической химии
- Часть 2 Следуйте нескольким полезным советам по учебе
- Часть 3 Получение помощи
В этой статье: Знать основные правила органической химии. Следуйте несколько полезных советов для его изучения.
Органическая химия имеет очень плохую репутацию. На самом деле, перед сдачей экзамена студенты очень часто слышат ужасные истории о трудностях этого предмета. Хотя этот вопрос немного сложен, в глубине души органическая химия — это не кошмар, как кажется. Есть очень мало концепций для запоминания, но много механизмов для ассимиляции. Поэтому, если вы хотите успешно сдать следующий экзамен по органической химии, вы должны понять основные правила и создать эффективный метод работы.
этапы
Часть 1 Знание основных правил органической химии
-
Изучите определение органической химии. В целом этот предмет относится к изучению химических соединений, содержащих атомы углерода. Углерод является шестым элементом периодической таблицы и одним из важнейших элементов жизни на Земле. Живые существа состоят из молекул, которые состоят в основном из углерода. Другими словами, органическая химия имеет дело с химическими процессами, которые происходят в вашем теле каждый день. Это также включает все химические процессы, которые происходят в растениях, животных и экосистемах.
- Однако органическая химия не ограничивается живыми существами. Например, химические реакции, которые происходят во время сжигания ископаемого топлива, напрямую связаны с органической химией, поскольку в этих реакциях участвуют соединения на основе углерода.
-
Научитесь представлять молекулы. Органическая химия является предметом гораздо большего изучения визуальный чем общая химия. Вам придется полагаться на схематические рисунки молекул и соединений, чаще, чем во втором цикле. Понимание того, как интерпретировать эти представления, является одним из наиболее важных базовых навыков для изучения органической химии.
- Прежде чем начать, вы должны ознакомиться со структурами Льюиса. Это основное понятие часто преподается в общей химии. Согласно этому графическому представлению, атомы молекулы представлены их химическим символом (буквы в периодической таблице). Линии представляют связи, а точки представляют собой валентные электроны. Чтобы освежить вашу память, посмотрите эту статью.
- Концепция топологических формул, которая может показаться вам новой, является еще одним способом представления молекул. В топологической формуле атомы углерода не представлены. Вместо этого сегменты используются для представления ссылок. Поскольку атомы углерода являются фундаментальным элементом в органической химии, топологическая формула позволяет рисовать молекулы гораздо быстрее. Все неуглеродные атомы представлены их химическим символом. Здесь вы найдете более подробное объяснение топологических представлений.
-
Узнайте, как представлять ссылки. Ковалентные связи, безусловно, являются наиболее распространенными связями, с которыми вы столкнетесь в органической химии (хотя хорошее понимание ионных связей и других типов связей все еще важно). В ковалентной связи два атома имеют одинаковые электроны и образуют связь. Если есть больше неспаренных электронов, они образуют двойную или тройную связь.
- Как в топологических формулах, так и в структурах Льюиса одинарная связь представлена линией, двойная связь — двумя линиями, а тройная связь — тремя линиями.
- В топологических формулах связи между углеродом (C) и водородом (H) не представлены, потому что эти атомы широко используются.
- За исключением особых обстоятельств, атомы могут иметь только восемь валентных электронов (электронных слоев). Это означает, что в большинстве случаев один атом может связывать не более четырех других атомов.
-
Научитесь представлять молекулярные структуры в 3D. В органической химии студенты должны научиться визуализировать фактическую форму молекул, а не просто нарисовать их на листе. Молекулы имеют трехмерную структуру. Природа связей между атомами является наиболее важным фактором, определяющим трехмерную форму молекулы, хотя и не единственным. Вот список вещей, которые нужно помнить, когда вы изучаете трехмерные формы молекул на основе углерода.
- Атом углерода, соединенный с четырьмя другими атомами одинарными связями, принимает форму тетраэдра (пирамиды с четырьмя вершинами). Хорошим примером этой структуры является метан (CH4).
- Когда углерод связан с другим атомом с двойной связью и с двумя другими атомами с одинарными связями, говорят, что он имеет тригональная плоскость молекулярной геометрии (плоский треугольник). Lion CO3 это пример.
- Углерод, который связан с двумя атомами с двойными связями или с атомом с тройной связью, имеет линейная геометрия (жесткая линия). Двуокись углерода (СО2) является примером.
-
Научитесь расшифровывать гибридизацию атомных орбиталей. Это может показаться пугающим как термин, но это понятие не так сложно понять. По сути, модель гибридных орбиталей — это просто метод, с помощью которого химики представляют валентные электроны атома на основе его поведения (а не его представления). Если у атома есть несколько одиночных электронов для связывания, но он имеет тенденцию образовывать различное количество связей, то говорят, что этот атом имеет гибридные орбитали, чтобы описать это различие.
- Углерод является прекрасным примером. Он имеет 4 валентных электрона, два из которых занимают 2s-лорбитал и два свободных электрона, которые занимают 2p-лорбитал. Поскольку существует два свободных электрона, можно подумать, что углерод образует две связи. Однако эксперименты показали, что электроны, сгруппированные в орбитальную форму 2s, связываются, даже если они не являются свободными. Следовательно, атом углерода имеет четыре неспаренных электрона, содержащихся в sp-гибридной орбите.
-
Изучите основы электроотрицательности. В органической химии есть много факторов, которые определяют, как две молекулы реагируют друг с другом. Однако электроотрицательность часто является одним из этих наиболее важных факторов. Электроотрицательность — это величина, которая характеризует, как атом сохраняет свои электроны.Атомы с высокой электроотрицательностью имеют тенденцию сохранять свои электроны (и наоборот для атомов со слабой электроотрицательностью). Для более подробной информации по этой теме, см. Эту статью.
- Электроотрицательность атома увеличивается слева направо и снизу вверх в периодической таблице (гелий и водород не являются его частью). Фтор, элемент в верхнем правом углу, обладает наибольшей электроотрицательностью.
- Поскольку электроотрицательные атомы склонны привлекать другие электроны они монополизировать свободные электроны, которыми обладают другие молекулы. Например, атомы, такие как хлор и фтор, часто принимают форму отрицательных ионов после краденых электроны от других атомов.
Часть 2 Следуйте нескольким полезным советам по учебе
-
Не пугайтесь. Органическая химия представляет большое количество понятий и требует от вас задуматься о проблемах химии в новых формах. Также вам придется выучить лексику общих терминов химии. Расслабьтесь, все ваши одноклассники сталкиваются с той же проблемой. Прилежно учитесь, при необходимости обратитесь за помощью, и вы увидите, что все будет хорошо.
- Некоторые кандидаты, которые сдали экзамен, прежде чем вы могли бы рассказать кучу ужасных историй на эту тему. Не слушай их! Люди имеют привычку немного преувеличивать в своем опыте. Пройдя свой первый экзамен, будучи напуганным и убежденным перед лицом невозможного испытания, вы только усложните ситуацию. Напротив, вы должны обрести уверенность, много изучая и правильно отдыхая в ночь перед экзаменом.
-
Понимать концепции, а не запоминать их. На уроке вы наверняка изучите сотни разных реакций. Практически невозможно выучить их наизусть, поэтому не теряйте времени и ограничивайтесь только самыми важными. Вместо этого сосредоточьтесь на основных принципах, которые управляют наиболее распространенными химическими реакциями. Большинство реакций очень редко следуют одинаковым схемам. Итак, если вы хотите правильно решать проблемы органической химии, вам нужно знать их и знать, как их применять.
- Однако, если вы умеете сдерживать, вы можете использовать это умение в своих интересах. Попробуйте описать механизмы элементарных реакций на маленьких карточках и использовать их для запоминания. Вам всегда нужно будет корректировать свои знания, когда вы сталкиваетесь с новыми химическими реакциями в упражнениях, но вы можете использовать те же самые базовые принципы, чтобы правильно написать механизм.
-
Изучите функциональные группы. Базовая органическая химия использует одинаковый набор структур практически во всех молекулах. Мы говорим о функциональные группы описать эти структуры. Знание того, как определить эти группы и понять, как они реагируют, является важным шагом в решении проблем органической химии. Поскольку функциональные группы постоянно реагируют одинаково, знание их характеристик позволит вам решить ряд проблем.
- Функциональных групп в органической химии слишком много, чтобы перечислить в этой статье. Тем не менее, вы можете легко найти ресурсы в Интернете, которые помогут вам для этой цели. Например, нажмите на эту ссылку для получения дополнительной информации.
-
Если сомневаетесь, следите за потоком электронов. На самом базовом уровне в большинстве органических реакций участвуют только две или более молекул, способных обмениваться электронами. Если вы не можете написать механизм реакции, начните оценивать, где вы можете разумно перемещать электроны. Другими словами, ищите атомы, которые кажутся акцепторами электронов, и те, которые кажутся донорами электронов. Перейдите и задайте себе этот вопрос: Что я могу сделать сейчас, чтобы сделать молекулы стабильными?
- Например, поскольку кислород (О) является более электроотрицательным, чем углерод, кислородный атом, который присоединяется посредством двойной углеродной связи в кетонной группе, стремится удерживать электроны ближе к себе. Это передает небольшой положительный заряд углероду и позволяет ему привлекать свободные электроны. Если в реакции присутствует атом, который имеет тенденцию высвобождать электроны, то логично, что он связывается с углеродом, образуя новую связь и вызывая реакцию.
-
Сформировать учебную группу. Никогда не верьте, что вы можете делать упражнения по органической химии в одиночку. Делать домашнее задание с другими одноклассниками — отличная идея. Не только другие могут помочь вам лучше понять концепции, которые кажутся вам сложными, но в то же время вы можете укрепить свои знания, объяснив то, что вы уже знаете.
Часть 3 Получение помощи
-
Узнайте своего учителя лучше. Человек, который лучше всех знает органическую химию в вашем классе, без сомнения, ваш учитель. Наслаждайтесь этим очень ценным ресурсом. Пойдите в офис своего учителя, чтобы обсудить понятия, которые Вы не понимаете. Постарайтесь задать ему несколько четких и кратких вопросов или упражнений, с которыми вам трудно иметь дело. Приготовьтесь объяснить причину, которая приводит вас к неправильному решению.
- Старайтесь не связываться со своим учителем, не имея четкого представления о том, что вы хотите его спросить. Просто скажи Я не понимаю упражнение не сильно поможет.
- Это не только отличная возможность найти ответы на свои вопросы, но и способ лучше узнать своего учителя. Помните, что если вы хотите пройти третий цикл, вам также понадобятся некоторые академические рекомендации. Учителя готовы написать положительное рекомендательное письмо о студентах, которые потрудились поговорить с ними.
-
Используйте инструменты для визуализации проблем. В органической химии форма молекул определяет, как они реагируют. Поскольку сложно создать трехмерное графическое представление сложных молекул, вы можете использовать синтоны (также называемые строительными блоками) для анализа сложных структур.
- Молекулярные модели — это инструменты, которые позволят вам представить молекулы с пластиковыми деталями. Они могут быть немного дороже, если вы покупаете их в книжном магазине университета или в магазине лабораторного и научного оборудования. Тем не менее, некоторые учителя одалживают их студентам, которые просят их.
- Если у вас нет молекулярной модели, используйте пенопластовые шарики, маркеры и деревянные дюбели. Вы можете легко найти их в ремесленных магазинах.
- Есть также несколько компьютерных программ (таких как ChemDraw), которые могут помочь вам визуализировать молекулы в 3D.
-
Присоединяйтесь к онлайн-форуму. Одна из положительных сторон уровня сложности органической химии заключается в том, что многие студенты ищут помощь в Интернете, а также помогают другим ученикам. Существует множество форумов, состоящих из больших сообществ людей, которые хотят обсудить самые сложные вопросы органической химии. Попробуйте опубликовать упражнение по проблеме на одном из этих форумов, а затем обсудите с людьми, которые ответят вам, чтобы найти решение.
- Хотя есть много форумов для таких проблем, этот является хорошей отправной точкой.
-
Используйте онлайн-ресурсы. Есть много сайтов, которые могут помочь вам решить самые сложные темы органической химии. Вот некоторые из них.
- Органическая химия: это отличный ресурс, и вы найдете книги, лексики и интересные статьи.
- Eduscol: хотя он не обновлялся с 2016 года, на этом сайте есть несколько курсов химии, которые помогут вам лучше понять эту науку. Вы также найдете упражнения, а также практическую работу.
- UNISCIEL: Этот сайт предлагает большое количество качественных цифровых ресурсов в нескольких научных дисциплинах, включая химию.
Поделиться

Как избавиться от муравьев плотника
В этой статье: Найти гнездоУдалить популяцию муравьев. Предотвратить возвращение муравьев плотника. Муравьи-плотники обычно строят свое гнездо из дерева, которое было разрушено водой, поэтому их часто…

Как избавиться от боли при артрите
В этой статье: Облегчение боли с помощью лекарств и пищевых добавок. Уменьшение боли путем изменения образа жизни. Боли от артрита мучают многих людей во всем мире. Хотя вы не можете вылечить артрит, …
Привет! Многие студенты медицинских вузов сейчас разбирают биоорганическую химию (сокращённо-БОХ).
В некоторых вузах этот предмет заканчивается зачётом, в некоторых – экзаменом. Иногда бывает, что зачёт в одном вузе сравним по сложности с экзаменом в другом.
В моём университете биоорганическая химия сдавалась как раз экзаменом во время летней сессии — это был самый конец первого курса. Надо сказать, что БОХ относится к тем предметам, которые поначалу ужасают и могут вселять мысль — «это сдать невозможно». Особенно это касается людей со слабой базой органической химии (а таких в медицинских университетах, как ни странно, довольно много).
Программы изучения биоорганической химии в разных университетах могут очень сильно отличаться, а методики преподавания – ещё сильнее.
Однако, требования к студентам везде примерно одинаковые. Если очень упростить, то чтобы сдать биоорганическую химию на 5, вы должны знать названия, свойства, особенности строения и типичные реакции ряда органических веществ.
Наш преподаватель, уважаемый профессор, подавал материал так, будто бы каждый студент был самым лучшим в школе по органической химии (а биоорганическая химия по сути представляет собой усложнённый курс школьной органической химии). Наверное, он был прав в своём подходе, все должны тянуться наверх и стараться быть лучшими. Однако это привело к тому, что некоторые студенты, которые на первых 2-3 парах не понимали материал частично, ближе к середине семестра вообще перестали понимать всё.
Я решил написать этот материал по большей части из-за того, что я как раз и был таким студентом. В школе я очень любил неорганическую химию, а вот с органикой у меня всегда не складывалось. Даже во время подготовки к ЕГЭ я выбрал стратегию усиления всех своих знания по неорганике, в то же время закрепляя только базу органики. Мне кстати это чуть не вышло боком в плане вступительных баллов, но это другая история.
Я не зря сказал про методику преподавания, потому что у нас она была тоже весьма необычная. Нам сразу же, чуть ли не на первой паре, продемонстрировали методички, по которым мы должны были сдавать зачёты и затем экзамен.
Биоорганическая химия — зачёты и экзамен
Весь курс у нас делился на 4 крупных темы, каждая из которых заканчивалась зачётным занятием. Вопросы к каждому из четырёх зачётов у нас уже были с первых пар. Они, конечно же, пугали, однако в то же время они служили своеобразной картой, по которой следует двигаться.
Первый зачёт был совсем элементарный. Он был посвящён, в основном, номенклатуре, тривиальным (бытовым) и международным названиям, и, конечно же, классификации веществ. Также в том или ином виде затрагивались признаки ароматичности.
Второй зачёт после первого казался значительно более сложным. Там необходимо было расписывать свойства и реакции таких веществ, как кетоны, альдегиды, спирты, карбоновые кислоты. Например, одна из типичнейших реакций альдегидов — это реакция серебряного зеркала. Довольно красивое зрелище, скажу я вам. Если к какому-либо альдегиду вы добавите реактив Толленса, то есть [Ag(NH3)2]ОН, то на стенке пробирки вы увидите осадок, напоминающий зеркало, вот как это выглядит:
Третий зачёт на фоне второго не казался таким грозным. Все уже привыкли писать реакции и запоминать свойства по классификациям. В третьем зачёте речь шла о соединениях с двумя функциональными группами – аминофенолы, аминоспирты, оксокислоты и другими. Также в каждом билете был минимум один билет про углеводы.
Четвёртый зачёт по биоорганической химии был почти целиком и полностью посвящён белкам, аминокислотам и пептидным связям. Особой изюминкой были вопросы, на которых требовалось собрать РНК и ДНК.
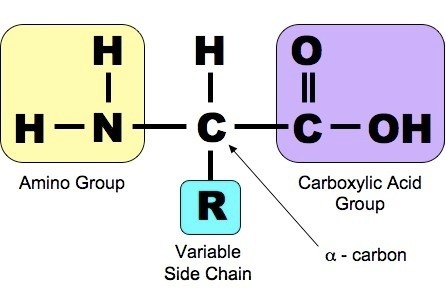
Кстати, как раз вот так выглядит аминокислота — вы можете увидеть аминогруппу (она подкрашена жёлтым на этом рисунке) и группу карбоксильной кислоты (она сиреневая). Именно с веществами этого класса приходилось иметь дело в четвертом зачёте.
Каждый зачёт сдавался у доски – студент должен без подсказок расписать и пояснить все необходимые свойства в виде реакций. Например, если вы сдаёте второй зачёт, и первым вопросом вашего билета указаны свойства спиртов. Преподаватель предлагает расписать свойства спиртов на примере пропанола. Вы пишете формулу пропанола и 4-5 типичных реакций, чтобы проиллюстрировать его свойства. Могла быть и экзотика, вроде серосодержащих соединений. Ошибка даже в индексе одного продукта реакции зачастую отправляла дальше учить этот материал до следующей попытки (которая была через неделю). Страшно? Сурово? Конечно!
Однако у такого подхода есть очень приятный побочный эффект. Во время регулярных семинарских занятий приходилось тяжко. Многие сдавали зачёты по 5-6 раз. Но зато на экзамене было очень легко, ведь каждый билет содержал 4 вопроса именно по одному из каждого уже выученного и решённого зачёта.
Поэтому я даже не буду расписывать тонкости подготовки к экзамену по биоорганической химии. В нашем случае вся подготовка сводилась к тому, как мы готовились к самим зачётам. Уверенно сдал каждый из четырёх зачётов – перед экзаменом просто просмотри свои же черновики, распиши ещё самые основные реакции и сразу всё восстановится. Дело в том, что органическая химия — это очень логичная наука. Запоминать нужно не огромные строки реакций, а сами механизмы.
Да, отмечу, что это работает далеко не со всеми предметами. Грозную анатомию не получится сдать, просто почитав свои записи накануне. Ряд других предметов также имеет свои особенности. Даже если в вашем медицинском университете биоорганическая химия преподаётся как-то иначе, возможно, вам нужно будет скорректировать вашу подготовку и осуществлять её немного не так, как делал я. В любом случае, удачи вам, понимайте и любите науку!
Автор:
Monica Porter
Дата создания:
19 Март 2021
Дата обновления:
8 Март 2023
Содержание
- меры
- чаевые
В этой статье: Базовые знанияУчебные советыПоиск справки
Органическая химия имеет плохую репутацию; Студенты нередко слышат ужасные истории о трудностях, с которыми они сталкиваются перед сдачей этого экзамена. Хотя это сложный вопрос, «органическая химия» не кошмар, как это часто изображают. Мало информации для запоминания, но много процессов, которые нужно усвоить, поэтому понимание основных понятий и хороший режим обучения являются ключом для сдачи экзамена.
меры
Часть 1 Базовые знания
- 1 Изучите определение «органическая химия». В общем, этот предмет касается изучения химические соединения углерода, Углерод — это шестой элемент периодической таблицы и один из тех, которые необходимы для жизни на Земле. Живые существа состоят из молекул, которые, в свою очередь, состоят в основном из углерода. Это означает, что органическая химия также имеет дело с химическими процессами, которые происходят каждый день в организмах, растениях, животных и экосистемах.
- Однако органическая химия не ограничивается живыми существами. Например, он также изучает реакции, которые происходят при сгорании ископаемого топлива, которые попадают в область действия органической химии, учитывая, что они основаны на углероде.
2 Изучите наиболее распространенные способы представления молекул. Органическая химия имеет явно более «графический» подход, чем общий. Вам часто приходится больше полагаться на конструкции молекул и соединений, чем когда-либо на предыдущих уроках. Понимание того, как интерпретировать эти рисунки, является одним из наиболее важных базовых навыков для изучения органической химии.
- Прежде чем начать, вам нужно ознакомиться со структурами Льюиса. Они обычно объясняются в части общей химии. Согласно этому графическому представлению атомы молекулы представлены их химическим символом (буква в периодической таблице). Линии представляют связи, точки валентных электронов. Для обзора прочитайте эту статью. Вероятно, новый для вас способ рисования молекул представлен структурная формула, С этим графическим решением атомы углерода не написаны, но ограничены линиями, которые идентифицируют связи. Учитывая, что при изучении органической химии существует много атомов углерода, таким образом, молекулы быстрее притягиваются. Все атомы, кроме углерода, изображены со своим собственным химическим символом. Вы можете провести онлайн-исследование, чтобы найти поддержку в изучении структурной формулы.
3 Узнайте, как рисовать облигации. те ковалентная они, безусловно, являются наиболее распространенными связями, с которыми вам придется столкнуться во время курса органической химии (даже если хорошее знание ионной связи и других жанров всегда является фундаментальным). В ковалентной связи два атома делят неспаренные электроны; если больше неспаренных электронов, то образуется двойная или тройная связь.
- Как в структурных формулах, так и в формулах Льюиса одинарная связь представлена линией, двойной связью двух линий и тройной связью трех линий. В структурных формулах связи между углеродом (C) и водородом (H) не прорисованы, потому что они очень часты. За исключением особых обстоятельств, атомы имеют только 8 валентных электронов (на внешней орбите). Это означает, что в большинстве случаев атом может связываться с максимумом с четырьмя другими атомами.
4 Изучите основы трехмерного представления молекулярных структур. Органическая химия требует от студентов думать о молекулах собственный как они в природе, а не как рисунок на листе. Молекулы имеют трехмерную структуру. Природа связей между атомами является наиболее важным фактором, который определяет трехмерную форму молекулы, даже если она не единственная. Ниже вы найдете некоторые вещи, которые нужно помнить, когда вы собираетесь изучать трехмерные формы молекул на основе углерода:
- Атом углерода, соединенный с четырьмя другими атомами одинарными связями, принимает форму тетраэдр (пирамида с четырьмя вершинами). Хорошим примером такой структуры является молекула метана (СН4). Молекула с атомом углерода в сочетании с атомом с двойной связью и двумя другими с одинарными связями имеет геометрию треугольный плоский (плоский треугольник). Ион СО3-2 это пример. Молекула, состоящая из атома углерода, объединенного с двумя атомами через двойные связи или объединенного в группу с тройной связью, принимает линейную геометрию (жесткую линию). Молекула углекислого газа (СО2) является примером.
5 Учись расшифровыватьорбитальная гибридизация. Хотя имя внушает страх, это не концепция так трудно понять. На практике гибридные орбитали они представляют собой метод, с помощью которого химики представляют валентные электроны атома, основываясь на том, как атом ведет себя (а не на том, как он нарисован). Если у атома есть определенное число неспаренных электронов, доступных для создания связей, но они имеют тенденцию образовывать различное количество связей, то для описания этой разности говорят, что атом имеет гибридные орбитали.
- Углерод является прекрасным примером такого рода атомов, поскольку он имеет четыре валентных атома: два на 2-й орбите и два непарных на 2-й орбите. Поскольку существует два неспаренных электрона, можно ожидать, что углерод образует две связи. Однако практический опыт учит нас, что связанные электроны в орбитальной форме 2s связываются, даже если они не являются неспаренными. Таким образом, можно утверждать, что один атом углерода имеет четыре неспаренных электрона на своей гибридной орбите sp.
6 Изучите основы электроотрицательности. В органической химии есть много факторов, которые определяют, как две молекулы реагируют друг с другом; электроотрицательность является одним из наиболее важных. Эта концепция измеряет, сколько «силы» латынь держит свои электроны. Атомы с высокой электроотрицательностью удерживают электроны с большей силой (и наоборот для атомов с низкой электроотрицательностью). Вы можете обратиться к этой статье для более подробной информации.
- Как вы двигаетесь вправо и вверх вдоль таблицы Менделеева электроны становятся все более электроотрицательными (исключая гелий и водород). Фтор, верхний правый элемент, имеет самый высокий электроотрицательность. Поскольку электроотрицательные атомы «имеют тенденцию притягивать» другие электроны, они реагируют, «забирая» электроны, имеющиеся в других молекулах. Например, такие атомы, как хлор и фтор, часто появляются как отрицательные ионы, потому что они забрали электроны у других атомов.
Часть 2 Советы по изучению
1 Не пугайтесь. Этот предмет вводит много новых концепций и заставляет вас думать о химических проблемах с другой точки зрения; Вам также придется выучить совершенно новый «химический словарь». Расслабьтесь, все ваши одноклассники сталкиваются с той же проблемой. Прилежно учитесь, в случае необходимости обратитесь за помощью, и вы увидите, что все будет хорошо.
- Не позволяйте «страшным историям» студентов, которые сдали экзамен по химии, прежде чем напугать вас. Для мальчиков характерно немного «раздувать» их переживания. Если вы пойдете на свой первый экзамен, когда будете в ужасе и убеждены, что столкнулись с невозможным подвигом, тогда вы все усложните, чем на самом деле. Вместо этого вы должны укрепить свою безопасность, много учась и отдыхая перед экзаменом.
2 Постарайтесь понять концепции, а не хранить их. На уроках будут изучены сотни химических реакций. Практически невозможно выучить их все наизусть, поэтому не тратьте свое время и ограничивайте себя самыми важными. Сосредоточиться на основные принципы которые управляют наиболее распространенными реакциями; большинство следуют только одной или двум схемам, поэтому знание последней и знание того, как их применять, становится гораздо более эффективной техникой для правильного решения химических задач.
- Однако, если у вас хорошая память, вы можете использовать этот навык в своих интересах. Попробуйте написать механизмы основных реакций на карточках и использовать их для запоминания. Вы по-прежнему должны быть в состоянии справиться с реакцией, которую вы никогда не видели прежде, но вы можете использовать те же принципы для разработки правильного механизма.
3 Узнай я функциональные группы. Основная органическая химия использует одинаковый набор структур практически во всех молекулах; эти структуры известны как «функциональные группы». Знание того, как их идентифицировать и понять, как они реагируют, является фундаментальным шагом в решении проблем органической химии. Поскольку функциональные группы постоянно реагируют одинаково, знание их характеристик позволяет решать широкий круг задач.
- В органической химии слишком много функциональных групп, чтобы перечислить их в этой статье. Тем не менее, нетрудно найти источники в Интернете, которые могут помочь вам в этом. В этой ссылке у вас есть пример.
4 Если сомневаетесь, следите за потоком электронов. На базовом уровне большинство реакций органической химии требуют двух или более молекул для обмена электронами. Если вы не можете понять, как запустить механизм реакции, начните оценивать, где вы могли бы разумно переместить электроны. Другими словами, ищите атомы, которые выглядят как хорошие «рецепторы» электронов, и те, которые с большей вероятностью продают их. Выполните этот шаг, а затем спросите себя, «что вы должны сделать, чтобы привести молекулы в состояние стабильности».
- Например, поскольку кислород (О) является более электроотрицательным, чем углерод, атом О, соединенный с С двойной связью в карбонильной группе, стремится удерживать связывающие электроны ближе к себе. Это дает С небольшой положительный заряд и делает его хорошим кандидатом на получение электронов. Если в реакции присутствует атом, который имеет тенденцию высвобождать электроны, то имеет смысл соединить его с С, образуя новую связь и инициируя реакцию.
5 Сформируйте учебную группу для выполнения домашних заданий и экзаменов. Вам не нужно чувствовать себя одиноким против органической химии. Делать домашнее задание с другими друзьями на одном курсе — отличная идея. Не только другие могут помочь вам с концепциями, которые вы находите наиболее сложными, но вы также можете лучше усвоить те, которые вы уже хорошо поняли, объяснив их своим собеседникам.
Часть 3 Обратиться за помощью
1 Познакомьтесь с профессором. Это человек, который лучше всех знает предмет в классе. Воспользуйтесь этим очень ценным ресурсом. Идите в его офис, чтобы обсудить понятия, которые вы не поняли. Попробуйте задать ему несколько ясных и кратких вопросов или предложить пару проблем, которые вы не можете решить. Приготовьтесь объяснить процесс, который приводит вас к неправильному решению.
- Старайтесь не ходить к своему профессору без четкого представления о том, что вы хотите. Просто заявить, что вы не сделали свою домашнюю работу, безусловно, бесполезно. Это не только отличная возможность найти ответы на свои сомнения, но и способ узнать своего учителя. Помните, что если вы хотите получить степень магистра или доктора, вам также понадобятся его рекомендации. Учителя готовы писать положительные отзывы ученикам, которые потрудились с ними поговорить.
2 Используйте инструменты, чтобы помочь вам визуализировать проблему. В органической химии форма молекул определяет, как они реагируют. Поскольку сложно сделать трехмерное графическое представление сложных молекул, вы можете использовать физические элементы, такие как детские конструкции, для анализа сложных структур.
- Молекулярные модельные наборы позволяют строить молекулы из пластиковых деталей. Они могут быть довольно дорогими, если вы покупаете их в книжном магазине университета или в магазине для лабораторных принадлежностей; однако некоторые учителя предоставляют их бесплатно тем ученикам, которые их просят. Если вы не можете получить «настоящий» набор, используйте пенопластовые шарики, фломастеры и деревянные булавки. Вы можете легко найти их в магазинах DIY и изобразительного искусства. Есть также несколько программ компьютерной графики, которые помогут вам визуализировать трехмерные молекулы. Перейдите по этой ссылке (на английском языке) для примера.
3 Подпишитесь на онлайн форум. Представлен один из спасательных якорей в бурном море органической химии приподнятый количество студентов, ищущих и предлагающих помощь онлайн. Есть много форумов, состоящих из большого сообщества людей, которые хотят обсуждать самые сложные темы. Попробуйте опубликовать проблему, которую вы не можете решить, и поработайте с людьми, которые ответят вам, чтобы найти решение.
- Практически в каждом университете с химическим факультетом есть онлайн-страница или форум, организованный студентами и нацеленный на взаимопомощь. Нетрудно найти подходящее для вас интернет-сообщество.
4 Попробуйте интернет-ресурсы. Есть много сайтов, которые помогут вам решить самые сложные вопросы органической химии. Ниже мы перечислим некоторые (на английском языке):
- Академия хана: вы можете найти множество видео уроков по основным темам. Chem Helper: на этом сайте есть ссылки на симуляции экзаменов, справочные форумы, механизмы реагирования и многое другое. Вы также найдете раздел для лаборатории. Университет Южной Каролины Айкен: вы найдете список различных полезных сайтов, которые охватывают множество тем по органической химии.
чаевые
- Чем больше вы изучаете органическую химию, тем больше вы сможете усвоить наиболее важные понятия. Попробуйте посвятить этому предмету хотя бы час или два каждый день; качество обучения так же важно, как и количество. Хорошее знание основ физики очень помогает в понимании многочисленных тем органической химии. Если возможно, вы также можете взять уроки физики, прежде чем записаться на курс химии. В этом разделе Villagemonkland вы можете найти много полезных статей.

Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Санкт-Петербургский Государственный технологический институт (Технический университет)
Кафедра органической химии
Е.К. Александрова, М.Н. Кривчун, Ю.Л. Питерская, М.Л.Петров, В.Ф. Плотников
ОРГАНИЧЕСКАЯ ХИМИЯ
Учебное пособие для студентов заочной формы обучения
УДК 541
Органическая химия: учебное пособие для студентов заочного отде-
ления /Е.К. Александрова, М.Н. Кривчун, Ю.Л. Питерская, М.Л.Петров, В.Ф. Плотников/ Под общ. редакцией д.х.н., проф., М.Л. Петрова – СПб, СПбГТИ
(ТУ), 2008. – 80с.
Учебное пособие предназначены для студентов 2 и 3 курса заочного отделения СПбГТИ(ТУ), изучающих дисциплину «Органическая химия»,. В пособии даны рекомендации для работы над основными темами дисциплины «Органическая химия», приведены примеры решения задач, а так же варианты и задания контрольных работ.
Утверждено на заседании Ученого Совета химического отделения СПбГТИ (ТУ).
2
|
Содержание |
|||||
|
ВВЕДЕНИЕ…………………………………………………………………………………………………………… |
4 |
||||
|
ВВЕДЕНИЕ В ОРГАНИЧЕСКУЮ ХИМИЮ…………………………………………………………. |
5 |
||||
|
2 ТЕМА. ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ………………………………………………………. |
13 |
||||
|
3 ТЕМА. АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ. АЛКИНЫ………………………………… |
15 |
||||
|
4 ТЕМА. УГЛЕВОДОРОДЫ С ДВУМЯ ДВОЙНЫМИ СВЯЗЯМИ. ДИЕНЫ………. |
16 |
||||
|
5 ТЕМА. МОНО- И ПОЛИГАЛОГЕНПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ……….. |
17 |
||||
|
6 ТЕМА. ОДНО- И МНОГОАТОМНЫЕ СПИРТЫ………………………………………………. |
18 |
||||
|
Одноатомные спирты. |
………………………………………………………………………………………. |
18 |
|||
|
Многоатомные спирты……………………………………………………………………………………… |
18 |
||||
|
7 ТЕМА. ПРОСТЫЕ ЭФИРЫ………………………………………………………………………………. |
20 |
||||
|
8 ТЕМА. АЛЬДЕГИДЫ И КЕТОНЫ……………………………………………………………………. |
20 |
||||
|
9 ТЕМА. ОДНО- И МНОГОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ И ИХ |
|||||
|
ПРОИЗВОДНЫЕ…………………………………………………………………………………………………. |
23 |
||||
|
10 |
ТЕМА. ГИДРОКСИКИСЛОТЫ ………………………………………………………………………. |
25 |
|||
|
11 |
ТЕМА. АЛЬДЕГИДО – И КЕТОКИСЛОТЫ ……………………………………………………. |
25 |
|||
|
12 |
ТЕМА. НИТРОСОЕДИНЕНИЯ……………………………………………………………………….. |
27 |
|||
|
13 |
ТЕМА. АМИНЫ……………………………………………………………………………………………… |
27 |
|||
|
15 |
ТЕМА. ЭЛЕМЕНТООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ………………………………….. |
28 |
|||
|
II |
РАЗДЕЛ. |
КАРБОЦИКЛИЧЕСКИЕ |
И |
АРОМАТИЧЕСКИЕ |
|
|
СОЕДИНЕНИЯ…………………………………………………………………………………………………… |
30 |
||||
|
16 |
ТЕМА. КАРБОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. АЛИЦИКЛИЧЕСКИЕ |
||||
|
УГЛЕВОДОРОДЫ………………………………………………………………………………………………. |
30 |
||||
|
17 |
ТЕМА. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ……………………………………………… |
31 |
|||
|
Реакции замещения в ароматическом ряду………………………………………………………… |
33 |
||||
|
18 |
ТЕМА. ГАЛОГЕНПРОИЗВОДНЫЕ………………………………………………………………… |
35 |
|||
|
19 |
ТЕМА. СУЛЬФОКИСЛОТЫ…………………………………………………………………………… |
37 |
|||
|
20 |
ТЕМА. НИТРОСОЕДИНЕНИЯ……………………………………………………………………….. |
38 |
|||
|
21 |
ТЕМА. АМИНЫ……………………………………………………………………………………………… |
39 |
|||
|
22 |
ТЕМА. ДИАЗО- И АЗОСОЕДИНЕНИЯ…………………………………………………………… |
41 |
|||
|
23 |
ТЕМА. ФЕНОЛЫ (НАФТОЛЫ) И АРОМАТИЧЕСКИЕ СПИРТЫ…………………… |
42 |
|||
|
24 |
ТЕМА. АЛЬДЕГИДЫ И КЕТОНЫ………………………………………………………………….. |
44 |
|||
|
25 |
ТЕМА. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ……………………………. |
45 |
|||
|
III РАЗДЕЛ. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ……………………………………….. |
47 |
||||
|
26 |
ТЕМА АРОМАТИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ…………… |
47 |
|||
|
27 |
ТЕМА. АМИНОКИСЛОТЫ, ПЕПТИДЫ, БЕЛКИ……………………………………………. |
49 |
|||
|
УГЛЕВОДЫ. НУКЛЕИНОВЫЕ КИСЛОТЫ……………………………………………………… |
49 |
||||
|
КОНТРОЛЬНЫЕ ЗАДАНИЯ……………………………………………………………………………….. |
50 |
||||
|
ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНЫХ РАБОТ И ЗАДАНИЙ……………………. |
51 |
||||
|
ЗАДАНИЯ КОНТРОЛЬНЫХ РАБОТ ……………………………………………………………….. |
53 |
||||
|
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ…………………………………………………………………………… |
72 |
||||
|
ЛИТЕРАТУРА…………………………………………………………………………………………………….. |
79 |
3

ВВЕДЕНИЕ
Дисциплина «Органическая химия» состоит из теоретической части и лабораторного практикума по синтезу органических соединений. Содержание теоретического курса и объем требований, предъявляемых студенту при сдаче экзаменов, определяются программой по органической химии для химико-технологических специальностей высших учебных заведений, утвержденной Министерством образования РФ.
В соответствии с программой дисциплина делится на три раздела: 1 – соединения с открытой цепью, 2 – карбоциклические и ароматические соединения, 3 – гетероциклические соединения.
Студент должен сдать два экзамена по дисциплине: первый экзамен – по соединениям с открытой цепью, второй – по циклическим соединениям.
К экзамену по первому разделу дисциплины допускаются студенты, выполнившие первое и второе контрольные задания, а ко второму – выполнившие третье и четвертое контрольные задания. Таким образом, по дисциплине органической химии студент должен сдать четыре контрольных задания и два экзамена. К отработке лабораторного практикума студент не допускается без сдачи экзамена по первому разделу дисциплины.
Студент, начинающий изучать органическую химию, часто делает ошибку, стремясь только запомнить материал. При наличии огромного фактического материала, с которым приходится иметь дело даже начинающему, необходимо суметь выделить в нем главное, найти взаимную связь различных классов соединений; это достигается только систематическим, последовательным и вдумчивым изучением материала.
Приступая к изучению каждого раздела, в первую очередь следует уяснить строение и свойства функциональной группы, т.е. группы, определяющей в основном химические свойства данного класса соединений.
Знание свойств различных классов соединений позволит найти естественную связь между отдельными классами, т.е. даст возможность уяснить систему органической химии в целом.
Изучение дисциплины органической химии рекомендуется вести по темам в последовательности, изложенной в настоящих указаниях. Для каждой темы даны: 1) программа, 2) литература основная и дополнительная, 3) методические указания, 4) вопросы и задачи для самопроверки.
Методические указания даются по основным вопросам дисциплины. Цель этих указаний – помочь студенту сосредоточить внимание на наиболее важных моментах. Поэтому в них отражены лишь некоторые вопросы из материала, подлежащего изучению.
Усвоению материала способствует правильно составленный конспект. Конспект должен быть кратким, однако уравнения реакций надо писать так, чтобы были изображены формулы всех образующихся соединений.
Формула органического вещества должна выражать не только его состав, но и его строение, т.е. должна указывать к какому классу относится данное соединение, и указывать порядок связей атомов в молекуле. Например, формулу изомасляной кислоты не следует писать С4Н8О2, а необходимо дать структурную формулу в виде графических формул:
|
O |
O |
|
|
CH3CHCH3COOH |
CH |
|
|
O |
O H |
После усвоения основных моментов данной темы необходимо ответить на вопросы для самопроверки.
В настоящих указаниях отсутствуют темы работ, входящих в практикум по синтезу органических соединений. Эти задания студент получит в вузе перед началом лабораторных занятий.
4
ВВЕДЕНИЕ В ОРГАНИЧЕСКУЮ ХИМИЮ
Предмет органической химии. Важнейшие этапы развития органической химии и промышленности органического синтеза. Перспективы развития промышленности органического синтеза.
Основные сырьевые источники получения органических соединений. Методы выделения, очистки, идентификации и установления строения органических соединений. Принципы качественного и количественного анализов.
Физические методы идентификации и исследования строения органических веществ, ИК-, УФ-, ЯМР-спектроскопия, масс-спектрометрия, дипольный момент, хроматография.
Краткие сведения о развитии теоретических представлений в органической химии. Теория А.М. Бутлерова о строении органических соединений. Изомерия и стереохимические представления в органической химии.
Природа химической связи. Ковалентные связи. Октетные формулы. Современные представления о природе химической связи, концепции молекулярных орбиталей и локализованных электронных пар. sp3-, sp2-, sp— Гибридные состояния углерода. Типы деформации электронной плотности в молекулах органических веществ. Индуктивный эффект, эффекты π, π- и p, π- сопряжения и сверхсопряжения.
Классификация реакций по результатам и типам разрыва химических связей. Реакции замещения и присоединения.
Радикальный, ионный и молекулярный механизмы реакций органических соединений.
Понятие о кислотах и основаниях в органической химии. Понятие о каталитических процессах в органической химии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Объектом изучения в органической химии являются соединения углеро-
да. Последние находят широкое практическое применение, а также играют важную роль в жизнедеятельности растительных и животных организмов.
При проработке настоящей темы необходимо обратить внимание на теорию химического строения органических соединений, сформулированную А.М. Бутлеровым в1861 году. Основные положения этой теории могут быть кратко сформулированы следующим образом:
1.В молекуле атомы соединяются в строго определенной последовательности, т.е. имеют строгий порядок в чередовании атомов и в характере их связи между собой, присущий молекулам именно данного вещества. Таким образом, для каждого вещества характерно определенное химическое строение, т.е. свойственная ему структура молекул.
2.Свойства веществ зависят от природы атомов, от их числа, порядка и характера их соединения в молекуле; химическое строение сложного вещества может быть установлено в результате изучения его химических превращений и, наоборот, по строению вещества можно определить его свойства.
5
3.Атомы в молекуле, связанные как непосредственно, так и через другие атомы, оказывают взаимное влияние друг на друга. Химический характер одних и тех же атомов меняется в зависимости от того, с какими атомами и каким образом они связаны в молекулах различных веществ.
4.Истинное строение молекулы данного вещества может быть выражено определенной формулой, и эта формула должна быть единственной для данного вещества.
Развитие современных теоретических представлений в области органической химии связано с квантовохимическим подходом к изучению строения соединений и реакций. Квантовохимический подход к электронному строению и поведению атомов и молекул выражается уравнением Э. Шредингера, связывающим энергию электрона с его волновым движением. Из квантовой механики известно, что электроны в атоме располагаются на определенных уровнях (орбиталях), которые отличаются разным запасом энергии. Положе-
ние электрона на орбитали не может быть определено точно, а характеризуется вероятностью (ψ2) пребывания электрона в определенной точке пространства. Различают атомные орбитали (АО) и молекулярные орбитали (МО), в которых электрон входит в состав молекулы. s-Атомные орбитали представляют собой сферы, p-атомные орбитали существуют в виде набора трех орбиталей (px, py, pz) и имеют форму объемных восьмерок.
|
z |
z |
z |
z |
|||
|
X |
X |
X |
X |
|||
|
s |
px |
py |
p |
|||
|
Y |
Y |
Y |
Y |
z |
||
Перекрывание одноименных частей функций называют перекрыванием в фазе.
|
z |
z |
z |
z |
|
X |
+ |
X |
X |
|
Y |
Y |
Y |
Y |
|
z |
z |
z |
z |
|
X |
+ |
X |
X |
|
Y |
Y |
Y |
Y |
Перекрывание в фазе осуществляется двояко. При осевом перекрывании не возникает узлов – так образуется σ-перекрывание. При боковом (латеральном) перекрывании π-связь лежит в узловой плоскости двух p-орбиталей. Сочетанием σ— и π-связей образуются двойная и тройная связи. При осевом пе-
6
рекрывании запас энергии меньше, при этом максимальная электронная плотность находится на прямой, соединяющей ядра атомов углерода.
При применении этих положений квантовой химии к соединениям углерода возникает существенные трудности, поскольку представление о наличии у атома углерода неэквивалентных орбиталей (одной s-орбитали с 2 электронами и двух p-орбиталей) не соответствует структуре большинства предельных углеводородов, например, метана СН4, где все С–Н связи равноценны. Это противоречие разрешается при помощи «гибридизации». Несколько атомных орбиталей с различной энергией и различной симметрии при возбуждении образуют такое же количество одинаковых гибридных орбиталей. Реакционная способность органических соединений определяется характером гибридизации орбиталей электронов (Л. Полинг): в предельных углеводородах – sp3-гибридизация (смешение одной 2s- и трех 2p-орбиталей), в этиленовых, ароматических и карбонилсодержащих соединениях – sp2— гибридизация (смешение одной 2s- и двух 2p-орбиталей), в соединениях с тройной связью – sp-гибридизация (смешение одой 2s- и одной 2p-орбитали).
|
px py pz |
p |
p |
p |
|
x |
y |
z |
|
|
s |
s |
Помимо углеродных атомов тройная связь может образовываться и с другими атомами, например азота:
H3C C C 
Эта связь полярна в силу различной электроотрицательности атомов углерода и азота. Для описания распределения электронной плотности здесь использованы дополнительные стрелки отображающие направление смещения электронной плотности. Следует отличать полярность (статическая характеристика) от поляризуемости (динамическая характеристика) молекул. Если атомы, образующие химическую связь, обладают одинаковой электроотрицательностью, то возникает симметричная молекулярная орбиталь, например, у этана СН3–СН3. Если химической связью связаны атомы с разной электроотрицательностью, то в такой несимметричной молекуле максимум электронной плотности сдвинут к более электроотрицательному атому:
7

|
O |
1/2 |
|||||||||
|
CH3 |
Br |
CH3 |
NH2 |
+ |
||||||
|
H3C |
N |
|||||||||
|
O |
1/2 |
|||||||||
Поляризацию σ-связи в сторону более электроотрицательного атома называют индуктивным эффектом (±I). Символ δ показывает частичность заряда на атомах. Индуктивные эффекты алкильных групп изменяются в ряду:
CH3 — < R–CH2— < R1R2CH — < R1R2R3C–
Стабильность радикалов и ионов карбения (карбкатионов), образующихся промежуточно в реакциях, изменяется аналогично возрастанию индуктивного эффекта алкильных групп.
Если смещение электронной плотности направлено по цепи в сторону заместителя, то такой индуктивный эффект заместителя называют отрицательным (-I). В том случае, если заместитель смещает электронную плотность в сторону заместителя, индуктивный эффект считают положительным (+I). В количественном отношении индуктивный эффект невелик. Он быстро затухает по длине цепи, таким образом, что уже на втором атоме от заместителя он практически становится равным нулю. Стабильность радикалов и ионов карбения заметно возрастает, если в распределении неспаренного электрона принимают участие π-орбитали (кратные связи), что приводит к делокализации неспаренного электрона или заряда:
|
. |
. |
||||||||
|
H2C C |
CH2 |
CH2 |
C |
CH2 |
H2C C |
CH2 |
CH2 |
C |
CH2 |
|
H |
H |
H |
H |
Для описания распределения электронной плотности здесь использован второй прием – граничные структуры: использование всех возможных структурных формул, отображающих граничные смещения электронной плотности. Положительный индуктивный эффект алкильного радикала смещает в несимметрично построенных алкенах электронную плотность, вызывая поляризацию молекулы, например, пропилена СН3–СН=СН2, что подтверждают реакции присоединения к нему любого соединения структуры Н– Х, в соответствии с правилом В.В. Марковникова.
Результатом электронного взаимодействия является, кроме того, мезомерный эффект (±M) или эффект сопряжения (±C), что связывают с перераспределением π-электронов:
|
H2C C C CH2 |
— |
||||||
|
CH |
C C |
CH |
|||||
|
H |
H |
2 |
H H |
2 |
|||
|
O— |
|||||||
|
H2C C |
C O |
CH |
2 |
C |
C |
||
|
H |
H |
||||||
|
H |
H |
Перераспределение электронной плотности за счет мезомерного эффекта имеет место в ненасыщенных и особенно сопряженных системах. Чем больше разность в электроотрицательностях атомов, связанных ковалентной связью, тем более полярна эта связь или молекула в целом. От наличия опре-
8
деленного заряда на атоме зависит реакционная способность всего соединения.
Часто эффективным средством перераспределения электронной плотности в молекуле становится присоединение или отщепление протона. Такое перераспределение является причиной сильного каталитического действия кислот и оснований. Более высокая кислотность гидроксила органической кислоты в сравнении со спиртовым гидроксилом обусловлена, в основном, эффективной стабилизацией карбоксилат-аниона вследствие делокализации электронной плотности в карбоксиле:
|
O |
1/2 |
|||||||
|
H3C |
O |
H |
C |
O |
||||
|
H |
C |
|||||||
|
3 |
3 |
1/2 |
||||||
|
O |
O |
O |
||||||
|
а |
б |
в |
Реальная структура ацетат-иона (в) является гибридной, по отношению к которой классические канонические граничные структуры (а) и (б) могут рассматриваться как предельные приближения.
Влияние эффекта сопряжения обычно преобладает в сравнении с индуктивным эффектом, например, молекула винилхлорида (СН2=СН–Сl) очень устойчива по отношению к нуклеофилам, так как атом галогена в этом соединении вступает в сопряжение за счет своих неподеленных пар электронов с π-электронным облаком двойной связи.
H2C=CH

Разрыв ковалентной связи между двумя атомами может протекать по следующим схемам:
A ..B 
Гетеролитический ( ионный ) разрыв связи
Гомолитический (радикальный) разрыв связи
При гетеролитическом разрыве одна из частей молекулы захватывает оба электрона ковалентной связи. Так возникают положительные (карбкатионы) и отрицательные (карбанионы) ионы. Такого рода разрывы инициируют ионные агенты, полярные растворители, ведение реакции на холоду и в темноте. Считают, что многие из ионных промежуточных продуктов несут заряд на некотором атоме углерода, хотя в действительности ион часто бывает стабилизирован за счет делокализации (перераспределения) заряда между другими атомами. Органические ионы – активные заряженные частицы, вре-
9
мя жизни которых очень мало. Однако их роль в органической химии очень большая, так как многие реакции протекают с их участием.
Гомолитический разрыв катализируется действием света, кислородом или добавлением других соединений, способных разрушаться с образованием свободных радикалов. Свободные радикалы имеют неспаренный электрон и образуются главным образом в газовой фазе, т.е. при нагревании и в растворах неполярных растворителей.
Реакции органических соединений классифицируются по различным признакам: по типу реакции – замещение, присоединение, отщепление, перегруппировка и т.д.; по механизму: радикальные, электрофильные, нуклеофильные и др.; по порядку наиболее медленной стадии реакции – мономолекулярные, бимолекулярные и т.д.
Наиболее часто встречающиеся электрофилы и нуклеофилы представлены следующими рядами:
Электрофилы:
H+, H3O+, HNO3 (NO2)+, H2SO4 (SO3), HNO2 (NO)+, Br2(Br+–Br–), BF3, AlCl3, и
т.д.
Нуклеофилы:
H—, :NH2—, HO— , RO— , RS— , R–COO— , Hal –(Br, Cl, I, F), CN— , HSO4— и т. д.
Процесс называют по атакующей атом углерода частице.
Понятия кислот и оснований в органической химии имеют свою специфику и рассматриваются в свете двух теорий: Бренстеда–Лоури, где кислотами считаются соединения в определенных условиях отщепляющих протон, а основаниями – соединения способные в определенных условиях принимать протон, и Льюиса, где в качестве кислот выступают соединения, имеющие на центральном атоме молекулы вакантную орбиталь, а основаниями считаются соединения, имеющие неподеленную пару электронов и способных эту пару отдавать.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ.
1.Основные источники получения органических соединений.
2.Основные положения теории химического строения А.М. Бутлерова.
3.Дать определения понятия структурой изомерии, структурного изоме-
ра.
4.Дать понятие ковалентной связи. Характерные особенности ковалентных связей: длина, полярность, пространственная направленность, энергия связи.
5.Дать определение кислоты и основания по Бренстеду – Лоури и по Льюису.
10
Соседние файлы в папке МЕТОДА 2 КУРС 3 СЕМЕСТР
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #