Эксперимент на ОГЭ по химии у многих вызывает вопросы, ведь далеко не во всех школах на уроках проводят опыты. Как подготовиться к экспериментальной части? Что на ней нужно делать? Как заработать максимум баллов и за что их можно лишиться? Рассказываем в этой статье.
Приходите на курсы подготовки к ОГЭ по химии в MAXIMUM Education: я и другие наши преподаватели отлично знаем структуру экзамена и умеем подавать сложные темы просто и доступно. Благодаря занятиям ваши знания по химии выстроятся в систему, а на экзамене вы не запутаетесь в хитрых вопросах составителей. Готовьтесь к ОГЭ осознанно — тогда высокий балл вам гарантирован!
Эксперимент на ОГЭ по химии
Экспериментальная часть экзамена по химии представлена двумя заданиями: 23 и 24. В 23-м задании нужно записать два уравнения качественных реакций, подтверждающие свойства заданного вещества.
Пример 1. Дан раствор сульфата железа (II), а также набор следующих реактивов: оксид меди (II), соляная кислота, растворы хлорида бария, гидроксида калия, серной кислоты.
Запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства сульфата железа (II), и укажите признаки их протекания. Используйте только вещества из приведенного выше перечня.
Запишите уравнения реакции
Чтобы записать два уравнения реакции, вы можете использовать такой лайфхак. Заданное вещество — сульфат железа (II) — состоит из катиона Fe2+ и аниона SO42–. Запишем их и все формулы реактивов в виде таблицы:
| CuO | HCl | BaCl2 | KOH | H2SO4 | |
| Fe2+ | |||||
| SO42– |
Затем, пользуясь таблицей растворимости солей, кислот и оснований, находим нерастворимые вещества. Отмечаем это в таблице.
| CuO | HCl | BaCl2 | KOH | H2SO4 | |
| Fe2+ | — | — | — | Fe(OH)2 | — |
| SO42– | — | — | BaSO4 | — | — |
Теперь записываем уравнения реакций:
- FeSO4 + 2KOH = Fe(OH)2↓ + K2SO4
- FeSO4 + BaCl2 = FeCl2 + BaSO4↓
За эту запись вы получите 2 балла.
Укажите цвет осадка
Чтобы получить еще 2 балла, нужно описать качественные признаки. Если качественный признак — осадок, нужно указать его цвет. Помните, что осадки металлов, находящихся в ряду активности до хрома, имеют белый цвет, как и AgCl. А вот осадки металлов после хрома включительно — цветные.
Можно выучить цвета часто используемых осадков:
| Белые осадки | Желтые осадки | Голубой осадок | Черные осадки | Бурый осадок | Зеленый осадок |
|---|---|---|---|---|---|
| BaSO4, CaCO3, AgCl, ZnS, Mg(OH)2, Al(OH)3 и т. д. | AgBr, AgI, PbI2, Ag3PO4 | Cu(OH)2 | CuS, PbS, Ag2S | Fe(OH)3 | Fe(OH)2, FeCO3 |
Но, если эта задача кажется, невыполнимой, вы можете оставить место после уравнений, выполнить эксперимент, а затем вернуться к работе и записать признак, какой увидели в пробирке.
Охарактеризуйте газы
Кроме осадков, мы часто наблюдаем другой качественный признак — выделение газа.
Пример 2. Дан раствор серной кислоты, а также набор следующих реактивов: цинк, соляная кислота, растворы хлорида бария, карбоната натрия, хлорида магния.
Используя только вещества из приведенного перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства серной кислоты, и укажите признаки их протекания.
Запишем уравнения реакций для серной кислоты:
- H2SO4 + Zn = ZnSO4 + H2↑
- H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑
Для характеристики газов следует указывать цвет и запах. В данном случае Н2 и СО2 — это бесцветные газы без запаха. Также в задании 23 вы можете встретить газы H2S и SO2 (бесцветные газы с неприятным запахом) и NH3 (бесцветный газ с резким запахом).
Опишите окраску индикатора
Но самое сложное задание 23 для учеников — это эксперимент с использованием индикаторов.
Пример 3. Дан раствор гидроксида натрия, а также набор следующих реактивов: медь, оксид меди (II), соляная кислота, растворы карбоната калия, сульфата меди (II), фенолфталеина. Возможно использование индикаторной бумаги.
Используя только вещества из приведенного перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства гидроксида натрия, и укажите признаки их протекания.
Известно, что индикатор меняет свою окраску при изменении типа среды раствора. Поэтому описать его окраску необходимо до и после протекания реакции. Записать это следует так:
Добавим 1–2 капли фенолфталеина в пробирку с NaOH. Наблюдается появление малиновой окраски раствора:
NaOH + HCl = NaCl + H2O
После протекания реакции наблюдается исчезновение окраски раствора:
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 — выпадение голубого осадка.
Итого: за 2 уравнения реакций и 2 описания качественных признаков вы получаете уже 4 балла. Но это еще не все: вас ждет задание 24 — сам эксперимент.
Задание 24
В каждом КИМ вы увидите инструкцию по выполнению практического задания. Мы выбрали для вас пункты, на которые стоит обратить пристальное внимание.
1. В склянке находится пипетка. Это означает, что отбор жидкости и переливание ее в пробирку для проведения реакции необходимо проводить только с помощью пипетки. Для проведения опытов отбирают 7–10 капель реактива.
2. Пипетка в склянке с жидкостью отсутствует. В этом случае переливание раствора осуществляют через край склянки, которую располагают так, чтобы при ее наклоне этикетка оказалась сверху («этикетку — в ладонь!»).
3. Отбор порошкообразного вещества из емкости осуществляют только с помощью ложечки или шпателя.
4. Возврат излишка реактива в исходную емкость категорически запрещен.
За правильно выполненный эксперимент вы получаете еще 2 балла, и ваш результат увеличивается уже на 6 баллов!
Теперь вы знаете, как выполнить эксперимент на ОГЭ по химии и правильно оформить задания 23 и 24 в бланке. Используйте наши советы и лайфхаки для получения максимальных результатов на экзамене. Успехов!
Как запомнить цветовые
переходы индикаторов в химии?
При изучении
химии нередко необходимо запоминание цветовых переходов индикаторов в различных
средах зачастую вызывает трудности в запоминании.
Мною была
разработана методика, основанная на смешении первичных цветов: красного,
синего, желтого.
Так, для
запоминания индикаторов создана следующая схема
Метилоранж в
нейтральной среде имеет оранжевый цвет. Оранжевый можно составить из двух
первичных цветов красного и желтого. Лакмус в нейтральной среде имеет
фиолетовый цвет. Фиолетовый цвет можно составить из синего и красного цвета.
Индикаторы показывают, что красный цвет относится к кислому диапазону,
соответственно другие простые цвета будут относиться к щелочному диапазону.
Основываясь на
предположении, что все оттенки красного будут относиться к кислой среде,
рассмотрим на примере перманганата калия. Так продукт окислительно-восстановительной
реакции в щелочной среде
KMnO4 + Na2SO3
+ NaOH →Na2MnO4 + К2SO4
+ H2O (1)
Раствор
перманганат калия имеет фиолетовый цвет (состоит из синего и красного) при
добавлении щелочи (желтого раствора) образуется зеленый раствор (К2MnO4).
В нейтральной
среде по уравнению реакции (2) видно, что сульфит натрия гидролизуется по
аниону и возникает щелочная среда в растворе, в результате ОВР реакции
образуется сильная кислота и происходит частично реакция нейтрализация. Катион
водорода кислоты усилит наличие красного цвета, а гидроксил ион щелочи добавит
желтый цвет. Все цвета — красный, синий, желтый — смешиваются и получается
коричневый цвет оксида марганца (IV)/
KMnO4 + Na2SO3
+ H2O→ MnO2↓ + Na2SO4 + KOH (2)
В кислой среде
происходит полная нейтрализация раствора перманганата калия и сульфита натрия,
в результате чего раствор обесцвечивается, так как фиолетовый цвет раствору
перманганата калия придает наличие иона калия.
KMnO4 + Na2SO3
+ H2SO4 → MnSO4 + Na2SO4
+ K2SO4 + H2O
Такие же
рассуждения можно предложить и для других цветных окислительно-восстановительных
переходов, например хрома.
Доступное
объяснение причин изменений окраски и простая схема запоминания изменений
цветов индикаторов для учащихся очень доступна.
Используя данную
методику, увеличивается понятие
30 октября 2022
В закладки
Обсудить
Жалоба
Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.
priznaki-him-r.pdf
Автор: Фрундина Дарья Андреевна, учитель химии.
Мнемоника на уроках химии
«Химию невозможно понять, ее надо выучить, но чтобы химию выучить ее нужно понимать»
Из школьных софизмов
Одним из условий эффективной организации учебного процесса является учет индивидуальных психологических особенностей учащихся. Психическое развитие человека происходит во многом благодаря возможности сохранения приобретенного опыта и знаний в нашей памяти, включающей запечатление, сохранение, последующее узнавание и воспроизведение следов прошлого опыта. Память понимается психологами как сложный процесс, обеспечивающий преемственность всех аспектов познавательной деятельности, лежащей в основе процесса обучения.
По мнению большинства старшеклассников, химия является одним из самых трудных учебных предметов, поскольку ряд химических фактов,законов, определений необходимо заучить или, говоря простым языком, вызубрить. У многих этот процесс ассоциируется с бездумным «сверлением» мозга. Может быть поэтому в белорусском языке существует соответствующий глагол — «дрылаваць», а по-английски процесс натаскивания по какому-либо учебному предмету переводится как «todrill». Но стоит ли так мучить свою память?
Психологами давно замечено, что легче всего запоминание происходит на уровне ассоциативного мышления, при переводе громоздкой информации — формул или правил — на язык созвучных фраз, стихов или смешных ассоциаций. Такой подход к сохранению в памяти получил название «мнемотехника» или «мнемоника». Многие мнемонические правила неосознанно используются нами с детства. Так, фразаКаждый Охотник Желает Знать, Где Сидит Фазан, помогает нам запомнить порядок цветов радуги (Красный, Оранжевый, Зеленый, Голубой, Синий, Фиолетовый). На этот же случай у гимназистов царской России было припасено свое правило: Как Однажды Жак ЗвонарьГоловой Сломал Фонарь.
Мнемоника (греч. mnemonika — искусство запоминания) (мнемотехника) — совокупность приемов и способов, облегчающих запоминание и увеличивающих объем памяти путем образования искусственных ассоциаций. Название происходит от имени древнегреческой богини памяти Мнемозины.
Элементы мнемотехники иногда применяются нами и в процессе школьного обучения. Несомненно, эти приемы не являются общепризнанными и не представлены на страницах учебников, но каждый из нас сам
выбирает, как ему удобно запомнить информацию — путем многократного повторения или с помощью ассоциированияматериала, который необходимо помнить. На уроках русского языка некоторые ученики используют такую фразу для запоминания порядка падежей (Именительного, Родительного, Дательного, Винительного, Творительного и Предложного) — Иван Родил Девчонку, Велел Тащить Пеленку (по первым буквам). Все глухие согласные русского языка заключены во фразе: «Фока, хочешь поесть щец?».
Элементы мнемоники используются и при обучении химии. Приемы ассоциативного запоминания рассматривались в журнале «Химия и жизнь» [5], в Интернете [6], а некоторые нам известны еще со школьных уроков химии — химикам ведь тоже не чужды образные выражения и фантастические ассоциации. Так, выделяющийся оксид азота(IV), окрашенный в бурый цвет, назван ими лисий хвост, а белый осадок хлорида серебра считается творожистым.
Правило Хунда в памяти школьников часто сохраняется под нелегальным названием — «правило троллейбуса, автобуса или трамвая», сущность которого отображена в следующих строках:
Ты приглядись, решив присесть,
К местам трамвайного вагона:
Когда ряды пустые есть,
Подсаживаться нет резона».
Многие, наверное, помнят такое правило для фенолфталеина— «фенолфталеиновый» в щелочи малиновый (при этом следует обратить внимание, что в сильно концентрированных щелочах фенолфталеин снова становится бесцветным).
Чтобы запомнить красный цвет лакмуса и метилового оранжевого в кислотах обращают внимание на то, что название цвета и термин «кислота» начинаются с буквы К. В нейтральной среде цвет этих индикаторов получается смешением цветов в кислой и щелочной средах: оранжевый цвет метилоранжа — это смесь красного (в кислой) с желтым (в щелочной), а фиолетовый у лакмуса — смесь красного с синим цветов.
Для лакмуса существует еще такое стихотворение:
Индикатор лакмус красный
Кислоту укажет ясно,
Индикатор лакмус синий:
Щелочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Для фенолфталеина:
Попасть в кислоту для других неудача,
Но он перетерпит без вздохов,без плача.
Зато в щелочах у фенолфталеина
Не жизнь, а малина, сплошная малина!
Для метилоранжа:
От щелочи я желт, как в лихорадке,
Краснею от кислот, как от стыда.
И я бросаюсь в воду без оглядки,
Здесь я оранжевый практически всегда.
Несомненно, у каждого учителя есть свои маленькие находки и хитрости, ведь не всякого ученика можно научить использовать строго научные определения и правила. Чего только стоит определение понятия «моль». Всегда ли мы сами можем воспроизвести его быстро и без запинки? Вот и используем на уроке интересные ассоциации и аналогии. Многие, наверное, энергетику хода реакции преподносят учащимся как преодоление путником горы, а валентность на первых уроках представляют как количество рук для образования связей с другими атомами. Для запоминания валентности используются стихотворные строки: натрий, калий, серебро — одновалентное добро и железо, алюминий, хром — их валентность равна трем (при этом следует помнить, что понятие «валентность» по отношению к металлам используется условно).
Особые трудности возникают при изучении темы «Окислителъно-вос-становительные реакции». Обычно на уроке мы с учениками представляем себе шкалу степеней окисления в виде железной дороги, по которой путешествуют атомы, приобретая и теряя электроны
Взял ē — Восстановился Отдал ē— Окислился
К этой же теме относится правило запоминания по гласным и согласным буквам для электролиза: на Аноде Анионы Окисляются, на Катоде Катионы Восстанавливаются, а еще можно помнить о том,
что окислитель — электронов грабитель.
Трудности запоминания специфики экзо- и эндотермических процессов преодолеваются нами, когда с термином «экзо» ассоциируются экзотические страны, в которых обычно тепло.
Реакции ионного обмена идут до конца:
- вариант:
Если выделится газ — это раз,
Иль получится вода — это два,
А еще — нерастворимый
осаждается продукт.
«Есть осадок» — говорим мы.
Это третий важный пункт.
- вариант:
Химик правила обмена не забудет никогда:
В результате непременно будет газ или вода,
Выпадет осадок — вот тогда порядок!
Легко можно запомнить, что сливание следует поводить по алфавиту: вода, потом кислота.
Немного смешной, как большинство мнемонических правил, кажется на первый взгляд памятка о пассивации в концентрированной азотной кислоте железа, алюминия и хрома, что вызывает у них, говоря по-белорусски, жах!
Для того чтобы запомнить цвет, формулу соли и определяемый ион, существует множество хитростей, например, «на два — три, на три — два» (на железо(II) — комплекс железа(III), на железо(III) — комплекс железа(II)). Если связать степень окисления определяемого иона железа с количеством атомов калия в соли получиться «на два — три, на три — четыре», а выражение «калий три — красная соль» запоминается с помощью следующей ассоциации, — если тереть кожу, она краснеет. И еще один способ:
В красной соли кровяной
Калий с тройкой за стеной.
Дальше феррум, шесть цианов,
Все в порядке, без обманов.
Более частным правилом мы пользуемся с учащимися, углубленно изучающими химию. Орта-, мета- и пара-изомеры ароматических соединений запоминаем так: орто— заместители находятся около друг друга, пара — против, а мета— среднее между орта и параизомерами. Кроме того, метаориентанты делают реакцию электрофильного замещения медленной. Цис- и транс-изомеры легко запомнить по направлению линий в начальных буквах их названия
и
Другой прием мы используем со школьниками при изучении темы «Углеводы». Чтобы запомнить, какая форма глюкозы входит в состав полисахарида, отмечаем, что альфа-глюкоза образует крахмал. Начальные буквы их названий идут по алфавиту раньше, чем у бета-глюкозы, которая образует целлюлозу. Обычно у учащихся, а иногда и учителей (у всех у нас память не идеальная) возникают трудности с записыванием циклической структурной формулы α — и β — глюкозы.
Итак, включаем фантазию. Молекула глюкозы «представляет собой» фантастического одноглазого пятинога, у которого одна нога переломана (возле С5), затем ОН— группы (ноги) слева направо в пространстве чередуются, а крайняя правая расположена так, как мы начинаем записывать букву греческого алфавита
α
β
β –глюкоза
Намного легче запоминать функциональную группу спирта, если знаешь анекдот: «Привезли в летный полк цистерну спирта для обработки приборов. Перед командиром возникла проблема, как подписать реактив, чтобы техники не догадались. Решили написать не название «этиловый спирт», а формулу С2Н5ОН. Утром встречает командир пьяного техника и спрашивает:
- Где ж вы спиртное взяли?
- Да, вот вчера мы прослышали, что спирт в полк привезли, стали искать. Где же он? Смотрим цистерна, а на ней надпись ОН, попробовали — точно ОН!
Ну и в заключение правила Морковникова и Зайцева:
Найдешь ли справедливость тут, Где много водорода, так еще дадут,
Где действуют двойные связи: Где мало, так отнимут сразу!
Что такое качественная реакция
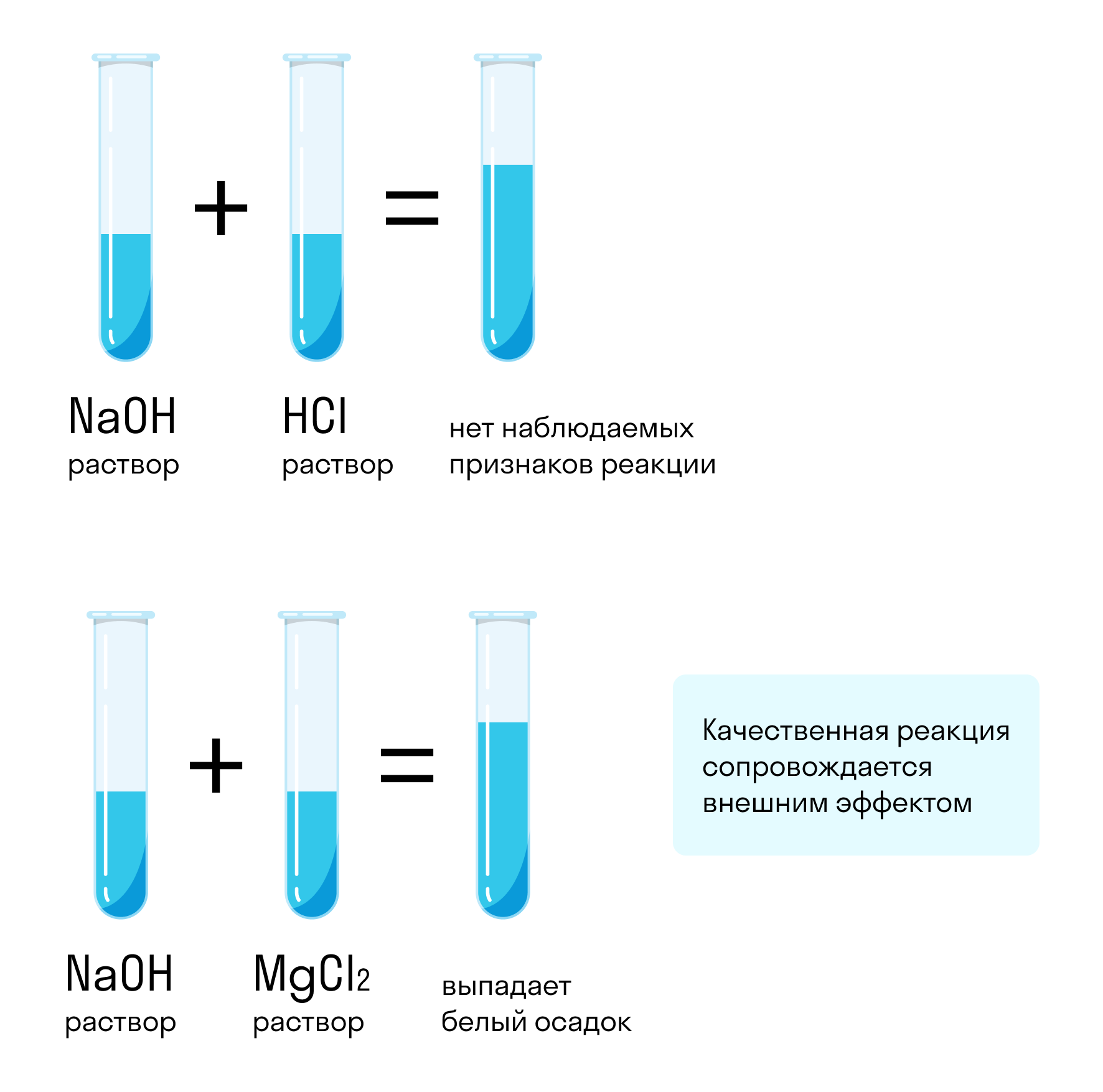
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
-
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
-
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
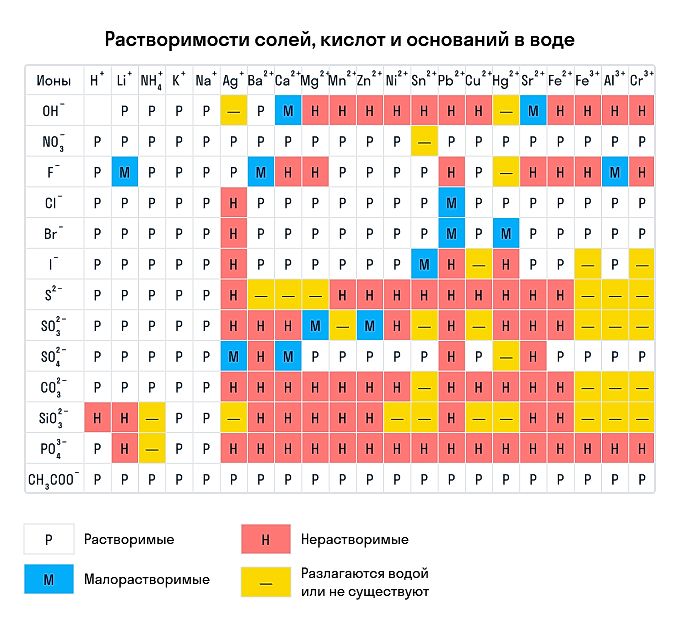
Правила растворимости химических соединений
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
-
абсолютно все нитраты;
-
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
-
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
-
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
-
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
-
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
-
любые карбонаты, фосфаты и сульфиты, кроме K2CO3, K2SO3, K3PO4, Na2CO3, Na2SO3, Na3PO4, (NH4)2CO3, (NH4)2SO3, (NH4)3PO4.
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
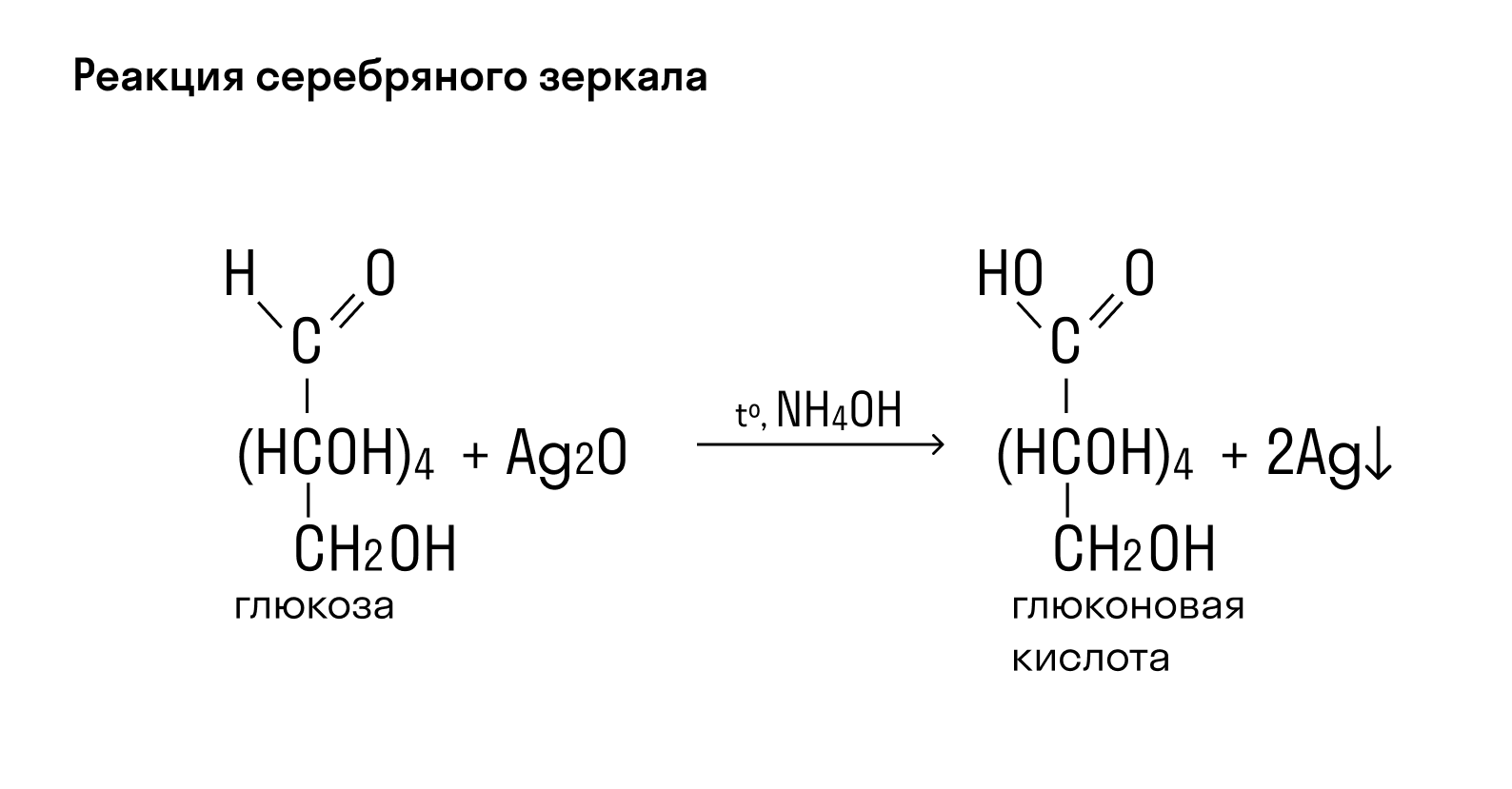
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
C6H5OH + 2Br2 ⇒ C6H2Br3OH + 3HBr — реакция с бромной водой.
3C6H5OH + FeCl3 ⇒ (C6H5O)3Fe + 3HCl — реакция с хлоридом железа (III).
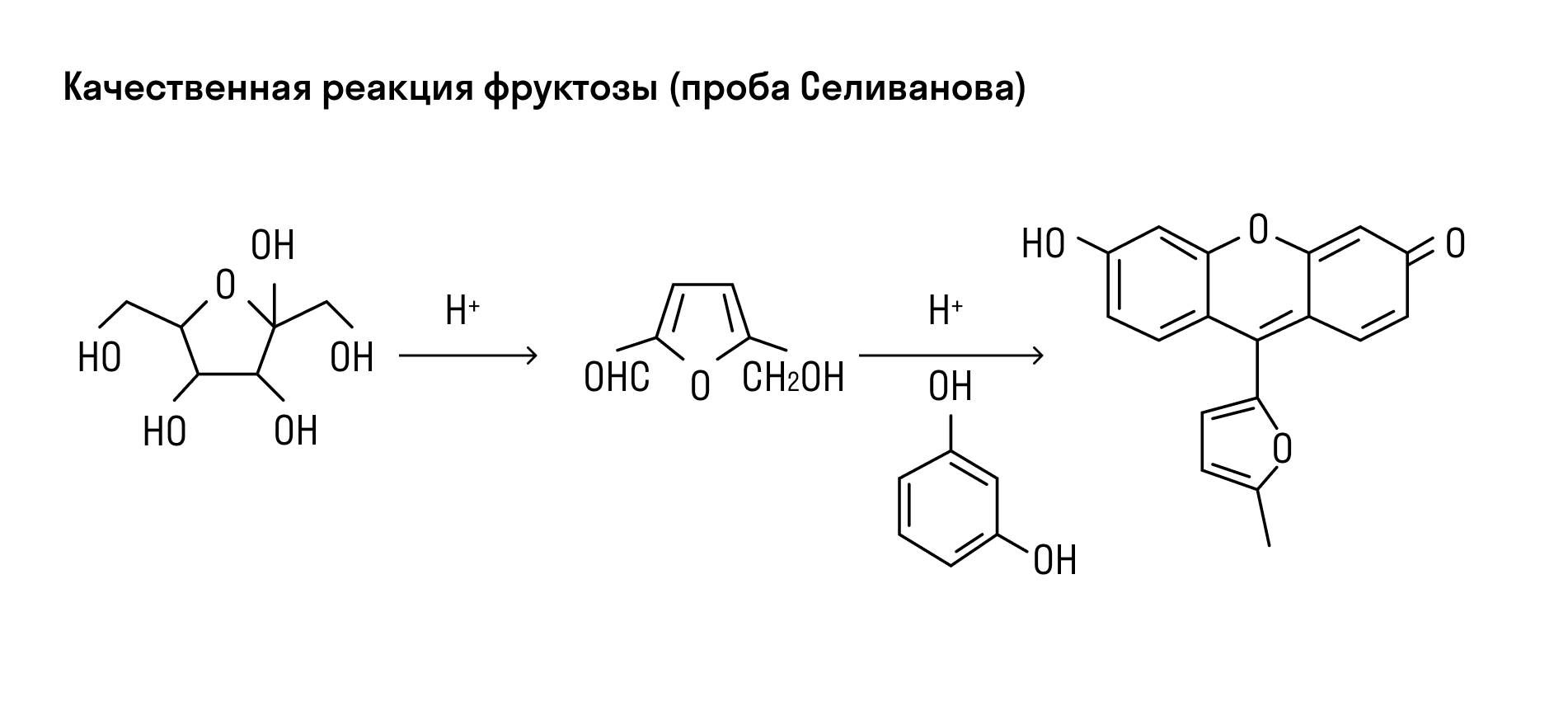
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
I2 + (C6H10O5)n ⇒ I2(C6H10O5)n— качественная реакция крахмала с йодом.
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Никак не можешь запомнить цвета осадков? Публикуем первую шпаргалку по качественным реакциям, здесь ты найдешь наиболее важные из них
Самые важные качественные реакции в неорганике:
Качественные реакции позволяют узнать, какое вещество или ион перед нами. Это не любая реакция с участием соединения, а только та, которая протекает с видимыми признаками.
🔸 KOH + HCl → KCl +H₂O — это не качественная реакция (не выделяется газ или осадок, не меняется цвет раствора).
🔸 Ba(OH)₂ + H₂SO₄ → BaSO₄ +2H₂O — это качественная реакция (выпадает белый кристаллический осадок).
В ЕГЭ обычно стоит задача подобрать реагент, которым можно отличить пару веществ. Например, NaNO₃ и AgNO₃, Ba(OH)₂ и NaOH.
Кстати, по запаху газов идентификацию мы не проводим, это нарушение правил техники безопасности. Поэтому эти две реакции для нас выглядят абсолютно одинаково:
🔸 K₂CO₃ + 2HCl → 2KCl + CO₂ + H₂O
🔸 K₂SO₃ + 2HCl → 2KCl + SO₂ + H₂O
ℹ️ Выполнить задание 25 (оно про качественные реакции) поможет таблица растворимости — это большая шпаргалка, которую тебе дадут на экзамене!
Только не попадись в ловушку — есть осадки, которые внешне выглядят одинаково, в этом случае придётся поломать голову.
Например, можно ли с помощью известковой воды (Ca(OH)₂) отличить друг от друга CO₂ и SO₂?
Запишем уравнения:
🔹 Сa(OH)₂ + CO₂ → CaCO₃ + H₂O
🔹 Сa(OH)₂ + SO₂ → CaSO₃ + H₂O
Смотрим в таблицу растворимости и видим, что и CaCO₃, и CaSO₃ — осадки. Поможет ли это? Нет! Эти осадки выглядят абсолютно одинаково: оба белого цвета, оба растворяются в кислотах, оба растворяются с образованием кислой соли при дальнейшем пропускании газа. Кстати, в завтрашнем шаге разберём, как же всё-таки их можно отличить 👩🔬
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
Химические запоминалки 1
Общеизвестный факт, что запоминать проще если новый материал связан со старым. Например, в детстве для запоминания очередности цветов спектра мы учили фразу: «Каждый охотник желает знать, где сидит фазан», по начальным буквам которой определялось: каждый — красный, охотник — оранжевый, желает — желтый, и.т.д. Существует и более современные вариант: “Каждый оформитель желает знать, где скачать Фотошоп”. На Британских островах последовательность спектра кодируют фразой связанной с историей Англии, когда Ричард Плантагенет (герцог Йоркский) потерпел сокрушительное поражение и погиб в войне Алой и Белой Розы. И сама фраза на английском: “Richard Of York Gave Battle In Vain” («Ричард Йоркский дал сражение напрасно»). И соответственно Richard – red, Of – orange, York – yellow, Gave – green, Battle – blue, In – indigo, Vain – violet.
Техника безопасности
Подобно этому существуют некоторые запоминалки и для химии: «ЛИЛА ВОДУ В КИСЛОТУ — ПОТЕРЯЛА КРАСОТУ». Которая гласит нам, что по правилам безопасности при работе с кислотой, кислота всегда добавляется в воду, а не наоборот.
Кстати, по-английски на эту тему есть правило трех «А»: Always (всегда), Add (добавляй), Acid (кислоту). Сначала вода, потом кислота, а не то случится беда.
И ещё по технике безопасности:
Помни, каждый ученик,
Знай, любая кроха:
Безопасность – хорошо,
А халатность – плохо
Чай и вкусный бутерброд
Очень просятся в твой рот.
Не обманывай себя —
Есть и пить у нас нельзя!
Это, друг, химкабинет,
Для еды условий нет.
Пусть в пробирке пахнет воблой,
В колбе — будто мармелад,
Вещества на вкус не пробуй!
Сладко пахнет даже яд.
Как же нюхать вещества?
В колбу нос совать нельзя!
Что может случиться?
Ты можешь отравиться!
Прежде чем начать работать,
Парту надо расчищать,
А не то учебник будет
Под рукой тебе мешать!
Хочешь весел быть и рад –
Надевай всегда халат!
Это должен каждый знать:
Спирт в спиртовке поджигать
Спичкой только можно
И очень осторожно.
Чтобы пламя погасить
Спиртовку следует закрыть.
И для этого, дружок,
У неё есть колпачок.
Рукой не трогай реактивы –
Начнутся страшные нарывы.
А коль коснешься кислоты,
О, скоро пожалеешь ты!
Остатки слив без разрешенья,
Ты не получишь утешенья.
Реакция начаться может,
Тогда никто уж не поможет.
Мы работаем по парам,
Чтобы не обдало жаром,
Ты пробирку отверни
От соседа впереди.
Всю сначала прогревай,
Уголочком наклоняй,
А потом – сильнее там,
Где есть место веществам!
Мы растворчик подогрели,
Вещества у нас вскипели.
Надо пламя укротить
И спиртовочку закрыть!
Если на руку попала
Капля жидкости какой,
Поспеши промыть то место
Ты холодною водой!
Правило прохождения реакции двойного обмена:
Химик правила обмена
Не забудет никогда:
В результате — непременно
Будет газ или вода,
Выпадет осадок —
Вот тогда — порядок!
Про органическую химию
Запомним, друг, и я, и ты,
Чем отличаются спирты —
В них углерод и гидроксид,
И каждый спирт легко горит.
R — это значит радикал,
Он может быть велик и мал,
Предельный или непредельный.
Но это разговор отдельный.
Среди карбоновых кислот
Известных «лиц» невпроворот.
В кислотах — группы карбоксильные,
Но все кислоты здесь — несильные.
В кетонах группа есть CO,
Но это тоже ничего…
Горит прекрасно ацетон,
И растворитель — тоже он.
Если ты, придя с мороза,
Наливаешь крепкий чай,
Хорошенько сахарозу
в чашке ложкой размешай.
Виноградную глюкозу
И медовую фруктозу
и молочную лактозу
любит взрослый и малыш.
Но крахмалом и клетчаткой,
Что совсем-совсем несладки
Тоже нас не удивишь.
Так устроена природа —
Это тоже углеводы.
Мы говорим спокойно: жир. А между прочим, он — эфир, Он из кислот и глицерина. Такая вот у нас картина…
Окраска индикаторов
Индикатор лакмус — красный,
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щелочь здесь! Не будь разиней!
Фенолфталеиновый в щелочах малиновый.
Сульфит и сульфид
Сульфит не путайте с сульфидом,
Чтоб места не было обидам:
Сульфиды — сероводорода
Родня. И нет в них кислорода!
А вот сульфит. Скорей смотри:
В нем кислорода сразу три!
Добавим кислорода атом —
И познакомимся с сульфатом!
А вот ещё про серу:
Тем, кто с Серой незнаком,
Я сейчас представлюсь лично:
Я бываю порошком,
А бываю и пластичной.
Поджигаю веток ворох –
Спичкам я даю огня.
Знай, алхимики и порох
Получили из меня!
Сера, сера буква S.
32 — атомный вес.
Сера в воздухе горит —
Получаем ангидрид.
Ангидрид да плюс вода —
Это будет кислота.
Сразу 4 факта зашифрованы в стишке:
- Сера обозначается буквой S.
- Её атомная ма́сса, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы — 32.
- При горении получается сернистый ангидрит.
- Ангидрит при растворении в воде даёт сернистую кислоту (H2SO4).
Кислоты
Для запоминания основных карбоновых кислот: щавелевая, малоновая, янтарная, глутаровая, адипиновая. Используют слово Щмяга. Слово не имеет перевода, но звучит забавно и хорошо запоминается.
Среди карбоновых кислот Известных “лиц” невпроворот. В кислотах — группы карбоксильные, Но все кислоты здесь — несильные.
Кислота тепла боится, быстро в воду превратится.
(Речь идет об угольной и сернистой кислотах)
Лакмус будет в них краснеть,
Растворяться — цинк и медь.
А мелок в них, посмотри,
Вмиг пускает пузыри!
И опасны для работы
Эти жгучие кислоты.
Самой сильной из кислот имя галоген дает.
(Хлорная кислота)
Водород
Не шутите с Водородом!
Он горит, рождая воду,
В смеси с Кислородом-братом
Он взрывается, ребята!
Вам скажу на всякий случай –
Эту смесь зовут гремучей.
Формулы
Загорелся, всем на диво
Фосфор в колбочке красиво —
Получился, надо знать,
Ангидрид Р2О5!
Алюминий, феррум, хром – их валентность равна трем.
Натрий, калий, серебро – одновалентное добро.
Магний, кальций, цинк и барий — их валентность равна паре.
Массу мы легко найдем,
умножив плотность на объём.
Получен газ, осадок иль вода – Процесс необратимый навсегда!
Стихи загадки
Если крупинки в жидкости найдет,
Как такую муть химик назовет?
(Суспензия)
В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без …
(Кислорода)
В воздухе он главный газ,
Окружает всюду нас.
Угасает жизнь растений
Без него, без удобрений.
В наших клеточках живет
Важный элемент …
(Азот)
Я растворчик изучал.
Лакмус в нем синее стал.
Поглощал раствор тотчас
Кислый углекислый газ!
Про такой раствор я знаю,
Что среда в нем …
(Щелочная)
И напоследок могу сказать, что наша учительница химии в школе поставила спектакль. Он тоже был в стихах, у каждого элемента была роль в соответствии с его активностью. Например, золото было королем и ни с кем не реагировало. А интриги против короля плели придворные азотная и соляной кислоты. Прошло почти 30 лет после спектакля, а я все помню. Спасибо учителю!
Подборка онлайн-ресурсов для «прокачки» химии
Наглядные онлайн-учебники, сайты с инфографикой, youtube и виртуальные лаборатории
Химия — не только один из предметов, по которому школьники сдают ЕГЭ. Это логичная и захватывающая наука о том, как устроен мир вокруг нас. Вместе с преподавателем химии в «Фоксфорде» Еленой Валишиной мы собрали полезные ресурсы, которые помогут изучать этот предмет с интересом и удовольствием.
Онлайн-учебники
Собственная википедия «Фоксфорда». Мы собрали всю школьную программу и немного больше в лаконичную структуру из отдельных статей. В учебнике есть понятные иллюстрации, видео-тьюториалы, возможность сохранять избранные статьи и много другое. И так по всем предметам — не только по химии.
Справочник, который в 2006 году выпустил Томский государственный университет. «Неорганическая химия» — базовый раздел, с которого начинается изучение химии в восьмом классе, поэтому ресурс пригодится для подготовки к ОГЭ, ЕГЭ и олимпиадам.
Больше нужен олимпиадникам и старшеклассникам, которые готовятся к ЕГЭ: органическая химия начинается только в конце девятого класса. Однако в ОГЭ есть один вопрос из органики, поэтому девятиклассникам учебник тоже пригодится.
Сборник авторских лекций, которые подготовил профессор Южного федерального университета Сергей Иванович Левченков. Отличный ресурс для того, чтобы понять логику науки: в какой последовательности происходили самые важные открытия в химии и как они связаны между собой.
Химическая википедия. Этому ресурсу можно доверять, потому что разработчики перевели в электронный вид хорошие справочники по химии. Также они сделали удобный поиск по сайту.
Ещё одно преимущество «Химика» — сервисы, которые помогают школьникам разобраться в сложных темах с помощью наглядных схем. Вот два самых важных из них:
Приложение для проверки своих знаний по строению атома: вводите символ элемента и приложение сразу выдаёт все возможные записи электронной конфигурации его атома.
Сервис помогает разобраться, какие вещества реагируют друг с другом, при каких условиях и что образуется в результате. Например, если ввести в строку поиска уравнение Cl2 + NaOH, можно получить все возможные реакции этих соединений с коэффициентами.
Виртуальные лаборатории
Российский портал, на котором эксперименты из школьной программы можно смоделировать онлайн.
Международный ресурс, которые разрабатывают учёные со всего мира. Позволяет ставить более серьёзные опыты.
Проект по доставке на дом наборов для экспериментов. Также на сайте есть подробные и корректные инструкции по выполнению опытов. Многие ингредиенты для этих опытов можно самостоятельно купить в аптеке или продовольственном магазине. В дополнение к опытам на Mel Science полезно смотреть видео, которые объясняют суть химических явлений.
На портале есть множество полезных статей, подробные разборы опытов, инструкции, как проводить их в домашних условиях и где брать для них реактивы.
7 важных советов, как готовиться к ЕГЭ по химии. Все нужные таблицы, формулы и пособия
До ЕГЭ по химии осталось совсем немного — меньше полугода (вот тут календарь ЕГЭ-2018). Но наверстать упущенное и разобраться наконец в таблице растворимости и формулах — не поздно. И не только в них, если составить чёткий план и выбрать правильные материалы. О подготовке к ЕГЭ по химии — преподаватель химии и автор телеграм-канала «ФарСмацевтика» Анна Тихонова.
В этом году форма экзамена почти не изменилась: вместо 34 заданий их будет 35. Но из-за этого немного изменится система пересчёта первичных баллов в тестовые. Экзамен состоит из двух частей: первая предполагает выбор цифр или последовательности цифр (29 заданий), вторая — ответы с развёрнутым ответом (6 заданий). Максимальное количество первичных баллов, которое можно набрать за первую часть, — 40, за вторую — 20. Обычно мои ученики начинают паниковать уже на этой стадии — когда узнают о заданиях. Но на самом деле всё не так страшно, как кажется.
1. Найдите человека, которому вы сможете задавать вопросы
Необязательно нанимать репетитора. Этим человеком может быть учитель в школе или знакомый студент, который учится на химфаке. Главное — не стесняться задавать даже самые глупые, на ваш взгляд, вопросы и стараться закрывать пробелы, которые возникают во время подготовки. Поверьте, то, что у вас появляются хоть какие-то мысли насчёт химии, уже говорит о том, что процесс запущен. Смело поднимайте руку прямо во время урока, расспрашивайте репетитора, участвуйте в обсуждениях в тематических сообществах и не бойтесь выглядеть глупо в глазах других.
2. На экзамене у вас будет три официальные шпаргалки. И в них нужно разбираться
Это таблица Менделеева, таблица растворимости и ряд напряжения металлов. В них содержится около 70% информации, которая поможет вам успешно сдать экзамен. На остальные 30% от вашего успеха приходится ваше умение пользоваться ими.
Чтобы разобраться с таблицей Менделеева, нужно сначала изучить периодические свойства элементов: строение атомов элементов, электроотрицательность, металлические, неметаллические, окислительные и восстановительные свойства, валентности, степени окисления. Если запомните их — не придётся запоминать свойства каждого отдельного элемента или каждого отдельного вещества в природе. Достаточно взглянуть в таблицу и вспомнить о периодическом законе.
Подсказка для тех, кто вечно всё забывает: F (Фтор) самый сильный неметалл и самый электроотрицательный элемент, а Fr (Франций) — наоборот (самый сильный металл и наименее электроотрицательный элемент). Это поможет с чего-то начать.
3. Повторяйте математику. Химию без неё не сдать
Конечно, никто не просит вас интегрировать или дифференцировать и вообще на экзамене можно пользоваться непрограммируемым калькулятором. Но повторить темы процентов и пропорций — обязательно. Формул, которые необходимы для решения задач, не так уж и много. Запомнить нужно только основные: формула для расчёта массовой доли, массы вещества, объёма, количества вещества, плотности и выхода продукта. Зная их, вы сможете без проблем выводить другие.
Попробуйте вывести из формулы массовой доли массу раствора или, зная массу и молярную массу вещества, определить его количество. Через несколько недель тренировок вы заметите, что все эти формулы связаны между собой и, если вы что-то забыли, всегда можно вывести нужную вам формулу из другой.
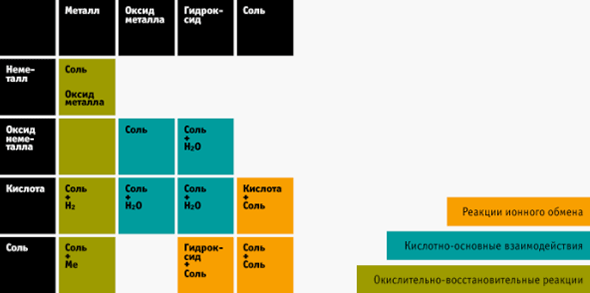
4. Таблица химических реакций — ваш помощник
Веществ в химии действительно очень много, их можно систематизировать и выявить закономерности. Вам поможет таблица взаимодействия веществ между собой. Распечатайте её и держите перед глазами, когда только начнёте решать цепочки или реакции.
Как ей пользоваться?
- Научитесь определять класс веществ (оксиды, кислоты, соли, основания, металлы и неметаллы) и разберитесь в типах реакций, чем они друг от друга отличаются.
- В реакцию вступает минимум два вещества. Определяете, к какому классу относится первое вещество. Находите соответствующий пункт в таблице справа (или вверху).
- Проделайте то же самое со вторым веществом, ищите пункт сверху таблицы (или справа).
- Смотрите на пересечение этих двух пунктов в таблице — это ответ, который получается в реакции.
На экзамене такой шпаргалкой пользоваться нельзя. Но во время подготовки вы легко запомните, что получается, если, например, реагируют кислота и щелочь, и другие вещества. А это около 80% заданий на ЕГЭ.
5. Берите книжки ФИПИ и идите от простого к сложному
На самом деле не важно, какой учебник вы выберете для подготовки к ЕГЭ. Берите тот, где вам будет понятен материал и в котором есть все темы, которые встретятся на экзамене. Что касается тестов, здесь тоже не нужно изобретать велосипед: я рекомендую пользоваться книжками ФИПИ. Тот материал, который они дают, максимально приближен к тому, что будет на экзамене. И можно решать тексты по изученным темам прямо на их сайте.
Начать стоит с блоков, которые встречаются чаще всего:
- строение атома, периодические свойства элементов
- типы химической связи
- классы неорганических веществ
- гидролиз
- электролиз
- взаимодействие веществ между собой и классификация химических реакций
- задачи на тему «растворы»
- химическое равновесие
- органическая химия (классы соединений, их способы получения и химические свойства)
Остальные блоки сложнее. После того, как прорешаете задания по основным блокам, вы поймёте, в каких темах у вас пробелы, а какие вы знаете хорошо. Закрепите темы, которые вы знаете лучше остальных, и вернитесь к изучению теоретической базы тех тем, которые даются хуже. Учите тему и выполняйте по 20 упражнений в день. Если времени для подготовки мало, сосредоточьтесь на заданиях, темы которых вам ясны. Лучше целиком решить задание с ОВР (окислительно-восстановительными реакциями), чем не сделать ничего.
6. Теория хорошо, но без тестов всё равно никуда
Если кажется, что вы всё знаете из теории и вам не нужно тратить время на решение тестов — это не так. Большинство ошибок на экзамене случается из-за того, что ученик неправильно прочитал задание или не понял, что от него хотят. Чем чаще вы будете решать тесты, тем быстрее поймёте структуру экзамена и сложные и загадочные формулировки задания.
Например, в задании № 30 сказано: «Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. В ответе запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций». Очень часто ученики пропускают стадию написания полного ионного уравнения и пишут сразу сокращённое, потому что так быстрее. Это не ошибка, но за это могу снять один первичный балл.
7. А вот читать лишние статьи и литературу точно не нужно
Иногда во время подготовки к экзамену ученик настолько увлекается, что начинает читать узкоспециализированную литературу. И при ответе на простой вопрос путает самого себя: вроде бы гидроксид цинка проявляет амфотерные свойства и реагирует и с кислотами, и с основаниями, а вот в такой-то статье говорилось, что новые исследования говорят абсолютно о другом. И это ставит под сомнения все фундаментальные знания о химии! Я, конечно, утрирую, но смысл в том, что цель экзамена — проверить ваши знания школьной программы. И стратегия «чем проще, тем вернее» работает в тестах как нельзя лучше.
источники:
http://media.foxford.ru/chemistry_online/
http://mel.fm/ucheba/yege/9276814-ege_chemistry_2018