Всего: 128 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Веществом молекулярного строения является
1) хлорид аммония
2) хлорид цезия
3) хлорид железа(III)
4) хлороводород
Молекулярное строение имеет оксид
1) азота(I)
2) бора
3) кремния
4) алюминия
К веществам с молекулярным строением относятся
1) алмаз и оксид натрия
2) аммиак и оксид серы (IV)
3) йод и хлорид бария
4) фосфорная кислота и кремний
Веществом молекулярного строения является
1)
2)
3)
4)
Веществом молекулярного строения является
1)
2)
3)
4)
Из предложенного перечня выберите две пары веществ, в которых каждое соединение имеет молекулярное строение.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ с молекулярным строением.
1) графит и оксид углерода (IV)
2) вода и оксид углерода (II)
3) кремний и оксид железа (III)
4) сероводород и аммиак
5) серная кислота и оксид кремния (IV)
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
К веществам молекулярного строения не относится
1) хлор
2) оксид серы (IV)
3) йод
4) бромид калия
Задания Д4 № 494
Молекулярное строение имеет
1) хлорид бария
2) оксид калия
3) хлорид аммония
4) аммиак
Из предложенного перечня выберите два вещества молекулярного строения.
1) озон
2) оксид бария
3) графит
4) сульфид калия
5) хлороводород
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества с молекулярным строением.
1) хлорид бария
2) бром
3) оксид калия
4) хлорид аммония
5) аммиак
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары соединений только молекулярного строения.
1) и
2) и
3) и
4) и
5) и
Запишите в поле ответа номера выбранных соединений.
Источник: РЕШУ ЕГЭ
Веществом молекулярного строения является
1) иод
2) оксид кремния
3) марганец
4) хлорид кальция
К веществам молекулярного строения относится
1) алюминий
2) хлорид натрия
3) оксид кремния (IV)
4) аммиак
Источник: ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 1
Из предложенного перечня выберите два соединения с молекулярным строением.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных соединений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества с молекулярным строением.
1) цинк
2) вода
3) нитрат бария
4) гидроксид калия
5) сероводород
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества молекулярного строения.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных соединений.
Из предложенного перечня выберите два вещества молекулярного строения.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных свойств.
Задания Д4 № 8
Молекулярное строение имеет
1) оксид кремния(IV)
2) нитрат бария
3) хлорид натрия
4) оксид углерода(II)
Источник: Демонстрационная версия ЕГЭ—2012 по химии
Задания Д4 № 150
В твердом виде молекулярное строение имеет
1) оксид кремния(IV)
2) хлорид кальция
3) сульфат меди (II)
4) йод
Источник: Демонстрационная версия ЕГЭ—2013 по химии
Всего: 128 1–20 | 21–40 | 41–60 | 61–80 …
Атомы и молекулы
Любые тела и предметы состоят из молекул — мелких частиц, на которые можно раздробить вещество физическими методами (например, растворением). Из этого вытекает определение молекулы: это самая мелкая частица вещества, сохраняющая его химические свойства.
Атомы — это мельчайшие частицы, сохраняющие свойства химического элемента, из них составляются молекулы. Атомы выделяются из молекул химическими методами.
Химические вещества могут быть газообразными, жидкими и твердыми. Частицы твердых веществ расположены ближе, а газов — дальше друг от друга, и они находятся в постоянном движении. Чем выше температура тела, тем быстрее движение молекул и атомов в нем, называемое броуновским, и тем больше расстояние между частицами. Внутри этого «бульона» постоянно действуют силы взаимного притяжения и отталкивания частиц, которые выражены тем сильнее, чем меньше разделяющее их расстояние.
Виды веществ
Вещества определяются как молекулярные и немолекулярные, в зависимости от того, из каких частиц они состоят. Разные типы частиц создают разные виды взаимосвязей, и это определяет физические и химические свойства соединений.
Имеющие молекулярное строение
Здесь связи между отдельными молекулами относительно слабые, поэтому легко разрываются при нагреве, причем тем легче, чем меньше молекулярная масса. Поэтому такие вещества плавятся при низких температурах и в нормальных условиях многие из них находятся в жидком или газообразном состоянии.
Это могут быть простые вещества: сера (S8), азот (N2), кислород (O2) и сложные, например, оксиды азота с разной валентностью (N2O, NO, N2O5, NO3), углекислый газ (CO2), серная кислота (H2SO4).
Самый известный пример такого рода — вода. Человеческое тело содержит около 65% воды. Даже шкала Цельсия привязана к ее плавлению (0°С) и кипению (100°С). В нормальных условиях это жидкость, но в природе встречается во всех трех агрегатных состояниях в виде снега или льда, воды и пара.
Электрическая полярность молекулы задает воде интересные особенности. Например, ее удельная теплоемкость настолько велика, что это делает ее одним из главных регуляторов климата Земли. Интересно, что наибольшей плотности она достигает не в виде льда, а в жидком состоянии, при 4 °C. Поэтому возле дна скапливается самая тяжелая вода, не достигающая замерзания, а более легкий твердый лед выталкивается наверх.
Еще один пример — йод. В нормальных условиях он имеет форму кристаллов, а при нагревании сразу переходит в газообразное состояние, что называется возгонкой.
Строящиеся из немолекулярных частиц
Целые классы соединений состоят не из молекул, а из атомов или ионов. Поскольку электрические связи разнозаряженных ионов или ковалентные атомные связи крепче, чем межмолекулярные, они разрушаются при нагреве гораздо труднее. Поэтому такие вещества, как правило, имеют твердую форму и высокие температуры плавления и кипения. Их определяют как вещества немолекулярного строения.
Примеры:
- Атомные вещества.
- Металлы: натрий (Na), железо (Fe), медь (Cu).
- Неметаллы: бор (B), кремний (Si), углерод © в аллотропных формах графита и алмаза.
- Ионные.
- Соли: поваренная соль (NaCl), сульфат натрия (Na2SO4).
- Гидриды: лития (LiH).
- Оксиды: кальция (CaO), магния (MgO).
- Основания: натрия (NaOH), калия (KOH).
Таблица молекулярного и немолекулярного строения вещества:
| Строение вещества | Молекулярное | Немолекулярное |
| Мельчайшие структурные единицы | Молекулы | Ионы и атомы |
| Агрегатное состояние | Газообразное, жидкое, твердое | В основном, твердое |
| Температуры плавления и кипения | Низкие | Высокие |
Аморфные и кристаллические вещества
Твердые вещества могут быть аморфными или кристаллическими.
Кристаллические отличаются тем, что их структурные единицы располагаются в повторяющемся порядке, образуя кристаллические решетки.
Аморфные соединения имеют в своем составе длинные тяжелые молекулы, которые не помещаются в правильные структуры кристаллических решеток, и поэтому переход из твердого состояния в жидкое у них совершается постепенно, без четкой границы. То есть аморфные вещества не имеют точно определенной температуры плавления. Очень знакомый пример такого типа — пластилин, который используется в мягком, а не твердом или жидком состоянии. Также это различные пластмассы, смолы, стекло.
Пластичность и мягкость разогретого стекла дает возможность лепить из него, как из пластилина, только не руками, а инструментами. Стеклянная посуда, лампочки, трубки, оконное стекло — все это было бы невозможно сделать из кристаллических веществ. А как выручают человека полиэтиленовые бутылки и фасовочные пакетики!
Еще один близкий пример — сахарная карамель. Она при нагревании становится тягучей, мягкой, как и все аморфные вещества. А если дать карамели залежаться в сухом помещении несколько месяцев, ее поверхность покроется белым налетом маленьких кристаллов сахара. То есть некоторые аморфные вещества способны переходить в кристаллическую форму.
Типы кристаллических решеток
Разные виды частиц образуют разные кристаллические решетки. Существует 4 их типа:
- ионные;
- атомные;
- молекулярные;
- металлические.
Ионный тип кристалла
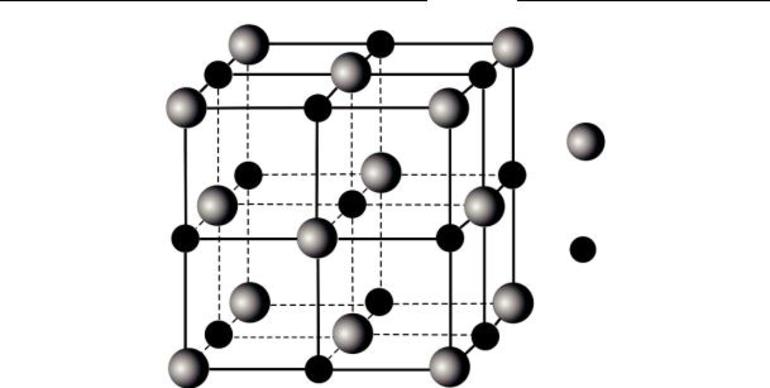
Это вид решетки, образуемый ионами — частицами, несущими на себе разноименные электрические заряды, чередующиеся в узлах решетки. Электроотрицательность анионов притягивает к себе положительно заряженные катионы, что придает решетке твердость. Поэтому такие соединения тугоплавки, зато хрупки, обладают хорошей растворимостью в воде и электропроводностью. Это основания, основные оксиды, органические и неорганические соли.
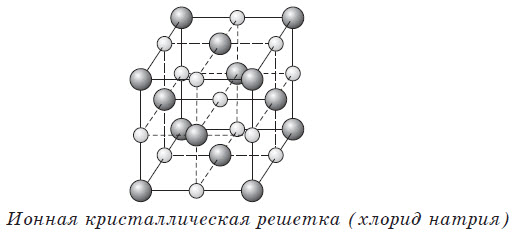
Пример такого кристалла — обычная поваренная соль, хлорид натрия. Его кубическая решетка сформирована катионами Na+ и анионами Cl-.
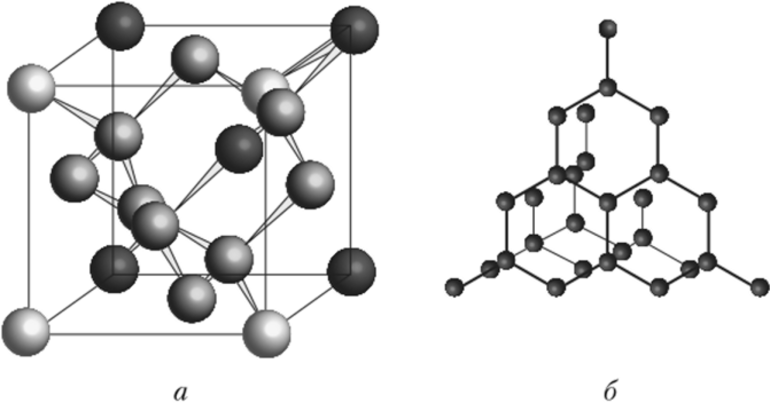
Атомная решетка
Этот вид кристаллов сформирован атомами, образующими между собой полярные и неполярные ковалентные связи. Такие связи очень прочны, поэтому эти вещества обладают высокой твердостью, тугоплавки и не растворяются в воде. В природе они мало распространены.
Характерный пример — углерод, имеющий две аллотропных формы, и обе — атомного типа.
Кристалл графита имеет слоистую структуру, атомы в слоях расположены по углам шестиугольника, расстояние между слоями значительно больше и межатомные связи слабее, чем внутри слоя. Поэтому кристалл хрупкий, легко расслаивается и крошится. Благодаря этому свойству, графит используется в карандашах или в виде графитовой смазки.
Алмаз — очень плотный кристалл кубической формы, среди природных минералов имеет наивысшую твердость. Образуется такая форма углерода из графита при очень высоких температуре и давлении.
Другие примеры: бор (B), германий (Ge), кремний (Si), оксид кремния (SiO2), карбид (B4C) и нитрид (BN) бора.
Состоящая из молекул
Такая решетка имеет в узлах молекулы. Силы межмолекулярного притяжения относительно слабее, и это определяет свойства веществ с молекулярной кристаллической решеткой — их кристаллы непрочные, плавятся при низких температурах, не электропроводны.
Примеры веществ с молекулярной кристаллической решеткой: полярной ковалентной связью обладает вода (H2O); а соединения неполярной ковалентной связью — твердый оксид углерода (CO2), сера (S8).
Очень интересно, что сера образует два вида кристаллов. В нормальных условиях кристаллы серы имеют интересную усечённо-ромбическую форму, а при 96 °C и выше вырастают длинные игольчатые кристаллы.
Также молекулярные кристаллы образуют многие из твердых органических соединений с достаточно сложной формулой: сахар, глюкоза.
Металлическая решетка
Эта решетка выделяется из общего ряда необычностью строения. Атомы металла, расположенные в узлах решетки, легко расстаются с внешними электронами, что превращает атом в катион, а свободно блуждающие электроны создают делокализованное электронное облако. Эта необычность определяет характерные особенности металлов: ковкость, пластичность, металлический блеск, электро- и теплопроводность.
Ионы более химически активны, чем электронейтральные атомы, этим объясняется способность металлов к поверхностному окислению. Окислы некоторых металлов, например, алюминия, образуют пленку, защищающую поверхность от контакта с кислородом воздуха. Такая особенность даже используется для защиты металлических изделий. Металлы, окислы которых образуют рыхлую структуру (например, железо), подвержены коррозии в гораздо большей степени. Примеры: железо (Fe), серебро (Ag), медь (Cu), алюминий (Al).
Темы кодификатора ЕГЭ: Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости.
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом.
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 оС она замерзает – переходит из жидкого состояния в твердое, и при 100 оС закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.
Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.
Пластичность – это способность вещества деформироваться без разрушения.
Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.
В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.
Аморфный бор
Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом, а саму структуру – кристаллической решеткой. Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку, различают атомную, молекулярную, ионную и металлическую кристаллическую структуру.
Атомная кристаллическая решетка
Атомная кристаллическая решетка образуется, когда в узлах кристалла расположены атомы. Атомы соединены между собой прочными ковалентными химическими связями. Соответственно, такая кристаллическая решетка будет очень прочной, разрушить ее непросто. Атомную кристаллическую решетку могут образовывать атомы с высокой валентностью, т.е. с большим числом связей с соседними атомами (4 или больше). Как правило, это неметаллы: простые вещества — кремния, бора, углерода (аллотропные модификации алмаз, графит), и их соединения (бороуглерод, оксид кремния (IV) и др.). Поскольку между неметаллами возникает преимущественно ковалентная химическая связь, свободных электронов (как и других заряженных частиц) в веществах с атомной кристаллической решеткой в большинстве случаев нет. Следовательно, такие вещества, как правило, очень плохо проводят электрический ток, т.е. являются диэлектриками. Это общие закономерности, из которых есть ряд исключений.
Связь между частицами в атомных кристаллах: ковалентная полярная или неполярная.
В узлах кристалла с атомной кристаллической структурой расположены атомы.
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества.
Вещества, образующие в твердом состоянии атомные кристаллы:
- Простые вещества с высокой валентностью (расположены в середине таблицы Менделеева): бор, углерод, кремний, и др.
- Сложные вещества, образованные этими неметаллами: кремнезем (оксид кремния, кварцевый песок) SiO2; карбид кремния (карборунд) SiC; карбид бора, нитрид бора и др.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.
Молекулярная кристаллическая решетка
Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водородные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.
Связь между частицами в молекулярных кристаллах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Вещества, образующие в твердом состоянии молекулярные кристаллы:
- Простые вещества-неметаллы, образующие маленькие прочные молекулы (O2, N2, H2, S8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями (кроме оксидов кремния и бора, соединений кремния и углерода) — вода H2O, оксид серы SO3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптон и др.);
- Большинство органических веществ, в которых нет ионных связей — метан CH4, бензол С6Н6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Ионная кристаллическая решетка
В случае, если в узлах кристалла находятся заряженные частицы – ионы, мы можем говорить о ионной кристаллической решетке. Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения. В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими. В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью. Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов.
Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH4Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
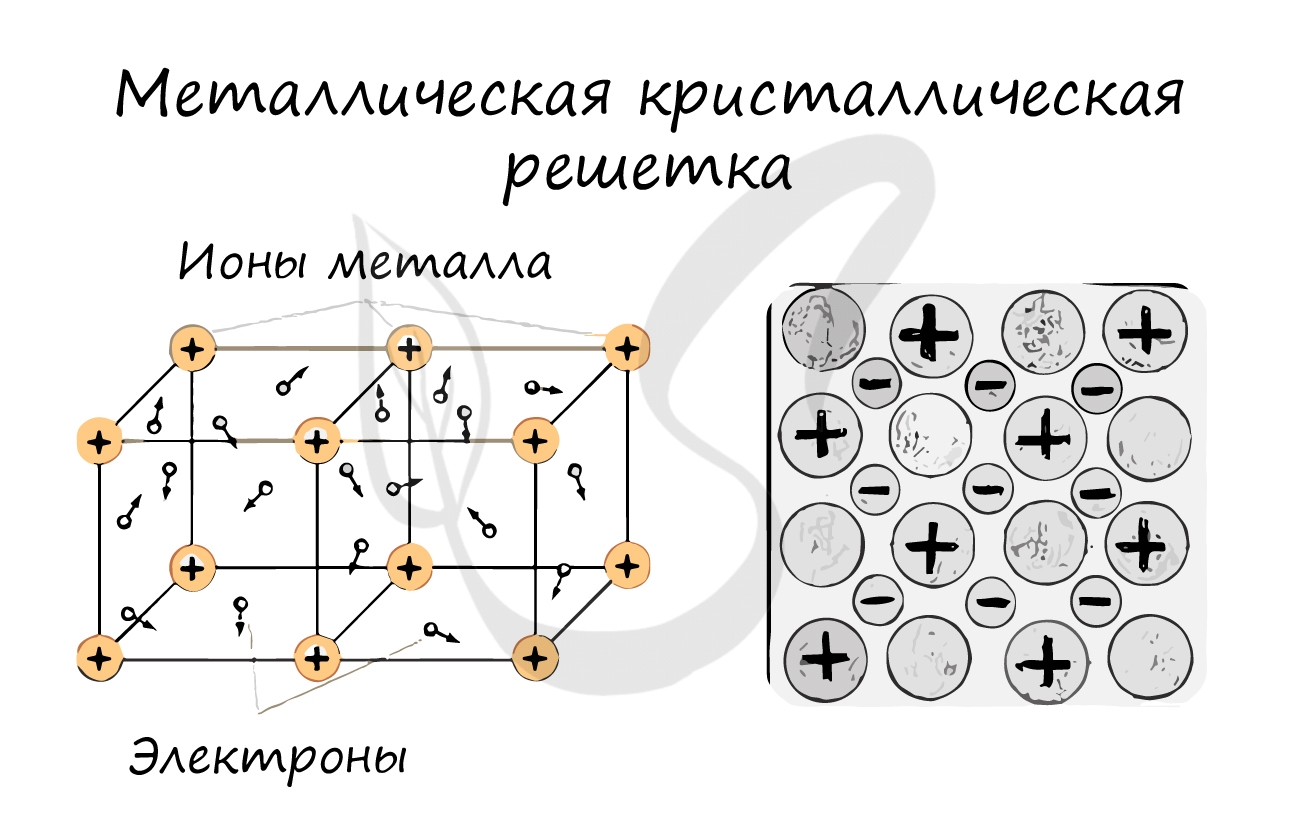
Металлическая кристаллическая решетка
И, наконец, металлы характеризуются особым видом пространственной структуры – металлической кристаллической решеткой, которая обусловлена металлической химической связью. Атомы металлов довольно слабо удерживают валентные электроны. В кристалле, образованном металлом, происходят одновременно следующие процессы: часть атомов отдает электроны и становится положительно заряженными ионами; эти электроны хаотично перемещаются в кристалле; часть электронов притягивается к ионам. Эти процессы происходят одновременно и хаотично. Таким образом, возникают ионы, как при образовании ионной связи, и образуются общие электроны, как при образовании ковалентной связи. Свободные электроны перемещаются хаотично и непрерывно по всему объему кристалла, как газ. Поэтому иногда их называют «электронным газом». Из-за наличия большого числа подвижных заряженных частиц металлы проводят ток, тепло. Температура плавления металлов сильно варьируется. Металлы также характеризуются своеобразным металлическим блеском, ковкостью, т.е. способностью изменять форму без разрушения при сильном механическом воздействии, т.к. химические связи при этом не разрушаются.
Связь между частицами: металлическая химическая связь.
В узлах кристалла с металлической решеткой расположены ионы металлов и атомы.
Фазовое состояние металлов при обычных условиях: как правило, твердые вещества (исключение — ртуть, жидкость при обычных условиях).
Химические вещества с металлической кристаллической решеткой — простые вещества-металлы.
Физические свойства веществ с металлической кристаллической решеткой:
— высокая тепло- и электропроводность;
— ковкость и пластичность;
— металлический блеск;
— металлы, как правило, нерастворимы в растворителях;
— большинство металлов – твердые вещества при нормальных условиях.
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества. Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами. Для молекулярной решетки это, например, углекислый газ, для атомной кристаллической решетки — алмаз, для металлической — медь, и для ионной кристаллической решетки — поваренная соль, хлорид натрия NaCl.
Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).
Итоговая таблица связи свойств веществ со строением:
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки
кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
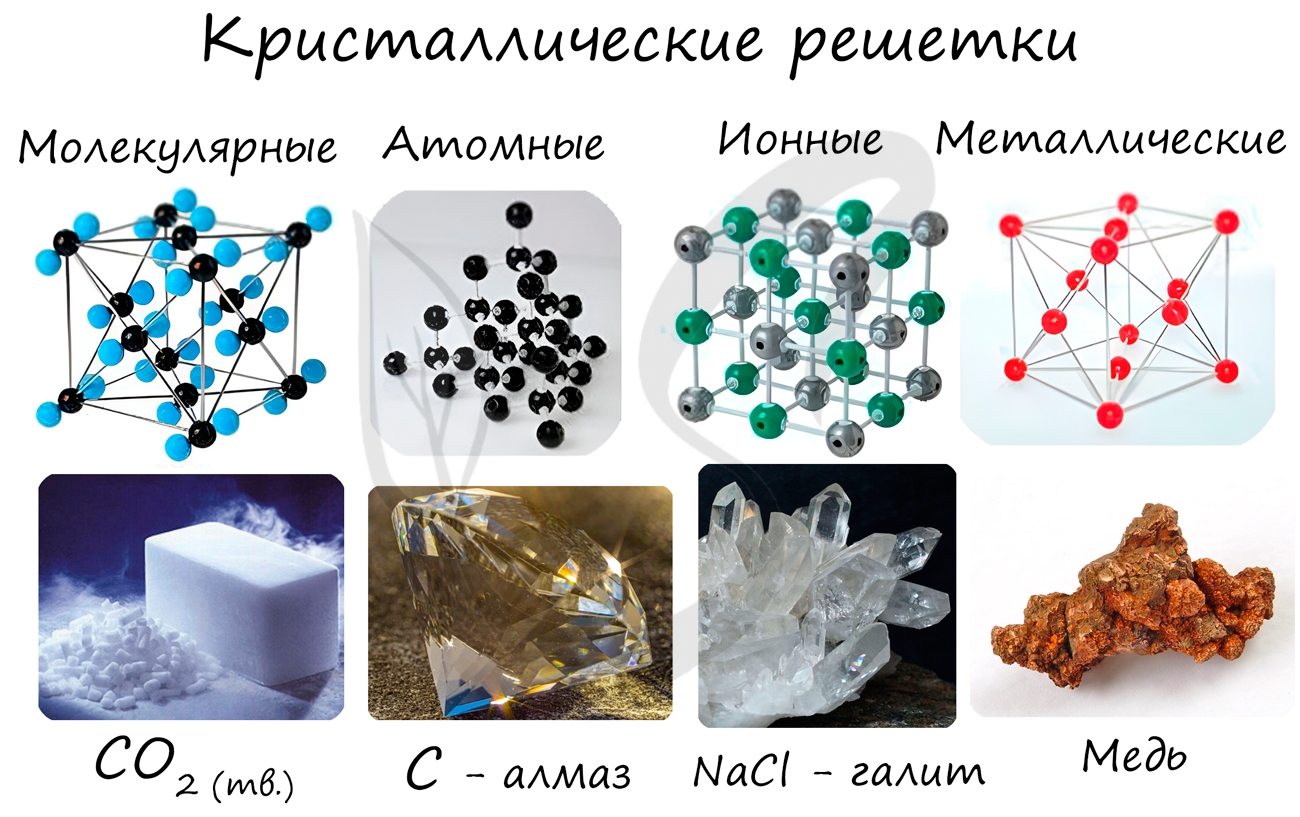
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают
пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей.
Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с
молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие
температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2.
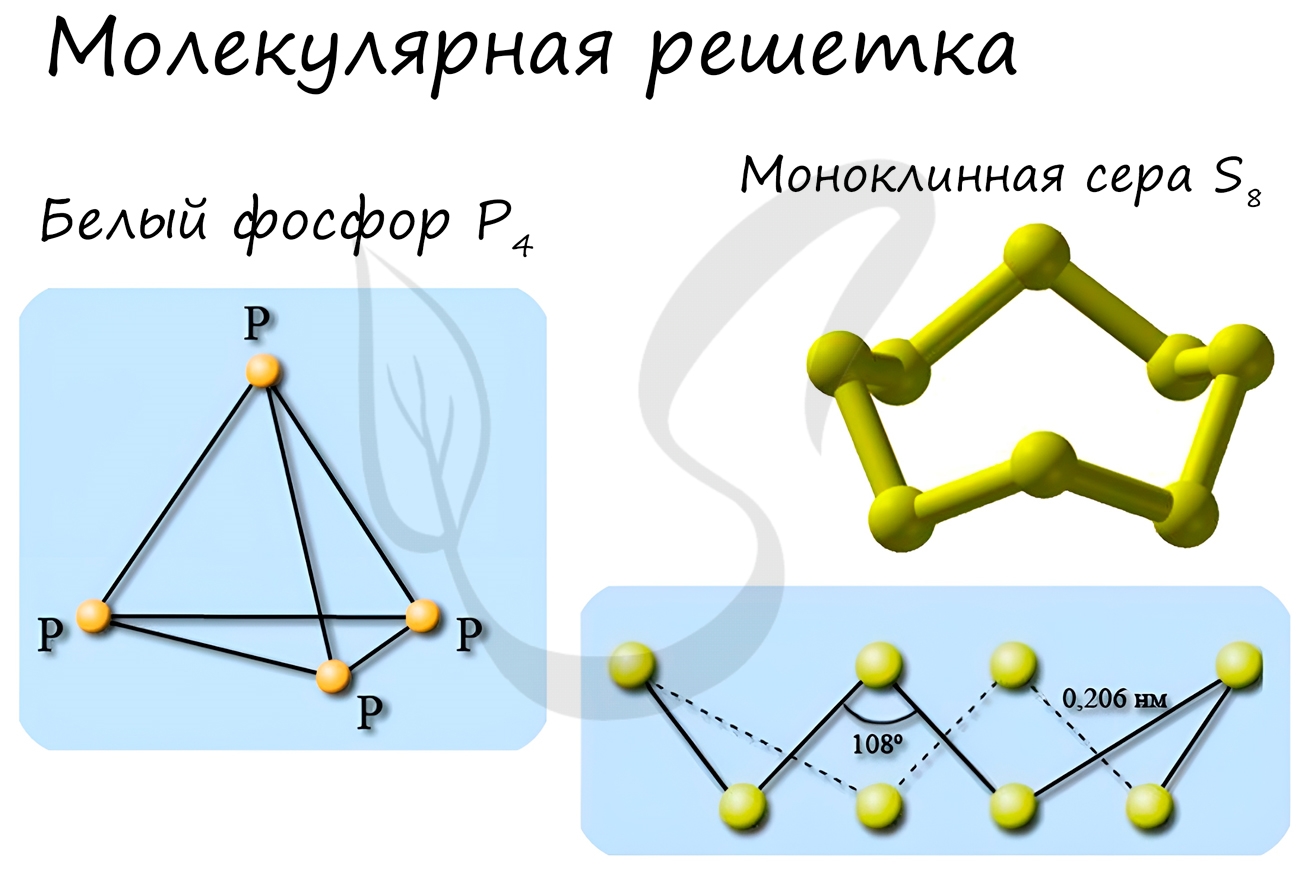
Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы
подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли,
оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью — NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко
растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.

Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят
электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные,
нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
«Строение веществ. Электроотрицательность»
Ключевые слова конспекта: строение веществ, кристаллические решетки, электроотрицательность.
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещества при заданных условиях могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Свойства веществ зависят также и от характера химической связи между частицами, которые их образуют — молекулами, атомами и ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, которые состоят из молекул, называются молекулярными. Связи между молекулами в таких веществах очень слабые, значительно слабее, чем между атомами в середине молекулы. Уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость, а затем в газ (сублимация газа). Температура плавления и кипения веществ, которые состоят из молекул, повышается с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них имеются металлы и неметаллы.
Простые вещества — неметаллы могут иметь молекулярное и атомное строение. Молекулярное строение при н. у. имеют газы (H2, N2, F2, Cl2, O3) либо твердые вещества (I2, P4, S8), а также единственная жидкость (Br2). Все эти вещества имеют молекулярное строение и обладают летучестью. В твердом состоянии они легкоплавкие и могут сублимироваться. Температуры кипения и плавления низкие.
К веществам немолекулярного строения относятся ионные соединения. Такие структуры имеют большинство соединений металлов с неметаллами: все соли (NaCl, K2SO4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Твердые вещества принято делить на кристаллические и аморфные.
Аморфные вещества не имеют четкой структуры, в них не существует закономерного расположения отдельных частиц. Следовательно, аморфные вещества не имеют и четкой температуры плавления. При нагревании они постепенно размягчаются и переходят в текучее состояние. К аморфным веществам относится большинство органических веществ (воск, стекло, полиэтилен, парафин, пластилин, смолы).
Кристаллические вещества характеризуются структурированным, упорядоченным расположением составляющих их частиц в строго определенных точках пространства, расположенных на определенном расстоянии друг от друга. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки расположения частиц, составляющих кристаллическую решетку, называют узлами решетки.
Тип кристаллической решетки определяется видом частиц, расположенных в ее узлах, и характером связи между этими частицами. Различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки в своих узлах содержат ионы. Их образуют вещества с ионной связью, которая связывает как простые (Na+, Cl–), так и сложные (OH–) ионы. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксиды металлов. Например, кристалл NaCl состоит из перемежающихся положительных ионов Na+ и отрицательных Cl–, которые образуют решетку куба. Связи в таком кристалле прочные, вещества с такой решеткой имеют высокую прочность и твердость, они тугоплавкие.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены прочными ковалентными связями. Примером вещества с таким типом кристаллической решетки может быть алмаз — аллотропное видоизменение углерода.
Молекулярными называют кристаллические решетки, в узлах которых расположены молекулы. Химические связи у этих молекул могут быть как полярными (HCl, H2O), так и неполярными (N2, O2).
Несмотря на то, что атомы в молекулах связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия. Вещества с молекулярным типом решеток имеют низкую прочность, низкие температуры плавления, они летучи. Молекулярные кристаллические решетки имеют большинство органических соединений (нафталин, глюкоза, сахар).
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток расположены атомы и ионы (атомы металла переходят в ионы и отдают внешние электроны в общее пользование). Такая внутренняя структура металла определяет его характерные свойства: ковкость, пластичность, электро- и теплопроводность, металлический блеск.
Электроотрицательность
В основе образования химических связей лежит явление электроотрицателъности. В ходе химических взаимодействий одни атомы отдают электроны, другие их присоединяют.
Электроотрицательность — это условная величина, характеризующая относительную способность атома приобретать отрицательный заряд.
Фактически электроотрицательность выражает способность атома оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Электроотрицательность атома определяет характер его свойств: сильнее всего металлические свойства проявляются у элементов, атомы которых легко отдают электроны, а неметаллические — соответственно у элементов, атомы которых легко их присоединяют.
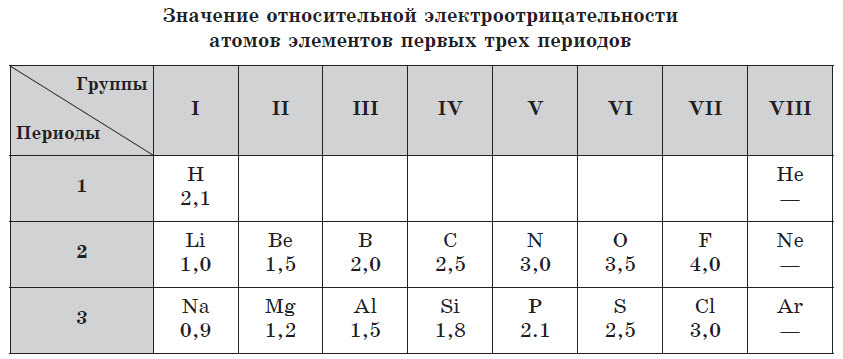
Абсолютные значения электроотрицательности элементов выражаются числами, затрудняющими их практическое применение для вычислений, поэтому в химии используют значения относительной электроотрицателъности. Условно за единицу принимают значение электроотрицательности лития (Li).
Чем меньше значение относительной элетроотрицательности, тем ярче выражены металлические свойства элемента. У всех металлов в периодической системе значение относительной электроотрицательности, как правило, меньше 2. У неметаллов это значение, как правило, превышает 2.
Электроотрицательность элементов также изменяется периодически: в периодах возрастает слева направо, а в главных подгруппах — снизу вверх.
При образовании химических связей электроны переходят или смещаются к атомам элементов, которые обладают большей электроотрицательностью.
Конспект урока «Строение веществ. Электроотрицательность».
Следующая тема: «Химическая связь».