Применение веществ в быту и промышленности. ЕГЭ по химии.
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония |
Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат |
Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия |
Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH |
Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) |
Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |
Задания
Версия для печати и копирования в MS Word
Установите соответствие между веществом и областью его применения.
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) производство удобрений
2) производство мыла
3) производство стекла
4) производство жиров
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
A. Карбонат натрия используют при производстве стекла (3);
Б. Нитрат калия используют при производстве удобрений (1);
В. Стеарат натрия используют при производстве мыла (2).
Ответ: 312.
|
Элемент и его соединения |
Применение |
|
Ø Al Ø Al₂O₃ Ø AlCl₃ Ø Al₂(SO₄)₃ ∙ 18H₂O |
· Алюмотермия используется в металлургии для получения металлов: 2Al + Fe₂O₃ = 2Fe + Al₂O₃ · Машиностроение, авиастроение, судостроение · Алюминиевая посуда · Некоторые соли применяются в медицине для лечения кожных заболеваний · Адсорбент в хроматографии · Катализатор в органической химии · Очистка воды |
|
Ø Fe Ø FeCl₃ Ø Fe(NO₃)₃ |
· Сплавы железа являются основным конструкционным материалом · Катализатор в органической химии · Окраска тканей |
|
Ø Cr Ø «Хромовая смесь» — раствор K₂Cr₂O₇ вH₂SO₄(конц) |
· В металлургии для получения специальных сортов стали · Хромом покрывают другие металлы с целью предохранения их от коррозии · Окислитель для очистки стеклянной химической посуды |
|
Ø KMnO₄ |
· Дезинфицирующее средство |
|
Ø Cu |
· Соединения меди используются для борьбы с вредителями сельскохозяйственных растений |
|
Ø H₂ Ø H₂O₂ |
· Сырьё для получения NH₃, HCl, CH₃OH · В пищевой промышленности водород используют для выработки твёрдых жиров путём гидрогенизации растительных масел · В металлургии для восстановления некоторых металлов и оксидов · Летательные аппараты, воздушные шары, зонды наполняют водородом · «водородная горелка» для сварки и резки металлов · Жидкий водород – одно из наиболее эффективных видов ракетного топлива · В энергетике водород используют в качестве топлива · Дезинфицирующее средство в медицине для полосканий, промываний и как кровоостанавливающее средство |
|
Ø Cl₂ |
· В производстве пластмасс · Отбеливатель бумаги и тканей · Обеззараживание воды – «хлорирование» · В химической промышленности для получения соляной кислоты, фосгена, хлорной извести, хлороформа, моющих средств, ядохимикатов, каучуков |
|
Ø O₂ |
· В металлургии при выплавке чугуна и стали · В смеси с ацетиленом используют для сварки и резки металлов · В химической промышленности · В медицине (кислородные подушки, кислородные коктейли и др.) |
|
Ø S Ø H₂S Ø SO₂ Ø H₂SO₄ Ø MgSO₄ ∙ 7H₂O(горькая английская соль)и Na₂SO₄ ∙ 10H₂O(глауберова соль) Ø CaSO₄ ∙ 2H₂O |
· Широко применяется для борьбы с вредителями сельского хозяйства · Для вулканизации каучука · В производстве спичек, пороха · В медицине для лечения кожных заболеваний · В медицине для лечения ревматизма и кожных заболеваний · Сероводород – один из компонентов минеральных вод · В текстильной промышленности для отбеливания различных изделий · Для уничтожения вредных микроорганизмов · Получение серной кислоты · Осушка газов · Получение других кислот · Получение удобрений · Различные красители · Слабительное · Гипсовые повязки |
|
Ø N₂ Ø NH₃ Ø NH₄OH(нашатырный спирт) и NH₄Cl Ø Аммонийные соли Ø N₂O(веселящий газ) Ø HNO₃ |
· Исходное сырьё для получения аммиака, азотной кислоты, азотных удобрений · Получение азотной кислоты, гидроксида аммония и т.д. · В медицине · Удобрения · В медицине для наркоза · Для получения удобрений, лекарственных и взрывчатых веществ |
|
Ø P Ø H₃PO₄ |
· Производство фосфорной кислоты · Красный фосфор используется при изготовлении спичек · Производство удобрений · Изготовление реактивов, многих органических веществ, для получения катализаторов · Для создания защитных покрытий на металлах · В фармацевтической промышленности |
|
Ø C Ø CO Ø CO₂ Ø Na₂CO₃ |
· Алмаз применяется в промышленности для обработки твердых сплавов и бурения, также для изготовления ювелирных изделий · Графит применяется в электротехнике для изготовления электродов · В металлургии для получения металлов и руд · Пищевая промышленность (газированная вода, лимонады) · Сухой лёд · Пищевая промышленность (сода) |
|
Ø Si Ø SiO₂ |
· Получение полупроводниковых материалов и сплавов · Из сплава кремния с железом (ферросилиций) изготавливают химическую аппаратуру · Сырьё для производства стекла · Изготовление цемента |
Содержание
- Физические свойства
- Химические свойства
- Природные источники и месторождения
- Применение
Нитрат калия, азотнокислый калий — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
| Нитрат калия | |
|---|---|
| Общие | |
| Систематическое наименование |
Нитрат калия |
| Сокращения | в народе КС, НК |
| Традиционные названия | Ка́лиевая селитра, кали́йная селитра, индийская селитра, Соль Петра (Salt of Peter, petersalt) |
| Хим. формула | KNO3 |
| Рац. формула | KNO3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 101,1032 г/моль |
| Плотность | 2,109 (16 °C) |
| Твёрдость | 2 |
| Термические свойства | |
| Температура | |
| • плавления | 334 °C |
| • кипения | с разложением °C |
| • разложения | 400 °C |
| Тройная точка | отсутствует |
| Мол. теплоёмк. | 95,06 Дж/(моль·К) |
| Энтальпия | |
| • образования | -494,00 кДж/моль |
| • плавления | 9,80 кДж/моль |
| • сублимации | 181,00 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 13,3 (0 °C) 36 (25 °C) 247 (100 °C) |
| Классификация | |
| Рег. номер CAS | 7757-79-1 |
| PubChem | 24434 |
| Рег. номер EINECS | 231-818-8 |
| SMILES |
[N+](=O)([O-])[O-].[K+] |
| InChI |
1S/K.NO3/c;2-1(3)4/q+1;-1 FGIUAXJPYTZDNR-UHFFFAOYSA-N |
| Кодекс Алиментариус | E252 |
| RTECS | TT3700000 |
| ChEBI | 63043 |
| Номер ООН | 1486 |
| ChemSpider | 22843 |
| Безопасность | |
| ЛД50 | 3750 мг/кг |
| Токсичность | малотоксичен |
| NFPA 704 |
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных.
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддаётся очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (чёрного) пороха) и как калий-азотное удобрение (очень удобное соединение двух обычно плохо сочетающихся при усваивании растениями элементов).
Физические свойства
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельчённом состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решёткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O:
| Растворитель / Температура, °С |
0 | 10 | 20 | 25 | 30 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 |
| Жидкий аммиак | 10,52 | 10,4 | |||||||
| Гидразин | 14 |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддаётся очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная):
Реакция поташа с кальциевой селитрой (нитратом кальция) является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа, впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
— наиболее применимая после реакции нитрата кальция с карбонатом или сульфатом калия.
— в основном, демонстрационная реакция соответствующей кислоты и основания
— тоже демонстрационная реакция соответствующих кислоты и металла.
— демонстрационная реакция соответствующего щелочного оксида с соответствующей кислотой.
Также:
Природные источники и месторождения
В природе нитрат калия распространён в виде минерала нитрокалита. Природный нитрат калия образуется в результате разложения азотсодержащих веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом. Наиболее известные месторождения нитрата калия находятся в Индии, Боливии, Австралии, Чили, ЮАР, России, США и Шри-Ланке. Он также встречается в Китае, Мексике, и других странах
В очень малых количествах нитрат калия содержится в растениях и животных, является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Применяется при изготовлении дымного пороха и некоторых других горючих смесей (например, карамельного ракетного топлива), которые почти полностью сейчас используются в производстве пиротехнических изделий.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стёкол и придания прочности изделиям из стекла.
Расплав иногда используется в химических лабораториях и у любителей химии для получения металлического калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности, при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252. Сам по себе он не имеет существенного антибактериального действия, но его оказывает образующийся в результате восстановления нитрит калия в мясных продуктах, в которых нитрат калия наиболее широко используется в качестве консерванта.
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.
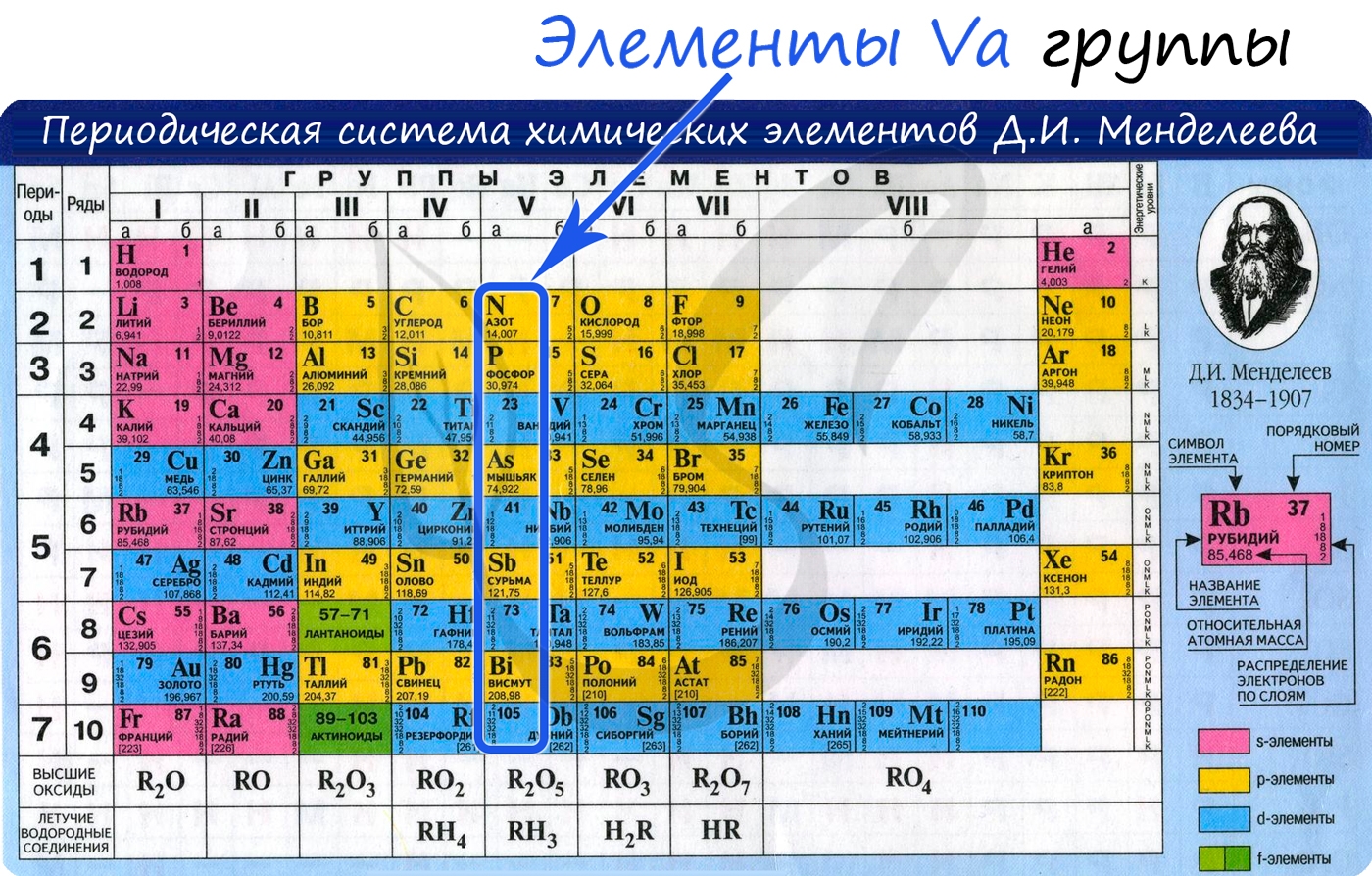
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
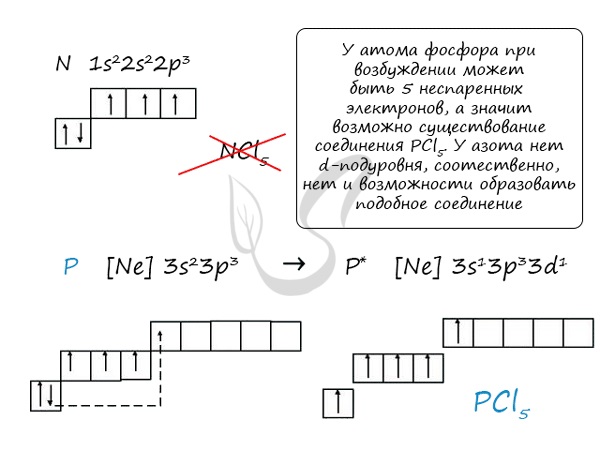
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
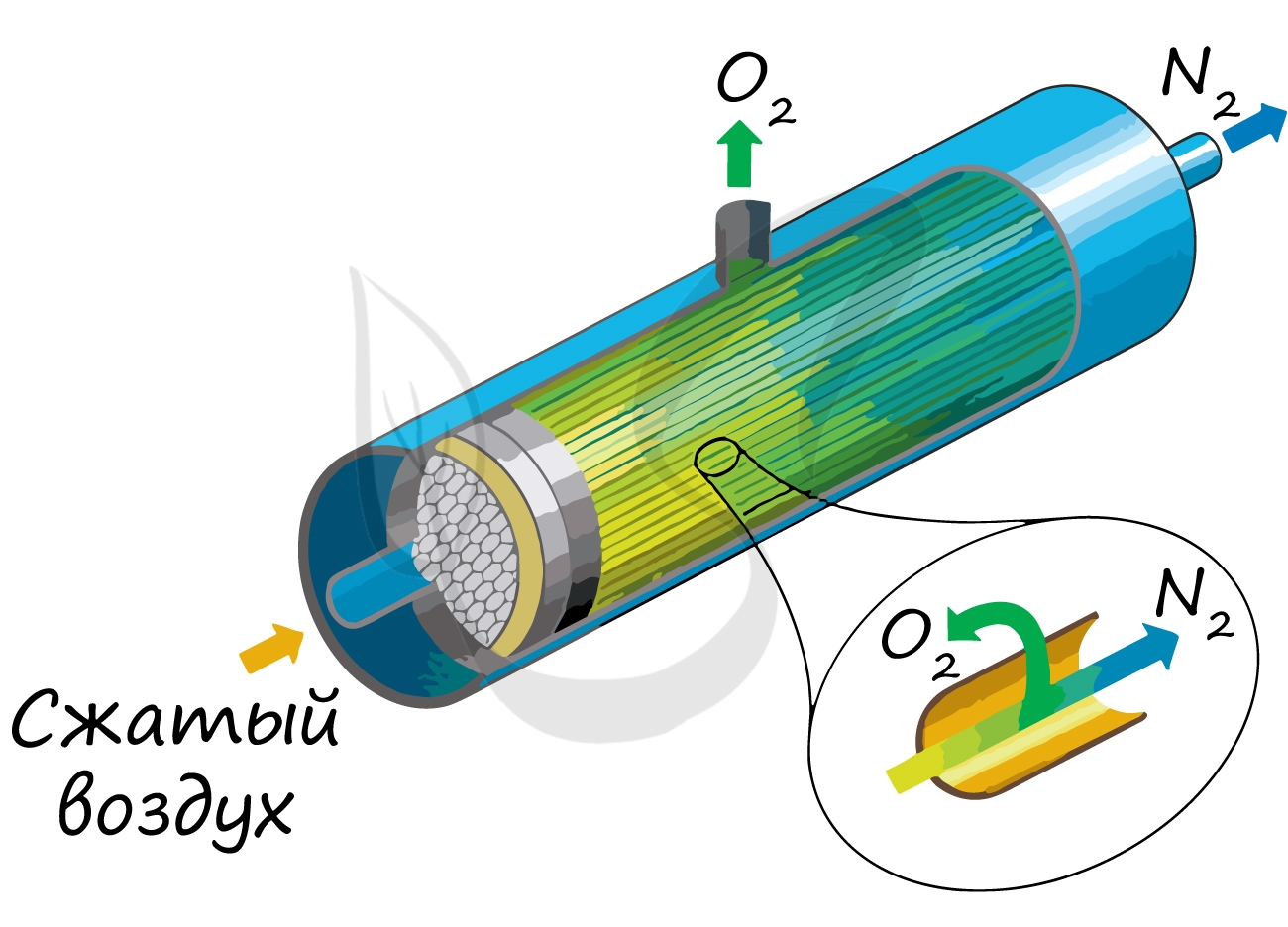
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
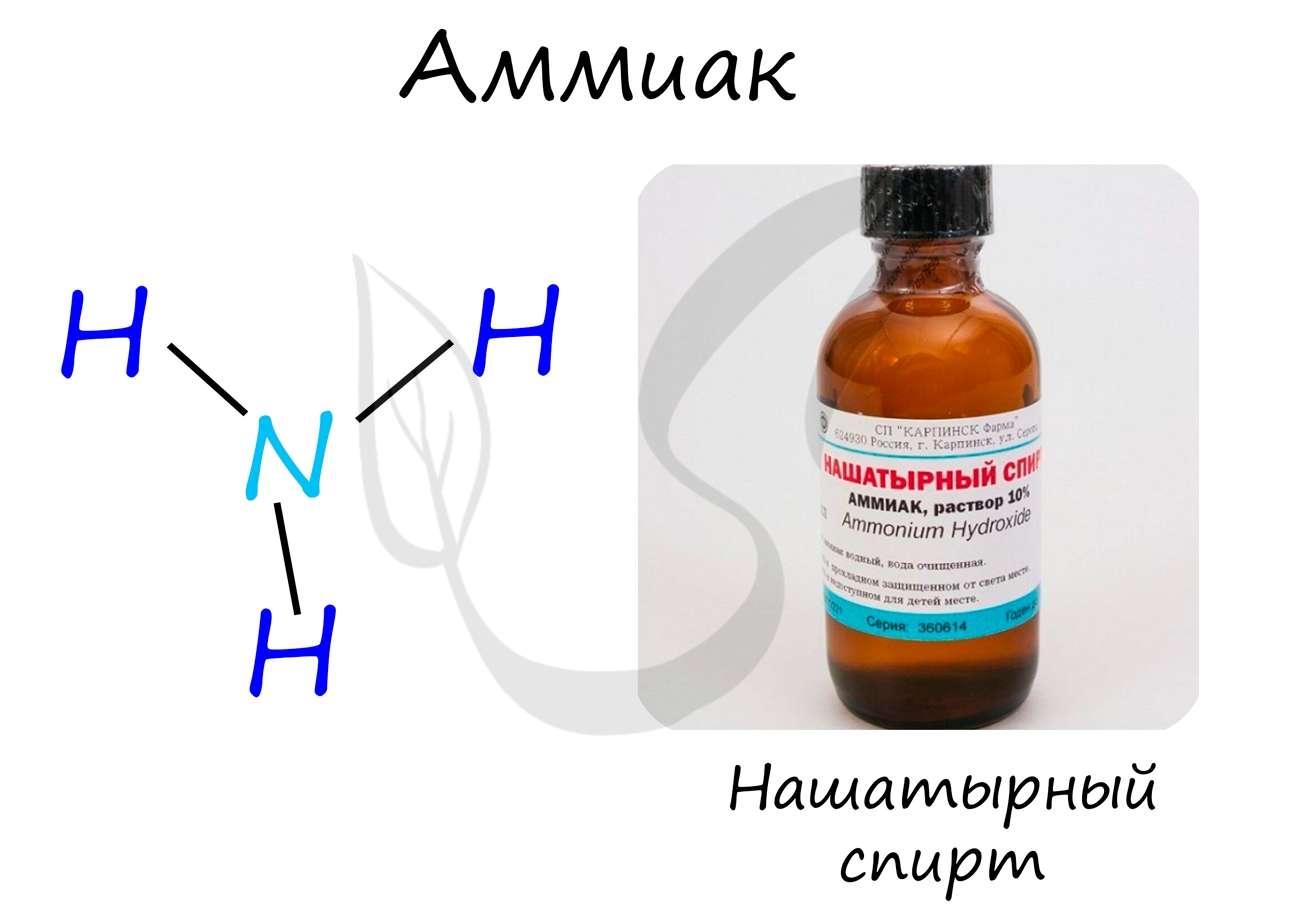
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.
Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO + O2 → NO2

Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем
охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 + HNO3 + H2O → H3AsO4 + NO↑
As2O3 + HNO3 + H2O → H3AsO4 + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2—).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
| Нитрат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Нитрат калия |
| Сокращения | в народе КС, НК |
| Традиционные названия | Калиевая селитра, калийная селитра, индийская селитра, Соль Петра (Salt of Peter, petersalt) |
| Хим. формула | KNO3 |
| Рац. формула | KNO3 |
| Состояние | твёрдое |
| Молярная масса | 101,1032 г/моль |
| Плотность | 2,109 (16 °C) |
| Твёрдость | 2 |
| Т. плав. | 334 °C |
| Т. кип. | с разложением °C |
| Т. разл. | 400 °C |
| Тройная точка | отсутствует |
| Мол. теплоёмк. | 95,06 Дж/(моль·К) |
| Энтальпия образования | -494,00 кДж/моль |
| Энтальпия плавления | 9,80 кДж/моль |
| Энтальпия сублимации | 181,00 кДж/моль |
| Растворимость в воде | 13,3 (0 °C) 36 (25 °C) 247 (100 °C) |
| ГОСТ | ГОСТ 4217-77 |
| Рег. номер CAS | 7757-79-1 |
| PubChem | 24434 |
| Рег. номер EINECS | 231-818-8 |
| SMILES |
[N+](=O)([O-])[O-].[K+] |
| InChI |
1S/K.NO3/c;2-1(3)4/q+1;-1 FGIUAXJPYTZDNR-UHFFFAOYSA-N |
| Кодекс Алиментариус | E252 |
| RTECS | TT3700000 |
| ChEBI | 63043 |
| Номер ООН | 1486 |
| ChemSpider | 22843 |
| ЛД50 | 3750 мг/кг |
| Токсичность | малотоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Нитрат калия, азотнокислый калий (калиевая селитра, калийная селитра, индийская селитра и др.) — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных.
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддается очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (чёрного) пороха) и как калий-азотное удобрение (очень удобное соединение двух обычно плохо сочетающихся при усваивании растениями элементов).
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Природные источники и месторождения
- 5 Применение
калиевая селитра — удобрение
Физические свойства
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельченном состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решеткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O[3]:
| Растворитель / Температура, °С |
0 | 10 | 20 | 25 | 30 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 |
| Жидкий аммиак | 10,52 | 10,4 | |||||||
| Гидразин | 14 |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддается очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
- 2KNO3 ⟶ 2KNO2 + O2↑
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная)[4]:
- Zn + 2HCl ⟶ ZnCl2 + 2H0,
- KNO3 + 2H0 ⟶ KNO2 + H2O.
- Расплав нитрата калия может быть использован для получения металлического калия электролизом, однако из-за высоких окислительных способностей нитрата калия в расплавленном состоянии предпочтительнее гидроксид калия.
Получение
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитряницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дёрном для удерживания образующихся газов. При гниении навоза образовывался аммиак, который накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca(NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу.
- Ca(NO3)2 + K2CO3 ⟶ 2KNO3 + CaCO3↓
Реакция поташа с кальциевой селитрой (нитратом кальция) является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа, впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
- Ca(NO3)2 + K2SO4 ⟶ 2KNO3 + CaSO4↓
Первый способ применялся вплоть до 1854 г., когда немецкий химик К. Нёльнер изобрел производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия, доступного в виде чилийской селитры:
- KCl + NaNO3 ⟶ KNO3 + NaCl
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
- KCl + NH4NO3 ⟶ KNO3 + NH4Cl
— наиболее применимая после реакции нитрата кальция с карбонатом или сульфатом калия.
- KOH + HNO3 ⟶ KNO3 + H2O — в основном, демонстрационная реакция соответствующей кислоты и основания
- 21K + 26HNO3 ⟶ 21KNO3 + NO↑ + N2O↑ + N2↑ + 13H2O — тоже демонстрационная реакция соответствующих кислоты и металла.
- K2O + 2HNO3 ⟶ 2KNO3 + H2O — демонстрационная реакция соответствующего щелочного оксида с соответствующей кислотой.
Также:
- 2KOH + N2O5 ⟶ 2KNO3 + H2O
- NH4NO3 + KOH ⟶ NH3 ↑ + KNO3 + H2O
- K2CO3 + 2HNO3 ⟶ 2KNO3 + H2O + CO2↑
Природные источники и месторождения
В природе нитрат калия распространен в виде минерала нитрокалита. Крупнейшее его месторождение находится в Индии. Природный нитрат калия образуется в результате разложения азотсодержащих веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом.
В очень малых количествах содержится в растениях и животных, является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Применяется при изготовлении дымного пороха и некоторых других горючих смесей (например, карамельного ракетного топлива), которые почти полностью сейчас используются в производстве пиротехнических изделий.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стекол и придания прочности изделиям из стекла.
Расплав иногда используется в химических лабораториях и у любителей химии для получения металлического калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности, при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252. Сам по себе он не имеет существенного антибактериального действия, но его оказывает образующийся в результате восстановления нитрит калия в мясных продуктах, в которых нитрат калия наиболее широко используется в качестве консерванта.
Физические свойства
Нитрат калия KNO3 — соль щелочного металла калия и азотной кислоты. Белый. Плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 101,10; относительная плотность для тв. и ж. состояния d = 2,109; tпл = 334, 5º C;
Способ получения
1. Нитрат калия можно получить при 70º С путем взаимодействия надпероксида калия и оксида азота (IV), образуется нитрат калия и кислород:
2KO2 + 2NO2 = 2KNO3 + O2
2. В результате взаимодействия разбавленной азотной кислоты и гидроксида калия образуется нитрат калия и вода:
KOH + HNO3 = KNO3 + H2O
3. В результате реакции между горячим гидроксидом калия, оксидом азота (IV) и кислородом, происходит образование нитрата калия и воды:
4KOH + 4NO2 + O2 = 4KNO3 + 2H2O
4. В результате взаимодействия горячего и разбавленного раствора нитрита калия и кислорода образуется нитрат калия:
2KNO2 + O2 = 2KNO3
5. При смешивании горячего пероксида водорода и нитрита калия в разбавленной серной кислоте происходит образование нитрата калия и воды:
KNO2 + H2O2 = KNO3 + H2O
Качественная реакция
Качественная реакция на нитрат калия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат калия образует сульфат калия, нитрат меди, газ оксид азота и воду:
Cu + 4KNO3 + 2H2SO4 = Cu(NO3)2 + 2K2SO4 + 2NO2 + 2H2O
Химические свойства
1. Hитрат калия разлагается при температуре 400–520º С с образованием нитрита калия и кислорода:
2KNO3 = 2KNO2 + O2
2. Нитрат калия может реагировать с простыми веществами:
2.1. Нитрат калия реагирует со свинцом при температуре 350–400 ºС. При этом образуется нитрит калия и оксид свинца:
KNO3 + Pb = KNO2 + PbO
2.2. Нитрат калия реагирует при температуре 400º С с алюминием с образованием алюмината калия, оксида алюминия и азота:
6KNO3 + 10Al = 6KAlO2 + 2Al2O3 + 3N2
2.3. Нитрат калия взаимодействует с атомным водородом в присутствии цинка и разбавленной соляной кислоты при этом образуются нитрит калия и вода:
KNO3 + Zn + 2HCl = KNO2 + ZnCl2 + H2O,
при взаимодействии нитрата калия и водорода при кипении в присутствии алюминия и концентрированного гидроксида калия образуется газ аммиак, вода и гидроксид калия:
3KNO3 + 8Al + 5KOH+ 18H2O = 3NH3↑ + 8K[Al(OH)4]
3. Возможны реакции между нитратом калия и сложными веществами:
3.1. Нитрат калия вступает в реакцию с кислотами:
3.1.1. В результате реакции в вакууме между нитратом калия и концентрированной серной кислотой образуется гидросульфат калия и азотная кислота:
KNO3 + H2SO4 = HNO3↑ + KHSO4
3.2. Нитрат калия взаимодействует с солями:
3.2.1. Нитрат калия реагирует с сульфатом аммония при нагревании. В результате данной реакции образуются сульфат калия, оксид азота (I) и вода:
2KNO3 + (NH4)2SO4 = K2SO4 + 2N2O + 4H2O




