Название
Колба | ЕГЭ по ХИМИИ 2022
Статус
+10 баллов ЕГЭ на повторении
Описание
Привет, я Ксюша Кармацкая. Готовлю к ЕГЭ по химии уже 8 лет, помогу и тебе
Результаты учеников:
— средний балл учеников — 82
— каждый 8-ой сдал на 90+
Мое образование и опыт работы:
— окончила бакалавриат, магистратуру и аспирантуру по химии
— шесть лет работала научным сотрудником в лаборатории
— занимаюсь подготовкой к ЕГЭ седьмой год
— год работала в английской школе по кембриджской программе
— третий год преподаю в своей онлайн школе
— занимаюсь дизайном обучающих материалов уже пятый год
Я написала два учебника для подготовки к ЕГЭ по химии, которыми пользуются не только школьники, но и учителя.
Выпустила сборник вариантов для подготовки к ЕГЭ
Пишу книгу по химии для более младшего школьного возраста
Эта группа создана для того, чтобы рассказать о нашей школе, погрузить вас в атмосферу изучения химии. А еще мы постоянно делимся полезной информацией, которая однозначно поможет при подготовке к ЕГЭ.
Чтобы вам было удобнее, навигация по группе:
#теория_неорганика@kolbacourse — теория по неорганике для ЕГЭ
#теория_органика@kolbacourse — теория по органике для ЕГЭ
#теория_огэ@kolbacourse — теория для ОГЭ
#словарь@kolbacourse — лучшие объяснения терминов от Колбы
#колба_memes@kolbacourse — смешные картинки
#колба_games@kolbacourse — игры
Сайт
http://kolbacourse.com/vspomnitvse
-
Лабораторная посуда
Лабораторная посуда
Посуда химическая лабораторная (п.х.л.) — изделия, изготовленные из стекла, кварца, фарфора и др. материалов, которые применяются
для препаративных и химико-аналитических работ.
Требования, которым должна соответствовать химическая посуда:
- Термоустойчивость, малый коэффициент теплового расширения материала
- Устойчивость к воздействию химических реагентов
- Загрязнения должны легко отмываться
В данной статье мы классифицируем всю химическую посуду на три группы по ее назначению: мерная, немерная и специального применения.
Мерная химическая посуда
Мерная посуда имеет точную градуировку, нагреванию ее не подвергают.
- Пипетки
- Бюретки
- Мерные колбы, мензурки и цилиндры
Пипетки служат для отбора жидкостей (до 100 мл) и газов (от 100 мл)

Применяются для измерения точных объемов, титрования (метод количественного/качественного анализа в аналитической химии)

С помощью мерных колб, мензурок и цилиндров отмеривают и хранят определенные объемы жидкостей.

Немерная химическая посуда (общего назначения)
К такой химической посуде относятся изделия, многие из которых употребляются с нагревом:
пробирки, стаканы, колбы (плоскодонные, круглодонные, конические), реторты.

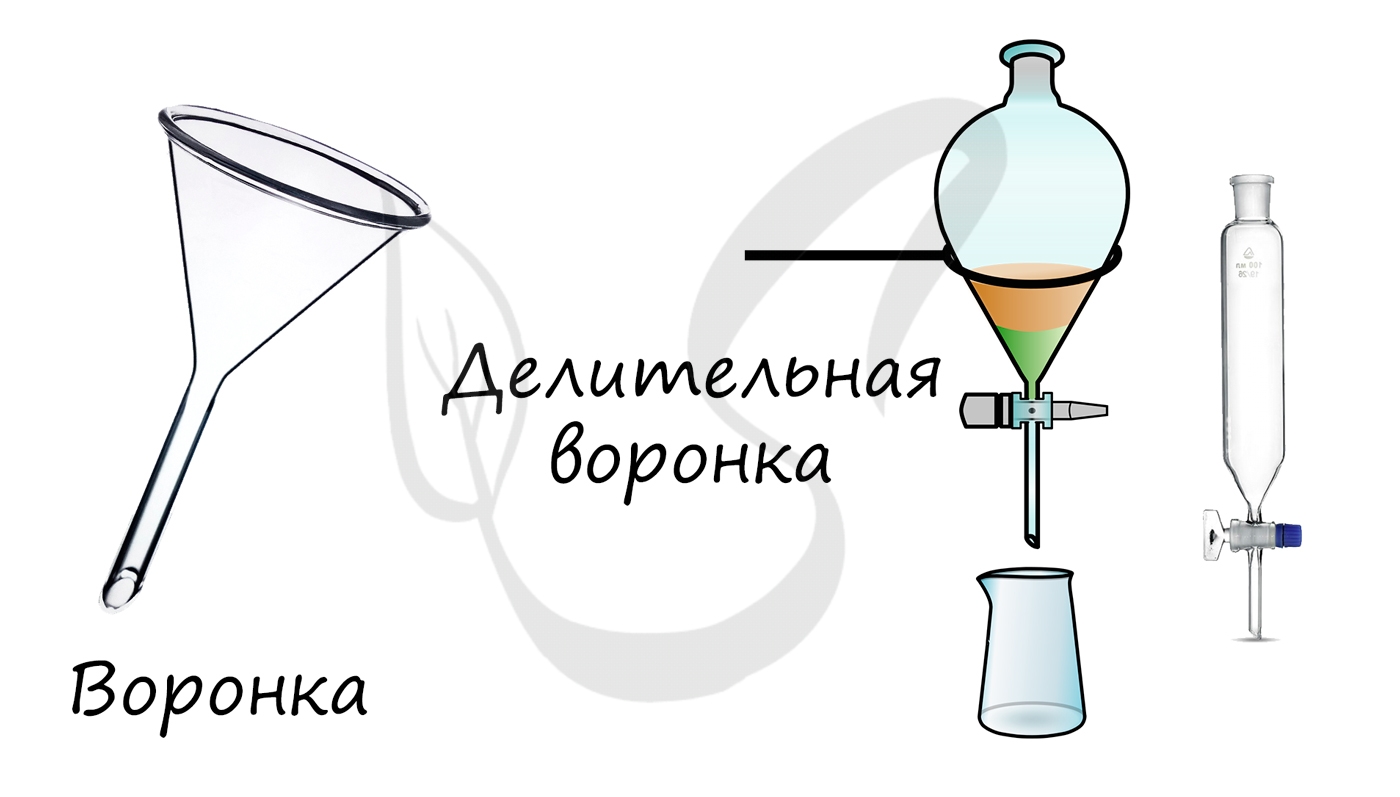
- Воронки, делительные воронки
- Кристаллизатор
- Сифон
- Банки, склянки, бюксы
- Капельница
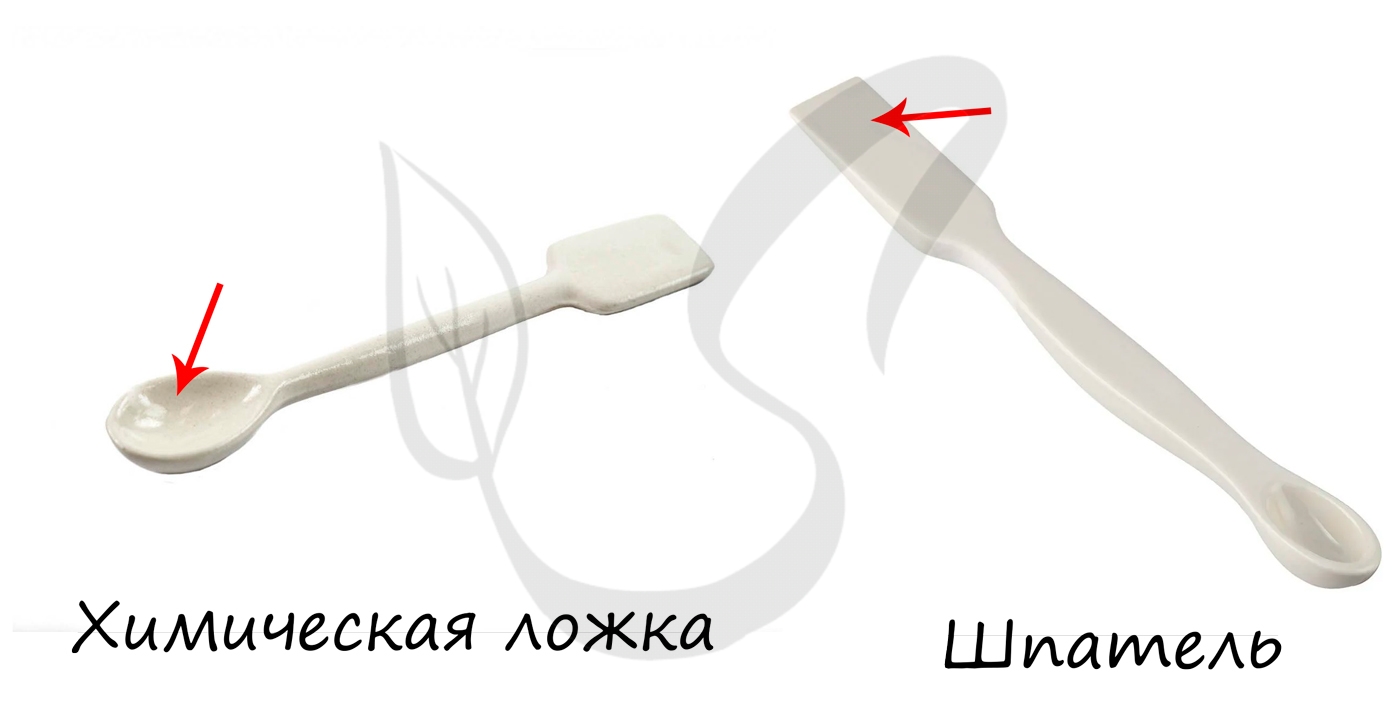
- Химические ложки, шпатели
- Штатив для пробирок
Служат для переливания и фильтрования жидкостей. Делительные воронки применяются для разделения несмешивающихся жидкостей.
Используется для выпаривания растворов и очистки веществ путем перекристаллизации — методе, основанном на различии растворимости вещества
в растворителе при различных температурах.

Сифон химический применяется для безопасного перекачивания жидких сред из бутылей, бочек, канистр. Особенно важен сифон в работе с агрессивными
опасными химическими веществами.

Банки служат для хранения твердых веществ, склянки — для хранения жидких веществ, а также в качестве резервуара, из которого жидкость поступает в другой
раствор, например, в бюретки в ходе титрования.
Бюкс — баночка с притертой пробкой, используется как емкость при исследовании, в ходе которых высушиваются и взвешиваются сыпучие материалы

Химическая капельница применяется для дозирования растворов и индикаторов.

Используются с целью взятия твердых и сыпучих веществ. Могут служить для перемешивания жидкостей.
Применяется для одновременного размещения и закрепления множества пробирок.

Химическая посуда специального назначения
Данная посуда отличается тем, что предназначена для какой-либо одной цели.
- Колбы для дистилляции (колбы Вюрца)
- Колба Бунзена
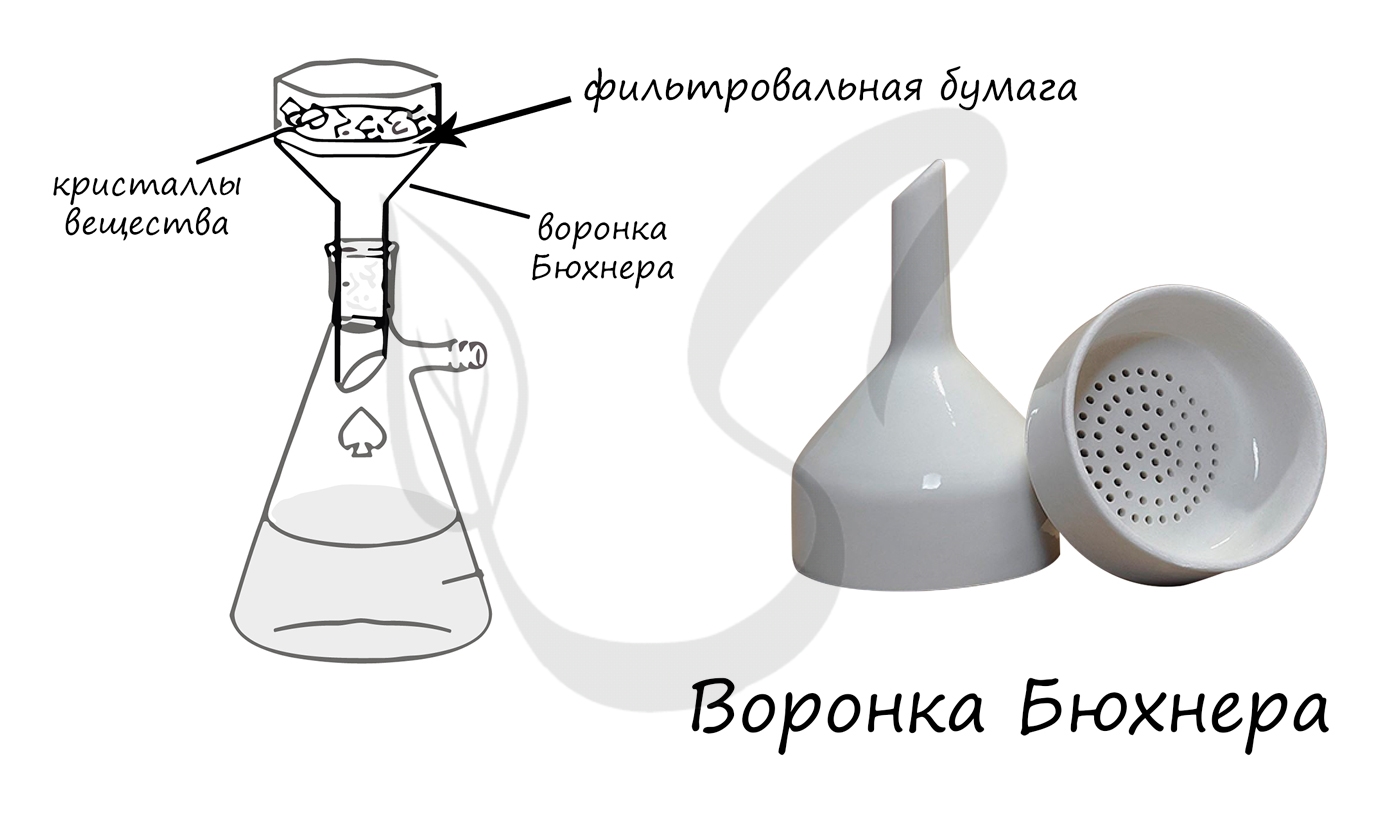
- Воронка Бюхнера
- Воронка (фильтр) Шотта
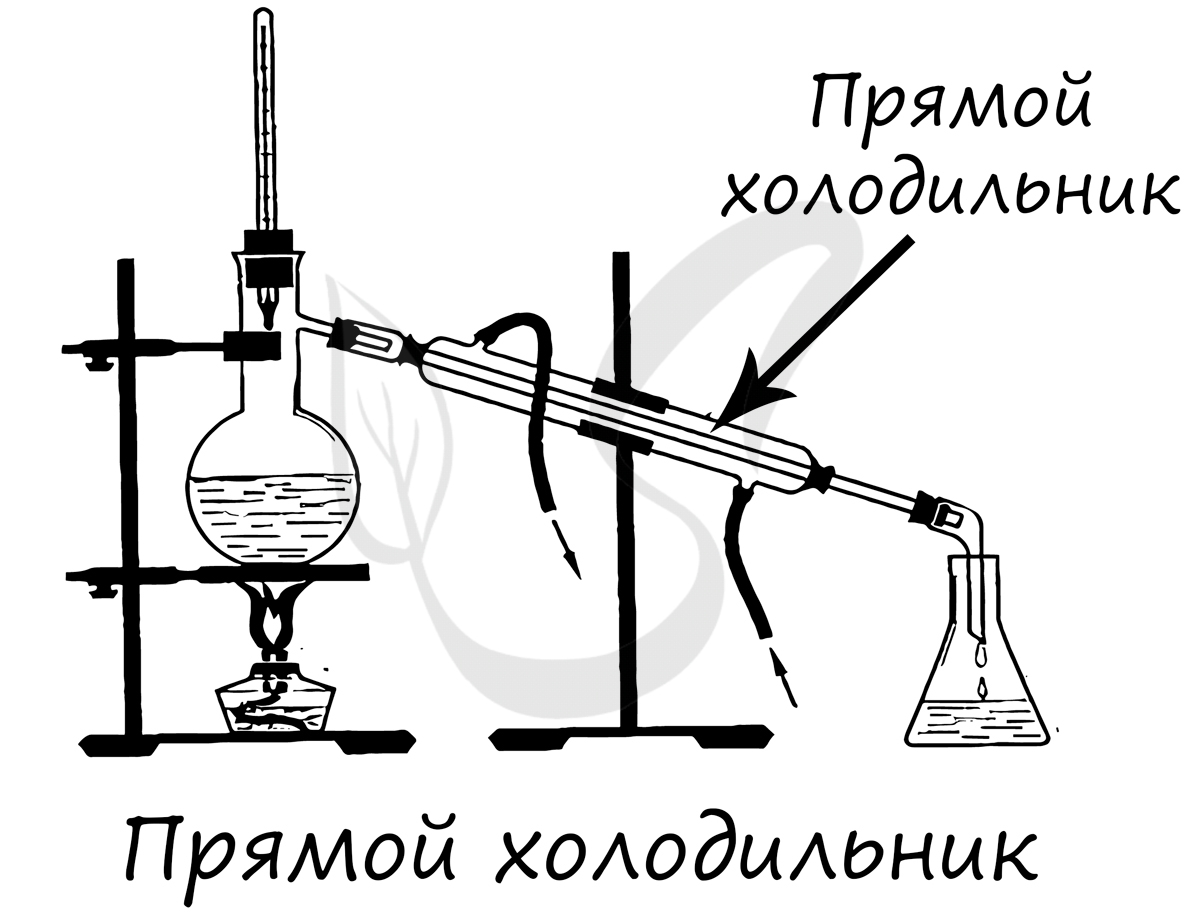
- Прямой холодильник
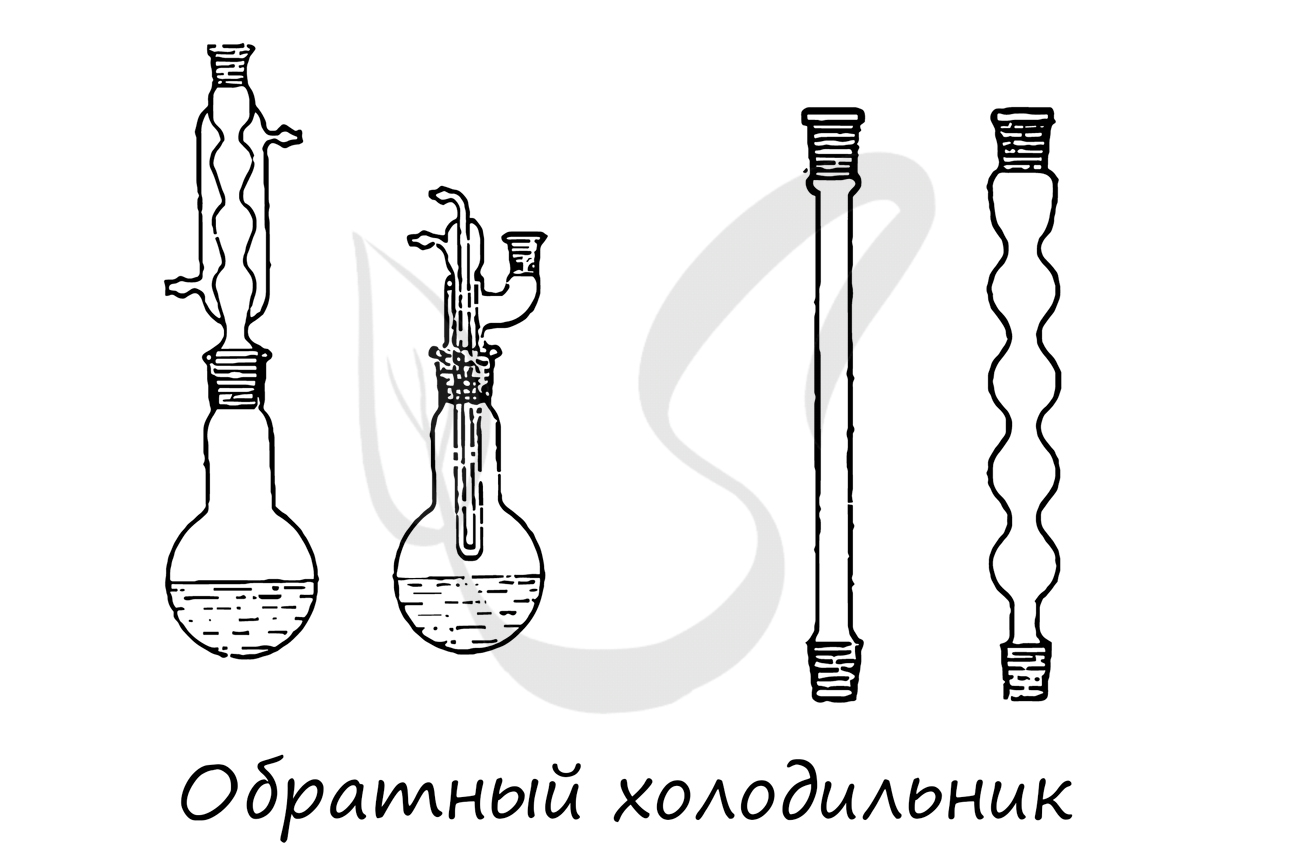
- Обратный холодильник
- Аллонж
- Колбы грушевидной формы (колбы Кьельдаля)
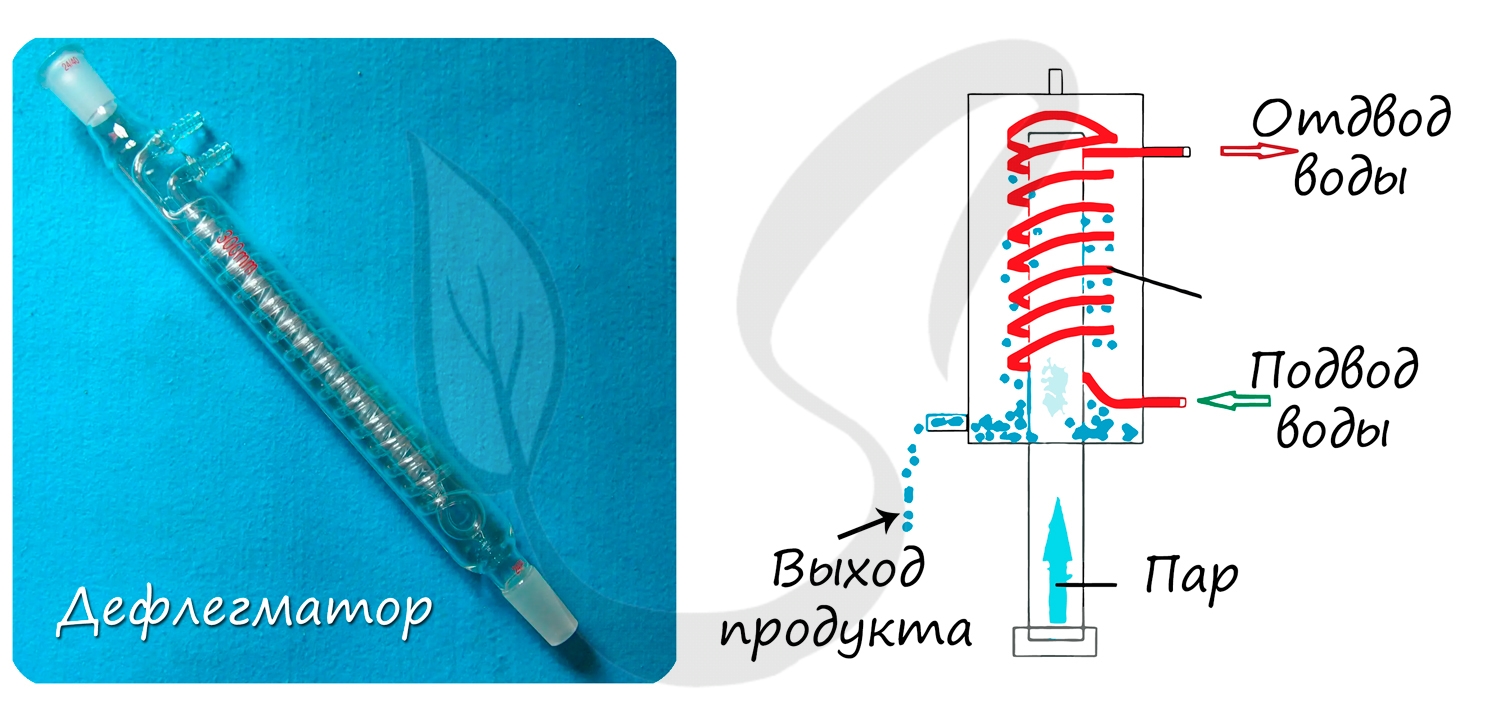
- Дефлегматор
- Эксикатор
- Склянка для промывания газов (склянка Дрекселя)
- Трубки различной формы (хлоркальцевые U-образные трубки)
- Аппарт Киппа
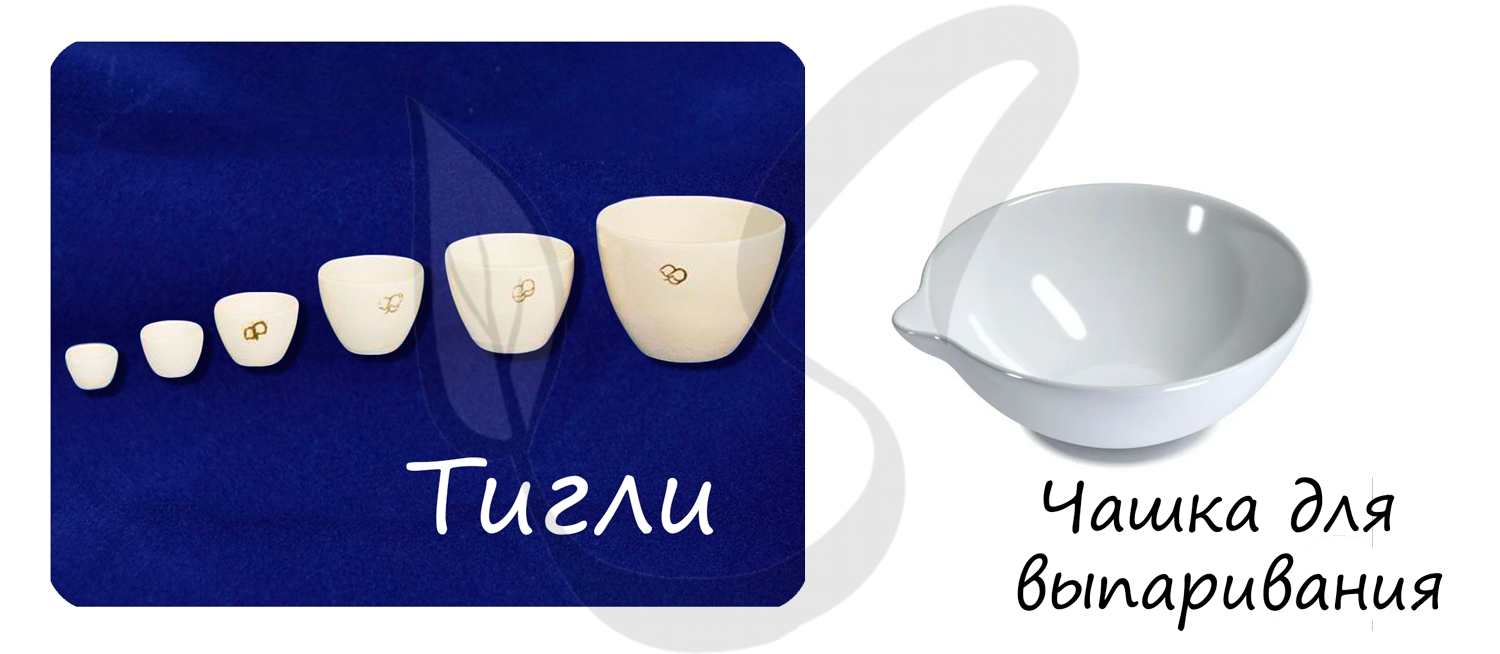
- Тигли, чашки для выпаривания
- Ступка с пестиком
- Лодочки
Круглодонная колба с отводом для вставки прямоточного холодильника. Используется для перегонки различных веществ.

Плоскодонная коническая колба, которая применяется для вакуумного фильтрования.

Применяется для фильтрования растворов при помощи фильтровальной бумаги под вакуумом.
Фильтр Шотта представляет собой стеклянную пористую пластинку. Фильтр Шотта используют в ходе вакуумного фильтрования.

Применяется для конденсирования паров и отвода образовавшегося конденсата из системы, сбор конденсата происходит в колбу-приемник.
Применяется для конденсирования паров и возврата конденсата в реакционную массу. Обычно устанавливается вертикально.
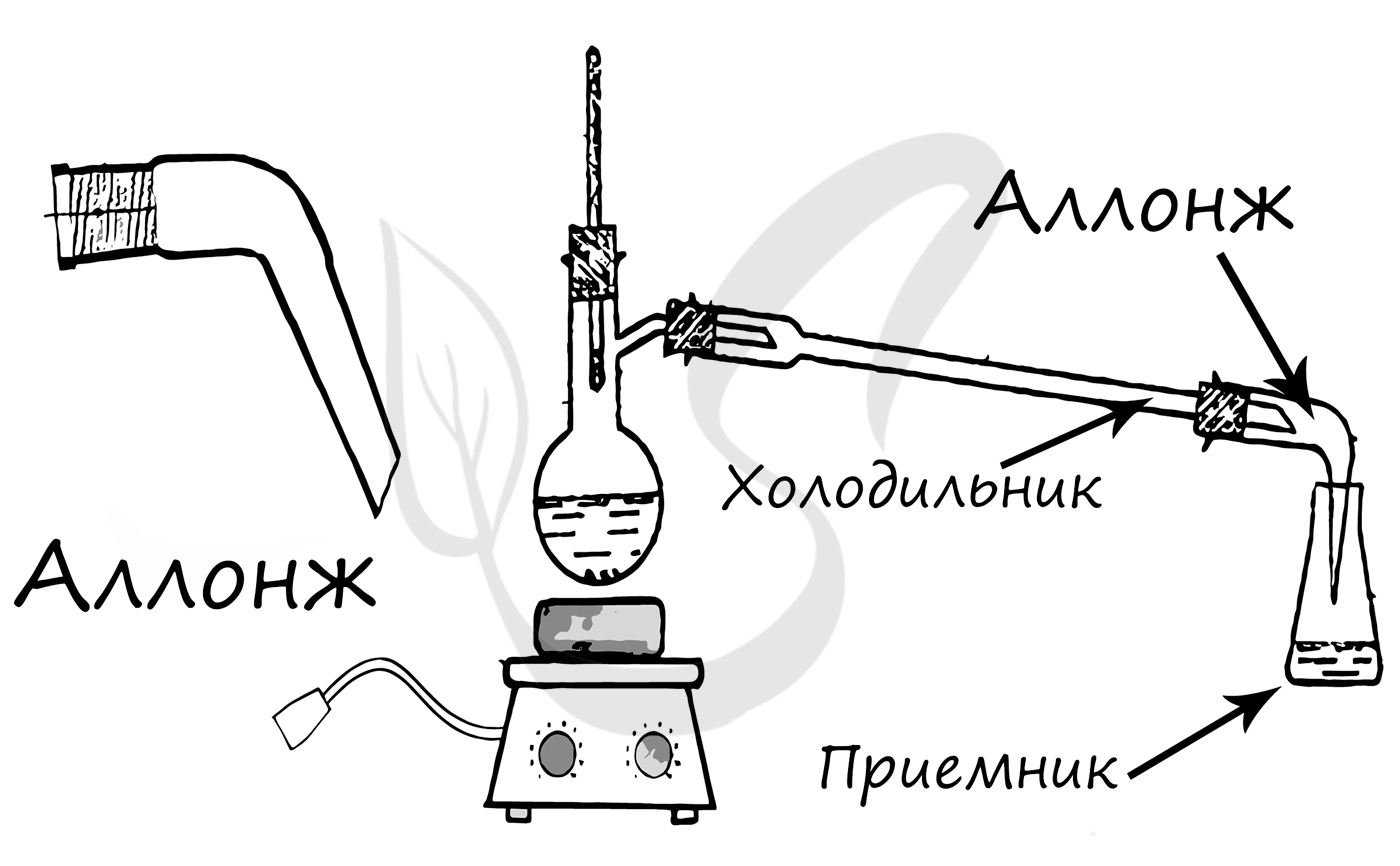
Конструктивный элемент химических приборов, чаще всего используется для соединения холодильника с приемником.
Используется в качестве приемника при перегонке. Одним из предназначений колбы Кьельдаля является
определения азота в веществах по методу Кьельдаля.

Используется для частичной или полной конденсации паров жидкостей, которые разделяют перегонкой или ректификацией (разделение, основанное
на многократной дистилляции.)
Толстостенный стеклянный сосуд, с пришлифованной крышкой, на дно которого помещают влагопоглощающее вещество, в результате чего в
эксикаторе поддерживается влажность воздуха приблизительно равная нулю. Эксикатор используется для высушивания и хранения различных веществ.

Склянка Дрекселя — сосуд, используемый для промывания и очистки газов. В результате пропускания газа через склянку Дрекселя он освобождается
от механических примесей.

Служат для очистки газов от механических примесей. Также хлоркальцевые трубки применяют для предохранения растворов от попадания в них
воды и углекислого газа: с этой целью их заполняют нужным поглотителем.

Применяется для получения газов при действии на твердые вещества растворов кислот и щелочей.
Тигель (от нем. Tiegel — горшок) — термостойкий сосуд-чаша (фарфоровый, глиняный) для нагрева, высушивания, сжигания и обжига различных материалов.
Применяют для сплавления.
Чашки для выпаривания используют для выпаривания (упаривания) растворов.
Применяется для измельчения твердых веществ.

Применяются для прокаливания веществ в печи.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Лабораторная посуда
1. Химическая бюретка применяется для
Разделения смешивающихся жидкостей
Выпаривания растворов
Измерения точного объема
Перегонки жидкостей
Химическая бюретка применяется для измерения точного объема.
2. Реторта используется для
Перегонки жидкостей
Измерения точного объема
Разделения смешивающихся жидкостей
Выпаривания растворов
Реторта используется главным образом для перегонки жидкостей.
3. С помощью делительной воронки
Упаривают растворы
Осуществляют перегонку жидкостей
Осуществляют вакуумное фильтрование
Разделяют несмешивающиеся жидкости
С помощью делительной воронки разделяют несмешивающиеся жидкости.
4. Кристаллизатор применяется для
Выпаривания растворов
Перегонки жидкостей
Вакуумного фильтрования
Дистилляции
Кристаллизатор применяется для выпаривания (упаривания) растворов.
5. Химический сифон служит для
Выпаривания растворов
Безопасного перекачивания жидкостей
Разделения смешивающихся жидкостей
Вакуумного фильтрования
Химический сифон служит для безопасного перекачивания жидкостей.
6. С помощью капельницы
Осуществляют вакуумную фильтрацию
Высушивают вещества
Дозируют растворы
Выпаривают растворы
С помощью капельницы дозируют растворы.
7. Колба Вюрца применяется для
Очистки газов от механических примесей
Дизрования растворов
Дистилляции
Вакуумной фильтрации
Колба Вюрца применяется для дистилляции: например, для разделения жидкостей с разной температурой кипения.
8. Для вакуумного фильтрования применяют
Колбу Вюрца и эксикатор
Капельницу и фильтр Шотта
Колбу Бунзена и фильтр Шотта
Воронку Бюхнера и колбу Вюрца
Для вакуумного фильтрования из всего перечисленного применяют: колбу Бунзена, фильтр Шотта и воронку Бюхнера.
9. Воронка Бюхнера служит для
Вакуумного фильтрования
Дистилляции
Сплавления веществ
Очистки газов от механических примесей
Воронка Бюхнера служит для вакуумного фильтрования.
10. Эксикатор используется для
Сплавления веществ
Высушивания и хранения различных веществ
Дистилляции
Очистки газов от механических примесей
Эксикатор используется для высушивания и хранения различных веществ.
11. Хлоркальцевые трубки применяются для
Дистилляции
Вакуумного фильтрования
Сплавления веществ
Очистки газов от механических примесей
Хлоркальцевые трубки применяются для очистки газов от механических примесей.
12. Тигли используются для
Очистки газов от механических примесей
Дистилляции
Сплавления веществ
Вакуумного фильтрования
Тигли используются для сплавления веществ, сжигания различных материалов.
Задания 34 (2021). Расчет массовой доли химического соединения в смеси и массы веществ.
Источник текстов условий задач — паблик Вконтакте И.С. Ермолаева «ЕГЭ по химии на максимум».
Авторы решений: Иванова А.М., Широкопояс С.И.
[raw shortcodes=1]
Задание №1
Смесь, содержащую оксид фосфора(V) и оксид калия, в которой соотношение числа атомов кислорода к числу атомов фосфора равно 14,5 : 4, сплавили, затем растворили в горячей воде. В результате получили 447,4 г раствора, в котором массовая доля атомов водорода составляет 7,6%. Вычислите массу фосфата калия в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
3K2O + P2O5 = 2K3PO4 (1)
Пусть в исходной смеси содержалось х моль P2O5 и y моль K2O.
Отношение количеств атомов фосфора и кислорода равно отношению количеств веществ этих атомов:
N(О)/N(P) =ν(О)/ν(P) =14,5/4
ν(O)= 5 ⋅ ν(P2O5) + ν(K2O) = 5x+y, а ν(P) = 2⋅ν(P2O5) = 2x;
Тогда будет верным такое соотношение:
(5x+y)/2x=14,5/4
Отсюда выразим одну переменную через другую:
4⋅(5x + y) = 2x ⋅14,5
20⋅x + 4⋅y = 29⋅x
9⋅x = 4y
x = 4/9⋅y
Далее, зная массовую долю водорода в полученном растворе, можем определить массу атомов водорода и добавленной воды:
m(H) = ω(Н) ∙ m(получ.р-ра)= 0,076 ∙ 447,4 = 34 г
ν(Н) = 34/1= 34 моль
ν(Н2О) = ν(Н)/2 = 34/2=17 моль
m(Н2О)=17 ∙ 18 = 306 г
Так как после растворения в воде получившейся в результате реакции (1) смеси никакие вещества не покидали сферу реакции, масса раствора стала равна сумме масс исходной смеси оксидов и добавленной воды:
m (получ. р-ра) = mисх (P2O5 и K2O) + mдоб(Н2О) = 142x +94y+306 = 447,4 г
Составим систему уравнений:
x= y∙ 4/9
142x+94y+306=447,4
Подставим выражение для х во второе уравнение:
142 y ⋅4/9 +94y+306=447,4
63,11y+94y+306=447,4
157,11y=141,4
y=0,9
x=0,9 ⋅ 4/9=0,4
Таким образом исходные количества оксидов равны х = νисх (P2O5) = 0,4 моль,
y = νисх (K2O) = 0,9 моль.
Количество вступившего в реакцию сплавления оксида фосфора(V) согласно уравнению реакции (1) в 3 раза меньше количества оксида калия:
ν1 (P2O5)= νисх (K2O)/3 = 0,9/3 = 0,3 моль, из этого видно, что оксид фосфора взят в избытке. Количество полученного в результате реакции (1) фосфата калия рассчитаем по соотношению с количеством вещества оксида калия:
ν1(K3PO4) = ν(K2O) ∙ 2/3 = 0,9∙ 2/3 = 0,6 (моль)
Оставшийся оксид фосфора будет вступать в реакцию с добавленной водой с образованием ортофосфорной кислоты:
P2O5 + 3Н2О = 2H3PO4 (2)
Найдём количества оставшегося после реакции (1) оксида фосфора, вступившего в реакцию (2), и фосфорной кислоты:
ν2(P2O5) = νисх.(P2O5) — ν1(P2O5) = 0,4 – 0,3 = 0,1 (моль).
ν(H3PO4) = 2 ∙ ν2 (P2O5) = 2 ∙ 0,1 = 0,2 (моль)
Теперь обратим внимание на то, что фосфорная кислота может взаимодействовать с фосфатом натрия двумя путями в зависимости от соотношения «соль : кислота» с образованием двух разных кислых солей:
2K3PO4 + H3PO4 = 3K2НPO4
K3PO4 + 2H3PO4 = 3KН2PO4
Установим соотношение между полученными количествами фосфата калия и кислоты в нашей задаче:
ν(H3PO4):ν1(K3PO4) = 0,2:0,6 = 1:3, то есть соли в полученном растворе в 3 раза больше, чем кислоты, поэтому реакция (3) протекает с образованием гидрофосфата калия:
2K3PO4 + H3PO4 = 3K2НPO4
Количество вещества фосфата калия, затраченного на взаимодействие с кислотой:
ν3 (K3PO4) = ν(H3PO4) ∙ 2 = 2 ∙ 0,2 = 0,4 (моль), тогда в растворе фосфата калия осталось
νост (K3PO4) = ν1 (K3PO4) — ν3 (K3PO4) = 0,6 – 0,4 = 0,2 (моль)
mост (K3PO4) = 0,2 ∙ 212 = 42,4 г
Задание №2
Смесь, содержащую оксид фосфора(V) и оксид натрия, в которой соотношение числа атомов фосфора к числу атомов натрия равно 7 : 18, нагрели, а затем растворили в горячей воде. В результате получили 312,5 г раствора, в котором массовая доля атомов водорода составляет 7,36 %. Вычислите массу фосфата натрия в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
(1) 3Na2O + P2O5 = 2Na3PO4
Пусть в исходной смеси содержалось х моль P2O5 и y моль Na2O.
Отношение количеств атомов фосфора и натрия равно отношению количеств веществ этих атомов и по условию составляет:
N(P)/N(Na) =ν(P)/ν(Na) =7/18
ν(P) = 2⋅ν(P2O5 ) = 2x, а ν(Na) = 2⋅ν(Na2O) = 2y
Тогда будет верным такое соотношение:
2x/2y = 7/18
2x ⋅ 18 = 2y ⋅ 7
x = y ⋅ 7/18
Далее, зная массовую долю водорода в полученном растворе, можем определить массу атомов водорода и добавленной воды:
m(H) = ω(Н) ∙ m(получ.р-ра) = 0,0736 ∙ 312,5 = 23 г
ν(Н) = 23 /1 = 23 моль
ν(Н2О) = ν(Н)/2 = 23 /2 = 11,5 моль
m(Н2О) = 11,5 ∙ 18 = 207 г
Так как после растворения в воде получившейся в результате реакции (1) смеси никакие вещества не покидали сферу реакции, масса раствора стала равна сумме масс исходной смеси оксидов и добавленной воды:
m (получ. р-ра) = mисх (P2O5 и Na2O) + mдоб(Н2О) = 142x + 62y + 206,64 = 312,5 (г)
Составим систему уравнений:
x = y ⋅ 7/18
142x+62y+207=312,5
Подставим выражение для х во второе уравнение:
142y ⋅ 7/18 + 62y + 207=312,5
55,22y + 62y + 207 = 312,5
117,22y = 105,5
y = 0,9
x = 0,9⋅7/18 = 0,35
Таким образом исходные количества оксидов равны х = νисх (P2O5) = 0,35 моль,
y = νисх (Na2O) = 0,9 моль.
Количество вступившего в реакцию сплавления оксида фосфора (V) согласно уравнению реакции (1) в 3 раза меньше количества оксида натрия:
ν1 (P2O5) = νисх (K2O)/3 = 0,9/3 = 0,3 моль, из этого видно, что оксид фосфора взят в избытке. Количество полученного в результате реакции (1) фосфата натрия рассчитаем по соотношению с количеством вещества оксида натрия:
ν1 (Na3PO4) = ν (Na2O) ∙ 2/3 = 0,9∙ 2/3 = 0,6 моль
Оставшийся оксид фосфора будет вступать в реакцию с добавленной водой с образованием ортофосфорной кислоты:
(2) P2O5 + 3Н2О = 2H3PO4
Найдём количества оставшегося после реакции (1) оксида фосфора, вступившего в реакцию (2), и фосфорной кислоты:
ν2 (P2O5) = νисх (P2O5) — ν1 (P2O5) = 0,35 – 0,3 = 0,05 моль
ν (H3PO4) = 2 ∙ ν2 (P2O5) = 2 ∙ 0,05 = 0,1 моль
Теперь обратим внимание на то, что фосфорная кислота может взаимодействовать с фосфатом натрия двумя путями в зависимости от соотношения «соль : кислота» с образованием двух разных кислых солей:
2Na3PO4 + H3PO4 = 3Na2НPO4
Na3PO4 + 2Na3PO4 = 3NaН2PO4
Установим соотношение между полученными количествами фосфата калия и кислоты в нашей задаче:
ν (H3PO4) : ν1 (Na3PO4) = 0,1 : 0,6 = 1:6, то есть соли в полученном растворе в 6 раз больше, поэтому реакция (3) протекает с образованием гидрофосфата калия:
(3) 2Na3PO4 + H3PO4 = 3Na2НPO4
Количество вещества фосфата натрия, затраченного на взаимодействие с кислотой:
ν3 (Na3PO4) = ν(H3PO4) ∙ 2 = 2 ∙ 0,1 = 0,2 (моль), тогда в растворе фосфата натрия осталось
νост (Na3PO4) = ν1 (Na3PO4) — ν3 (Na3PO4) = 0,6 – 0,2 = 0,4 моль
mост (Na3PO4) = 0,4 ∙ 164 = 65,6 г
Задание №3
Смесь хлорида бария и гидроксида бария растворили в воде. Полученный раствор разлили по трем колбам. К 520 г раствора в первой колбе добавили избыток раствора серной кислоты. При этом образовалось 163,1 г осадка. К 130 г раствора во второй колбе добавили 166,5 г 20%-ной соляной кислоты. В результате массовая доля кислоты в растворе уменьшилась вдвое. Вычислите массовую долю хлорида бария и гидроксида бария в растворе в третьей колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Запишем уравнения реакций, протекающих в первой и второй колбах. В первой колбе с серной кислотой реагируют и хлорид бария, и гидроксид бария. Во второй колбе только гидроксид бария вступает во взаимодействие с соляной кислотой:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl (1)
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O (2)
Ba(OH)2 + 2HCl = BaCl2 + 2H2O (3)
Начнем решение задачи с рассмотрения процессов во второй колбе. Рассчитаем количество вещества хлороводорода в исходном растворе соляной кислоты, добавленной во II колбу:
νисх (HCl) = mисх.р-ра (HCl) ∙ ω1 (HCl) / M(HCl) = 166,5 ∙ 0,2 / 36,5 = 0,912 моль
Массовая доля хлороводорода после добавления к раствору во II колбе составила
ω2 = ω1/2 = 20% / 2 = 10%, а масса полученного раствора будет складываться из массы исходного раствора добавленной кислоты и исходного раствора во II колбе:
m (получ. р-ра во II колбе) = mисх.р-ра (HCl) + mисх.р-ра (во II колбе) = 166,65 + 130 = 296,65 г
Тогда количество вещества хлороводорода, оставшегося во II колбе после реакции:
νост (HCl) = m (получ. р-ра во II колбе) ∙ ω2(HCl) / M(HCl) = 296,65 ∙ 0,1 / 36,5 = 0,813 моль
Исходя из полученных данных рассчитаем количество вещества хлороводорода, затраченного на реакцию (3):
νпрореаг (HCl) = νисх (HCl) — νост (HCl) = 0,912 – 0,813 ≈ 0,1 моль
Согласно уравнению реакции (3) количество вещества вступившего в реакцию гидроксида бария в 2 раза меньше количества вещества хлороводорода:
ν3 (Ba(OH)2) = νпрореаг (HCl) / 2 = 0,1 / 2 = 0,05 моль
Так как отношение количеств растворенных веществ к общей массе раствора одинаково для каждой колбы, найдем количество вещества гидроксида бария в первой колбе:
ν3 (Ba(OH)2) / m ( исх. р-ра во II колбе) = ν2 (Ba(OH)2) / m ( исх. р-ра во I колбе), где
ν3 (Ba(OH)2) — количество вещества гидроксида бария во II колбе
ν2 (Ba(OH)2) — количество вещества гидроксида бария в I колбе
0,05 / 130 = ν2 (Ba(OH)2) / 520
ν2 (Ba(OH)2) = 0,05 ∙ 520 / 130 = 0,2 моль
Рассчитаем количество вещества сульфата бария, выделившегося в первой колбе:
νобщ (BaSO4) = 163,1 / 233 = 0,7 моль
По уравнению реакции (2) количества веществ гидроксида бария и сульфата бария равны: ν2 (BaSO4) = ν2 (Ba(OH)2) = 0,2 моль, тогда в реакции (1) выделилось
ν1 (BaSO4) = 0,7 – 0,2 = 0,5 моль. Отсюда найдем количество хлорида бария в I колбе:
ν1 (BaCl2) = ν1 (BaSO4) = 0,5 моль
m1 (BaCl2) = 0,5 ∙ 208 = 104 г
m1 (Ba(OH)2) = 0,2 ∙ 171 = 34,2 г
Зная, что массовая доля хлорида бария и гидроксида бария одинакова во всех исходных растворах, разлитых по трем колбам, вычислим массовые доли этих веществ в первой колбе, что и будем верным ответом для третьей колбы:
ωIII (Ba(OH)2) = ωI (Ba(OH)2) = 34,2 / 520 ∙ 100% = 6,58%
ωIII (BaCl2) = ωI (BaCl2) = 104 / 520 ∙ 100% = 20%
Задание №4
Смесь хлорида бария и хлорида алюминия растворили в воде. Полученный раствор разлили по трем колбам. К 300 г раствора в первой колбе добавили 164 г 10%-ного раствора фосфата натрия. При этом все исходные вещества прореагировали полностью. К 120 г раствора во второй колбе добавили 155,61 г 20%-ого раствора сульфата натрия. При этом массовая доля сульфата натрия в полученном растворе оказалась вдвое меньше, чем в исходном. Вычислите массовую долю каждой из солей в третьей колбе. Процессами гидролиза пренебречь.
Решение
Запишем уравнения реакций, протекающих в первой и второй колбах. В первой колбе с фосфатом натрия реагируют и хлорид бария, и хлорид алюминия. Во второй колбе только хлорид бария вступает во взаимодействие с сульфатом натрия:
AlCl3 + Na3PO4 = AlPO4↓ + 3NaCl (1)
3BaCl2 + 2Na3PO4 = Ba3(PO4)2↓ + 6NaCl (2)
BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl (3)
Начнем решение задачи с рассмотрения процессов во второй колбе. Рассчитаем количество вещества сульфата натрия в исходном растворе, добавленном во II колбу:
mисх(Na2SO4) = mисх.р—ра (Na2SO4) ∙ ω1 (Na2SO4)= 155,61 ∙ 0,2 = 31,122 г
Массовая доля Na2SO4 сульфата натрия после добавления к раствору во II колбе составила
ω2 (Na2SO4) = ω1/2 = 20% / 2 = 10%
Пусть в (3) реакцию вступило х моль Na2SO4, тогда образовалось х моль сульфата бария.
Масса полученного раствора будет складываться из массы исходного раствора сульфата натрия, исходного раствора солей во II колбе, учитывая массу выпавшего осадка:
m (получ. р-ра во II колбе) = mисх.р-ра (Na2SO4) + mисх.р-ра (во II колбе) – m (BaSO4)= 155,61+ 120 – 233х = 275,61 – 233х г
Тогда массовая доля сульфата натрия в полученном растворе после протекания (3) реакции:
(31,122 – 142х) / (275,61 – 233х) = 0,1
31,122 – 142х = (275,61 – 233х) ∙ 0,1
31,122 – 142х = 27,561 – 23,3х
118,7х = 3,561
х = 0,03
ν3 (Na2SO4) = ν3 (BaCl2) = х = 0,03 моль
Так как отношение количеств растворенных веществ к общей массе раствора одинаково для каждой колбы, найдем количество вещества хлорида бария в первой колбе:
ν3 (BaCl2) / m ( исх. р-ра во II колбе) = ν2 (BaCl2) / m ( исх. р-ра во I колбе), где
ν3 (BaCl2) — количество вещества хлорида бария во II колбе
ν2 (BaCl2) — количество вещества хлорида бария в I колбе
0,03 / 120 = ν2 (BaCl2) / 300
ν2 (BaCl2) = 0,03 ∙ 300 / 120 = 0,075 моль
Рассчитаем количество вещества фосфата натрия, прореагировавшего с хлоридом бария в первой колбе:
ν2 (Na3PO4) = ν2 (BaCl2) ∙ 2 / 3 = 0,075 ∙ 2 / 3 = 0,05 моль
Общее количество фосфата натрия, добавленного в I колбу составит:
νобщ (Na3PO4) = 164 ∙ 0,1 / 164 = 0,1 моль
Тогда рассчитаем количество фосфата, прореагировавшего с хлоридом алюминия:
ν1 (Na3PO4) = νобщ (Na3PO4) — ν2 (Na3PO4) = 0,1 – 0,05 = 0,05 моль
Отсюда по уравнению (1) найдем количество хлорида алюминия в первой колбе:
ν1 (AlCl3) = ν1 (Na3PO4) = 0,05 моль
m1 (AlCl3) = 0,05 ∙ 133,5 = 6,675 г
m1 (BaCl2) = 0,075 ∙ 208 = 15,6 г
Зная, что массовая доля хлорида бария и хлорида алюминия одинакова во всех исходных растворах, разлитых по трем колбам, вычислим массовые доли этих веществ в первой колбе, что и будем верным ответом для третьей колбы:
ωIII (AlCl3) = ωI (AlCl3) = 6,675 / 300 ∙ 100% = 2,225%
ωIII (BaCl2) = ωI (BaCl2) = 15,6 / 300 ∙ 100% = 5,2%
Задание №5
Смесь хлорида магния и нитрата алюминия растворили в воде. Полученный раствор разлили по трем колбам. К 750 г раствора в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 114,8 г осадка. К 300 г раствора во второй колбе добавили 868,54 г 20%-ого раствора гидроксида натрия. При этом массовая доля щелочи в растворе уменьшилась в 1,6 раза. Вычислите массовую долю каждой из солей в третьей колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Начнем решение задачи с рассмотрения процессов в первой колбе. С нитратом серебра взаимодействует только хлорид магния:
2AgNO3 + MgCl2 = 2AgCl↓ + Mg(NO3)2 (1)
Вычислим массу выпавшего осадка:
ν1 (AgCl) = 114,8 / 143,5 = 0,8 моль
ν1 (MgCl2) = ν1 (AgCl) / 2 = 0,8 / 2 = 0,4 моль
m1 (MgCl2) = 0,4 ∙ 95 = 38 г
Рассчитаем массовую долю хлорида магния, которая в каждой колбе одинакова:
ωIII (MgCl2) = ωI (MgCl2) = 38 / 750 ∙ 100% = 5,07%
Реакции, протекающие после добавления гидроксида натрия во вторую колбу:
MgCl2 + 2NaOH = Mg(OH)2 +2NaCl (2)
Al(NO3)3 + 4NaOH = Na[Al(OH)4] + 3NaNO3 (3)
Далее рассчитаем количество хлорида магния во второй колбе, учитывая, что отношение количества растворенного вещества к массе раствора везде одинаково:
ν1 (MgCl2) / mI (исх. раствора солей) = ν2 (MgCl2) / mII (исх. раствора солей)
ν2 (MgCl2) = ν1 (MgCl2) ∙ mII (исх. раствора солей) / mI (исх. раствора солей) = 0,4 ∙ 300 / 750 = 0,16 моль.
Найдем общее количество вещества гидроксида натрия, добавленного во вторую колбу:
νобщ (NaOH) = 0,2 ∙ 868,54 / 40 = 4,34 моль
Известно, что после взаимодействия гидроксида натрия с растворенными солями его массовая доля уменьшилась в 1,6 раз, то есть составила
ω2 (NaOH) = ω1/1,6 = 20% / 1,6 = 12,5%
Для вычисления массы полученного после реакций (2) и (3) раствора нам потребуется найти массу выпавшего в осадок гидроксида магния:
ν (Mg(OH)2) = ν2 (MgCl2) = 0,16 моль
m (Mg(OH)2) = 0,16 ∙ 54 = 8,64 г
mII (полученного раствора после 2 и 3 реакции) = mII (исх. раствора солей) + mисх (р-ра NaOH) — m (Mg(OH)2) = 300 + 868,54 – 8,64 = 1160 г
Пусть в реакцию (3) вступило х моль нитрата алюминия, тогда количество прореагировавшего с ним гидроксида натрия составит 4х моль.
Массовая доля оставшегося гидроксида натрия в полученном после реакций (2) и (3) раствора:
(4,02 – 4х) ∙ 40 / 1160 = 0,125
1160 ∙ 0,125 = (4,02 – 4х) ∙ 40
145 = 160,8 – 160х
160х = 15,8
х = 0,1
ν2 (Al(NO3)3) = х = 0,1 моль
m2 (Al(NO3)3) = 0,1 ∙ 213 = 21,3 г
Учитывая, что массовая доля солей одинакова во всех колбах, рассчитаем массовую долю нитрата алюминия:
ωIII (Al(NO3)3) = ωII (Al(NO3)3) = 21,3 / 300 ∙ 100% = 7,1%
[adsp-pro-3]
Задание №6
Смесь сульфата железа (II) и хлорида цинка растворили в воде. Полученный раствор разлили по трем колбам. К 800 г раствора в первой колбе добавили избыток раствора нитрата бария. При этом образовалось 116,5 г осадка. К 320 г раствора во второй колбе добавили 462 г 40%-ого раствора гидроксида натрия без доступа воздуха. При этом массовая доля щелочи в растворе уменьшилась в 2 раза. Вычислите массовую долю каждой из солей в растворе в третьей колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
В первой колбе с нитратом бария взаимодействует только сульфат железа.:
FeSO4 + Ba(NO3)2 = Fe(NO3)2 + BaSO4↓ (1)
При этом выпадает ν1 (BaSO4) = 116,5 / 233 = 0,5 моль, тогда по уравнению реакции (1) ν1 (FeSO4) = ν1 (BaSO4) = 0,5 моль
m1 (FeSO4) = 152 ∙ 0,5 = 76 г
Так как массовая доля растворенных солей одинакова во всех трех колбах, найдем массовую долю сульфата железа в первой колбе:
ωIII (FeSO4) = ωI (FeSO4) = 76 / 800 ∙ 100% = 9,5%
Рассмотрим процессы, протекающие во второй колбе. С гидроксидом натрия реагируют обе исходные соли, при этом выпадают гидроксид железа, массу которого нам потребуется вычесть для нахождения массы полученного раствора после протекания реакций (2) и (3):
2NaOH + FeSO4 = Fe(OH)2↓ + Na2SO4 (2)
4NaOH + ZnCl2 = Na2[Zn(OH)4] + 2NaCl (3)
Исходя из того, что отношение количества растворенного вещества к общей массе раствора одинаково в каждой колбе, найдем количество вещества сульфата железа во второй колбе:
ν1 (FeSO4) / m (исх. р-ра в I колбе) = ν2 (FeSO4) / m (исх. р-ра во II колбе)
ν2 (FeSO4) = ν1 (FeSO4) ∙ m (исх. р-ра во II колбе) / m (исх. р-ра в I колбе)
ν2 (FeSO4) = 0,5 ∙ 320 / 800 = 0,2 моль, тогда согласно уравнению (2):
ν2 (NaOH) = 2 ∙ ν2 (FeSO4) = 2 ∙ 0,2= 0,4 моль
Количество вещества гидроксида натрия в исходном растворе:
νисх (NaOH) = 462 ∙ 0,4 / 40 = 4,62 моль
Массовая доля щелочи в полученном растворе составит:
ωост (NaOH) = ωисх/2 = 40% / 2 = 20%
Количество прореагировавшего в (3) реакции хлорида цинка примем за х моль, что позволит выразить массу оставшейся в растворе щелочи:
mост (NaOH) = 40 ∙ (4,62 – 4х – 0,4) = 168,8 – 160х г
m (получ. р-ра после реакций (2) и (3)) = m (исх. р-ра солей во II колбе) + m (исх. р-ра NaOH) – m (Fe(OH)2) = 320 + 462 – 90 ∙ 0,2 = 764 г
Приравняем отношение массы оставшегося гидроксида натрия к массе полученного раствора к найденной массовой доле:
(168,8 – 160х) / 764 = 0,2
168,8 – 160х = 0,2 ∙ 764
168,8 – 160х = 152,8
160х = 16
х = 0,1
ν3 (ZnCl2) = 0,1 моль
m3 (ZnCl2) = 0,1 ∙ 136 = 13,6 г
ωIII (ZnCl2) = ωII (ZnCl2) = 13,6 / 320 ∙ 100% = 4,25%
Задание №7
Смесь бромида калия и иодида калия растворили в воде. Полученный раствор разлили по трем колбам. К 250 г раствора в первой колбе добавили 430 г 40%-ого раствора нитрата серебра. После завершения реакции массовая доля нитрата серебра в образовавшемся растворе составила 8,44%. К 300 г раствора во второй колбе добавили избыток раствора нитрата меди (II), в результате чего в осадок выпало 28,65 г соли. Вычислите массовую долю каждой из солей в третьей колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
В первой колбе обе соли взаимодействуют с нитратом серебра, при этом выпадают в осадок галогениды серебра, массу которых нужно вычесть при нахождении массы полученного раствора после протекания реакций (1) и (2).
Во второй колбе только йодид калия способен окислиться нитратом меди (II), поэтому начнем решение задачи с рассмотрения второй колбы.
KBr + AgNO3 = AgBr↓ + KNO3 (1)
KI + AgNO3 = AgI↓ + KNO3 (2)
2Cu(NO3)2 + 4KI = 2CuI↓ + I2 + 4KNO3 (3)
Найдем количество выпавшего йодида меди (I):
ν3 (CuI) = 28,65 / 191 = 0,15 моль
Согласно уравнению реакции (3) количество йодида калия во второй колбе в 2 раза больше количества выпавшего йодида меди:
ν3 (KI) = 2 ∙ ν3 (CuI) = 2 ∙ 0,15 моль = 0,3 моль
m3 (KI) = 0,3 ∙ 166 = 49,8 г
Так как массовая доля растворенных солей одинакова во всех трех колбах, найдем массовую долю сульфата железа в первой колбе:
ωIII (KI) = ωII (KI) = 49,8 / 300 ∙ 100% = 16,6%
Исходя из того, что отношение количества растворенного вещества к общей массе раствора одинаково в каждой колбе, найдем количество вещества йодида калия в первой колбе:
ν2 (KI) / m (исх. р-ра в I колбе) = ν3 (KI) / m (исх. р-ра во II колбе)
ν2 (KI) = ν3 (KI) ∙ m (исх. р-ра во I колбе) / m (исх. р-ра во II колбе)
ν2 (KI) = 0,3 ∙ 250 / 300 = 0,25 моль, тогда согласно уравнению (2) количество вступившего в реакцию (2) нитрата серебра:
ν2 (AgNO3) = ν2 (KI) = 0,25 моль
Вычислим общее количество вещества добавленного в первую колбу нитрата серебра:
mисх (AgNO3) = 430 ∙ 0,4 = 172 г
Пусть количество вещества нитрата серебра, вступившего в реакцию (1) х моль, тогда масса оставшегося нитрата серебра составит:
mост (AgNO3) = 172 — 170 ∙ (0,25 + х) = 172 – 42,5 – 170х = 129,5 – 170х г, а масса полученного раствора в первой колбе:
m (получ.р-ра в I колбе по реакций (1) и (2)) = 250 + 430 – 235 ∙ 0,25 – 188х =
=621,25 – 188х г
Составим выражение для нахождения массовой доли нитрата серебра в полученном растворе и найдем х:
(129,5 – 170х) / (621,25 – 188х) = 0,0844
129,5 – 170х = (621,25 – 188х) ∙ 0,0844
129,5 – 170х = 52,43 – 15,87х
154,13х = 77,07
х = 0,5
ν1 (AgNO3) = ν1 (KBr) = 0,5 моль
m1 (KBr) = 0,5 ∙ 119 = 59,5 г
ωIII (KBr) = ωII (KBr) = 59,5/ 250 ∙ 100% = 23,8%
Задание №8
Смесь бромида кальция и хлорида меди (II) растворили в воде. Полученный раствор разлили по трем колбам. К 200 г раствора в первой колбе добавили 785 г 30%-ого раствора нитрата серебра. При этом массовая доля нитрата серебра в растворе уменьшилась вдвое. К 340 г раствора во второй колбе добавили избыток раствора иодида калия, в результате чего в осадок выпало 64,94 г соли. Вычислите массовую долю каждой из солей в третьей колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
В первой колбе с нитратом серебра взаимодействуют обе растворенные соли, при этом в осадок выпадают хлорид и бромид серебра:
2AgNO3 + CaBr2 = 2AgBr↓ + Ca(NO3)2 (1)
2AgNO3 + CuCl2 = 2AgCl↓ + Cu(NO3)2 (2)
Во второй колбе йодид калия окисляется хлоридом меди (II):
4KI + 2CuСl2 = 2CuI↓ + I2 + 4KCl (3)
В результате этой реакции в осадок выпадает ν3 (CuI) = 64,94 / 191 = 0,34 моль.
Согласно уравнению реакции (3) ν3 (CuCl2) = ν3 (CuI) = 0,34 моль.
Известно, что массовая доля растворенных солей одинакова во всех трех колбах, рассчитаем массовую долю хлорида меди (II) во второй колбе:
m3 (CuCl2) = 0,34 ∙ 135 = 45,9 г
ωIII (CuCl2) = ωII (CuCl2) = 45,9 / 340 ∙ 100% = 13,5%
Теперь учитывая, что отношение количества растворенного вещества к общей массе раствора одинаково в каждой колбе, найдем количество вещества хлорида меди в первой колбе:
ν2 (CuCl2) / m (исх. р-ра в I колбе) = ν3 (CuCl2) / m (исх. р-ра во II колбе)
ν2 (CuCl2) = ν3 (CuCl2) ∙ m (исх. р-ра во I колбе) / m (исх. р-ра во II колбе)
ν2 (CuCl2) = 0,34 ∙ 200 / 340 = 0,2 моль, тогда согласно уравнению (2) количество вступившего в реакцию (2) нитрата серебра и выпавшего хлорида серебра:
ν2 (AgNO3) = 2 ∙ ν2 (CuCl2) = 2 ∙ 0,2 моль = 0,4 моль = ν2 (AgCl)
Рассчитаем массу нитрата серебра в исходном растворе, добавленном в первую колбу:
mисх (AgNO3) = 785 ∙ 0,3 = 235,5 г
Пусть в реакцию (1) вступило х моль бромида кальция, тогда с ним прореагировало 2х моль нитрата серебра и в осадок выпало 2х моль бромида серебра. Тогда выразим массу полученного раствора после протекания реакций (1) и (2) и составим выражение для массовой доли оставшегося в растворе нитрата серебра:
m (получ.р-ра после р-ций (1) и(2)) = 200 + 785 – 0,4 ∙ 143,5 – 2х ∙ 188 = 927,6 – 376х г
ωост (AgNO3) = (235,5 – 170 ∙ (0,4 + 2х)) / (927,6 – 376х) = 0,3 / 2
235,5 – 170 ∙ (0,4 + 2х) = (927,6 – 376х) ∙ 0,15
167,5 – 340х = 139,14 – 56,4х
283,6х = 28,36
х = 0,1
ν1 (CaBr2) = 0,1 моль
m1 (CaBr2) = 0,1 ∙ 200 = 20 г
Учитывая, что массовая доля солей одинакова во всех колбах, рассчитаем массовую долю бромида кальция:
ωIII (CaBr2) = ωI (CaBr2) = 20 / 200 ∙ 100% = 10%
Задание №9
Через 520 г 16,1%-ого раствора сульфата цинка пропускали электрический ток до тех пор, пока объём газа, выделившегося на катоде, не оказался равным объёму газа, выделившегося на аноде. При этом получили раствор, в котором массовая доля сульфата цинка составила 10,3%. К полученному раствору добавили 212 г 10%-ого раствора карбоната натрия. Вычислите массовую долю сульфата цинка в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Рассмотрим процессы, протекающие при электролизе сульфата цинка. По условию задачи сказано, что на катоде выделяется газ. Он получается не иначе как в результате электролиза воды. Запишем уравнения реакций:
2ZnSO4 + 2H2O = 2Zn + O2↑ + 2H2SO4 (1)
2H2O = 2H2↑ + O2↑ (2)
Пусть в реакции (2) выделилось х моль кислорода, тогда водорода выделилось 2х моль. Так как сказано, что объемы газов на катоде и аноде равны, значит при н.у. равны их количества веществ:
V(H2) = V1(O2) + V2(O2)
ν (H2) = ν1 (O2) + ν2 (O2)
2х = ν1 (O2) + х
ν1 (O2) = х моль, тогда количество сульфата цинка, вступившего в реакцию электролиза составит 2х моль.
Общая масса сульфата цинка в исходном растворе составляла:
mобщ (ZnSO4) = 520 ∙ 0,161 = 83,72 г
После проведения электролиза масса раствора уменьшается за счет разложившейся воды, кислорода и цинка в реакции (1):
m (раствора после электролиза) = m (исх. р-ра ZnSO4) – mразл (H2O) – m (O2) =
= 520 – 18 ∙ 2х – 32х – 65 ∙ 2х = 520 – 198х г
Составим выражение для массовой доли оставшегося в растворе после электролиза сульфата цинка и найдем х:
(83,72 – 161 ∙ 2х) / (520 – 198х) = 0,103
83,72 – 322х = (520 – 198х) ∙ 0,103
83,72 – 322х = 53,56 – 20,4х
301,6х = 30,16
х = 0,1
Масса полученного раствора m (раствора после электролиза) = 520 – 198х = 500,2 г
Сравним количества серной кислоты и карбоната натрия:
ν (H2SO4) = 2 ∙ 0,1 = 0,2 моль
ν (Na2CO3) = 212 ∙ 0,1 / 106 = 0,2 моль
Так как их соотношение 1:1, сделаем вывод, что протекает только реакция карбоната натрия с серной кислотой:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ (3)
Для определения массовой доли сульфата цинка в конечном растворе найдем массу оставшегося сульфата цинка и массу полученного после (3) реакции раствора:
mост (ZnSO4) = 83,72 – 161 ∙ 0,2 = 51,52 г
m (получ. р-ра после (3) р-ции) = m (раствора после электролиза) + m (р-ра Na2CO3) – m (CO2) = 500,2 + 212 — 44 ∙ 0,2 = 703,4 г
ωост (ZnSO4) = 51,52 / 703,4 ∙ 100% = 7,32%
Задание №10
Через 400 г 36%-ого раствора нитрата железа (II) пропускали электрический ток до тех пор, пока объём газа, выделившийся на катоде, не оказался в 2 раза меньше объёма газа, выделившегося на аноде. При этом получили раствор, в котором массовая доля нитрата железа (II) составила 10,19%. К полученному раствору добавили 120 г 40%-ого раствора карбоната аммония. Вычислите массовую долю нитрата железа (II) в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
При электролизе водного раствора нитрата железа на катоде выделяется водород из воды
2Fe(NO3)2 + 2H2O = 2Fe + O2↑+ 4HNO3 (1)
2H2O = 2H2↑ + O2↑ (2)
По условию дано соотношение объемов газов, выделившихся на катоде и аноде:
V(H2) = V(O2) / 2, для газов при н.у. ν (H2) = (ν1 (O2) + ν2 (O2)) / 2
2 ∙ ν (H2) = ν1 (O2) + ν2 (O2)
Пусть количество вещества кислорода, выделившегося во второй реакции х моль, тогда количество водорода — 2х моль:
2 ∙ 2х = ν1 (O2) + х
ν1 (O2) = 3х моль
Масса нитрата железа (II) в исходном растворе составляла:
mобщ (Fe(NO3)2) = 400 ∙ 0,36 = 144 г
Масса, вступившего в реакцию электролиза нитрата железа:
mпрореаг. (Fe(NO3)2) 3х ∙ 2 ∙ 180 = 1080х г
Масса раствора после электролиза будет уменьшаться за счет разложившейся воды и кислорода и железа, выделяющихся в первой реакции:
m (получ.р-ра после электролиза) = 400 – 18 ∙ 2х – 32 ∙ 3х – 56 ∙ 2 ∙ 3х = 400 – 468х г
Составим выражение для массовой доли оставшегося нитрата железа в полученном после электролиза растворе:
(144 — 1080х) / (400 – 468х) = 0,1019
144 — 1080х = (400 – 468х) ∙ 0,1019
144 — 1080х = 40,76 – 47,67х
1032,33х = 103,24
х = 0,1
Количество вещества выделившейся азотной кислоты в реакции (1) составит
ν1 (HNO3) = 3х ∙ 4 = 1,2 моль
Запишем уравнение реакции азотной кислоты и карбоната аммония:
2HNO3 + (NH4)2CO3 = 2NH4NO3 + H2O + CO2↑ (3)
Найдем количество вещества карбоната аммония:
ν ((NH4)2CO3) = 120 ∙ 0,4 / 96 = 0,5 моль
Азотная кислота по сравнению с карбонатом аммония — в избытке.
При расчете массы конечного раствора учтем массу выделившегося углекислого газа:
m (СO2) = 0,5 ∙ 44 = 22 г
m (конечного р-ра) = 400 – 468 ∙ 0,1 + 120 – 22 = 451,2 г
mост (Fe(NO3)2) = 144 – 1080 ∙ 0,1 = 36 г
ωост (Fe(NO3)2) = 36 / 451,2 ∙ 100% = 7,98%
[adsp-pro-3]
Задание №11
Через 522 г 5%-ого раствора нитрата бария пропускали электрический ток до тех пор, пока на аноде не выделилось 8,4 л (н.у.) газа. К образовавшемуся раствору добавили насыщенный раствор, приготовленный при комнатной температуре растворением 96,6 г глауберовой соли (Na2SO4 ∙ 10H2O) в необходимом количестве воды. При этом массовая доля сульфата натрия в растворе уменьшилась в 4,5 раза. Вычислите растворимость безводного сульфата натрия при комнатной температуре (в г на 100 г воды).
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Электролиз водного раствора нитрата бария сводится к электролизу воды:
2H2O = 2H2↑+ O2↑ (1)
Газ, выделившийся на аноде – кислород. Найдем его количество вещества, и по уравнению реакции (1) определим количество и массу разложившейся в ходе электролиза воды:
ν (O2) = 8,4 / 22,4 = 0,375 моль
νразл (H2O) = 2 ∙ ν (O2) = 0,375 ∙ 2 = 0,75 моль
mразл (H2O) = 0,75 ∙ 18 = 13,5 г
Оставшийся в растворе нитрат бария реагирует с сульфатом натрия глауберовой соли:
Na2SO4 + Ba(NO3)2 = BaSO4↓+ 2NaNO3 (2)
Количество вещества нитрата бария в исходном растворе:
ν (Ba(NO3)2) = 522 ∙ 0,05 / 261 = 0,1 моль
Количество вещества сульфата натрия равно количеству вещества глауберовой соли:
νисх (Na2SO4) = ν (Na2SO4 ∙ 10H2O) = 96,6 / 322 = 0,3 моль
mисх (Na2SO4) = 0,3 ∙ 142 = 42,6 г
Согласно уравнению реакции (2) количество вступившего в реакцию сульфата натрия равно количеству нитрата бария и выпавшего сульфата бария:
νпрореаг (Na2SO4) = ν (Ba(NO3)2) = ν (BaSO4) = 0,1 моль
Примем за х г массу воды, добавленной к глауберовой соли для получения насыщенного раствора сульфата натрия. С этим учетом масса исходного насыщенного раствора:
mисх.(насыщ. р-ра Na2SO4) = 96,6 + х г,
а масса конечного раствора после реакции (2) составляла:
m (конечного р-ра) = 522 – 13,5 + 96,6 + х – 0,1 ∙ 233 = 581,8 + х г
Масса оставшегося сульфата натрия:
mост (Na2SO4) = 142 ∙ (0,3 – 0,1) = 28,4 г
По условию задачи массовая доля сульфата натрия уменьшается в 4,5 раза:
ω1 (Na2SO4) / ω2 (Na2SO4) = 4,5
ω1 (Na2SO4) = 42,6 / (96,6 + х)
ω2 (Na2SO4) = 28,4 / 581,8 + х
Подставим соответствующие выражения и найдем х:
42,6 / (96,6 + х) = 4,5 ∙ 28,4 / 581,8 + х
42,6 ∙ (581,8 + х) = 4,5 ∙ 28,4 ∙ (96,6 + х)
12345,48 + 127,8х = 24784,68 +42,6х
85,2х = 12439,2
х = 146
mдоб (H2O) = 146 г
Теперь найдем массовую долю сульфата натрия в насыщенном растворе при комнатной температуре:
ω1 (Na2SO4) = 42,6 / (96,6 + 146) = 0,1756
Так как массовая доля вещества в насыщенном растворе при определенной температуре не зависит от массы раствора, можем рассчитать растворимость сульфата натрия, что есть масса растворенного вещества в 100 г растворителя, в нашем случае воды.
Обозначим эту массу через y г, составим выражение для массовой доли и приравняем к уже известному значению:
y / (y+100) = 0,1756
(y+100) ∙ 0,1756 = у
0,8244у = 17,56
у = 21,3
Растворимость сульфата натрия составляет 21,3 г в 100 г воды.
Задание №12
Через 522 г 10%-ого раствора нитрата бария пропускали электрический ток до тех пор, пока на катоде не выделилось 94,08 л (н.у.) газа. К образовавшемуся раствору добавили насыщенный раствор, приготовленный при комнатной температуре растворением 100 г медного купороса (CuSO4 ∙ 5H2O) в необходимом количестве воды. При этом массовая доля сульфата меди (II) в растворе уменьшилась в 4 раза. Вычислите растворимость безводного сульфата меди (II) при комнатной температуре (в г на 100 г воды).
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Электролиз водного раствора нитрата бария сводится к электролизу воды:
2H2O = 2H2↑+ O2↑ (1)
Газ, выделившийся на катоде – водород. Найдем его количество вещества, и по уравнению реакции (1) определим количество и массу разложившейся в ходе электролиза воды:
ν (H2) = 94,08 / 22,4 = 4,2 моль
νразл (H2O) = ν (H2) = 4,2 моль
mразл (H2O) = 4,2 ∙ 18 = 75,6 г
Оставшийся в растворе нитрат бария реагирует с сульфатом меди (II):
CuSO4 + Ba(NO3)2 = BaSO4↓+ Cu(NO3)2 (2)
Количество вещества нитрата бария в исходном растворе:
ν (Ba(NO3)2) = 522 ∙ 0,1 / 261 = 0,2 моль
Количество вещества сульфата натрия равно количеству вещества глауберовой соли:
νисх (CuSO4) = ν (CuSO4 ∙ 5H2O) = 100 / 250 = 0,4 моль
mисх (CuSO4) = 0,4 ∙ 160 = 64 г
Согласно уравнению реакции (2) количество вступившего в реакцию сульфата меди (II) равно количеству нитрата бария и выпавшего сульфата бария:
νпрореаг (CuSO4) = ν (Ba(NO3)2) = ν (BaSO4) = 0,2 моль
Примем за х г массу воды, добавленной к медному купоросу для получения насыщенного раствора сульфата меди (II). С этим учетом масса исходного насыщенного раствора:
mисх.(насыщ. р-ра CuSO4) = 100 + х г,
а масса конечного раствора после реакции (2) составляла:
m (конечного р-ра) = 522 – 75,6 + 100 + х – 0,2 ∙ 233 = 499,8 + х г
Масса оставшегося сульфата натрия:
mост (Na2SO4) = 160 ∙ (0,4 – 0,2) = 28,4 г
По условию задачи массовая доля сульфата меди уменьшается в 4 раза:
ω1 (CuSO4) / ω2 (CuSO4) = 4
ω1 (CuSO4) = 64 / (100 + х)
ω2 (CuSO4) = 32 / 499,8 + х
Подставим соответствующие выражения и найдем х:
64 / (100 + х) = 4 ∙ 32 / 499,8 + х
64 ∙ (499,8 + х) = 4 ∙ 32∙ (100 + х)
31987,2 + 64х = 12800 + 128х
64х = 19187,2
х = 299,8
mдоб (H2O) = 299,8 г
Теперь найдем массовую долю сульфата натрия в насыщенном растворе при комнатной температуре:
ω1 (CuSO4) = 64 / (100 + 299,8)
Так как массовая доля вещества в насыщенном растворе при определенной температуре не зависит от массы раствора, можем рассчитать растворимость сульфата натрия, что есть масса растворенного вещества в 100 г растворителя, в нашем случае воды.
Обозначим эту массу через y г, составим выражение для массовой доли и приравняем к
ω1 (CuSO4):
y / (y+100) = 64 / (100 + 299,8)
(y+100) ∙ 64 = у ∙ 399,8
335,8у = 6400
у = 19,06
Растворимость сульфата меди (II) составляет 19,06 г в 100 г воды.
Задание №13
Кристаллогидрат сульфата алюминия, в котором массовая доля атомов серы меньше массовой доли атомов кислорода в 5 раз, растворили в воде. При этом образовался раствор массой 722,4 г. Через образовавшийся раствор пропускали электрический ток до тех пор, пока на аноде не выделилось 35,84 л (н.у.) газа. К образовавшемуся в процессе электролиза раствору добавили 424 г 10%-ого раствора карбоната натрия. При этом массовая доля карбоната натрия в растворе уменьшилась в 10 раз. Вычислите массу растворенного кристаллогидрата сульфата алюминия.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Определим формулу кристаллогидрата Al2(SO4)3 ∙ xH2O. Нам известно соотношение массовых долей серы и кислорода, оно равно соотношению массы атомов серы к массе атомов кислорода.
В 1 моль кристаллогидрата содержится 3 моль атомов серы и (12 + х) моль атомов кислорода, тогда:
m (S) = 32 ∙ 3 = 96 г
m (О) = (12 + х) ∙ 16 = 192 + 16х г
ω (S) / ω (О) = m (S) / m (О) = 96 / (192 + 16х) = 1 / 5
96 ∙ 5 = 192 + 16х
16х = 480 – 192
х = 18
Состав кристаллогидрата: Al2(SO4)3 ∙ 18H2O
Электролиз водного раствора этого кристаллогидрата сводится к электролизу воды:
2H2O = 2H2↑+ O2↑ (1)
Газ, выделившийся на аноде – кислород.
ν (O2) = 35,84 / 22,4 = 1,6 моль
νразл (H2O) = 2 ∙ ν (O2) = 1,6 ∙ 2 = 3,2 моль
mразл (H2O) = 0,75 ∙ 18 = 57,6 г
Далее добавленный карбонат натрия вступает в реакцию с сульфатом алюминия:
Al2(SO4)3 + 3Na2CO3 +3H2O = 2Al(OH)3 + 3CO2 + 3Na2SO4 (2)
mисх (Na2CO3) = 424 ∙ 0,1 = 42,4 г
Массовая доля уменьшилась в 10 раз и в конечном растворе составила 1%.
Примем за х моль количество вступившего в реакцию сульфата алюминия. Тогда согласно уравнению реакции (2) количество карбоната натрия, прореагировавшего с ним:
νпрореаг (Na2CO3) = 3х моль
Для расчета массы конечного раствора необходимо вычислить массы покинувших сферу реакции гидроксида алюминия и углекислого газа:
ν (Al(OH)3) = 2х моль
m (Al(OH)3) = 2х ∙ 78 = 156х г
ν (CO2) = 3х моль
m (CO2) = 3х ∙ 44 = 132х г
Тогда масса конечного раствора равна:
m (конечного раствора) = 722,4 – 57,6 + 424 – 156х – 132х г
Составим выражение для массовой доли оставшегося карбоната натрия в конечном растворе:
ω2 (Na2CO3) = (42,4 — 3х ∙ 106) / (1088,8 -288х)
(42,4 — 3х ∙ 106) / (1088,8 — 288х) = 0,01
42,4 – 318х = 0,01 ∙ (1088,8 — 288х)
42,4 – 318х = 10,888 – 2,88х
315,12х = 31,512
х = 0,1
ν (Al2(SO4)3) = 0,1 моль
ν (Al2(SO4)3 ∙ 18H2O) = ν (Al2(SO4)3) = 0,1 моль
m (Al2(SO4)3 ∙ 18H2O) = 0,1 ∙ 666 = 66,6 г
Задание №14
Смесь, состоящую из нитрата цинка, нитрата меди (II) и нитрата серебра, растворили в воде. При этом получили раствор, в котором массовая доля нитрата цинка составила 18,9%, а массовая доля нитрата меди (II) – 9,4%. В первую колбу налили 500 г этого раствора и внесли медную проволоку. После окончания реакции массовая доля нитрата меди (II) в колбе составила 25,5%. (Возможной реакцией избытка меди с нитратом меди (II) пренебречь.) Во вторую колбу налили 200 г исходного раствора и добавили избыток порошка цинка. Вычислите массовую долю соли в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Рассмотрим процессы, происходящие в первой колбе:
2AgNO3 + Cu = Cu(NO3)2 +2Ag (1)
Исходная масса нитрата меди (II) в первой колбе составляла:
mисх (Cu(NO3)2) в I колбе = 500 ∙ 0,094 = 47 г
νисх (Cu(NO3)2) в I колбе = 47 / 188 = 0,25 моль
Учитывая, что доля вещества в растворе не зависит от массы раствора, найдем исходное количество вещества нитрата меди (II) во второй колбе:
0,25 / 500 = νисх (Cu(NO3)2) во II колбе / 200
νисх (Cu(NO3)2) во II колбе = 0,1 моль
Пусть в реакцию (1) вступило х моль меди, тогда образовалось х моль нитрата меди (II) и 2х моль серебра.
Масса нитрата меди (II) в образовавшемся растворе после протекания реакции (1) складывается из масс исходной и образовавшейся соли:
mполуч (Cu(NO3)2) в I колбе = mисх (Cu(NO3)2) в I колбе + mобр (Cu(NO3)2) в I колбе = 47 + 188х г
Для расчета массы полученного раствора в первой колбе потребуется учесть вступившую в реакцию медь и выделившееся серебро:
mполуч (р-ра) в I колбе = 500 + 64х — 108 ∙ 2х = 500 – 152х г
Зная, что массовая доля нитрата меди (II) в полученном растворе составляла 25,5%, найдем х:
(47 + 188х) / = 0,255
47 + 188х = 0,255 ∙ (500 – 152х)
226,76х = 80,5
х = 0,355
ν (AgNO3) в I колбе = 20,355 = 0,71 моль, тогда рассчитаем количество нитрата серебра во второй колбе:
0,71 / 500 = ν (AgNO3) во II колбе /200
ν (AgNO3) во II колбе = 0,71 ∙ 200 / 500 = 0,284 моль
Во второй колбе с цинковым порошком взаимодействовали нитрат меди (II) и нитрат серебра:
Cu(NO3)2 + Zn = Cu + Zn(NO3)2 (2)
2AgNO3 + Zn = 2Ag + Zn(NO3)2 (3)
Масса нитрата цинка во второй колбе таким образом после протекания реакций составит:
mполуч (Zn(NO3)2) во II колбе = mисх (Zn(NO3)2) во II колбе + mобр в реакции (2) (Zn(NO3)2) во II колбе +
mобр в реакции (3) (Zn(NO3)2) во II колбе = 0,189 ∙ 200 + 189 ∙ (0,1 + 0,142) = 83,54 г
При расчете массы конечного раствора во второй колбе прибавим массу прореагировавшего цинка и вычтем массы серебра и меди:
mполуч (раствора) во II колбе = 200 + (0,1 +0,142) ∙ 65 – 0,1 ∙ 64 – 0,284 ∙ 108 = 178,66 г
ω (Zn(NO3)2) во II колбе = 83,54 / 178,66 ∙ 100% = 46,76%
Задание №15
Раствор нитрата меди(II) массой 2 кг 730 г с массовой долей нитрата меди(II) 18,8%, содержащий в качестве примеси нитрат серебра, разлили на две колбы в соотношении 1 : 2. В первую колбу, содержащую меньшую часть раствора, внесли медную проволоку. После окончания реакции массовая доля нитрата меди (II) в колбе составила 20%. (Возможной реакцией избытка меди с нитратом меди (II) пренебречь.) В раствор во второй колбе внесли порошок цинка, в результате получили бесцветный раствор. Вычислите массовую долю соли в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Пусть масса раствора нитрата меди (II) в первой колбе равна х г, тогда масса раствора нитрата меди (II), приходящаяся на вторую колбу – 2х г
х + 2х = 2730
х = 910
mI (р-ра Cu(NO3)2) = 910 г, mII (р-ра Cu(NO3)2) = 910 ∙ 2 =1820 г
Запишем уравнение реакции между нитратом серебра и медной проволокой, происходящей в первой колбе:
2AgNO3 + Cu = Cu(NO3)2 +2Ag (1)
Исходя из постоянства массовой доли растворенного вещества в любой отобранной порции раствора, найдем исходную массу нитрата меди (II) в первой колбе:
mисх (Cu(NO3)2) в I колбе = 0,188 ∙ 910 = 171,08 г
Примем количество вступившей в реакцию (1) меди за у моль, тогда и нитрата меди (II) образовалось у моль, серебра — 2у моль.
Рассчитывая массу получившегося раствора после протекания реакции, учтем массу вступившей в реакцию меди и выделившегося серебра:
mполуч (р-ра) в I колбе = 910 + 64у – 2у ∙ 108 = 910 – 152у
Масса нитрата меди (II) в полученном после реакции растворе в первой колбе складывается из исходной массы и массы образовавшегося нитрата меди (II):
mполуч (Cu(NO3)2) в I колбе = 171,08 + 188у г
Составим выражение для уже численно известной массовой доли нитрата меди (II) в конечном растворе в первой колбе и найдем у:
(171,08 + 188у) / (910 – 152у) = 0,2
171,08 + 188у = 0,2 ∙ (910 – 152у)
218,4у = 10,92
у = 0,05
Согласно уравнению реакции (1) нитрат серебра вступил в количестве:
ν (AgNO3) в I колбе = 2у = 0,1 моль
Тогда рассчитаем исходное количество нитрита серебра во второй колбе:
0,1 / 910 = ν (AgNO3) во II колбе / 1820
ν (AgNO3) во II колбе = 0,2 моль
νисх (Cu(NO3)2) во II колбе = (0,188 ∙ 1820) / 188 = 1,82 моль
Cu(NO3)2 + Zn = Cu + Zn(NO3)2 (2)
2AgNO3 + Zn = 2Ag + Zn(NO3)2 (3)
Масса нитрата цинка в конечном растворе во второй колбе:
mполуч (Zn(NO3)2) во II колбе = (1,82 + 0,1) ∙ 189 = 362,88 г
mполуч (р-ра) во II колбе = 1820 + 65 ∙ (0,1 + 1,82) – 1,82 ∙ 64 – 0,2 ∙ 108 = 1806, 72 г
ω (Zn(NO3)2) во II колбе = 362,88 / 1806, 72 ∙ 100% = 20%
[adsp-pro-3]
Сделали подборку из 25 полезных ресурсов для подготовки к ЕГЭ по химии. Среди них: базовые сайты, youtube-лекции, учебники и приложения. Все ресурсы бесплатные, без регистрации и смс.
Друзья, на связи «Сотка».
Онлайн–школа, которая подготовила к ЕГЭ более 63000 учеников👇
Ниже вы увидите список из 25 ссылок с ресурсами.
Нажмите на ссылку, чтобы узнать подробнее о ресурсе.
Нажмите кнопку «назад» в браузере, чтобы вернутся к списку.
Сайты:
- ФИПИ
- Рособрнадзор
- Калькулятор балов
- Решу ЕГЭ
- Яндекс.ЕГЭ
- Наука для тебя
- Edumedia-sciences
- Сайт учителя Кардаевой Т. А.
- Сhemege
- ХИМИК
- 4EGE
- Учебник по органической химии
- Экзамен по химии
- Сайт учителя Ким Н. В.
- Российский учебник
- Studarium
- Compundchem
- Examer
- Сайт учителя Натеткиной С. А.
Видеолекции:
- Stepenin
- Examtop100
- Химия — просто
- Ptichka_ximichka
- Thoisoi
Приложения:
- «Химия»
🗿Бонус:
- Советы для успешной подготовки к ЕГЭ по химии
- Ресурсы для подготовки по другим предметам
Подготовка к ЕГЭ по химии: базовые сервисы
Прежде чем приступим к рассмотрению основных ресурсов для подготовки к ЕГЭ по химии — остановимся на базовых сайтах. Базовыми они называются потому, что будут актуальны для любого ученика, который сдает ЕГЭ. Вне зависимости от выбранного предмета.
- ФИПИ — сайт организации, которая каждый год создает и актуализирует КИМы для ЕГЭ по всем предметам. На этом ресурсе вы найдете информацию об изменениях и нововведениях на экзамене.
- Рособрнадзор — федеральная служба следит, чтобы экзамен проходил в соответствии с правилами и нормами, которые они же и устанавливают. На ресурсе вы найдете актуальное расписание экзаменов, свежие КИМы и другую важную документацию.
- Калькулятор баллов — название сайта говорит само за себя. Когда узнаете свои баллы по химии — введите их на сайте и ознакомьтесь с перечнем ВУЗов, которые уже жду вас.
Подготовка к ЕГЭ по химии: сайты
- Решу ЕГЭ — здесь вам будут доступны тренировочные задания разного уровня сложности. После завершения тестирования — сайт автоматически покажет правильные ответы и выставит оценку.
- Яндекс.ЕГЭ — тренировочные тестовые задания по химии от разных авторов. По функционалу сайт похож на «Решу ЕГЭ». Отличие лишь в дизайне. Здесь вы также сможете прорешать онлайн тесты, понять сколько баллов вы набираете и какие ошибки допускаете.
- Наука для тебя — образовательный портал по химии. На ресурсе много теоретической информации, справочного материала, а также ответы на распространенные вопросы по разным темам. Если потребуются расчеты с участием кристаллогидратов — вам на этот сайт.
- Edumedia-sciences — ресурс примечателен тем, что объяснения задач происходит схематически, с помощью анимации. Это называется — мультимедийная энциклопедия. Подача материала таким способом на 100% эффективнее обычных лекций. Попробуйте сами.
- Сайт учителя по химии Кардаевой Т. А. — на сайте много теоретического материала по органической и неорганической химии. Здесь вы найдете теоретические основы по химии и методы ее познания.
- Сhemege — сайт репетитора по химии Степанова В. Н. Помимо теоретической информации и тестовых заданий на сайте вы сможете прорешать олимпиадные задания по химии.
- ХИМИК — популярный ресурс для тех, кто готовится к сдаче экзамена по химии. Вы можете воспользоваться онлайн-учебниками по органической, и неорганической химии. Онлайн вычисления малярных масс, игра «Таблица Менделеева» — все это на xumuk.ru.
- 4ЕГЭ — на ресурсе можно найти свежие КИМы, прорешать тесты онлайн, найти шпаргалку или презентацию по нужной теме. Листайте ленту, выбирайте нужный раздел и изучайте.
- Органическая химия — интерактивный сайт-учебник. Выбираете нужную тему для изучения — получаете теоретическое объяснение вопроса с элементами анимации, видео или аудио. Очень просто и визуально наглядно.
- Экзамен по химии — на этом ресурсе вы найдете задания с решениями. Выбираете тему из каталога и изучайте задание. Оно снабжено пояснениями в максимально возможном объеме. Это обеспечивает методическую поддержку при самостоятельной подготовке к ЕГЭ по химии.
- Сайт учителя химии Ким Н. В. — тот случайно, когда не стоит судить по дизайну. На авторском сайте Натальи Викторовны вы найдете накопленный ею материал, тесты, картинки, анимации и документацию для успешной подготовки к ЕГЭ по химии.
- Корпорация Российский учебник — ресурс с наглядным раздаточным материалом. Здесь вы сможете найти и сохранить на свой смартфон плакаты по химии. Визуализация материала очень важна в обучении:)
- Studarium — простой и визуально приятный сайт для подготовки к ЕГЭ по химии. На ресурсе вы найдете теоретическую информацию по органической, общей и неорганической химии. Материал доносится с помощью полезных и структурированных конспектов с разбивкой на темы.
- Compundchem — ресурс для тех, кто немного понимает английский. Здесь вы найдете большое количество инфорграфики. С помощью визуализации авторы ресурса отвечают на необычные вопросы, связанные с химией.
- Examer — здесь вы найдете теорию с разбивкой на темы для качественной подготовки к ЕГЭ по химии.
- Сайт учителя Натеткиной С. А. — в разделе «ЕГЭ» есть множество постов с тематическим материалом для подготовки к экзамену. Таблица качественных реакций органических веществ, важнейшие реакции железа, шпаргалки, множество инфографики и таблиц — все это на ресурсе «Химикус».
Подготовка к ЕГЭ по химии: видеолекции
- Stepenin— на канале вас ждут понятные объяснения основных принципов органической химии, качественная картинка и простое донесение информации.
- Examtop100 — автор канала — это преподаватель по химии Ермолаев И.С. Здесь вы найдете заданий за прошлые года и пробные варианты для успешной подготовки к ЕГЭ по химии. Для удобства видео собраны в тематические плейлисты.
- Химия — просто — канал с познавательными видео химических опытов и объяснениями к ним. Здесь вы найдёте много интересного, весёлого и полезного. Если вы хотите не скучно провести время и подготовится к ЕГЭ по химии — вам на этот канал.
- Ptichka_ximichka — на канале достаточно полезного материала, чтобы подготовить ученика к ЕГЭ по химии с нуля. Здесь вы найдете разборы демоверсий, основные понятия, законы и формулы.
- Thoisoi — на канале можно найти опыты по органической или неорганической химии. Для каждого опыта есть объяснения, которые будут понятны даже далеким от химии людям. Качественный и крутой контент.
Подготовка к ЕГЭ по химии: приложения
- «Химия» (Android, iOS) — с помощью этого приложения вы сможете находить химические уравнения с одним или несколькими неизвестными. Калькулятор расчета молярных масс, таблица Менделеева и таблица растворимости теперь всегда в вашем смартфоне.
Советы для успешной подготовки к ЕГЭ по химии:
Теперь когда вы знаете так много полезных сервисов для подготовки к ЕГЭ по химии, может возникнуть вопрос:
— «в каком порядке начать изучение материала? С какого ресурса начать?
Простые, но действенные советы от онлайн-школы «Сотка»👇
- Решите несколько демо-вариантов тестов, чтобы понять свой уровень подготовки и темы, которые вызывают непонимание.
- Из предложенной подборки выберите ресурсы, где есть теоретическая или практическая информация по проблемным темам.
- Целенаправленно тренируйтесь по проблемным темам, прорешивая онлайн-тесты на «Решу ЕГЭ« или »Яндекс ЕГЭ».
- У вас должен быть человек, которому вы сможете задавать вопросы. И это не обязательно должен быть репетитор. Это может быть, как школьный учитель, так и знакомый из университета, изучающий химию.
- Создайте график подготовки. Он нужен, чтобы вы понимали время и дни, когда вы будете заняты подготовкой к ЕГЭ по химии.
- Вам стоит наладить режим и не забывать отдыхать. Важно давать организму отдых и время, чтобы усвоить информацию.
Мы уверены, что вы сдадите экзамены на максимальный балл и поступите в ВУЗ своей мечты!)
💙 С заботой, ваша «Сотка».
Ресурсы для подготовки по другим предметам
Курсы ЕГЭ: 33 бесплатных сайта
Статья содержит информацию о курсах ЕГЭ по различным предметам, включая: литературу, математику, химию, русский язык, обществознание, информатику, физику, английский язык и биологию. Все курсы ЕГЭ являются бесплатными. Материал регулярно обновляется — сохраняйте в закладки.
Курсы ЕГЭ | youtube.com/c/devinf74
ЕГЭ 2023: расписание, изменения, бесплатные лекции
В статье вы найдете всю необходимую информацию по теме ЕГЭ 2023: расписание, баллы, изменения, а также бесплатные ресурсы для подготовки по любому предмету. Статья регулярно обновляется, поэтому смело добавляйте ее в Закладки.
Подготовка к ЕГЭ: 139 бесплатных сайтов
В статье вы найдете 139 бесплатных ресурсов для подготовки к ЕГЭ по следующим предметам: математика, русский язык, обществознание, информатика, физика, английский язык, литература, химия, биология. Статья регулярно обновляется — добавляйте в закладки.
🗣Уверены, что это далеко не полный список полезных сайтов для подготовки к ЕГЭ по химии, поэтому будет рады, если вы поделитесь своими рекомендациями в комментариях👇
