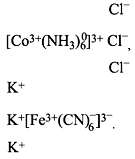Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
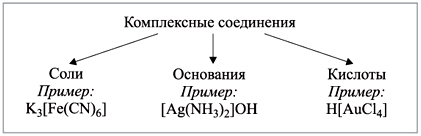
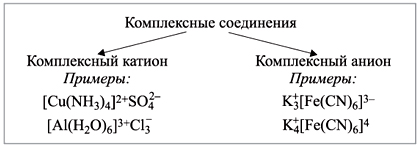
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
3 ноября 2021
В закладки
Обсудить
Жалоба
Комплексные (координационные) соединения
Презентация предназначена для изучения материала по теме «Комплексные соединения» на углубленном уровне в 11 классе.
Комплексные соединения (КС) – это вещества, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе.
kompleks-s.pptx
kompleks-s.pdf
Автор: Плис Татьяна Фёдоровна.
Комплексные соединения
Занятие, представленное на конкурс «Я иду на
урок», я провожу в 11-м биолого-химическом классе,
где на изучение химии отводится 4 часа в неделю.
Тему «Комплексные соединения» я взяла,
во-первых, потому что эта группа веществ имеет
исключительно большое значение в природе;
во-вторых, многие задания ЕГЭ включают понятие о
комплексных соединениях; в-третьих, учащиеся из
этого класса выбирают профессии, связанные с
химией, и будут встречаться с группой
комплексных соединений в будущем.
Цель. Сформировать понятие о составе,
классификации, строении и основах номенклатуры
комплексных соединений; рассмотреть их
химические свойства и показать значение;
расширить представления учащихся о многообразии
веществ.
Оборудование. Образцы комплексных
соединений.
План урока
I. Организационный момент.
II. Изучение нового материала (лекция).
III. Подведение итогов и постановка домашнего
задания.
План лекции
1. Многообразие веществ.
2. Координационная теория А.Вернера.
3. Строение комплексных соединений.
4. Классификация комплексных соединений.
5. Природа химической связи в комплексных
соединениях.
6. Номенклатура комплексных соединений.
7. Химические свойства комплексных соединений.
8. Значение комплексных соединений.
ХОД УРОКА
I. Организационный момент
II. Изучение нового материала
Многообразие веществ
Мир веществ многообразен, и мы уже знакомы с
группой веществ, которые принадлежат к
комплексным соединениям. Данными веществами
стали заниматься с XIX в., но понять их строение с
позиций существовавших представлений о
валентности было трудно.
Координационная теория А.Вернера
В 1893 г. швейцарским химиком-неоргаником
Альфредом Вернером (1866–1919) была сформулирована
теория, позволившая понять строение и некоторые
свойства комплексных соединений и названная координационной
теорией*. Поэтому
комплексные соединения часто называют
координационными соединениями.
Соединения, в состав которых входят сложные
ионы, существующие как в кристалле, так и в
растворе, называются комплексными, или
координационными.
Строение комплексных соединений
Согласно теории Вернера центральное положение
в комплексных соединениях занимает, как правило,
ион металла, который называют центральным ионом,
или комплексообразователем.
Комплексообразователь – частица (атом,
ион или молекула), координирующая (располагающая)
вокруг себя другие ионы или молекулы.
Комплексообразователь обычно имеет
положительный заряд, является d-элементом,
проявляет амфотерные свойства, имеет
координационное число 4 или 6. Вокруг
комплексообразователя располагаются
(координируются) молекулы или кислотные
остатки – лиганды (адденды).
Лиганды – частицы (молекулы и ионы),
координируемые комплексообразователем и
имеющие с ним непосредственно химические связи
(например, ионы: Cl–, I–, NO3–,
OH–; нейтральные молекулы: NH3, H2O,
CO).
Лиганды не связаны друг с другом, так как между
ними действуют силы отталкивания. Когда
лигандами являются молекулы, между ними возможно
молекулярное взаимодействие. Координация
лигандов около комплексообразователя является
характерной чертой комплексных соединений (рис.
1).
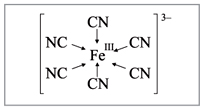 |
Рис. 1. Координация цианид-ионов
|
Координационное число – это
число химических связей, которые
комплексообразователь образует с лигандами.
![Рис. 2. Тетраэдрическая структура иона [AlBr4]–](https://him.1sept.ru/2009/08/28-3.jpg) |
Рис. 2. Тетраэдрическая структура иона
|
Значение координационного числа
комплексообразователя зависит от его природы,
степени окисления, природы лигандов и условий
(температура, концентрация), при которых
протекает реакция комплексообразования.
Координационное число может иметь значения от 2
до 12. Наиболее распространенными являются
координационные числа 4 и 6. Для координационного
числа 4 структура комплексных частиц может быть
тетраэдрической [AlBr4]– (рис. 2) и в виде
плоского квадрата [Pt(NH3)2Cl2] (рис.
3). Комплексные соединения с координационным
числом 6 имеют октаэдрическое строение [AlF6]3–
(рис. 4).
![Рис. 3. Соединение [Pt(NH3)2Cl2] со структурой плоского квадрата](https://him.1sept.ru/2009/08/28-2.jpg) |
Рис. 3. Соединение [Pt(NH3)2Cl2]
|
![Рис. 4. Ион [AlF6]3– октаэдрического строения](https://him.1sept.ru/2009/08/28-4.jpg) |
Рис. 4. Ион [AlF6]3–
|
Комплексообразователь и окружающие
его лиганды составляют внутреннюю сферу
комплекса. Частица, состоящая из
комплексообразователя и окружающих лигандов,
называется комплексным ионом. При изображении
комплексных соединений внутреннюю сферу
(комплексный ион) ограничивают квадратными
скобками. Остальные составляющие комплексного
соединения расположены во внешней сфере (рис.
5).
Суммарный заряд ионов внешней сферы должен
быть равен по значению и противоположен по знаку
заряду комплексного иона:
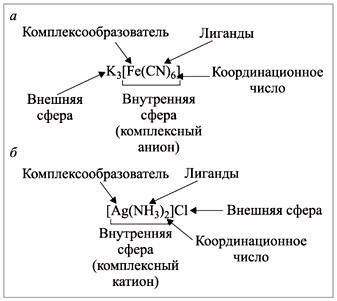 |
Рис. 5. Пояснения к изображению формул
|
Заряд комплексного иона легко
подсчитать, зная степень окисления составляющих
его частей.
Классификация комплексных
соединений
Большое многообразие комплексных соединений и
их свойств не позволяет создать единую
классификацию. Однако можно группировать
вещества по некоторым отдельным признакам.
1) По составу.
2) По типу координируемых лигандов.
а) Аквакомплексы – это комплексные
катионы, в которых лигандами являются молекулы H2O.
Их образуют катионы металлов со степенью
окисления +2 и больше, причем способность к
образованию аквакомплексов у металлов одной
группы периодической системы уменьшается сверху
вниз.
Примеры аквакомплексов:
[Al(H2O)6]Cl3, [Cr(H2O)6](NO3)3.
б)Гидроксокомплексы – это комплексные
анионы, в которых лигандами являются
гидроксид-ионы OH–.
Комплексообразователями являются металлы,
склонные к проявлению амфотерных свойств – Be,
Zn, Al, Cr.
Например: Na[Al(OH)4], Ba[Zn(OH)4].
в) Аммиакаты – это комплексные катионы, в
которых лигандами являются молекулы NH3.
Комплексообразователями являются d-элементы.
Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl.
г) Ацидокомплексы – это комплексные
анионы, в которых лигандами являются анионы
неорганических и органических кислот.
Например: K3[Al(C2O4)3], Na2[Zn(CN)4],
K4[Fe(CN)6].
3) По заряду внутренней сферы.
Природа химической связи в
комплексных соединениях
Во внутренней сфере между
комплексообразователем и лигандами существуют
ковалентные связи, образованные в том числе и по
донорно-акцепторному механизму. Для образования
таких связей необходимо наличие свободных
орбиталей у одних частиц (имеются у
комплексообразователя) и неподеленных
электронных пар у других частиц (лиганды). Роль
донора (поставщика электронов) играет лиганд, а
акцептором, принимающим электроны, является
комплексообразователь. Донорно-акцепторная
связь возникает как результат перекрывания
свободных валентных орбиталей
комплексообразователя с заполненными
орбиталями донора.
Между внешней и внутренней сферой существует
ионная связь. Приведем пример.
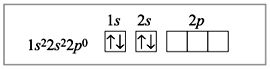
Электронное строение атома бериллия:
Электронное строение атома бериллия в
возбужденном состоянии:
Электронное строение атома бериллия в
комплексном ионе [BeF4]2–:
Пунктирными стрелками показаны электроны
фтора; две связи из четырех образованы по
донорно-акцепторному механизму. В данном случае
атом Be является акцептором, а ионы фтора –
донорами, их свободные электронные пары
заполняют гибридизованные орбитали (sp3-гибридизация).
Номенклатура комплексных
соединений
Наибольшее распространение имеет
номенклатура, рекомендованная IUPAC. Название комплексного
аниона начинается с обозначения состава
внутренней сферы: число лигандов обозначается
греческими числительными: 2–ди, 3–три, 4–тетра,
5–пента, 6–гекса и т.д., далее следуют названия
лигандов, к которым прибавляют соединительную
гласную «о»: Cl– – хлоро-, CN– –
циано-, OH– – гидроксо- и т.п. Если у
комплексообразователя переменная степень
окисления, то в скобках римскими цифрами
указывают его степень окисления, а его название с
суффиксом -ат: Zn – цинкат, Fe – феррат(III),
Au – аурат(III). Последним называют катион
внешней сферы в родительном падеже.
Примеры:
K3[Fe(CN)6] – гексацианоферрат(III)
калия,
K4[Fe(CN)6] – гексацианоферрат(II)
калия,
K2[Zn(OH)4] – тетрагидроксоцинкат
калия.
Названия соединений, содержащих комплексный
катион, строятся из названий анионов внешней
среды, после которых указывается число лигандов,
дается латинское название лиганда (молекула
аммиака NH3 – аммин, молекула воды H2O –
аква от латинского названия воды) и русское
название элемента-комплексообразователя;
римской цифрой в скобках указывается степень
окисления элемента-комплексообразователя, если
она переменная. Например:
[Cu(NH3)4]SO4 – сульфат
тетраамминмеди(II),
[Al(H2O)6]Cl3 – хлорид
гексаакваалюминия.
Химические свойства комплексных
соединений
1. В растворе комплексные соединения ведут
себя как сильные электролиты, т.е. полностью
диссоциируют на катионы и анионы:
[Pt(NH3)4]Cl2 = Pt(NH3)4]2+
+ 2Cl–,
K2[PtCl4] = 2K+ + [PtCl4]2–.
Диссоциация по такому типу называется
первичной.
Вторичная диссоциация связана с удалением
лигандов из внутренней сферы комплексного иона:
[PtCl4]2– PtCl3– + Cl–.
Вторичная диссоциация происходит ступенчато:
комплексные ионы ([PtCl4]2–) являются
слабыми электролитами.
2. При действии сильных кислот происходит
разрушение гидроксокомплексов, например:
а) при недостатке кислоты
Na3[Al(OH)6] + 3HCl = 3NaCl + Al(OH)3 + 3H2O;
б) при избытке кислоты
Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 +
6H2O.
3. Нагревание (термолиз) всех аммиакатов
приводит к их разложению, например:
[Cu(NH3)4]SO4 CuSO4 + 4NH3
.
Значение комплексных соединений
Координационные соединения имеют
исключительно большое значение в природе.
Достаточно сказать, что почти все ферменты,
многие гормоны, лекарства, биологически активные
вещества представляют собой комплексные
соединения. Например, гемоглобин крови,
благодаря которому осуществляется перенос
кислорода от легких к клеткам ткани, является
комплексным соединением, содержащим железо (рис.
6), а хлорофилл, ответственный за фотосинтез в
растениях, – комплексным соединением магния
(рис. 7).
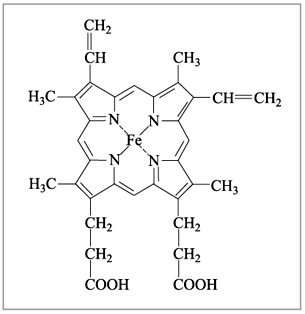 |
Рис. 6. Гем-группа в молекуле
|
Значительную часть природных
минералов, в том числе полиметаллических руд и
силикатов, также составляют координационные
соединения. Более того, химические методы
извлечения металлов из руд, в частности меди,
вольфрама, серебра, алюминия, платины, железа,
золота и других, также связаны с образованием
легкорастворимых, легкоплавких или летучих
комплексов. Например: Na3[AlF6] –
криолит, KNa3[AlSiO4]4 – нефелин
(минералы, комплексные соединения, содержащие
алюминий).
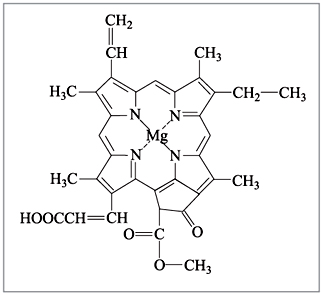 |
Рис. 7. Хлорофилл c1 |
Современная химическая отрасль
промышленности широко использует
координационные соединения как катализаторы при
синтезе высокомолекулярных соединений, при
химической переработке нефти, в производстве
кислот.
III. Подведение итогов и постановка
домашнего задания
Домашнее задание.
1) Приготовиться по лекции к уроку-практикуму по
теме: «Комплексные соединения».
2) Письменно дать характеристику следующим
комплексным соединениям по строению и
классифицировать по признакам:
K3[Cr(OH)6], [Cr(H2O)6](NO3)3,
Na2[Zn(CN)4], [Ag(NH3)2]OH.
3) Написать уравнения реакций, при помощи
которых можно осуществить превращения:
* За открытие этой
новой области науки А.Вернер в 1913 г. был
удостоен Нобелевской премии.
Н.Н.ТОПОЕВА,
учитель химии
Аскизского лицея-интерната
(с. Аскиз, Республика Хакасия)
Наверх
Как известно, металлы имеют свойство терять электроны и, тем самым, образовывать катионы. Положительно заряженные ионы металлов могут находиться в окружении анионов или нейтральных молекул, образуя частицы, называемые комплексными и способные к самостоятельному существованию в кристалле или растворе. А соединения, содержащие в узлах своих кристаллов комплексные частицы, называются комплексными соединениями.
Подробнее >>
В настоящее время образование и свойства комплексных соединений объясняют с точки зрения теории метода валентных связей (ВС), теории кристаллического поля (ТКП) и теории молекулярных орбиталей (МО). Далее кратко на примерах рассмотрим каждую из теорий.
Подробнее >>
Изомеры – соединения, имеющие одинаковый химический состав, но при этом отличающиеся физическими или химическими свойствами. Это отличие возникает в связи с различным положением одних и тех же групп атомов в изомерных соединениях. Для комплексных соединений характерно несколько видов изомерии. Рассмотрим их.
Подробнее >>
При получении растворов комплексных соединений, происходит их диссоциация на ионы внутренней и внешней сферы. После отщепления внешней сферы (первичная диссоциация), обратимой диссоциации подвергается внутренняя сфера (вторичная диссоциация): [MLn] ↔ M + nL Заряды для упрощения опущены, а ионы представлены в негидрированном виде. Диссоциация комплекса протекает ступенчато, т.е. лиганды удаляются из внутренней сферы последовательно один за другим.
Подробнее >>
Получение комплексных соединений Комплексные соединения можно получить различными способами: 1. В результате реакций соединения: HgI2 + 2KI (изб.) = K2[HgI4] 2. По реакции замещения лиганда во внутренней сфере: Некоторые комплексы способны к быстрому замещению лигандов. Такие комплексы называются лабильными. У других же этот процесс происходит очень медленно – это инертные комплексы.
Подробнее >>
Здесь приведены задачи к разделу Комплексные соединения: структура, классификация, номенклатура комплексных соединений, а также их устойчивость и химические свойства.
Подробнее >>
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная).
Классификация неорганических веществ с примерами соединений
Теперь проанализируем представленную выше классификационную схему более детально.
Как мы видим, прежде всего все неорганические вещества делятся на простые и сложные:
Простыми веществами называют такие вещества, которые образованы атомами только одного химического элемента. Например, простыми веществами являются водород H2, кислород O2, железо Fe, углерод С и т.д.
Среди простых веществ различают металлы, неметаллы и благородные газы:
Металлы образованы химическими элементами, расположенными ниже диагонали бор-астат, а также всеми элементами, находящимися в побочных группах.
Благородные газы образованы химическими элементами VIIIA группы.
Неметаллы образованы соответственно химическими элементами, расположенными выше диагонали бор-астат, за исключением всех элементов побочных подгрупп и благородных газов, расположенных в VIIIA группе:
Названия простых веществ чаще всего совпадают с названиями химических элементов, атомами которых они образованы. Однако для многих химических элементов широко распространено такое явление, как аллотропия. Аллотропией называют явление, когда один химический элемент способен образовывать несколько простых веществ. Например, в случае химического элемента кислорода возможно существование молекулярных соединений с формулами O2 и O3. Первое вещество принято называть кислородом так же, как и химический элемент, атомами которого оно образовано, а второе вещество (O3) принято называть озоном. Под простым веществом углеродом может подразумеваться любая из его аллотропных модификаций, например, алмаз, графит или фуллерены. Под простым веществом фосфором могут пониматься такие его аллотропные модификации, как белый фосфор, красный фосфор, черный фосфор.
Сложные вещества
Сложными веществами называют вещества, образованные атомами двух или более химических элементов.
Так, например, сложными веществами являются аммиак NH3, серная кислота H2SO4, гашеная известь Ca(OH)2 и бесчисленное множество других.
Среди сложных неорганических веществ выделяют 5 основных классов, а именно оксиды, основания, амфотерные гидроксиды, кислоты и соли:
Оксиды — сложные вещества, образованные двумя химическими элементами, один из которых кислород в степени окисления -2.
Общая формула оксидов может быть записана как ЭxOy, где Э — символ какого-либо химического элемента.
Номенклатура оксидов
Название оксида химического элемента строится по принципу:
Например:
Fe2O3 — оксид железа (III); CuO — оксид меди (II); N2O5 — оксид азота (V)
Нередко можно встретить информацию о том, что в скобках указывается валентность элемента, однако же это не так. Так, например, степень окисления азота N2O5 равна +5, а валентность, как это ни странно, равна четырем.
В случае, если химический элемент имеет единственную положительную степень окисления в соединениях, в таком случае степень окисления не указывается. Например:
Na2O — оксид натрия; H2O — оксид водорода; ZnO — оксид цинка.
Классификация оксидов
Оксиды по их способности образовывать соли при взаимодействии с кислотами или основаниями подразделяют соответственно на солеобразующие и несолеобразующие.
Несолеобразующих оксидов немного, все они образованы неметаллами в степени окисления +1 и +2. Список несолеобразующих оксидов следует запомнить: CO, SiO, N2O, NO.
Солеобразующие оксиды в свою очередь подразделяются на основные, кислотные и амфотерные.
Основными оксидами называют такие оксиды, которые при взаимодействии с кислотами (или кислотными оксидами) образуют соли. К основным оксидам относят оксиды металлов в степени окисления +1 и +2, за исключением оксидов BeO, ZnO, SnO, PbO.
Кислотными оксидами называют такие оксиды, которые при взаимодействии с основаниями (или основными оксидами) образуют соли. Кислотными оксидами являются практически все оксиды неметаллов за исключением несолеобразующих CO, NO, N2O, SiO, а также все оксиды металлов в высоких степенях окисления (+5, +6 и +7).
Амфотерными оксидами называют оксиды, которые могут реагировать как с кислотами, так и основаниями, и в результате этих реакций образуют соли. Такие оксиды проявляют двойственную кислотно-основную природу, то есть могут проявлять свойства как кислотных, так и основных оксидов. К амфотерным оксидам относятся оксиды металлов в степенях окисления +3, +4, а также в качестве исключений оксиды BeO, ZnO, SnO, PbO.
Некоторые металлы могут образовывать все три вида солеобразующих оксидов. Например, хром образует основный оксид CrO, амфотерный оксид Cr2O3 и кислотный оксид CrO3.
Как можно видеть, кислотно-основные свойства оксидов металлов напрямую зависят от степени окисления металла в оксиде: чем больше степень окисления, тем сильнее выражены кислотные свойства.
Основания
Основания — соединения с формулой вида Me(OH)x, где x чаще всего равен 1 или 2.
Исключения: Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2 не относятся к основаниям, несмотря на степень окисления металла +2. Данные соединения являются амфотерными гидроксидами, которые еще будут рассмотрены в этой главе более подробно.
Классификация оснований
Основания классифицируют по количеству гидроксогрупп в одной структурной единице.
Основания с одной гидроксогруппой, т.е. вида MeOH, называют однокислотными основаниями, с двумя гидроксогруппами, т.е. вида Me(OH)2, соответственно, двухкислотными и т.д.
Также основания подразделяют на растворимые (щелочи) и нерастворимые.
К щелочам относятся исключительно гидроксиды щелочных и щелочно-земельных металлов, а также гидроксид таллия TlOH.
Номенклатура оснований
Название основания строится по нижеследующему принципу:
Например:
Fe(OH)2 — гидроксид железа (II),
Cu(OH)2 — гидроксид меди (II).
В тех случаях, когда металл в сложных веществах имеет постоянную степень окисления, указывать её не требуется. Например:
NaOH — гидроксид натрия,
Ca(OH)2 — гидроксид кальция и т.д.
Кислоты
Кислоты — сложные вещества, молекулы которых содержат атомы водорода, способные замещаться на металл.
Общая формула кислот может быть записана как HxA, где H — атомы водорода, способные замещаться на металл, а A — кислотный остаток.
Например, к кислотам относятся такие соединения, как H2SO4, HCl, HNO3, HNO2 и т.д.
Классификация кислот
По количеству атомов водорода, способных замещаться на металл, кислоты делятся на:
— одноосновные кислоты: HF, HCl, HBr, HI, HNO3;
— двухосновные кислоты: H2SO4, H2SO3, H2CO3;
— трехосновные кислоты: H3PO4, H3AsO4.
Следует отметить, что количество атомов водорода в случае органических кислот чаще всего не отражает их основность. Например, уксусная кислота с формулой CH3COOH, несмотря на наличие 4-х атомов водорода в молекуле, является не четырех-, а одноосновной. Основность органических кислот определяется количеством карбоксильных групп (-COOH) в молекуле.
Также по наличию кислорода в молекулах кислоты подразделяют на бескислородные (HF, HCl, HBr и т.д.) и кислородсодержащие (H2SO4, HNO3, H3PO4 и т.д.). Кислородсодержащие кислоты называют также оксокислотами.
Более детально про классификацию кислот можно почитать здесь.
Номенклатура кислот и кислотных остатков
Нижеследующий список названий и формул кислот и кислотных остатков обязательно следует выучить.
В некоторых случаях облегчить запоминание может ряд следующих правил.
Как можно видеть из таблицы выше, построение систематических названий бескислородных кислот выглядит следующим образом:
Например:
HF — фтороводородная кислота;
HCl — хлороводородная кислота;
H2S — сероводородная кислота.
Названия кислотных остатков бескислородных кислот строятся по принципу:
Например, Cl— — хлорид, Br— — бромид.
Названия кислородсодержащих кислот получают добавлением к названию кислотообразующего элемента различных суффиксов и окончаний. Например, если кислотообразующий элемент в кислородсодержащей кислоте имеет высшую степень окисления, то название такой кислоты строится следующим образом:
Например, серная кислота H2S+6O4, хромовая кислота H2Cr+6O4.
Все кислородсодержащие кислоты могут быть также классифицированы как кислотные гидроксиды, поскольку в их молекулах обнаруживаются гидроксогруппы (OH). Например, это видно из нижеследующих графических формул некоторых кислородсодержащих кислот:
Таким образом, серная кислота иначе может быть названа как гидроксид серы (VI), азотная кислота — гидроксид азота (V), фосфорная кислота — гидроксид фосфора (V) и т.д. При этом число в скобках характеризует степень окисления кислотообразующего элемента. Такой вариант названий кислородсодержащих кислот многим может показаться крайне непривычным, однако же изредка такие названия можно встретить в реальных КИМах ЕГЭ по химии в заданиях на классификацию неорганических веществ.
Амфотерные гидроксиды
Амфотерные гидроксиды — гидроксиды металлов, проявляющие двойственную природу, т.е. способные проявлять как свойства кислот, так и свойства оснований.
Амфотерными являются гидроксиды металлов в степенях окисления +3 и +4 (как и оксиды).
Также в качестве исключений к амфотерным гидроксидам относят соединения Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2, несмотря на степень окисления металла в них +2.
Для амфотерных гидроксидов трех- и четырехвалентных металлов возможно существование орто- и мета-форм, отличающихся друг от друга на одну молекулу воды. Например, гидроксид алюминия (III) может существовать в орто-форме Al(OH)3 или мета-форме AlO(OH) (метагидроксид).
Поскольку, как уже было сказано, амфотерные гидроксиды проявляют как свойства кислот, так и свойства оснований, их формула и название также могут быть записаны по-разному: либо как у основания, либо как у кислоты. Например:
| Амфотерный гидроксид в форме основания | Амфотерный гидроксид в форме кислоты | «Кислотный» остаток |
| Zn(OH)2 гидроксид цинка | H2ZnO2 цинковая кислота | ZnO22- цинкат |
| Al(OH)3 (орто)гидроксид алюминия | H3AlO3 ортоалюминиевая кислота | AlO33- ортоалюминат |
| AlO(OH) метагидроксид алюминия | HAlO2 метаалюминиевая кислота | AlO2— метаалюминат |
Соли
Соли — это сложные вещества, в состав которых входят катионы металлов и анионы кислотных остатков.
Так, например, к солям относятся такие соединения как KCl, Ca(NO3)2, NaHCO3 и т.д.
Представленное выше определение описывает состав большинства солей, однако же существуют соли, не попадающие под него. Например, вместо катионов металлов в состав соли могут входить катионы аммония или его органические производные. Т.е. к солям относятся такие соединения, как, например, (NH4)2SO4 (сульфат аммония), [CH3NH3]+Cl— (хлорид метиламмония) и т.д.
Также противоречат определению солей выше класс так называемых комплексных солей, которые будут рассмотрены в конце данной темы.
Классификация солей
С другой стороны, соли можно рассматривать как продукты замещения катионов водорода H+ в кислоте на другие катионы или же как продукты замещения гидроксид-ионов в основаниях (или амфотерных гидроксидах) на другие анионы.
При полном замещении образуются так называемые средние или нормальные соли. Например, при полном замещении катионов водорода в серной кислоте на катионы натрия образуется средняя (нормальная) соль Na2SO4, а при полном замещении гидроксид-ионов в основании Ca(OH)2 на кислотные остатки нитрат-ионы образуется средняя (нормальная) соль Ca(NO3)2.
Соли, получаемые неполным замещением катионов водорода в двухосновной (или более) кислоте на катионы металла, называют кислыми. Так, при неполном замещении катионов водорода в серной кислоте на катионы натрия образуется кислая соль NaHSO4.
Соли, которые образуются при неполном замещении гидроксид-ионов в двухкислотных (или более) основаниях, называют основными солями. Например, при неполном замещении гидроксид-ионов в основании Ca(OH)2 на нитрат-ионы образуется основная соль Ca(OH)NO3.
Соли, состоящие из катионов двух разных металлов и анионов кислотных остатков только одной кислоты, называют двойными солями. Так, например, двойными солями являются KNaCO3, KMgCl3 и т.д.
Если соль образована одним типом катионов и двумя типами кислотных остатков, такие соли называют смешанными. Например, смешанными солями являются соединения Ca(OCl)Cl, CuBrCl и т.д.
Существуют соли, которые не попадают под определение солей как продуктов замещения катионов водорода в кислотах на катионы металлов или продуктов замещения гидроксид-ионов в основаниях на анионы кислотных остатков. Это — комплексные соли. Так, например, комплексными солями являются тетрагидроксоцинкат- и тетрагидроксоалюминат натрия с формулами Na2[Zn(OH)4] и Na[Al(OH)4] соответственно. Распознать комплексные соли среди прочих чаще всего можно по наличию квадратных скобок в формуле. Однако нужно понимать, что, чтобы вещество можно было отнести к классу солей, в его состав должны входить какие-либо катионы, кроме (или вместо) H+, а из анионов должны быть какие-либо анионы помимо (или вместо) OH—. Так, например, соединение H2[SiF6] не относится к классу комплексных солей, поскольку при его диссоциации из катионов в растворе присутствуют только катионы водорода H+. По типу диссоциации данное вещество следует скорее классифицировать как бескислородную комплексную кислоту. Аналогично, к солям не относится соединение [Ag(NH3)2]OH, т.к. данное соединение состоит из катионов [Ag(NH3)2]+ и гидроксид-ионов OH—, т.е. его следует считать комплексным основанием.
Номенклатура солей
Номенклатура средних и кислых солей
Название средних и кислых солей строится по принципу:
Если степень окисления металла в сложных веществах постоянная, то ее не указывают.
Названия кислотных остатков были даны выше при рассмотрении номенклатуры кислот.
Например,
Na2SO4 — сульфат натрия;
NaHSO4 — гидросульфат натрия;
CaCO3 — карбонат кальция;
Ca(HCO3)2 — гидрокарбонат кальция и т.д.
Номенклатура основных солей
Названия основных солей строятся по принципу:
Например:
(CuOH)2CO3 — гидроксокарбонат меди (II);
Fe(OH)2NO3 — дигидроксонитрат железа (III).
Номенклатура комплексных солей
Номенклатура комплексных соединений значительно сложнее, и для сдачи ЕГЭ многого знать из номенклатуры комплексных солей не нужно.
Следует уметь называть комплексные соли, получаемые взаимодействием растворов щелочей с амфотерными гидроксидами. Например:
*Одинаковыми цветами в формуле и названии обозначены соответствующие друг другу элементы формулы и названия.
Тривиальные названия неорганических веществ
Под тривиальными названиями понимают названия веществ не связанные, либо слабо связанные с их составом и строением. Тривиальные названия обусловлены, как правило, либо историческими причинами либо физическими или химическими свойствами данных соединений.
Список тривиальных названий неорганических веществ, которые необходимо знать:
| Na3[AlF6] | криолит |
| SiO2 | кварц, кремнезем |
| FeS2 | пирит, железный колчедан |
| CaSO4∙2H2O | гипс |
| CaC2 | карбид кальция |
| Al4C3 | карбид алюминия |
| KOH | едкое кали |
| NaOH | едкий натр, каустическая сода |
| H2O2 | перекись водорода |
| CuSO4∙5H2O | медный купорос |
| NH4Cl | нашатырь |
| CaCO3 | мел, мрамор, известняк |
| N2O | веселящий газ |
| NO2 | бурый газ |
| NaHCO3 | пищевая (питьевая) сода |
| Fe3O4 | железная окалина |
| NH3∙H2O (NH4OH) | нашатырный спирт |
| CO | угарный газ |
| CO2 | углекислый газ |
| SiC | карборунд (карбид кремния) |
| PH3 | фосфин |
| NH3 | аммиак |
| KClO3 | бертолетова соль (хлорат калия) |
| (CuOH)2CO3 | малахит |
| CaO | негашеная известь |
| Ca(OH)2 | гашеная известь |
| прозрачный водный раствор Ca(OH)2 | известковая вода |
| взвесь твердого Ca(OH)2 в его водном растворе | известковое молоко |
| K2CO3 | поташ |
| Na2CO3 | кальцинированная сода |
| Na2CO3∙10H2O | кристаллическая сода |
| MgO | жженая магнезия |
Чтобы поделиться, нажимайте
Координационные (комплексные) соединения относятся к многочисленному классу соединений, в состав которых могут входить как неорганические, так и органические соединения в виде нейтральных или заряженных чатиц. По своей многочисленности они занимают второе место после органических соединений.
К координационным относят любое соединение, образованное присоединением одного или нескольких ионов или молекул к одному или более ионам или молекулам. Поэтому такое известное соединение как нашатырь NH4Cl относится к координационным, в котором роль центрального атома играет азот. Формально такие анионы как можно считать координационными: тетрагидроборат (III), тетраоксосульфат (VI), гексафторосиликат (IV).
Современная координационная химия связана с именем швейцарского химика А. Вернера, сформулировавшего основные положения координационной теории (1893 г.).
Координационными называют соединения, содержащие в одном из агрегатных состояний группу ионов или нейтральных молекул (лигандов), в определенном порядке размещенных (координированных) вокруг атома (иона) – комплексообразователя.
Система комплексообразователь–лиганды называется внутренней координационной сферой, обычно отделяемой квадратными скобками от внешней координационной сферы: K4[Fe(CN)6], [Cr(NH3)6]Cl3, [PtCl2(NH3)2], [Cr(CO)6].
Формула координационного иона или молекулы записывается, как правило, слева направо в следующей последовательности: центральный атом (ион), анионные, затем нейтральные лиганды с указанем их числа в виде правого нижнего индекса: [MLmXn]q.
Координационные соединения бывают катионные [Cr(NH3)]Cl3, анионные K4[Fe(CN)6], катион-анионные [Cr(NH3)6] [Fe(CN)6] и нейтральные [PtCl2(NH3)2].
Название координационного соединения электролита начинается с аниона, употребляемого в именительном падеже, затем следует название катиона в родительном падеже. Число лигандов каждого вида обозначается греческими приставками ди-, три-, тетра-, пента-, гекса-. Название комплексного аниона составляется из перечисления лигандов, корня латинского наименования центрального атома и суффикса -ат; в скобках римской цифрой обозначается степень его окисления или заряд координационного иона: K2[CuCl4] – тетрахлорокупрат (II) калия; в комплексном катионе металлу-комплексообразователю дается русское название: [Cr(H2O)6]Cl3 – хлорид гексааквахрома (III). Название координационной частицы начинается с перечисления лигандов в алфавитном порядке в последовательности, обратной записи (справа налево). Лиганды сохраняют обычные названия, к анионным лигандам добавляется суффикс «-о», (CH3COO– – ацетато-, F– – фторо-, OH– – гидроксо-), кроме NH3 – аммин-, H2O – аква-, CO – карбонил-, NO – нитрозил-. Например: [Co(NO2)2(NH3)4]Cl – хлорид тетрамминдинитритокобальта(III), [PtCl4(H2O)2] – диакватетрахлорплатина (IV), [Cr(NH3)6][Fe(CN)6] – гексацианоферрат (III) гексамминхрома (III), K3[AlF6] – гексафтороалюминат (III) калия или гексафтороалюминат (III–) калия.
Важнейшим параметром комплексообразователя и всего координационного соединения является координационное число (кч), которое наряду со степенью окисления в комплексных соединений служит еще одной его характеристикой.
Координационным числом называют число атомов лигандов, непосредственно присоединенных к центральному атому. Лиганды характеризуются дентатностью (от английского «dent» – зуб). К лигандам, способным занимать только одно координационное место (монодентатным), относятся H2O, NH3, C5H5N – пиридин (py), другие полярные молекулы (PPh3), однозарядные анионы CN–, Hal–, OH– и т. п. Некоторые лиганды могут занимать более одного координационного места, если содержат два и более донорных (со свободной электронной парой) атома. Такие лиганды называют многодентатными: NH2–CH2–CH2–NH2 (en) – этилендиамин, NH2–CH2–COO– (gly) – глицинат.
С учетом дентатности координационное число атома-комплексообразователя равно произведению числа лигандов во внутренней координационной сфере комплекса на их дентатность.
Комплексные соединения
Материалы портала onx.distant.ru
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами . Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F — — фторо, Cl — -хлоро, ОН — — гидроксо, CN — — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование комплексных солей.
Если комплексообразователем является Fe 2+ или Fe 3+ , то координационные числа в обоих случаях равны шести:
Координационные числа ртути и меди, как правило, равны четырем:
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например , в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
Для комплексного иона [Ni(NH3)6] 2+ , диссоциирующего по уравнению
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni 2+ ]·[NH3] 6 / [[Ni(NH3)6] 2+ ] (1)
Величина, обратная Кн, называется константой устойчивости:
Она представляет собой константу равновесия процесса образования комплексного иона:
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGT о = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3 — в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag + в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2] + = 5,7× 10 — 8 при 298 К.
3) Величину ΔG o 298 процесса диссоциации комплексного иона.
[NO3 — ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag + и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2] + составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
Следовательно, [Ag + ] = 1,43× 10 — 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2] + уравнением:
Значит, при Т = 298 К получаем:
ΔG о 298 = — 8,314× 298× ln5,7× 10 — 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10 — 10 , Кн.[Ag(NH3)2] + = 5,7× 10 — 8 .
Решение. Осадок выпадет при условии: [Ag + ][Сl — ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag + и Сl — в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10 -3 , 1 и 0,25 М соответственно.
Найдем концентрацию [Ag + ] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10 — 10 .
Значит, [Ag + ] = 2,85× 10 — 10 моль/л, а [Сl — ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag + ][Сl — ] = 2,85× 10 — 10 × 0,25 = 7,1× 10 — 11 (моль/л) 2 .
Поскольку [Ag + ][Сl — ] = 7,1× 10 — 11 — 10 , то осадок не выпадет.
Задача 3. При какой концентрации ионов S 2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10 — 27 , Кн[Cd(CN)4] 2- = 7,8× 10 — 18 .
Решение. Осадок выпадет при условии: [Cd 2+ ][S 2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd 2+ и S 2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S 2- ] > ПР(CdS):[Cd 2+ ].
Комплексный ион диссоциирует незначительно:
[Cd(CN)4] 2- → Cd 2+ + 4CN —
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd 2+ и 4x моль/л ионов CN — . Суммарная концентрация ионов CN — равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4] 2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4] 2- = [Cd 2+ ] · [CN — ] 4 / [[Cd(CN)4] 2- ]
Следовательно, [Cd 2+ ] = 1,8·10 — 12 моль/л.
Выпадение осадка начнется при [S 2- ] > 7,9·10 — 27 : 1,8·10 — 12 > 4,39·10 — 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия;
2. Назовите следующие комплексные соединения
[Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II).
3. Составьте уравнение химической реакции:
4. Составьте уравнение химической реакции:
5 . Составьте уравнение химической реакции:
6. Составьте уравнение химической реакции:
7. Составьте уравнение химической реакции:
Комплексные соединения
Цели. Сформировать представления о составе, строении, свойствах и номенклатуре комплексных соединений; развить навыки определения степени окисления у комплексообразователя, составления уравнений диссоциации комплексных соединений.
Новые понятия: комплексное соединение, комплексообразователь, лиганд, координационное число, внешняя и внутренняя сферы комплекса.
Оборудование и реактивы. Штатив с пробирками, концентрированный раствор аммиака, растворы сульфата меди(II), нитрата серебра, гидроксида натрия.
ХОД УРОКА

Что произошло? Химическая реакция? До сих пор мы не знали, что аммиак может реагировать с солью. Какое вещество образовалось? Каковы его формула, строение, название? К какому классу соединений его можно отнести? Может ли аммиак реагировать с другими солями? Есть ли соединения, аналогичные этому? Ответить на эти вопросы нам и предстоит сегодня.
Растворы CuSO4 (а)
и комплексного соединения
[Cu(NH3)4(H2O)2]SO4 (б)
Чтобы лучше изучить свойства некоторых соединений железа, меди, серебра, алюминия, нам потребуются знания о комплексных соединениях.
Продолжим наш опыт. Полученный раствор разделим на две части. К одной части прильем щелочь. Осадка гидроксида меди(II) Cu(OH)2 не наблюдается, следовательно, в растворе нет двухзарядных ионов меди или их слишком мало. Отсюда можно заключить, что ионы меди вступают во взаимодействие с прибавленным аммиаком и образуют какие-то новые ионы, которые не дают нерастворимого соединения с ионами OH – .
В то же время ионы 
Исследованиями установлено, что темно-синяя окраска аммиачного раствора обусловлена присутствием в нем сложных ионов [Cu(NH3)4] 2+ , образовавшихся путем присоединения к иону меди четырех молекул аммиака. При испарении воды ионы [Cu(NH3)4] 2+ связываются с ионами 
Комплексными называют соединения, содержащие сложные ионы и молекулы, способные к существованию как в кристаллическом виде, так и в растворах.
Формулы молекул или ионов комплексных соединений обычно заключают в квадратные скобки. Комплексные соединения получают из обычных (некомплексных) соединений.
Примеры получения комплексных соединений
| Реагирующие вещества | Kомплексные соединения | Kомплексные ионы |
|---|---|---|
| CuSO4 + 4NH3 | [Cu(NH3)4] SO4 | [Cu(NH3)4] 2+ |
| Fe(CN)2 + 4KCN | K4[Fe(CN)6] | [Fe(CN)6] 4– |
| PtCl2 + 2NH3 | [Pt(NH3)2Cl2] | – |
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером, лауреатом Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
А.Вернер
(1866–1919)
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определенное число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя.
Пример комплексного соединения
Рассмотренное в примере соединение [Cu(H2O)4)]SO4•H2O или CuSO4•5Н2О – это кристаллогидрат сульфата меди(II).
Определим составные части других комплексных соединений, например K4[Fe(CN)6].
(Справка. Вещество с формулой HCN – это синильная кислота. Соли синильной кислоты называют цианидами.)
Комплексообразователь – ион железа Fe 2+ , лиганды – цианид-ионы СN – , координационное число равно шести. Все, что записано в квадратных скобках, – внутренняя сфера. Ионы калия образуют внешнюю сферу комплексного соединения.
Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения. С другой – между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония. Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения, так и связью, образующейся за счет неподеленных электронных пар комплексообразователя и свободных орбиталей лигандов.
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы. Например:
[Cu(NH3)4]SO4 

При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава:
[Cu(NH3)4]SO4 + BaCl2 = [Cu(NH3)4]Cl2 + BaSO4
Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы.
Таким нейтральным комплексом является, например, [Pt(NH3)2Cl2].
Наиболее типичными комплексообразователями являются катионы d-элементов.
Лигандами могут быть:
а) полярные молекулы – NH3, Н2О, CO, NO;
б) простые ионы – F – , Cl – , Br – , I – , H – , H + ;
в) сложные ионы – CN – , SCN – , NO2 – , OH – .
Pассмотрим таблицу, в которой приведены координационные числа некоторых комплексообразователей.
 |
| Kоординационное число |
Ионы |
|---|---|
| 2 | Cu +, Ag + , Au + |
| 4 | Cu 2+ , Hg 2+ , Sn 2+ , Pt 2+ , Pb 2+ , Ni 2+ , Co 2+ , Zn 2+ , Au 3+ , Al 3+ |
| 6 | Fe 2+ , Fe 3+ , Co 2+ , Co 3+ , Ni 2+ , Cr 3+ , Sn 4+ , Pt 4+ |

Примеры. Чтобы назвать комплекс [Cu(NH3)4]Сl2, определяют степень окисления (С.О.)
х комплексообразователя – иона Cu х+ :
Аналогично находят степень окисления иона кобальта:
Чему равно координационное число кобальта в этом соединении? Сколько молекул и ионов окружает центральный ион? Координационное число кобальта равно шести.
Название комплексного иона пишут в одно слово. Степень окисления центрального атома обозначают римской цифрой, помещенной в круглые скобки. Например:
На примере нескольких комплексных соединений определим структуру молекул (ион-комплексообразователь, его С.О., координационное число, лиганды, внутреннюю и внешнюю сферы), дадим название комплексу, запишем уравнения электролитической диссоциации.
K4[Fe(CN)6] 
H[AuCl4] – тетрахлорозолотая кислота (образуется при растворении золота в «царской водке»),
H[AuCl4] 
[Ag(NH3)2]OH – гидроксид диамминсеребра(I) (это вещество участвует в реакции «серебряного зеркала»),
[Ag(NH3)2]OH 
Na[Al(OH)4] – тетрагидроксоалюминат натрия,
Na[Al(OH)4] 
К комплексным соединениям относятся и многие органические вещества, в частности, известные вам продукты взаимодействия аминов с водой и кислотами. Например, соли хлорид метиламмония и хлорид фениламмония являются комплексными соединениями. Согласно координационной теории они имеют следующее строение:
Здесь атом азота – комплексообразователь, атомы водорода при азоте, радикалы метил и фенил – лиганды. Вместе они образуют внутреннюю сферу. Во внешней сфере находятся хлорид-ионы.
Многие органические вещества, имеющие большое значение в жизнедеятельности организмов, представляют собой комплексные соединения. К ним относятся гемоглобин, хлорофилл, ферменты и др.
Комплексные соединения находят широкое применение:
1) в аналитической химии для определения многих ионов;
2) для разделения некоторых металлов и получения металлов высокой степени чистоты;
3) в качестве красителей;
4) для устранения жесткости воды;
5) в качестве катализаторов важных биохимических процессов.
Урок №15. Комплексные соединения
Комплексные соли — это сложные вещества, в состав которых входят комплексный катион и анион, либо катион и комплексный анион
Na 2 [Zn(OH) 4 ] →2Na + + [Zn(OH) 4 ] 2-
Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу.
Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки).
Комплексообразователь – это d-элемент, имеющий на внешнем уровне достаточное количество свободных орбиталей (Cu +2 , Ag + , Pt +4 , Fe +2 , Fe +3 , Co +2 , Co +3 , Co +2 )
Лиганды – это ионы и молекулы, имеющие свободные электронные пары (OH — , CN — , Cl — , NH 3 , H 2 O)
Координационное число (КЧ) — это число лигандов в комплексном ионе
Координационное число зависит:
от природы центрального атома;
условий образования комплексов.
Виды комплексов
Соединения с комплексными анионами
K 2 [PtCl 4 ] — тетрахлороплатинат (II) калия
Na 2 [Zn(OH) 4 ] — тетрагидроксоцинкат натрия
Na[Cr(H 2 O) 2 F 4 ] — тетрафтородиаквахромат (III) натрия
Соединения с комплексными катионами
[Ag(NH 3 ) 2 ]Cl – хлорид диамминсеребра
[Al(H 2 O) 5 OH]SO 4 – сульфат гидроксопентаакваалюминия
[Pt(H 2 O)(NH 3 ) 2 OH] NO 3 – нитрат гидроксодиамминакваплатины (II)
Соединения без внешней сферы
[Al (H 2 O) 3 (OH) 3 ] — тригидроксотриакваалюминий
[Pt(NH 3 ) 2 Cl 2 ] – дихлородиамминплатина (II)
[Co(NH 3 ) 3 Cl 3 ] – трихлоротриамминкобальт (III)
Номенклатура
в названиях комплексных ионов сначала указываются лиганды;
название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках);
в названиях комплексных катионов используются русские названия металлов;
в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат;
источники:
http://him.1sept.ru/article.php?id=200500610
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/10-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D1%82%D1%80%D0%B5%D1%82%D0%B8%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-15-%D0%BA%D0%BE%D0%BC%D0%BF%D0%BB%D0%B5%D0%BA%D1%81%D0%BD%D1%8B%D0%B5-%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F