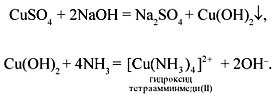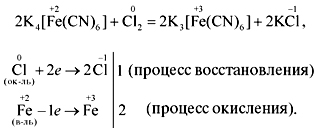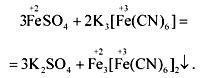Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка).
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Общая формула соли М
n
Ac
m
, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Средними солями
называют продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Например, H
3
PO
4
– Na
3
PO
4
;
Cu(OH)
2
– CuSO
4
.
Кислыми солями
называют продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Например, H
2
SO
4
– NaHSO
4
,
H
3
PO
4
– Na
2
HPO
4
– NaH
2
PO
4
.
Основными солями
называют продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными остатками.
Например, Ca(OH)
2
– CaOHCl;
Fe(OH)
3
– Fe(OH)
2
Cl – FeOHCl
2
.
Кислые соли вступают в реакции с щелочами с образованием средних солей.
KHCO
3
+ KOH = K
2
CO
3
+ H
2
O
Некоторые кислые соли, например, угольной кислоты разлагаются под действием более сильных кислот:
KHCO
3
+ HCl = KCl + CO
2
+ H
2
O
Основные соли вступают в реакции с кислотами:
Cu(OH)Cl + HCl = CuCl
2
+ H
2
O
Свойства комплексных солей (способы разрушения комплексных солей)
1) Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами. При действии избытка сильной кислоты получается две средних соли и вода. При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода, например:
K
3
[Al(OH)
6
] + 3HCl = 3KCl + Al(OH)
3
↓ + 3H
2
O
K
3
[Al(OH)
6
] + 6HClизб = 3KCl + AlCl
3
+ 6H
2
O
K
2
[Zn(OH)
4
] + 2HBr = 2KBr + Zn(OH)
2
↓ + 2H
2
O
K
2
[Zn(OH)
4
] + 4HBr изб = 2KBr + ZnBr
2
+ 4H
2
O
K
3
[Cr(OH)
6
] + 6HNO
3
изб
.
= 3KNO
3
+ Cr(NO
3
)
3
+ 6H
2
O
2) При нагревании комплексные соли теряют воду:
K[Al(OH)
4
] = KAlO
2
+ 2H
2
O
K
3
[Cr(OH)
6
] = KCrO
2
+ 2H
2
O + 2KOH
3) При действии углекислого газа, сернистого газа или сероводорода получается соль активного металла и амфотерный гидроксид:
Na[Al(OH)
4
] + CO
2
= NaHCO
3
+ Al(OH)
3
↓
K
3
[Cr(OH)
6
]+ 3SO
2
= 3KHSO
3
+ Cr(OH)
3
↓
Na[Al(OH)
4
] + H
2
S = NaHS + Al(OH)
3
↓+ H
2
O
4) При действии солей, образованных катионами Fe
3+
, Al
3+
и Cr
3+
происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла:
3Na[Al(OH)
4
] + FeCl
3
= 3Al(OH)
3
↓ + Fe(OH)
3
↓ + 3NaCl
K
3
[Cr(OH)
6
] + Al(NO
3
)
3
= Al(OH)
3
↓
+ Cr(OH)
3
↓+ 3KNO
3
3 ноября 2021
В закладки
Обсудить
Жалоба
Комплексные (координационные) соединения
Презентация предназначена для изучения материала по теме «Комплексные соединения» на углубленном уровне в 11 классе.
Комплексные соединения (КС) – это вещества, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе.
kompleks-s.pptx
kompleks-s.pdf
Автор: Плис Татьяна Фёдоровна.
ИЗ ОПЫТА РАБОТЫ
Для самых смелых
Комплексные соединения
Материал данной статьи
может быть с успехом использован при проведении
уроков как по обычной программе в 10–11-х классах
(повторение и обобщение знаний по неорганической
химии, амфотерность), так и по программе с
углубленным изучением химии для отдельного
тематического занятия.
Все познается в сравнении.
Приступая к изучению вопроса о комплексных
соединениях, вспомним строение атома азота и
молекулы аммиака.
Азот имеет на внешнем электронном слое пять
электронов – одну пару и три неспаренных (рис. 1).
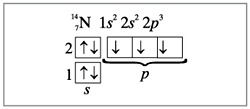 |
Рис. 1.
|
Аммиак: азот затрачивает эти три
неспаренных электрона на образование
ковалентных связей с атомами водорода –
образует с водородом три общие электронные пары.
Собственную неподеленную пару электронов азот
использует на образование донорно-акцепторной
связи, например, с протоном (рис. 2).
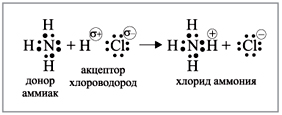 |
Рис. 2.
|
Соединения, образование которых не
связано с возникновением новых электронных пар
(общая электронная пара образовалась за счет
собственной электронной пары одного из
партнеров), называются комплексными.
Создатель теории комплексных соединений, она
называется еще координационной теорией, –
шведский ученый Альфред Вернер. В начале
прошлого столетия наибольший прогресс в этой
области химии достигнут в нашей стране благодаря
Льву Александровичу Чугаеву, который создал
уникальную школу химиков-комплексников.
Рассмотрим комплексное соединение на
конкретном примере: если, получив гидроксид меди,
добавить к осадку раствор аммиака в воде, то
осадок исчезнет, а раствор станет прозрачным и
темно-синим. Это образовалось комплексное
соединение. Запишем уравнения реакций:
Состав комплексного соединения (КС) [Cu(NH3)4](OH)2:
внешняя сфера – два иона ОН–;
внутренняя сфера – ион [Cu(NH3)4]2+;
комплексообразователь (центральный ион,
координатор) – Cu2+;
координационное число (КЧ) (число молекул или
ионов, соединенных непосредственно с
атомом-комплексообразователем) – 4;
лиганды (молекулы или ионы, расположенные около
комплексообразователя) – (NH3).
При написании формул комплексных солей
комплекс заключается в квадратные скобки.
Комплексы могут выполнять роль катионов, анионов
или быть нейтральными молекулами, например:
[Cu(NH3)4]2+ – катион;
[Fe(CN)6]4– – анион;
[Pt(NH3)2Cl4] – нейтральная
молекула.
Заряд комплексного иона равен сумме зарядов
комплексообразователя и лигандов.
Алгебраическая сумма зарядов внутренней и
внешней сферы равна нулю, например, в соединении
Na2[Zn(CN)4]: два иона 2Na+ – внешняя
сфера, ион [Zn(CN)4]2– – внутренняя
сфера, ее заряд складывается из двух
положительных зарядов иона Zn2+ и четырех
отрицательных зарядов четырех ионов CN–,
что в сумме дает минус два.
Образование внутренней сферы комплексов
происходит по донорно-акцепторному механизму.
Комплексообразователь – акцептор,
предоставляющий свободные орбитали. Лиганды –
доноры, предоставляющие свободные пары
электронов. Роль комплексообразователя обычно
выполняют положительно заряженные ионы, имеющие
небольшую величину ионного радиуса. Чаще всего
это катионы d-элементов, хотя известны и
комплексные соединения катионов s-, p- и f-элементов*.
Лигандами, как правило, являются ионы (анионы), к
названию которых прибавляется гласная «о»,
например: ионы F– – фторо, Cl– –
хлоро, I– – йодо, CN– – циано, OH–
– гидроксо, CNS– – роданидо; и нейтральные
молекулы: Н2O – аква, NH3 – амин и др.
Координационное число зависит от радиуса атома
комплексообразователя и его заряда (таблица).
Чем больше радиус комплексообразователя, тем
большее число лигандов может соединиться с ним.
Самостоятельная работа
Составьте комплексные соединения, обозначьте
составные части, заряды ионов.
2AgNO3
…………………….. .
(Ответ. Ag+[Ag+(NO3)2]–.)
Pt+4Cl4•2KCl (КЧ Pt = 6) …………………. . .
(Ответ. [Pt 4+(Cl–)6]2–.)
Таблица
Наиболее частые и возможные (в
скобках) координационные числа
в зависимости от заряда центрального иона
| Примеры соединений |
Заряд комплексообразователя |
КЧ (четное) |
| Na[Au(CN)2] | +1 | 2 |
| [Cu(NH3)4]SO4 | +2 | 4(6) |
| K3[Fe(CN)6] | +3 | 6(4) |
| K4[Mо(CN)8]?2H2O | +4 | 8(6) |
Названия комплексных
соединений
Формула комплексного соединения читается
справа налево. Сначала называется анион (если он
есть): Cl– – хлорид, ОН– – гидроксид,
SO4 – сульфат и т.д. Название комплексного
катиона записывают в одно слово, число лигандов
указывают греческими числительными: 1 – моно, 2
– ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса.
Отрицательные лиганды (анионы) внутренней сферы
в названии приобретают суффикс «о» (см. выше),
затем перечисляют нейтральные лиганды, называют
центральный атом и римской цифрой обозначают его
степень окисления.
В комплексных анионах добавляется суффикс «ат»
к названию комплексообразователя. После
обозначения состава внутренней сферы называют
внешнесферные катионы (если такие имеются).
Cамостоятельная работа
Дайте названия в каждом конкретном примере.
[Al(H2O) 6]Cl3.
(Ответ. Хлорид гексаакваалюминия.)
K2[Pt(Cl)6].
(Ответ. Гексахлороплатинат(IV) калия.)
Na2[Zn(OH)4].
(Ответ. Тетрагидроксоцинкат натрия.)
[Cu(NH3)4](OH).
(Ответ. Гидроксид тетраамминмеди(II).)
NH4Cl.
(Ответ. Хлорид аммония.)
[Ag(NH3)2]Cl.
(Ответ. Хлорид диамминсеребра(I).)
K4[Мо(CN)8]•2H2O.
(Ответ. Дигидрат
октацианомолибдата(IV) калия.)
Свойства комплексных соединений
Свойства КС определяются их составом и
строением. В воде они диссоциируют на внешнюю
сферу и комплексный ион:
K3[Fe(CN)6] 3K+ + [Fe(CN)6]–3.
Важнейшим свойством комплексов в растворах
является их устойчивость. Количественно она
характеризуется константой устойчивости.
Внутренняя сфера комплекса в незначительной
степени подвергается электролитической
диссоциации, распадаясь на
комплексообразователь и лиганды, например:
[Fe(CN)6]3– Fe3+ + 6CN–.
Отношение концентрации недиссоциированного
комплекса к произведению концентраций
комплексообразователя и лигандов называется
константой устойчивости, а обратная ей величина
– константой нестойкости:
Чем больше константа устойчивости и чем меньше
константа нестойкости, тем прочнее комплекс.
Комплексные соли могут вступать в реакции
обмена и в реакции замещения, например:
2CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2K2SO4,
Zn + 2Na[Au(CN)2] = Na2[Zn(CN)4] + 2Au,
а также в окислительно-восстановительные
реакции:
Таким образом, комплексные соли в растворах
ведут себя так же, как и соли простые.
Объяснение амфотерности гидроксидов
с точки зрения химии комплексных соединений
Согласно протолитической теории амфотерные
соединения способны быть как донорами, так и
акцепторами протона. Типичным примером
амфотерного соединения может служить вода:
Н2О + Н2О Н3О+ + ОН–.
Из гидроксидов наиболее ярко выражены
амфотерные свойства у гидроксида галлия Ga(OH)3,
для которого константы диссоциации в водном
растворе по кислотному и основному типу почти
равны.
Преобладание кислотных или осно’вных свойств у
гидроксидов различных элементов связано с
положением элемента в периодической системе.
Ослабление осно’вных и усиление кислотных
свойств гидроксидов R(OH)n наблюдается с
увеличением поляризующего действия иона Rn+,
т.е.
с уменьшением его радиуса и возрастанием заряда.
Поэтому к сильным основаниям относят гидроксиды
щелочных и щелочно-земельных металлов.
Амфотерные гидроксиды образуют во II группе
периодической системы бериллий и цинк – элемент
II группы, но побочной подгруппы, а в III группе –
алюминий, галлий и индий.
Исследование влияния концентрации ионов Н+
в растворе на свойства различных гидроксидов
показало, что амфотерность обусловлена
устойчивостью гидроксокомплекса данного
металла. Приведем пример – гидроксид цинка
растворяется в кислотах и щелочах:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O,
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4],
или в ионной форме:
Zn(OH)2 + 2H+ = Zn2+ + 2H2O,
Zn(OH)2 + 2ОH– = [Zn(OH)4]2–.
В водном растворе свободные ионы не могут
существовать, они находятся в виде гидратов.
Энергия гидратации велика, и при этом образуются
аквакомплексы постоянного состава. Число
молекул воды обычно равно координационному
числу. Аквакомплексы ведут себя как кислоты.
Например, в водном растворе какой-либо соли цинка
его аквакомплекс диссоциирует:
[Zn(Н2О)4]2+ [Zn(Н2О)3ОН]+ + Н+.
В ряду аква-, аквагидроксо- и гидрокомплексов
цинка (цинк проявляет координационное число 4, а
лигандами являются молекулы воды или ионы ОН–):
[Zn(Н2О)4]2+ [Zn(Н2О)3ОН]+
[Zn(Н2О)2(ОН)2]
L [Zn(Н2О)(ОН)3]–
[Zn(OH)4]2–
каждый последующий член ряда по составу
отличается от предыдущего на один протон. При
переходе каждого предыдущего члена в
последующий первый ведет себя как кислота.
Обратный переход связан с притяжением протона, а
следовательно, с проявлением соединением
основных свойств. Равновесие взаимоперехода
одних комплексов в другие в указанном ряду
смещено вправо в щелочной среде и влево – в
кислой.
Рассмотрим образование аналогичных комплексов
у алюминия. При растворении алюминия в кислоте (в
сильнокислой среде) получается катион в виде
аквакомплекса:
2Al + 6Н+ + 6Н2О = 2[Аl(Н2О)6]3+
+ 3Н2,
При постепенном прибавлении раствора щелочи
происходит замена молекул воды в комплексе на
гидроксильные группы (переход от аквакомплексов
к гидроксокомплексам):
[Al(Н2О)6]3+ + ОН– =
[Al(Н2О)5ОН]2+ + Н2О,
[Al(Н2О)5ОН]2+ + ОН–
= [Al(Н2О)4(ОН)2]+ + Н2О,
[Al(Н2О)4(ОН)2]+ + ОН–
= [Al(Н2О)3(ОН)3] + Н2О.
Нейтральный гидроксид не растворяется в воде и
выпадает в осадок.
При дальнейшем прибавлении раствора щелочи
снова образуются ионы, но уже не катионы, а
анионы, и осадок растворяется:
[Al(Н2О)3(ОН)3] + ОН– =
[Al(Н2О)2(ОН)4]– + Н2О,
[Al(Н2О)2(ОН)4]– +
ОН– = А1[(Н2О)(ОН)5]2– + Н2О,
[Al(Н2О)(ОН)5]2– + ОН–
= [Al(ОН)6]3– + Н2О.
Таким образом, амфотерность трехвалентного
алюминия проявляется в возможности его
существования в водном растворе как в составе
катионов, так и анионов. Состав этих ионов
зависит от кислотности среды. В школьном курсе
химии принято для аниона использовать формулу
[Al(ОН)4]–, где координационное число
алюминия не 6, а 4.
Получение комплексных солей
Комплексные соли получаются в результате
реакций соединения, обмена,
окислительно-восстановительных реакций, а также
при электролизе.
Например:
HgI2 + 2KI (изб.) = K2[HgI4],
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4
+ 4H2O,
ZnCl2 + 4NaOH (изб.) = Na2[Zn(OH)4]
+ 2NaCl.
Применение комплексных соединений
• Гальванические покрытия – защита одного
металла другим. Например, медное покрытие крепко
соединяется с железом, если использовать в
процессе комплексные соединения.
• Электролитическое получение металлов.
Например, алюминий в расплаве криолита образует
комплекс Nа3[AlF6]. Из расплавов
соединений комплексных солей получают такие
металлы, как Nb, Tl, Th, Mg.
• Защита металлов от коррозии. Ингибиторы –
комплексные соли, где лигандами выступают и
органические вещества.
• Аналитическая химия. Многие индикаторы,
реактивы, которые помогают распознать вещества,
ионы и даже заряды ионов, – комплексные
соединения. Катион Fe2+ можно распознать в
реакции с гексацианоферратом(III) калия:
Образуется синий осадок (турнбулева синь).
Катион Fe3+ можно распознать
гексацианоферратом(II) калия:
Образуется темно-синий осадок (берлинская
лазурь).
• Получение металлов. Например золота: золотой
песок растворяется в растворе цианида натрия (NaCN)
в присутствии кислорода и воды, потому что
образуется очень устойчивое комплексное
соединение золота:
4Au + O2 + 2H2O + 8NaCN = 4Na[Au(CN)2]
+ 4NaOH.
Из полученного комплекса золото вытесняют
цинком:
Zn + 2Na[Au(CN)2] = Na2[Zn(CN)4] + 2Au.
Важнейшие органические соединения –
гемоглобин и хлорофилл – тоже соединения
комплексные (схему строения данных соединений
можно посмотреть в книге Л.А.Николаева «Металлы в
живых организмах» и др.) (рис. 3).
 |
Рис. 3.
|
Синтез многих лекарственных
препаратов, витаминов, биодобавок и многих
других веществ связан с комплексными
соединениями.
Л и т е р а т у р а
Гузей Л.С., Суровцева Р.П. Учебник. Химия. 10
класс. М.: Дрофа, 2002; Николаев Л.А. Металлы в
живых организмах. М.: Просвещение, 1983; Глинка Н.Л.
Общая химия. Л.: Химия, Ленингр. отд-ние, 1987; Хомченко
Г.П. Неорганическая химия. М.: Высшая школа, 1978;
Гликина Ф.Б., Ключников Н.Г. Химия комплексных
соединений. М.: Просвещение, 1982; Кукушкин Ю.Н.
Соединения высшего порядка. Л.: Химия. Ленингр.
отд-ние, 1991.
* В химии очень много
исключений. Вот и в комплексных соединениях есть
исключение – ион аммония, в котором
«координатором» является отрицательно
заряженный атом азота. Кроме того, существует еще
целая интересная группа соединений – карбонилы
металлов, в которых и комплексообразователь, и
лиганды (молекулы СО) не заряжены. Например,
карбонил железа
[Fe0(CO)5]0. – Прим. ред.
В.А.ЛУНЬКИНА,
учитель школы № 1
(р. п. Колышлей, Пензенская обл.)
-
Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу.
-
Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки).
Комплексообразователь – это d-элемент, имеющий на внешнем уровне достаточное количество свободных орбиталей (Cu+2, Ag+, Pt+4, Fe+2, Fe+3, Co+2, Co+3, Co+2)
Лиганды – это ионы и молекулы, имеющие свободные электронные пары (OH—, CN—, Cl—, NH3, H2O)
Координационное число (КЧ) — это число лигандов в комплексном ионе
Координационное число зависит:
-
от природы центрального атома;
-
заряда комплексообразователя;
-
условий образования комплексов.
Виды комплексов
Катионные
[Co(NH3)6]3+
Анионные
[CoF6]3-
Нейтральные
[Al (H2O)3(OH)3]
Соединения с комплексными анионами
K2[PtCl4] — тетрахлороплатинат (II) калия
Na2[Zn(OH)4] — тетрагидроксоцинкат натрия
Na[Cr(H2O)2F4] — тетрафтородиаквахромат (III) натрия
Соединения с комплексными катионами
[Ag(NH3)2]Cl – хлорид диамминсеребра
[Al(H2O)5OH]SO4 – сульфат гидроксопентаакваалюминия
[Pt(H2O)(NH3)2OH] NO3 – нитрат гидроксодиамминакваплатины (II)
Соединения без внешней сферы
[Al (H2O)3(OH)3] — тригидроксотриакваалюминий
[Pt(NH3)2Cl2] – дихлородиамминплатина (II)
[Co(NH3)3Cl3] – трихлоротриамминкобальт (III)
Номенклатура
-
в названиях комплексных ионов сначала указываются лиганды;
-
название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках);
-
в названиях комплексных катионов используются русские названия металлов;
-
в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат;
-
названия лигандов:
NH3 – аммин
H2O – аква
CO – карбонил
F— – фторо
Cl— – хлоро
CN— – циано
OH— – гидроксо
CNS— – тиоцианато
NO3— – нитрато
NO2— – нитро
-
Умножающие приставки:
2 — ди
3 – три
4 – тетра
5 – пента
6 – гекса
Примеры
K4[Fe(CN)6] – гексацианоферрат (II) калия (жёлтая кровяная соль)
K3[Fe(CN)6] – гексацианоферрат (III) калия (красная кровяная соль)
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия
[Ag(NH3)2]Cl – хлорид диамминсеребра (I)
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II)
[Cu(H2O)4]SO4 ∙ H2O – сульфат тетрааквамеди (II) (медный купорос)
Диссоциация ступенчатая
Na2[Zn(OH)4] →2Na+ + [Zn(OH)4]2-
(первая ступень – необратимо)
[Zn(OH)4]2- ↔ Zn2+ + 4OH—
(вторая ступень – обратимо)
Химические свойства солей
1. Взаимодействие растворов солей с металлами
Более активные металлы вытесняют из солей менее активные металлы:
Fe + CuSO4 → Cu + FeSO4
Железо является более активным металлом, чем медь, так как стоит левее в ряду активностей металлов, следовательно вытесняет медь из ее соли. Такие реакции протекают в растворах, следовательно, соли должны быть растворимыми.
Ag + CuSO4 → реакция не идет, так как серебро стоит правее меди в ряду активностей металлов и, следовательно, является более слабым металлом.
2. Соли вступают в реакции ионного обмена с щелочами:
Условия: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2
NaOH + NH4NO3 → NH3
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
3. Соли вступают в реакции ионного обмена с кислотами:
Условие: должен выделяться газ, выпадать осадок или образовываться более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2
AgNO3 + HCl → AgCl
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
4. Некоторые соли могут вступать в окислительно-восстановительные реакции.
1) Соли, проявляющие окислительные свойства: соли кислородсодержащих кислот галогенов (KClO3, KClO4 и др.), KMnO4, K2CrO7, нитраты (KNO3 и др) и некоторые другие.
2KClO3 + 3FeSO4 + 12KOH → 2KCl + 3K2FeO4 + 3K2SO4 + 6H2O
3KBrO4 + 8NH3 → 3KBr + 4N2 + 12H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
KNO3 + MnO2 + 2KOH → KNO2 + K2MnO4 + H2O
2FeCl3 + Fe → 3FeCl2
2) Соли, прявляющие восстановительные свойства: соли Fe+2, Cr+2, Cr+3, Sn+2, Cu+, K2S и сульфиды, K2SO3 и сульфиты и некоторые другие.
2CrCl2 + 4H2SO4(к) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
Cr2O3 + NaClO3 + 2K2CO3 → 2K2CrO4 + NaCl + 2CO2
Cu2S + 14HNO3(к) → H2SO4 + 2Cu(NO3)2 + 10NO2
3Na2S + K2Cr2O7 + 7H2SO4 → 3S
Na2SO3 + H2O2 → Na2SO4 + H2O
5. Химические свойства кислых солей
1) Реагируют с металлами:
2KНSO4 + Ca → CaSO4 + K2SO4 + H2
2NaHSO4 + Zn → ZnSO4 + Na2SO4 + H2
2) Реагируют с оксидами и гидроксидами металлов:
2KHSO4 + MgO → MgSO4 + K2SO4 + H2O
2KHSO4 + 2NaOH → K2SO4 + Na2SO4 + 2H2O
2KHSO4 + Cu(OH)2 → K2SO4 + CuSO4 + 2H2O
3) Реагирую с солями, если выделяется газ или образуется осадок:
2KHSO4 + CaCO3 → K2SO4 + CaSO4 + CO2
2KHSO4 + CaCl2 → CaSO4
KHS + Cu(NO3)2 → CuS
AgH2PO4 + NH4Br → AgBr
3NaHCO3 + AlCl3 → Al(OH)3
4) Реагируют с основаниями с образованием средних солей:
KНСO3 + KОН → K2СO3 + H2O
NaHCO3 + KOH → KNaCO3 + H2O
2KHCO3 + Ba(OH)2 → BaCO3
KHCO3 + Ba(OH)2(изб.) → BaCO3
3Mg(H2PO4)2 + 12KOH → Mg3(PO4)2
Mg(H2PO4)2 + 6KOH → Mg(OH)2
3NaH2PO4 + 3Ba(OH)2 → Ba3(PO4)2
2NaH2PO4 + 3Ba(OH)2 → Ba3(PO4)2
Ca(H2PO4)2 + 2Ca(OH)2 → Ca3(PO4)2
2NH4H2PO4 + 3Ba(OH)2 → Ba3(PO4)2

5) Реагируют с кислотами с образованием средних солей, если выделяется газ или образуется осадок:
NaHCO3 + HCl → NaCl + H2O + CO2
2KHS + H2SO4 → K2SO4 + 2H2S
6) Разлагаются при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O (t)
Mg(HCO3)2 → MgCO3 + CO2 + H2O (t)
2NaHCO3 → Na2CO3 + CO2 + H2O (t)
NH4HCO3 → NH3 + CO2+ H2O (t)
6. Химические свойства комплексных солей
1) Реагируют с CO2 и SO2 с образованием амфотерных гидроксидов (могут образовываться как средние, так и ксилые соли):
Na[Al(OH)4] + CO2 → NaHCO3 + Al(OH)3 или
2Na[Al(OH)4] + CO2 → Na2CO3 + 2Al(OH)3 + H2O
K3[Cr(OH)6]+ 3SO2 → 3KHSO3 + Cr(OH)3
2) Реагируют с кислотами (могут образовываться как средние, так и ксилые соли)
Na[Al(OH)4] + HCl → NaCl + Al(OH)3
K3[Cr(OH)6] + 3HNO3 → 3KNO3 + Cr(OH)3
K[Al(OH)4] + H2S(изб.) → KHS + Al(OH)3
Но:
K2[Zn(OH)4] + 3H2S → 2KHS + ZnS
3) Разлагаются при нагревании:
Na[Al(OH)4] → NaAlO2 + 2H2O (t)
K2[Zn(OH)4] → K2ZnO2 + 2H2O (t)
7. Разложение средних солей при нагревании
1) Нерастворимые карбонаты разлагаются при нагревании:
CaCO3 → CaO + CO2 (t)
FeCO3 → FeO + CO2 (t)
MgCO3 → MgO + CO2 (t)
2) Нитраты разлагаются при нагревании. Продукты зависят от положения металла в ряду активности металлов:
| MNO3 → MNO2 + O2 | M – металл, находящийся в ряду активности металлов левее Mg, исключая Li. |
| MNO3 → MO + NO2 + O2 | M – металл, находящийся в ряду активности металлов от Mg до Cu (Mg и Cu включительно), а также Li. |
| MNO3 → M + NO2 + O2 | M – металл, находящийся в ряду активности металлов правее Cu. |
3) Соли аммония разлагаются при нагревании:
NH4Cl → NH3 + HCl (t)
(NH4)3PO4 → 3NH3 + H3PO4(t)
(NH4)2CO3 → 2NH3 + CO2
Соли аммония азотной и азотистой кислот разлагаются с изменением степени окисления:
NH4NO3 → N2O + H2O (t)
NH4NO2 → N2 + H2O (t)
4) Термическое разложение кислородсодержащих солей хлора:
2KClO3 → 2KCl + 3O2
Правило 8. Соли слабой кислоты и амфотерного металла реагируют с оксидами щелочных металов, щелочами и карбонатами щелочных металлов:
ZnCO3(тв.) + K2O(тв.) → K2ZnO2 + CO2
ZnCO3(тв.) + 2KOH(тв.) → K2ZnO2 + CO2
ZnCO3(тв.) + K2CO3(тв.) → K2ZnO2 + 2CO2
Правило 9. Соли соединений Zn, Be и Al разлагаются водой, кислотами, хлоридом аммония:
NaAlO2 + 2H2O → Na[Al(OH)4]
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O (в избытке HCl)
NaAlO2 + HCl + H2O → NaCl + Al(OH)3 (в недостатке HCl)
NaAlO2 + NH4Cl + H2O → Al(OH)3 + NaCl + NH3