Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка).
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония:
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Автор: С.И. Широкопояс https://scienceforyou.ru/
Химические свойства солей
1. Взаимодействие растворов солей с металлами
Более активные металлы вытесняют из солей менее активные металлы:
Fe + CuSO4 → Cu + FeSO4
Железо является более активным металлом, чем медь, так как стоит левее в ряду активностей металлов, следовательно вытесняет медь из ее соли. Такие реакции протекают в растворах, следовательно, соли должны быть растворимыми.
Ag + CuSO4 → реакция не идет, так как серебро стоит правее меди в ряду активностей металлов и, следовательно, является более слабым металлом.
2. Соли вступают в реакции ионного обмена с щелочами:
Условия: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2
NaOH + NH4NO3 → NH3
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
3. Соли вступают в реакции ионного обмена с кислотами:
Условие: должен выделяться газ, выпадать осадок или образовываться более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2
AgNO3 + HCl → AgCl
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
4. Некоторые соли могут вступать в окислительно-восстановительные реакции.
1) Соли, проявляющие окислительные свойства: соли кислородсодержащих кислот галогенов (KClO3, KClO4 и др.), KMnO4, K2CrO7, нитраты (KNO3 и др) и некоторые другие.
2KClO3 + 3FeSO4 + 12KOH → 2KCl + 3K2FeO4 + 3K2SO4 + 6H2O
3KBrO4 + 8NH3 → 3KBr + 4N2 + 12H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
KNO3 + MnO2 + 2KOH → KNO2 + K2MnO4 + H2O
2FeCl3 + Fe → 3FeCl2
2) Соли, прявляющие восстановительные свойства: соли Fe+2, Cr+2, Cr+3, Sn+2, Cu+, K2S и сульфиды, K2SO3 и сульфиты и некоторые другие.
2CrCl2 + 4H2SO4(к) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
Cr2O3 + NaClO3 + 2K2CO3 → 2K2CrO4 + NaCl + 2CO2
Cu2S + 14HNO3(к) → H2SO4 + 2Cu(NO3)2 + 10NO2
3Na2S + K2Cr2O7 + 7H2SO4 → 3S
Na2SO3 + H2O2 → Na2SO4 + H2O
5. Химические свойства кислых солей
1) Реагируют с металлами:
2KНSO4 + Ca → CaSO4 + K2SO4 + H2
2NaHSO4 + Zn → ZnSO4 + Na2SO4 + H2
2) Реагируют с оксидами и гидроксидами металлов:
2KHSO4 + MgO → MgSO4 + K2SO4 + H2O
2KHSO4 + 2NaOH → K2SO4 + Na2SO4 + 2H2O
2KHSO4 + Cu(OH)2 → K2SO4 + CuSO4 + 2H2O
3) Реагирую с солями, если выделяется газ или образуется осадок:
2KHSO4 + CaCO3 → K2SO4 + CaSO4 + CO2
2KHSO4 + CaCl2 → CaSO4
KHS + Cu(NO3)2 → CuS
AgH2PO4 + NH4Br → AgBr
3NaHCO3 + AlCl3 → Al(OH)3
4) Реагируют с основаниями с образованием средних солей:
KНСO3 + KОН → K2СO3 + H2O
NaHCO3 + KOH → KNaCO3 + H2O
2KHCO3 + Ba(OH)2 → BaCO3
KHCO3 + Ba(OH)2(изб.) → BaCO3
3Mg(H2PO4)2 + 12KOH → Mg3(PO4)2
Mg(H2PO4)2 + 6KOH → Mg(OH)2
3NaH2PO4 + 3Ba(OH)2 → Ba3(PO4)2
2NaH2PO4 + 3Ba(OH)2 → Ba3(PO4)2
Ca(H2PO4)2 + 2Ca(OH)2 → Ca3(PO4)2
2NH4H2PO4 + 3Ba(OH)2 → Ba3(PO4)2

5) Реагируют с кислотами с образованием средних солей, если выделяется газ или образуется осадок:
NaHCO3 + HCl → NaCl + H2O + CO2
2KHS + H2SO4 → K2SO4 + 2H2S
6) Разлагаются при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O (t)
Mg(HCO3)2 → MgCO3 + CO2 + H2O (t)
2NaHCO3 → Na2CO3 + CO2 + H2O (t)
NH4HCO3 → NH3 + CO2+ H2O (t)
6. Химические свойства комплексных солей
1) Реагируют с CO2 и SO2 с образованием амфотерных гидроксидов (могут образовываться как средние, так и ксилые соли):
Na[Al(OH)4] + CO2 → NaHCO3 + Al(OH)3 или
2Na[Al(OH)4] + CO2 → Na2CO3 + 2Al(OH)3 + H2O
K3[Cr(OH)6]+ 3SO2 → 3KHSO3 + Cr(OH)3
2) Реагируют с кислотами (могут образовываться как средние, так и ксилые соли)
Na[Al(OH)4] + HCl → NaCl + Al(OH)3
K3[Cr(OH)6] + 3HNO3 → 3KNO3 + Cr(OH)3
K[Al(OH)4] + H2S(изб.) → KHS + Al(OH)3
Но:
K2[Zn(OH)4] + 3H2S → 2KHS + ZnS
3) Разлагаются при нагревании:
Na[Al(OH)4] → NaAlO2 + 2H2O (t)
K2[Zn(OH)4] → K2ZnO2 + 2H2O (t)
7. Разложение средних солей при нагревании
1) Нерастворимые карбонаты разлагаются при нагревании:
CaCO3 → CaO + CO2 (t)
FeCO3 → FeO + CO2 (t)
MgCO3 → MgO + CO2 (t)
2) Нитраты разлагаются при нагревании. Продукты зависят от положения металла в ряду активности металлов:
| MNO3 → MNO2 + O2 | M – металл, находящийся в ряду активности металлов левее Mg, исключая Li. |
| MNO3 → MO + NO2 + O2 | M – металл, находящийся в ряду активности металлов от Mg до Cu (Mg и Cu включительно), а также Li. |
| MNO3 → M + NO2 + O2 | M – металл, находящийся в ряду активности металлов правее Cu. |
3) Соли аммония разлагаются при нагревании:
NH4Cl → NH3 + HCl (t)
(NH4)3PO4 → 3NH3 + H3PO4(t)
(NH4)2CO3 → 2NH3 + CO2
Соли аммония азотной и азотистой кислот разлагаются с изменением степени окисления:
NH4NO3 → N2O + H2O (t)
NH4NO2 → N2 + H2O (t)
4) Термическое разложение кислородсодержащих солей хлора:
2KClO3 → 2KCl + 3O2
Правило 8. Соли слабой кислоты и амфотерного металла реагируют с оксидами щелочных металов, щелочами и карбонатами щелочных металлов:
ZnCO3(тв.) + K2O(тв.) → K2ZnO2 + CO2
ZnCO3(тв.) + 2KOH(тв.) → K2ZnO2 + CO2
ZnCO3(тв.) + K2CO3(тв.) → K2ZnO2 + 2CO2
Правило 9. Соли соединений Zn, Be и Al разлагаются водой, кислотами, хлоридом аммония:
NaAlO2 + 2H2O → Na[Al(OH)4]
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O (в избытке HCl)
NaAlO2 + HCl + H2O → NaCl + Al(OH)3 (в недостатке HCl)
NaAlO2 + NH4Cl + H2O → Al(OH)3 + NaCl + NH3
Общая формула соли М
n
Ac
m
, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Средними солями
называют продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Например, H
3
PO
4
– Na
3
PO
4
;
Cu(OH)
2
– CuSO
4
.
Кислыми солями
называют продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Например, H
2
SO
4
– NaHSO
4
,
H
3
PO
4
– Na
2
HPO
4
– NaH
2
PO
4
.
Основными солями
называют продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными остатками.
Например, Ca(OH)
2
– CaOHCl;
Fe(OH)
3
– Fe(OH)
2
Cl – FeOHCl
2
.
Кислые соли вступают в реакции с щелочами с образованием средних солей.
KHCO
3
+ KOH = K
2
CO
3
+ H
2
O
Некоторые кислые соли, например, угольной кислоты разлагаются под действием более сильных кислот:
KHCO
3
+ HCl = KCl + CO
2
+ H
2
O
Основные соли вступают в реакции с кислотами:
Cu(OH)Cl + HCl = CuCl
2
+ H
2
O
Свойства комплексных солей (способы разрушения комплексных солей)
1) Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами. При действии избытка сильной кислоты получается две средних соли и вода. При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода, например:
K
3
[Al(OH)
6
] + 3HCl = 3KCl + Al(OH)
3
↓ + 3H
2
O
K
3
[Al(OH)
6
] + 6HClизб = 3KCl + AlCl
3
+ 6H
2
O
K
2
[Zn(OH)
4
] + 2HBr = 2KBr + Zn(OH)
2
↓ + 2H
2
O
K
2
[Zn(OH)
4
] + 4HBr изб = 2KBr + ZnBr
2
+ 4H
2
O
K
3
[Cr(OH)
6
] + 6HNO
3
изб
.
= 3KNO
3
+ Cr(NO
3
)
3
+ 6H
2
O
2) При нагревании комплексные соли теряют воду:
K[Al(OH)
4
] = KAlO
2
+ 2H
2
O
K
3
[Cr(OH)
6
] = KCrO
2
+ 2H
2
O + 2KOH
3) При действии углекислого газа, сернистого газа или сероводорода получается соль активного металла и амфотерный гидроксид:
Na[Al(OH)
4
] + CO
2
= NaHCO
3
+ Al(OH)
3
↓
K
3
[Cr(OH)
6
]+ 3SO
2
= 3KHSO
3
+ Cr(OH)
3
↓
Na[Al(OH)
4
] + H
2
S = NaHS + Al(OH)
3
↓+ H
2
O
4) При действии солей, образованных катионами Fe
3+
, Al
3+
и Cr
3+
происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла:
3Na[Al(OH)
4
] + FeCl
3
= 3Al(OH)
3
↓ + Fe(OH)
3
↓ + 3NaCl
K
3
[Cr(OH)
6
] + Al(NO
3
)
3
= Al(OH)
3
↓
+ Cr(OH)
3
↓+ 3KNO
3
-
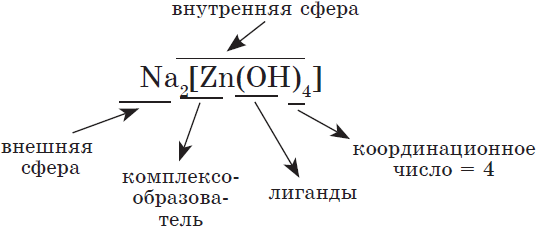
Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу.
-
Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки).
Комплексообразователь – это d-элемент, имеющий на внешнем уровне достаточное количество свободных орбиталей (Cu+2, Ag+, Pt+4, Fe+2, Fe+3, Co+2, Co+3, Co+2)
Лиганды – это ионы и молекулы, имеющие свободные электронные пары (OH—, CN—, Cl—, NH3, H2O)
Координационное число (КЧ) — это число лигандов в комплексном ионе
Координационное число зависит:
-
от природы центрального атома;
-
заряда комплексообразователя;
-
условий образования комплексов.
Виды комплексов
Катионные
[Co(NH3)6]3+
Анионные
[CoF6]3-
Нейтральные
[Al (H2O)3(OH)3]
Соединения с комплексными анионами
K2[PtCl4] — тетрахлороплатинат (II) калия
Na2[Zn(OH)4] — тетрагидроксоцинкат натрия
Na[Cr(H2O)2F4] — тетрафтородиаквахромат (III) натрия
Соединения с комплексными катионами
[Ag(NH3)2]Cl – хлорид диамминсеребра
[Al(H2O)5OH]SO4 – сульфат гидроксопентаакваалюминия
[Pt(H2O)(NH3)2OH] NO3 – нитрат гидроксодиамминакваплатины (II)
Соединения без внешней сферы
[Al (H2O)3(OH)3] — тригидроксотриакваалюминий
[Pt(NH3)2Cl2] – дихлородиамминплатина (II)
[Co(NH3)3Cl3] – трихлоротриамминкобальт (III)
Номенклатура
-
в названиях комплексных ионов сначала указываются лиганды;
-
название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках);
-
в названиях комплексных катионов используются русские названия металлов;
-
в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат;
-
названия лигандов:
NH3 – аммин
H2O – аква
CO – карбонил
F— – фторо
Cl— – хлоро
CN— – циано
OH— – гидроксо
CNS— – тиоцианато
NO3— – нитрато
NO2— – нитро
-
Умножающие приставки:
2 — ди
3 – три
4 – тетра
5 – пента
6 – гекса
Примеры
K4[Fe(CN)6] – гексацианоферрат (II) калия (жёлтая кровяная соль)
K3[Fe(CN)6] – гексацианоферрат (III) калия (красная кровяная соль)
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия
[Ag(NH3)2]Cl – хлорид диамминсеребра (I)
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II)
[Cu(H2O)4]SO4 ∙ H2O – сульфат тетрааквамеди (II) (медный купорос)
Диссоциация ступенчатая
Na2[Zn(OH)4] →2Na+ + [Zn(OH)4]2-
(первая ступень – необратимо)
[Zn(OH)4]2- ↔ Zn2+ + 4OH—
(вторая ступень – обратимо)
Химические свойства солей: средних, кислых, основных, комплексных
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Номенклатура солей
Названия солей кислородсодержащих кислот состоят из двух слов: названия иона, образованного кислотным остатком, в именительном падеже и названия иона металла — в родительном. Названия ионов кислотных остатков составляются, в свою очередь, из корней названий элементов с суффиксами -ат для высшей степени окисления и -ит для низшей степени окисления атомов элемен — та-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты $HNO_3$ называются нитратами: $KNO_3$ — нитрат калия, а соли азотистой кислоты $HNO_2$ — нитритами: $Ca(NO_2)_2$ — нитрит кальция. Если же металл проявляет различные степени окисления, то они указываются в скобках римской цифрой, например: $Fe^{2+}SO_4$ — сульфат железа (II) и $Fe_2^{3+}(SO_4)_3$ — сульфат железа (III).
Номенклатура солей.
| Название кислоты | Формула | Название солей | Формула (пример) |
| Азотистая | $HNO_2$ | Нитриты | $KNO_2$ |
| Азотная | $HNO_3$ | Нитраты | $Al(NO_3)_3$ |
| Хлороводородная (соляная) | $ HCl$ | Хлориды | $FeCl_3$ |
| Сернистая | $ H_2SO_3$ | Сульфиты | $K_2SO_3$ |
| Серная | $H_2SO_4$ | Сульфаты | $Na_2SO_4$ |
| Сероводородная | $H_2S$ | Сульфиды | $FeS$ |
| Фосфорная | $H_3PO_4$ | Фосфаты | $Ca_3(PO_4)_2$ |
| Угольная | $H_2CO_3$ | Карбонаты | $CaCO_3$ |
| Кремниевая | $H_2SiO_3$ | Силикаты | $Na_2SiO_3$ |
Растворимость солей
По растворимости в воде соли делятся на растворимые ($Р$), нерастворимые ($Н$) и малорастворимые ($М$). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
- Растворимы все соли азотной кислоты — нитраты.
- Растворимы все соли соляной кислоты — хлориды, кроме $AgCl (Н), PbCl_2 (М)$.
- Растворимы все соли серной кислоты — сульфаты, кроме $BaSO_4 (Н), PbSO_4 (Н)$.
- Растворимы соли натрия и калия.
- Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей для $Na^{+}$ и $K^{+}$.
Классификация солей
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
$Na_2CO_3$ — карбонат натрия,
$CuSO_4$ — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
$Na_2CO_3=2Na^{+}+CO_2^{2-}$.
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят, например, питьевую соду $NaHCO_3$, которая состоит из катиона металла $Na^{+}$ и кислотного однозарядного остатка $HCO_3^{−}$. Для кислой кальциевой соли формула записывается так: $Ca(HCO_3)_2$.
Названия этих солей складываются из названий средних солей с прибавлением приставки гидро-, например:
$Mg(HSO_4)_2$ — гидросульфат магния.
Диссоциируют кислые соли следующим образом:
$NaHCO_3=Na^{+}+HCO_3^{-}$,
$Mg(HSO_4)_2=Mg^{2+}+2HSO_4^{-}$.
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например, к таким солям относится знаменитый малахит $(CuOH)_2CO_3$, о котором вы читали в сказках П. Бажова. Он состоит из двух основных катионов $CuOH^{+}$ и двухзарядного аниона кислотного остатка $CO_3^{2−}$.
Катион $CuOH^{+}$ имеет заряд $+1$, поэтому в молекуле два таких катиона и один двухзарядный анион $CO_3^{2−}$ объединены в электронейтральную соль.
Названия этих солей такие же, как и у нормальных солей, но с прибавлением приставки гидроксо-, $(CuOH)_2CO_3$ — гидро ксокарбонат меди (II) или $AlOHCl_2$ — гидроксо хлорид алюминия. Большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
$AlOHCl_2=AlOH^{2+}+2Cl^{–}$.
Свойства солей
Типичные реакции солей.
1. Соль + кислота ${→}↙{text»(реакция обмена)»}$ другая соль + другая кислота.
2. Соль + щелочь ${→}↙{text»(реакция обмена)»}$ другая соль + другое основание.
3. ${Соль_1 + соль_2 → соль_3 + соль_4}↙{text»(реакция обмена: в реакцию вступают две соли, в результате ее получаются две другие соли)»}$.
4. Соль + металл ${→}↙{text»(реакция замещения)»}$ другая соль + другой металл.
Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
а) $Ca(NO_3)_2+Na_2CO_3=CaCO_3↓+2NaNO_3$
или $Ca^{2+}+CO_2^{2-}=CaCO_3↓$;
б) $K_2SO_4+BaCl_2=2KCl+BaSO_4↓$
или $SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов.
Второе правило ряда напряжений: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило соблюдается при выполнении следующих условий:
а) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
б) металлы не должны взаимодействовать с водой, по этому металлы главных подгрупп I и II групп (для последней начиная с $Са$) не вытесняют другие металлы из растворов солей.
Комплексные соединения
При взаимодействии со щелочами амфотерных оксидов и гидроксидов в растворе образуются комплексные соли, состав которых может быть отражен формулой
${Na[Al(OH)_4^{–}]}↙{text»тетрагидроксоалюминат натрия»}$.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовывалась по донорно-акцепторному механизму.
В переводе с латинского complexus означает «сочетание». Действительно, очень многие комплексные соединения получают из двух или трех веществ, например:
$NH_3 + HCl = {[NH_4]Cl}↙{text»соль аммония»}$,
$C_6H_5NH_2 + HCl = {[C_6H_5NH_3]}↙{text»соль амина»}$.
Малорастворимый гидроксид алюминия под воздействием гидроксид-ионов $ОН^{–}$ переходит в раствор в виде иона $[Al(OH)_4]^{–}$:
$Al(OH)_3 + OH^{–} = [Al(OH)_4]^{–}$.
Комплексные, или, как их еще называют, координационные соединения, построены так: в центре находится атом или ион (он называется комплексообразователем), а вокруг него — атомы, молекулы или ионы, образовавшие с ним ковалентные связи по донорно-акцепторному механизму (называются лигандами). Это могут быть анионы кислот, молекулы небольшого размера ($H_2O, NH_3, CO$), имеющие атомы с неподеленными электронными парами.
Общее число лигандов, непосредственно связанных с центральным атомом, называется координационным числом. Последнее изменяется от $1$ до $12$ (но чаще атом образует внутреннюю сферу комплекса (ее заключают в квадратные скобки). Внешняя сфера состоит из ионов, не связанных непосредственно с комплексообразователем. Внутренняя сфера участвует в химических реакциях как один многоатомный ион, внешняя сфера — как обычные ионы.
Например, строение тетрагидроксоалюмината натрия:
и уравнение его диссоциации:
$Na_2[Zn(OH)_4]→2Na^{+}+[Zn(OH)_4]^{2–}$.
Комплексные соединения играют большую роль в жизнедеятельности живых организмов. Почти все ферменты, гормоны, хлорофилл растений и гемоглобин животных, лекарства представляют собой комплексные соединения.