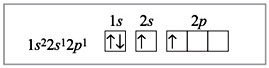
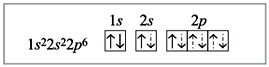
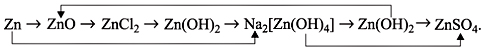
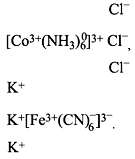Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
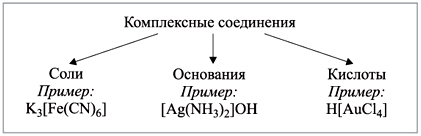
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
3 ноября 2021
В закладки
Обсудить
Жалоба
Комплексные (координационные) соединения
Презентация предназначена для изучения материала по теме «Комплексные соединения» на углубленном уровне в 11 классе.
Комплексные соединения (КС) – это вещества, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе.
kompleks-s.pptx
kompleks-s.pdf
Автор: Плис Татьяна Фёдоровна.
Наверх
Как известно, металлы имеют свойство терять электроны и, тем самым, образовывать катионы. Положительно заряженные ионы металлов могут находиться в окружении анионов или нейтральных молекул, образуя частицы, называемые комплексными и способные к самостоятельному существованию в кристалле или растворе. А соединения, содержащие в узлах своих кристаллов комплексные частицы, называются комплексными соединениями.
Подробнее >>
В настоящее время образование и свойства комплексных соединений объясняют с точки зрения теории метода валентных связей (ВС), теории кристаллического поля (ТКП) и теории молекулярных орбиталей (МО). Далее кратко на примерах рассмотрим каждую из теорий.
Подробнее >>
Изомеры – соединения, имеющие одинаковый химический состав, но при этом отличающиеся физическими или химическими свойствами. Это отличие возникает в связи с различным положением одних и тех же групп атомов в изомерных соединениях. Для комплексных соединений характерно несколько видов изомерии. Рассмотрим их.
Подробнее >>
При получении растворов комплексных соединений, происходит их диссоциация на ионы внутренней и внешней сферы. После отщепления внешней сферы (первичная диссоциация), обратимой диссоциации подвергается внутренняя сфера (вторичная диссоциация): [MLn] ↔ M + nL Заряды для упрощения опущены, а ионы представлены в негидрированном виде. Диссоциация комплекса протекает ступенчато, т.е. лиганды удаляются из внутренней сферы последовательно один за другим.
Подробнее >>
Получение комплексных соединений Комплексные соединения можно получить различными способами: 1. В результате реакций соединения: HgI2 + 2KI (изб.) = K2[HgI4] 2. По реакции замещения лиганда во внутренней сфере: Некоторые комплексы способны к быстрому замещению лигандов. Такие комплексы называются лабильными. У других же этот процесс происходит очень медленно – это инертные комплексы.
Подробнее >>
Здесь приведены задачи к разделу Комплексные соединения: структура, классификация, номенклатура комплексных соединений, а также их устойчивость и химические свойства.
Подробнее >>
2
Комплексные соединения
Комплексные соединения – большой класс неорганических веществ. В составе комплексных соединений выделяют центральный атом –комплексообразователь, роль которого выполняет ион или нейтральный атом металла побочной подгруппы. С комплексообразователем связаны донорно-акцепторной связью различные ионы или нейтральные молекулы, которые называются лигандами (или аддендами). Комплексообразователь и лиганды образуют внутреннюю среду комплексного соединения, устойчивую как в кристаллическом веществе, так и в растворе.
Строение комплексных соединений
Представления о координационном строении комплексных соединений дает теория Вернера А. (1891г. швейцарский химик). По этой теории в комплексных соединениях имеется правильное геометрическое расположение лигандов вокруг центрального атома или иона. Лиганды могут образовать квадрат, тетраэдр, куб, пирамиду и т.д. Комплексные соединения состоят из внутренней и внешней среды. Во внутреннюю среду входят комплексообразователь и лиганды, образуя комплексную частицу. Заряд ее определяется как алгебраическая сумма зарядов составных частей. Комплексная частица в формуле заключена в квадратные скобки:
Например, [Pt(NH3)4]2+ [Fe(CO)5]0
Здесь Pt2+ и Fe0 – комплексообразователи, а NH3 и CO – лиганды. Число лигандов, связанное с комплексообразователем, называется координационным числом (к.ч.). Чаще всего к.ч. равно 4 или 6, но может быть меньше 6 (2), и больше (max=12).
Внутренняя среда комплекса Pt имеет заряд +2, а комплекс железа – нейтрален. Заряд внутренней сферы комплекса нейтрализуется противоположно заряженной внешней сферой [Pt(NH3)4]SO4 ; K3[Fe(CN)6]
В первом случае во внешней сфере катионы SO42-, а во втором – катионы калия К+, связаны с комплексом ионной связью. Если комплексная частица нейтральна, внешняя среда отсутствует.
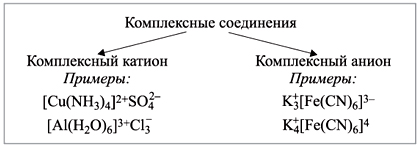
Классификация комплексных соединений
-
Комплексные электролиты и неэлектролиты.
Комплексные соединения, имеющие внутренние и внешние сферы, являются электролитами и диссоциируют на ионы:
K3[Fe(CN)6] [Fe(CN)6]3-
Нейтральные комплексы – неэлектролиты.
-
Классификация комплексов по заряду комплексного иона.
|
катионные |
анионные |
Нейтральные |
|
[Ag+1(NH3)2]Cl |
K3[Al3+(OH)6] |
[Pt2+(NH3)2Cl2] |
-
Классификация комплексов по природе лигандов.
а) аммиачные комплексы
[Cu(NH3)4]SO4
б) аквакомплексы
[Cu(H2O)4]SO4
В) смешанные комплексы
K2[PtCl2Br2]
Г) комплексные кислоты, основания, соли.
H4[Fe(CN)6] – кислота
[Pt(NH3)4](OH)2 – основания
K4[Fe(CN)6] – соль
Номенклатура комплексных соединений
Для составления названия комплексного соединения существуют следующие правила:
-
В названии комплексной частицы сначала лиганды, потом комплексообразователь.
-
Количество лигандов обозначается греческими числительными: моно(1), ди (2), три (3), тетра (4), пета (5), гекса (6), Гента (7), окта (8). Моно – обычно опускается.
-
Названия лигандов – нейтральных молекул – берут без изменения, за исключением NH3 – амин; Н2О – аква; СО – карбонил. К названиям анионов добавляют букву «О» (хлоро, нитрато и т. д.).
-
Комплексообразователь называют латинским названием элементов.
-
К названиям комплексообразователя в анионных комплексах добавляют окончание – ат: [Fe(CN)6]4 – гексацианоферрат.
-
Степень окисления комплексообразователя обозначают римской цифрой в скобках после названия.
-
Если имеется несколько лигандов, то сначала называют заряженные лиганды, потом нейтральные.
[CO(NH3)3(NO2)3] – тринитротриамминкобальт (III)
K4[Fe(CN)6] – гексацианоферрат (II) калия
[Zn(H2O)4](NO3)2 – нитрат тетрааквацинка (III)
Природа химической связи в комплексных соединениях
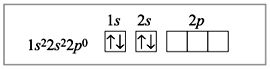
Образование комплексных соединений происходит по донорно-акцепторному механизму, где ион комплексообразователя акцептор, а лиганды – доноры.
Например: СО3+
СО27 – 1s22s22p63s23p64s23d7
3d7 4s2 4p




3d6 4s0 4p




CO3+
При возбуждении электроны способны к спариванию.
3d 4s 4p





СО3+
Остается 6 свободных орбиталей, которые способны образовывать связи с молекулами или ионами, имеющими свободные электронные пары.
3d 4s 4p





NH3 NH3 NH3 NH3 NH3 NH3
Происходит гибридизация d2sp3, образуя 6 гибридных орбиталей, образующих октаэдр.
Диссоциация комплексных соединений
-
Первичная диссоциация – на внешнюю и внутреннюю сферы.
K3[Fe(CN)6] 3K+ + [Fe(CN)6]3-
[Cu(NH3)4]SO4 [Cu(NH3)4]2+ + SO42 –
-
Вторичная (частичная) диссоциация комплексных ионов. Характеризуется константой нестойкости комплексных соединений.
[Fe(CN)6]3+ Fe3+ + 6KN—
C Fe 3+ C6 KN —
= 10 -31
K =
C [Fe(CN)6] 3-
Чем меньше К нестойкости, тем устойчивее комплексный ион.
Чтобы поделиться, нажимайте
Координационные (комплексные) соединения относятся к многочисленному классу соединений, в состав которых могут входить как неорганические, так и органические соединения в виде нейтральных или заряженных чатиц. По своей многочисленности они занимают второе место после органических соединений.
К координационным относят любое соединение, образованное присоединением одного или нескольких ионов или молекул к одному или более ионам или молекулам. Поэтому такое известное соединение как нашатырь NH4Cl относится к координационным, в котором роль центрального атома играет азот. Формально такие анионы как можно считать координационными: тетрагидроборат (III), тетраоксосульфат (VI), гексафторосиликат (IV).
Современная координационная химия связана с именем швейцарского химика А. Вернера, сформулировавшего основные положения координационной теории (1893 г.).
Координационными называют соединения, содержащие в одном из агрегатных состояний группу ионов или нейтральных молекул (лигандов), в определенном порядке размещенных (координированных) вокруг атома (иона) – комплексообразователя.
Система комплексообразователь–лиганды называется внутренней координационной сферой, обычно отделяемой квадратными скобками от внешней координационной сферы: K4[Fe(CN)6], [Cr(NH3)6]Cl3, [PtCl2(NH3)2], [Cr(CO)6].
Формула координационного иона или молекулы записывается, как правило, слева направо в следующей последовательности: центральный атом (ион), анионные, затем нейтральные лиганды с указанем их числа в виде правого нижнего индекса: [MLmXn]q.
Координационные соединения бывают катионные [Cr(NH3)]Cl3, анионные K4[Fe(CN)6], катион-анионные [Cr(NH3)6] [Fe(CN)6] и нейтральные [PtCl2(NH3)2].
Название координационного соединения электролита начинается с аниона, употребляемого в именительном падеже, затем следует название катиона в родительном падеже. Число лигандов каждого вида обозначается греческими приставками ди-, три-, тетра-, пента-, гекса-. Название комплексного аниона составляется из перечисления лигандов, корня латинского наименования центрального атома и суффикса -ат; в скобках римской цифрой обозначается степень его окисления или заряд координационного иона: K2[CuCl4] – тетрахлорокупрат (II) калия; в комплексном катионе металлу-комплексообразователю дается русское название: [Cr(H2O)6]Cl3 – хлорид гексааквахрома (III). Название координационной частицы начинается с перечисления лигандов в алфавитном порядке в последовательности, обратной записи (справа налево). Лиганды сохраняют обычные названия, к анионным лигандам добавляется суффикс «-о», (CH3COO– – ацетато-, F– – фторо-, OH– – гидроксо-), кроме NH3 – аммин-, H2O – аква-, CO – карбонил-, NO – нитрозил-. Например: [Co(NO2)2(NH3)4]Cl – хлорид тетрамминдинитритокобальта(III), [PtCl4(H2O)2] – диакватетрахлорплатина (IV), [Cr(NH3)6][Fe(CN)6] – гексацианоферрат (III) гексамминхрома (III), K3[AlF6] – гексафтороалюминат (III) калия или гексафтороалюминат (III–) калия.
Важнейшим параметром комплексообразователя и всего координационного соединения является координационное число (кч), которое наряду со степенью окисления в комплексных соединений служит еще одной его характеристикой.
Координационным числом называют число атомов лигандов, непосредственно присоединенных к центральному атому. Лиганды характеризуются дентатностью (от английского «dent» – зуб). К лигандам, способным занимать только одно координационное место (монодентатным), относятся H2O, NH3, C5H5N – пиридин (py), другие полярные молекулы (PPh3), однозарядные анионы CN–, Hal–, OH– и т. п. Некоторые лиганды могут занимать более одного координационного места, если содержат два и более донорных (со свободной электронной парой) атома. Такие лиганды называют многодентатными: NH2–CH2–CH2–NH2 (en) – этилендиамин, NH2–CH2–COO– (gly) – глицинат.
С учетом дентатности координационное число атома-комплексообразователя равно произведению числа лигандов во внутренней координационной сфере комплекса на их дентатность.
Комплексные соединения
Занятие, представленное на конкурс «Я иду на
урок», я провожу в 11-м биолого-химическом классе,
где на изучение химии отводится 4 часа в неделю.
Тему «Комплексные соединения» я взяла,
во-первых, потому что эта группа веществ имеет
исключительно большое значение в природе;
во-вторых, многие задания ЕГЭ включают понятие о
комплексных соединениях; в-третьих, учащиеся из
этого класса выбирают профессии, связанные с
химией, и будут встречаться с группой
комплексных соединений в будущем.
Цель. Сформировать понятие о составе,
классификации, строении и основах номенклатуры
комплексных соединений; рассмотреть их
химические свойства и показать значение;
расширить представления учащихся о многообразии
веществ.
Оборудование. Образцы комплексных
соединений.
План урока
I. Организационный момент.
II. Изучение нового материала (лекция).
III. Подведение итогов и постановка домашнего
задания.
План лекции
1. Многообразие веществ.
2. Координационная теория А.Вернера.
3. Строение комплексных соединений.
4. Классификация комплексных соединений.
5. Природа химической связи в комплексных
соединениях.
6. Номенклатура комплексных соединений.
7. Химические свойства комплексных соединений.
8. Значение комплексных соединений.
ХОД УРОКА
I. Организационный момент
II. Изучение нового материала
Многообразие веществ
Мир веществ многообразен, и мы уже знакомы с
группой веществ, которые принадлежат к
комплексным соединениям. Данными веществами
стали заниматься с XIX в., но понять их строение с
позиций существовавших представлений о
валентности было трудно.
Координационная теория А.Вернера
В 1893 г. швейцарским химиком-неоргаником
Альфредом Вернером (1866–1919) была сформулирована
теория, позволившая понять строение и некоторые
свойства комплексных соединений и названная координационной
теорией*. Поэтому
комплексные соединения часто называют
координационными соединениями.
Соединения, в состав которых входят сложные
ионы, существующие как в кристалле, так и в
растворе, называются комплексными, или
координационными.
Строение комплексных соединений
Согласно теории Вернера центральное положение
в комплексных соединениях занимает, как правило,
ион металла, который называют центральным ионом,
или комплексообразователем.
Комплексообразователь – частица (атом,
ион или молекула), координирующая (располагающая)
вокруг себя другие ионы или молекулы.
Комплексообразователь обычно имеет
положительный заряд, является d-элементом,
проявляет амфотерные свойства, имеет
координационное число 4 или 6. Вокруг
комплексообразователя располагаются
(координируются) молекулы или кислотные
остатки – лиганды (адденды).
Лиганды – частицы (молекулы и ионы),
координируемые комплексообразователем и
имеющие с ним непосредственно химические связи
(например, ионы: Cl–, I–, NO3–,
OH–; нейтральные молекулы: NH3, H2O,
CO).
Лиганды не связаны друг с другом, так как между
ними действуют силы отталкивания. Когда
лигандами являются молекулы, между ними возможно
молекулярное взаимодействие. Координация
лигандов около комплексообразователя является
характерной чертой комплексных соединений (рис.
1).
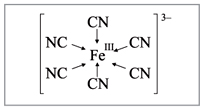 |
Рис. 1. Координация цианид-ионов
|
Координационное число – это
число химических связей, которые
комплексообразователь образует с лигандами.
![Рис. 2. Тетраэдрическая структура иона [AlBr4]–](https://him.1sept.ru/2009/08/28-3.jpg) |
Рис. 2. Тетраэдрическая структура иона
|
Значение координационного числа
комплексообразователя зависит от его природы,
степени окисления, природы лигандов и условий
(температура, концентрация), при которых
протекает реакция комплексообразования.
Координационное число может иметь значения от 2
до 12. Наиболее распространенными являются
координационные числа 4 и 6. Для координационного
числа 4 структура комплексных частиц может быть
тетраэдрической [AlBr4]– (рис. 2) и в виде
плоского квадрата [Pt(NH3)2Cl2] (рис.
3). Комплексные соединения с координационным
числом 6 имеют октаэдрическое строение [AlF6]3–
(рис. 4).
![Рис. 3. Соединение [Pt(NH3)2Cl2] со структурой плоского квадрата](https://him.1sept.ru/2009/08/28-2.jpg) |
Рис. 3. Соединение [Pt(NH3)2Cl2]
|
![Рис. 4. Ион [AlF6]3– октаэдрического строения](https://him.1sept.ru/2009/08/28-4.jpg) |
Рис. 4. Ион [AlF6]3–
|
Комплексообразователь и окружающие
его лиганды составляют внутреннюю сферу
комплекса. Частица, состоящая из
комплексообразователя и окружающих лигандов,
называется комплексным ионом. При изображении
комплексных соединений внутреннюю сферу
(комплексный ион) ограничивают квадратными
скобками. Остальные составляющие комплексного
соединения расположены во внешней сфере (рис.
5).
Суммарный заряд ионов внешней сферы должен
быть равен по значению и противоположен по знаку
заряду комплексного иона:
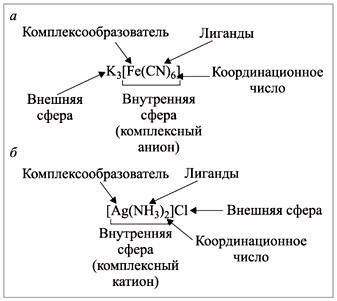 |
Рис. 5. Пояснения к изображению формул
|
Заряд комплексного иона легко
подсчитать, зная степень окисления составляющих
его частей.
Классификация комплексных
соединений
Большое многообразие комплексных соединений и
их свойств не позволяет создать единую
классификацию. Однако можно группировать
вещества по некоторым отдельным признакам.
1) По составу.
2) По типу координируемых лигандов.
а) Аквакомплексы – это комплексные
катионы, в которых лигандами являются молекулы H2O.
Их образуют катионы металлов со степенью
окисления +2 и больше, причем способность к
образованию аквакомплексов у металлов одной
группы периодической системы уменьшается сверху
вниз.
Примеры аквакомплексов:
[Al(H2O)6]Cl3, [Cr(H2O)6](NO3)3.
б)Гидроксокомплексы – это комплексные
анионы, в которых лигандами являются
гидроксид-ионы OH–.
Комплексообразователями являются металлы,
склонные к проявлению амфотерных свойств – Be,
Zn, Al, Cr.
Например: Na[Al(OH)4], Ba[Zn(OH)4].
в) Аммиакаты – это комплексные катионы, в
которых лигандами являются молекулы NH3.
Комплексообразователями являются d-элементы.
Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl.
г) Ацидокомплексы – это комплексные
анионы, в которых лигандами являются анионы
неорганических и органических кислот.
Например: K3[Al(C2O4)3], Na2[Zn(CN)4],
K4[Fe(CN)6].
3) По заряду внутренней сферы.
Природа химической связи в
комплексных соединениях
Во внутренней сфере между
комплексообразователем и лигандами существуют
ковалентные связи, образованные в том числе и по
донорно-акцепторному механизму. Для образования
таких связей необходимо наличие свободных
орбиталей у одних частиц (имеются у
комплексообразователя) и неподеленных
электронных пар у других частиц (лиганды). Роль
донора (поставщика электронов) играет лиганд, а
акцептором, принимающим электроны, является
комплексообразователь. Донорно-акцепторная
связь возникает как результат перекрывания
свободных валентных орбиталей
комплексообразователя с заполненными
орбиталями донора.
Между внешней и внутренней сферой существует
ионная связь. Приведем пример.
Электронное строение атома бериллия:
Электронное строение атома бериллия в
возбужденном состоянии:
Электронное строение атома бериллия в
комплексном ионе [BeF4]2–:
Пунктирными стрелками показаны электроны
фтора; две связи из четырех образованы по
донорно-акцепторному механизму. В данном случае
атом Be является акцептором, а ионы фтора –
донорами, их свободные электронные пары
заполняют гибридизованные орбитали (sp3-гибридизация).
Номенклатура комплексных
соединений
Наибольшее распространение имеет
номенклатура, рекомендованная IUPAC. Название комплексного
аниона начинается с обозначения состава
внутренней сферы: число лигандов обозначается
греческими числительными: 2–ди, 3–три, 4–тетра,
5–пента, 6–гекса и т.д., далее следуют названия
лигандов, к которым прибавляют соединительную
гласную «о»: Cl– – хлоро-, CN– –
циано-, OH– – гидроксо- и т.п. Если у
комплексообразователя переменная степень
окисления, то в скобках римскими цифрами
указывают его степень окисления, а его название с
суффиксом -ат: Zn – цинкат, Fe – феррат(III),
Au – аурат(III). Последним называют катион
внешней сферы в родительном падеже.
Примеры:
K3[Fe(CN)6] – гексацианоферрат(III)
калия,
K4[Fe(CN)6] – гексацианоферрат(II)
калия,
K2[Zn(OH)4] – тетрагидроксоцинкат
калия.
Названия соединений, содержащих комплексный
катион, строятся из названий анионов внешней
среды, после которых указывается число лигандов,
дается латинское название лиганда (молекула
аммиака NH3 – аммин, молекула воды H2O –
аква от латинского названия воды) и русское
название элемента-комплексообразователя;
римской цифрой в скобках указывается степень
окисления элемента-комплексообразователя, если
она переменная. Например:
[Cu(NH3)4]SO4 – сульфат
тетраамминмеди(II),
[Al(H2O)6]Cl3 – хлорид
гексаакваалюминия.
Химические свойства комплексных
соединений
1. В растворе комплексные соединения ведут
себя как сильные электролиты, т.е. полностью
диссоциируют на катионы и анионы:
[Pt(NH3)4]Cl2 = Pt(NH3)4]2+
+ 2Cl–,
K2[PtCl4] = 2K+ + [PtCl4]2–.
Диссоциация по такому типу называется
первичной.
Вторичная диссоциация связана с удалением
лигандов из внутренней сферы комплексного иона:
[PtCl4]2– PtCl3– + Cl–.
Вторичная диссоциация происходит ступенчато:
комплексные ионы ([PtCl4]2–) являются
слабыми электролитами.
2. При действии сильных кислот происходит
разрушение гидроксокомплексов, например:
а) при недостатке кислоты
Na3[Al(OH)6] + 3HCl = 3NaCl + Al(OH)3 + 3H2O;
б) при избытке кислоты
Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 +
6H2O.
3. Нагревание (термолиз) всех аммиакатов
приводит к их разложению, например:
[Cu(NH3)4]SO4 CuSO4 + 4NH3
.
Значение комплексных соединений
Координационные соединения имеют
исключительно большое значение в природе.
Достаточно сказать, что почти все ферменты,
многие гормоны, лекарства, биологически активные
вещества представляют собой комплексные
соединения. Например, гемоглобин крови,
благодаря которому осуществляется перенос
кислорода от легких к клеткам ткани, является
комплексным соединением, содержащим железо (рис.
6), а хлорофилл, ответственный за фотосинтез в
растениях, – комплексным соединением магния
(рис. 7).
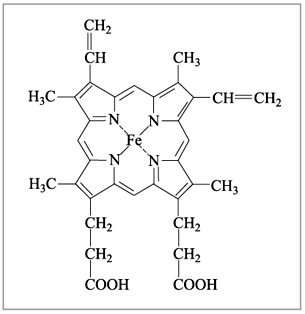 |
Рис. 6. Гем-группа в молекуле
|
Значительную часть природных
минералов, в том числе полиметаллических руд и
силикатов, также составляют координационные
соединения. Более того, химические методы
извлечения металлов из руд, в частности меди,
вольфрама, серебра, алюминия, платины, железа,
золота и других, также связаны с образованием
легкорастворимых, легкоплавких или летучих
комплексов. Например: Na3[AlF6] –
криолит, KNa3[AlSiO4]4 – нефелин
(минералы, комплексные соединения, содержащие
алюминий).
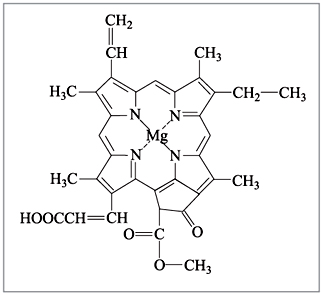 |
Рис. 7. Хлорофилл c1 |
Современная химическая отрасль
промышленности широко использует
координационные соединения как катализаторы при
синтезе высокомолекулярных соединений, при
химической переработке нефти, в производстве
кислот.
III. Подведение итогов и постановка
домашнего задания
Домашнее задание.
1) Приготовиться по лекции к уроку-практикуму по
теме: «Комплексные соединения».
2) Письменно дать характеристику следующим
комплексным соединениям по строению и
классифицировать по признакам:
K3[Cr(OH)6], [Cr(H2O)6](NO3)3,
Na2[Zn(CN)4], [Ag(NH3)2]OH.
3) Написать уравнения реакций, при помощи
которых можно осуществить превращения:
* За открытие этой
новой области науки А.Вернер в 1913 г. был
удостоен Нобелевской премии.
Н.Н.ТОПОЕВА,
учитель химии
Аскизского лицея-интерната
(с. Аскиз, Республика Хакасия)
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| 1.1 | Современные представления о строении атома | |
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов. | |
| 1.2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | |
| 1.2.1 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической таблицы химических элементов. | |
| 1.2.2 | Общая характеристика металлов IА–IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И.Менделеева и особенностям строения их атомов. | |
| 1.3 | Химическая связь и строение вещества | |
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов. | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения. | |
| 1.4 | Химическая реакция | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии. | |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения. | |
| 1.4.3 | Скорость реакции, ее зависимость от различных факторов. | |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | |
| 1.4.6 | Реакции ионного обмена. | |
| Особенности взаимодействия кислых солей со щелочами. | ||
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. | |
| Необратимый гидролиз бинарных соединений. | ||
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. | |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей,кислот). | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). | |
| 2.2 | Химические свойства простых веществ — металлов | |
| 2.2.1 | Характерные химические свойства щелочных металлов. | |
| 2.2.2 | Характерные химические свойства бериллия, магния и щелочноземельных металлов. | |
| 2.2.3 | Характерные химические свойства алюминия. | |
| 2.2.4 | Химические свойства переходных металлов (меди, цинка, хрома, железа). | |
| 2.3 | Химические свойства простых веществ — неметаллов | |
| 2.3.1 | Химические свойства водорода и галогенов. | |
| 2.3.2 | Химические свойства кислорода и серы. | |
| 2.3.3 | Химические свойства азота и фосфора. | |
| 2.3.4 | Химические свойства углерода и кремния. | |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных. | |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов. | |
| 2.6 | Характерные химические свойства кислот. | |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка). | |
| 3 | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная). | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). | |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6 | Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. | |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. | |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахарады, дисахариды, полисахариды) | |
| 3.8.1 | Жиры. | |
| 3.8.2 | Белки. | |
| 3.8.3 | Углеводы (моносахариды, дисахариды, полисахариды). | |
| 3.9 | Взаимосвязь органических соединений. | |
| 4 | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1 | Экспериментальные основы химии | |
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. | |
| 4.1.2 | Методы разделения смесей и очистки веществ. | |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы. | |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы. | |
| 4.1.5 | Качественные реакции органических соединений. | |
| 4.1.7 | Основные способы получения углеводородов. | |
| 4.1.8 | Основные способы получения кислородсодержащих соединений. | |
| 4.2 | Общие представления о промышленных способах получения важнейших веществ | |
| 4.2.1 | Понятие о металлургии: общие способы получения металлов. | |
| 4.2.2.1 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). | |
| 4.2.3 | Природные источники углеводородов, их переработка. | |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. | |
| 4.3 | Рачеты по химическим формулам и уравнениям реакций | |
| 4.3.1 | Расчеты с использованием понятия «массовая доля вещества в растворе». | |
| 4.3.2 | Расчеты объемных отношений газов при химических реакциях. | |
| 4.3.3 | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. | |
| 4.3.4 | Расчеты теплового эффекта реакции. | |
| 4.3.5 | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). | |
| 4.3.6 | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. |