Если выпускник хочет получить профессию, которая связана с такими сферами как наука, медицина, ветеринария, промышленность, фармакология, агрономия и селекция, он выбирает ЕГЭ по химии. Успешная сдача зависит от того, насколько внимательны и усидчивы были ученики в период посещения школы.
Как готовиться
Чтобы получить отличную оценку по единому экзамену по химии, важны следующие
моменты:
- Хорошая подготовленность в теории;
-
достижения в области чтения и составления формул;
-
«натренированность» в решении задач и уравнений;
-
способность разбираться в таких способах структурирования данных как таблицы и
схемы.
Работа должна быть основательной и комплексной. Предпочтительны
различные методы тренировки:
- Использование учебных материалов за все годы с
акцентом на объемные и сложные темы; -
изучение дополнительной специализированной литературы: это обязательно пригодится во время тестирования;
-
прохождение онлайн-тестов для закрепления полученной информации и выработки навыков правильного и качественного заполнения бланков теста.
Упражнения с тестами помогают выявлять «уязвимые места» и направлять силы в нужное русло.
Нюансы
На ЕГЭ придется блеснуть познаниями по всем ячейкам школьного курса. В
процессе подготовки рекомендуется обратить внимание на теоретические разделы по следующим вопросам:
- Химические элементы — характеристика;
- атом — строение;
- органические соединения — особенности;
- массовые доли, масса в растворах и соединениях — расчеты;
- оксиды;
- простые вещества, основания, кислоты, соли,
углеводороды, спирты, альдегиды и другие; - реакции и связи;
- неорганика — классификация, свойства, взаимосвязи классов.
Советы
Лучше всего придерживаться стратегии, включающей как повторение легких,
так и доскональная проработка тех тем, которые вызывают сложности. При переключении деятельности качество занятий повышается;
Не пытайтесь перегружать мозг потоком информации одного типа – очень
полезно дополнять тексты цифровыми выражениями и условными записями;
Чтобы уложить в голове непростые вопросы, не ленитесь делать заметки и
составлять схематические изображения.
Полный курс подготовки к ЕГЭ по химии-2023. Здесь приведена теория по каждому заданию в соответствии с спецификацией и кодификатором ЕГЭ по химии. Учебные материалы и теория, необходимые для подготовки к ЕГЭ по химии.
Вы можете поддержать работу сайта, разработку новых материалов и тестов. Донаты принимаются через форму:
Обратите внимание! Форма выше — это не оплата курса по химии, это форма для сбора донатов на работу сайта)
Кодификатор ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| |
1.1. | Современные представления о строении атома |
| 1.1.1. | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
|
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1. | Закономерности изменения свойств элементов и их соединений по периодам и группам
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами) |
|
| 1.2.2. | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3. | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | |
| 1.2.4. | Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | |
| 1.3. | Химическая связь и строение вещества |
|
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.3.2. | Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| 1.3.3. | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. | Химическая реакция | |
| 1.4.1. | Классификация химических реакций в неорганической и органической химии
Тренировочные тесты в формате ЕГЭ по теме «Классификация реакций» ( с ответами) |
|
| 1.4.2. | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3. | Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» ( с ответами) |
|
| 1.4.4. | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» ( с ответами) |
|
| 1.4.5. |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | |
| 1.4.6. | Реакции ионного обмена | |
| 1.4.7. |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (с ответами) |
|
| 1.4.8. |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 19 ЕГЭ по химии) ( с ответами) |
|
| 1.4.9. |
Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами) |
|
| 1.4.10. |
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1. | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2.2. | Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | |
| 2.3. | Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 2.4. | Характерные химические свойства оксидов: основных, амфотерных, кислотных | |
| 2.5. | Характерные химические свойства оснований и амфотерных гидроксидов | |
| 2.6. | Характерные химические свойства кислот | |
| 2.7. | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | |
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1. | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тренировочные тесты в формате ЕГЭ по теме «Теория строения орг. соединений» ( с ответами) |
|
| 3.2. | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3. | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация орг. соединений» ( с ответами) |
|
| 3.4. | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | |
| 3.5. | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6. | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | |
| 3.7. | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Тренировочные тесты в формате ЕГЭ по теме «Свойства азотсодержащих соединений» ( с ответами) |
|
| 3.8. | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | |
| 3.9. | Взаимосвязь органических соединений | |
| 4. | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1. | Экспериментальные основы химии | |
| 4.1.1. | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2. | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | |
| 4.1.3. | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4. | Качественные реакции на неорганические вещества и ионы | |
| 4.1.5. | Качественные реакции органических соединений | |
| 4.1.6. | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | |
| 4.1.7. | Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов | |
| 4.1.8. | Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот | |
| 4.2.1. | Понятие о металлургии: общие способы получения металлов | |
| 4.2.2. | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | |
| 4.2.3. | Природные источники углеводородов, их переработка | |
| 4.2.4. | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | |
| 4.3. | Расчеты по химическим формулам и уравнениям реакций | |
| 4.3.1. | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2. | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3. | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4. | Расчеты теплового эффекта реакции | |
| 4.3.5. | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | |
| 4.3.6. | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества | |
| 4.3.7. | Установление молекулярной и структурной формулы вещества | |
| 4.3.8. | Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9. | Расчеты массовой доли (массы) химического соединения в смеси |
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами)
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.3. Химическая связь и строение вещества
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами)
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами)
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.4. Химическая реакция
1.4.1. Классификация химических реакций в неорганической и органической химии
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения
1.4.3. Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» (задание 20 ЕГЭ по химии) ( с ответами)
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
1.4.6. Реакции ионного обмена
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 21 ЕГЭ по химии) ( с ответами)
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 22 ЕГЭ по химии) ( с ответами)
1.4.10. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
2.8. Взаимосвязь различных классов неорганических веществ
3. ОРГАНИЧЕСКАЯ ХИМИЯ
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
3.6. Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
3.8. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
3.9. Взаимосвязь органических соединений
4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1. Экспериментальные основы химии
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
4.1.4. Качественные реакции на неорганические вещества и ионы
4.1.5. Качественные реакции органических соединений
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
4.1.7. Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов
4.1.8. Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот
4.2.1. Понятие о металлургии: общие способы получения металлов
4.2.2. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
4.2.3. Природные источники углеводородов, их переработка
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
4.3. Расчеты по химическим формулам и уравнениям реакций
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе»
4.3.2. Расчеты объемных отношений газов при химических реакциях
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
4.3.4. Расчеты теплового эффекта реакции
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
4.3.7. Установление молекулярной и структурной формулы вещества
4.3.8. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчеты массовой доли (массы) химического соединения в смеси
Курс подготовки к ЕГЭ или ОГЭ (ГИА) по химии:
Общая химия
Часть 1. Строение вещества
1. Строение атома. Электронные формулы атомов
2. Периодический закон
3. Строение молекул. Типы химических связей. Основные характеристики ковалентной связи. Межмолекулярные связи
4. Строение вещества (кристаллические решетки). Основные физические свойства различных кристаллов
5. Степень окисления и валентность химических элементов.
Часть 2. Основы неорганической химии
1. Классификация неорганических веществ
2. Номенклатура неорганических веществ
3. Способы получения оксидов
4. Химические свойства основных оксидов
5. Химические свойства кислотных оксидов
6. Химические свойства амфотерных оксидов
7. Химические свойства и способы получения кислот
8. Химические свойства и способы получения солей
9. Химические свойства и способы получения оснований
10. Взаимосвязь основных классов неорганических веществ
11. Бинарные соединения — гидриды.
12. Реакции разложения в неорганической химии
Часть 3. Физико-химия растворов:
1. Понятие о растворах, растворимость
2. Теория электролитической диссоциации
3. Реакции ионного обмена
4. Гидролиз.
Часть 4. Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции.
2. Электролиз солей. Электролиз солей карбоновых кислот. Коррозия.
Часть 5. Особенности работы в лаборатории
Часть 6. Химические реакции. Закономерности их протекания
1. Классификация химических реакций.
2. Кинетика (скорость) химических реакций и ее зависимость от разных факторов.
3. Термодинамика химических реакций: химическое равновесие и его смещение.
Органическая химия
1. Теория строения органических веществ. Классификация органических веществ. Гомологи и изомеры. Виды изомерии.
2. Алканы: химические и физические свойства, строение, получение, изомерия.
3. Алкены: химические и физические свойства, строение, получение, изомерия.
4. Алкины: химические и физические свойства, строение, получение, изомерия.
5. Алкадиены: химические и физические свойства, строение, получение, изомерия.
6. Арены: химические и физические свойства, строение, получение, изомерия.
7. Циклоалканы: химические и физические свойства, строение, получение, изомерия.
8. Спирты: химические и физические свойства, строение, изомерия и способы получения. Фенолы: химические свойства, способы получения, строение и изомерия.
9. Альдегиды и кетоны: химические и физические свойства, строение и изомерия, получение.
10. Карбоновые кислоты: химические и физические свойства, строение, номенклатура и изомерия, способы получения.
11. Сложные эфиры: химические и физические свойства, строение, получение, изомерия.
12. Жиры: химические и физические свойства, строение, получение.
13. Углеводы: химические и физические свойства, строение, получение.
14. Амины: химические и физические свойства, строение, получение, изомерия.
15. Аминокислоты: химические и физические свойства, строение, получение, изомерия.
16. Белки: химические и физические свойства, строение и получение.
17. Взаимосвязь разных классов органических веществ.
18. Качественные реакции в органической химии.
Характерные реакции в органической химии:
Реакция Дюма Электролиз солей карбоновых кислот Пиролиз метана Реакция Вагнера
Химия элементов
Часть 1. Химия щелочных металлов и их соединений. Пероксиды щелочных металлов. Гидроксиды щелочных металлов.
Часть 2. Химия щелочноземельных металлов. Оксиды щелочноземельных металлов. Гидроксиды щелочноземельных металлов.
Часть 3. Химия алюминия и его соединений. Оксид алюминия. Гидроксид алюминия. Соли алюминия.
Часть 4. Химия углерода. Оксид углерода (II) и оксид углерода (IV). Угольная кислота и ее соли (карбонаты и гидрокарбонаты).
Часть 5. Химия кремния. Оксид кремния (IV). Кремниевая кислота. Силан. Силикаты.
Часть 6. Химия азота и его соединений. Оксиды азота. Аммиак. Нитриды. Азотная кислота и азотистая кислота. Нитраты.
Часть 7. Химия фосфора и его соединений. Фосфин. Фосфиды металлов. Оксиды фосфора III и V. Фосфорные кислоты и их соли (фосфаты, гидрофосфаты и дигидрофосфаты, пирофосфаты и метафосфаты). Фосфористая кислота.
Часть 8. Химия кислорода и его соединений.
Часть 9. Химия серы и ее соединений. Сероводород и сульфиды. Оксиды серы – сернистый газ и серный ангидрид. Серная кислота и ее свойства. Сернистая кислота. Особенности химии сульфатов и сульфитов.
Часть 10. Химия галогенов и их соединений.
Часть 11. Химия d-элементов: железа, хрома, цинка, меди.
Часть 12. Химия водорода и его соединений.
Задачи: базовый блок
1. Атомно -молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Диагностические и тренировочные работы
Все реальные варианты КИМ ЕГЭ по химии
Тренировочная работа по химии в формате ЕГЭ 26 октября 2017 года
Тренировочная работа по химии для 11 классов 30 ноября 2017 года
Досрочный ЕГЭ по химии 25.03.2019
Видеоопыты
Видеоопыты по общей и неорганической химии
Видеоопыты по органической химии
Спецификация ЕГЭ по химии-2022
Химия Кодификатор ЕГЭ
Государственная итоговая аттестация в форме единого государственного экзамена (ЕГЭ)
Химия Кодификатор ЕГЭ элементов содержания и требований к уровню подготовки обучающихся
для проведения ГИА по ХИМИИ. Ссылки на конспекты
Элементы содержания, проверяемые заданиями экзаменационной работы,
ссылки на конспекты уроков.
| Код элемента | Элементы содержания, проверяемые заданиями КИМ | Ссылки на конспекты |
| 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | ||
| 1.1. Современные представления о строении атома | ||
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырёх периодов: s–, р– и d–элементы. Электронная конфигурация атомов и ионов. Основное и возбуждённое состояния атомов | КОНСПЕКТ |
| 1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева | ||
| 1.2.1 | Закономерности изменения свойств элементов и их соединений по периодам и группам | КОНСПЕКТ |
| 1.2.2 | Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | КОНСПЕКТ |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | КОНСПЕКТ |
| 1.2.4 | Общая характеристика неметаллов IVA-VIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | КОНСПЕКТ |
| 1.3. Химическая связь и строение вещества | ||
| 1.3.1 | Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь | Ионная связь, Ковалентная, Металлическая, Водородная |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. Химическая реакция | Справочник ОГЭ | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии | КОНСПЕКТ |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3 | Скорость реакции, её зависимость от различных факторов | КОНСПЕКТ |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов | КОНСПЕКТ |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | КОНСПЕКТ |
| 1.4.6 | Реакции ионного обмена | КОНСПЕКТ |
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная | КОНСПЕКТ |
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от неё | КОНСПЕКТ |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей, кислот) | КОНСПЕКТ |
| 1.4.10 | Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2. НЕОРГАНИЧЕСКАЯ ХИМИЯ | ||
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) | |
| 2.2 | Характерные химические свойства простых веществ -металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | Щелочные, Щёлочноземельные, Магний, Алюминий; Медь, Цинк, Хром, Железо |
| 2.3 | Характерные химические свойства простых веществ -неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | Водород, Свойства водорода, Галогены, Кислород, Сера, Азот, Фосфор, Углерод, Кремний |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных | Оксиды, Свойства оксидов, Амфотерные оксиды |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов | Основания, Амфотерные гидрооксиды |
| 2.6 | Характерные химические свойства кислот | Кислоты |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | Соли |
| 2.8 | Взаимосвязь различных классов неорганических веществ | |
| 3. ОРГАНИЧЕСКАЯ ХИМИЯ | ||
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | Алканы, Циклоалканы, Алкены, Диены, Алкины, Ароматические углеводороды |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола | Одноатомные спирты, Многоатомные спирты, Фенол |
| 3.6 | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | Альдегиды, Карбоновые кислоты, Сложные эфиры |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот | Амины, Аминокислоты |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | Жиры, Белки, Углеводы |
| 3.9 | Взаимосвязь органических соединений | |
| 4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ и ЖИЗНЬ | ||
| 4.1. Экспериментальные основы химии | ||
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | КОНСПЕКТ |
| 4.1.2 | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | КОНСПЕКТ |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы | КОНСПЕКТ |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы | КОНСПЕКТ |
| 4.1.5 | Качественные реакции органических соединений | КОНСПЕКТ |
| 4.1.6 | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | КОНСПЕКТ |
| 4.1.7 | Основные способы получения углеводородов (в лаборатории) | КОНСПЕКТ |
| 4.1.8 | Основные способы получения органических кислородсодержащих соединений (в лаборатории) | КОНСПЕКТ |
| 4.2. Общие представления о промышленных способах получения важнейших веществ. Применение веществ | ||
| 4.2.1 | Понятие о металлургии: общие способы получения металлов | КОНСПЕКТ |
| 4.2.2 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | КОНСПЕКТ |
| 4.2.3 | Природные источники углеводородов, их переработка | КОНСПЕКТ |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | КОНСПЕКТ |
| 4.2.5 | Применение изученных неорганических и органических веществ | КОНСПЕКТ |
| 4.3. Расчёты по химическим формулам и уравнениям реакций | ||
| 4.3.1 | Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе» | Задачи с решениями |
| 4.3.2 | Расчёты объёмных отношений газов при химических реакциях | Задачи с решениями |
| 4.3.3 | Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ | |
| 4.3.4 | Расчёты теплового эффекта реакции | |
| 4.3.5 | Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | Задачи с ответами |
| 4.3.6 | Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества | |
| 4.3.7 | Установление молекулярной и структурной формул вещества | |
| 4.3.8 | Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9 | Расчёты массовой доли (массы) химического соединения в смеси |
Список конспектов по химии
Проверить знания (онлайн-тесты)
Вы смотрели: Химия Кодификатор ЕГЭ элементов содержания, проверяемых заданиями экзаменационной работы,
ссылки на конспекты, размещенные на сайте Учитель PRO.
Материалы по химии
Подготовка к ЕГЭ, ОГЭ, ДВИ
-
Свойства основных оксидов
Свойства основных оксидов на ОГЭ и ЕГЭ по химии. Взаимодействие основных оксидов с водой, кислотами, кислотными оксидами, амфотерными оксидами, восстановителями.
Читать далее…
Дата публикации 14.01.2023
-
Электролиты и неэлектролиты. Сильные и слабые электролиты
Электролиты и неэлектролиты, сильные и слабые электролиты. Список сильных и слабых электролитов, и неэлектролитов. Почему загорается лампочка при соединении с некоторыми растворами?
Читать далее…
Дата публикации 10.10.2022
-
Репетитор химия ЕГЭ
Репетитор по химии для подготовки к ЕГЭ на высокий балл. Подготовка к ЕГЭ по химии в Москве и дистанционно.
Читать далее…
Дата публикации 18.07.2022
-
Задание 8 ЕГЭ по химии
Неорганическая химия ЕГЭ. Задание 8 по химии теория и практика. Шпаргалки по химии. Как решать ЕГЭ по заданиям.
Читать далее…
Дата публикации 20.04.2022
-
Разложение веществ
Разложение основных групп солей – карбонатов, нитратов, кислых, комплексных солей, разложение солей аммония. Реакции термического разложения перманганатов, дихроматов, бертолетовой соли, азотной и азотистой кислоты.
Читать далее…
Дата публикации 20.02.2022
-
Тривиальные названия ЕГЭ
Тривиальные названия ЕГЭ, тривиальные названия неорганических веществ в форме таблицы. Как выучить названия веществ. Таблица с тривиальными названиями
Читать далее…
Дата публикации 05.02.2022
-
Химия с нуля и до ЕГЭ
С чего начинать подготовку к ЕГЭ по химии, как организовать свою работу, если до экзамена осталось немного времени. Можно ли подготовиться к ЕГЭ за месяц? Основные правила для успешного прохождения экзамена.
Читать далее…
Дата публикации 17.01.2022
-
Водород
Водород на ЕГЭ по химии: получение водорода, положение в периодической системе. Реакция взаимодействия водорода с галогенами, металлами, халькогенами. Восстановительные свойства водорода.
Читать далее…
Дата публикации 19.12.2021
-
Щелочи: определение, химические свойства, методы получения
Реакции щелочей. Щелочь с кислотой. Соль и щелочь. Образование щелочи из оксида. Металлы со щелочами. Растворимые гидроксиды.
Читать далее…
Дата публикации 09.12.2021
-
Дисперсные системы
Кодификатор ФИПИ. Конспект к ЕГЭ. Гели и золи. Коллоиды. Виды дисперсных систем. Истинные растворы. ЕГЭ химия. Дисперсные системы 11 класс.
Читать далее…
Дата публикации 01.12.2021
- 1
- 2
- 3

Подготовка к ЕГЭ начинается с
психологического настроя на успех, обязательную сдачу ЕГЭ.
Поэтому не
лишними будут помощь психолога, советы родителей и учителей.
Теория к ЕГЭ. Методика самостоятельной подготовки к ЕГЭ
ТЕОРИЯ ДЛЯ СДАЮЩИХ ЕГЭ
Дopoнькин ЕГЭ. Химия. Большой справочник
Adobe Acrobat Document
7.6 MB
РАСПЕЧАТАТЬ И ИСПОЛЬЗОВАТЬ
Методические рекомендации по подготовке
Adobe Acrobat Document
375.5 KB
ПРОРАБОТАТЬ И ПРИНЯТЬ К СВЕДЕНИЮ
анализ типичных ошибок ЕГЭ-2019 г.pdf
Adobe Acrobat Document
771.7 KB
ПРОГРАММА ПОДГОТОВКИ К ЕГЭ ПО ХИМИИ.doc
Microsoft Word Document
129.5 KB
ВНИМАНИЕ
Тривиальные названия органических вещест
Adobe Acrobat Document
340.1 KB
Теория и тест для самостоятельной проработки.
Основные способы получения металлов.pptx
Microsoft Power Point Presentation
920.7 KB
Все свойства органических веществ.
Реакции к основным темам курса 10 класса
Microsoft Word Document
158.0 KB
Общие формулы. УЧИТЬ!!!
Общие формулы классов органических вещес
Adobe Acrobat Document
188.4 KB
Металлы. Соединения металлов. УЧИТЬ!!!
Свойства металлов и их соединений.docx
Microsoft Word Document
2.5 MB
Цепочки превращений.
Задание С3. Цепочки превращений..docx
Microsoft Word Document
674.8 KB
Теория по основным классам неорганических соединений.
Основные классы и их свойства.doc
Microsoft Word Document
880.0 KB
Нужно разобраться и выучить.
Ряд активности металлов.pdf
Adobe Acrobat Document
315.0 KB

Документация и подготовка к ЕГЭ
таблица ПСХЭ.doc
Microsoft Word Document
396.5 KB
Таблица растворимости некоторых веществ
Microsoft Word Document
578.5 KB

Дополнительная информация, теория к ЕГЭ
Адреса сайтов подготовки.
Материалы для подготовки к ОГЭ и ЕГЭ.doc
Microsoft Word Document
15.2 KB
Таблица. Качественные признаки веществ.d
Microsoft Word Document
44.8 KB
Ряд ЭО. Названия кислот и остатков. Степ
Microsoft Word Document
518.7 KB
Таблица ПСХЭ . С обозначением классов со
Microsoft Word Document
498.4 KB
цвета оксидов.doc
Microsoft Word Document
24.0 KB
Номенклатура неорганических веществ.doc
Microsoft Word Document
135.5 KB
Определение ионов. Качественные реакции.
Microsoft Word Document
51.0 KB
Часть представленных здесь материалов взята с
сайта учителя химии Сикорской О.Э.
Ниже приведен подробный разбор демоверсии ЕГЭ-2023 по химии, проектная версия. Задания разобраны от 1 до 34 подряд, приведена логика рассуждения по каждому из них. Если есть желание разобраться более детально, то переходите по ссылкам в тексте или записывайтесь к нам на курс.
Для выполнения первого задания всегда рекомендую расписать электронно-графические формулы элементов (с ячейками). В большинстве случаев достаточно изобразить внешний и предвнешний уровень. Напомню также, что для элементов дальше IV периода не нужно изображать формулу целиком, а можно воспользоваться аналогией строения валентных подуровней с соседом из подгруппы. По приведенным элементам:
- Цезий находится в первой группе, главной подгруппе, аналог натрия по строению внешнего уровня. Имеет 1 электрон на 6s-подуровне, он же является неспаренным.
- Углерод находится в четвертой группе, главной подгруппе. На внешнем уровне имеет 4 электрона, из них неспаренных два, которые находятся на 2р-подуровне.
- Кислород находится в шестой группе, главной подгруппе. На внешнем уровне имеет 6 электронов, из них неспаренных два, которые находятся на 2р-подуровне.
- Хром находится в шестой группе, побочной подгруппе. Необходимо вспомнить о проскоке электрона, за счет которого на внешнем уровне, 4s-подуровне, имеет 1 электрон, а не предвнешнем, 3d-подуровне, – пять. Итого 6 неспаренных.
- Азот находится в пятой группе, главной подгруппе. На внешнем уровне имеет 5 электронов, из них неспаренных три, которые находятся на 2р-подуровне.
Выбираем углерод и кислород, у обоих по два неспаренных электрона.
Ответ: 23
Необходимо вспомнить, что к р-элементам можно отнести элементы главных подгрупп шести последних групп в периоде. Представители первых двух относятся к s-элементам, а элементы побочных подгрупп относим к d-элементам. Исходя из приведенных соображений, выбираем пункты 2), 3), 5).
Атомный радиус уменьшается направо по периоду, поэтому располагаем выбранные ранее элементы в порядке 2), 5), 3).
Ответ: 253
Для выполнения такого рода заданий рекомендую выписать на лист бумаги высшую и низшую степени окисления для каждого из элементов.
- Цезий имеет высшую степень окисления +1, низшую – 0. Разность 1.
- Углерод имеет высшую степень окисления +4, низшую – -4. Разность 8.
- Кислород имеет высшую степень окисления +2, низшую – -2. Разность 4.
- Хром имеет высшую степень окисления +6, низшую – 0. Разность 6.
- Азот имеет высшую степень окисления +5, низшую – -3. Разность 8.
Таким образом, выбираем углерод и азот.
Ответ: 25
В задании, по сути, есть два фильтра: по типу строения и по характеру связи. Начнем с типа строения. Поскольку необходимо выбрать вещества молекулярного строения, то сразу можно исключить соли и иные соединения, имеющие ионные связи. Убираем из рассмотрения пункты 1) и 4). Среди оставшихся нужно найти вещества с ковалентной полярной связью. Вспомним, что такая связь может возникать между атомами разных неметаллов (или сильно различающихся фрагментов в органических молекулах). По такому принципу можно исключить пункт 5). Остаются вещества 2) и 3).
Ответ: 23
К двухосновным кислотам относятся те из них, которые содержат в молекуле 2 атома водорода, способных замещаться на катионы металлов. Подобным требованиям отвечает сернистая кислота, пункт 4).
К средним можно отнести соли, не содержащие способных к замещению атомов водорода, фрагментов ОН, комплексных ионов и подобного. Из приведенного списка можно взять аммиачную селитру, тривиальное название нитрата аммония.
К амфотерным гидроксидам можно отнести гидроксиды металлов в степенях окисления +3 и +4, также гидроксиды бериллия, цинка, свинца, олова. Подойдет пункт 2).
Ответ: 482
Попробуем найти в приведенном списке сильные кислоты. Пункт 1) подходит, поскольку в пункте 3) находится слабая кислота. Таким образом X уже установлен.
Среди оставшихся пунктов нужно найти вещество, которое при добавлении вызовет растворение гидроксида алюминия. Поскольку гидроксид является амфотерным, то сможет прореагировать с кислотой, кроме наиболее слабых, или щелочью. Среди приведенных соединений можно взять 4), поскольку гидроксид калия является щелочью.
Ответ: 14
Для выполнения подобных заданий советую следующий порядок действий:
- Берем вещество из левого столбика
- Классифицируем его, вспоминаем характерные типы реакций для такого класса соединений
- Оцениваем его с точки зрения кислотно-основных и окислительно-восстановительных свойств
- Подбираем вещества и правого столбика, противоположные по свойствам и способные реагировать с веществом из правого столбика
Пункт А):
Сера относится к простым веществам-неметаллам, средняя по активности. Способна вступать в реакцию со щелочами, сильными окислителями и активными восстановителями. С водой и кислотами, кроме кислот-окислителей, реакции нет.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) водород выступит против серы в качестве восстановителя, хлор и кислород – окислители. Подходит.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Пункт Б):
Оксид серы (VI) относится к кислотным оксидам, реагирует с водой, большинством веществ основной и амфотерной природы. Восстановительных свойств не проявляет, может быть окислителем.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) оксид бария – основный, КОН – щелочь, с водой реакция тоже есть. Подходит.
В пункте 3) хлор и кислород – окислители, не подходит.
В пункте 4) нет реакции с уксусной кислотой, не подходит.
В пункте 5) нет реакции уже со вторым веществом, дальше не продолжаем.
Пункт В):
Гидроксид цинка относится к амфотерным гидроксидам, может реагировать со щелочами, кислотами. Выраженных окислительных или восстановительных свойств не проявляет. В воде нерастворим, с солями не обменивается.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции с водой, не подходит.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) реагирует с кислотами и щелочью. Подходит.
В пункте 5) нет реакции с хлоридом бария, не подходит.
Пункт Г):
Бромид цинка относится к солям, может вступать в реакции обмена со щелочами и солями. Может проявлять восстановительные свойства за счет бромид-иона.
В пункте 1) обмен имеет смысл с первым и вторым веществам, с третьим будет ОВР. Подходит.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Ответ: 3241
Для ответа на вопрос имеет смысл оценить свойства веществ в каждой паре, а при необходимости записать уравнение реакции между ними. Сделаем и то, и другое.
В пункте А) магний является сильным восстановителем, а концентрированная серная кислота – окислителем. Магний способен восстановить серу до низшей степени окисления:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
В пункте Б) встречаются основный оксид и кислота, произойдет обмен:
MgO + H2SO4 = MgSO4 + H2O
В пункте В) сера выступает в качестве восстановителя, а концентрированная серная кислота – окислитель. Произойдет ОВР:
S + 2H2SO4 = 3SO2 + 2H2O
В пункте Г) сероводород выступает в качестве восстановителя, а кислород – окислитель. Произойдет ОВР:
2H2S + 3O2 = 2SO2 + 2H2O
Ответ: 5144
Обратим внимание, что железо в одну стадию переходит в степень окисления +3. Для этого нам нужен сильный окислитель- хлор.
2Fe + 3Cl2 = 2FeCl3
Во второй реакции железо понижает степень окисления до +2, поэтому необходимо найти восстановитель. Им тут может быть только йодид калия.
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
Ответ: 43
Для установления соответствия имеет смысл найти в структурах из левого столбика характерные функциональные группы и фрагменты.
В структуре А) видим фрагмент -NH-, который можно отнести ко вторичному амину. Циклическая структура молекулы в данном случае ничего не значит.
В структуре Б) есть аминогруппа и карбоксильная группа. Соответственно, вещество можно отнести к аминокислотам.
В структуре В) есть структурный фрагмент -С(О)NH- и просматриваются два остатка от аминокислот, что указывает на дипептид.
Ответ: 231
К решению подобных заданий может быть несколько подходов. Можно для начала определить молекулярную формулу бутена-1, а затем сравнить ее с молекулярными формулами предложенных вариантов. Изомеры по определению должны иметь одинаковые молекулярные формулы.
Бутен-1 – С4Н8
- С4Н10
- С4Н8
- С4Н6
- С4Н6
- С4Н8
Ответ: 25
Поскольку подкисленный раствор перманганата проявляет сильные окислительные свойства, следует поискать вещества, которые могут окисляться с образованием карбоновой кислоты. Прокомментируем все предложенные пункты:
- Окисляется с разрывом кратной связи, кислота будет
- Не окисляется
- Окисляется по боковой цепи, кислота будет
- Не окисляется
- Окисляется до кислоты
Ответ: 135
Метиламин относится к первичным алифатическим аминам, проявляет выраженные основные свойства, вступает в реакции алкилирования, реагирует с азотистой кислотой. Прокомментируем все предложенные пункты:
- Алкан, низкая активность, реакции нет
- Хлоралкан, реакция алкилирования, реагирует
- Водород, гидрировать нечего, не реагирует
- Основание, не реагирует
- Кислота, образование соли, реагирует
Ответ: 25
Для решения имеет смысл записать классы соединений из левого столбика, далее оценить происходящие изменения:
А) 1,2-дигалогеналкан – алкен
Б) моногалогеналкан – алкен
В) моногалогеналкан – алкан
Г) 1,2-дигалогеналкан – алкин
По изменениям назвать тип происходящей реакции и подобрать к ней подходящий реагент:
А) дегалогенирование, магний
Б) дегидрогалогенирование, спиртовой раствор щелочи
В) реакция Вюрца, натрий
Г) дегидрогалогенирование, спиртовой раствор щелочи
Ответ: 1252
Для надежности перед выбором ответа имеет смысл преобразовать названия веществ в формулы и прописать предложенные реакции. Попробуем это сделать:
А) 2CH3COOH + Na2S = 2CH3COONa + H2S
Б) HCOOH + NaOH = HCOONa + H2O
В) HCOH + 4Cu(OH)2 = 2Cu2O + CO2 + 5H2O
Г) 2CH3CH2OH + 2Na = 2CH3CH2ONa + H2
Ответ: 5462
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
В первых двух реакциях цепочки число атомов углерода удваивается, что наводит на мысль о реакции Вюрца. Если рассуждение верное, то веществом Х должен быть галогеналкан. Действительно, его можно получить в одну стадию из спирта, а затем превратить в алкан.
Следующее превращение можно понять, если посмотреть на условия реакции. Нагревание линейного алкана в присутствии хлорида алюминия приводит к его изомеризации в разветвленный алкан.
Ответ: 54
Для решения можно переписать вещества в парах в виде формул, оценить их окислительно-восстановительные свойства и возможность реакции между ними:
- K2S – восстановитель, KMnO4 – окислитель, имеет смысл
- H2SO4 – окислитель, NaCl – очень слабый восстановитель, не ОВР
- NH4Cl – очень слабый восстановитель, NaNO2 – окислитель, специфический случай обмена, сопровождаемого ОВР
- SiO2 – выраженных окислительно-восстановительных свойств не проявляет, Na2CO3 — выраженных окислительно-восстановительных свойств не проявляет, не ОВР
- HI – восстановитель, Na2Cr2O7 – сильный окислитель, имеет смысл
Для надежности можно записать уравнения реакций между ними:
- 2KMnO4 + 3K2S + 4H2O = 2MnO2 + 3S + 8KOH
- NaCl + H2SO4 = NaHSO4 + HCl
- NaNO2 + NH4Cl = NaCl + N2 + 2H2O
- Na2CO3 + SiO2 = Na2SiO3 + CO2
- Na2Cr2O7 + 14HI = 2NaI + 2CrI3 + 3I2 + 7H2O
Ответ: 135
Изменение давления не будет влиять на скорость реакций, в которых нет газообразных реагентов. Среди приведенных пунктов это будут 2), 3), 5).
Ответ: 235
Для решения подобных заданий нужно расставить степени окисления на атомах азота до и после реакции.
Если степень не меняется, то азот не проявляет окислительно-восстановительных свойств. Так будет в пункте А) (переход -3 в -3).
Если степень увеличится, то азот проявляет восстановительные свойства. Так будет в пунктах Б) (переход -3 в 0) и В) (переход -3 в +2).
Ответ: 422
В первом случае для решения необходимо вспомнить зависимость продуктов электролиза от состава соли:
А) соль образована катионом активного металла и кислородсодержащим анионом, на электродах выделятся водород и кислород.
Б) соль образована катионом активного металла и галогенид-ионом, на электродах выделятся водород и галоген.
В) соль образована катионом малоактивного металла и галогенид-ионом, на электродах выделятся металл и галоген.
Ответ: 342
Во втором случае нужно помнить, что алюминий получают при электролизе раствора оксида в расплаве криолита. Калий и подобные наиболее активные металлы только из расплавов галогенидов. Кислород в данном случае можно получить при электролизе водного раствора фторида калия.
Ответ: 124
Для начала имеет смысл определить класс каждого из соединений:
- Средняя соль
- Средняя соль
- Средняя соль
- Сильная кислота
Исходя из этого уже можно сказать, что наиболее низкое значение рН (самая кислая среда) будет в пункте 4).
Как разобраться с солями? Нужно оценить их способность к гидролизу и потенциальное влияние на среду раствора:
- Соль сильной кислоты и сильного основания, не гидролизуется, среда нейтральная
- Соль слабого основания и сильной кислоты, гидролиз по катиону, среда кислая
- Соль сильного основания и слабой кислоты, гидролиз по аниону, среда щелочная
Ответ: 4213
В задании на равновесие следует учитывать разные факторы. Пройдем по каждому из пунктов:
А) кислота при диссоциации может дать дополнительное количество ионов Н+, которые участвуют в равновесии. При увеличении их концентрации равновесие сместится в сторону обратной реакции.
Б) давление в данном случае не окажет влияния, поскольку нет участников-газов
В) повышение температуры сместит равновесие в сторону эндотермической реакции. В данном случае – прямой.
Г) твердая щелочь может раствориться и прореагировать с Н+, уменьшая концентрацию таких ионов в системе. Равновесие сместится в сторону прямой реакции.
Ответ: 2311
Задания подобного типа удобнее всего решать с помощью таблицы. Данный подход к решению задания ЕГЭ-2023 на равновесие в реакторе можно посмотреть по ссылке ниже:
Способ, на мой взгляд, наиболее оптимальный и доступный каждому.
Ответ: 25
В первом случае нужно подобрать такое вещество из правого столбика, которое реагирует с одним или двумя веществами из пары в левом столбике. При этом очень важно, чтобы реакция сопровождалась видимыми признаками:
Пара А):
- Есть реакция с азотной кислотой, сопровождается выделением газа и растворением твердого вещества. Нитрат натрия не реагирует. Подходит.
- Есть реакция с азотной кислотой, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
Пара Б):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом калия, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом натрия, сопровождается образованием осадка. Хлорид калия не реагирует. Подходит.
Пара В):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с хлоридом бария, сопровождается образованием осадка. Хлорид натрия не реагирует. Подходит.
Пара Г):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Специфический случай, поскольку один из изначально образовавшихся нерастворимых гидроксидов (Al(OH)3) может раствориться снова при избытке щелочи. Подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
В заданиях второго типа имеет смысл записать происходящие реакции и попытаться себе их представить. Как может выглядеть и что увидим:
- 2CH3CH2COOH + 2Li = 2CH3CH2COOLi + H2
- 2CH3CH(OH)CH3 + 2K = 2CH3CH(OK)CH3 + H2
- Zn(OH)2 + 2CH3COOH = Zn(CH3COO)2 + 2H2O
- C2H2 + 2Br2 = CHBr2-CHBr2
В первом и втором случаях наблюдаем выделение газообразного водорода. В третьем наблюдаем растворение осадка гидроксида цинка. В четвертом исчезнет окраска брома, наблюдается обесцвечивание.
Ответ: 4415
Задание 25 охватывает несколько совершенно разнородных тем, каждая из которых требует отдельного блока знаний. Приведу здесь ссылки на полезные материалы по заданию, поскольку многое здесь нужно просто выучить.
По первому блоку следует знать, что сопряженные алкадиены используются для производства каучуков, а алкены – пластмасс. Метан в составе природного газа используют в качестве топлива.
По второму блоку можно относительно легко соотнести мономер и полимер, если представить себе структуру молекулы мономера. В молекуле этена всего два атома углерода, поэтому элементарное звено формулы полимера тоже содержит два атома углерода. По той же логике здесь можно действовать и для пропена с дивинилом.
Третий блок нужно просто выучить. По переработке углеводородов можно заглянуть сюда. Хорошее описание технологических процессов можно посмотреть здесь.
Ответ: 234; 214; 312
Для решения подобных заданий на растворы рекомендую использовать метод таблиц, подробно описанный здесь.
В итоге решение задачи сводится к уравнению вида
(15+х)/(150+х) = 0,12
15+х = 18+0,12х
0,88х = 3
х = 3,4
Ответ: 3,4 г
Задания такого типа сводятся к решению пропорции. Для начала переведем известный объем аммиака в количество:
n(NH3) = V(NH3)/Vm = 0,56/22,4 = 0,025 (моль)
2 моль – 92 кДж
0,025 моль – х кДж
х = 1,15 кДж
Ответ: 1,15 кДж
Для решения первой задачи запишем уравнение протекающей реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
Далее вычислим количество нитрата кальция:
n(Ca(NO3)2) = m(Ca(NO3)2)/M(Ca(NO3)2) = 196800/164 = 1200 (моль)
Вычислим массу чистого карбоната кальция, который содержался в известняке:
m(CaCO3) = n(Ca(NO3)2)·M(Ca(NO3)2) = 1200·100 = 120000 (г) = 120 (кг)
Вычислим массу примесей в известняке:
m(примеси) = m(известняка) – m(CaCO3) = 150 — 120 = 30 (кг)
Определим массовую долю примеси в известняке:
ω(примеси) = m(примеси)/m(известняка)·100% = 30/150·100% = 20%
Ответ: 20%
Для решения второй задачи запишем уравнение протекающей реакции:
3С2Н2 = С6Н6
Вычислим количества ацетилена и практически полученного бензола:
n(С2Н2) = V(С2Н2)/Vm = 26,88/22,4 = 1,2 (моль)
n(С6Н6 практ.) = m(С6Н6)/M(С6Н6) = 23,4/78 = 0,3 (моль)
Вычислим теоретически возможное количество бензола и сравним его с практическим:
n(С6Н6 теор.) = n(С2Н2)/3 = 1,2/3 = 0,4 (моль)
η(С6Н6) = n(С6Н6 практ.)/n(С6Н6 теор.)·100% = 0,3/0,4·100% = 75%
Ответ: 75%
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. Поскольку должно происходить изменение цвета раствора, нужно найти окрашенный реагент. Из предложенных это может быть только KMnO4. Это вещество проявляет сильные окислительные свойства, поэтому нужно подобрать восстановитель. Осадка в ходе реакции образоваться не должно, поэтому брать нейтральную среду нельзя. В противном случае выпадет осадок MnO2. Среда может быть кислой или щелочной. Кислоты в предложенном наборе нет, поэтому выберем гидроксид калия для создания среды. Восстановителей в предложенном наборе два: сульфит натрия и пероксид водорода. Пероксид брать нельзя, поскольку по описанию реакции газа образоваться не должно. Таким образом приходим к выводу, что нужно взять сульфит, перманганат и щелочь. Приведем соответствующую реакцию и электронный баланс:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
2∙ | Mn+7 + 1ē → Mn+6
1∙ | S+4 – 2ē → S+6
марганец в степени окисления +7 (или перманганат калия) является окислителем.
сера в степени окисления +4 (или сульфит натрия) – восстановителем.
Есть хороший инструмент для отработки данного задания, рекомендую.
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. К кислым солям здесь относится только NaHCO3. В обмен с ней вступит только гидроксид калия, поскольку кислое и щелочь точно смогут прореагировать. Приведем молекулярное, полное и сокращенное ионные уравнения:
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3− + 2K+ + 2OH− = 2Na+ + CO32− + 2K+ + CO32− + 2H2O
HCO3− + OH− = CO32− + H2O
Решение 31 номера сводится к знанию неорганической химии, свойств и реакций отдельных веществ. Приведем уравнения протекающих процессов:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
SO2 + 2H2S = 3S + 2H2O
3S + 6KOH = K2SO3 + 2K2S + 3H2O
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
Начнем с циклогексана. Получить его путем гидрирования можно, например, из бензола. Его, в свою очередь, можно получить из гексана по реакции дегидроциклизации. Х1 – бензол. Далее в цепочке много неизвестных веществ, заглянем в самый конец. Циклогексанон относится к кетонам, получить его можно из вторичного спирта. Условия последней реакции на это указывают, поскольку там дан сильный окислитель в кислой среде. Тогда Х3 – циклогексанол. Получить такой спирт в две стадии нужно из циклоалкана. Тогда можно предположить последовательно галогенирование и замещение полученного галогенпроизводного под действием водного раствора щелочи. Тогда Х2 – хлорциклогексан, можно бромциклогексан. Последовательность реакций получается следующей:
Решение задачи начинается с анализа и расчета молекулярной формулы. Поскольку продуктами сгорания являются только углекислый газ и вода, можно приписать веществу формулу CxHyOz. Вычислим количества углекислого газа и воды:
n(H2O) = m(H2O)/M(H2O) = 1,8/18 = 0,1 (моль)
n(СО2) = V(CO2)/Vm = 4,48/22,4 = 0,2 (моль)
Тогда можно определить количества и массы элементов, входивших в состав исходного вещества:
n(С) = n(СО2) = 0,2 моль
m(С) = n(С)·M(С) = 0,2·12 = 2,4 г
n(H) = 2n(H2O) = 0,2 моль
m(H) = n(H)·M(H) = 0,2·1 = 0,2 г
m(О) = m(CxHyOz) − m(С) − m(H) = 3,4 − 2,4 − 0,2 = 0,8 (г)
n(O) = m(O)/M(O) = 0,8/16 = 0,05 (моль)
Вычислим молекулярную формулу неизвестного вещества:
x : y : z = n(С) : n(H) : n(O) = 0,2 : 0,2 : 0,05 = 4 : 4 : 1
Поскольку по условию один из фрагментов молекулы должен содержать 7 атомов углерода, разумным будет удвоить простейшее соотношение и получить формулу C8H8O2.
С8Н8О2 – молекулярная формула
Вещество по условию реагирует со щелочью, процесс гидролиза с образованием соли и спирта. В остатке кислоты 7 атомов углерода и малое количество атомов водорода, что вполне соответствует бензоату. Тогда на спирт приходится всего один атом углерода, что соответствует метанолу. Тогда можно предложить структуру метилбензоата:
Запишем уравнение его реакции с гидроксидом лития:
К заданию 34 следует приступать только после ПОЛНОГО выполнения и проверки всех остальных заданий КИМа. Убедитесь также, что все прочие задания перенесены в бланк ответов, а не остались на черновике. Времени на это задание нужно больше всего, поэтому велик риск потерять остальное и не успеть что-то перенести в бланк.
Для решения следует внимательно прочитать условие и написать реакции, которые сразу же очевидны, без дополнительных расчетов. Здесь их можно записать две:
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Поскольку напрямую ничего не известно про массу и количество кальция и карбоната кальция, можно сказать, что кальция было х моль, а его карбоната у моль. Тогда в ходе реакций выделилось х моль водорода и у моль углекислого газа. Выразим массы указанных веществ:
m(Ca) = n·M = 40х г
m(CaCO3) = n·M = 100у г
m(Н2) = n·M = 2х г
m(CO2) = n·M = 44у г
Выразим массу раствора после добавления исходной твердой смеси к соляной кислоте:
m(р-ра) = m(Ca) + m(CaCO3) + m(р-ра HCl) − m(Н2) − m(CO2)
m(р-ра) = 40х + 100у + 300 − 2х − 44у = 330 (г)
38х + 56у = 30
Первое уравнение системы готово. Второе составим по массовой доле кальция в исходной смеси:
m(смеси) = m(Ca) + m(CaCO3) = 40х + 100у (г)
m(Ca) = 40х + 40у (г)
ω(Са) = m(Ca)/m(смеси)·100% = (40х+40у)/(40х+100у)·100% = 50%
(40х+40у)/(40х+100у) = 0,5
Составим и решим систему уравнений:
38х + 56у = 30
(40х + 40у)/(40х + 100у) = 0,5
38х + 56у = 30
(2х + 2у)/(2х + 5у) = 0,5
38х + 56у = 30
2х + 2у = х + 2,5у
38х + 56у = 30
х = 0,5у
75у = 30
у = 0,4
х = 0,2
n(Ca) = 0,2 моль
n(CaСО3) = 0,4 моль
Далее вычислим количество и массу углекислого газа:
n(СО2) = n(CaСО3) = 0,4 моль
m(СО2) = n(СО2)·M(СО2) = 0,4·44 = 17,6 г
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH)·ω(NaOH)/100% = 400·4%/100% = 16 (г)
n(NaOH) = m(NaOH)/M(NaOH) = 16/40 = 0,4 (моль)
Далее нужно сравнить количества щелочи и углекислого газа, чтобы понять, какая будет реакция между ними:
n(СО2)/n(NaOH) = 0,4/0,4 = 1:1
Соотношение 1:1, поэтому образуется кислая соль:
NaOH + CO2 = NaHCO3
Вычислим массу образовавшейся соли и массу раствора:
n(NaHCO3) = n(СО2) = 0,4 моль
m(NaHCO3) = n·M = 0,4·84 = 33,6 г
m(р-ра конечн.) = m(р-ра NaOH) + m(CO2) = 400 + 17,6 = 417,6 (г)
Вычислим массовую долю гидрокарбоната натрия в полученном растворе:
ω(NaHCO3) = m(NaHCO3)/m(р-ра конечн.)·100% = 33,6/417,6·100% = 8,05%
Ответ: 8,05%
Тема 2. СТРОЕНИЕ АТОМА.
Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Электронная оболочка – совокупность движущихся вокруг ядра электронов.
Атомное ядро – центральная, положительно заряженная, часть атома, состоящая из протонов и нейтронов, связанных между собой ядерными силами.
|
Протон р+ |
Нейтрон n0 |
Электрон е |
|
|
Заряд частицы |
+1 |
0 |
-1 |
|
Масса частицы |
1,00728 а.е.м. |
1,00866 а.е.м. |
1/1840 от массы протона |
Заряд ядра атома Z равен порядковому номеру элемента в периодической системе.
Химический элемент – вид атомов, с определённым зарядом ядра.
Так как атом – электронейтрален (не заряжен), то число протонов в атоме равно числу электронов (число + = числу — ): N(e—) = N(p) = Z
Массовое число атома А складывается из числа протонов и нейтронов в ядре данного изотопа. Число нейтронов можно найти, вычитая заряд ядра атома из массового числа. А = N(p) + N(n) N(n) = A – Z
Oдин и тот же химический элемент может существовать в виде двух или нескольких изотопов.
Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом, т.е разным числом нейтронов в ядре.
Нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Пример 1: Определить число нейтронов у изотопов углерода: 12С и 14С.
Решение: у 12С – 6 нейтронов (12-6=6), у 14С – 8 нейтронов (14-6=8).
Пример 2: определить число протонов и нейтронов в ядре изотопа мышьяка с массовым числом 75.
Решение: порядковый номер у As – 33. Следовательно, заряд ядра Z= +33, число протонов – 33. Число нейтронов: A – Z = 75 – 33 = 42.
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА.
В 1913 г датский физик Н. Бор предложил модель атома, в которой электроны вращаются вокруг ядра атома, как планеты обращаются вокруг Солнца.
|
|
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Электронные орбиты в модели Бора обозначаются целыми числами: 1, 2, …, n, начиная от ближайшей к ядру. |
Такие орбиты называют электронными уровнями (слоями).
Уровни состоят из близких по энергии подуровней (электронных оболочек).
Их обозначают s, p, d, f.
Подуровни состоят из одинаковых по энергии орбиталей.
На каждой орбитали может быть не больше двух электронов.
Они отличаются так называемым СПИНОМ, упрощенно – направлением вращения.
Принцип Паули (запрет Паули) ограничивает число электронов, которые могут находиться на одной орбитали.
Согласно принципу Паули, на любой орбитали может находиться не более двух электронов и лишь если они имеют противоположные спины.
Правило Хунда определяет порядок заселения электронами орбиталей, имеющих одинаковую энергию. Оно было выведено немецким физиком-теоретиком Ф. Хундом в 1927 г. на основе анализа атомных спектров.
Согласно правилу Хунда, заполнение орбиталей одного и того же подуровня происходит таким образом: сначала каждую орбиталь занимают по одному электрону, а затем уже по второму, с противоположным спином.
Пример: атом азота имеет три электрона, находящиеся на 2р-подуровне. Согласно правилу Хунда, они должны располагаться поодиночке на каждой из трех 2р-орбиталей. При этом все три электрона должны иметь параллельные спины:
Связь между уровнем и подуровнями.
|
Номер электронного слоя (уровня) |
Электронные подуровни |
Максимальное число электронов |
|
n = 1 |
1s ◻ |
2e |
|
n = 2 |
2s ◻ 2p ◻◻◻ |
2e 6e |
|
n = 3 |
3s ◻ 3p ◻◻◻ 3d ◻◻◻◻◻ |
2e 6e 10e |
|
n = 4 |
4s ◻ 4p ◻◻◻ 4d ◻◻◻◻◻ 4f ◻◻◻◻◻◻◻ |
2e 6e 10e 14e |
ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ АТОМОВ
Изображение орбиталей с учетом их энергии называется энергетической диаграммой атома.
На каждом s-подуровне (одна орбиталь) могут находиться два электрона, на каждом p-подуровне (три орбитали) — шесть электронов, на каждом d-подуровне (пять орбиталей) — десять электронов.
Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию.
Энергия подуровней растет в ряду:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f∼5d < 6p < 7s <5f∼6d…
Оказалось, что у одних элементов более низкую энергию имеет 4f-подуровень, а у других — 5d-подуровень.
То же самое наблюдается для 5f- и 6d-подуровней.
ПОСЛЕДОВАТЕЛЬНОСТЬ ЗАПОЛНЕНИЯ ОРБИТАЛЕЙ У ПЕРВЫХ 36 АТОМОВ.
Электронная формула атома – запись распределения электронов по орбиталям в основном (невозбужденном) состоянии атома или его ионов: 1s22s22p63s23p6… и т.д.
Заполнение электронных оболочек атомов первых 4-х периодов.
Водород (1е): Н 1s1 – заполняется первый уровень.
Гелий (2е) Не 1s2
ПЕРВЫЙ ЭЛЕКТРОННЫЙ УРОВЕНЬ ЗАПОЛНЕН.
Литий (3е) — начинает заполняться второй уровень: Li 1s22s1
Бериллий на 2s-подуровень приходит второй электрон.
Затем у бора начинается заполнение 2p-подуровня:
В 1s22s22p1
У следующих за бором пяти атомов продолжается заполнение 2р-подуровня, вплоть до неона: Ne 1s22s22p6
ВТОРОЙ ЭЛЕКТРОННЫЙ УРОВЕНЬ ПОЛНОСТЬЮ ЗАВЕРШЕН.
Начинается третий период – сначала происходит заполнение 3s-подуровня у натрия и магния (это s-элементы), а потом заполняется 3р-подуровень у шести р-элементов: от алюминия до аргона.
Na 1s22s22р63s1 Mg 1s22s22р63s2
Al 1s22s22р63s23p1 ….. Ar 1s22s22р63s23p6
У аргона — инертного газа на внешнем слое 8 электронов.
Распределение электронов по электронным уровням у атома № 18 — аргона выглядит так: 2,8,8.
При этом третий электронный уровень ещё не заполнен: в нём есть 3d-подуровень.
Однако атом № 19 – калий является первым элементом 4 периода, у него идёт заполнение 4s-подуровня.
Калий — это s-элемент.
K 1s22s22p63s23p64s1
3d-подуровень пока остаётся незаполненным.
4s-подуровень заполняется и у кальция: Са 1s22s22p63s23p64s2
И вот ТОЛЬКО у следующих 10 элементов (от скандия до цинка) происходит заполнение 3d-подуровня. Это d-элементы.
Sc 1s22s22p63s23p63d14s2
Ti 1s22s22p63s23p63d24s2
V 1s22s22p63s23p63d34s2
У ванадия на d-подуровне 3 электрона, на 4s — 2 электрона.
Казалось бы, у хрома должно получиться: Сr …3d44s2
Однако у хрома происходит переход одного электрона с s-подуровня на d-подуровень: Сr…3d54s1
Это явление называется ПРОВАЛ ЭЛЕКТРОНА, причина такого явления — более выгодная по энергии полузаполненная d-оболочка.
Дальше у марганца снова происходит «возвращение» электрона на 4s-подуровень: Mn…3d54s2
У атомов с №26 (железо) до № 28 (никель) происходит дальнейшее заполнение 3d-подуровня.
У никеля на d-подуровне 8 электронов, на 4s — 2 электрона. У меди вновь происходит переход одного электрона с s на d-подуровень: Сu …3d104s1
Это снова ПРОВАЛ ЭЛЕКТРОНА, причина которого — более выгодная по энергии полностью заполненная d-оболочка.
И наконец, цинк завершает ряд из 10 d-элементов 4 периода:
Zn 1s22s22p63s23p63d104s2
ТРЕТИЙ ЭЛЕКТРОННЫЙ УРОВЕНЬ только теперь ЗАВЕРШЕН – на нем 18 электронов.
Со следующего элемента 4 периода — галлия вновь начинается заполнение внешнего электронного уровня (№4), теперь уже 4p-подуровня – от галлия до криптона.
Ga 1s22s22p63s23p63d104s24p1 ……… Kr 1s22s22p63s23p63d104s24p6
Для краткости записи электронной конфигурации атома вместо орбиталей, полностью заселенных электронами, иногда записывают символ благородного газа, имеющего соответствующую электронную формулу: 1s2 = [He] 1s22s22p6 = [Ne]
Пример: электронная формула атома хлора 1s22s22p63s23p5, или [Ne]3s23p5.
ЭЛЕКТРОННЫЕ ФОРМУЛЫ ИОНОВ.
Ионы – заряженные частицы; катионы – положительно заряженные ионы, анионы – отрицательно заряженные ионы.
Ионы получаются из атомов путем отдачи электронов (тогда образуются катионы) или принятия электронов (образуются анионы).
S0 (атом серы)+ 2e → S2−(сульфид-анион)
Cu0(атом меди) -2е →Cu2+ (катион меди)
Электронная формула иона получается путём добавления или отнятия электронов в электронной формуле атома.
Электроны сначала уходят с внешнего электронного уровня!
Пример: составить электронные формулы ионов: As3- ; Cu2+.
1) As0 1s22s22p63s23p63d104s24p3 → As3- 1s22s22p63s23p63d104s24p6 (добавились ещё 3 электрона на внешний уровень – их стало 8, а всего – 36е: оболочка инертного газа криптона)
2) Cu01s22s22p63s23p63d104s1 → Cu2+1s22s22p63s23p6 3d9 (уходят 2 электрона, сначала ВНЕШНИЙ 4s-электрон, а потом – 3d-электроны! )
Изоэлектронные частицы – это атомы и ионы, имеющие одинаковое строение электронной оболочки. Например, ион Са2+ и атом аргона – имеют одинаковую 18- электронную оболочку.
Пример: какие из этих солей образованы изоэлектронными ионами: хлорид натрия, фторид бария, бромид магния, сульфид кальция.
NaCl Na+(10e), Cl —(18e), BaF2 Ba2+(54 e), F — (10e);
MgBr2 Mg2+(10e),Br — (36e) CaS Ca2+(18e),S2-(18e)–ионы изоэлектронны. Ответ: CaS
ОСНОВНОЕ И ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМА.
Основное состояние атома — это наиболее выгодное по энергии состояние, которое получается в результате последовательного заполнения оболочек электронами согласно правилу Хунда и принципу минимума энергии.
Поэтому ПРИ НАЛИЧИИ СВОБОДНЫХ ОРБИТАЛЕЙ и при наличии некоторой ЭНЕРГИИ (энергия возбуждения) электроны атома могут РАСПАРИВАТЬСЯ и атом переходит в возбужденное состояние. При этом число неспаренных электронов, а, следовательно, ЧИСЛО СВЯЗЕЙ, образуемых атомом, УВЕЛИЧИВАЕТСЯ.
Пример: у атома углерода на внешнем валентном слое есть 4 электрона. В невозбуждённом (основном) состоянии число неспаренных электронов равно ДВУМ: С … 2s2 2p2
|
↑↓ |
↑ |
↑ |
При переходе одного электрона с s-оболочки на р – оболочку число неспаренных электронов становится равным ЧЕТЫРЁМ: С* …2s12p3
|
↑ |
↑ |
↑ |
↑ |
Это возбужденное состояние углерода.
Тема 3. ПЕРИОДИЧЕСКИЙ ЗАКОН
Д.И. Менделеев в 1869 году так сформулировал Периодический закон: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел находятся в периодической зависимости от их атомного веса«.
Менделеев учитывал, что для некоторых элементов атомные массы могли быть определены недостаточно точно. После того, как было доказано ядерное строение атома и равенство порядкового номера элемента заряду ядра его атома, Периодический закон получил новую формулировку:
«Свойства элементов, а также образуемых ими веществ находятся в периодической зависимости от заряда их атомных ядер».
Современная Периодическая система состоит из 7 периодов (седьмой период заканчивается 118-м элементом).
Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы — 18 групп, имеющих те же обозначения, что и в короткопериодном.
В группах, обозначенных буквой А (главных подгруппах), содержатся элементы, в которых идет заселение s- и р-оболочек: s-элементы (IA- и IIA-группы) и р-элементы (IIIA-VIIIA-группы). В группах, обозначенной буквой Б (побочных подгруппах), находятся элементы, в которых заселяются d-подуровни — d-элементы.
Номер периода в Периодической системе соответствует числу энергетических уровней атома данного элемента, заполненных электронами.
Номер периода = Число энергетических уровней, заполненных электронами = номер последнего энергетического уровня
Номер группы в Периодической системе определяет число валентных электронов в атомах s- и p-элементов.
ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ.
1) Атомные и ионные радиусы.
Радиус атома – это расстояние от центра ядра до внешнего уровня (области максимальной электронной плотности внешнего уровня).
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра уменьшаются, т.к. растет заряд ядра и => притяжение внешнего электронного уровня к ядру.
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных слоёв.
У s- и p-элементов изменение радиусов как в периодах, так и в подгруппах более заметно, чем у d- и f-элементов, поскольку d- и f-электроны находятся на внутренних, а не внешних уровнях.
Уменьшение радиусов у d- и f-элементов в периодах называется d- и f-сжатием.
Образование ионов приводит к изменению ионных радиусов по сравнению с атомными.
Радиусы катионов всегда меньше, а радиусы анионов всегда больше соответствующих атомных радиусов.
Изоэлектронные ионы – это ионы, имеющие одинаковое электронное строение.
Радиус изоэлектронных ионов уменьшается слева направо по периоду, т.к. заряд ядра увеличивается и растёт притяжение внешнего электронного уровня к ядру.
Пример: изоэлектронные ионы с электронной оболочкой, соответствующей аргону – (18 е): S2-, Cl—, K+, Ca2+ и т.п. В этом ряду радиус уменьшается, т.к. растёт заряд ядра.
2) Электроотрицательность— это способность атома элемента к притягивать к себе электроны в химической связи.
Электроны в общей электронной паре смещены к атому того элемента, который имеет большую электроотрицательность.
Слева направо по периоду происходит увеличение электроотрицательности, т.к. растёт заряд ядра и внешний уровень притягивается к ядру сильнее.
Сверху вниз по подгруппе электроотрицательность уменьшается, т.к. увеличивается число электронных уровней и увеличение радиуса. Внешние электроны слабее притягиваются к ядру.
На рис. приведены значения электроотрицательности различных элементов по Полингу.
Металлами являются:
-все элементы побочных подгрупп (d-элементы);
— лантаноиды, актиноиды;
-все s- элементы, кроме водорода и гелия.
р-элементы делятся диагональю на металлы и неметаллы:
|
Ве |
В |
||||
|
Al |
Si |
||||
|
Ge |
As |
неметаллы |
|||
|
металлы |
Sb |
Te |
22 штуки |
||
|
Po |
At |
Каждый период начинается щелочным металлом (или водородом), а заканчивается инертным газом.
3) Валентность – число связей, которые образует атом в молекуле.
Высшая валентность как правило равна номеру группы (исключения – элементы второй половины второго периода – азот, кислород, фтор, инертные газы – гелий, неон, аргон, а также металлы побочных подгрупп первой и VIIIB группы (второй и третий элемент «триады»)).
4) Степень окисления – условный заряд у атома в молекуле, рассчитанный, исходя из предположения, что все связи в молекуле – ионные (т.е. электроны полностью смещены от менее электроотрицательного атома к более электроотрицательному.
Высшая положительная степень окисления определяется числом валентных электронов и равна номеру группы. У s- и р-элементов она равна числу внешних электронов. У d-элементов (кроме групп IB,IIB и VIIIB) — она равна числу d+s электронов.
Исключения: 1) фтор, кислород
2) инертные газы – гелий, неон, аргон.
3) медь, серебро, золото
4) кобальт, никель, родий, палладий, иридий, платина.
Для неметаллов также характерна низшая (отрицательная) степень окисления:
Отрицательная степень окисления неметалла = 8 – номер группы.
5) Высшие оксиды и гидроксиды.
1) Степень окисления элемента в высшем оксиде и гидроксиде равна номеру группы:
SeO3 – высший оксид селена.
2) Чем активнее металл, тем более выражены основные свойства высшего оксида и гидроксида.
3) Чем активнее неметалл и чем больше высшая степень окисления – тем сильнее выражены кислотные свойства.
6) ВОДОРОДНЫЕ СОЕДИНЕНИЯ.
Существует два типа водородных соединений:
- Ионные солеобразные гидриды
Это соединения активных металлов с водородом, в которых водород имеет отрицательную степень окисления: СаН2 – гидрид кальция. Это кристаллические вещества, похожие по виду на соли, поэтому их называют СОЛЕОБРАЗНЫМИ.
- ЛЕТУЧИЕ водородные соединения – их образуют только НЕМЕТАЛЛЫ.
В них отрицательную степень окисления имеет неметалл, а водород имеет степень окисления +1. Все газы, кроме воды.
Особенности свойств летучих водородных соединений.

 Свойства основных оксидов на ОГЭ и ЕГЭ по химии. Взаимодействие основных оксидов с водой, кислотами, кислотными оксидами, амфотерными оксидами, восстановителями.
Свойства основных оксидов на ОГЭ и ЕГЭ по химии. Взаимодействие основных оксидов с водой, кислотами, кислотными оксидами, амфотерными оксидами, восстановителями.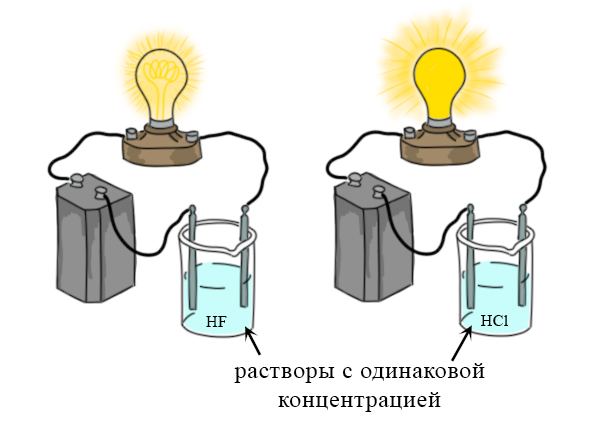 Электролиты и неэлектролиты, сильные и слабые электролиты. Список сильных и слабых электролитов, и неэлектролитов. Почему загорается лампочка при соединении с некоторыми растворами?
Электролиты и неэлектролиты, сильные и слабые электролиты. Список сильных и слабых электролитов, и неэлектролитов. Почему загорается лампочка при соединении с некоторыми растворами? Репетитор по химии для подготовки к ЕГЭ на высокий балл. Подготовка к ЕГЭ по химии в Москве и дистанционно.
Репетитор по химии для подготовки к ЕГЭ на высокий балл. Подготовка к ЕГЭ по химии в Москве и дистанционно.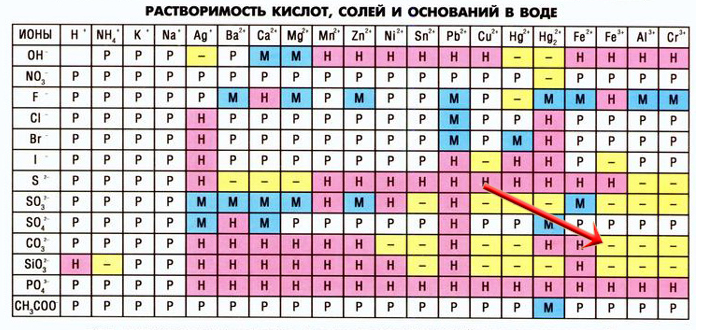 Неорганическая химия ЕГЭ. Задание 8 по химии теория и практика. Шпаргалки по химии. Как решать ЕГЭ по заданиям.
Неорганическая химия ЕГЭ. Задание 8 по химии теория и практика. Шпаргалки по химии. Как решать ЕГЭ по заданиям. Водород на ЕГЭ по химии: получение водорода, положение в периодической системе. Реакция взаимодействия водорода с галогенами, металлами, халькогенами. Восстановительные свойства водорода.
Водород на ЕГЭ по химии: получение водорода, положение в периодической системе. Реакция взаимодействия водорода с галогенами, металлами, халькогенами. Восстановительные свойства водорода.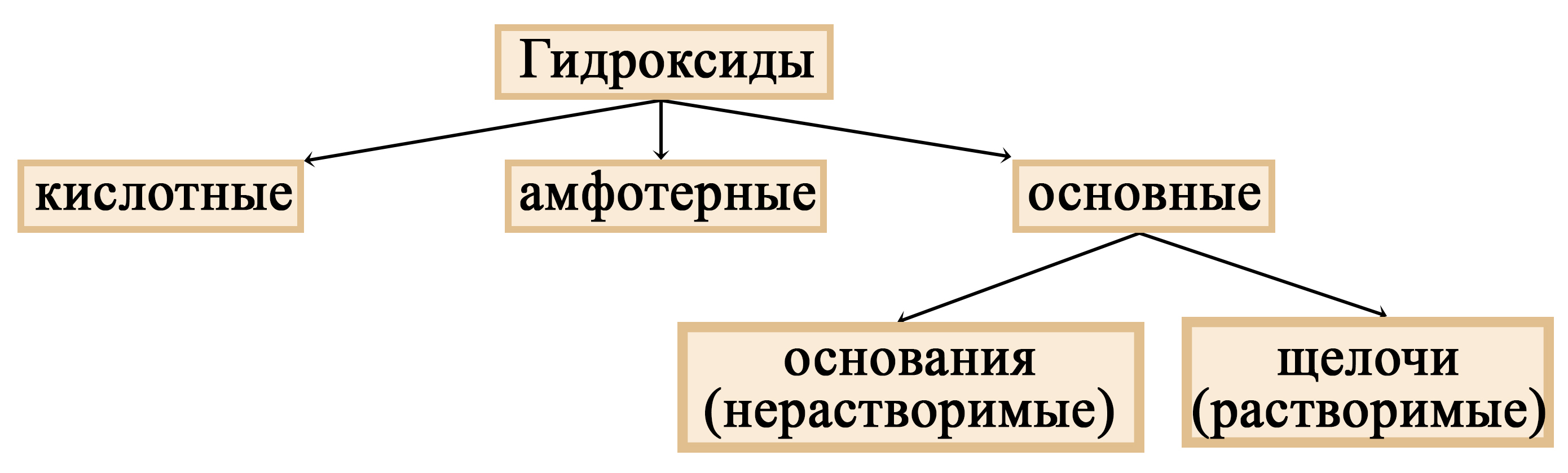 Реакции щелочей. Щелочь с кислотой. Соль и щелочь. Образование щелочи из оксида. Металлы со щелочами. Растворимые гидроксиды.
Реакции щелочей. Щелочь с кислотой. Соль и щелочь. Образование щелочи из оксида. Металлы со щелочами. Растворимые гидроксиды.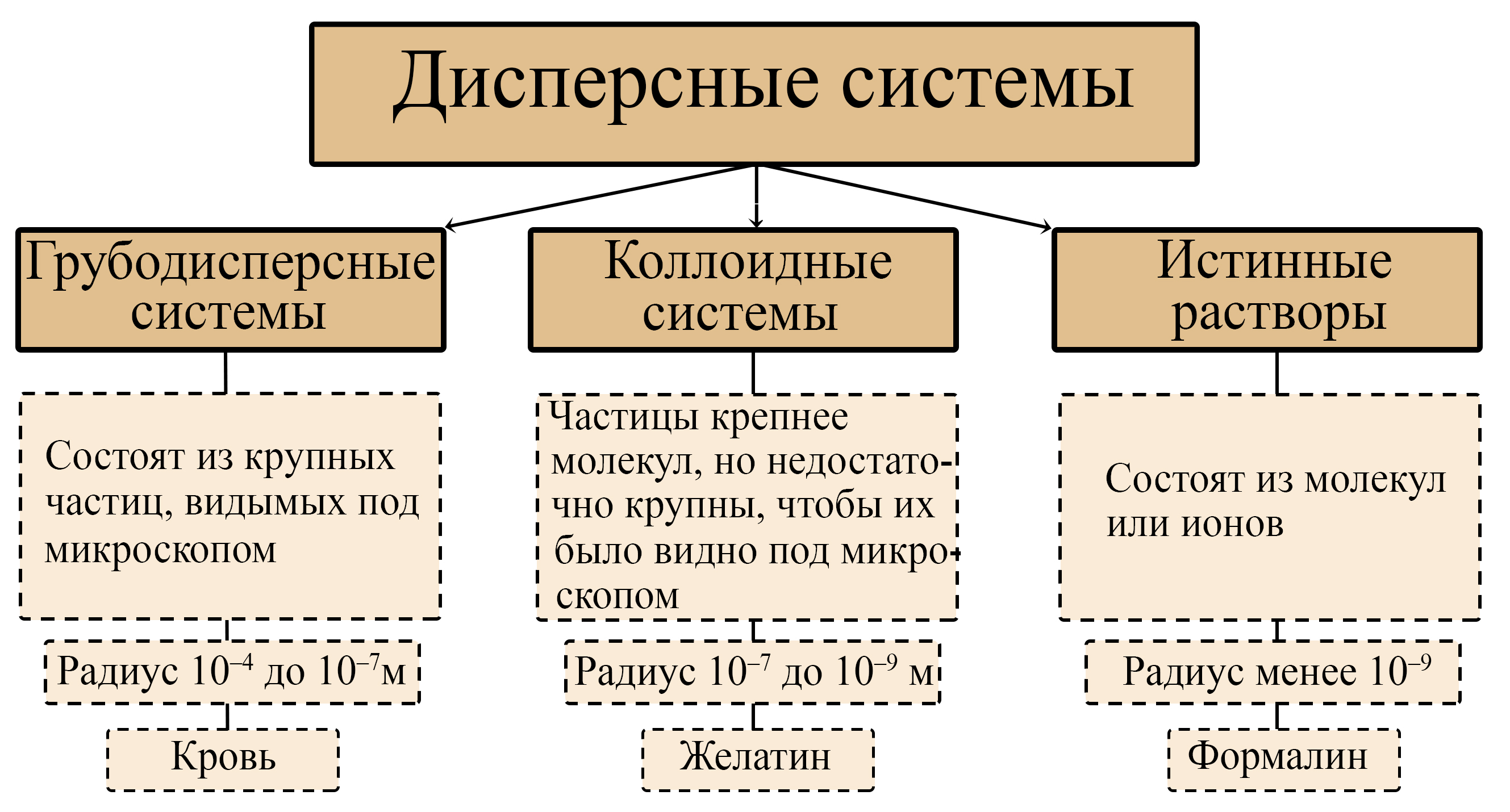 Кодификатор ФИПИ. Конспект к ЕГЭ. Гели и золи. Коллоиды. Виды дисперсных систем. Истинные растворы. ЕГЭ химия. Дисперсные системы 11 класс.
Кодификатор ФИПИ. Конспект к ЕГЭ. Гели и золи. Коллоиды. Виды дисперсных систем. Истинные растворы. ЕГЭ химия. Дисперсные системы 11 класс.







































