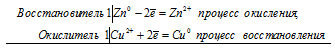…
В данном разделе вы найдете задачи по теме Коррозия металлов. Приведены уравнения реакций, протекающих при электрохимической коррозии металлов, а также примеры задач на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов.
Задача 1. В каком случае цинк корродирует быстрее: в контакте с никелем, железом или с висмутом? Ответ поясните. Напишите для всех случаев уравнение электрохимической коррозии в серной кислоте. Будет ли оксидная пленка, образующаяся на кальции, обладать защитными свойствами?
Показать решение »
Решение.
В месте контакта двух металлов корродирует более активный металл. Происходит отток электронов от более активного металла к менее активному. Металл тем активнее, чем более отрицателен его электродный потенциал. В таблице электродных потенциалов найдем:
EZn2+/Zn = — 0,763 В
EFe2+/Fe = — 0,440 В
ENi2+/Ni = — 0,250 В
EBi3+/Bi = + 0,215 В
В данном случае, цинк корродирует быстрее в контакте с висмутом, так как из перечисленных металлов, Bi является самым неактивным. В образовавшейся паре роль анода выполняет цинк.
Запишем уравнения электрохимической коррозии в серной кислоте:
Zn—Bi
К: 2H+ +2e— = H2
А: Zn — 2e— = Zn2+
Zn + 2H+ = Zn2++ H2
Zn + H2SO4 = ZnSO4 + H2
Fe-Bi
К: 2H+ +2e— = H2
А: Fe — 3e— = Fe3+
2Fe + 6H+ = Fe3++ 3H2
2Fe + 3H2SO4 = Fe2(SO4)3 + 3H2
Ni-Bi
К: 2H+ +2e— = H2
А: Ni — 2e— = Ni2+
Ni + 2H+ = Ni2++ H2
Ni + H2SO4 = NiSO4 + H2
Будет ли оксидная пленка, образующаяся на кальции, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок)
Мок = 40+16=56 г/моль
AMe = 40 г/моль
n = 1
ρМе = 1,55 г/см3
ρок = 3,37 г/см3
α = Vок/VМе =56·1,55/(40·1·3,37)
α = 0,64
т.е α<1, а это значит, что оксидная пленка, образующаяся на Ca, не обладает защитными свойствами.
Задача 2. Приведите примеры двух металлов, пригодных для протекторной защиты железа. Для обоих случаев напишите уравнение электрохимической коррозии во влажной среде, насыщенной кислородом. Будет ли оксидная пленка, образующаяся на алюминии, обладать защитными свойствами?
Показать решение »
Решение.
Протекторная защита заключается в присоединении к защищаемому металлическому изделию, металла с более отрицательным значением стандартного электродного потенциала E0, т.е. более активного металла. Для защиты железа подойдут, например, цинк и бериллий:
EFe2+/Fe = — 0,440 В
EZn2+/Zn = — 0,763 В
EBe2+/Be = — 1,850 В
Запишем уравнения электрохимической коррозии во влажной среде, насыщенной кислородом:
Fe—Zn
К: O2 + 2H2O + 4e— = 4OH—
А: Zn — 2e—= Zn2+
2Zn + O2 + 2H2O = 2Zn2++ 4OH—
2Zn + O2 + 2H2O = 2Zn(OH)2
Fe-Be
К: O2 + 2H2O + 4e— = 4OH—
А: Be — 2e— = Be2+
2Be + O2 + 2H2O = 2Be2++ 4OH—
2Be + O2 + 2H2O = 2Be(OH)2
Будет ли оксидная пленка, образующаяся на алюминии, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок)
Мок = 27·2+16·3 = 102 г/моль
AMe = 27 г/моль
n = 2
ρМе = 2,7 г/см3
ρок = 3,99 г/см3
α = Vок/VМе = 102·2,7/(27·2·3,99)
α = 1,3
т.е 2,5>α>1, а это значит, что оксидная пленка, образующаяся на Al, является сплошной и обладает защитными свойствами.
Задача 3. Деталь сделана из сплава, в состав которого входит магний и марганец. Какой из компонентов сплава будет разрушаться при электрохимической коррозии? Ответ подтвердите уравнениями анодного и катодного процесса коррозии: а) в кислой среде; б) в кислой среде, насыщенной кислородом. Будет ли оксидная пленка, образующаяся на олове, обладать защитными свойствами?
Показать решение »
Решение.
При электрохимической коррозии сплава, в первую очередь будет разрушаться более активный металл, т.е. металл, имеющий более отрицательное значение стандартного электродного потенциала. В таблице электродных потенциалов найдем:
EMg2+/Mg = — 2,37 В
EMn2+/Mn = — 1,18 В
По значениям E видно, что магний является более активным металлом, чем марганец, вследствие чего при коррозии Mg будет разрушаться в первую очередь.
Запишем уравнения электрохимической коррозии магния а) в кислой среде; б) в кислой среде, насыщенной кислородом:
а) в кислой среде
К: 2H+ +2e— = H2
А: Mg — 2e— =Mg2+
Mg + 2H+ = Mg 2++ H2
Mg + H2SO4 = MgSO4 + H2
б) в кислой среде, насыщенной кислородом
К: O2 + 2H2O + 4e— = 4OH—
А: Mg — 2e— =Mg+
2Mg + O2 + 2H2O = 2Mg2++ 4OH—
2Mg + O2 + 2H2O = 2Mg(OH)2
Будет ли оксидная пленка, образующаяся на олове, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок)
Олово может образовать два оксида SnO и SnO2, поэтому рассчитаем значение α для каждого случая
МSnO = 119+16 = 135 г/моль
МSnO2 = 119+16·2 = 151 г/моль
ASn = 119 г/моль
n = 1
ρSn = 7,31 г/см3
ρSnO = 6,45 г/см3
ρSnO2 = 6,95 г/см3
α = VSnO/VSn = 135·7,31/(119·1·6,45) = 1,3
α = 1,3
α = VSnO2/VSn = 151·7,31/(119·1·6,95) = 1,4
α = 1,3
т.е для всех оксидных пленок α лежит в интервале 2,5>α>1, т.е. они являются сплошными и обладают защитными свойствами.
Задача 4. С целью защиты от коррозии цинковое изделие покрыли оловом. Какое это покрытие: анодное или катодное? Напишите уравнение атмосферной коррозии данного изделия при нарушении целостности покрытия. Оценить коррозионную стойкость алюминия в серной кислоте, если убыль массы алюминиевой пластины размером 70х20х1 мм составила после 8 суток испытания 0,0348 г.
Показать решение »
Решение.
Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный), чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
В таблице электродных потенциалов найдем:
EZn2+/Zn = — 0,763 В
ESn2+/Sn = — 0,136 В
Олово будет выполнять роль катода и покрытие из него – катодное. При нарушении целостности покрытия, корродировать будет цинк, как более активный металл. При атмосферной коррозии протекают следующие уравнения реакций:
К: O2 + 2H2O + 4e— = 4OH—
А: Zn — 2e—= Zn2+
2Zn + O2 + 2H2O = 2Zn2++ 4OH—
2Zn + O2 + 2H2O = 2Zn(OH)2
Оценить коррозионную стойкость алюминия в серной кислоте, если убыль массы алюминиевой пластины плотностью ρ = 2,7 г/см3, размером 70х20х1 мм составила после 8 суток испытания 0,0348 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(7·2) + 2·(7·0,1) + 2·(2·0,1) = 29,8 см2
h = 0,0348/(29,8·2,7) = 0,00043см = 0,0043 мм
Kн = 365·0,0043/8 = 0,02 мм/год
По десятибалльной шкале коррозионной стойкости металлов, алюминий соответствует 4 баллам и относится к стойким металлам.
Задача 5. Если на стальной предмет нанести каплю воды, то коррозии подвергается средняя, а не внешняя часть смоченного металла. Чем это можно объяснить? Какой участок металла, находящийся под влиянием капли, является анодным, а какой катодным? Составьте электронные уравнения соответствующих процессов. Будет ли оксидная пленка, образующаяся на никеле, обладать защитными свойствами?
Показать решение »
Решение.
При нанесении на стальной предмет капли воды, наибольший доступ воздуха будет по краям капли, где протекает процесс восстановления кислорода. Т.е. края капли выступают в качестве катода. Для окисления железа остается центр капли, где доступ воздуха минимален. Здесь центр капли является анодом. В этом случае протекают следующие реакции:
А: Fe – 2e— = Fe2+
K: O2 + 2H2O + 4e— = 4OH—
2Fe + O2 + 2H2O = 2Fe2++ 4OH—
2Fe + O2 + 2H2O = 2Fe(OH)2
Будет ли оксидная пленка, образующаяся на никеле, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок)
Мок = 59+16 = 75 г/моль
AMe = 59 г/моль
n = 1
ρМе = 8,9 г/см3
ρок = 6,7 г/см3
Подставим значения в формулу:
α = 75·8,9/(59·1·6,7) = 1,7
т.е α лежит в интервале 2,5>α>1, т.е. оксидная пленка является сплошной и обладает защитными свойствами.
Задача 7. Сплав содержит железо и никель. Какой из названных компонентов будет разрушаться при атмосферной коррозии? Приведите уравнение анодного и катодного процессов. Оценить коррозионную стойкость цинка на воздухе при высоких температурах. Образец цинка размером 50х30х1 мм после 180 часов окисления и снятия продуктов коррозии весил 10,6032 г.
Показать решение »
Решение.
Исходя из положения металлов в электрохимическом ряду напряжения металлов, находим, что железо более активный металл, чем никель:
EFe2+/Fe = — 0,440 В
ENi2+/Ni = — 0,250 В
Поэтому в первую очередь при атмосферной коррозии будет разрушаться железо. В этом случае протекают следующие реакции:
А: Fe – 2e— = Fe2+
K: O2 + 2H2O + 4e— = 4OH—
2Fe + O2 + 2H2O = 2Fe2++ 4OH—
2Fe + O2 + 2H2O = 2Fe(OH)2
Далее Fe(OH)2 переходит в Fe(OH)3
4Fe(OH)2 + O2 + 2H2O = Fe(OH)3
Оценить коррозионную стойкость цинка на воздухе при высоких температурах. Образец цинка плотностью ρ = 7,14 г/см3, размером 50х30х1 мм после 180 часов окисления и снятия продуктов коррозии весил 10,6032 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(5·3) + 2·(5·0,1) + 2·(3·0,1) = 31,6 см2
Масса металла до коррозии равна:
m1 = V·ρ = 5·3·0,1·7,14 = 10,71г.
Убыль массы:
Δm = m1 – m2 = 10,71 — 10,6032 = 0,1068
h = 0,1068/(31,6·7,14) = 0,00047 см = 0,0047 мм
Kн = 365·0,0047/7,5 = 0,23 мм/год
По десятибалльной шкале коррозионной стойкости металлов, цинк соответствует 6 баллам и относится к пониженностойким металлам.
Задача 8. Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в азотной кислоте. Будет ли оксидная пленка, образующаяся на свинце, обладать защитными свойствами?
Показать решение »
Решение.
Техническое железо содержит примеси, которые, как правило, выполняют роль катода. Либо, если это углерод, который не передает в раствор положительно заряженных ионов и не имеет заградительного барьера от ионов водорода в кислой среде. Само железо будет служить анодом и подвергаться разрушению.
В химически чистом железе нет примесей, которые образовали бы гальванопару с железом, где бы оно окислялось.
При коррозии технического железа протекают следующие реакции:
Во влажном воздухе
А: Fe – 2e— = Fe2+
K: O2 + 2H2O + 4e— = 4OH—
2Fe + O2 + 2H2O = 2Fe2++ 4OH—
2Fe + O2 + 2H2O = 2Fe(OH)2
Далее Fe(OH)2 переходит в Fe(OH)3
4Fe(OH)2 + O2 + 2H2O = Fe(OH)3
В азотной кислоте
А: Fe – 2e— = Fe2+
K: 2H+ + NO3— + e— = NO2 + H2O
Fe + 4H+ + 2NO3— = Fe2++ 2NO2 + 2H2O
Fe + 4HNO3 = Fe(NO3)2 + 2NO2 + 2H2O
Будет ли оксидная пленка, образующаяся на свинце, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок)
Свинец может образовать оксиды состава PbO и PbO2, поэтому рассчитаем значение α для каждого случая
МPbO = 207+16 = 223 г/моль
МPbO2 = 207+16·2 = 239 г/моль
APb = 207 г/моль
n = 1
ρPb = 11,34 г/см3
ρPbO = 9,63 г/см3
ρPbO2 = 9,38 г/см3
α = VPbO/VPb = 223·11,34/(207·1·9,63) = 1,3
α = 1,3
α = VPbO2/VPb = 239·11,34/(207·1·9,38) = 1,4
α = 1,3
т.е для всех оксидных пленок α лежит в интервале 2,5>α>1, т.е. они являются сплошными и обладают защитными свойствами.
Задача 9. Приведите примеры двух металлов, пригодных для протекторной защиты никеля. Для обоих случаев напишите уравнение электрохимической коррозии в среде азотной кислоты. Оценить коррозионную стойкость кадмия на воздухе при высоких температурах. Образец кадмия плотностью ρ = 8,65 г/см3, размером 45х25х1 мм после 150 часов окисления и снятия продуктов коррозии весил 10,0031 г.
Показать решение »
Решение.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Для протекторной защиты никеля подойдут, например, железо и цинк:
ENi2+/Ni = — 0,250 В
EFe2+/Fe = — 0,440 В
EZn2+/Zn = — 0,763 В
При электрохимической коррозии в среде азотной кислоты протекают следующие реакции:
Ni — Fe
А: Fe – 2e— = Fe2+
K: 2H+ + NO3— + e— = NO2 + H2O
Fe + 4H+ + 2NO3— = Fe2++ 2NO2 + 2H2O
Fe + 4HNO3 = Fe(NO3)2 + 2NO2 + 2H2O
Ni — Zn
А: Zn – 2e— =Zn+
K: 2H+ + NO3— + e— = NO2 + H2O
Zn + 4H+ + 2NO3— = Zn 2++ 2NO2 + 2H2O
Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O
Оценить коррозионную стойкость кадмия на воздухе при высоких температурах. Образец кадмия плотностью ρ = 8,65 г/см3, размером 45х25х1 мм после 150 часов окисления и снятия продуктов коррозии весил 10,0031 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(4,5·2,5) + 2·(4,5·0,1) + 2·(2,5·0,1) = 23,9 см2
Масса металла до начала коррозии равна:
m1 = V·ρ = 4,5·2,5·0,1·8,65 = 9,7313 г
Убыль массы:
Δm = m1 – m2 = 10,0031 – 9,7313 = 0,2718
h = 0,2718/(23,9·8,65) = 0,0013 см = 0,013 мм
Kн = 365·0,013·24/150 = 0,76 мм/год
По десятибалльной шкале коррозионной стойкости металлов, определяем, что в данных условиях, кадмий соответствует 7 баллам и относится к пониженностойким металлам.
Коррозия металлов. Методы защиты металлов от коррозии
Задача 74
Железная пластинка погружается в разбавленный раствор 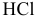
Решение:
При погружении железной пластинки в раствор 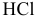
При касании железа медью образуется короткозамкнутый гальванический элемент, состоящий из железного и медного электродов, загруженных в раствор электролита. Медный электрод играет роль катода, так как он имеет более высокий электродный потенциал. На катоде должен протекать процесс восстановления, а на аноде — железной пластине — процесс окисления:
Таким образом, железо продолжает растворяться, причем скорость электрохимического процесса выше, чем скорость обычного окислительно-восстановительного процесса.
На катоде происходит деполяризация, т.е. процесс восстановления каких-либо частиц, называемых деполяризатором, избытком электронов.
В кислой среде роль деполяризатора играют катионы водорода:
Таким образом, водород выделяется с поверхности меди, несмотря на отсутствие взаимодействия 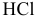
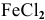
Задача 75
Две пластинки — одна железная, а другая магниевая -погружены раздельно в разбавленную соляную кислоту. Что изменится, если соединить обе пластинки?
Решение:
Обе пластинки, находящиеся раздельно в разбавленной 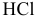
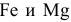
При объединении пластин образуется короткозамкнутый гальванический элемент, и протекает электрохимическая коррозия. Магний, будучи более активным металлом, играет роль анода. На аноде происходит процесс окисления:
На катоде — железной пластинке — будет происходить водородная деполяризация:
Таким образом, при соприкосновении двух пластин наблюдается усиление выделения водорода с поверхности железа, хотя разрушение железа резко уменьшается, а активизируется процесс разрушения магниевой пластины. Выделение водорода с поверхности магния резко сокращается.
Задача 76
Кладут в один стакан, содержащий солевой раствор, кусочек чистого железа, а в другой стакан, содержащий такой же солевой раствор, — кусочек железа, соединенный с кусочком свинца. В оба стакана есть доступ кислороду воздуха. Через несколько дней определяют содержание ионов железа в обоих стаканах. В каком из стаканов концентрация ионов железа будет больше ?
Решение:
Кислород растворяется в водном растворе. Железо, погруженное в солевой раствор, в присутствии растворенного кислорода будет подвергаться коррозии, хотя и медленно, так как оно чистое, а чистые металлы медленно корродируют (обычно присутствие примесей в железе (чугуне) резко увеличивает скорость коррозии).
Процесс коррозии чистого железа может быть представлен следующей схемой:
где 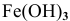
Железо в контакте с менее активным свинцом играет роль анода и подвергается электрохимической коррозии с кислородной деполяризацией на свинцовом катоде:
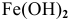
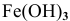
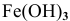
Скорость электрохимической коррозии намного выше скорости химической коррозии, поэтому в стакане, содержащем железо, соединенное со свинцом, концентрация ионов железа 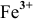
Задача 77
Описать процессы электрохимической коррозии, протекающие на оцинкованном железе при наличии трещин в защитном слое:
а) в кислой среде;
б) в нейтральной среде в присутствии кислорода.
Решение:
Покрытие железа цинком относится к анодным покрытиям, так как металл покрытия более активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль анода.
В кислой среде на поверхности катода, т.е. на поверхности железа, протекает водородная деполяризация (рис.6):
В нейтральной среде в присутствии кислорода на поверхности катода (железа) протекает кислородная деполяризация (рис.7):
Продукт коррозии, образующийся по реакции
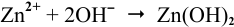
Задача 78
Описать процессы электрохимической коррозии,
протекающей на хромированном железе при наличии трещин в защитном слое:
а) в кислой среде;
б) в нейтральной среде в присутствии кислорода.
Решение:
Покрытие железа хромом относится к катодным покрытиям, так как металл покрытия менее активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль катода.
Защищаемый металл играет роль анода, т.е. подвергается разрушению.
В кислой среде на поверхности катода, т.е. на поверхности хрома, протекает водородная деполяризация (рис.8):
В нейтральной среде в присутствии кислорода на поверхности катода (хрома) протекает кислородная деполяризация (рис.9):
Продукт коррозии, образующийся по реакции
на воздухе окисляется:
Задача 79
Объяснить, почему в стальном сосуде застойная зона подвергается интенсивной коррозии (нейтральная среда в присутствии кислорода воздуха), тогда как в цинковом сосуде, наоборот, застойная зона подвергается коррозии в незначительной степени.
Решение:
Интенсивность (скорость) электрохимической коррозии зависит от ЭДС образующегося короткозамкнутого элемента: чем больше величина ЭДС, тем интенсивнее электрохимическая коррозия.
Для электрохимической коррозии ЭДС рассчитывается аналогично расчету ЭДС гальванического элемента:
где 
Для электродной полуреакции кислородной деполяризации
В зоне, подверженной воздействию кислорода, электродный потенциал катодных участков будет выше, чем в застойной зоне (концентрация кислорода в растворе находится в числителе). Таким образом, в начальный момент ЭДС микрогальваноэлементов в зоне, подверженной воздействию кислорода, будет выше, чем ЭДС микрогальваноэлементов в застойной зоне, а значит, коррозия анодных участков в зонах, подверженных воздействию кислорода, будет значительной. Эта коррозия в начальный момент приводит к накоплению анионов 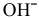
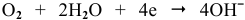
В сосуде из цинка коррозия зон, подверженных воздействию кислорода, всегда будет очень интенсивной, так как щелочная среда не пассивирует цинк, а наоборот, способствует его разрушению:
Поэтому застойная зона меньше подвергается коррозии, чем аэрируемая.
Задача 80
Показать необходимыми расчетами, что платина в контакте с золотом никогда не подвергается электрохимической коррозии, тогда как медь в контакте в золотом подвергается электрохимической коррозии только в присутствии кислорода в щелочной среде.
Решение:
Для процесса кислородной деполяризации
электродный потенциал определяется по формуле Нернста:
В нейтральной среде
В щелочной среде
Для того, чтобы протекала электрохимическая коррозия, необходимо следующее:
Отсюда
Таким образом, электродный потенциал металла (анода) должен быть ниже 0 В в нейтральной среде или ниже 0,401 В в сильно щелочной среде (рН=14). Если находятся в контакте золото и платина, платина играет роль анода, но ее стандартный электродный потенциал 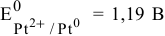
Медь в контакте с золотом может подвергаться электрохимической коррозии с кислородной деполяризацией, особенно в щелочной среде, так как 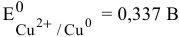
Остается показать отсутствие электрохимической коррозии с водородной деполяризацией для обоих случаев.
Электродный потенциал водородной деполяризации выражается уравнением:
В кислой среде
В слабокислой среде
Таким образом, металлы, имеющие электродный потенциал выше 0 В, в кислой среде не подвергаются электрохимической коррозии с водородной деполяризацией.
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Теоретический материал по определению степеней окисления в пункте 4(Б)
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Это реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов.
ОКИСЛИТЕЛИ — это атомы, ионы или молекулы, которые ПРИНИМАЮТ электроны. Окислитель принимает электроны – это процесс ВОССТАНОВЛЕНИЯ.
1) Оксиды, кислоты, соли с максимально положительной степенью окисления входящего в них элемента.
Например: кислоты – HNO3, H2SO4, HClO4, H2Cr2O7;
соли – KСlO4, KClO3, KNO3, KMnO4, K2Cr2O7;
оксиды –PbO2, Mn2O7, CrO3, N2O5
2) Самые активные неметаллы – фтор, кислород, озон
ВОССТАНОВИТЕЛИ — это атомы, ионы или молекулы, которые ОТДАЮТ электроны.Восстановитель отдает электроны — это процесс окисления.
ВОССТАНОВИТЕЛИ:
1.Bсе металлы (они могут только отдавать электроны);
2) Bещества с минимально возможной (отрицательной) степенью окисления неметалла.
Например: водородные соединения – РН3, HI, HBr, H2S;
соли – KI, NaBr, K2S.
Все остальные вещества в зависимости от условий могут быть как окислителями, так и восстановителями: Н2О2, KNO2, Cl2, простые вещества-неметаллы могут как принимать, так и отдавать электроны.
Классификация окислительно-восстановительных реакций
ОСНОВНОЕ ТРЕБОВАНИЕ
Число электронов, отданных восстановителем =
числу электронов, принятых окислителем
МЕТОДЫ СОСТАВЛЕНИЯ ОВР
1. Метод электронного баланса
2. Метод электронно-ионного баланса
СОСТАВЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ УРАВНЕНИЙ МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА
1.Указываем степени окисления каждого элемента
2.Находим
элементы, изменившие степень окисления
3.Составляем электронный баланс.
Выписываем элементы, изменившие степень окисления.
4.Определяем количество отданных и присоединенных электронов (элемент, отдающий электроны увеличивает степень окисления, присоединяющий – уменьшает).
5.Уравниваем количество отданных и присоединенных электронов, т.е. находим коэффициенты, которые необходимо поставить у элементов, изменивших степень окисления (справа).
6. Указываем окислитель и восстановитель, или процесс окисления и восстановления
7.Устанавливаем найденные коэффициенты.
8. Остальные коэффициенты находим методом подбора.
Сначала уравнивают элементы, повторяющиеся один раз, затем те, у которых стоят коэффициенты, затем водород и кислород.
КОРРОЗИЯ – это разрушение металлов и сплавов в результате воздействия на них окружающей среды.
Это окислительно-восстановительный процесс, при котором атомы металлов переходят в ионы (идёт процесс окисления):
ТИПЫ КОРРОЗИИ
ХИМИЧЕСКАЯ КОРРОЗИЯ – разрушение металлов в результате взаимодействия с сухими газами или жидкостями, не проводящими электрический ток.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ – разрушение металла в присутствии воды и кислорода, либо в растворах электролитов.
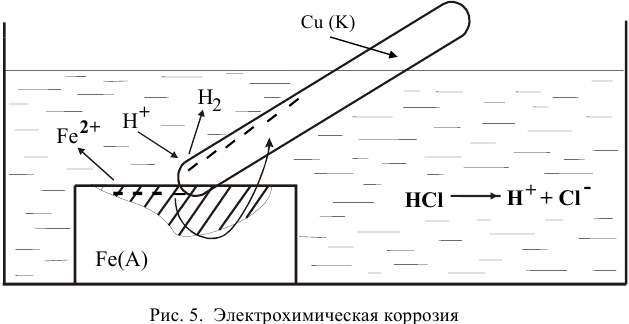
На поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе. Электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
УСЛОВИЯ, СПОСОБСТВУЮЩИЕ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ:
- Положение металлов в ряду напряжения. Чем дальше расположены металлы друг от друга в ряду, тем быстрее происходит коррозия.
- Чистота металла (с примесями металлы быстрее подвергаются коррозии)
- Неровность поверхности металла, трещины.
- Блуждающие токи.
- Грунтовые воды.
- Среда электролита (наличие раствора сильного электролита, например, морская вода, усиливает коррозию)
- Повышение температуры.
- Действие микроорганизмов (бактерий и грибов)
МЕРЫ ЗАЩИТЫ
1. Защитные покрытия: металлические, лаки, краски, пленки, смазки и т. п.
Уменьшают скорость коррозии как в результате затруднения выхода металла в окружающую среду, так и в результате затруднения доступа окислителя к поверхности металла.
2.Электрохимическая защита
Достигают либо подключением защищаемого металла к отрицательному полюсу источника тока (катод, катодная зашита), либо соединяя защищаемое металлическое изделие с более активным металлом («жертвенный анод»). Гораздо реже применяют анодную защиту: при этом потенциал корродирующего металла специальными способами сдвигают в область пассивации.
3. Использование специальных (легированных) сплавов, состав которых подбирают таким образом, чтобы скорость коррозии в данной коррозионно-активной среде была наименьшей
4. Использование ингибиторов коррозии. Уменьшают скорость разрушения металла. Ингибиторы коррозии можно добавлять в агрессивную среду, например, при перевозке кислот по железной дороге или транспортировке газа по газопроводам, так и вводить в состав защитного покрытия (ингибированные смазки и др.).
28(П) Тесты ЕГЭ ФИПИ 2015 по теме «Окислительно-восстановительные реакции»
ДОПОЛНИТЕЛЬНЫЙ МАТЕРИАЛ
ЭЛЕКТРОННО- ИОННЫЙ МЕТОД (МЕТОД ПОЛУРЕАКЦИЙ)
Преимущество:
при составлении полуреакций рассматриваются реально существующие в растворе ионы и наглядно видна роль среды. В ионном виде записываются восстановитель, окислитель и продукты их взаимодействия:
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ записывают в виде ионов.
СЛАБЫЕ ЭЛЕКТРОЛИТЫ: газы↑, нерастворимые вещества↓ — в виде молекул.
При составлении полуреакций окисления и восстановления следует учитывать следующее:
1. Если исходное вещество содержит БОЛЬШЕ АТОМОВ КИСЛОРОДА, чем продукт реакции, то освобождающийся кислород в форме О-2 связывается
в кислых растворах ионами водорода (Н+) – в воду О-2 + 2Н+ = Н2О
в нейтральных и щелочных растворах — в гидроксид-ионы. В нейтральных растворах: О-2 + Н+ (НОН) = ОН- В щелочных растворах : О-2 + НOH = 2ОН-
2. Если исходное вещество содержит МЕНЬШЕ АТОМОВ КИСЛОРОДА, чем продукты реакции, то недостаток их восполняется в кислых и нейтральных растворах за счёт молекул воды ,
в кислых растворах : Н2О = О-2 + 2Н+
В нейтральных растворах: Н2О = О-2 + 2 Н+
в щелочных — за счёт гидроксид-анионов. 2ОН- = О-2 + Н2О
АЛГОРИТМ РАССТАНОВКИ КОЭФФИЦИЕНТОВ МЕТОДОМ ПОЛУРЕАКЦИЙ
1. Записать схему реакции в молекулярной форме:
2. Составить схему реакции в полной ионной форме, подчеркнув восстановитель и окислитель
3. Составить сокращенную молекулярно-ионную схему
4. Определить характер среды – кислая, щелочная, нейтральная
Наличие Н+ – среда кислая
5. Выписать частицы, изменившие состав и заряд:
6. Составить молекулярно-ионные уравнения для процессов окисления и восстановления с учетом характера среды
-Проверьте число атомов (О) в левой и правой частях уравнений
— Проверьте число атомов каждого элемента
7. Проверить суммы зарядов ионов в левой и правой частях молекулярно-ионных уравнений:
Если сумма зарядов исходных частиц больше суммы зарядов продуктов реакции, то к левой части надо добавить соответствующее число электронов, если меньше — вычесть
8. Найти коэффициенты восстановителя, окислителя и продуктов их превращения.
Умножить левую и правую части обоих уравнений на найденные коэффициенты
9. Составить сокращенное ионное уравнение окислительно-восстановительной реакции.
ДЛЯ ЭТОГО:
1.сложить уравнения полуреакций
2. сократить, если имеются, одинаковые частицы
3. добавить в левую часть уравнения необходимое число сопутствующих противоположно заряженных ионов (см. стрелки)
4. то же число тех же ионов добавьте в правую часть уравнения
10. Составить полное молекулярно-ионное уравнение
11. По полному молекулярно-ионному уравнению составьте полное молекулярное уравнение
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Задания Д30 C1 № 1
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
2
Задания Д30 C1 № 49
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
3
Задания Д30 C1 № 226
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
4
Задания Д30 C1 № 269
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
5
Задания Д30 C1 № 312
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
Пройти тестирование по этим заданиям
Процессы коррозии различных металлов. Интенсивность коррозии
Решение задач по химии на коррозию металлов
Задание 296
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu2+ — восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Уравнения электронного баланса:
Ионно-молекулярное уравнение:
Zn0 + Сu2+ = Zn2+ + Cu0
Молекулярная форма:
Zn + CuSO4 = ZnSO4 + Cu
б) Электрохимические процессы при реакции железа и сульфата меди
Уравнения электронного баланса:
Ионно-молекулярное уравнение:
Fe0 + Сu2+ = Fe2+ + Cu0
Молекулярная форма:
Fe + CuSO4 = FeSO4 + Cu
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn0 -2
Катодный процесс: Cu2+ + 2
Задание 297
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н+ + 2
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, — это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н+ + 2
При повышении рН раствора уменьшается концентрация ионов водорода Н+ и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н+ + 2

Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
а) Схема коррозии цинка:
Анод: Zn0 -2
Катод: 1/2O2 + H2O + 2
б) Схема коррозии железа:
Анод: Zn0 -2
Катод: 1/2O2 + H2O + 2
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn2+:
Zn0 -2
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn0 -2
Катодный процесс: в кислой среде: 2Н+ + 2

В нейтральной среде или в щелочной ионы цинка Zn2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
Все
процессы неорганической химии можно разбить на две группы:
·
Процессы,
идущие без изменения степени окисления атомов элементов в составе реагирующих
веществ. К ним относятся различные случаи обмена атомами или ионами: так
называемые реакции обмена.
·
Процессы,
идущие с изменением степеней окисления атомов элементов в составе реагирующих
веществ. Такие химические реакции принято называть окислительно-восстановительными
реакциями.
Химические
реакции, в результате которых происходит изменение степеней окисления атомов
химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными
реакциями.
В окислительно-восстановительных реакциях электроны не уходят из сферы
реакции, а переносятся от одного элемента к другому.
В окислительно-восстановительных реакциях идут два процесса: процесс окисления
– потеря электронов окисляющимся веществом, и процесс восстановления
– присоединении электронов восстанавливающимся веществом.
В данном случае несущественно, переходят
ли электроны с одного атома на другой (ионная связь) или же только более или
менее оттягиваются (ковалентная полярная связь). Поэтому мы говорим об отдаче
или присоединении электронов независимо от действительного типа химической
связи в веществе.
Вещества, участвующие в окислительно-восстановительных реакциях, и у
которых изменились степени окисления, являются либо
окислителями, либо восстановителями.
Окислитель — это атомы, ионы или молекулы, которые принимают
электроны.
Восстановитель — это
атомы, ионы или молекулы, которые отдают электроны.
Пример1:
Zn0 +
2H+1Cl = Zn+2Cl2 + H20
Мы
видим, что степень окисления цинка меняется от 0 до +2, а степень окисления
водорода от +1 до 0. Следовательно, в ходе этой реакции атом цинка теряет два
электрона, т.е. окисляется (восстановитель), а водород принимает два
электрона, т.е. восстанавливается (окислитель).
Задание 1:
- 5HClO3+6 P +9 H2O=6H3PO4+
5HCl - Cu+2H2SO4= CuSO4+ SO2+2H2O
Определите степени окисления элементов. Назовите окислитель и
восстановитель.
Типичные
восстановители и окислители.
Окислители:
1)
вещества (оксиды, кислоты, соли) с максимально положительной или
высокой степенью окисления входящего в них элемента.
Например: кислоты – HNO3, H2SO4, HClO4, H2Cr2O7;
соли – KСlO4,
KClO3, KNO3, KMnO4, K2Cr2O7;
оксиды –PbO2,
Mn2O7, CrO3, N2O5
2) Активные
неметаллы – фтор, кислород, озон
Восстановители:
1) Bсе металлы
в нулевой степени окисления!!! (они могут только отдавать электроны);
2) Bещества
с минимально возможной (отрицательной) степенью окисления неметалла.
Например: водородные соединения – РН3, NH3, HI, HBr, H2S;
соли – KI, NaBr, K2S.
Все
остальные вещества в зависимости от условий могут быть как
окислителями, так и восстановителями: Н2О2, KNO2, Cl2,
простые вещества-неметаллы могут как принимать, так и отдавать электроны.
Задание 2: Укажите, какую роль в
окислительно-восстановительных реакциях могут играть следующие вещества:
- H2S,
P, HCl, Cu, H2SO4, SO2, H2O2,
HNO3, Mg, F2, MnO4—,
Cr+3.
Уравнения окислительно-восстановительных реакций составляют, пользуясь
методом ЭЛЕКТРОННОГО
БАЛАНСА: число отданных и принятых электронов должно быть одинаково.
Пример: Н N+5O3 + C0 à
Азотная кислота – типичный окислитель. Восстанавливается до N+4O2,
углерод в этой реакции будет восстановителем, окислится до С+4О2.
HN+5O3 + C0 à С+4О2
+ N+4O2+ Н2О
Составляем
электронный баланс:
N+5 + 1е à N+4 4 –
окислитель, восстанавливается
C0 – 4 е à С+4
1 – восстановитель, окисляется.
Таким
образом, в уравнении реакции перед оксидом азота и азотной кислотой должен
стоять коэффициент 4, а перед углеродом и углекислым газом – 1. Остаётся
уравнять воду.
4HNO3 + C à СО2
+ 4NO2+ 2Н2О
Задание 3:
Поставьте коэффициенты методом электронного баланса, укажите
окислитель и восстановитель.
- Ca3( PO4)2 + Al → Ca3P2
+ Al2O3 - KI +
KNO2 + H2SO4 → NO + I2 +
K2SO4 + H2O - NH3+ CuO = Cu+ N2+ H2O
- NH3+ Na = NaNH2 + H2
Окислительно-восстановительные
процессы зависят от реакции среды:
Чаще
всего окислитель или восстановитель является таковым только в определенной
среде. Иногда влияние среды определяет направление протекания реакции, а
также, продукты восстановления или окисления.
Пример:
·
Направление
____в щелочной среде___®
3I2+ 3H2O = HIO3+ 5HI
¬В кислой
среде__
·
Среда
определяет продукты реакции:
Сa3P2+KMnO4+H2SO4=
MnSO4+ CaSO4+ H3PO4+
K2SO4+ H2O
среда
Сa3P2+KMnO4+H2O=
MnO2+ Ca3(PO4)2+KOH
среда
Главные
схемы окислительно-восстановительных переходов
|
|
KMnO4 (малиновый раствор)
|
|||
|
кислая среда: Mn2+ (MnCl2, MnSO4) Обесцвечивание |
нейтральная среда: Mn +4 (MnO2↓ |
щелочная среда: Mn+6 (K2MnO4, зеленый раствор) |
||
Задание 4: Написать уравнения реакций,
указав продукт восстановления марганца. Поставьте коэффициенты методом электронного
баланса:
KMnO4+ KNO2 + H2SO4® K2SO4
+ KNO3 + H2O + …
KMnO4+ KNO2 + KOH ® KNO3 + H2O
+ …
KMnO4+ KNO2 + H2O
® KNO3 + КОН + …
2. Дихромат и хромат как
окислители.
|
K2Cr2O7 (кислая и нейтральная среда), K2CrO4 (щелочная среда) + |
||
|
кислая среда |
нейтральная среда |
щелочная среда |
|
Соли тех кислот, которые участвуют в реакции: CrCl3, Cr2(SO4)3 |
Cr(OH)3 |
K3[Cr(OH)6] K3CrO3 |
Задание 5: Написать уравнения реакций,
указав продукт восстановления хрома. Поставьте коэффициенты методом электронного
баланса:
K2Cr2O7 +
KJ + H2SO4® J2 + K2SO4 + H2O
+ …
K2CrO4+ KJ +КОН® J2 + H2O
+ …
Схема 3: Повышение степеней
окисления хрома и марганца
|
Cr+3 |
||
|
Cr2O3, |
+ а)KNO3, б) |
Щелочная |
|
Cr(OH)3, |
+ |
Кислая |
|
Mn+2,+4 |
+ очень |
Щелочная |
|
Mn+2 – |
+ очень |
Кислая |
Задание 6: Написать уравнения реакций, указав
продукт окисления хрома и марганца. Поставьте коэффициенты методом
электронного баланса:
CrCl3 + Cl2
+ KOH → … + KCl + H2O
MnO2 + KNO3
+ KOH → … + KNO2 + H2O
Схема
4: Азотная кислота.
|
Кислота HNO3 |
концентрированная |
разбавленная |
очень разбавленная |
|
|
Металлы |
à образуется |
|||
|
неактивные |
NO2 |
NO |
||
|
цинк |
NO2 |
N2 |
NH4NO3 |
|
|
железо |
пассивация (при нагревании — NO2) |
NO |
N2, NH4NO3 |
|
|
алюминий |
пассивация (при нагревании — NO2) |
N2 |
NH4NO3 |
|
|
хром |
не растворяется |
|||
|
марганец |
NO2 |
NO |
||
|
бериллий |
пассивация |
NO |
||
|
щелочные |
N2O |
NH4NO3 |
||
|
Щелочноземельные |
N2O |
N2O |
NH4NO3 |
|
|
магний |
N2O |
|||
|
Неметаллы |
à кислота |
|||
|
NO или |
не реагируют! |
|||
Разложение
нитратов (по ряду активности).
|
1. |
KNO3 à КNO2 + |
|
2. до |
Mg(NO3) оксид металла* + NO2 + O2 |
|
3. |
AgNO3 à Ag + NO2 металл + NO2 + |
*оксид
металла в наиболее устойчивой степени окисления
Задание 7:
Написать уравнения реакций. Поставьте коэффициенты методом
электронного баланса:
а) реакции концентрированной азотной
кислоты с Р, С, Cu, Mg
b)
реакции разбавленной азотной кислоты с Al, Fe, Cu.
Задание 8:
Написать уравнения реакций
разложения нитратов калия, меди(2), свинца, серебра
Схема 5.
Серная кислота.
|
Кислота |
концентрированная |
разбавленная |
|
неактивные |
– SO2 |
не реагируют! |
|
Цинк |
— SO2 |
à сульфат (в + Н2 |
|
Железо |
только à SO2 |
|
|
Алюминий |
||
|
Хром |
Не |
|
|
бериллий |
Не |
|
|
щелочные |
à Н2S |
|
|
щелочноземельные |
à S |
|
|
неметаллы |
SO2 + неметалл в высшей степени |
Сульфаты:
- Сульфаты щелочных металлов – плавятся без разложения.
- Сульфаты металлов средней активности – при нагревании разлагаются с образованием
соответствующего оксида.
- При разложении сульфата переходного
металла в низкой степени окисления – образуется оксид (с более высокой степенью
окисления)
- Сульфаты тяжелых металлов – разлагаются с образованием
соответствующего металла.
- Сульфаты металлов при прокаливании с
углем – восстанавливаются
до сульфидов.
BaSO4+2C = BaS + 2CO2
Задание 9: Написать уравнения реакций. Поставьте
коэффициенты методом электронного баланса:
а) реакции концентрированной серной
кислоты с C, Cu, Ca.
b)
реакции разбавленной серной кислоты с Al, Cr.
Задание 10: Написать
уравнения возможных реакций разложения сульфатов калия, железа(2),
железа(3), ртути
Схема 6: Диспропорционирование
Реакции диспропорционирования –
это реакции, в которых один и тот же элемент является и окислителем, и
восстановителем, одновременно и повышая, и понижая свою степень окисления.
Простые вещества:
|
Сера |
S0 и S+4 |
|
Фосфор |
Р0 и |
|
Хлор, Хлор, |
Cl20 и |
|
Хлор, Хлор, |
Cl20 и |
Пример: Сl2 + KOH = KCl + KClO +
H2O
(холодный раствор)
Задание 11: Написать уравнения реакций
взаимодействия серы с раствором гидроксида натрия (при кипячении). Поставьте
коэффициенты методом электронного баланса:
Оксиды,
соли
|
NO2 NO2 |
N+4 и |
|
K2SO3 |
S+4 и S+6 |
|
KClO3 В |
Cl+5 и |
Задание 12: Написать уравнения реакций
взаимодействия оксида азота (IV) с раствором
гидроксида бария. Поставьте коэффициенты методом электронного баланса:
6. Запомните особенности поведения некоторых окислителей и
восстановителей:
а) кислородсодержащие
соли и кислоты хлора обычно переходят в хлориды:
Пример: КClO3 + P = P2O5 + KCl
б) если в реакции
участвуют вещества, в которых один и тот же элемент имеет степени окисления
отрицательную и положительную – они встречаются в нулевой степени окисления
(выделяется простое вещество).
Пример: H2S + SO2 = S + H2O
Восстановители
+ KMnO4 или K2Cr2O7:
а) S2-, I—, Br—, Cl— à переходят в Э0
б) Р-3, As-3 à +5
в) N+3,S+4, P+3, и т.п.
à в
высшую степень окисления (соль или кислота)
7.
Вещества с двойственной природой:
Н2О2 + окислитель à O2
+ восстановитель à Н2О
или ОН—
КNO2 +
окислитель à KNO3
+ восстановитель à NO
Чётко запомните, как отличаются
активности неметаллов, какой из неметаллов более активен, а какой менее.
Более активный неметалл будет
окислителем, а менее активный будет довольствоваться ролью восстановителя,
если они реагируют друг с другом.
|
Ряд электроотрицательности неметаллов: |
|
H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F |
|
—————————————————> увеличение электроотрицательности |
Электролиз – это
процесс разложения расплавов и растворов электролитов под действием электрического
тока.
В раствор или расплав какого-либо электролита опускают электроды: катод (-)
и анод (+).
Пропускание электрического тока через раствор или расплав вызывает разрядку
на электродах частиц, из которых он состоит.
На
катоде
происходит восстановление катионов,
на аноде – окисление
анионов.
Электролиз
расплавов.
1)
Расплав хлорида натрия. Он содержит
катион натрия и анион хлора.
На
катоде: восстанавливается КАТИОН натрия, на аноде окисляется АНИОН хлора:
катод: Na+ + 1e à Na0
2
анод: 2Cl— — 2e à Cl20
1
Cуммарное
уравнение электролиза: 2 NaCl(расплав) —(эл.
ток)à 2Na + Cl2
2)
Расплав гидроксида натрия.
4NaOH
(расплав) —(эл. ток)à 4Na + O2 + 2H2O
катод: Na+ + 1e à Na0
4
анод: 4ОН—
— 4e à O2 + 2H2O 1
3)
Расплав оксида алюминия в криолите.
(Криолит
– Na3[AlF6], в нем
температура плавления оксида алюминия меньше). Электролиз проводится на
графитовых электродах, при этом часть электрода сгорает в выделяющемся
кислороде, выделяются оксиды углерода.
2Al2O3
(расплав) —(эл. ток)à4 Al + 3O2
Электролиз растворов электролитов (с инертными электродами)
(в процессе могут участвовать молекулы воды, материал электродов
– не участвует).
|
Катодный |
Анодный |
|
1. Металлы восстанавливаются на катоде Меn++ne— ® Ме0↓ На катоде |
1. Анионы |
|
2. Металлы идёт два а) восстановление Меn++ne— ® Ме0↓ б) восстановление 2H2O + 2e—® Н20↑+2ОН— На катоде |
2. Анионы кислородсодержащих 2H2O-4e—® О20↑+4H+ |
|
3. Металлы 2H2O + 2e—® Н20↑+2ОН— На катоде |
3. Если он окисляется |
Примеры:
1)
раствор хлорида натрия.
NaCl + H2O —(эл. ток)à
катод: около
катода Na+ и H2O. Натрий
находится в ряду левее Al,
поэтому
идёт восстановление воды.
2Н2О +2е— à H20 + OH— 1
анод: около
анода хлорид-анион
и вода. Окисляется
ион Cl—
2Cl— + 2e à Cl2
1
Cуммарное
уравнение электролиза:
2NaCl + 2H2O —(эл. ток)à Сl2 + H2 + 2NaOH
На
электродах выделяются газообразные продукты – хлор и водород, в растворе
накапливается гидроксид натрия.
2)
раствор сульфата меди (II)
CuSO4
+ H2O -(эл. ток)à
катод: около
катода Cu2+ и H2O.
Медь
находится в ряду после Н, поэтому она сама будет восстанавливаться на катоде:
Cu2+ +2е à Cu
1
анод: около
анода – сульфат- анион
и вода. Окисляется
вода.
2H2O + 2e à O2 + 4H+
1
Cуммарное
уравнение электролиза:
CuSO4
+ H2O —(эл. ток)àCu + O2
+ H2SO4
На
катоде выделяется металл – медь, на аноде – газообразный кислород, в растворе
накапливается серная кислота.
Таким
образом, сравнивая активность тех молекул и ионов, которые находятся у
каждого электрода, мы можем определить, какое вещество выделяется на каждом
электроде в первую очередь.
Задание 13: Написать уравнения реакций
электролиза растворов следующих солей: K2SO4,
AgNO3, CuI2
Электролиз
с растворимыми электродами.
В
случае, если электроды НЕинертны, то происходит окисление материала анода
Пример:
Электролиз раствора хлорида меди с медными электродами.
CuCl2 + H2O -(эл.
ток)à
катод: около
катода Cu2+ и H2O.
Медь
находится в ряду после Н, поэтому она сама будет восстанавливаться на катоде:
Cu2+ +2е à Cu0
1
анод: около
анода – хлорид- анион,
вода и
сам материал анода (медь).
Окисляется
материал анода.
Cu0 — 2e—àCu2+ 1
на аноде
– происходит растворение материала анода (окисление), на катоде –
восстановление катионов меди, в растворе – хлорид меди (II). Масса
катода растет, масса анода уменьшается.
Электролиз
смеси веществ:
- На
катоде восстанавливается в первую очередь более электроотрицательный
элемент. (стоящий в ряду напряжений правее) - На
аноде окисляется менее электроотрицательный элемент.
Пример:
СuF2 + MnCl2
(раствор)-(эл. ток)àCu0+ Cl2+ MnF2
катод: около
катода Cu2+, Mn2+ и H2O.
Медь
находится в ряду после Н и после Mn, поэтому она
сама будет восстанавливаться на катоде:
Cu2+ +2е à Cu0
1
анод: около
анода – хлорид- анион, F—
вода. Окисляется
Сl—
2Cl— — 2e—àCl20
1
В
растворе: накапливается MnF2.
Задание 14: Написать уравнения реакций
протекающих при электролизе раствора нитрата серебра на серебряных электродах.
Коррозия – это
разрушение металлов и металлических конструкций под воздействием различных
факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе.
Коррозионная стойкость металла зависит от его природы, характера среды и
температуры.
1) Благородные
металлы не подвергаются коррозии из-за химической инертности;
2) Металлы Al, Ti, Zn, Cr, Ni имеют
плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии;
3) Металлы
с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно
неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
Химическая коррозия
происходит при воздействии на металл сухих газов, её называют газовой.
3Fe
+ 2O2 à Fe3O4
В
аппаратах химических производств возможны процессы:
Fe + 2HCl
à FeCl2
+ H2
2 Fe +
3Cl2 à 2FeCl3
Электрохимическая коррозия
– разрушение
металла в присутствии воды и кислорода, либо в растворах электролитов. В
таких растворах на поверхности металла возникают процессы переноса
электронов от металла к окислителю, которым является либо кислород, либо кислота,
содержащаяся в растворе:
Электродами являются сам металл (например, железо) и содержащиеся в нем
примеси (обычно менее активные металлы, например, олово).
В
таком загрязнённом металле идёт перенос электронов от железа к меди, при
этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe
–2e = Fe 2+,
а на
поверхности олова (катод) идёт процесс восстановления водорода из воды или
растворённого кислорода:
а) 2H+
+ 2e = H2;
б) O2 + 2H2O + 4e=4OH–
Пример:
при контакте железа с оловом в растворе соляной кислоты происходят процессы:
анод: Fe –2e =
Fe 2+,
катод: 2H+ + 2e = H2
Суммарная
реакция:
Fe + 2H+
= H2 + Fe2+ ,
Если
реакция проходит в атмосферных условиях в воде, в ней участвует кислород и
происходят процессы:
анод: Fe –2e =
Fe 2+,
катод: O2 + 2H2O + 4e=4OH–
Суммарная
реакция:
Fe 2+ + 2OH – = Fe(OH)2
4Fe(OH)2
+ O2+ 2H2O = 4Fe(OH)3
Образуется
ржавчина.
Методы защиты от коррозии.
|
1.Защитные |
2. |
3. |
4. |
|
а) Катодное б) в) Создание |
Нержавеющая |
Добавление |
Протекторная |
Примеры решения задач
Пример 1.
Вычислите ЭДС и определите направление
тока во внешней цепи данного гальванического
элемента:
Fe
│FeSO4║AgNO3│Ag,
учитывая,
что концентрация ионов Fe2+
и Ag+
соответственно равна 0,1моль/л и 0,01моль/л.
Р е ш е н и е. 1)
Составляем схему гальванического
элемента и указываем концентрацию ионов
Fe2+
и Ag+
в растворах электролитов:
Fe
│FeSO4║AgNO3│Ag
C
Fe2+
= 10-1
моль/л и С
Ag+
= 10-2
моль/л.
2) Пользуясь
уравнением Нернста, вычисляем значения
электродных потенциалов железа и
серебра в растворах заданной концентрации:
EFe2+/Fe0
= E0
Fe2+/Fe0
+ (0,059/2)
lg
CFe2+
= – 0,44 + (0,059/2)
lg10-1
= – 0,47B,
EAg+/Ag0
= E0
Ag+/Ag0
+ 0,059)
lg
CAg+
= + 0,80 + 0.059
lg10-2
= + 0,68 В
EFe2+/Fe0
EAg+/Ag0,
следовательно, более активным металлом
является железо, оно будет отрицательным
электродом – анодом, а серебро – катодом.
Таким образом, Fe
– анод (А) и
Fe
– восстановитель, Ag
– катод.
3) Указываем
направление движения электронов во
внешней цепи, учитывая, что электроны
движутся от анода к катоду:
(–)Fe
│FeSO4║AgNO3│Ag(+)
4) Составляем
электронные уравнения процессов,
протекающих на электродах, учитывая,
что на аноде происходит окисление атомов
железа, а на катоде – восстановление
ионов серебра:
(-)
(А) Fe0
– 2e–
→ Fe2+
1–
процесс окисления
(+)
(K)
Ag+
+ e–
→ Ag0
2 – процесс восстановления
Fe0
+2 Ag+
→ Fe2+
+2 Ag0
5) Записываем
молекулярное уравнение
окислительно-восстановительной реакции,
лежащей в основе работы гальванического
элемента:
Fe0
+ 2AgNO3
→ Fe(NO3)2
+ 2Ag0↓
6) Рассчитываем
ЭДС гальванического элемента:
Еэдс
= ЕК
– ЕА
= E
Ag+/Ag0
– E
Fe2+/Fe0
= 0,68 – (–0,47) = 1,15 В.
Пример 2.
Будет ли магний взаимодействовать с
раствором сульфата никеля.
Р
е ш е н и е. Для решения этой задачи
необходимо сравнить стандартные
электродные потенциалы магния и никеля:
E0Mg2+/Mg0
= – 2,34В, E0Ni2+/Ni0
= – 0,25В
Магний
– металл, имеющий более отрицательное
значение стандартного электродного
потенциала и поэтому являющийся более
сильным восстановителем. Следовательно,
магний будет подвергаться окислению
под действием ионов никеля, и электроны
от магния будут переходить к никелю:
Mg0
– 2e–
→ Mg2+
Ni2+
+2e–
→ Ni0
Mg0
+ Ni2+
→ Mg2+
+ Ni0
Mg
+ NiSO4
= MgSO4
+ Ni
1.13. Коррозия металлов
Коррозия
– разрушение
металла под воздействием окружающей
среды.
Это
самопроизвольный окислительно-восстановительный
процесс, протекающий на границе раздела
фаз. По механизму протекания коррозия
подразделяется на химическую
(протекает в средах, не проводящих
электрический ток) и
электрохимическую
(протекает
в средах, проводящих электрический
ток).
Основные причины
электрохимической коррозии (ЭХК) –
наличие в металле примесей других
металлов и контакт металла с другими
металлами, отличающимися по активности.
Согласно теории ЭХК при соприкосновении
металла с раствором электролита на его
поверхности возникает множество
гальванических микроэлементов. При
этом анодами являются частицы основного
металла, катодами – примеси, с большим
значением электродного потенциала.
Одной из особенностей
электрохимической коррозии является
ее многостадийность. Рассмотрим процесс
коррозионного разрушения металла на
примере коррозионного гальванического
элемента, возникающего при контакте
железа и меди: Fe
электролит
Cu.
Для того, чтобы понять, какой из этих
двух металлов будет подвергаться
коррозии, необходимо сравнить значения
их стандартных электродных потенциалов:
E0Fe2+/Fe0
= – 0,44В, E0
Cu2+/Cu0
= +
0,34В.
E0Fe2+/Fe0
E0
Cu2+/Cu0,
следовательно, железо является более
активным восстановителем: Fe
– анод (А), Cu
– катод (К).
На первой стадии
происходит окисление более активного
металла (анодный процесс) и переход
образовавшихся ионов в раствор: Fe0
– 2e—
=Fe2+
Вторая стадия
– перенос электронов от анода к катоду,
который при этом заряжается отрицательно,
т.е. поляризуется.
На третьей стадии
происходит процесс восстановления
(катодный процесс), в котором участвует
окислитель окружающей среды. Он “забирает”
электроны у катода, т.е. снимает с него
отрицательный заряд и, таким образом,
деполяризует
катод. Процесс отвода электронов с
катода называется деполяризацией, а
окислитель – деполяризатором.
Важнейшими
окислителями, вызывающими ЭХК, являются
ионы водорода и растворенный в воде
молекулярный кислород. В связи с этим
различают два вида электрохимической
коррозии: с водородной
и с кислородной
деполяризацией.
Электрохимическая
коррозия с водородной деполяризацией
протекает
в кислой среде.
Коррозионному
разрушению подвергаются металлы,
удовлетворяющие условию: Е0Меn+/Ме0
Е0 2Н+/Н20
(Е0
2Н+/Н20
=0).
Электрохимическая
коррозия с кислородной деполяризацией
протекает
в нейтральной (влажный
воздух, морская вода, влажные почвы) или
щелочной средах. Коррозионному разрушению
подвергаются металлы, стандартный
электродный потенциал которых меньше
стандартного электродного потенциала
кислорода:
Е0Меn+/Ме0
Е0 О2
/2Н2О
(Е0
О2
/2Н2О
= 1,23В).
П
рассмотрении механизма электрохимической
коррозии следует использоватьалгоритм,
приведенный в примерах решения задач.
Для защиты металлов
от коррозии используют различные виды
защитных покрытий, в том числе металлические
покрытия.
Анодное
покрытие –
покрытие основного металла более
активным металлом, т.е. Е0осн.Ме
Е0покр.Ме
(например,
покрытие железа цинком). Катодное
покрытие –
покрытие основного металла менее
активным, т.е. Е0осн.
Ме
Е0 покр.
Ме
(например,
покрытие железа никелем).
Соседние файлы в папке Методички 2 сем
- #
- #
- #
- #


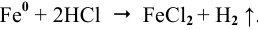
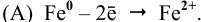
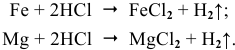
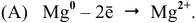
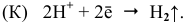
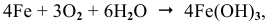
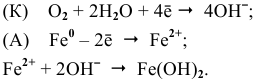
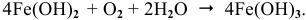
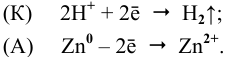
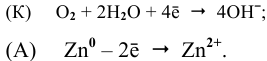
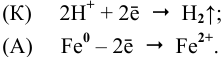
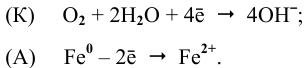
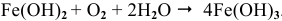
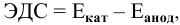
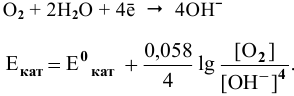
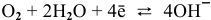

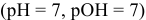
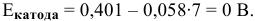
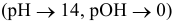
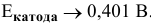
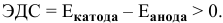
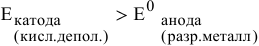
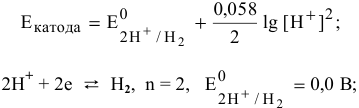
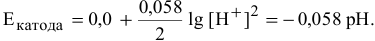
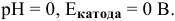
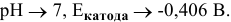

![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)