Всего: 29 1–20 | 21–29
Добавить в вариант
Установите соответствие между парами веществ и реагентами, с помощью которых их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПАРА ВЕЩЕСТВ
А) гексен-1 и гексан
Б) пропионовая кислота и пропанол-1
В) этилен и ацетилен
Г) крахмал и целлюлоза
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между формулами газов и реагентом, с помощью которого можно различить эти газы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГЕНТ
1) бромная вода
2) соляная кислота
3) известковая вода
4) раствор иодида калия, крахмал
5) раствор хлорида кальция
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задания Д26 № 386
Природным полимером является
1) полиэтилен
2) поливинилхлорид
3) крахмал
4) полистирол
Задания Д8 № 682
К электролитам относится каждое из двух веществ:
1) гидроксид натрия, ацетат натрия
2) гидроксид железа (III), метанол
3) крахмал, серная кислота
4) глюкоза, карбонат кальция
К электролитам относятся все вещества, указанные в ряду:
1) гидроксид натрия, ацетат натрия, соляная кислота
2) гидроксид железа (III), уксусная кислота, метанол
3) хлорид бария, крахмал, серная кислота
4) глюкоза, мыло, карбонат кальция
Из предложенного перечня выберите два вещества, относящихся к полисахаридам.
1) рибоза
2) крахмал
3) сахароза
4) целлюлоза
5) фруктоза
Запишите номера выбранных соединений.
Из предложенного перечня выберите два утверждения, которые верны для крахмала и целлюлозы.
1) имеют одинаковую степень полимеризации
2) являются природными полимерами
3) вступают в реакцию «серебряного зеркала»
4) не подвергаются гидролизу
5) состоят из остатков молекул глюкозы
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, с которыми не реагирует крахмал, в отличие от глюкозы.
1)
2)
3) (аммиачный р-р.)
4)
5) (разбавленный р-р.)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два утверждения, которые справедливы для крахмала и целлюлозы.
1) имеют одинаковую степень полимеризации
2) имеют общую формулу
3) вступают в реакцию «серебряного зеркала»
4) реагируют с оксидом кремния (IV)
5) состоят из остатков молекул глюкозы
Запишите в поле ответа номера выбранных утверждений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, которые не подвергаются гидролизу.
1) фруктоза
2) крахмал
3) целлюлоза
4) глюкоза
5) сахароза
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Установите соответствие между классом соединений и тривиальным названием вещества, которое является его представителем: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС СОЕДИНЕНИЙ
А) спирты
Б) углеводы
В) углеводороды
ТРИВИАЛЬНОЕ НАЗВАНИЕ ВЕЩЕСТВА
1) толуол
2) крахмал
3) этиленгликоль
4) анилин
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 02.04.2016. Досрочная волна
Из предложенного перечня веществ выберите два вещества, которые подвергаются гидролизу.
1) глюкоза
2) сахароза
3) фруктоза
4) рибоза
5) крахмал
Запишите в поле ответа номера выбранных веществ.
Источник: ЕГЭ по химии 2017. Досрочная волна
Установите соответствие между формулами газов и реагентом, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГЕНТ
1) лакмус
2) (водн.)
3)
4) крахмал
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между формулами газов и реагентом, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГЕНТ
1) фенолфталеин
2)
3) (водн.)
4) крахмал
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Из предложенного перечня выберите два вещества, которые вступают в реакцию гидролиза.
1) фенилаланин
2) крахмал
3) рибоза
4) мальтоза
5) глюкоза
Запишите в поле ответа номера выбранных веществ.
Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) крахмал
Б) дезоксирибоза
В) цис-бутен–2
КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) углеводы
2) углеводороды
3) аминокислоты
4) липиды
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: ЕГЭ по химии 2019. Основная волна. Вариант 1
Установите соответствие между двумя веществами, взятыми в виде водных растворов, и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАКТИВ
1) соляная кислота
2) нитрат серебра
3) гидроксид калия
4) цинк
5) крахмал
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 1
Из предложенного перечня выберите два вещества, при полном гидролизе которых образуется только глюкоза.
1) мальтоза
2) сахароза
3) крахмал
4) лактоза
5) рибоза
Запишите номера выбранных ответов в порядке возрастания.
Задания Д14 № 591
Глицерин можно получить в результате гидролиза
1) белка
2) жира
3) крахмала
4) целлюлозы
Установите соответствие между формулами газов и реагентом, с помощью которого их можно различить.
РЕАГЕНТ
1)
2) , крахмал
3)
4) (аммиачный р-р)
5) фенолфталеин
Запишите в таблицу выбранные цифры под соответствующими буквами.
Всего: 29 1–20 | 21–29
Углеводы — группа природных органических соединений, химическая структура которых отвечает формуле
Cm(H2O)n. Входят в состав всех без исключения живых организмов.

Классификация
Углеводы подразделяются на
- Моносахариды
- Олигосахариды
- Полисахариды
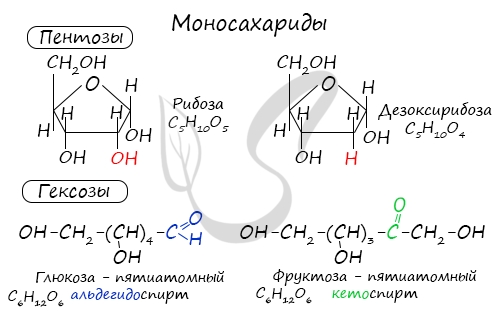
Моносахариды (греч. monos — единственный + sacchar — сахар) — наиболее распространенная группа углеводов в природе,
содержащие в молекулах пять (пентозы) или шесть (гексозы) атомов углерода.
Из наиболее известных представителей к пентозам относятся рибоза и дезоксирибоза, к гексозам — глюкоза и фруктоза.
Олигосахариды (греч. ὀλίγος — немногий) — группа углеводов, в молекулах которых, содержится от 2 до 10 моносахаридных
остатков. Если в молекуле содержатся два моносахаридных остатка, ее называют дисахарид.
Наиболее известны следующие дисахариды: сахароза, лактоза, мальтоза. Они являются изомерами, их молекулярная
формула одинакова — C12H22O11.

Полисахариды (греч. poly — много) — природные биополимеры, молекулы которых состоят из длинных цепей (десятки, сотни
тысяч) моносахаридов.
Например, глюкоза — моносахарид, а крахмал, гликоген и целлюлоза — ее полимеры. Также к полимерам относится
хитин, пектин. Формула крахмала, целлюлозы — (C6H10O5)n

Моносахариды
Получение глюкозы возможно несколькими способами:
- Реакция Бутлерова
- Гидролиз крахмала
- Фотосинтез
В присутствии ионов металла, молекулы формальдегида соединяются, образуя различные углеводы, например, глюкозу.
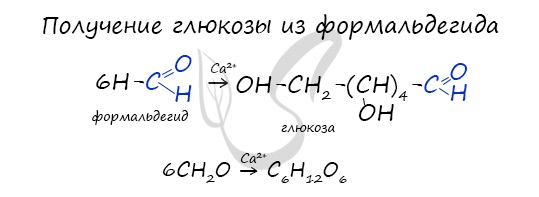
В присутствии кислоты и при нагревании, крахмал (полимер) распадается на мономеры — молекулы глюкозы.
Эту реакцию изобрела природа, для нее существует необыкновенный катализатор — солнечный свет (hν).
6CO2 + 6H2O → (hν) C6H12O6 + 6O2↑
По химическому строению глюкоза является пятиатомным альдегидоспиртом, а, значит, для нее характерны реакции и
альдегидов, и многоатомных спиртов.
- Реакции по альдегидной группе
- Реакции по гидроксогруппам
- Брожение глюкозы
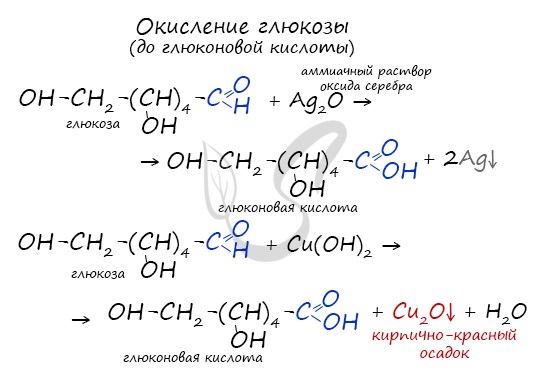
Окисление глюкозы идет до глюконовой кислоты. Это можно осуществить с помощью реакций серебряного зеркала,
с гидроксидом меди II.
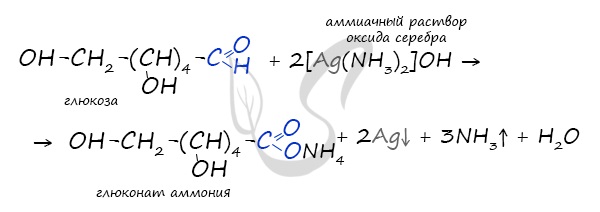
Обратите особое внимание на то, что при написании формулы аммиачного раствора в полном виде будет правильнее указать в продуктах не кислоту, а соль — глюконат аммония. Это связано с тем, что аммиак, обладающий основными свойствами, реагирует с глюконовой кислотой с образованием соли.
Восстановление глюкозы возможно до шестиатомного спирта сорбита (глюцита), применяемого в пищевой промышленности в
качестве сахарозаменителя. На вкус сорбит менее приятен, менее сладок, чем сахар.
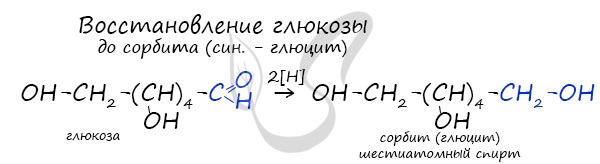
Глюкоза содержит пять гидроксогрупп, является многоатомным спиртом. Она вступает в качественную реакцию
для многоатомных спиртов — со свежеприготовленным гидроксидом меди II.
В результате такой реакции образуется характерное голубое окрашивание раствора.

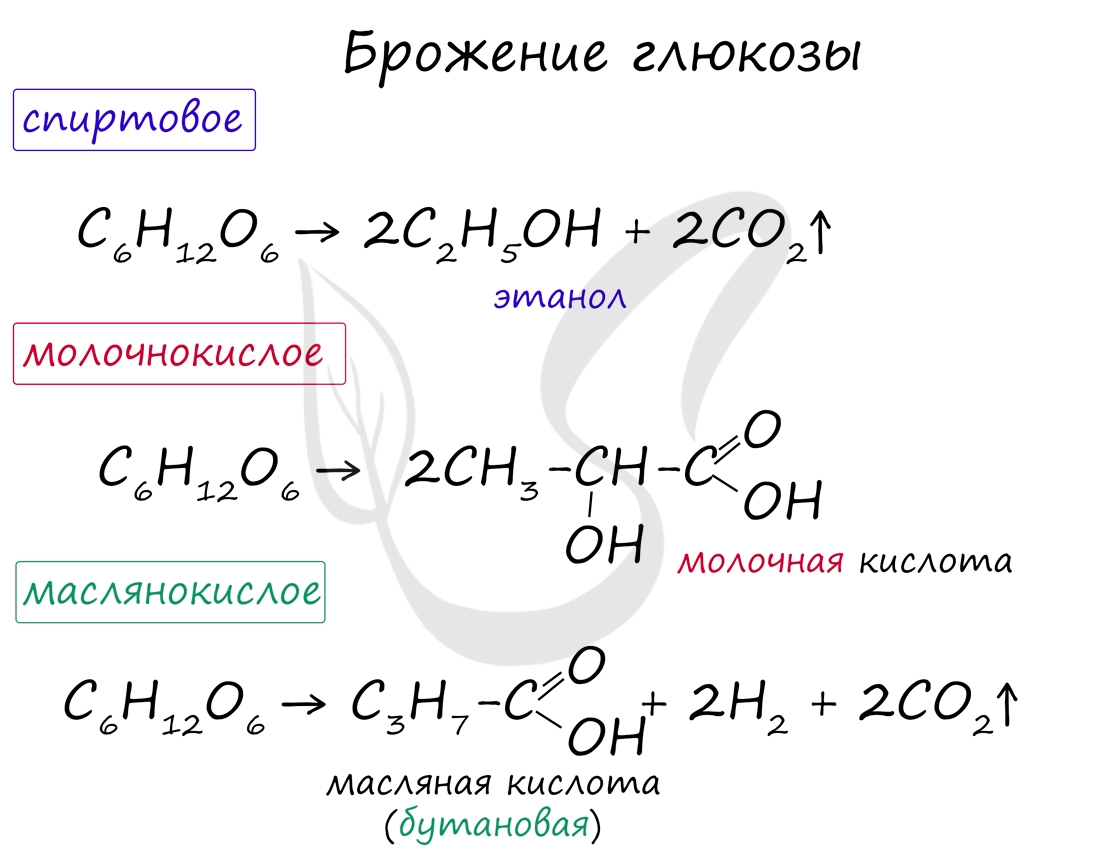
Возможны несколько вариантов брожения глюкозы: спиртовое, молочнокислое, маслянокислое. Эти виды брожения
имеют большое практическое значение и характерны для многих живых организмов, в частности бактерий.
Фруктоза является изомером глюкозы. В отличие от нее не вступает в реакции окисления — она является кетоспиртом,
а кетоны окислению до кислот не подвергаются.
Для нее характерна качественная реакция как многоатомного спирта — со свежеприготовленным гидроксидом меди II.
В реакцию серебряного зеркала фруктоза не вступает.
Применяется фруктоза как сахарозаменитель. Она в 3 раза слаще глюкозы и в 1,5 раза слаще сахарозы.

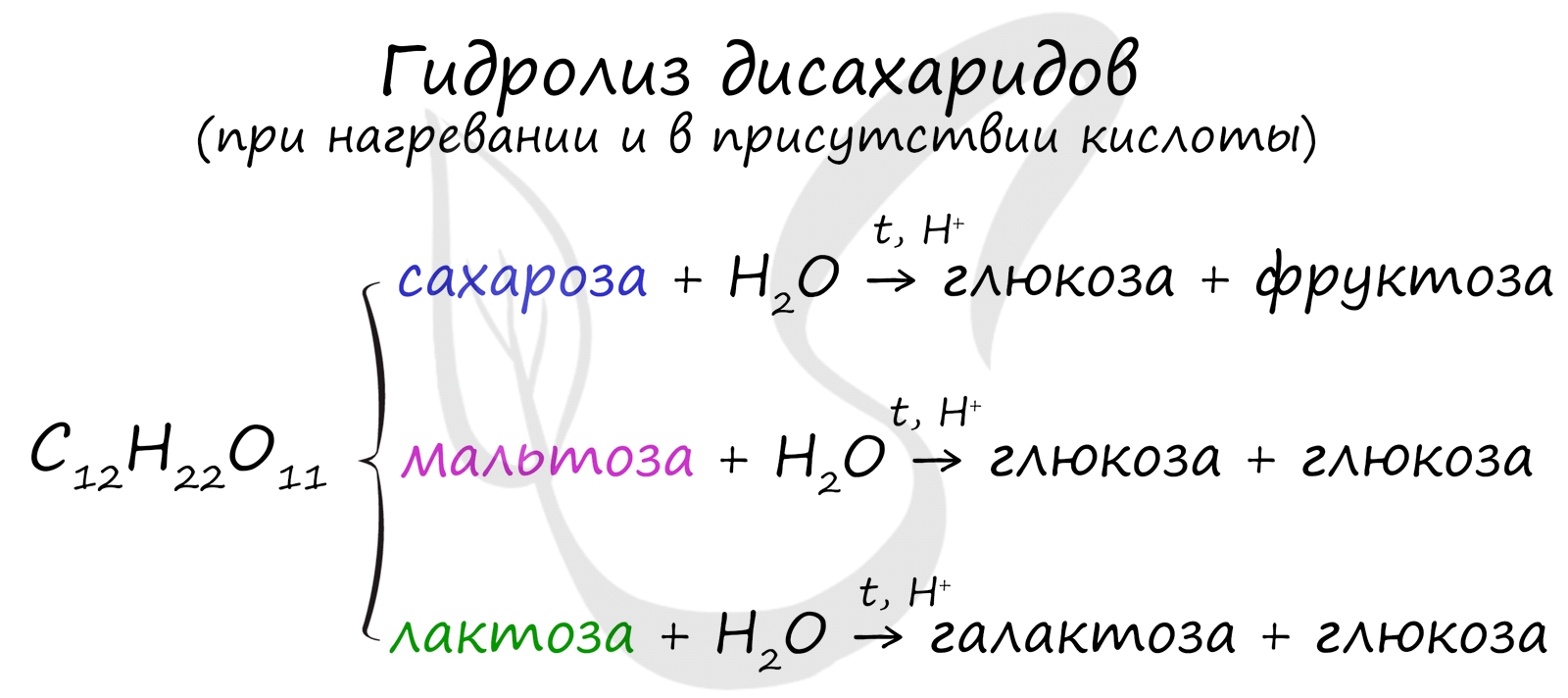
Дисахариды
Как уже было сказано ранее, наиболее известные дисахариды: сахароза, лактоза и мальтоза — имеют одну и ту же формулу —
C12H22O11.
При их гидролизе получаются различные моносахариды.
Полисахариды
Из множества реакций, более всего мне хотелось бы выделить гидролиз крахмала. В результате образуется глюкоза.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Чтобы поделиться, нажимайте
Крахмал
1. Физические свойства
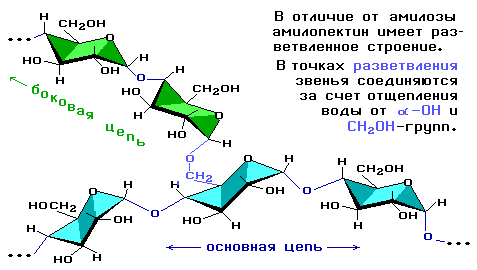
Это белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор (крахмальный клейстер) в горячей воде. Существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
2. Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
6CO2 + 6H2O свет, хлорофилл → C6H12O6 + 6O2
nC6H12O6 → (C6H10O5)n + nH2O
глюкоза крахмал
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал), образуется в печени и мышцах животных.
3. Строение
Состоит из остатков α — глюкозы.
В состав крахмала входят:
· амилоза (внутренняя часть крахмального зерна) – 10-20%
· амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 – 1000 остатков α-глюкозы и имеет неразветвленное строение.
Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1 — 6 млн.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах. Поэтому крахмал – необходимый резервный углевод питания.
Подобно амилопектину построен гликоген (животный крахмал), макромолекулы которого отличаются большей разветвлённостью:
4. Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.).
· Ценный питательный продукт.
· Для накрахмаливания белья.
· В качестве декстринового клея.
5. Химические свойства полисахаридов
Гидролиз:
(C6H10O5)n + nH2O t,H2SO4 → nC6H12O6
глюкоза
Гидролиз протекает ступенчато:
(C6H10O5)n → (C6H10O5)m → xC12H22O11 → n C6H12O6 (Примечание, m<n)
крахмал декстрины мальтоза глюкоза
Качественная реакция:
Охлаждённый крахмальный клейстер + I2 (раствор) = синее окрашивание, которое исчезает при нагревании.
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев α-глюкозы.
При взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения. Это соединение имеет характерный синий цвет. Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
Целлюлоза
Целлюлоза (клетчатка) – растительный полисахарид, являющийся самым распространенным органическим веществом на Земле.
1. Физические свойства
Это вещество белого цвета, без вкуса и запаха, нерастворимое в воде, имеющее волокнистое строение. Растворяется в аммиачном растворе гидроксида меди (II) – реактиве Швейцера.
2. Нахождение в природе
Этот биополимер обладает большой механической прочностью и выполняет роль опорного материала растений, образуя стенку растительных клеток. В большом количестве целлюлоза содержится в тканях древесины (40-55%), в волокнах льна (60-85%) и хлопка (95-98%). Основная составная часть оболочки растительных клеток. Образуется в растениях в процессе фотосинтеза.
Древесина состоит на 50% из целлюлозы, а хлопок и лён, конопля практически чистая целлюлоза.
Хитин (аналог целлюлозы) – основной компонент наружного скелета членистоногих и других беспозвоночных, а также в составе клеточных стенок грибов и бактерий.
3. Строение
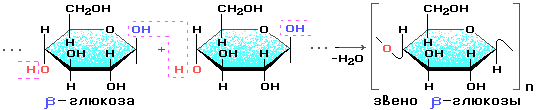
Состоит из остатков β — глюкозы
4. Получение
Получают из древесины
5. Применение
Целлюлоза используется в производстве бумаги, искусственных волокон, пленок, пластмасс, лакокрасочных материалов, бездымного пороха, взрывчатки, твердого ракетного топлива, для получения гидролизного спирта и др.
· Получение ацетатного шёлка – искусственное волокно, оргстекла, негорючей плёнки из ацетилцеллюлозы.
· Получение бездымного пороха из триацетилцеллюлозы (пироксилин).
· Получение коллодия (плотная плёнка для медицины) и целлулоида (изготовление киноленты, игрушек) из диацетилцеллюлозы.
· Изготовление нитей, канатов, бумаги.
· Получение глюкозы, этилового спирта (для получения каучука)
К важнейшим производным целлюлозы относятся:
— метилцеллюлоза (простые метиловые эфиры целлюлозы) общей формулы
[C6H7O2(OH)3-x(OCH3)x]n (х = 1, 2 или 3);
— ацетилцеллюлоза (триацетат целлюлозы) – сложный эфир целлюлозы и уксусной кислоты
[C6H7O2(OCOCH3)3]n
— нитроцеллюлоза (нитраты целлюлозы) – сложные азотнокислые эфиры целлюлозы:
[C6H7O2(OH)3-х(ONO2)х]n (х = 1, 2 или 3).
6. Химические свойства
Гидролиз
(C6H10O5)n + nH2O t,H2SO4 → nC6H12O6
глюкоза
Гидролиз протекает ступенчато:
(C6H10O5)n → (C6H10O5)m → xC12H22O11 → n C6H12O6 (Примечание, m<n)
крахмал декстрины мальтоза глюкоза
Реакции этерификации
Целлюлоза – многоатомный спирт, на элементную ячейку полимера приходятся три гидроксильных группы. В связи с этим, для целлюлозы характерны реакции этерификации (образование сложных эфиров). Наибольшее практическое значение имеют реакции с азотной кислотой и уксусным ангидридом. Целлюлоза не дает реакции «серебряного зеркала».
1. Нитрование:
(C6H7O2(OH)3)n + 3nHNO3 H2SO4(конц.)→ (C6H7O2(ONO2)3)n + 3nH2O
пироксилин
|
|
+3n HNO3 | H2SO4→ |
|
+ 3n H2О |
Полностью этерифицированная клетчатка известна под названием пироксилин, который после соответствующей обработки превращается в бездымный порох. В зависимости от условий нитрования можно получить динитрат целлюлозы, который в технике называется коллоксилином. Он так же используется при изготовлении пороха и твердых ракетных топлив. Кроме того, на основе коллоксилина изготавливают целлулоид.
2. Взаимодействие с уксусной кислотой:
(C6H7O2(OH)3)n + 3nCH3COOH H2SO4(конц.)→ (C6H7O2(OCOCH3)3)n + 3nH2O
При взаимодействии целлюлозы с уксусным ангидридом в присутствии уксусной и серной кислот образуется триацетилцеллюлоза.
|
|
+3n |
|
→ |
|
+3n СH3СOOН |
Триацетилцеллюлоза (или ацетилцеллюлоза) является ценным продуктом для изготовления негорючей кинопленки и ацетатного шелка. Для этого ацетилцеллюлозу растворяют в смеси дихлорметана и этанола и этот раствор продавливают через фильеры в поток теплого воздуха.
Растворитель испаряется и струйки раствора превращаются в тончайшие нити ацетатного шелка.
Говоря о применении целлюлозы, нельзя не сказать о том, что большое количество целлюлозы расходуется для изготовления различной бумаги. Бумага – это тонкий слой волокон клетчатки, проклеенный и спрессованный на специальной бумагоделательной машине.
Теория по теме Углеводы. Краткие конспект по углеводам. Классификация углеводов, химические свойства углеводов, способы получения углеводов. Свойства и получение моносахаридов (глюкоза, фруктоза), олигосахаридов (сахароза и др.), полисахаридов.
Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3.
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
Классификация углеводов
По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
| Глюкоза С6Н12О6
Фруктоза С6Н12О6 Рибоза С5Н10О5 Дезоксирибоза С5Н10О4 |
Сахароза С12Н22О11
Лактоза С12Н22О11 Мальтоза С12Н22О11 Целлобиоза С12Н22О11 |
Целлюлоза (С6Н10О5)n
Крахмал(С6Н10О5)n |
По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
Химические свойства, общие для всех углеводов
1. Горение
Все углеводы горят до углекислого газа и воды.
Например, при горении глюкозы образуются вода и углекислый газ
C6H12O6 + 6O2 → 6CO2 + 6H2O
2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода
C6H12O6 → 6C + 6H2O
Моносахариды
Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных.
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза
C6H12O6 |
Фруктоза
C6H12O6 |
Рибоза
C5H10O5 |
| Структурная формула |  |
 |
 |
| Классификация |
|
|
|
Глюкоза
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.
Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»
- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи.
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
C6H12O6 → 2C2H5OH + 2CO2
Молочнокислое брожение. При молочнокислом брожении глюкозы образуется молочная кислота:
Маслянокислое брожение. При маслянокислом брожении глюкозы образуется масляная кислота (внезапно):
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
Простые эфиры глюкозы получили название гликозидов.
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы):
Получение глюкозы
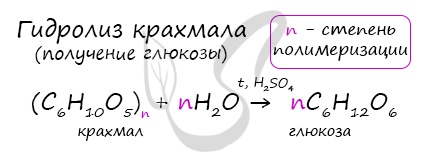
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
(C6H10O5)n + nH2O → nC6H12O6
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
6CH2=On → C6H12O6
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
6CO2 + 6H2O → C6H12O6 + 6O2
Фруктоза
Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы).
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
Дисахариды
Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой).
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:
В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться.
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
C12H22O11 + H2O → C6H12O6 + C6H12O6
глюкоза фруктоза
Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.
Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов.
При гидролизе мальтозы образуется глюкоза.
C12H22O11 + H2O → 2C6H12O6
Полисахариды
Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов.
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:
Крахмал
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.
В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:
- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
- Качественная реакция на крахмал: синее окрашивание с раствором йода.
Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
Свойства целлюлозы
- Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
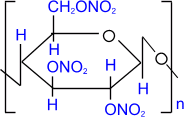
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.
- Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.
Крахмал – ценный питательный продукт. Он входит в состав хлеба, картофеля, круп и наряду с сахарозой является важнейшим источником углеводов в человеческом организме.

Химическая формула крахмала (С6(Н2О)5)n.
Строение крахмала
Крахмал состоит из 2 полисахаридов, построенных из остатков циклической a-глюкозы.
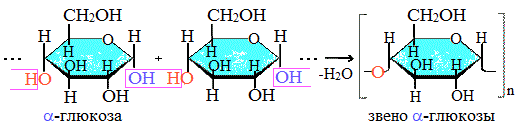
Как видно, соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют. Поэтому крахмал не дает реакцию «серебряного зеркала».
Иллюстрация. Фрагмент молекулы крахмала
Крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) — 10-20%;
- амилопектин (оболочка крахмального зерна) — 80-90%.
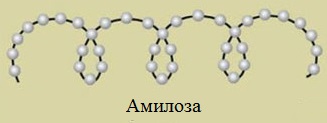
Амилоза
Амилоза растворима в воде и представляет собой линейный полимер, в котором остатки α–глюкозы связаны друг с другом через первый и четвертый атомы углерода (α-1,4-гликозидными связями).
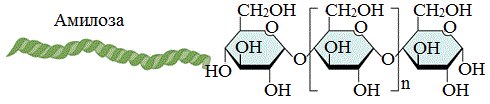
Цепь амилозы включает 200 — 1000 остатков a-глюкозы (средняя мол. масса 160 000) .
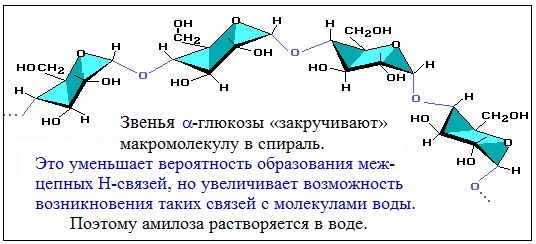
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев a-глюкозы.
Амилопектин
В отличие от амилозы, амилопектин не растворим в воде, и имеет разветвленное строение.
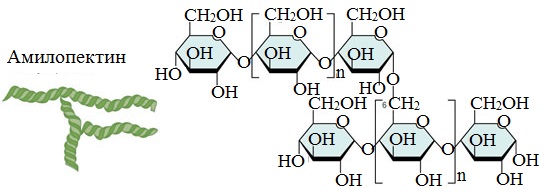
Подавляющее большинство глюкозных остатков в амилопектине связаны, как и в амилозе α-1,4-гликозидными связями. Однако в точках разветвлений цепи имеются α-1,6-гликозидные связи.
Молекулярная масса амилопектина достигает 1-6 млн.
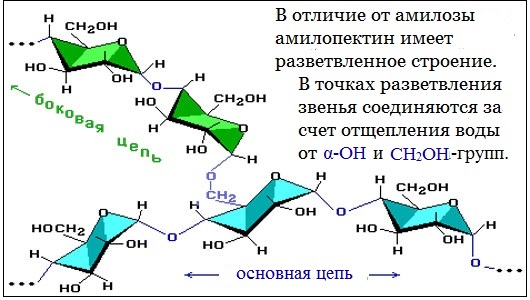
Молекулы амилопектина также довольно компактны, так как имеют сферическую форму.
Биологическая роль крахмала. Гликоген
Крахмал – главное запасное питательное вещество растений, основной источник резервной энергии в растительных клетках.
Остатки глюкозы в молекулах крахмала соединены достаточно прочно и в то же время под действием ферментов легко могут отщепляться, как только возникает потребность в источнике энергии.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах.
Гликоген (животный крахмал) – полисахарид, молекулы которого построены из большого числа остатков α–глюкозы. Он имеет сходное строение с амилопектином, но отличается от него большей разветвленностью цепей, а также большей молекулярной массой.

Содержится гликоген главным образом в печени и в мышцах.
Гликоген – белый аморфный порошок, хорошо растворяется даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе – глюкозу.
Превращение крахмала в организме человека и животных

Нахождение в природе
Крахмал широко распространен в природе. Он образуется в растениях в процессе фотосинтезе и накапливается в клубнях, корнях, семенах, а также в листьях и стеблях.
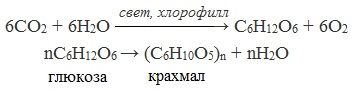
Крахмал содержится в растениях в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков: риса (до 80%), пшеницы (до 70%), кукурузы (до 72%), а также клубни картофеля (до 25%). В клубнях картофеля крахмальные зерна плавают в клеточном соке, в злаках они плотно склеены белковым веществом клейковиной.
Физические свойства
Крахмал – белое аморфное вещество, без вкуса и запаха, нерастворимое в холодной воде, в горячей воде набухает и частично растворяется, образуя вязкий коллоидный раствор (крахмальный клейстер).
Крахмал существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
Химические свойства крахмала
Химические свойства крахмала объясняются его строением.
Крахмал не дает реакцию «серебряного зеркала», однако ее дают продукты его гидролиза.
1. Гидролиз крахмала
При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α-глюкозы. При этом образуется ряд промежуточных продуктов, в частности мальтоза. Конечным продуктом гидролиза является глюкоза:
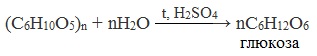
Процесс гидролиза протекает ступенчато, схематически его можно изобразить так:
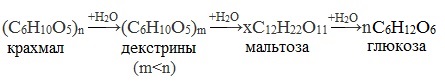
Видеоопыт «Кислотный гидролиз крахмала»
Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К.Кирхгоф (реакция Кирхгофа).
2. Качественная реакция на крахмал
Так как молекула амилозы представляет собой спираль, то при взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения.
Раствор иода окрашивает крахмал в синий цвет. При нагревании окрашивание исчезает (комплекс разрушается), при охлаждении появляется вновь.
Крахмал + J2 – синее окрашивание

Видеоопыт «Реакция крахмала с йодом»
Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
3. Большинство глюкозных остатков в молекулах крахмала имеют по 3 свободных гидроксила (у 2,3,6-го атомов углерода), в точках разветвления – у 2-го и 3-го атомов углерода.
Следовательно, для крахмала возможны реакции, характерные для многоатомных спиртов, в частности образование простых и сложных эфиров. Однако эфиры крахмала большого практического значения не имеют.
Качественную реакцию на многоатомные спирты крахмал не дает, так как плохо растворяется в воде.
Получение крахмала
Из растений извлекают крахмал, разрушая клетки и отмывая его водой. В промышленном масштабе его получают главным образом из клубней картофеля (в виде картофельной муки), а также кукурузы, в меньшей степени – из риса, пшеницы и других растений.
Получение крахмала из картофеля
Картофель моют, измельчают и промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Вода извлекает из измельченного сырья крахмальные зерна, образуя так называемое «крахмальное молоко».
Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе теплого воздуха.
Получение крахмала из кукурузы
Зерна кукурузы замачивают в теплой воде разбавленной сернистой кислоты с целью размягчения зерна и удаления из него основной части растворимых веществ.
Набухшее зерно дробят для удаления ростков.
Ростки, после всплывания на поверхность воды, отделяют и используют в дальнейшем для получения кукурузного масла.
Кукурузную массу повторно измельчают, обрабатывают водой для вымывания крахмала, затем отделяют отстаиванием или с помощью центрифуги.
Применение крахмала
Крахмал широко применяется в различных отраслях промышленности (пищевой, фармацевтической, текстильной, бумажной и т.п.).
Он является основным углеводом пищи человека – хлеба, круп, картофеля.
В значительных количествах перерабатывается на декстрины, патоку и глюкозу, используемые в кондитерском производстве.
Из крахмала, содержащегося в картофеле и зерне злаков, получают этиловый, н-бутиловый спирты, ацетон, лимонную кислоту, глицерин.
Крахмал используется как клеящее средство, применяется для отделки тканей, крахмаления белья.
В медицине на основе крахмала готовятся мази, присыпки и т.д.
Иллюстрация. Применение крахмала

Углеводы
Полисахариды
ГОТОВИМСЯ К ЕГЭ
УГЛЕВОДЫ
Углеводы (сахара) – органические соединения, имеющие сходное строение и свойства, состав
большинства которых отражает формула Cx(H2O)y,
где x, y ≥ 3.
Исключение
составляет дезоксирибоза, которая имеют формулу С5Н10O4.
НЕКОТОРЫЕ ВАЖНЕЙШИЕ УГЛЕВОДЫ
|
Моносахариды |
Олигосахариды |
Полисахариды |
|
Глюкоза С6Н12О6 Фруктоза С6Н12О6 Галактоза С6Н12О6 Рибоза С5Н10О5 Дезоксирибоза С5Н10О4 |
Дисахариды: Сахароза С12Н22О11 Лактоза (молочный сахар) С12Н22О11 Мальтоза (солодовый сахар) С12Н22О11 |
Целлюлоза Крахмал Гликоген |
Физические
свойства
Моно- и олигосахариды – твердые, белые
кристаллические вещества, имеют сладкий вкус, хорошо растворимы в воде.
Полисахариды – твердые, без сладкого вкуса, практически нерастворимые в воде
(кроме крахмала).
Моносахариды
Моносахариды
– гетерофункциональные
соединения, в состав их молекул входит одна карбонильная группа
(альдегидная или кетонная) и несколько гидроксильных.
ГЛЮКОЗА
Строение
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими
формами — α и β и линейной формой:
Циклические α- и
β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением
полуацетального гидроксила относительно плоскости кольца. В α-глюкозе этот гидроксил находится втранс-положении
к гидроксиметильной группе -СН2ОН,
в β-глюкозе – в цис-положении.
Явление существования веществ в нескольких
взаимопревращающихся изомерных формах было названо А. М. Бутлеровым динамической изомерией.
Позднее это явление было названо таутомерией
В твёрдом состоянии глюкоза имеет циклическое строение.
Обычная кристаллическая глюкоза – это α- форма. В растворе более устойчива
β-форма (при установившемся равновесии на неё приходится более 60% молекул).
Доля альдегидной формы в равновесии незначительна. Это объясняет отсутствие
взаимодействия с фуксинсернистой кислотой (качественная реакция альдегидов).
Для глюкозы кроме явления таутомерии характерны структурная изомерия с кетонами (глюкоза и фруктоза –
структурные межклассовые изомеры) и оптическая
изомерия:
Физические свойства
Глюкоза
– бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на
вкус (лат. «глюкос» – сладкий):
1)
она встречается почти во всех органах растения: в плодах, корнях, листьях,
цветах;
2)
особенно много глюкозы в соке винограда и спелых фруктах, ягодах;
3)
глюкоза есть в животных организмах;
4) в
крови человека ее содержится примерно 0,1 %.
Получение.
В
промышленности
Гидролиз крахмала:
(C6H10O5)n +
nH2O t,H+→ nC6H12O6
крахмал глюкоза
В лаборатории
Из формальдегида (1861 г А.М. Бутлеров):
6 HCOH Ca(OH)2→ C6H12O6
формальдегид
В природе
Фотосинтез:
6CO2 + 6H2O hν, хлорофилл → C6H12O6 + 6O2
Другие способы
Гидролиз дисахаридов:
C12H22O11 + H2O t,H+→ 2 C6H12O6
мальтоза
глюкоза
C12H22O11 + H2O t,H+→ C6H12O6 + C6H12O6
сахароза глюкоза фруктоза
Химические
свойства глюкозы.
1. Реакция комплексообразования с гидроксидом
меди (II).
Глюкоза как многоатомный спирт
При взаимодействии свежеосажденного гидроксида меди (II) с моносахаридами
происходит растворение гидроксида с образованием комплекса синего цвета.
(глюкозат меди (II) – синий
раствор)
2. Глюкоза как
альдегид
а) реакция серебряного зеркала. Образуется соль глюконовой кислоты.
б) реакция с
гидроксидом меди (II) при нагревании. Образуется глюконовая кислота.
в) Глюкозу также
можно окислить до глюконовой кислоты бромной водой, хлором, азотной кислотой
(разб.):
г)
Каталитическое гидрирование глюкозы – происходит
восстановление карбонильной группы до спиртового гидроксила, получается шестиатомный
спирт – сорбит.
д) С NaHSO3 – НЕ реагирует!!!
3. Реакции
брожения.
а) спиртовое брожение C6H12O6
à 2C2H5OH
+ 2CO2
этанол
б) молочнокислое брожение C6H12O6
à 2CH3-CH(OH)-COOH
молочная кислота
в) маслянокислое брожение C6H12O6
à C3H7COOH
+ 2CO2 + 2H2O
масляная кислота
г) лимоннокислое брожение
4. Реакции
образования эфиров глюкозы.
Глюкоза способна образовывать простые и
сложные эфиры. Наиболее легко происходит замещение полуацетального (гликозидного)
гидроксила:
Простые эфиры
получили название гликозидов.
В более жестких условиях (например, с CH3—I )
возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные
эфиры с карбоновыми кислотами (реакция проходит с ангидридами, а не с
самими кислотами) и с минеральными кислотами.
5. Реакция
горения глюкозы.
C6H12O6 +
6О2 à 6CO2 + 6H2O
Фруктоза
Это структурный изомер глюкозы — кетоноспирт:
СН2— СН- СН- СН — С — СН2
| | | | ║ |
OH OH OH OH O OH
Кристаллическое
вещество, хорошо растворимое в воде, более сладкое, чем глюкоза. В свободном
виде содержится в мёде и фруктах.
Химические свойства фруктозы обусловлены
наличием кетонной и пяти гидроксильных групп. Так же, как и глюкоза, реагирует с
гидроксидом меди (ярко-синий раствор) без нагревания; образует простые и
сложные эфиры, горит. При гидрировании фруктозы также получается
СОРБИТ. С бромной водой, Сu(OH)2 при нагревании, аммиачным раствором оксида серебра – не
реагирует.
Реакция
восстановления:
Реакция
многоатомных спиртов:
Образование
сложных эфиров:
Дисахариды
Дисахариды – это
углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных
друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных
или одной полуацетальной и одной спиртовой).
1.
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Физические
свойства и нахождение в природе
1.
Она представляет собой бесцветные кристаллы сладкого вкуса, хорошо растворима в
воде.
2.
Температура плавления сахарозы 160 °C.
3.
При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
4.
Содержится во многих растениях: в соке березы, клена, в моркови, дыне, а также
в сахарной свекле и сахарном тростнике.
Строение
Молекула сахарозы состоит из
остатков α-глюкозы и β-фруктозы, соединенных друг с другом.
Химические свойства
В молекуле сахарозы гликозидный атом углерода глюкозы СВЯЗАН,
поэтому она не образует ОТКЫТУЮ (альдегидную) форму. (альдегидная группа α-глюкозы, входящей в состав сахарозы,
участвует в образовании связи с β-фруктозой)
Вследствие этого
сахароза не вступает в реакции альдегидной группы – с аммиачным раствором
оксида серебра с гидроксидом меди при нагревании. Подобные дисахариды
называют невосстанавливающими, т.е. не способными окисляться.
Сахароза реагирует
с Сu(OH)2 без нагревания
(ярко-синий раствор), с Са(ОН)2 (образуется сахарат кальция).
Сахароза подвергается гидролизу подкисленной водой:
С12Н22О11
+ Н2О à С6Н12О6 (глюкоза) + С6Н12О6
(фруктоза)
Из числа изомеров сахарозы, имеющих молекулярную формулу
С12Н22О11, можно выделить мальтозу и лактозу.
При гидролизе различные дисахариды расщепляются на
составляющие их моносахариды за счёт разрыва связей между ними (гликозидных
связей):

Таким образом, реакция гидролиза дисахаридов является
обратной процессу их образования из моносахаридов.
Применение
сахарозы
· Продукт питания;
· В кондитерской промышленности;
· Получение искусственного мёда
2. Мальтоза
Это дисахарид, состоящий из двух
остатков α-глюкозы, она является промежуточным веществом при гидролизе
крахмала.
остаток остаток
α-глюкозы α-глюкозы
Мальтоза – является восстанавливающим
дисахаридом и вступает в реакции, характерные для альдегидов.
2.
К восстанавливающим сахаром относятся также целлобиоза
и лактоза
Эти дисахариды так же могут
гидролизоваться.
Полисахариды.
Полисахариды — это природные
высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов.
Основные
представители — крахмал и целлюлоза — построены из остатков одного моносахарида
— глюкозы. Крахмал и целлюлоза имеют одинаковую молекулярную формулу (C6H10O5)n,
но совершенно различные свойства. Это объясняется особенностями их пространственного
строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из
β-глюкозы, которые являются
пространственными изомерами и отличаются лишь положением одной гидроксильной
группы (выделена цветом):
Крахмал.
Крахмалом
называется смесь двух полисахаридов, построенных из остатков циклической
α-глюкозы.
В его состав входят:
·
амилоза (внутренняя часть крахмального зерна) –
10-20%
·
амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200-1000
остатков α-глюкозы (средняя Mr=160 000) и имеет неразветвленное
строение.
Макромолекула амилозы представляет собой
спираль, каждый виток которой состоит из 6 звеньев α-глюкозы.
Свойства
крахмала:
1.
Гидролиз крахмала: при
кипячении в кислой среде крахмал последовательно гидролизуется.
2. Крахмал не
дает реакцию “серебряного зеркала” и не восстанавливает гидроксид
меди (II).
3. Качественная
реакция на крахмал: синее окрашивание с раствором йода.
Получение
Получают крахмал из природных
крахмалосодержащих продуктов, чаще всего картофеля и кукурузы. Он широко
используется в качестве продукта питания, а также как сырье для производства
глюкозы и этилового спирта.
Целлюлоза
Физические
свойства
Это вещество белого цвета, без вкуса и запаха,
нерастворимое в воде, имеющее волокнистое строение. Растворяется в аммиачном
растворе гидроксида меди (II)
Нахождение
в природе
Этот биополимер обладает большой механической прочностью
и выполняет роль опорного материала растений, образуя стенку растительных
клеток. В большом количестве целлюлоза содержится в тканях древесины (40-55%),
в волокнах льна (60-85%) и хлопка (95-98%). Основная составная часть оболочки
растительных клеток. Образуется в растениях в процессе фотосинтеза.
Древесина состоит на 50% из целлюлозы, а хлопок и лён,
конопля практически чистая целлюлоза.
Хитин (аналог целлюлозы) – основной компонент наружного
скелета членистоногих и других беспозвоночных, а также в составе клеточных
стенок грибов и бактерий.
Получение
Получают
из древесины
Целлюлоза
(клетчатка) – наиболее
распространенный растительный полисахарид. Цепи целлюлозы построены из остатков
β-глюкозы и имеют линейное строение.
Молекулярная масса целлюлозы – от 400 000 до 2
млн.
Свойства
целлюлозы.
1. Горение
(С6Н10О5)n
+ О2 à CO2
+ Н2О
Без доступа кислорода – до угля и воды
(С6Н10О5)n
à C + Н2О
2. С йодом целлюлоза сине-фиолетовое окрашивание не дает.
3. Образование сложных
эфиров с азотной и уксусной кислотами.
а) нитрование целлюлозы. Т.к. в звене
целлюлозы содержится 3 гидроксильные группы, то при нитровании избытком азотной
кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества
пироксилина:
(С6Н7О2(ОН)3)n + 3n HNO3 à 3nH2O + (С6Н7О2(ОNO2)3)n
целлюлоза тринитрат
целлюлозы (пироксилин)
б) ацилирование целлюлозы. При действии на
целлюлозу уксусного ангидрида происходит реакция этерификации, при этом
возможно участие в реакции 1, 2 и 3 групп ОН. Получается ацетат целлюлозы – ацетатное
волокно.
(С6Н7О2(ОН)3)n +3n(СН3СО)2Оà
3nСН3-СООН + (С6Н7О2(ОСОСН3)3)n
целлюлоза уксусный ангидрид
уксусная кислота триацетат целлюлозы
|
|
+ 3n |
|
→ |
|
+ 3n СH3СOOН |
4. Гидролиз
целлюлозы.
Целлюлоза, подобно крахмалу, в кислой
среде гидролизуется:
Применение
Целлюлоза
используется в производстве бумаги, искусственных волокон, пленок, пластмасс,
лакокрасочных материалов, бездымного пороха, взрывчатки, твердого ракетного
топлива, для получения гидролизного спирта и др.
· Получение ацетатного шёлка –
искусственное волокно, оргстекла, негорючей плёнки из ацетилцеллюлозы.
· Получение бездымного пороха из
триацетилцеллюлозы (пироксилин).
· Получение коллодия (плотная плёнка для
медицины) и целлулоида ( изготовление киноленты, игрушек) из
диацетилцеллюлозы.
· Изготовление нитей, канатов, бумаги.
· Получение глюкозы, этилового спирта
(для получения каучука)
3.8.3. Углеводы (моносахариды, дисахариды, полисахариды).
Углеводы — органические соединения, чаще всего природного происхождения, состоящие только из углерода, водорода и кислорода.
Углеводы играют огромную роль в жизнедеятельности всех живых организмов.
Свое название данный класс органических соединений получил за то, что первые изученные человеком углеводы имели общую формулу вида Cx(H2O)y . Т.е. их условно посчитали соединениями углерода и воды. Однако позднее оказалось, что состав некоторых углеводов отклоняется от этой формулы. Например, такой углевод как дезоксирибоза имеет формулу С5Н10О4. В то же время существуют некоторые соединения, формально соответствующие формуле Cx(H2O)y, однако к углеводам не относящиеся, как, например, формальдегид (СН2О) и уксусная кислота (С2Н4О2).
Тем не менее, термин «углеводы» исторически закрепился за данным классом соединений, в связи с чем повсеместно используется и в наше время.
Классификация углеводов
В зависимости от способности углеводов расщепляться при гидролизе на другие углеводы с меньшей молекулярной массой их делят на простые (моносахариды) и сложные (дисахариды, олигосахариды, полисахариды).
Как легко догадаться, из простых углеводов, т.е. моносахаридов, нельзя гидролизом получить углеводы с еще меньшей молекулярной массой.
При гидролизе одной молекулы дисахарида образуются две молекулы моносахарида, а при полном гидролизе одной молекулы любого полисахарида получается множество молекул моносахаридов.
Химические свойства моносахаридов на примере глюкозы и фруктозы
Самыми распространенными моносахаридами являются глюкоза и фруктоза, имеющие следующие структурные формулы:
Как можно заметить, и в молекуле глюкозы, и в молекуле фруктозы присутствует по 5 гидроксильных групп, в связи с чем их можно считать многоатомными спиртами.
В составе молекулы глюкозы имеется альдегидная группа, т.е. фактически глюкоза является многоатомным альдегидоспиртом.
В случае фруктозы можно обнаружить в ее молекуле кетонную группу, т.е. фруктоза является многоатомным кетоспиртом.
Химические свойства глюкозы и фруктозы как карбонильных соединений
Все моносахариды могут реагировать в присутствии катализаторов с водородом. При этом карбонильная группа восстанавливается до спиртовой гидроксильной. Так, в частности, гидрированием глюкозы в промышленности получают искусственный подсластитель – гексаатомный спирт сорбит:
Молекула глюкозы содержит в своем составе альдегидную группу, в связи с чем логично предположить, что ее водные растворы дают качественные реакции на альдегиды. И действительно, при нагревании водного раствора глюкозы со свежеосажденным гидроксидом меди (II) так же, как и в случае любого другого альдегида, наблюдается выпадение из раствора кирпично-красного осадка оксида меди (I). При этом альдегидная группа глюкозы окисляется до карбоксильной – образуется глюконовая кислота:
Также глюкоза вступает и в реакцию «серебряного зеркала» при действии на нее аммиачного раствора оксида серебра. Однако, в отличие от предыдущей реакции вместо глюконовой кислоты образуется ее соль – глюконат аммония, т.к. в растворе присутствует растворенный аммиак:
Фруктоза и другие моносахариды, являющиеся многоатомными кетоспиртами, в качественные реакции на альдегиды не вступают.
Химические свойства глюкозы и фруктозы как многоатомных спиртов
Поскольку моносахариды, в том числе глюкоза и фруктоза, имеют в составе молекул несколько гидроксильных групп. Все они дают качественную реакцию на многоатомные спирты. В частности, в водных растворах моносахаридов растворяется свежеосажденный гидроксид меди (II). При этом вместо голубого осадка Cu(OH)2 образуется темно-синий раствор комплексных соединений меди.
Реакции брожения глюкозы
Спиртовое брожение
При действии на глюкозу некоторых ферментов глюкоза способна превращаться в этиловый спирт и углекислый газ:
Молочнокислое брожение
Помимо спиртового типа брожения существует также и немало других. Например, молочнокислое брожение, которое протекает при скисании молока, квашении капусты и огурцов:
Особенности существования моносахаридов в водных растворах
Моносахариды существуют в водном растворе в трех формах – двух циклических (альфа- и бета-) и одной нециклической (обычной). Так, например, в растворе глюкозы существует следующее равновесие:
Как можно видеть, в циклических формах отсутствует альдегидная группа, в связи с тем что она участвует в образовании цикла. На ее основе образуется новая гидроксильная группа, которую называют ацетальным гидроксилом. Аналогичные переходы между циклическими и нециклической формами наблюдаются и для всех других моносахаридов.
Дисахариды. Химические свойства.
Общее описание дисахаридов
Дисахаридами называют углеводы, молекулы которых состоят из двух остатков моносахаридов, связанных между собой за счет конденсации двух полуацетальных гидроксилов либо же одного спиртового гидроксила и одного полуацетального. Связи, образующиеся таким образом между остатками моносахаридов, называют гликозидными. Формулу большинства дисахаридов можно записать как C12H22O11.
Наиболее часто встречающимся дисахаридом является всем знакомый сахар, химиками называемый сахарозой. Молекула данного углевода образована циклическими остатками одной молекулы глюкозы и одной молекулы фруктозы. Связь между остатками дисахаридов в данном случае реализуется за счет отщепления воды от двух полуацетальных гидроксилов:
Поскольку связь между остатками моносахаридов образована при конденсации двух ацетальных гидроксилов, для молекулы сахара невозможно раскрытие ни одного из циклов, т.е. невозможен переход в карбонильную форму. В связи с этим сахароза не способна давать качественные реакции на альдегиды.
Подобного рода дисахариды, которые не дают качественные реакции на альдегиды, называют невосстанавливающими сахарами.
Тем не менее, существуют дисахариды, которые дают качественные реакции на альдегидную группу. Такая ситуация возможна, когда в молекуле дисахарида остался полуацетальный гидроксил из альдегидной группы одной из исходных молекул моносахаридов.
В частности, в реакцию с аммиачным раствором оксида серебра, а также гидроксидом меди (II) подобно альдегидам вступает мальтоза. Связано это с тем, что в её водных растворах существует следующее равновесие:
Как можно видеть, в водных растворах мальтоза существует в виде двух форм – с двумя циклами в молекуле и одним циклом в молекуле и альдегидной группой. По этой причине мальтоза, в отличие от сахарозы, дает качественную реакцию на альдегиды.
Гидролиз дисахаридов
Все дисахариды способны вступать в реакцию гидролиза, катализируемую кислотами, а также различными ферментами. В ходе такой реакции из одной молекулы исходного дисахарида образуется две молекулы моносахарида, которые могут быть как одинаковыми, так и различными в зависимости от состава исходного моносахарида.
Так, например, гидролиз сахарозы приводит к образованию глюкозы и фруктозы в равных количествах:
А при гидролизе мальтозы образуется только глюкоза:
Дисахариды как многоатомные спирты
Дисахариды, являясь многоатомными спиртами, дают соответствующую качественную реакцию с гидроксидом меди (II), т.е. при добавлении их водного раствора ко свежеосажденному гидроксиду меди (II) нерастворимый в воде голубой осадок Cu(OH)2 растворяется с образованием темно-синего раствора.
Полисахариды. Крахмал и целлюлоза
Полисахариды — сложные углеводы, молекулы которых состоят из большого числа остатков моносахаридов, связанных между собой гликозидными связями.
Есть и другое определение полисахаридов:
Полисахаридами называют сложные углеводы, молекулы которых образуют при полном гидролизе большое число молекул моносахаридов.
В общем случае формула полисахаридов может быть записана как (C6H10O5)n.
Крахмал – вещество, представляющее собой белый аморфный порошок, не растворимый в холодной воде и частично растворимый в горячей с образованием коллоидного раствора, называемого в быту крахмальным клейстером.
Крахмал образуется из углекислого газа и воды в процессе фотосинтеза в зеленых частях растений под действием энергии солнечного света. В наибольших количествах крахмал содержится в картофельных клубнях, пшеничных, рисовых и кукурузных зернах. По этой причине указанные источники крахмала и являются сырьем для его получения в промышленности.
Целлюлоза – вещество, в чистом состоянии представляющее собой белый порошок, не растворимый ни в холодной, ни в горячей воде. В отличие от крахмала целлюлоза не образует клейстер. Практически из чистой целлюлозы состоит фильтровальная бумага, хлопковая вата, тополиный пух. И крахмал, и целлюлоза являются продуктами растительного происхождения. Однако, роли, которые они играют в жизни растений, различны. Целлюлоза является в основном строительным материалом, в частности, главным образом ей образованы оболочки растительных клеток. Крахмал же несет в основном запасающую, энергетическую функцию.
Химические свойства крахмала и целлюлозы
Горение
Все полисахариды, в том числе крахмал и целлюлоза, при полном сгорании в кислороде образуют углекислый газ и воду:
Образование глюкозы
При полном гидролизе как крахмала, так и целлюлозы образуется один и тот же моносахарид – глюкоза:
Качественная реакция на крахмал
При действии йода на что-либо, в чем содержится крахмал, появляется синее окрашивание. При нагревании синяя окраска исчезает, при охлаждении появляется вновь.
При сухой перегонке целлюлозы, в частности древесины, происходит ее частичное разложение с образованием таких низкомолекулярных продуктов как метиловый спирт, уксусная кислота, ацетон и т.д.
Поскольку и в молекулах крахмала, и в молекулах целлюлозы имеются спиртовые гидроксильные группы, данные соединения способны вступать в реакции этерификации как с органическими, так и с неорганическими кислотами: