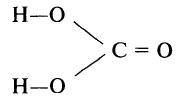
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кислот на растворимые силикаты (силикаты щелочных металлов).
Например, при действии соляной кислоты на силикат натрия:
Na2SiO3 + 2HCl → H2SiO3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Na2SiO3 + 2Н2O + 2CO2 → 2NaHCO3 + H2SiO3
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Например, кремниевая кислота реагирует с концентрированным гидроксидом калия:
H2SiO3 + 4KOH → K2SiO3 + 4H2O
2. При нагревании кремниевая кислота разлагается на оксид и воду:
H2SiO3 → SiO2 + H2O
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1. Растворение кремния, кремниевой кислоты или оксида в щелочи:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
Si + 2NaOH + H2O → Na2SiO3 + H2
SiO2 + 2KOH → K2SiO3 + H2O
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
K2SiO3 + CaCl2 → CaSiO3 + 2KCl
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато-лиловый.
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности
в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.

Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством
компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем
вы думаете: внутри гаджета, которым вы пользуетесь 

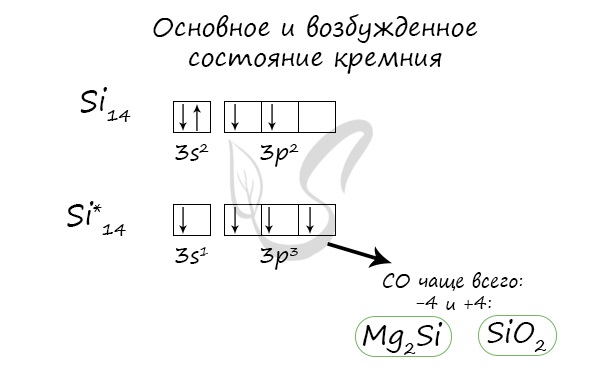
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe3+ — цитрин
- SiO2 с примесью Fe2+ и Fe3+ — аметист

Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
SiO2 + C → (t) Si + CO2↑
SiO2 + Al → (t) Si+ Al2O3
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакция с щелочами
При обычных условиях без нагревания кремний реагирует только со фтором.
Si + F2 → SiF4
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний
с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + Cl2 → (t) SiCl4
Si + C → (t) SiC
Si + O2 → (t) SiO2
Si + O2 → (t = 1200 °C) SiO

В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
KOH + Si → K2SiO3 + H2↑
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре
+1730 °C градусов.
Получение
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
Si + O2 → SiO2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2,
который выпадает в осадок, и воду.
Na2SiO3 + CH3COOH → CH3COONa + H2SiO3↓
H2SiO3 → SiO2 + H2O

Химические свойства
- Реакции с кислотами
- Реакции с основными оксидами и щелочами
- С карбонатами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
SiO2 + HF → SiF4 + H2O
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли
данной кислоты — силикаты.
MgO + SiO2 → MgSiO3
NaOH + SiO2 → Na2SiO3 + H2O

Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
K2CO3 + SiO2 → K2SiO3 + CO2↑
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Получение
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии
через ее соли — силикаты.
LiOH + SiO2 → Li2SiO3 + H2O
Li2SiO3 + HCl → LiCl + H2SiO3↓
Химические свойства
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
H2SiO3 → H2O + SiO2

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
…
Силан (моносилан, гидрид кремния)
Способы получения силана
- Разложение силицида магния соляной кислотой – наиболее распространенный способ получения силана:
Mg2Si + 4HCl → 2MgCl2 + SiH4↑
- Восстановление галогенидов кремния алюмогидридом лития:
SiCl4 + LiAlH4 = SiH4↑ + LiCl + AlCl3
- Разложение триэтоксисилана при нагревании до 80ºС в присутствии натрия:
4SiH(OC2H5)3 = SiH4↑ + 3Si(OC2H5)4
Химические свойства силана
Силаны (кремневодороды) имеют общую формулу SinH2n+2, где n = 1-8. Цепи -Si-Si- неустойчивы.
Моносилан SiH4 – бесцветный ядовитый газ с неприятным запахом.
- Окисляется кислородом даже при невысоких температурах. На воздухе он самовоспламеняется (часто со взрывом) с образованием SiO2 и H2O:
SiH4+ 2O2 → SiO2 + 2H2O
Видео Горение силана
- Силан с легкостью гидролизуется водой и особенно легко щелочами:
SiH4 + 2H2O → SiO2+ 4H2
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
- При
нагревании разлагается:
SiH4 → Si + 2H2
Диоксид кремния (кремнезем)
Нахождение в природе кремнезема
Диоксид
кремния имеет атомную
кристаллическую решетку. Существует в виде кристаллической (горный хрусталь,
аметист, агат, яшма), аморфной (опал) и стеклообразной (кварцевое стекло) форм
Химические свойства кремнезема
Диоксид кремния — кислотный оксид. Проявляет слабые окислительные свойства
- Практически не растворяется в воде и органических растворителях.
- Взаимодействует с растворами и расплавами щелочей, образуя силикаты:
SiO2 + 2KOH → K2SiO3 + H2O
- Реагирует с основными оксидами:
SiO2 + CaO → CaSiO3
- Вытесняет углекислый газ при сплавлении с карбонатами щелочных металлов:
SiO2 + K2CO3 → K2SiO3 + CO2
- Из всех кислот вступает в реакцию только с плавиковой кислотой, с образованием кремнийфтористоводородной кислоты:
SiO2 + 6HF(р-р) → H2[SiF6] + 2H2O
- С газообразным фтороводородом взаимодействует при 250-400ºС с образованием тетрафторсилана:
SiO2 + 4HF(г) = SiF4 + 2H2O
SiO2 + 2F2 = SiF4 + O2
- Взаимодействует с активными металлами при температуре выше 1000 °С с образованием кремния:
SiO2 + 2Mg → Si + 2MgO
При избытке
восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
- Взаимодействует с неметаллами – с водородом в жестких условиях, с углеродом:
SiO2 + 2Н2 → Si + 2Н2O
SiO2 + 3С → SiС + 2СО
- При
сплавлении реагирует с фосфатом кальция и углем:
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
Кремниевые кислоты и силикаты
Кремниевые кислоты – nSiO2 · mH2O
Кремниевые кислоты — соединения общей формулы nSiO2 · mH2O. Это очень слабые, малорастворимые в воде соединения, легко образующие коллоидные растворы.
Существуют ортокремниевая кислота – H4SiO4
Метакремниевая (кремниевая) кислота – H2SiO3
Ди – и поликремниевые
кислоты
Способы получения кремниевых кислот
- Действие сильных кислот на растворы силикатов щелочных металлов:
Na2SiO3 + 2HCl → H2SiO3 + 2NaCl
- Гидролиз хлорсиланов:
SiCl4 + 4H2O = H4SiO4 + 4HCl
Химические свойства кремниевых кислот
- кремниевая
кислота реагирует только с сильными основаниями и их оксидами:
H2SiO3 + 4KOH → K2SiO3 + 4H2O
- При нагревании кремниевая кислота дегидратируется с образованием оксида и воды:
H2SiO3 → SiO2 + H2O
Силикаты – соли кремниевой кислоты
Большинство силикатов
нерастворимо в воде. Растворимыми являются силикаты натрия и калия,
растворы которых
называют
«жидким стеклом».
Способы получения силикатов
- Взаимодействие кремния, кремниевой кислоты или диоксида кремния с щелочью:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
Si + 2NaOH + H2O → Na2SiO3 + H2
SiO2 + 2KOH → K2SiO3 + H2O
- Реакция с основными оксидами:
СаО + SiO2 → CaSiO3
- Взаимодействие растворимых силикатов с солями:
K2SiO3 + CaCl2 → CaSiO3 + 2KCl
Химические свойства силикатов
- Силикаты в водных растворах сильно гидролизованы (среда щелочная):
K2SiO3 + H2O ↔ KНSiO3 + KOH
SiO32-+ H2O ↔ НSiO3— + OH—
- Взаимодействие с растворимыми солями:
Na2SiO3+ MgCl2 =MgSiO3↓ + 2NaCl
- При пропускании СО2 через растворы силикатов происходит выпадение гелеобразного осадка кремневой кислоты:
Na2SiO3 + CO2 + H2O = H2SiO3↓ + Na2CO3
| Стекло | Смесь силикатов натрия и кальция (Na2O·CaO·6SiO2) – это обычное оконное стекло. Получают его при сплавлении смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2 в специальных печах:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2↑ Для получения специального стекла вводят различные добавки: Pb2+ – хрусталь; Cr3+ – придает зеленую стеклу окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – окрашивает стекло в синий цвет, Mn2+ – стекло имеет красновато-лиловый окрас |
| Цемент | Цемент — искусственное порошкообразное неорганическое гидравлическое вяжущее вещество. При взаимодействии с водой, водными растворами солей и другими жидкостями образует пластичную массу, которая затем твердеет и превращается в камневидное тело. Видов цементов много, но все они содержат в своем составе: диоксид кремния SiO2 (кварц или кремнекислота), оксид алюминия Al2O3 (глинозём), оксид железа Fe2O3 Например, наиболее распространенный портланд – цемент имеет следующий состав: SiO2 – 20-23% Al2O3 – 4-7% Fe2O3 – 2-5% СаО – 62-76% MgO – 1-5% |
Угольная кислота. Кремниевая кислота
Ключевые слова конспекта: угольная кислота, графическая форма угольной кислоты, кремниевая кислота, мета-форма, орто-форма, метакремниевая, ортокремниевая кислота, получение кремниевой кислоты.
И углерод, и кремний образуют высшие гидроксиды – кислоты: соответственно угольную (H2СО3) и кремниевую (H2SiO3). В свободном виде они не получены. H2СО3 существует только в разбавленных растворах, a H2SiO3 – в полимерной форме.
Угольная кислота H2СО3.
Графическая формула угольной кислоты:
В молекуле СO2 кратные связи очень прочны, образование H2СО3 невыгодно, так как общая кратность связи понижается. Поэтому, несмотря на хорошую растворимость углекислого газа СO2 в воде, основная его масса в растворе находится в виде гидратированного оксида и лишь небольшая часть – в форме угольной кислоты.
В результате взаимодействий в системе СO2 (г.) – H2O (ж.) устанавливается следующая совокупность равновесий:
СO2 (г.) + H2O (ж.) ⇆ СO2 (р-р) + H2O (ж.) ⇆ H2СO3 (р-р) ⇆ Н+ +NCO3– ⇆ 2Н+ + СО32–
Из всего количества растворённого СO2 (при давлении СO2, равном атмосферному) только 0,3% связывается с водой, образуя молекулы H2СО3.
Угольная кислота – слабая двухосновная кислота. Лакмус в растворе углекислого газа окрашивается в красный цвет.
Кремниевая кислота
Осаждается в виде полимерного соединения. Формулы для кремниевой кислоты H2SiO3 (мета-форма) и H4SiO4 (орто-форма) только отражают соотношение элементов в соединении, но не истинный состав. Условно на плоскости состав кремниевой кислоты можно изобразить в виде схемы:
Кремниевую кислоту получают взаимодействием силикатов щелочных металлов с сильными кислотами. Уравнение реакции записываем с учётом условности приводимых формул:
Na2SiO3 + 2НCl = 2NaCl + H2SiO3↓
SiO32– + 2Н+ = H2SiO3↓
Осаждение кремниевой кислоты приводит к образованию геля (студня) переменного состава SiO2 • nH2O (n > 2). Над осадком в разбавленном растворе существует мономерная слабая ортокремниевая кислота H4SiO4. Соединение мономерного состава H2SiO3 не выделено.
Кремниевая кислота при нагревании разлагается:
Кремниевая кислота растворяется при взаимодействии с растворами щелочей – гидроксидов щелочных металлов (уравнения реакций записываются с учётом условности приводимых формул для кремниевой кислоты и силикатов):
H2SiO3 + 2NaOH = Na2SiO3 + 2H2O
H2SiO3 + 2ОН– = SiO32– + 2H2О
Конспект урока по химии «Угольная кислота. Кремниевая кислота». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Ещё конспекты по теме «Углерод и кремний«:
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Кремниевые кислоты –
соединения оксида кремния с водой, очень слабые нерастворимые кислоты. Соотношение оксида кремния и воды различно, общая формула
nSiO
2
·mH
2
O
, кислоты легко переходят друг в друга.
В водных растворах доказано существование ортокремниевой H
4
SiO
4
, пирокремниевой H
6
Si
2
O
7
, метакремниевой H
2
SiO
3
и дикремниевой H
2
Si
2
O
5
кислот.
H
2
SiO
3
— очень слабая (слабее угольной), непрочная, в воде малорастворима (образует коллоидный раствор).
Получение кремниевой кислоты:
Na
2
SiO
3
+ 2HCl → 2NaCl + H
2
SiO
3
При нагревании разлагается:
H
2
SiO
3
–
t°
→ H
2
O + SiO
2
Соли кремниевой кислоты –
силикаты
. Обычно они нерастворимы в воде, исключения составляют силикаты натрия и калия, их называют «жидким стеклом». Силикаты широко распространены в природе. Свойства силикатов различны в зависимости от их состава и строения, очень часто они имеют красивую окраску, некоторые из них используются в ювелирном деле (гранат, топаз, изумруд).
Гранат
— общая формула: R
2+
3
R
3+
2
[SiO
4
]
3
, где R
2+
— Mg, Fe, Mn, Ca; R
3+
— Al, Fe, Cr
Топаз
— Al
2
[SiO
4
](F, OH)
2
+ примеси Fe
2+
, Fe
3+
, Ti, Cr, V и др
Изумруд
— Be
3
Al
2
Si
6
O
18
+ примеси Fe
2
O
3
, V
2
O
3
, Cr
2
O
3
Состав обычного оконного стекла: Na
2
O·CaO·6SiO
2
.
Стекло получают при сплавлении в специальных печах смеси соды Na
2
CO
3
, известняка CaCO
3
и белого песка SiO
2
:
6SiO
2
+ Na
2
CO
3
+ CaCO
3
→ Na
2
O·CaO·6SiO
2
+ 2CO
2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы:
Pb
2+
– хрусталь;
Cr
3+
– имеет зеленую окраску,
Fe
3+
– коричневое бутылочное стекло,
Co
2+
– дает синий цвет,
Mn
2+
– красновато–лиловый