1. Положение кремния в периодической системе химических элементов
2. Электронное строение кремния
3. Физические свойства и нахождение в природе кремния
4. Качественные реакции на силикаты
5. Основные соединения кремния
6. Способы получения кремния
7. Химические свойства кремния
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и углеродом
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с щелочами
7.2.2. Взаимодействие с кислотами
7.2.3. Взаимодействие с азотной кислотой
Бинарные соединения кремния — силициды, силан и др.
Оксид кремния (IV)
1. Физические свойства и нахождение в природе
2. Химические свойства
2.1. Взаимодействие с щелочами и основными оксидами
2.2. Взаимодействие с водой
2.3. Взаимодействие с карбонатами
2.4. Взаимодействие с кислотами
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
Кремниевая кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
Силикаты
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии:
+14Si 1s22s22p63s23p2
Электронная конфигурация кремния в возбужденном состоянии:
+14Si* 1s22s22p63s13p3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см3. Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO32- — взаимодействие солей-силикатов с сильными кислотами. Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например, если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2
кремниевая кислота H2SiO3 силикаты MeSiO3 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4
силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
3SiO2 + 4Al → 3Si + 2Al2O3
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком:
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана:
SiH4 → Si + 2H2
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами, и с неметаллами.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
Si + 2F2 → SiF4
При нагревании кремний реагирует с хлором, бромом, йодом:
Si + 2Cl2 → SiCl4
Si + 2Br2 → SiBr4
1.2. При сильном нагревании (около 2000оС) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом.
1.4. С азотом кремний реагирует в очень жестких условиях:
3Si + 2N2 → Si3N4
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом:
Si + O2 → SiO2
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Видеоопыт взаимодействия кремния с раствором щелочи можно посмотреть здесь.
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si + 6HF → H2[SiF6] + 2H2
При обработке кремния безводным фтороводородом комплекс не образуется:
Si(тв.) + 4HF(г.) = SiF4 + 2H2
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например, силицид магния разлагается водой на гидроксид магния и силан:
Mg2Si + 4H2O → 2Mg(OH)2 + SiH4
Соляная кислота легко разлагает силицид магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg2Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
SiH4 + 2O2 → SiO2 + 2H2O
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
Силан при нагревании разлагается:
SiH4 → Si + 2H2
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si+4C-4. Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
SiC +2O2 → SiO2 + CO2
Карборунд окисляется кислородом в расплаве щелочи:
SiC + 2O2 + 4NaOH → Na2SiO3 + Na2CO3 + 2H2O
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем:
SiO2 + C + Cl2 → SiCl4 + CO
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
SiCl4 + 3H2O → H2SiO3↓ + 4HCl
Хлорид кремния (IV) восстанавливается водородом:
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид. За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами. При этом образуются силикаты.
Например, диоксид кремния взаимодействует с гидроксидом калия:
SiO2 + 2KOH → K2SiO3 + H2O
Еще пример: диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой, т.к. кремниевая кислота нерастворима.
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов. При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например, оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
SiO2 + K2CO3 → K2SiO3 + CO2
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 4HF(г) = SiF4 + 2H2O
SiO2 + 6HF(р-р) → H2[SiF6] + 2H2O
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например, оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например, оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
SiO2 + 2Н2 → Si + 2Н2O
Еще пример: оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кислот на растворимые силикаты (силикаты щелочных металлов).
Например, при действии соляной кислоты на силикат натрия:
Na2SiO3 + 2HCl → H2SiO3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Na2SiO3 + 2Н2O + 2CO2 → 2NaHCO3 + H2SiO3
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Например, кремниевая кислота реагирует с концентрированным гидроксидом калия:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
2. При нагревании кремниевая кислота разлагается на оксид и воду:
H2SiO3 → SiO2 + H2O
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1. Растворение кремния, кремниевой кислоты или оксида в щелочи:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
Si + 2NaOH + H2O → Na2SiO3 + 2H2
SiO2 + 2KOH → K2SiO3 + H2O
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
K2SiO3 + CaCl2 → CaSiO3 + 2KCl
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато-лиловый.
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности
в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.

Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством
компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем
вы думаете: внутри гаджета, которым вы пользуетесь 

Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
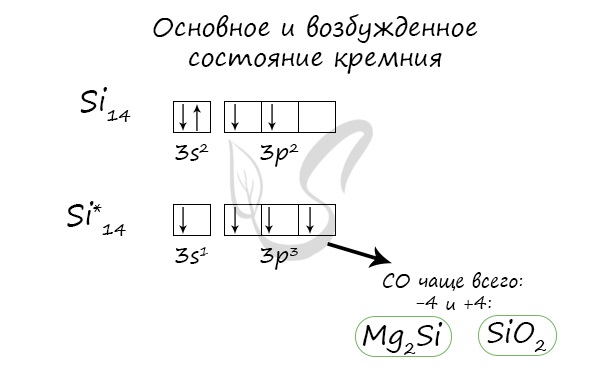
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe3+ — цитрин
- SiO2 с примесью Fe2+ и Fe3+ — аметист

Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
SiO2 + C → (t) Si + CO2↑
SiO2 + Al → (t) Si+ Al2O3
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакция с щелочами
При обычных условиях без нагревания кремний реагирует только со фтором.
Si + F2 → SiF4
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний
с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + Cl2 → (t) SiCl4
Si + C → (t) SiC
Si + O2 → (t) SiO2
Si + O2 → (t = 1200 °C) SiO

В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
KOH + Si → K2SiO3 + H2↑
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре
+1730 °C градусов.
Получение
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
Si + O2 → SiO2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2,
который выпадает в осадок, и воду.
Na2SiO3 + CH3COOH → CH3COONa + H2SiO3↓
H2SiO3 → SiO2 + H2O

Химические свойства
- Реакции с кислотами
- Реакции с основными оксидами и щелочами
- С карбонатами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
SiO2 + HF → SiF4 + H2O
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли
данной кислоты — силикаты.
MgO + SiO2 → MgSiO3
NaOH + SiO2 → Na2SiO3 + H2O

Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
K2CO3 + SiO2 → K2SiO3 + CO2↑
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Получение
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии
через ее соли — силикаты.
LiOH + SiO2 → Li2SiO3 + H2O
Li2SiO3 + HCl → LiCl + H2SiO3↓
Химические свойства
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
H2SiO3 → H2O + SiO2

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
2.3.4. Химические свойства углерода и кремния.
Химические свойства углерода
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем. 1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам. Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
Карбиды активных металлов гидролизуются водой:
а также растворами кислот-неокислителей:
При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
С хлором, бромом и йодом кремний реагирует только при нагревании. При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
Так с хлором реакция протекает при 340-420 оС:
С бромом – 620-700 оС:
С йодом – 750-810 оС:
Все галогениды кремния легко гидролизуются водой:
а также растворами щелочей:
Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
При температуре 1200-1500 оС кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500оС. При этом образуется водород и диоксид кремния:
Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Чтобы поделиться, нажимайте
Второй по распространённости элемент в земной коре после кислорода (27,6% по массе). Встречается в соединениях.
| Строение атома кремния в основном состоянии
1s22s22p63s23p2 |
Строение атома кремния в возбуждённом состоянии
1s22s22p63s13p3 Степени окисления: +4, -4. |
Аллотропия кремния
Известен аморфный и кристаллический кремний.
Кристаллический – тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; ρ = 2,33 г/см3, t°пл. =1415°C; t°кип. = 2680°C.
Имеет алмазоподобную структуру и образует прочные ковалентные связи. Инертен.
Аморфный — бурый порошок, гигроскопичен, алмазоподобная структура, ρ = 2 г/см3, более реакционноспособен.
Получение кремния
1) Промышленность – нагревание угля с песком:
2C + SiO2 t˚→ Si + 2CO
2) Лаборатория – нагревание песка с магнием:
2Mg + SiO2 t˚→ Si + 2MgO
Химические свойства
Типичный неметалл, инертен.
Как восстановитель:
1) С кислородом
Si0 + O2 t˚→ Si+4O2
2) С фтором (без нагревания)
Si0 + 2F2 → SiF4
3) С углеродом
Si0 + C t˚→ Si+4C
(SiC — карборунд — твёрдый; используется для точки и шлифовки)
4) С водородом не взаимодействует.
Силан (SiH4) получают разложением силицидов металлов кислотой:
Mg2Si + 2H2SO4 → SiH4 + 2MgSO4
5) С кислотами не реагирует (только с плавиковой кислотой Si+4HF=SiF4+2H2)
Растворяется только в смеси азотной и плавиковой кислот:
3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O
6) Со щелочами (при нагревании):
Si0 + 2NaOH + H2O t˚→ Na2Si+4O3+ 2H2
Как окислитель:
7) С металлами (образуются силициды):
Si0 + 2Mg t˚→ Mg2Si-4
Применение кремния
Кремний широко используется в электронике как полупроводник. Добавки кремния к сплавам повышают их коррозионную стойкость. Силикаты, алюмосиликаты и кремнезем – основное сырье для производства стекла и керамики, а также для строительной промышленности.
Силан — SiH4
Физические свойства: Бесцветный газ, ядовит, t°пл. = -185°C, t°кип. = -112°C.
Получение: Mg2Si + 4HCl → 2MgCl2 + SiH4↑
Химические свойства:
1) Окисление: SiH4 + 2O2 t˚→ SiO2 + 2H2O
2) Разложение: SiH4 → Si + 2H2
Оксид кремния (IV) — (SiO2)n
SiO2 — кварц, горный хрусталь, аметист, агат, яшма, опал, кремнезём (основная часть песка):
Кристаллическая решётка оксида кремния (IV) – атомная и имеет такое строение:
Al2O3 • 2SiO2 • 2H2O — каолинит (основная часть глины)
K2O • Al2O3 • 6SiO2 — ортоклаз (полевой шпат)
Физические свойства: Твёрдое, кристаллическое, тугоплавкое вещество, t°пл.= 1728°C, t°кип.= 2590°C
Химические свойства:
Кислотный оксид. При сплавлении взаимодействует с основными оксидами, щелочами, а также с карбонатами щелочных и щелочноземельных металлов:
1) С основными оксидами:
SiO2 + CaO t˚→ CaSiO3
2) Со щелочами:
SiO2 + 2NaOH t˚→ Na2SiO3 + H2O
3) С водой не реагирует
4) С солями:
SiO2 + CaCO3 t˚→ CaSiO3 + CO2
SiO2 + K2CO3 t˚→ K2SiO3 + CO2
5) С плавиковой кислотой:
SiO2 + 4HF t˚→ SiF4 + 2H2O
SiO2 + 6HF t˚→ H2[SiF6] (гексафторкремниевая кислота) + 2H2O
(реакции лежат в основе процесса травления стекла).
Применение:
1. Изготовление силикатного кирпича
2. Изготовление керамических изделий
3. Получение стекла
Кремниевые кислоты
x • SiO2 • y H2O
x = 1, y = 1 H2SiO3 — метакремниевая кислота
x = 1, y = 2 H4SiO4 — ортокремниевая кислота и т.д.
Физические свойства: H2SiO3 — очень слабая (слабее угольной), непрочная, в воде малорастворима (образует коллоидный раствор), не имеет кислого вкуса.
Получение:
Действие сильных кислот на силикаты — Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
Химические свойства:
При нагревании разлагается: H2SiO3 t˚→ H2O + SiO2
Соли кремниевой кислоты — силикаты.
1) с кислотами
Na2SiO3+H2O+CO2=Na2CO3+H2SiO3
2) с солями
Na2SiO3+CaCl2=2NaCl+CaSiO3↓
3) Силикаты, входящие в состав минералов, в природных условиях разрушаются под действием воды и оксида углерода (IV) — выветривание горных пород:
(K2O • Al2O3 • 6SiO2)(полевой шпат) + CO2 + 2H2O → (Al2O3 • 2SiO2 • 2H2O)(каолинит (глина)) + 4SiO2(кремнезём (песок)) + K2CO3
Силикаты:
ли кремниевой кислоты – силикаты. Обычно они нерастворимы в воде, исключения составляют силикаты натрия и калия, их называют «жидким стеклом». Силикаты широко распространены в природе. Свойства силикатов различны в зависимости от их состава и строения, очень часто они имеют красивую окраску, некоторые из них используются в ювелирном деле (гранат, топаз, изумруд).
Гранат – общая формула: R2+3 R3+2 [SiO4]3, где R2+ — Mg, Fe, Mn, Ca; R3+ — Al, Fe, Cr
Топаз – Al2[SiO4](F, OH)2 + примеси Fe2+, Fe3+, Ti, Cr, V и др
Изумруд – Be3Al2Si6O18 + примеси Fe2O3, V2O3, Cr2O3
Состав обычного оконного стекла: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы:
Pb2+ – хрусталь;
Cr3+ – имеет зеленую окраску,
Fe3+ – коричневое бутылочное стекло,
Co2+ – дает синий цвет,
Mn2+ – красновато–лиловый
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности
в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.

Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством
компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем
вы думаете: внутри гаджета, которым вы пользуетесь

Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.

Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe3+ — цитрин
- SiO2 с примесью Fe2+ и Fe3+ — аметист

Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
SiO2 + C → (t) Si + CO2↑
SiO2 + Al → (t) Si+ Al2O3
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакция с щелочами
При обычных условиях без нагревания кремний реагирует только со фтором.
Si + F2 → SiF4
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний
с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + Cl2 → (t) SiCl4
Si + C → (t) SiC
Si + O2 → (t) SiO2
Si + O2 → (t = 1200 °C) SiO

В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
KOH + Si → K2SiO3 + H2↑
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре
+1730 °C градусов.
Получение
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
Si + O2 → SiO2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2,
который выпадает в осадок, и воду.
Na2SiO3 + CH3COOH → CH3COONa + H2SiO3↓
H2SiO3 → SiO2 + H2O

Химические свойства
- Реакции с кислотами
- Реакции с основными оксидами и щелочами
- С карбонатами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
SiO2 + HF → SiF4 + H2O
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли
данной кислоты — силикаты.
MgO + SiO2 → MgSiO3
NaOH + SiO2 → Na2SiO3 + H2O

Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
K2CO3 + SiO2 → K2SiO3 + CO2↑
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Получение
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии
через ее соли — силикаты.
LiOH + SiO2 → Li2SiO3 + H2O
Li2SiO3 + HCl → LiCl + H2SiO3↓
Химические свойства
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
H2SiO3 → H2O + SiO2

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
М.П. с. 153. ) Учеб . с. 185 Кремний – П – 31
Задача № 3. При взаимодействии избытка раствора гидроксида натрия ( Na O H )с 16 г кремния было получено 22,4 л водорода(н.у.) . Вычислите массовую долю кремния во взятом образце.
Сколько граммов оксида кремния (IV) содержалось в нём?
Сколько граммов 60%- го раствора щёлочи потребовалось для реакции?
Дано: Решение:
m(Si) загряз. = 16 г 1) Составим уравнение реакции. Обозначим через Х массу
V( H 2 ) = 22,4 л чистого кремния(без примесей):
W( Na O H ) = 60%
Х г ————— У г 22,4 л
W(Si) — ? Si + 2 Na O H + Н 2 О = Na 2 Si O 3 + 2Н 2
m(Si O 2) — ? V (ню) = 1 моль —- 2 моль 2 моль
m(р – ра ) — ? М = 28 г моль – 40 г моль V м = 22,4 л
m= 28 г —— 80 г V = 44,8 л
Составим пропорцию:
28 г —— 44,8 л водорода 28 х 22,4
Х г —— 22,4 л Х = ———— = 14 г кремния
44,8
2) Рассчитаем массовую долю кремния:
m(Si) 14
W(Si) = —————- = ——- = 0,875, или 87,5 %
m(Si) загряз. 16
3) Рассчитаем массу примеси, т.е. оксида кремния:
m ( Si O 2 ) = m(Si) загряз. — m(Si) = 16 -14 = 2 г.
4) Рассчитаем массу чистого Na O H, необходимого для реакции:
80 г Na O H — 44,8 л 80 х 22,4
У г ———- 22,4 л У = ————- = 40 г Na O H
44,8
5) Рассчитаем необходимую массу раствора, для этого воспользуемся формулой:
m( Na O H ) m( Na O H ) 40
W( Na O H ) = —————- ; m(р – ра ) = —————— = —— = 66,7 г раствора щёлочи
m(р – ра ) W( Na O H ) 0,6
Ответ : W(Si) = 87,5%; m ( Si O 2 ) = 2 г; m(р – ра ) = 66,7 г раствора щёлочи
В этом видео поговорим о химических свойствах кремния и его соединений. Силан, оксиды кремния, кремниевая кислота — что в них особенного, как их получить и с чем они реагируют? Химические свойства кремния. Строение атома кремния, возможные валентности и степени окисления. Аллотропные модификации кремния. Применение кремния и его соединений в повседневной жизни. Подготовка к ЕГЭ и ОГЭ по химии +7(999)445-96-07 (WhatsApp/Viber).
Видеокурс по неорганической химии. Автор курса — Алексей Манзюк.
0:00 — Кремний на Земле: где его можно встретить?
0:41 — Электронное строение атома кремния
1:02 — Основное и возбужденное состояние атома кремния
1:25 — Аллотропия кремния
1:53 — Способы получения кремния
2:42 — Химические свойства кремния
3:55 — Степени окисления кремния в соединениях
4:27 — Силан — как его получают и с чем он реагирует?
5:20 — Оксиды кремния
6:45 — Кремниевая кислота и её соли силикаты
7:50 — Как получают цветное стекло?
8:10 — Применение кремния и его соединений
Видео Кремний: химические свойства — ЕГЭ по химии канала Химшкола
Показать
Смотреть видео:
СМОТРЕТЬ ВИДЕОРОЛИК:
youtu.be/qqKyg0pcR1c
#химия #химияпросто #неорганика #егэпохимии #эксперименты #химик #егэхимия #химияегэ #огэхимия
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Досрочный ЕГЭ по химии 2019. Задание 15
Your system education

Досрочный ЕГЭ по химии 2019. Задание 17
Your system education

Досрочный ЕГЭ по химии 2019. Задание 20
Your system education

Досрочный ЕГЭ по химии 2019. Задание 19
Your system education
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
18.06.2019

К учебнику: Химия. Неорганическая химия. Органическая химия. 9 класс. Рудзитис Г.Е., Фельдман Ф.Г..-М.: 2009. — 191с.
Подготовка к ЕГЭ по химии и другие
полезные материалы для учителя химии, которые вы можете выбрать и скачать бесплатно в этом разделе.
Показывать
Химия. Неорганическая химия. Органическая химия. 9 класс. Рудзитис Г.Е., Фельдман Ф.Г..-М.: 2009. — 191с.

- Все учебники
- Органическая химия. 11 (10) класс. Нифантьев Э.Е.-М.: 2007. — 287 с.
- Органическая химия. 11 класс. Базовый уровень. Новошинский И.И., Новошинская Н.С.-М.: 2009. — 176с.
- Органическая химия. 11 класс. Профильный уровень. Новошинский И.И., Новошинская Н.С.-М.: 2008. — 352с.
- Органическая химия. Учебник для 10-11 класса. Цветков Л.А.-М.: 2012. -271с.
- Физика. Химия. 5-6 классы. Гуревич А.Е., Исаев Д.А., Понтак Л.С. М.: 2011. — 192 с.
- Химия 8 класс. Кузнецова Н.Е., Титова И.М., Гара Н.Н. 4-е изд., перераб. — М.: 2012. — 256 с.
- Химия 8 класс. Учебник. Еремин В.В., Кузьменко Н.Е. и др. М.: 2012. — 272 с.
- Химия 9 класс. Учебник. Еремин В.В., Кузьменко Н.Е. и др. М.: 2013. — 256 с.
- Химия 9 класс. Учебник. Кузнецова Н.Е., Титова И.М., Гара Н.Н. 4-е изд., перераб. — М.: 2012. — 288 с.
- Химия, 8 класс, Габриелян О.С, Сивоглазов В.И. и др., Москва : Дрофа, 2015. — 287 с.
- Химия, 8 класс, Оржековский П.А., Мещерякова Л.М. и др., Москва : АСТ : Астрель, 2013. — 274 с.
- Химия, 9 класс, Габриелян О.С, Сивоглазов В. И. и др., Москва : Дрофа, 2014. — 270 с.
- Химия, 9 класс, Журин А. А., Москва : Просвещение, 2013. — 127 с.
- Химия, 9 класс, Рудзитис Г.Е., Фельдман Ф.Г., Москва : Просвещение, 2016. — 208 с.
- Химия. 10 класс. Базовый уровень. Габриелян О.С. 9-е изд., стер. — М.: 2013. — 192 с.
- Химия. 10 класс. Базовый уровень. Новошинский И.И., Новошинская Н.С.-М.: 2008. — 176с.
- Химия. 10 класс. Профильный уровень. Еремин В.В., Кузьменко Н.Е. и др. 2-е изд., стер. — М.: 2012. — 464 с.
- Химия. 10 класс. Профильный уровень. Еремин В.В., Кузьменко Н.Е. и др. 3-е изд., стер. — М.: 2012. — 464 с.
- Химия. 10 класс. Профильный уровень. Карцова А.А., Лёвкин А.Н. М.: 2011. — 432 с.
- Химия. 10 класс. Углубленный уровень. Габриелян О.С. 2-е изд., стер. — М.: 2014. — 368с.
- Химия. 10 класс. Учебник. Габриелян О.С., Маскаев Ф.Н.-М.: 2002. — 304с.
- Химия. 11 класс. Базовый уровень. Габриелян О.С. М.: 2014. — 224 с.
- Химия. 11 класс. Базовый уровень. Еремин В.В., Кузьменко Н.Е. и др. 3-е изд., стер. — М.: 2012. — 160 с.
- Химия. 11 класс. Базовый уровень. Кузнецова Н.Е., Лёвкин А.Н., Шаталов М.А. М.: 2012. — 208 с.
- Химия. 11 класс. Профильный уровень. В 2 ч. Кузнецова Н.Е., Литвинова Т.Н., Лёвкин А.Н. М.: Ч.1 — 2008, 208с.; Ч.2 — 2011, 256с.
- Химия. 11 класс. Профильный уровень. В 2 ч. Кузнецова Н.Е., Литвинова Т.Н., Лёвкин А.Н. М.: Ч.1- 2008, 208с.; ч.2 — 2011, 256с.
- Химия. 11 класс. Профильный уровень. Еремин В.В., Кузьменко Н.Е. и др. М.: 2010. — 464 с.
- Химия. 11 класс. Учебник. Габриелян О.С. М., Лысова Г.Г.: 2002 — 368с.
- Химия. 11 класс. Учебник. Гузей Л.С., Суровцева Р.П., Лысова Г.Г.: 2008 — 224с.
- Химия. 8 класс. Габриелян О.С. 2-е изд.- М.: 2013. — 288с.
- Химия. 8 класс. Кузнецова Л.М. 6-е изд., стер. — М.: 2011. — 224 с.
- Химия. 8 класс. Новошинский И.И., Новошинская Н.С.-М.: 2013. — 224с.
- Химия. 8 класс. Учебник. Журин. А.А., Корнилаев С.В., Шалашова М.М.-М.: 2012. — 224с.
- Химия. 9 класс. Оржековский П.А., Мещерякова Л.М., Понтак Л.С.-М.: 2007. — 224с.
- Химия. 9 класс. Учебник. Габриелян О.С. М.: 2014 — 320с.
- Химия. 9 класс. Учебник. Гузей Л.С., Сорокин В.В., Суровцева Р.П.-М.: 2003. — 288с.
- Химия. 9 класс. Учебник. Новошинский И.И., Новошинская Н.С.-М.: 2012. — 256с.
- Химия. Вводный курс. 7 класс. Габриелян О.С., Остроумов И.Г., Ахлебинин А.К. 7-е изд., стер. — М.: 2013. — 160 с.
- Химия. Неорганическая химия. 8 класс. Рудзитис Г.Е., Фельдман Ф.Г.-М.: 2011. — 176с.
- Химия. Неорганическая химия. Органическая химия. 9 класс. Рудзитис Г.Е., Фельдман Ф.Г..-М.: 2009. — 191с.
- Химия. Органическая химия. 10 класс. Базовый уровень. Рудзитис Г.Е., Фельдман Ф.Г.-М.: 2012. — 192с.
- Химия. Основы общей химии. 11 класс. Базовый уровень. Рудзитис Г.Е., Фельдман Ф.Г.-М.: 2012. — 159с.
- Химия. Учеб. для пед. учреждений сред. проф. образования. О.С.Габриелян, И.Г.Остроумов. — 9-е изд., стер. — М.: Издательский центр «Академия», 2011. — 336 с.
- Химия. Учебник для 9 класса в 2 ч. Жилин Д.М.-М.: 2012. — 223с.
- Химия.10 класс. Базовый уровень. Кузнецова Н.Е., Гара Н.Н. М.: 2012. — 288 с.
- Химия.10 класс. Профильный уровень. Кузнецова Н.Е., Гара Н.Н., Титова. И.М.: 2011. — 384 с.
- Химия.11 класс. Профильный уровень. Габриелян О.С., Лысова Г.Г. 2-е изд., стер. — М.: 2015 — 400с.
- Химия: учебник для 8 класса, Жилин Д.М., Изд. «БИНОМ. Лаборатория знаний» 2012
- Химия: учебник для 9 класса, Жилин Д.М., Изд. «БИНОМ. Лаборатория знаний» 2012
Нет файлов по заданным параметрам
Зарегистрироваться
Или войти с помощью аккаунта в соцсети
Войти в профиль
Вспомнить пароль
Или войти с помощью аккаунта в соцсети
Химические свойства углерода.
Углерод ($C$) — первый элемент главной подгруппы IV группы Периодической системы. На его высшем энергетическом уровне $4$ электрона, поэтому его атомы могут принимать четыре электрона, приобретая степень окисления $–4$, т.е. проявлять окислительные свойства, и отдавать свои электроны, проявляя восстановительные свойства, приобретая степень окисления $+4$.
О свойствах аллотропных модификаций алмаза и графита мы уже говорили ранее. Химические свойства углерода и его соединений обобщены в таблице.
Углерод — это особый химический элемент. Он — основа многообразия органических соединений, из которых построены все живые организмы на планете.
Углерод и его соединения.
| Углерод | Соединения углерода | |
| Оксид углерода (IV) | Угольная кислота | |
| 1. Имеет аллотропные модификации: алмаз, графит, карбин, фуллерен. 2. Проявляет восстановительные свойства: а) горит в кислороде: $C+O_2=CO_2+Q$ неполное сгорание: $2C+O_2=2CO+Q;$ б) взаимодействует с оксидом углерода (IV), образуя ядовитое вещество — угарный газ: $C+CO_2=2CO;$ в) восстанавливает металлы из их оксидов: $C+2CuO=CO_2+2Cu$ Получение Неполное сжигание метана: $CH_4+O_2=C+2H_2O$ |
1. Газ без запаха, цвета и вкуса, тяжелее воздуха. 2. Кислотный оксид. 3. При растворении взаимодействует с водой: $CO_2+H_2O⇄H_2CO_3$ 4. Реагирует с основаниями (известковая вода при его пропускании мутнеет): $CO2+Ca(OH)_2=CaCO_3↓+H_2O$ 5. Реагирует с основными оксидами: $CO_2+CaO=CaCO_3$ 6. Образуется в реакциях: — горения углерода в кислороде: $C+O_2=CO_2$ — окисления оксида углерода (II): $2CO+O_2=2CO_2$ — сгорания метана: $CH_4+2O_2=CO_2+2H_2O$ — взаимодействия кислот с карбонатами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ — термического разложения карбонатов и гидрокарбонатов: $CaCO_3=CaO+CO_2↑$ $2NaHCO_3=Na_2CO_3+CO_2↑+H_2O$ — окислительных биохимических процессов дыхания, гниения |
1. Непрочная молекула. Слабая двухосновная кислота. Равновесие в водном растворе: $CO_2+H_2O⇄H_2CO_3⇄H^{+}+HCO_3^{−}⇄2H^{+}+CO_3^{2−}$ 2. Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием кислых (гидрокарбонатов) и средних (карбонатов) солей: $CO_2+NaOH=NaHCO_3$ $CO_2+2NaOH=Na_2CO_3+H_2O$ 3. Вытесняется из солей более сильными кислотами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ 4. Соли угольной кислоты подвергаются гидролизу: $2Na^{+}+CO_3^{2−}+H_2O⇄2Na^{+}+HCO_3^{−}+OH^{–}$ $CO_3^{2−}+H_2O⇄HCO_3^{−}+OH^–$ |
Химические свойства кремния.
Кремний ($Si$) — второй представитель главной подгруппы IV группы. По распространенности в природе кремний — второй после кислорода. Наиболее распространенными соединениями кремния являются диоксид кремния $SiO_2$ — кремнезем и силикаты.
Кристаллический кремний имеет структуру алмаза, очень хрупок, относится к тугоплавким веществам. При обычных условиях инертен, что объясняется прочностью его кристаллической решетки. В таблице обобщены химические свойства кремния и его соединений.
Соединения кремния служат основой производства стекла и цемента. Состав оконного стекла: $Na_2O·CaO·6SiO_2$.
Кремний и его соединения.
| Кремний | Соединения кремния | |
| Оксид кремния (IV) | Кремниевая кислота | |
| 1. Обладает полупроводниковыми свойствами. 2. Горит в кислороде: $Si+O_2=SiO_2+Q$ Получение — Восстановление оксида кремния (IV) углеродом (в промышленности): $SiO_2+2C=Si+2CO$ — порошком магния (в лаборатории): $SiO_2+2Mg=Si+2MgO$ |
1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла. 2. В воде не растворяется и с водой не реагирует. 3. Как кислотный оксид взаимодействует с: а) щелочами: $SiO_2+2NaOH=Na_2SiO_3+H_2O;$ б) основными оксидами: $SiO_2+CaO=CaSiO_3$ 4. Вытесняет из солей летучие кислоты (реакции, лежащие в основе варки стекла): $SiO_2+Na_2CO_3=Na_2SiO_3+CO_2↑$ $SiO_2+CaCO_3=CaSiO_3+CO_2↑$ |
1. Очень слабая двухосновная не растворимая в воде кислота состава $mSiO_2·nH_2O(H_2SiO_3)$ 2. Разлагается уже при несильном нагревании: $H_2SiO_3=SiO_2+H_2O$ 3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу: $4Na^{+}+2SiO_3^{2-}+2H_2O⇄4Na^{+}+Si_2O_5^{2−}+2OH^–$ $2SiO_3^{2-}+2H_2O⇄Si_2O_5^{2−}+2OH^–$ Получение Действие кислот на растворимые силикаты: $Na_2SiO_3+2HCl=2NaCl+H_2SiO_3↓$ |

















