Кодификатор ЕГЭ. Раздел 1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
Атомы элементов IА–IIIА групп имеют сходство в строении электронных оболочек и закономерностях изменения свойств, что приводит к некоторому сходству их химических свойств и свойств их соединений.
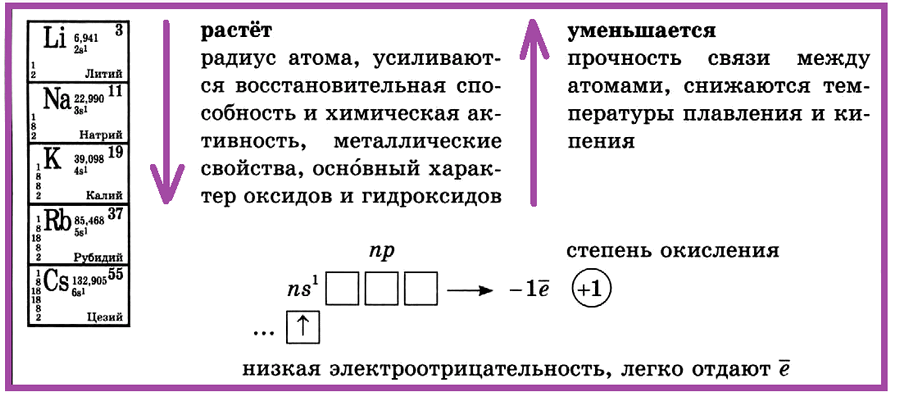
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы«. К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон:
… ns1 — электронное строение внешнего энергетического уровня щелочных металлов
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Рассмотрим характеристики элементов IA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность,
г/см3 |
| Литий | 6,941 | +3 | 0,98 | 0,152 | 520,2 | 180,6 | 0,534 |
| Натрий | 22,99 | +11 | 0,99 | 0,186 | 495,8 | 97,8 | 0,968 |
| Калий | 39,098 | +19 | 0,82 | 0,227 | 418,8 | 63,07 | 0,856 |
| Рубидий | 85,469 | +37 | 0,82 | 0,248 | 403,0 | 39,5 | 1,532 |
| Цезий | 132,905 | +55 | 0,79 | 0,265 | 375,7 | 28,4 | 1,90 |
Все щелочные металлы — сильные восстановители. Это самые активные металлы, которые могут непосредственно взаимодействовать с неметаллами. С ростом порядкового номера и уменьшением энергии ионизации металлические свойства элементов усиливаются. Щелочные металлы образуют с кислородом оксиды Э2О. Оксиды щелочных металлов реагируют с водой с образованием основания (щелочи):
Э2О + Н2О = 2ЭОН
Водородные соединения щелочных металлов — это гидриды с общей формулой ЭН. Степень окисления водорода в гидридах равна -1.
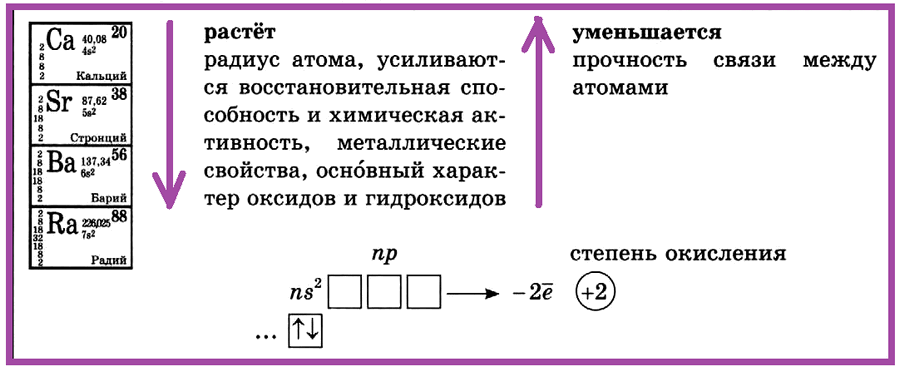
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне:
… ns2 — электронное строение внешнего энергетического уровня элементов IIA группы
Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
Характеристики элементов IIA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность,
г/см3 |
| Бериллий | 9,012 | +4 | 1,57 | 0,169 | 898,8 | 1278 | 1,848 |
| Магний | 24,305 | +12 | 1,31 | 0,245 | 737,3 | 650 | 1,737 |
| Кальций | 40,078 | +20 | 1,00 | 0,279 | 589,4 | 839 | 1,55 |
| Стронций | 87,62 | +38 | 0,95 | 0,304 | 549,0 | 769 | 2,54 |
| Барий | 137,327 | +56 | 0,89 | 0,251 | 502,5 | 729 | 3,5 |
Металлы подгруппы бериллия довольно активны. На воздухе они легко окисляются, образуя основные оксиды с общей формулой ЭО. Этим оксидам соответствуют гидроксиды Э(ОН)2.
Первый элемент IIA группы, бериллий, по большинству свойств гораздо ближе к алюминию (диагональное сходство). Это проявляется в свойствах бериллия. Например, он не взаимодействует с водой. Магний взаимодействует с водой только при нагревании. Кальций, стронций и барий — это типичные металлы. Они реагируют с водой при обычных условиях.
Элементам IIA группы соответствуют гидриды с общей формулой ЭН2.
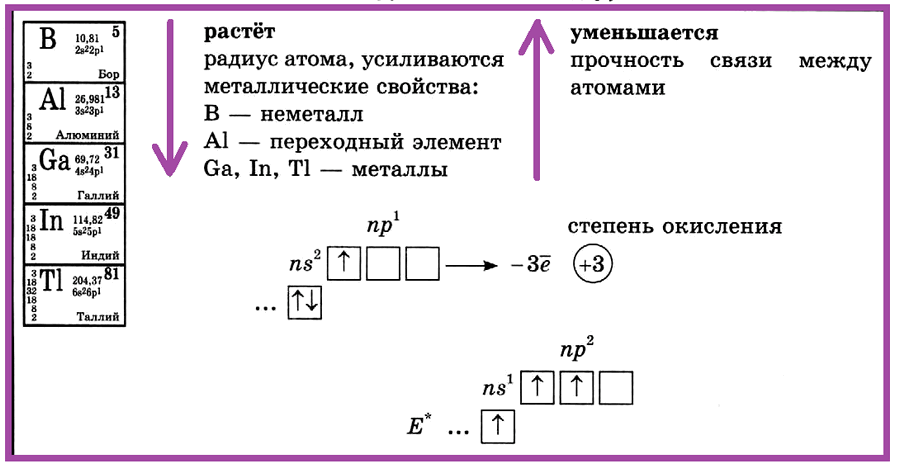
Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
… ns2nр1 — электронное строение внешнего энергетического уровня элементов IIIA группы
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Характеристики элементов IIIA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Радиус атома, нм | Энергия ионизации,
Э → Э3+, эВ |
Степень окисления в соединениях | Валентные электроны |
| Бор | 10,811 | +5 | 2,01 | 0,091 | 71,35 | +3, -3 | 2s22p1 |
| Алюминий | 26,982 | +13 | 1,47 | 0,143 | 53,20 | +3 | 3s23p1 |
| Галлий | 69,723 | +31 | 1,82 | 0,139 | 57,20 | +3 | 4s24p1 |
| Индий | 114,818 | +49 | 1,49 | 0,116 | 52,69 | +3 | 5s25p1 |
| Таллий | 204,383 | +81 | 1,44 | 0,171 | 56,31 | +1, +3 | 6s26p1 |
Металлические свойства у элементов подгруппы бора выражены слабее, чем у элементов IIA подгруппы. Элмент бор относится к неметаллам. Энергия ионизации атома у бора наибольшая среди элментов IIIA подгруппы. Алюминий относится к типичным металлам, но оксид и гидроксид алюминия проявляют амфотерные свойства. У таллия более сильно выражены металлические свойства, в степени окисления +1 он близок по свойствам к щелочным металлам. Наибольшее практическое значение среди элементов IIIA подгруппы имеет алюминий.
В общем металлы IА–IIIА подгрупп характеризуются:
- небольшим количеством электронов на внешнем энергетическом уровне:
- сравнительно сильными восстановительными свойствами;
- низкими значениями электроотрицательности;
- сравнительно большими атомными радиусами (относительно радиусов других атомов в периодах, в которых расположены соответствующие металлы);
- металлической кристаллической решеткой;
- высокой электро- и теплопроводностью;
- твердым фазовым состоянием при нормальных условиях.
- 23.03.2014
Публикуем теоретические и практические задания, которые необходимы при подготовке к ЕГЭ по химии.
Тема: Металлы главных подгрупп I–III групп
Весь материал соответствует кодификатору ЕГЭ по химии. В конце каждого теоретического блока публикуются практические задания с правильными ответами. Вы можете сразу же проверять качество пройденного материала.
Смотреть в PDF:
Или прямо сейчас: Скачайте в pdf файле.
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
(от лат. metallum – шахта, рудник): группа элементов, обладающая характерными металлическими свойствами.
Металлы — группа элементов, обладающая характерными металлическими свойствами.
Из 118 химических элементов — 99 элементов металлы.
Металлы имеют большой атомный радиус и малое число электронов (от 1 до 3) на внешнем слое.
Ge, Sn, Pb ─ 4 электрона;
Sb, Bi ─ 5 электронов;
Po ─ 6 электронов
Ме – одноатомны: K, Fe, Zn и т.д
ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ.
1. Металлическая кристаллическая решетка – наличие подвижных электронов
2.Металлический блеск (неметаллы йод и углерод в виде графита) Самые блестящие: алюминий, серебро, палладий и родий.
3. Твёрдое состояние (кроме ртути ).Обладают различной твёрдостью: щелочные металлы режутся ножом, а ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
4. Пластичность — возможность лёгкой механической обработки. Самыми пластичными являются золото, серебро и медь , германий и висмут непластичны.
5. Высокая теплопроводность и электропроводимость обусловлена наличием подвижных электронов. Серебро, медь и алюминий имеют наибольшую электропроводность.
5. Высокая плотность Металлы делят на: лёгкие (плотность 0,53 ÷ 5 г/см³) .Самый лёгкий литий (плотность 0.53 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самые тяжёлые металлы осмий и иридий (около 22.6 г/см³).
6. Температура плавления лежит в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам).
ОБЩАЯ ХАРАКТЕРИСТИКА ОТДЕЛЬНЫХ ГРУПП МЕТАЛЛОВ
МЕТАЛЛЫ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (А) (ЩЕЛОЧНЫЕ МЕТАЛЛЫ).
литий, натрий, калий, рубидий, цезий, франций
Мягкие металлы, легко режутся ножом. На срезе белого цвета с блеском, исчезающим на воздухе.
МЕТАЛЛЫ II ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (А)
Бериллий, магний и щелочноземельные металлы: кальций, стронций, барий и радий.
АЛЮМИНИЙ И ЭЛЕМЕНТЫ III-A ГРУППЫ
Алюминий — металл с переходными свойствами. На воздухе покрывается тонкой, химически инертной оксидной пленкой.Вор — неметалл с атомной кристаллической решеткой. Галий, индий, талий — типичные металлы.
ПЕРЕХОДНЫЕ МЕТАЛЛЫ 4 ПЕРИОДА.
Переходными называются все d-элементы. Являются металлами.
s-орбиталь внешней оболочки заполнена уже до заполнения внутренней d-орбитали.
Хорошие проводники электрического тока, особенно те, у которых имеется один внешний s-электрон (провал электрона): медь, серебро золото, хром, молибден и вольфрам.
ЦИНК
Цинк — элемент побочной подгруппы второй группы (А), четвёртого периода, не входит в число переходных элементов.
Хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Минералы цинка — сфалерит, или цинковая обманка ZnS (разнообразные примеси придают всевозможные цвета) .
МЕДЬ
Медь -тяжелый розово-красный металл, мягкий и ковкий. Хороший проводит тепло и электрический ток.
В чистом виде в природе встречается чаще, чем самородки золота или серебра. Но в основном медь добывают из медных руд – природных минеральных образований. Больше всего меди содержится в сульфидных рудах: халькозин (79% меди), борнит (до 65%), халькопирит, или медный колчедан ( около 35%).
ХРОМ
Блестящий, сероватого цвета d-элемент. Валентные электроны хрома имеют следующую конфигурацию: 3d⁵4s¹.(ПРОВАЛ ЭЛЕКТРОНА!)
На воздухе покрыт прочной пленкой оксида.
Хром (с примесями) — один из самых твердых металлов, легко царапает стекло, уступая лишь вольфраму. Очень чистый хром достаточно хорошо поддаётся механической обработке.
Электро – теплопроводность небольшая.
МАРГАНЕЦ
Серебристо-белый, тугоплавкий металл.
ЖЕЛЕЗО
Серебристо-белый металл, быстро ржавеющий на воздухе. Железо пластично, легко подвергается ковке и прокатке, температура плавления 1539°С. Обладает сильными магнитными свойствами (ферромагнетик) , хорошей тепло- и электропроводностью.
Закономерности изменения химических свойств элементов и их соединений по периодам и группам
Перечислим закономерности изменения свойств, проявляемые в пределах периодов:
— металлические свойства уменьшаются;
— неметаллические свойства усиливаются;
— степень окисления элементов в высших оксидах возрастает от $+1$ до $+7$ ($+8$ для $Os$ и $Ru$);
— степень окисления элементов в летучих водородных соединениях возрастает от $–4$ до $–1$;
— оксиды от основных через амфотерные сменяются кислотными оксидами;
— гидроксиды от щелочей через амфотерные сменяются кислотами.
Д. И. Менделеев в $1869$ г. сделал вывод — сформулировал Периодический закон, который звучит так:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.
Систематизируя химические элементы на основе их относительных атомных масс, Менделеев уделял большое внимание также свойствам элементов и образуемых ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы — группы.
Иногда, в нарушение выявленной им закономерности, Менделеев ставил более тяжелые элементы с меньшими значениями относительных атомных масс. Например, он записал в свою таблицу кобальт перед никелем, теллур перед йодом, а когда были открыты инертные (благородные) газы, — аргон перед калием. Такой порядок расположения Менделеев считал необходимым потому, что иначе эти элементы попали бы в группы несходных с ними по свойствам элементов, в частности щелочной металл калий попал бы в группу инертных газов, а инертный газ аргон — в группу щелочных металлов.
Д. И. Менделеев не мог объяснить эти исключения из общего правила, не мог объяснить и причину причину периодичности свойств элементов и образованных ими веществ. Однако он предвидел, что эта причина кроется в сложном строении атома, внутреннее строение которого в то время не было изучено.
В соответствии с современными представлениями о строении атома, основой классификации химических элементов являются заряды их атомных ядер, и современная формулировка периодического закона такова:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Периодичность в изменении свойств элементов объясняется периодической повторяемостью в строении внешних энергетических уровней их атомов. Именно число энергетических уровней, общее число расположенных на них электронов и число электронов на внешнем уровне отражают принятую в Периодической системе символику, т.е. раскрывают физический смысл номера периода, номера группы и порядкового номера элемента.
Строение атома позволяет объяснить и причины изменения металлических и неметаллических свойств элементов в периодах и группах.
Периодический закон и Периодическая система химических элементов Д. И. Менделеева обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы. Эти два важнейших значения Периодического закона и Периодической системы дополняет еще одно, которое заключается в возможности прогнозировать, т.е. предсказывать, описывать свойства и указывать пути открытия новых химических элементов.
Общая характеристика металлов главных подгрупп I±III групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Химические элементы — металлы
Большинство химических элементов относят к металлам — $92$ из $114$ известных элементов.
Все металлы, кроме ртути, в обычном состоянии — твердые вещества и имеют ряд общих свойств.
Металлы — это ковкие, пластичные, тягучие вещества, имеющие металлический блеск и способны проводить тепло и электрический ток.
Атомы элементов-металлов отдают электроны внешнего (а некоторые и предвнешнего) электронного слоя, превращаясь в положительные ионы.
Это свойство атомов металлов, как вы знаете, определяется тем, что они имеют сравнительно большие радиусы и малое число электронов (в основном от $1$ до $3$ на внешнем слое).
Исключение составляют лишь $6$ металлов: атомы германия, олова, свинца на внешнем слое имеют $4$ электрона, атомы сурьмы и висмута — $5$, атомы полония — $6$.
Для атомов металлов характерны небольшие значения электроотрицательности (от $0.7$ до $1.9$) и исключительно восстановительные свойства, т.е. способность отдавать электроны.
Вы уже знаете, что в Периодической системе химических элементов Д. И. Менделеева металлы находятся ниже диагонали бор — астат, а также выше ее, в побочных подгруппах. В периодах и главных подгруппах действуют известные вам закономерности в изменении металлических, а значит, восстановительных свойств атомов элементов.
Химические элементы, расположенные вблизи диагонали бор — астат ($Be, Al, Ti, Ge, Nb, Sb$), обладают двойственными свойствами: в одних своих соединениях ведут себя как металлы, в других проявляют свойства неметаллов.
В побочных подгруппах восстановительные свойства металлов с увеличением порядкового номера чаще всего уменьшаются.
Это можно объяснить тем, что на прочность связи валентных электронов с ядром у атомов этих металлов в большей степени влияет величина заряда ядра, а не радиус атома. Величина заряда ядра значительно увеличивается, притяжение электронов к ядру усиливается. Радиус атома при этом хотя и увеличивается, но не столь значительно, как у металлов главных подгрупп.
Простые вещества, образованные химическими элементами — металлами, и сложные металлосодержащие вещества играют важнейшую роль в минеральной и органической «жизни» Земли. Достаточно вспомнить, что атомы (ионы) элементов металлов являются составной частью соединений, определяющих обмен веществ в организме человека, животных. Например, в крови человека найдено $76$ элементов, из них только $14$ не являются металлами. В организме человека некоторые элементы- металлы (кальций, калий, натрий, магний) присутствуют в большом количестве, т.е. являются макроэлементами. А такие металлы, как хром, марганец, железо, кобальт, медь, цинк, молибден присутствуют в небольших количествах, т.е. это микроэлементы.
Особенности строения металлов главных подгрупп I–III групп.
Щелочные металлы — это металлы главной подгруппы I группы. Их атомы на внешнем энергетическом уровне имеют по одному электрону. Щелочные металлы — сильные восстановители. Их восстановительная способность и химическая активность возрастают с увеличением порядкового номера элемента (т.е. сверху вниз в Периодической таблице). Все они обладают электронной проводимостью. Прочность связи между атомами щелочных металлов уменьшается с увеличением порядкового номера элемента. Также снижаются их температуры плавления и кипения. Щелочные металлы взаимодействуют со многими простыми веществами — окислителями. В реакциях с водой они образуют растворимые в воде основания (щелочи).
Щелочноземельными элементами называются элементы главной подгруппы II группы. Атомы этих элементов содержат на внешнем энергетическом уровне по два электрона. Они являются восстановителями, имеют степень окисления $+2$. В этой главной подгруппе соблюдаются общие закономерности в изменении физических и химических свойств, связанные с увеличением размера атомов по группе сверху вниз, также ослабевает и химическая связь между атомами. С увеличением размера иона ослабевают кислотные и усиливаются основные свойства оксидов и гидроксидов.
Главную подгруппу III группы составляют элементы бор, алюминий, галлий, индий и таллий. Все элементы относятся к $p$-элементам. На внешнем энергетическом уровне они имеют по три $(s^2p^1)$ электрона, чем объясняется сходство свойств. Степень окисления $+3$. Внутри группы с увеличением заряда ядра металлические свойства увеличиваются. Бор — элемент-неметалл, а у алюминия уже металлические свойства. Все элементы образуют оксиды и гидроксиды.
Характеристика переходных элементов ± меди, цинка, хрома, железа по их положению в Периодической системе химических элементов Д. И. Менделеева и особенностям строения их атомов
Большинство элементов-металлов находится в побочных группах Периодической системы.
В четвертом периоде у атомов калия и кальция появляется четвертый электронный слой, заполняется $4s$-подуровень, так как он имеет меньшую энергию, чем $3d$-подуровень. $K, Ca — s$-элементы, входящие в главные подгруппы. У атомов от $Sc$ до $Zn$ заполняется электронами $3d$-подуровень.
Рассмотрим, какие силы действуют на электрон, который добавляется в атом при возрастании заряда ядра. С одной стороны, притяжение атомным ядром, что заставляет электрон занимать самый нижний свободный энергетический уровень. С другой стороны, отталкивание уже имеющимися электронами. Когда на энергетическом уровне оказывается $8$ электронов (заняты $s-$ и $р-$орбитали), их общее отталкивающее действие так сильно, что следующий электрон попадает вместо расположенной по энергии ниже $d-$орбитали на более высокую $s-$орбиталь следующего уровня. Электронное строение внешних энергетических уровней у калия $…3d^{0}4s^1$, у кальция — $…3d^{0}4s^2$.
Последующее прибавление еще одного электрона у скандия приводит к началу заполнения $3d$-орбитали вместо еще более высоких по энергии $4р$-орбиталей. Это оказывается энергетически выгоднее. Заполнение $3d$-орбитали заканчивается у цинка, имеющего электронное строение $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{10}4s^2$. Следует отметить, что у элементов меди и хрома наблюдается явление «провала » электрона. У атома меди десятый $d$-электрон перемещается на третий $3d$-подуровень.
Электронная формула меди $…3d^{10}4s^1$. У атома хрома на четвертом энергетическом уровне ($s$-орбиталь) должно быть $2$ электрона. Однако один из двух электронов переходит на третий энергетический уровень, на незаполненную $d$-орбиталь, его электронная формула $…3d^{5}4s^1$.
Таким образом, в отличие от элементов главных подгрупп, где происходит постепенное заполнение электронами атомных орбиталей внешнего уровня, у элементов побочных подгрупп заполняются $d$-орбитали предпоследнего энергетического уровня. Отсюда и название: $d$-элементы.
Все простые вещества, образованные элементами подгрупп Периодической системы, являются металлами. Благодаря большему числу атомных орбиталей, чем у элементов-металлов главных подгрупп, атомы $d$-элементов образуют большое число химических связей между собой и потому создают более прочную кристаллическую решетку. Она прочнее и механически, и по отношению к нагреванию. Поэтому металлы побочных подгрупп — самые прочные и тугоплавкие среди всех металлов.
Известно, если атом имеет более трех валентных электронов, то элемент проявляет переменную валентность. Это положение относится к большинству $d$-элементов. Максимальная их валентность, как у элементов главных подгрупп, равна номеру группы (хотя есть и исключения). Элементы с равным числом валентных электронов входят в группу под одним номером $(Fe, Co, Ni)$.
У $d$-элементов изменение свойств их оксидов и гидроксидов в пределах одного периода при движении слева направо, т.е. с увеличением их валентности, происходит от основных свойств через амфотерные к кислотным. Например, хром имеет валентности $+2, +3, +6$; а его оксиды: $CrO$ — основной, $Cr_{2}O_3$ — амфотерный, $CrO_3$ — кислотный.
Общая характеристика неметаллов главных подгрупп IV±VII групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Химические элементы – неметаллы
Самой первой научной классификацией химических элементов было деление их на металлы и неметаллы. Эта классификация не утратила своей значимости и в настоящее время.
Неметаллы — это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Это определение оставляет в стороне элементы VIII группы главной подгруппы — инертные, или благородные, газы, атомы которых имеют завершенный внешний электронный слой. Электронная конфигурация атомов этих элементов такова, что их нельзя отнести ни к металлам, ни к неметаллам. Они являются теми объектами, которые разделяют элементы на металлы и неметаллы, занимая между ними пограничное положение. Инертные, или благородные, газы («благородство» выражается в инертности) иногда относят к неметаллам, но формально, по физическим признакам. Эти вещества сохраняют газообразное состояние вплоть до очень низких температур. Так, гелий Не переходит в жидкое состояние при $t°= –268,9 °С$.
Инертность в химическом отношении у этих элементов относительна. Для ксенона и криптона известны соединения с фтором и кислородом: $KrF_2, XeF_2, XeF_4$ и др. Несомненно, в образовании этих соединений инертные газы выступали в роли восстановителей.
Из определения неметаллов следует, что для их атомов характерны высокие значения электроотрицательности. Она изменяется в пределах от $2$ до $4$. Неметаллы — это элементы главных подгрупп, преимущественно $р$-элементы, исключение составляет водород — s-элемент.
Все элементы-неметаллы (кроме водорода) занимают в Периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор $F$, а основанием — диагональ $B — At$.
Однако следует особо остановиться на двойственном положении водорода в Периодической системе: в главных подгруппах I и VII групп. Это не случайно. С одной стороны, атом водорода, подобно атомам щелочных металлов, имеет на внешнем (и единственном для него) электронном слое один электрон (электронная конфигурация $1s^1$), который он способен отдавать, проявляя свойства восстановителя.
В большинстве своих соединений водород, как и щелочные металлы, проявляет степень окисления $+1$. Но отдача электрона атомом водорода происходит труднее, чем у атомов щелочных металлов. С другой стороны, атому водорода, как и атомам галогенов, до завершения внешнего электронного слоя недостает одного электрона, поэтому атом водорода может принимать один электрон, проявляя свойства окислителя и характерную для галогена степень окисления — $1$ в гидридах (соединениях с металлами, подобных соединениям металлов с галогенами — галогенидам). Но присоединение одного электрона к атому водорода происходит труднее, чем у галогенов.
Свойства атомов элементов – неметаллов
У атомов неметаллов преобладают окислительные свойства, т.е. способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах.
Фтор — самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, т.е. проявлять восстановительные свойства.
Конфигурация внешнего электронного слоя.
| В периоде: — заряд ядра увеличивается; — радиус атома уменьшается; — число электронов на внешнем слое увеличивается; — электроотрицательность увеличивается; — окислительные свойства усиливаются; — неметаллические свойства усиливаются. |
В главной подгруппе: — заряд ядра увеличивается; — радиус атома увеличивается; — число электронов на внешнем слое не изменяется; — электроотрицательность уменьшается; — окислительные свойства ослабевают; — неметаллические свойства ослабевают. |
Другие неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами; в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.
Химических элементов-неметаллов всего $16$! Совсем немного, если учесть, что известно $114$ элементов. Два элемента-неметалла составляют $76%$ массы земной коры. Это кислород ($49%$) и кремний ($27%$). В атмосфере содержится $0.03%$ массы кислорода в земной коре. Неметаллы составляют $98.5%$ массы растений, $97.6%$ массы тела человека. Неметаллы $C, H, O, N, S, Р$ — органогены, которые образуют важнейшие органические вещества живой клетки: белки, жиры, углеводы, нуклеиновые кислоты. В состав воздуха, которым мы дышим, входят простые и сложные вещества, также образованные элементами-неметаллами (кислород $О_2$, азот $N_2$, углекислый газ $СО_2$, водяные пары $Н_2О$ и др.).
Водород — главный элемент Вселенной. Многие космические объекты (газовые облака, звезды, в том числе и Солнце) более чем наполовину состоят из водорода. На Земле его, включая атмосферу, гидросферу и литосферу, только $0.88%$. Но это по массе, а атомная масса водорода очень мала. Поэтому небольшое содержание его только кажущееся, и из каждых $100$ атомов на Земле $17$ — атомы водорода.
Общая характеристика некоторых элементов
в связи с их положением в Периодической системе
Элемент ЕГЭ: 1.2.2. Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. 1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа)… 1.2.4. Общая характеристика неметаллов IVA-VIIA групп…
1.2.2. Общая характеристика металлов IA-IIIA групп …
Все элементы IА–IIIА-групп Периодической системы относят к металлам (кроме бора). На внешнем энергетическом уровне эти элементы имеют не более трех электронов, что соответствует номеру группы, в которой они расположены.
Металлы IA-группы называют щелочными, так как при взаимодействии с водой они образуют щелочи. Металлы IIА-группы, за исключением бериллия и магния, называют щелочноземельными.
I группа, главная подгруппа —
щелочные металлы (литий, натрий, калий, рубидий, цезий).
I группа, главная подгруппа — щелочные металлы: литий, натрий, калий, рубидий, цезий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются восстановительная способность и химическая активность, металлические свойства, основный характер оксидов и гидроксидов.
II группа, главная подгруппа —
щёлочноземельные металлы (кальций, стронций, барий, радий)
II группа, главная подгруппа — щёлочноземельные металлы: кальций, стронций, барий, радий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются восстановительная способность и химическая активность, металлические свойства, оснОвный характер оксидов и гидроксидов.
Элементы III группы главной подгруппы
(бор, алюминий, галлий, индий, таллий)
Элементы III группы главной подгруппы: бор, алюминий, галлий, индий, таллий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются металлические свойства. В — неметалл, Аl — переходный элемент, Ga, In, Тl — металлы.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) …
Понятие переходный элемент относится к d-элементам, занимающим переходное положение между s- и p-элементами. Они расположены в побочных подгруппах (группах IБ-VIIIБ). Все d-элементы являются металлами, валентные электроны которых расположены на ns- и (n–1)d-подуровнях, т.е. они имеют электронную конфигурацию: (n–1)d1–10ns1–2.
Общая характеристика переходных элементов (меди, цинка, хрома, железа):
- Находятся в побочных подгруппах периодической системы.
- Валентные электроны расположены на внешних уровнях (s-электроны) и на предвнешних уровнях (d-электроны).
- Элементы — металлы.
- Для элементов, за исключением цинка, характерны переменные степени окисления.
- Соединения проявляют различные кислотно-основные свойства.
- С возрастанием степени окисления элемента в оксиде и гидроксиде кислотные свойства последних усиливаются.
Медь — I группа побочной подгруппы
Цинк — II группа побочной подгруппы
Хром — VI группа побочной подгруппы
Железо — VIII группа побочной подгруппы
1.2.4. Общая характеристика неметаллов IVA-VIIA групп …
Неметаллы занимают главные подгруппы IV–VIII-групп (или группы с IVA по VIIIA). Атомы неметаллов на внешнем энергетическом уровне могут содержать от 4 до 8 электронов. Исключение составляют: водород — 1 электрон, гелий — 2 электрона, бор — 3 электрона. У атомов неметаллов, как правило, происходит заполнение р-подуровня.
Элементы VIIA-группы носят название галогены, а элементы VIA-группы — халькогены.
Элементы IV группы главной подгруппы
(углерод, кремний, германий, олово, свинец)
Элементы IV группы главной подгруппы: углерод, кремний, германий, олово, свинец. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются, металлические и восстановительные свойства. С, Si, Ge, Sn — переходные элементы, Pb — металл.
Элементы V группы главной подгруппы
(азот, фосфор, мышьяк, сурьма, висмут)
Элементы V группы главной подгруппы: азот, фосфор, мышьяк, сурьма, висмут. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются металлические и восстановительные свойства. У азота также возможны степени окисления +1; +2; +4.
Элементы VI группы главной подгруппы
(кислород, сера, селен, теллур, полоний)
Элементы VI группы главной подгруппы: кислород, сера, селен, теллур, полоний. С уменьшением порядкового номера в ПСХЭ усиливаются: неметаллические свойства, электроотрицательность, устойчивость соединений с водородом.
Элементы VII группы главной подгруппы —
галогены (фтор, хлор, бром, йод, астат)
Элементы VII группы главной подгруппы — галогены: фтор, хлор, бром, йод, астат. С уменьшением порядкового номера в ПСХЭ усиливаются: неметаллические свойства, электроотрицательность, устойчивость соединений с водородом.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «Общая характеристика некоторых элементов». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
- Конспект урока в 9 классе «»
- Конспект урока в 11 классе «»
Теоретические основы при подготовке к ЕГЭ
| Ċ | Просмотр | Металлы главных подгрупп и их соединения |
3 июн. 2018 г., 12:26 |
Анжела Никитина | |||
| Ċ | Просмотр | 3 июн. 2018 г., 15:52 | Анжела Никитина | ||||
| Ċ | Просмотр | Оксиды | 3 июн. 2018 г., 12:26 | Анжела Никитина | |||
| Ċ | Просмотр | Металлы побочных подгрупп и их соединения |
3 июн. 2018 г., 12:26 | Анжела Никитина | |||
| Ċ | Просмотр | Основания | 3 июн. 2018 г., 12:27 | Анжела Никитина | |||
| Ċ | Просмотр | Типы органических реакций | 4 июн. 2018 г., 00:46 | Анжела Никитина | |||
| Ċ | Просмотр | Кислоты | 3 июн. 2018 г., 12:27 | Анжела Никитина | |||
| Ċ | Просмотр | 3 июн. 2018 г., 15:52 | Анжела Никитина | ||||
| Ċ | Просмотр | Лантаноиды (IIIB-группа, VI период) и их соединения |
3 июн. 2018 г., 12:27 | Анжела Никитина | |||
| Ċ | Просмотр | Актиноиды (IIIB-группа, VII период) и их соединения |
3 июн. 2018 г., 12:28 | Анжела Никитина | |||
| Ċ | Просмотр | 3 июн. 2018 г., 15:52 | Анжела Никитина | ||||
| Ċ | Просмотр | СОЛИ | 3 июн. 2018 г., 12:28 | Анжела Никитина | |||
| Ċ | Просмотр | 3 июн. 2018 г., 15:52 | Анжела Никитина | ||||
| Ċ | Просмотр | 3 июн. 2018 г., 15:52 | Анжела Никитина | ||||
| Ċ | Просмотр | 3 июн. 2018 г., 15:52 | Анжела Никитина | ||||
| Ċ | Просмотр | 3 июн. 2018 г., 15:52 | Анжела Никитина | ||||
|
ċ |
Просмотр | Окраска окислительного пламени | 3 июн. 2018 г., 15:22 | Анжела Никитина | |||
| Ċ | Просмотр | Названия некоторых органических веществ. УГЛЕВОДОРОДЫ | 3 июн. 2018 г., 12:28 | Анжела Никитина | |||
| Ċ | Просмотр | Информативные шпаргалки | 3 июн. 2018 г., 15:32 | Анжела Никитина | |||
| Ċ | Просмотр | Информативные шпаргалки | 3 июн. 2018 г., 15:32 | Анжела Никитина | |||
| Ċ | Просмотр | Информативные шпаргалки | 3 июн. 2018 г., 15:32 | Анжела Никитина | |||
| Ċ | Просмотр | Информативные шпаргалки | 3 июн. 2018 г., 15:32 | Анжела Никитина | |||
| Ċ | Просмотр | 32. Качественные реакции на неорганические вещества и ионы. Идентификация орган.в-в | 3 июн. 2018 г., 12:29 | Анжела Никитина | |||
| Ċ | Просмотр | Схема взаимного превращения углеводородов | 3 июн. 2018 г., 12:30 | Анжела Никитина | |||
| Ċ | Просмотр | Реагенты | 3 июн. 2018 г., 12:31 | Анжела Никитина | |||
| Ċ | Просмотр | Генетическая связь | 3 июн. 2018 г., 12:31 | Анжела Никитина |

![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)