Образовательный портал для подготовки к экзаменам
Химия
Сайты, меню, вход, новости
Задания
Версия для печати и копирования в MS Word
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
A) аммиак
Б) метан
В) изопрен
Г) этилен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение капрона
2) в качестве топлива
3) получение каучука
4) производство удобрений
5) получение пластмасс
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
Установим соответствие.
A) Аммиак широко используется как исходное азотсодержащее вещество в производстве удобрений (4).
Б) Одно из основных применений метана — в качестве топлива (2).
В) Изопрен — исходный мономер при получении каучука (3).
Г) Этилен может использоваться для различных целей, но из представленных вариантов наиболее подходящий — получение пластмасс (5).
Ответ: 4235.
Источник: Демонстрационная версия ЕГЭ—2017 по химии
Задание № 22564
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) азот
Б) метан
В) изопрен
Г) пропилен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение капрона
2) в качестве топлива
3) получение каучука
4) получение аммиака
5) получение полимеров
[topic]
[topic]
Показать ответ
Комментарий:
1) С помощью азота получают аммиак.
Б) Метан используют в качестве топлива.
В) Изопрен необходим для получения каучука.
Г) С помощью пропилена получают различные полимеры.
Ответ: 4235
Нашли ошибку в задании? Выделите фрагмент и нажмите Ctrl + Enter.
Применение веществ в быту и промышленности. ЕГЭ по химии.
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония |
Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат |
Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия |
Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH |
Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) |
Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |
- Дисциплина: Химия
- Номер вопроса в билете: 26
- Баллы: 1
- Сложность: Базовый
-
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
-
ВЕЩЕСТВО
- А)метан
- Б)нитрат аммония
- В)гидрофосфат кальция
-
ОБЛАСТЬ ПРИМЕНЕНИЯ
- 1)удобрение
- 2)топливо для газовых плит
- 3)получение каучука
- 4)растворитель
Баллы: 0 из 1
- Подробное решение
-
метан — CH4 топливо для газовых плит (метан основной компонент природного газа 70-98%)
нитрат аммония — NH4NO3 азотное удобрение
гидрофосфат кальция CaHPO4 — фосфорное удобрение
Содержание
- 1 Общее понятие о строении метана
- 1.1 Электроны в атоме углерода
- 1.2 Молекула метана
- 2 Физические свойства
- 3 Химические свойства
- 4 Метан в природе
- 5 Получение метана
- 6 Области применения
- 6.1 Топливо
- 6.2 Металлообработка
- 6.3 Бытовое применение метана
- 6.4 Метан как химическое сырье
- 7 Вред и польза метана
Метан, которым открывается гомологический ряд насыщенных (предельных) углеводородов – алканов – представляет собой наиболее простое органическое вещество. Химические свойства, проявляемые метаном, присущи всем соединениям алканового ряда. Поэтому изучение алканов начинают с рассмотрения структуры молекулы этого вещества и его поведения в химических взаимодействиях.
Общее понятие о строении метана
Определяющая метан формула имеет вид , то есть молекула его образована одним атомом углерода с валентностью IV и четырьмя водородными атомами. На понимании того, как строится эта молекула, основано дальнейшее изучение всех органических соединений.
Электроны в атоме углерода
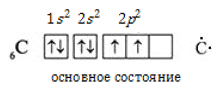
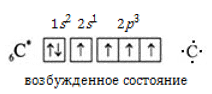
В основном состоянии углерод характеризуется конфигурацией электронного облака и валентностью II, поскольку обладает лишь двумя неспаренными внешними электронами:
При сообщении некоторой энергии происходит возбуждение атома, 2s2-электроны распариваются и один из них занимает вакантную орбиталь на 2p-подуровне. В результате атом получает четыре неспаренных электрона и валентность IV:
Углерод во всех органических соединениях четырехвалентен.
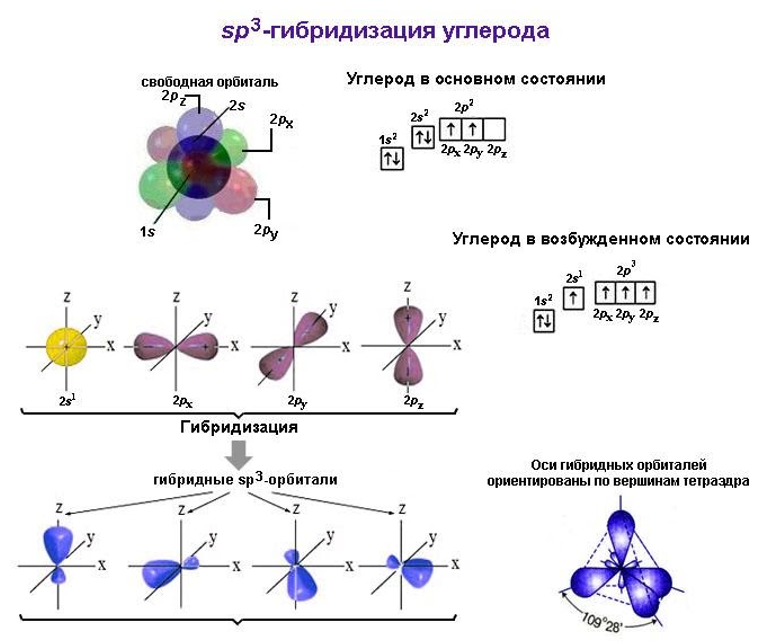
Подуровни 2s и 2p стремятся к выравниванию энергий своих электронов, что ведет к перераспределению электронных плотностей их облаков и к изменению их формы. Образуются гибридные 2sp-облака (орбитали). Их количество зависит от того, сколько орбиталей участвует в гибридизации.
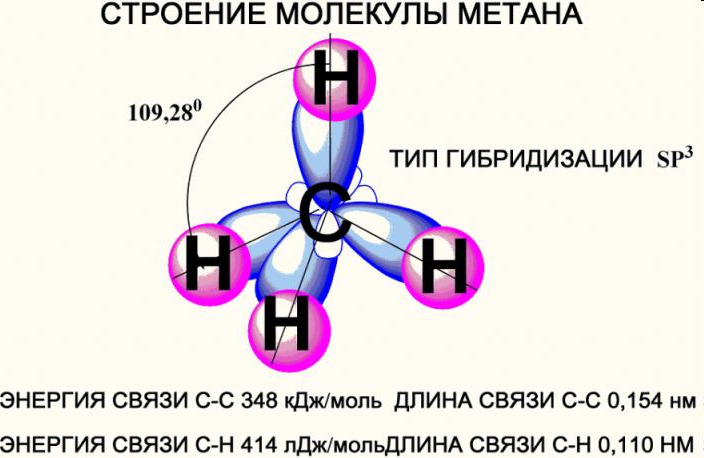
Если в нее вступают наряду с 2s все три 2p-орбитали, говорят о гибридизации типа sp3. В этом случае образуются четыре одинаковых гибридных электронных облака. Оси их вследствие взаимного отталкивания располагаются в пространстве таким образом, что атом приобретает форму тетраэдра. Молекулы метана и прочих алканов образованы только sp3-гибридизованным углеродом.
Молекула метана
Углеродный атом в sp3-гибридизованном состоянии вступает в четыре равноправных ковалентных простых σ-связи с водородом. Каждая из них формируется путем перекрывания одной из четырех углеродных 2sp3-орбиталей с 1s1-орбиталью водорода по линии, проходящей через ядра атомов. Ориентация σ-связей соответствует осям гибридных орбиталей, поэтому молекула имеет тетраэдрическую форму.
Строение молекулы удобно отображать с помощью структурной и электронной формул:
В молекулах метана и его гомологов углерод связывается с наибольшим возможным числом атомов водорода, поэтому углеводороды ряда алканов называют предельными.
Физические свойства
Метан в стандартных условиях (атмосферное давление и температура 0°C) представляет собой газ без цвета и запаха плотностью (легче воздуха). Основные свойства приведены в таблице.
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 0,6682 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 0,7168 |
| Плотность (при -164,6 °C и атмосферном давлении 1 атм.), кг/м3 | 415 |
| Температура плавления, °C | -182,49 |
| Температура кипения, °C | -161,58 |
| Температура самовоспламенения, °C | 537,8 |
| Критическая температура*, °C | -82,4 |
| Критическое давление, МПа | 4,58 |
| Критический удельный объём, м3/кг | 0,0062 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 4,4 до 17,0 |
| Удельная теплота сгорания, МДж/кг | 50,1 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0302 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0361 |
| Молярная масса, г/моль | 16,04 |
| Растворимость в воде, г/кг | 0,02 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства
Так как углерод в метане задействует все свободные валентности и молекула максимально насыщена атомами водорода, метан характеризуется слабой химической активностью. В стандартных условиях он не вступает во взаимодействие с щелочами, сильными кислотами, галогенами (за исключением фтора) и щелочными металлами.
Метан участвует в нескольких типах реакций, которые всегда протекают с разрушением углерод-водородных связей .
- Свободно-радикальное замещение:
- Окисление:
- Разложение метана. Наиболее распространенным методом разложения является крекинг, широко используемый в нефтепереработке:
В процессе крекинга происходит разрушение тройной связи в молекуле ацетилена, и среди конечных продуктов реакции присутствуют различные углеводороды.
Метан в природе
В естественных условиях метан имеет несколько источников:
- природный газ и попутные нефтяные газы, в составе которых метан является главным компонентом;
- рудничный газ, поступающий из угольных пластов и образующий с воздухом взрывоопасную смесь;
- вулканические газы;
- продукты обмена веществ некоторых анаэробных микроорганизмов, перерабатывающих клетчатку и обитающих в болотах, стоячих водоемах, в пищеварительном тракте жвачных животных.
Метан способен в больших количествах накапливаться в газогидратной форме в многолетней мерзлоте и на океанском дне. В составе метангидрата молекула внедряется в полости внутри кристаллической решетки водяного льда. Соединения с такой структурой называют клатратами. При таянии льда газ высвобождается и поступает в атмосферу.
За пределами Земли метан в большом количестве обнаружен на спутнике Сатурна Титане, в атмосферах планет-гигантов и Марса.
Получение метана
В промышленности метан, как правило, не синтезируют искусственно, а выделяют при переработке нефти, нефтепродуктов, очистке природного газа, коксовании каменного угля. В этих процессах метан является продуктом следующих реакций:
Лабораторный синтез метана проводится двумя основными способами:
Области применения
Сфера использования метана включает различные отрасли. Он применяется и как конечный продукт, и в качестве сырья для производства других веществ.
Топливо
Наиболее широко газ используется как дешевый горючий материал в таких областях, как:
- автомобильный транспорт;
- некоторые системы ракетных двигателей (жидкий очищенный метан);
- электроэнергетика (топливо для газовых турбин).
Металлообработка
При горении метана в кислороде развивается температура от 2400 до 2700 °C, поэтому он пригоден для сварки и пайки легкоплавких металлов и сплавов – чугуна, меди, латуни, алюминия. Также он используется как заменитель ацетилена и пропан-бутановой смеси при кислородной резке металлов.
Бытовое применение метана
Во многих регионах метан широко применяется в отопительных системах. Городские сети снабжают значительную часть населения природным газом для кухонных плит.
Метан как химическое сырье
Большую роль метан играет в качестве реагента в процессах синтеза соединений, используемых в разных областях:
- топливная промышленность (получение синтетического бензина);
- производство органических красителей и растворителей;
- производство ацетилена;
- медицина и биология (получение формальдегида – консерванта для биоматериалов).
Читайте также:
Применение алканов
Применение алкенов
Вред и польза метана
Вследствие малой растворимости и слабой химической активности метан нетоксичен, однако длительное пребывание в среде с повышенной концентрацией газа негативно отражается на нервной системе. Если содержание его в воздухе превышает 25%, человек может пострадать от кислородного голодания.
Как сильный парниковый газ, метан оказывает влияние на климат. Несмотря на малую концентрацию в атмосфере, по вкладу в парниковый эффект он занимает третье место после водяного пара и углекислого газа. Парниковое действие метана приблизительно в 25 раз превышает эффект, оказываемый тем же молярным объемом углекислого газа.
Метан обладает полезными свойствами. При полном сгорании он не образует твердых продуктов, загрязняющих внутренние части оборудования и окружающую среду. В сочетании с дешевизной это качество расширяет перспективы использования метана как экономичного и чистого топлива.