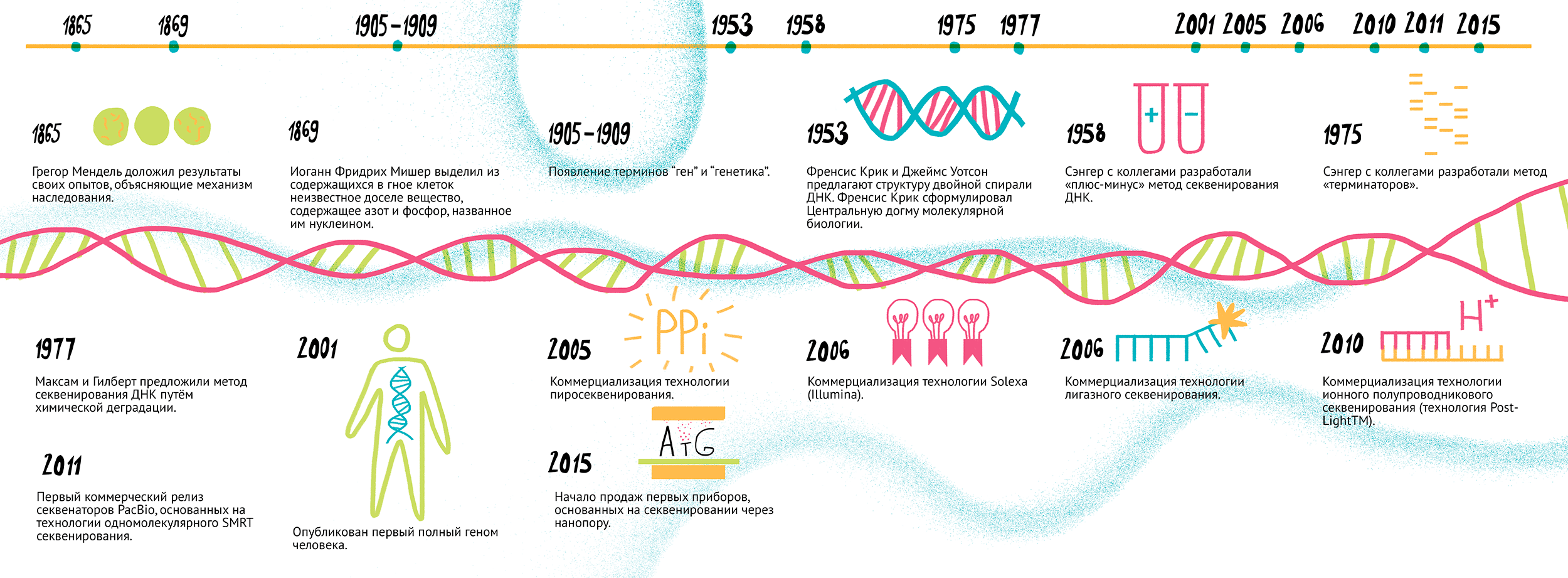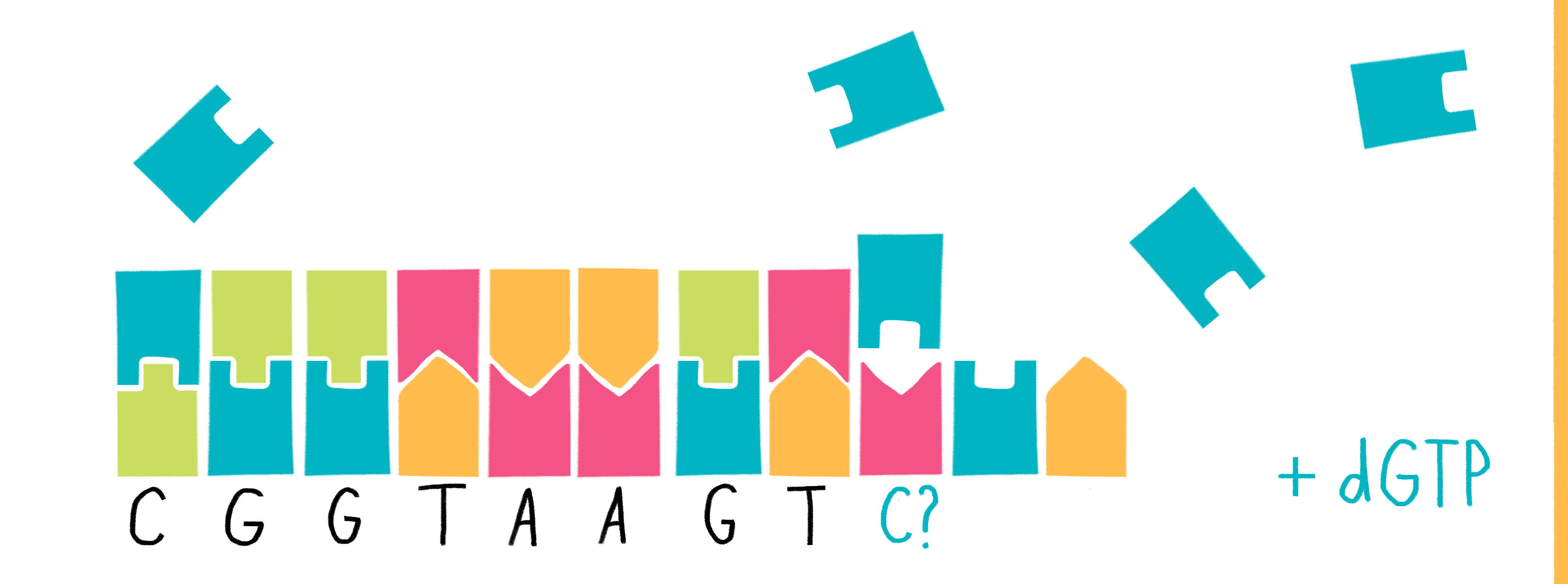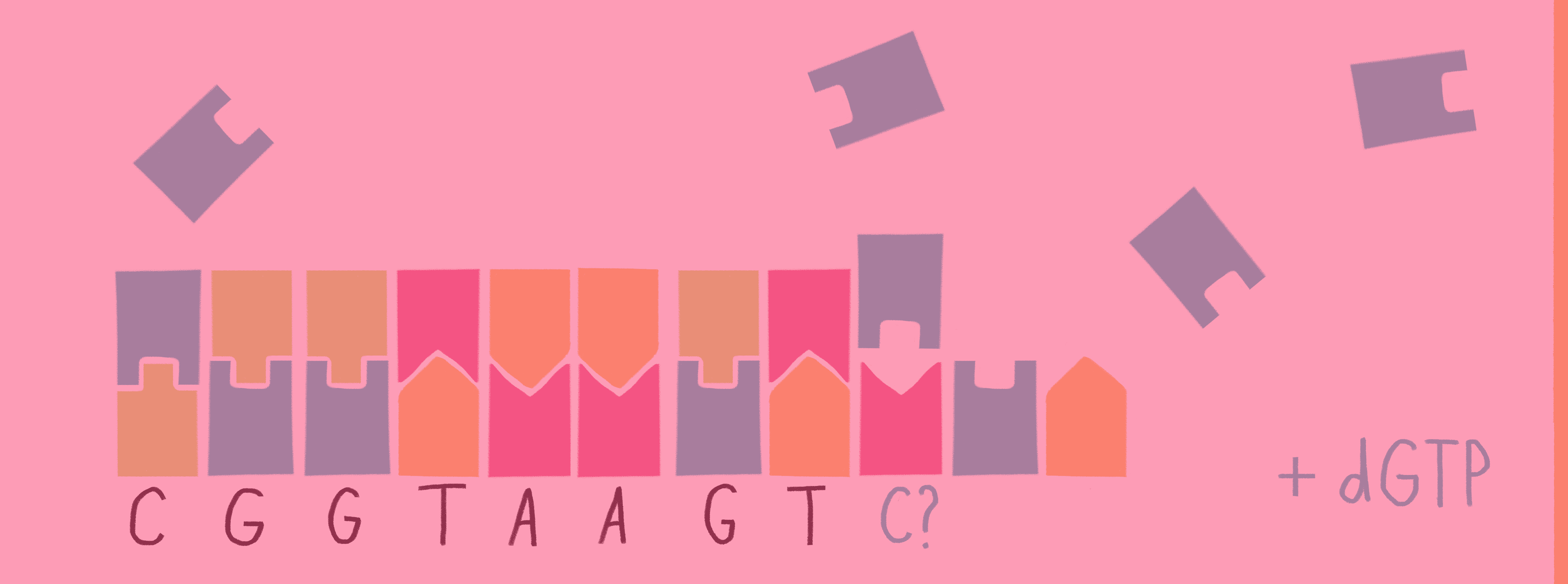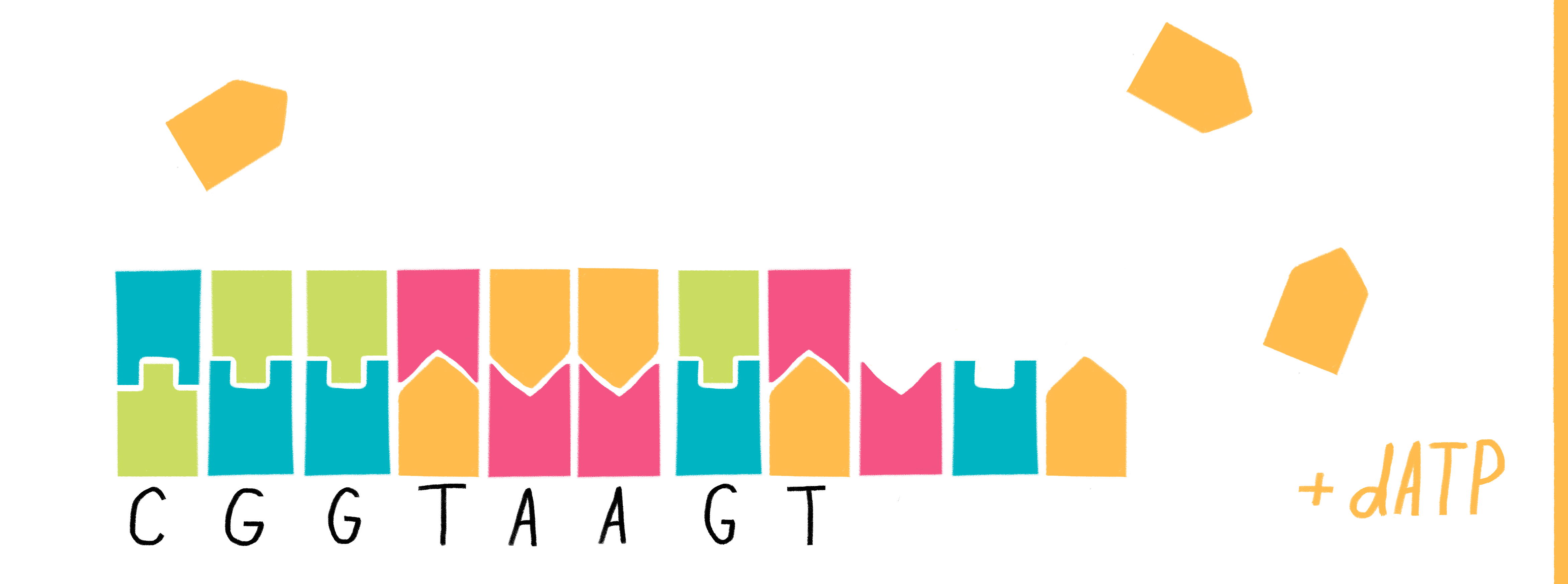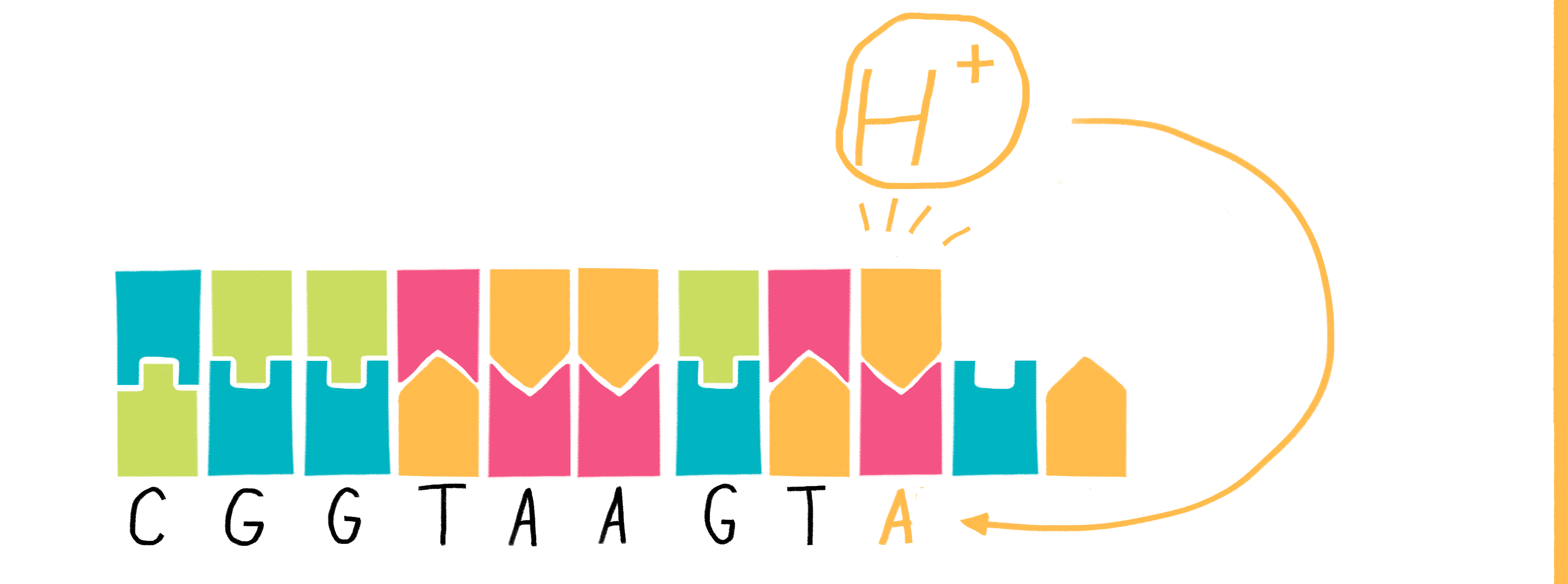Секвенирование на ЕГЭ
Материал по биологии
- Примеры заданий ЕГЭ на секвенирование
- Секвенирование по Сэнгеру
- Последовательность секвенирования
- Где применяется секвенирование?
Примеры заданий ЕГЭ на секвенирование
Секвенирование – это один из методов, встречающийся на ЕГЭ по биологии в заданиях линии 1 (таблица с пропуском названия метода), например:
Рассмотрите таблицу «Методы биологических исследований». Запишите в ответе пропущенный термин, обозначенный в таблице вопросительным знаком.
|
Методы |
Применение методов |
|
? |
Определение нуклеотидной последовательности ДНК или РНК |
|
Микроскопия |
Изучение особенностей фаз митоза |
Ответ: секвенирование / биохимический / молекулярногенетический / цитогенетический.
В этом году задания линии 1 могут содержать иллюстрации, мы оформили такое задание, использовав иллюстрации: https://vk.com/biochempublic?w=wall-202970776_1386
Секвенирование по Сэнгеру
Рассмотрим секвенирование по Сэнгеру (за разработку этого метода ученый получил Нобелевскую премию в 1977 году), а точнее его современную модификацию.
Чтобы знать структуру ДНК, достаточно узнать последовательность нуклеотидов в одной цепи, затем по принципу комплементарности можно легко установить и вторую цепь.
Что нужно знать, чтобы понимать принцип определения последовательности ДНК с помощью секвенирования?
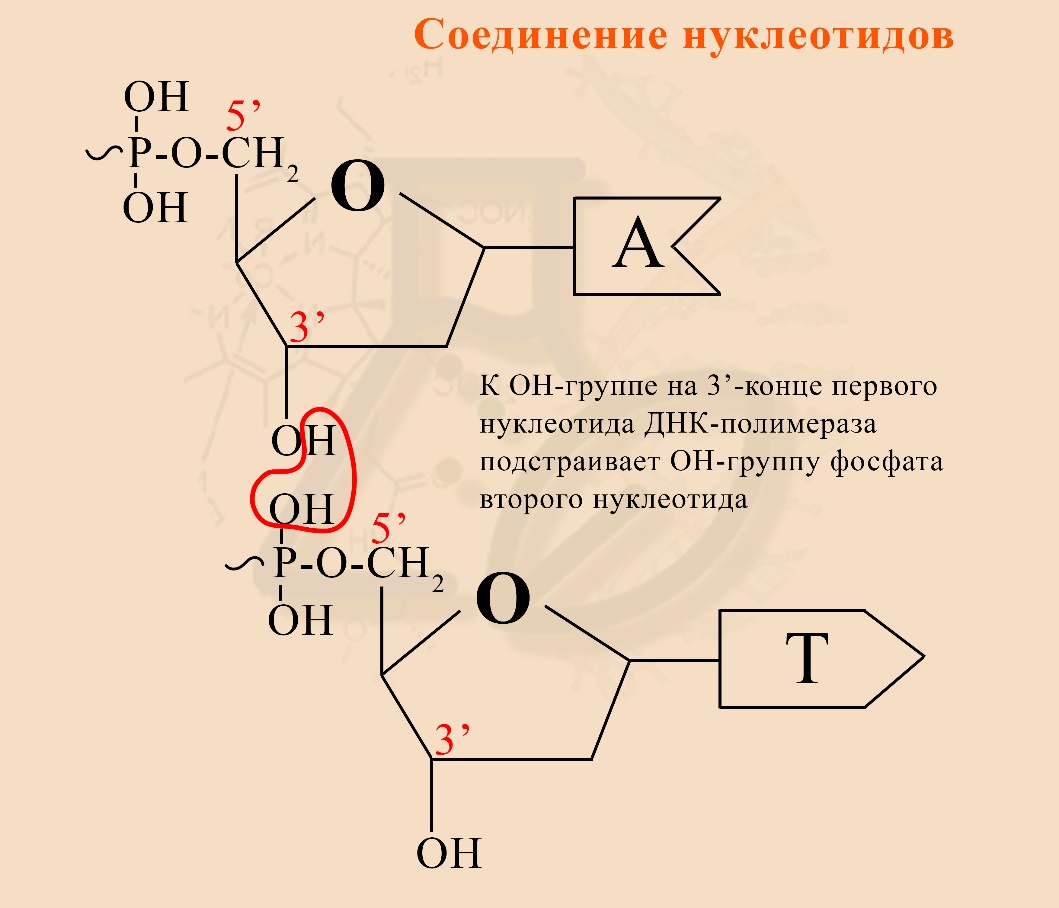
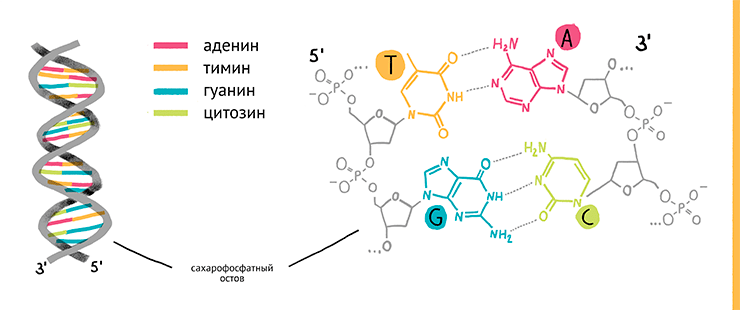
1) В состав ДНК входят нуклеотиды, они соединяются посредством взаимодействия ОН-группы дезоксирибозы одного нуклеотида и ОН-группы остатка фосфорной кислоты другого нуклеотида:
Секвенирование на ЕГЭ
Волнообразная связь от фосфата является макроэргической, так как цепи ДНК строятся не из обычных нуклеотидов, а из «активированных», содержащих не один, а три остатка фосфорной кислоты, о чем будет рассказано в другой статье.
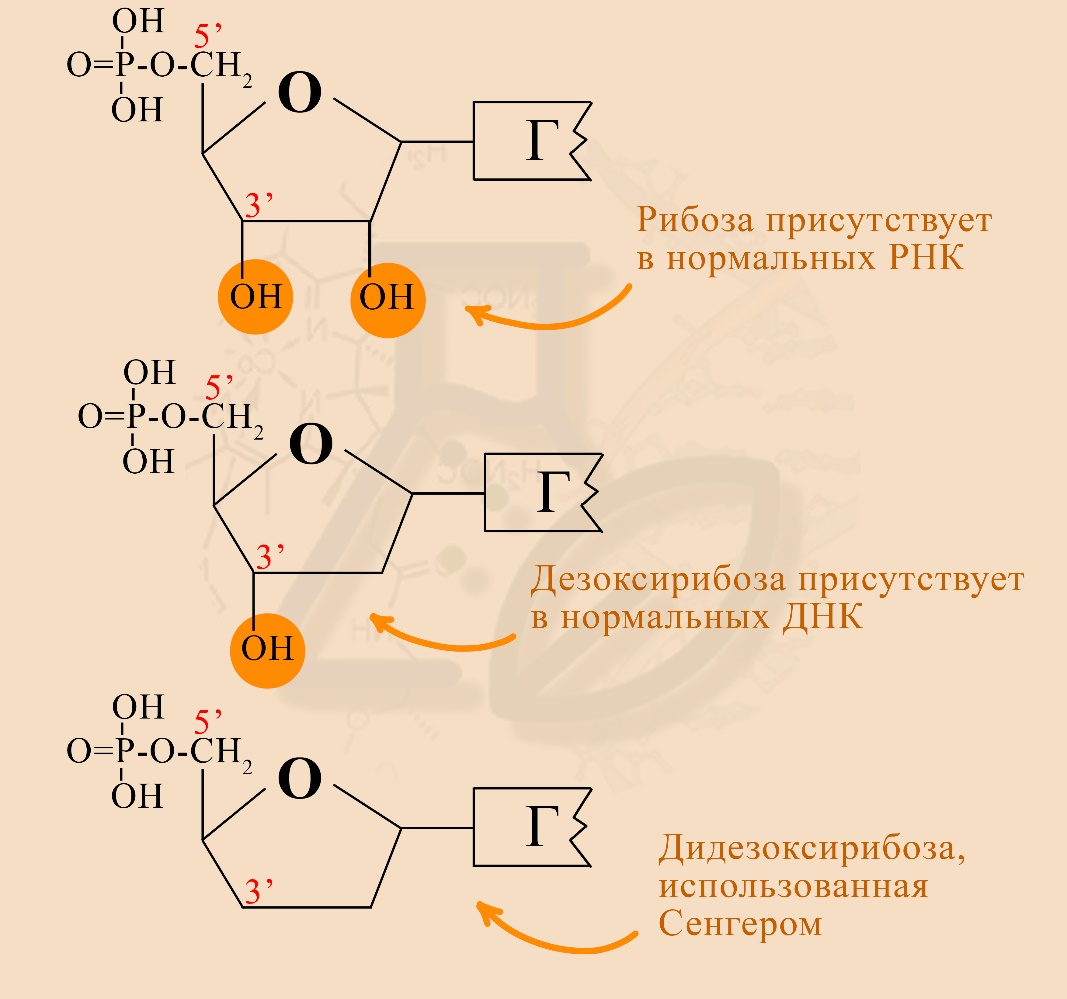
2) В своих экспериментах Сэнгер использовал нуклеотиды с дидезоксирибозой. Чтобы понять, чем она отличается от рибозы и дезоксирибозы, рассмотрите следующую иллюстрацию:
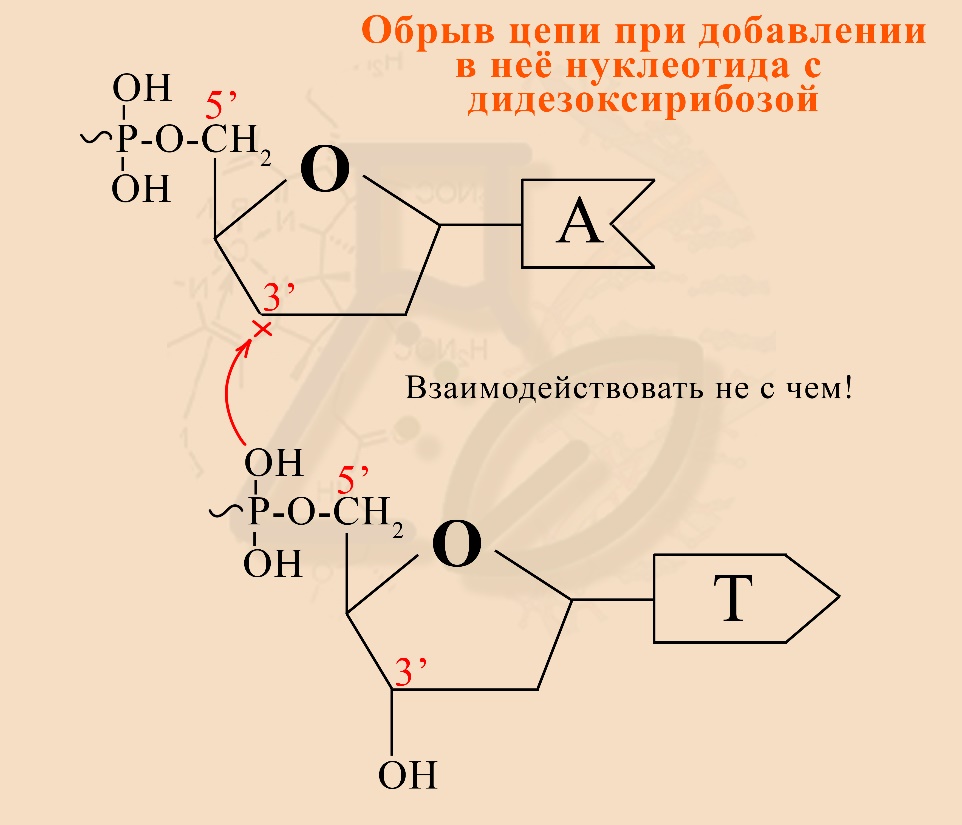
3) Использование дидезоксирибозы удобно тем, что на ней останавливается синтез нуклеотидной цепи, так как она не содержит ОН-группы на 3’-углероде сахара (рибоза, дезоксирибоза, дидезоксирибоза являются сахарами / моносахаридами / пентозами). Поэтому следующий нуклеотид не может присоединиться к цепи, оканчивающейся на дидезоксирибонуклеотид.
Образование динуклеотида
Последовательность секвенирования
Для определения последовательности ДНК секвенированием производят следующие действия (мы рассмотрим в упрощенном виде, достаточном для ЕГЭ по биологии).
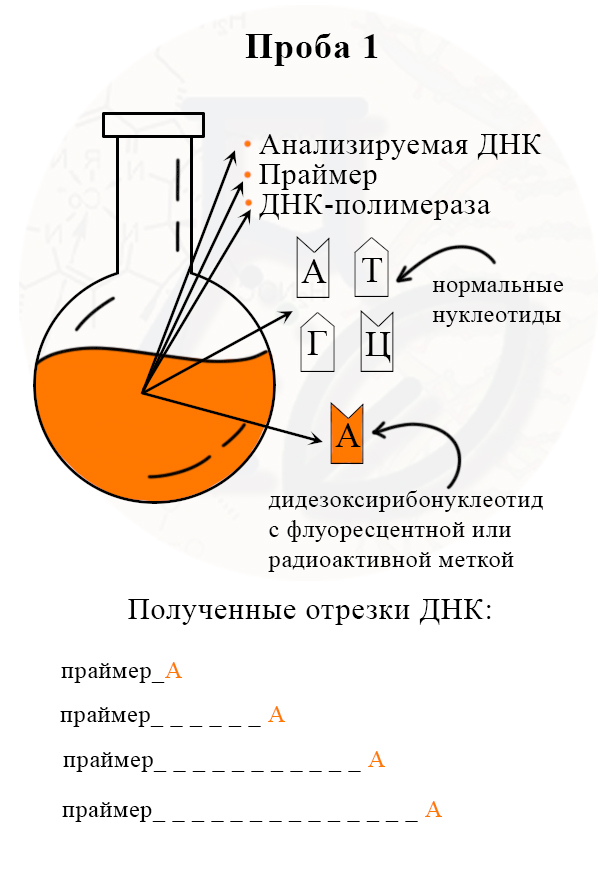
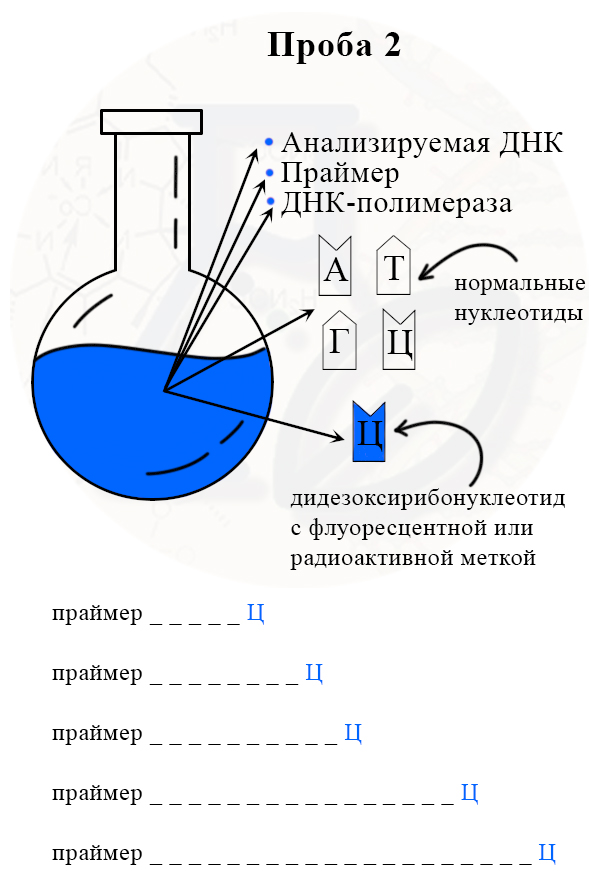
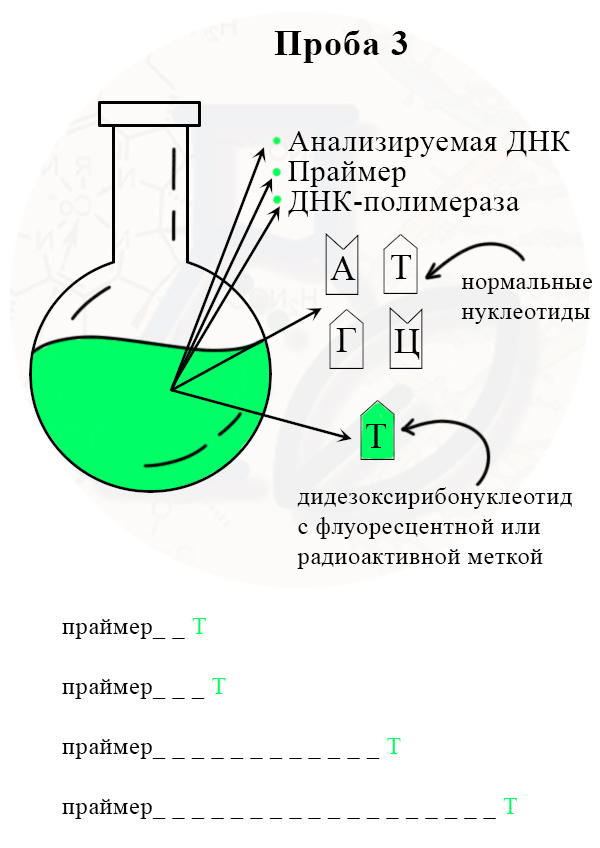
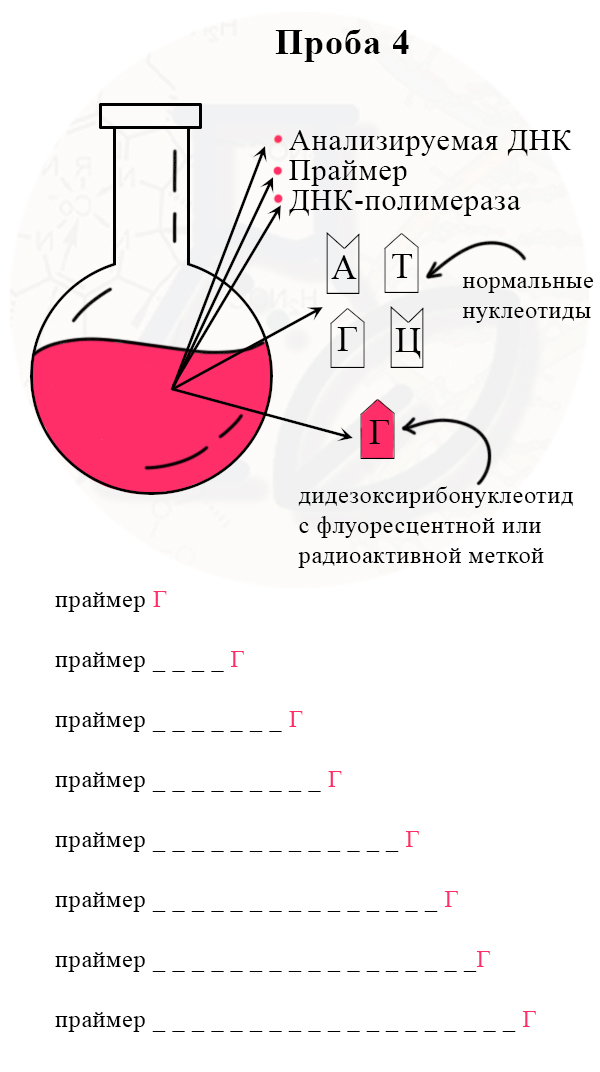
1) В колбу добавляют исследуемую ДНК (много копий), ДНК-полимеразу, праймер, все нормальные нуклеотиды и один вид дидезоксирибонуклеотидов, взятых в гораздо меньшем количестве, чем нормальных. Дидезоксирибонуклеотид помечают флуоресцентной меткой.
Почему добавляют много копий ДНК?
Дидезоксирибонуклеотид (далее сократим до «дд»), содержащий тимин, может комплиментарно присоединиться к первому нуклеотиды с аденином, или ко второму, или к пятому (представьте, сколько нуклеотидов с аденином может быть в одной ДНК, даже если мы используем последовательность около 1000 нуклеотидов – максимально длинный участок, который можно расшифровать методом Сэнгера). Исследователю нужно получить ВСЕ возможные варианты присоединения ддТ к растущей полинуклеотидной цепи.
Зачем нужна ДНК-полимераза?
Новая ДНК не может синтезироваться самостоятельно, каждый последующий нуклеотид присоединяется с помощью фермента ДНК-полимеразы.
Зачем нужен праймер?
ДНК-полимераза может присоединять следующие нуклеотиды только если уже имеется хотя бы несколько нуклеотидов новой цепи. Этими несколькими нуклеотидами и является праймер, он выполняет роль своего рода «затравки», к которой ДНК-полимераза присоединяет следующие нуклеотиды.
Почему дидезоксирибонуклеотидов гораздо меньше, чем нормальных нуклеотидов? Чтобы увеличить шанс образования цепей разной длинны. Если бы дидезоксирибонуклеотидов было много, то они бы достаточно быстро встраивались в цепь и обрывали дальнейший синтез полинуклеотида, а исследователь получил бы много одинаковых коротких фрагментов исследуемой ДНК и ни одного более длинного фрагмента.
2) В итоге получаем четыре колбы, каждая из которых отличается только видом дидезоксирибонуклеотида.
3) В каждой колбе происходит синтез отрезков новой цепи ДНК на матрице исходной (исследуемой) цепи. При этом образуется множество вариантов этих отрезков, их разнообразие зависит от количества того или иного нуклеотида в исходной цепи ДНК.
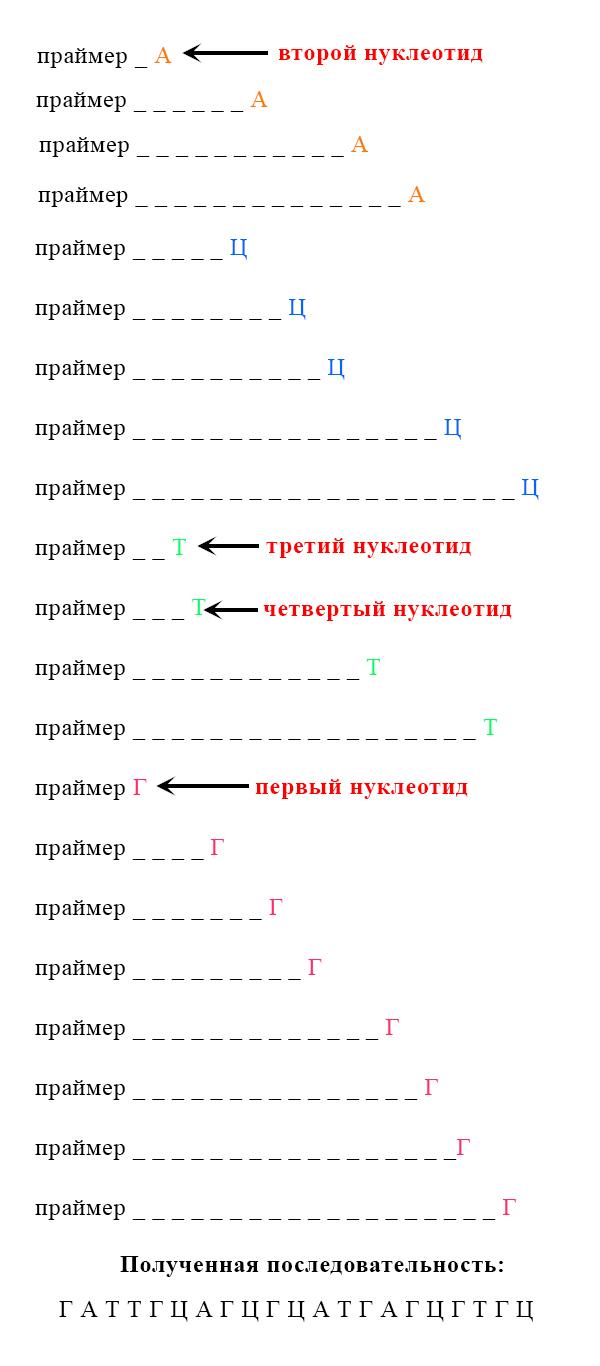
Рассмотрим вариант, при котором исходная ДНК имела четыре нуклеотида с аденином. К этим неклеотидам могут комплиментарно присоединиться как нормальные нуклеотиды с тимином, так и ддТ, обрывающий цепь. Всего получится четыре варианта новых цепей:
Таким образом, в пробирках с разными видами дидезоксирибонуклеотидов, будут формироваться цепи разной длины.
Первая проба (пробирка или колба) с меченым дидезоксирибонуклеотидом А (аденином). Прочерками обозначены места неизвестных (не меченных) нуклеотидов.
Проба 2 с меченым дидезоксирибонуклеотидом Ц (цитозином)
Проба 3 с меченым дидезоксирибонуклеотидом Т (тимином)
Четвертая проба с меченым дидезоксирибонуклеотидом Г (гуанином)
Если мы посмотрим на эти последовательности, то можем прийти к некоторым умозаключениям, позволяющим нам определить последовательность нуклеотидов в цепи (путем наложения):
4) Но на деле все немного сложнее. Далее полученные отрезки помещают в прибор, автоматически определяющий последовательность ДНК с помощью электрофореза. Через гель, используемый в электрофорезе (в него помещают исследуемые отрезки) проходит луч лазера, который заставляет флуоресцировать меченные молекулы. Так экспериментатор получает сведения о последовательности комплементарной цепи.
5) По последовательности отрезков комплементарной цепи исследователь может сделать вывод о последовательности исходной исследуемой цепи ДНК. Воспользовавшись таблицей генетического кода, можно понять, какой белок (или фрагмент какого белка) закодирован этим отрезком ДНК.
Где применяется секвенирование?
1) С помощью секвенирования расшифровывают геномы организмов.
2) Определение не только ДНК, но и РНК.
3) Определение генных заболеваний.
Секвенирование ДНК и РНК — это рутинный процесс, позволяющий, тем не менее, вникнуть в суть всего живого. Первоначально расшифровка генома была «развлечением» для избранных, а сегодня заказать эту услугу может каждая вторая научно-исследовательская лаборатория. С каждым годом проникнуть в дебри геномной, транскриптомной и эпигеномной информации становится все проще. Этот обзор посвящен основным принципам секвенирования нуклеиновых кислот и может послужить превосходным путеводителем как для любителя, изучающего основы молекулярной биологии, так и для специалиста, который планирует эксперимент и грезит научными прорывами.
12 биологических методов в картинках
Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Партнер этой статьи — «СкайДжин»
Пять причин выбрать SkyGen:
- Доступ к высококачественной продукции для молекулярной биологии
- Быстрая логистика и складская программа
- Удобное и взаимовыгодное сотрудничество
- Высококвалифицированная поддержка
- Адекватные цены
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Появление и развитие технологий секвенирования
С момента открытия нуклеиновых кислот прошло уже почти полторы сотни лет. В далеком 1869 году Иоганн Фридрих Мишер выделил из находившихся в гное клеток неизвестное доселе вещество, содержащее азот и фосфор, которое назвал нуклеином, а затем (из-за его свойств) — нуклеиновой кислотой. Первоначально считалось, что молекулы нуклеиновых кислот — резерв фосфора в клетках, однако уже в первой половине XX века ученые доказали их наследственную природу. Тогда же появилось понятие гена —наименьшей структурной и функциональной единицы наследственности, — и сформировалась новая наука — генетика.
Вплоть до середины прошлого века структура носителей генетической информации и способы ее передачи оставались неясными. Модель двойной спирали ДНК, которая входит во все современные учебники генетики и молекулярной биологии, предложили в 1953 году Френсис Крик и Джеймс Уотсон (за это в 1962 ученые получили Нобелевскую премию). Последовавшие следом открытие генетического кода и разработка центральной догмы молекулярной биологии дали мощный толчок к развитию естественных наук, в первую очередь — генетики. Основные исторические вехи этого процесса показаны на рисунке 1.
Рисунок 1. История геномных исследований и секвенирования нуклеиновых кислот. 8 марта 1865 г. — Грегор Мендель доложил результаты своих опытов, объясняющие механизм наследования. 1869 г. — Иоганн Фридрих Мишер выделил из клеток в гное неизвестное доселе вещество, содержащее азот и фосфор, которое назвал нуклеином. 1905–1909 гг. — появление терминов «ген» и «генетика». 1953 г. — Френсис Крик и Джеймс Уотсон предложили структуру двойной спирали ДНК. 1958 г. — Френсис Крик сформулировал центральную догму молекулярной биологии. 1975 г. — Сэнгер с коллегами разработал «плюс-минус» метод секвенирования ДНК. 1977 г. — группа Сэнгера разработала метод «терминаторов». 1977 г. — Максам и Гилберт предложили метод секвенирования ДНК путем химической деградации. 2001 г. — опубликован первый полный геном человека. 2005 г. — коммерциализация технологии пиросеквенирования. 2006 г. — коммерциализация технологии Solexa (Illumina). 2006 г. — коммерциализация технологии лигазного секвенирования. 2010 г. — коммерциализация технологии ионного полупроводникового секвенирования (технология PostLightTM). 2011 г. — первый коммерческий релиз секвенаторов PacBio, основанных на технологии одномолекулярного SMRT-секвенирования. 2015 г. — начало продаж первых приборов, основанных на секвенировании через нанопору. Чтобы увидеть рисунок в полном размере, нажмите на него.
Осознав основные принципы функционирования нуклеиновых кислот (НК), научное сообщество предприняло грандиозные усилия для того чтобы разработать быстрые и эффективные методы определения их первичной последовательности (рис. 2) — как это принято говорить сегодня, секвенирования. Спустя десятилетия после открытия Уотсона и Крика в биологической науке наступила новая эпоха — эра секвенирования нуклеиновых кислот и геномики…
Рисунок 2. Секвенирование нуклеиновых кислот (другими словами, определение их нуклеотидной последовательности) — это расшифровка первичной структуры линейных молекул ДНК или РНК, состоящих из последовательности «букв» — нуклеозидтрифосфатов: дАТФ, дГТФ, дЦТФ, дТТФ и УТФ. Эти «буквы» зачастую именуют просто по азотистому основанию, входящему в их состав — аденин (А), гуанин (Г), цитозин (Ц), тимин (Т), а также урацил (У) в случае РНК.
Почти четверть века назад в Соединенных Штатах стартовал грандиозный по своему масштабу научный проект, посвященный определению последовательности генома человека [1]. Основной его целью стала расшифровка генетической информации, заключенной в хромосомах (компактизованная ДНК), которые мы наследуем от своих родителей. В течение тринадцати лет многочисленные исследовательские группы по всему миру работали над определением полной последовательности генома человека. Почти три миллиарда долларов, потраченные на этот проект, открыли перед исследователями замечательные перспективы. Используя полученные данные, появилась возможность искать и находить участки ДНК, связанные с генетически обусловленными заболеваниями. И если природа многих моногенных болезней (вызываемых отказом единственного гена нашего генома) стала понятна уже давно, то некоторые заболевания — сердечно-сосудистые, онкологические, болезни Альцгеймера [2] и Паркинсона — являются многофакторными: вызвать их может широкий спектр изменений генома, многие из которых до сих пор неизвестны. Информация о генетических вариантах, связанных с человеческими недугами, позволяет формировать научно-обоснованный подход при их диагностике и лечении.
Расшифровка и аннотация (маркировка генов и других объектов в последовательности ДНК) генома человека поставили вопрос об использовании генетической информации как для диагностики заболеваний и их долговременного прогнозирования у человека, так и для исследования популяционной структуры сообществ, этногенеза и эволюционных процессов. Применение современных технологий секвенирования и генотипирования предлагает перспективные способы решения задач современной медицинской геномики и эпигеномики.
Такие результаты могут быть использованы при создании систем для проведения дифференциальной диагностики и выявления генетической природы заболеваний, для проведения персональной терапии и подбора методик лечения на основе анализа индивидуальных генетических характеристик. Решение таких задач тесно связано с разработкой эффективных алгоритмов и математических моделей для биоинформатической обработки данных геномного секвенирования и их использованием на базе суперкомпьютерных кластеров.
Геномные исследования позволяют решать массу задач как прикладного, так и фундаментального плана. Благодаря им разрабатываются новые лекарства и продукты, они же позволяют проникнуть в глубокую историю человечества [3] или понять причину массового вымирания видов.
Сейчас разработано несколько способов секвенирования НК. Самый популярный и надежный из них — секвенирование по Сэнгеру — позволяет «считывать» последовательности до 1000 пар оснований (п.о.) и используется для небольших фрагментов генома/генов или для валидации результатов более современного секвенирования нового поколения (next-generation sequencing, NGS), где размер одного прочитанного фрагмента варьирует от 25 до 500 п.о. В отличие от секвенирования по Сэнгеру, методы NGS используют для глубокого (многократного) прочтения генетического материала, которое необходимо, например, для ресеквенирования и сборки новых геномов (de novo), транскриптомных и эпигеномных исследований [4]. Помимо этого, NGS-секвенирование значительно производительнее, позволяя одновременно считывать миллионы и даже миллиарды коротких фрагментов. Такой рост производительности привел к возможности определения последовательности сразу десятков геномов (в зависимости от их размера) за один запуск прибора (рис. 3).
Рисунок 3. Современные технологии делают процесс секвенирования ДНК рутинной процедурой.
Стремительно развивающиеся новые технологии секвенирования ДНК позволяют быстро и эффективно определять особенности организмов на уровне их геномов. Главным итогом развития геномных и постгеномных технологий стало существенное расширение возможностей изучения генетической природы целого спектра заболеваний человека. Масштабные ассоциативные исследования на больших клинических выборках позволяют получать данные о генетических характеристиках, присущих конкретным группам людей (семьям, популяциям), развивая методы персонализированной медицины. В связи с этим, изучение механизмов генетической предрасположенности к многофакторным заболеваниям и выявление специфических генетических маркеров сегодня имеет особенную актуальность. Подобные методы широко применяются за рубежом и в России, где технологии современного секвенирования также постепенно внедряют в медицинские исследования и медицинскую практику с целью персонификации стратегии лечения [1].
Технологической основой для подобных исследовательских и сугубо прикладных проектов служат геномные секвенаторы (приборы, на которых проводят секвенирование), поставляемые различными коммерческими компаниями, такими как Illumina, Thermo Fisher Scientific, Oxford Nanopore Technologies, Pacific Biosciences и другие.
В 2017 году на рынке представлены сразу несколько перспективных разработок в области секвенирования НК. Эти подходы применены в секвенаторах нового поколения:
- Ion Proton и Ion Personal Genome Machine (Thermo Fisher Scientific) — технология ионного полупроводникового секвенирования;
- MiSeq и NovaSeq (Illumina) — технология секвенирования на молекулярных кластерах с использованием флуоресцентно меченых нуклеотидов;
- MinION, GridION X5, PromethION и SmidgION (Oxford Nanopore Technologies) — нанопоровое секвенирование;
и некоторых других.
Современные технологии делают процесс секвенирования ДНК рутинной процедурой, особенно в том случае, когда речь идет об организмах с уже известной последовательностью генома — их последующая биоинформатическая обработка не представляет значительного труда, поскольку исследователь уже имеет референсный (ранее отсеквенированный) геном, который позволяет избежать ошибок при анализе полученных данных. При анализе нового, неопубликованного ранее, генома (de novo секвенирование и сборка) перед исследователем стоит ряд более сложных задач, в ходе решения которых он пытается сложить единичные фрагменты в цельную последовательность, задействуя многочисленные математические алгоритмы и суперкомпьютерные мощности [5], [6].
Однако наибольший интерес представляет не сама последовательность генома, а понимание того, как он функционирует: какие гены обеспечивают жизнедеятельность клетки, как происходит регуляция (включение или выключение генов) или какие генные пути начинают работать в ответ на стрессовые факторы.
Все современные секвенирующие платформы отличаются от метода секвенирования по Сэнгеру тем, что не требуют этапа клонирования фрагментов ДНК. Это экономит рабочее время и позволяет избежать ряда проблем с клонированием АТ-богатых участков. Общий принцип пробоподготовки для большинства современных (NGS) секвенаторов включает фрагментирование ДНК, привязку к субстрату, амплификацию фрагментов с помощью ПЦР (в одномолекулярном секвенировании от ПЦР удалось отказаться) и последующее считывании последовательности НК. В отличие от метода секвенирования по Сэнгеру, современные платформы обеспечивают параллельное проведение миллиардов реакций в малых объемах, что позволяет получить намного больший объем информации на выходе.
Рассмотрим основные технологии секвенирования нуклеиновых кислот подробнее.
Секвенирование по Сэнгеру
«Плюс-минус» метод секвенирования ДНК
Один из наиболее популярных методов секвенирования обязан своим появлением английскому биофизику Фредерику Сэнгеру (1918–2013) — единственному ученому в истории мировой науки, получившему сразу две Нобелевские премии по химии (в 1958 и 1980 годах). Первую премию присудили за установление структур белков, особенно инсулина, а вторую награду ему вручили в том числе и за разработку методов определения первичной последовательности нуклеиновых кислот.
Методику секвенирования ДНК с использованием радиоактивно меченых нуклеотидов и ДНК-полимеразы (или фрагмента Кленова ДНК-полимеразы I) предложили Сэнгер и его коллеги в 1977 году, причем с течением времени этот метод прошел несколько модификаций и к настоящему моменту считается золотым стандартом современного секвенирования.
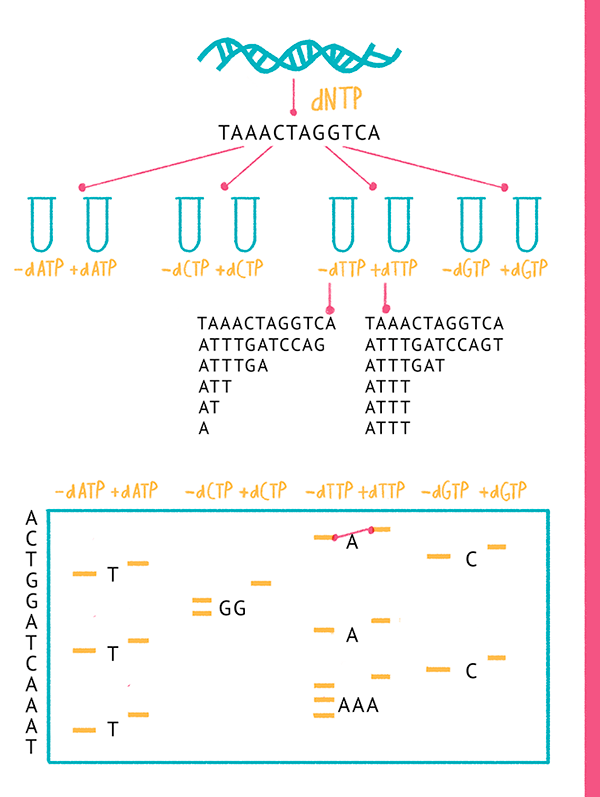
Первоначально Ф. Сэнгер и Алан Коулсон разработали так называемый «плюс-минус» метод секвенирования ДНК [7], который можно подразделить на две основные стадии:
- Полимеразная цепная реакция [8], в которой используется ДНК (например, ДНК человека), фермент (ДНК-полимераза), олигонуклеотидные праймеры и смесь четырех дезоксинуклеотидов (dNTPs) (А, Т, G и C), причем один из дезоксинуклеотидов радиоактивно помечен по α-положению фосфата (32P).
- Очистка смеси амплифицированных фрагментов от дезоксинуклеозидтрифосфатов, не вступивших в реакцию (например, на колонках). Смесь делят на восемь равных частей (в разных пробирках). В «плюс»-системе проводят четыре ПЦР-реакции в присутствии каждого из четырех типов дезоксинуклеозидтрифосфатов; параллельно в «минус»-системе проводят четыре ПЦР-реакции в отсутствии каждого из них. Далее результаты визуализируют с помощью электрофореза, и определяют последовательность ДНК, исходя из того, что в «плюс»-системе терминация (прерывание) ПЦР происходит после конкретного dNTP, а в «минус»-системе — перед ним (рис. 4).
Рисунок 4. «Плюс-минус» метод секвенирования ДНК, предложенный Ф. Сэнгером и А. Коулсоном.
Секвенирование ДНК по Сэнгеру: метод «терминаторов»
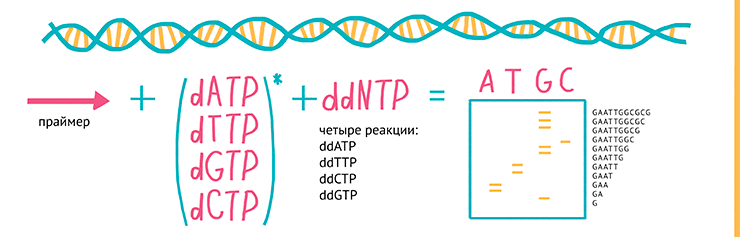
Спустя пару лет Сэнгер с коллегами предложил еще один способ секвенирования, получивший название метода «терминаторов» или метода «обрыва цепи» [9]. Суть этого метода заключается в том, что в реакционную смесь добавляют аналоги привычных нуклеотидов (дидезоксинуклеозидтрифосфаты), включение которых в синтезируемую цепь приводит к невозможности ее дальнейшего синтеза (терминации), а по образовавшемуся «обломку» можно установить последнюю букву секвенируемого фрагмента ДНК (рис. 5).
Рисунок 5. Метод «терминаторов»: используют ДНК-полимеразу, олигонуклеотидные праймеры и смесь четырех дезоксинуклеотидов (dNTPs) (А, Т, G и C), один из которых радиоактивно помечен по α-положению фосфата (32P). В каждую из четырех реакций добавляется по одному 2’,3’-дидезоксинуклеозидтрифосфату (ddATP, ddTTP, ddCTP или ddGTP), которые терминируют дальнейшую реакцию (синтез комплементарной молекулы ДНК с матрицы) — таким образом в каждой пробирке образуется набор фрагментов ДНК разной длины, которые заканчиваются одним и тем же нуклеотидом. Затем полученные фрагменты визуализируют с помощью электрофореза и, сравнивая длины фрагментов из четырех реакций с ddATP, ddTTP, ddCTP или ddGTP, восстанавливают последовательность ДНК.
Автоматизированные модификации метода «терминаторов» активно применяют до сих пор в специальных приборах — секвенаторах. Открытие многочисленных флуоресцентных молекул позволило отказаться от использования радиоактивной метки и сделало возможным проведение реакции в одной пробирке. Реакционную смесь разделяют капиллярным электрофорезом, a выстроившиеся в синтезируемую цепочку ДНК меченые нуклеотиды затем регистрируют детекторами флуоресценции, предоставляя возможность считывать последовательность всего секвенируемого ДНК-фрагмента.
Другие методы секвенирования «старого поколения»
Кроме методов, предложенных Сэнгером, в конце прошлого века развивались и другие подходы к определению последовательности НК, которые — в частности, метод химической деградации, разработанный Максамом и Гилбертом [10], — не получили дальнейшего распространения из-за быстрого развития энзимологии (раздел биохимии, изучающий ферменты), которая предоставила преимущество методу «терминаторов» Сэнгера.
Использование секвенирования по Сэнгеру
Секвенирование по Сэнгеру позволяет «считывать» последовательности до 1000 пар нуклеотидов и применяется для небольших фрагментов генома/генов. В частности, оно используется для:
- секвенирования отдельных участков генома с целью анализа мутаций и полиморфизмов;
- идентификации вирусов и организмов (бактерий, растений, грибов и животных);
- валидации данных, полученных на платформах секвенирования нового поколения (NGS);
- микросателлитного анализа;
- анализа делеций и инсерций (малых и протяженных).
Наиболее популярными секвенаторами, использующими технологию секвенирования по Сэнгеру, являются приборы, производимые компанией Thermo Fisher Scientific: 3730xL, 3730, 3500xL, 3500, 3130xL, 3130, 310.
Следует отметить, что все описанные выше типы исследований сейчас можно проводить с помощью секвенирования «нового поколения», речь о котором пойдет в следующей главе, однако главные плюсы секвенирования по Сэнгеру — высокая точность (достоверность) полученных данных и невысокая стоимость работ при анализе небольшого количества ДНК-фрагментов — сохраняют актуальность этого типа определения последовательности НК.
Секвенирование «нового поколения» — next-generation sequencing (NGS)
За последние полтора десятилетия были разработаны, коммерциализированы и продолжают успешно развиваться совершенно новые технологии определения последовательности НК, в основе которых лежит стремление к миниатюризации, автоматизации, увеличению объема получаемых данных, а также удешевлению процесса. Появление NGS впервые позволило значительно ускорить и удешевить определение полной последовательности миллионов геномов организмов, начиная от бактерий и заканчивая человеком. Более того, появилась реальная возможность единовременно оценивать экспрессию (работу) тысяч генов в организмах, тканях и единичных клетках (секвенирование транскриптомов), а также анализировать регуляцию их активности (анализ экспрессии микроРНК и метилирования генома). В настоящее время на рынке представлено сразу несколько разработок, позволяющих определять последовательность полных геномов организмов, проводить анализ экспрессии генов и метилирования генома. Эти подходы реализуются на секвенаторах нового поколения производства коммерческих компаний Illumina, Thermo Fisher Scientific, Pacific Biosciences и Oxford Nanopore Technologies. Часть разработанных платформ уже ушли с рынка (например, GS FLX, 454/Roche или HeliScope/Helicos Bioscience); другие, пройдя несколько реинкарнаций и модификаций, прочно закрепились на нем (Illumina и Thermo Fisher Scientific); третьи только нащупывают почву, намереваясь занять свою нишу и найти своего потребителя (например, Oxford Nanopore Technologies).
Появление высокопроизводительных технологий секвенирования сопровождается прогрессом программного обеспечения — создаются алгоритмы с открытым программным кодом, появляются открытые источники данных и платформы для вычислений. Новые математические и информационные технологии позволяют геномике развиваться быстрее и использовать более сложные алгоритмы. Эти алгоритмы могут включать в себя сразу несколько приложений и программ и позволяют работать с очень большим объемом данных.
Секвенирование «нового поколения» применяется как для анализа геномов организмов, для которых уже доступен референсный геном (ресеквенирование), так и для того, чтобы впервые расшифровать геном организма (секвенирование de novo).
Для ресеквенирования успешно используют платформы, генерирующие большое количество коротких чтений (секвенируемых фрагментов ДНК), поскольку даже относительно короткие фрагменты ДНК успешно картируются (картирование, или выравнивание, — процесс биоинформатического поиска расположения конкретного короткого фрагмента в полной геномной последовательности) на референсный геном (последовательность ДНК в цифровом виде, составленную учеными как общий репрезентативный пример последовательности генома конкретного вида) при биоинформатическом анализе данных. Такие выравненные чтения могут использоваться для поиска однонуклеотидных полиморфизмов (SNPs), малых делеций и инсерций или других структурных изменений в геноме.
Что касается секвенирования de novo и сборки новых, ранее не прочитанных, геномов, то использование коротких чтений сильно усложняет сборку, особенно в случае больших по размеру и сложно устроенных геномов эукариот (например, полиплоидных геномов). В этих случаях используют комбинированный подход — сочетание платформ, генерирующих как короткие, так и длинные чтения. При сборке генома de novo ученые уподобляются ребенку, пытаясь правильно сложить элементы геномного пазла (короткие фрагменты отсеквенированной ДНК) в единую картину, созданную эволюцией за сотни миллионов лет (рис. 6).
Рисунок 6. Cеквенирование de novo и сборка новых, ранее непрочитанных, геномов требует значительных усилий.
В то же время наибольший интерес представляет отнюдь не сама последовательность генома, а понимание того, как он функционирует. Новые методы секвенирования НК позволяют оценивать уровень метилирования ДНК, проводить анализ дифференциальной экспрессии генов, в том числе и генов-регуляторов (например, микроРНК). Возможность анализа экспрессии генов в биологических системах открывает перед исследователем огромные возможности. Например, этот метод можно применять при исследовании функционирования центральной нервной системы человека (для понимания основных молекулярных аспектов работы головного мозга [11], [12]), при оценке защитного ответа клеток на атаки вирусов [13] или ответной реакции на стресс [14]. Не менее интересные данные может дать изучение регуляции экспрессии генов посредством анализа их метилирования [15] или изучение экспрессии некодирующих РНК [16], [17].
Оценка уровня метилирования генома, например, позволяет определить, какие генные пути и сети включаются в ответ на меняющиеся факторы окружающей среды; такие работы зачастую проводят для изучения эволюционных механизмов в живых системах. Изучение экспрессии кодирующих белки и некодирующих РНК в разных тканях и клетках также позволяет понять и описать гены, вовлеченные в жизнедеятельность клеток, органов и организмов.
Пиросеквенирование
Одним из первых методов глубокого секвенирования, предложенным на суд научного сообщества, было пиросеквенирование, подразумевающее «секвенирование путем синтеза». Основной смысл этого типа секвенирования заключается в последовательном синтезе ДНК на ДНК-фрагментах изучаемого организма в специальных пиколитровых «реакторах». В ходе синтеза дочерней цепочки ДНК детектируют пирофосфаты, высвобождающиеся при включении нуклеотида в синтезируемую на матрице (участке молекулы ДНК, служащим матрицей для синтеза) комплементарную цепь .
Технологии пиросеквенирования на «биомолекуле» посвящена отдельная большая статья: «454-секвенирование (высокопроизводительное пиросеквенирование ДНК)» [18].
Технологию предложил в 1996 году Пол Нирен с коллегами из Королевского технологического института в Стокгольме [19]. Затем ее коммерциализировали (2005 год) и воплотили в приборе GS FLX, 454 производства Roche (2008 год). Этим методом можно определять нуклеотидную последовательность фрагментов геномной ДНК размером 300–500 пар оснований (п.о.). Особо следует отметить тот факт, что подавляющее большинство NGS-методов требуют предварительной фрагментации ДНК для упрощения ферментативных реакций. К обоим концам фрагментированной ДНК «пришивают» ДНК-адаптеры (данная конструкция называется ДНК-библиотекой), необходимые для эмульсионной ПЦР (эПЦР) на магнитных сферах и последующего секвенирования.
Готовые ДНК-библиотеки иммобилизуют на магнитных сферах. Затем магнитные сферы с нанесенной на них клональной библиотекой доставляют на проточную ячейку, где в присутствии праймера, дезоксинуклеотидтрифосфатов и ферментов — ДНК-полимеразы, люциферазы, АТФ-сульфурилазы — происходит циклический синтез новой цепи.
Во время цикла пиросеквенирования при образовании фосфодиэфирной связи между матричной цепочкой ДНК и нуклеотидом синтезируемой цепи выделяется пирофосфат, который запускает каскад химических реакций, приводящих к выделению АТФ, необходимой для реакции окисления люциферина с выделением кванта света, который фиксируют аналоговой интегральной микросхемой (ПЗС-матрицей), состоящей из светочувствительных фотодиодов. Нуклеотиды, не вовлеченные в синтез новой цепи, удаляют из проточной ячейки, и начинается следующий реакционный цикл, в ходе которого добавляют дезоксинуклеотидтрифосфат другого типа (рис. 7).
Рисунок 7. Принцип пиросеквенирования. При включении нуклеотида в синтезируемую цепочку ДНК происходит регистрация высвобождающихся пирофосфатов — побочного продукта реакции полимеризации нуклеотидов в ДНК.
Технология секвенирования на молекулярных кластерах с использованием флуоресцентно меченых нуклеотидов
Технология секвенирования на молекулярных кластерах, так же как и пиросеквенирование, подразумевает синтез новой молекулы ДНК по матрице. Этот метод начали разрабатывать еще в середине 90-х годов прошлого века химики Шанкар Баласубраманиан и Дэвид Кленерман из Кембриджа, изучавшие работу ДНК-полимеразы на молекулярном уровне, используя флуоресцентно меченые нуклеотиды и ДНК-матрицу, иммобилизованную на поверхности [20]. Творческие семинары в лаборатории и дружеские посиделки в баре привели к коммерциализации этой технологии в 2006 году под брендом Solexa, который спустя год был приобретен компанией Illumina. Сейчас платформа продолжает развиваться, и потребителям предлагают новые линейки приборов.
Суть метода заключается в следующем. К обоим концам предварительно фрагментированной ДНК лигируют адаптеры, необходимые для ПЦР и последующего секвенирования на молекулярных кластерах. Полученные ДНК-библиотеки иммобилизуют на поверхности проточной ячейки, где и проводят циклический процесс секвенирования. Реакционная смесь для синтеза комплементарной ДНК подается на поверхность проточной ячейки и содержит ферменты, олигонуклеотиды, а также четыре типа флуоресцентно меченых дезоксинуклеозидтрифосфатов. После включения в синтезируемую цепь ДНК нуклеотида-терминатора идентифицируют с помощью ПЗС-матрицы как тип включенного нуклеотида, так и его положение. Затем терминирующая группа и флуоресцентная краска отщепляются от нуклеотида, и цикл синтеза повторяется. Эта серия шагов продолжается определенное количество раз, число которых задает пользователь (рис. 8).
Рисунок 8. Принцип секвенирования на молекулярных кластерах: полимеризация (синтез «дочерней» цепочки) ДНК с использованием флуоресцентно меченых нуклеотидов внутри специальной камеры, регистрирующей флуоресценцию.
Размер чтений, получаемых с секвенатора, может достигать 300 п.о. (прибор Illumina MiSeq). Кроме того, серия секвенаторов 2017 года NovaSeq позволяет определять последовательность до 48 геномов человека за один запуск прибора.
Технология циклического лигазного секвенирования
Технология циклического лигазного секвенирования была разработана группой Джорджа Макдональда Черча [21] и, в отличие от представленных выше, использует метод лигирования (формирование химических связей между нуклеотидами при помощи специального фермента — лигазы). Данный подход к секвенированию НК коммерциализировали в 2006 году, и приборы, известные под брендом SOLiD, уже длительное время представлены на рынке (первоначально развитием этой системы секвенирования занималась компания Applied Biosystems, а затем Life Technologies и Thermo Fisher Scientific).
Суть метода заключается в определении нуклеотидной последовательности фрагментов геномной ДНК размером 25–75 п.о. К обоим концам предварительно фрагментированной ДНК лигируют адаптеры, необходимые для эПЦР на магнитных сферах и последующего секвенирования на проточной ячейке.
Магнитные сферы с нанесенной на них клональной библиотекой помещают на проточную ячейку, где и происходит секвенирование с помощью лигирования восьминуклеотидных зондов, несущих четыре различных флуорофора на 5’-конце. Флуоресценция считывается с помощью специальной камеры после каждого цикла секвенирования и, затем переводится в последовательность нуклеотидов (рис. 9).
Рисунок 9. Принцип лигазного секвенирования и последовательность зондов, которые используют при секвенировании. Зонды для секвенирования можно разделить на несколько участков (начиная с 3’-конца): первые два нуклеотида зонда лигируются к комплементарным участкам на секвенируемой ДНК-библиотеке, нуклеотиды с третьего по пятый — вырожденные (т.е. могут гибридизоваться с любыми тремя нуклеотидами секвенируемой ДНК-библиотеки). Нуклеотиды с шестого по восьмой также способны гибридизоваться с любыми тремя нуклеотидами секвенируемой ДНК-библиотеки, однако они отщепляются вместе с флуоресцентным красителем в конце каждого цикла секвенирования.
Технология лигазного секвенирования применялась в приборах, выпускаемых под брендом SOLiD. Спустя несколько поколений приборов пробоподготовку усовершенствовали, и на рынок вышла новая линейка приборов — 5500, 5500xl, а также 5500w, использующий изотермальную ПЦР (WildFire технология) для клонирования ДНК-библиотек [22].
Ионное полупроводниковое секвенирование
Ионное полупроводниковое секвенирование, основанное на технологии PostLightTM, разработано компанией Ion Torrent и в настоящее время применяется в приборах, реализуемых Thermo Fisher Scientific — Ion S5 / Ion S5 XL, Ion Proton, Ion Personal Genome Machine (PGM).
Технология, предлагаемая в этой приборной линейке, основана на использовании полупроводниковых микрочипов для секвенирования. Суть этого подхода весьма проста и заключается в регистрации локального изменения рН на микрочипе в момент удлинения синтезируемой цепи ДНК-полимеразой на ДНК-матрице (рис. 10).
Рисунок 10. Принцип полупроводникового секвенирования основан на обнаружении ионов водорода, которые выделяются во время полимеризации ДНК.
Пробоподготовка (приготовление ДНК-библиотек) напоминает таковую при циклическом лигазном секвенировании. Первоначально ДНК фрагментируют, затем к концам полученных фрагментов лигируют специфические ДНК-адаптеры, необходимые для эмульсионной ПЦР на магнитных сферах и последующего секвенирования.
Одномолекулярное секвенирование
SMRT-секвенирование (single molecule real time sequencing), предложенное сотрудниками компании Pacific Biosciences, не только позволило отказаться от проведения полимеразной цепной реакции при пробоподготовке, но и дало возможность наблюдать за работой ДНК-полимеразы, наращивающей синтезируемую цепь, в реальном времени [23].
Создание платформы Pacific Biosciences не только решило проблему ПЦР-дупликатов, но и значительно увеличило длину чтений, что крайне важно при сборке геномов de novo. Суть метода заключается в определении нуклеотидной последовательности фрагментов геномной ДНК размером до 20 000 п.о. с лигированными к их концам специфическими ДНК-адаптерами, необходимыми для последующего секвенирования.
Сама реакция секвенирования молекул ДНК проходит в специальных ячейках (SMRT-ячейки) на прозрачной (кремниевой) подложке, с напыленным на нее слоем алюминия. В основе метода лежит использование технологии Zero-mode waveguide (ZMW) [24]. Сквозь дно в ячейку подается свет, однако благодаря особенностям ее строения, пучок фотонов не рассеивается, а освещает только конкретную часть (на подложке), где закреплена молекула phi29 ДНК-полимеразы. Эта полимераза была выбрана в качестве «считывающего» фермента благодаря своей высокой точности, скорости синтезирования дочерней цепи и эффективной работе с нуклеотидами, несущими флуоресцентную метку [25].
Смысл SMRT-секвенирования схож с описанными ранее методами NGS — ДНК-полимераза достраивает вторую цепь исследуемой молекулы ДНК, используя нуклеотиды, меченные различными флуоресцентными метками, которые регистрируют при помощи конфокальной микроскопии. В 2016 году анонсировали покупку платформы Pacific Biosciences биотехнологическим гигантом Roche Diagnostics, однако сделка так и не состоялась [26].
Разработка другого способа одномолекулярного секвенирования (коммерциализированного к настоящему времени) началась в конце прошлого века, когда группа американских ученых наглядно продемонстрировала возможность побуждать молекулы ДНК и РНК проходить сквозь ионный канал диаметром 2,6 нм в двуслойной липидной мембране под воздействием электрического поля. Более того, уже тогда исследователи сумели различать ДНК и РНК, а также оценивать длину входящих в нанопору олигонуклеотидов [27]. Спустя 13 лет впервые продемонстрировали возможность определения последовательности НК нанопоровым секвенированием [28], а затем данную технологию коммерциализировала и представила на рынок компания Oxford Nanopore Technologies (рис. 11).
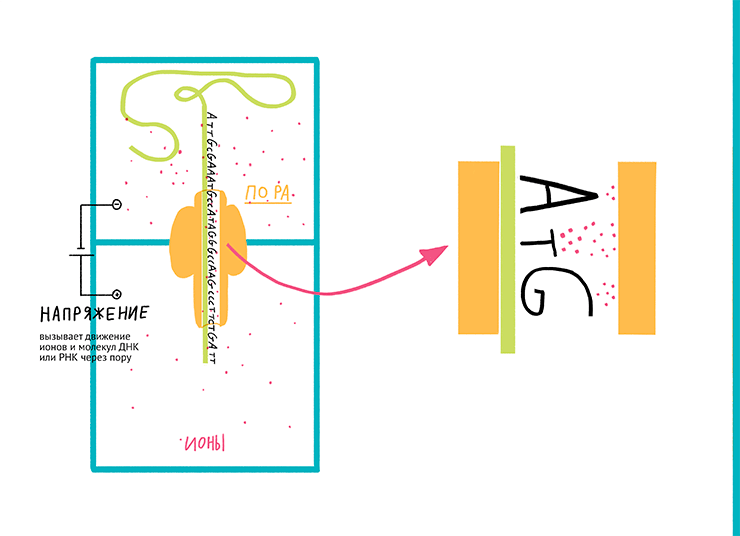
Рисунок 11. Принцип нанопорового секвенирования, коммерциализованный компанией Oxford Nanopore Technologies. Данный тип секвенирования основан на измерении меняющейся силы тока при прохождении молекулы НК сквозь нанопору в двухслойной мембране.
Суть работы нанопоровых систем (MinION, GridION X5, PromethION и SmidgION), предложенных британской компанией, достаточно проста. Реакционная камера, в которой проходит процесс считывания последовательности НК, разделена двухслойной мембраной с единичной порой. К камере прикладывается напряжение, вызывающее движение ионов и молекул ДНК или РНК через пору. При прохождении молекулы НК сечение поры (доступное для миграции ионов) уменьшается, в результате чего сила тока падает. Таким образом, считывая изменение силы тока, можно определять тип нуклеотида, проходящего через пору в конкретный отрезок времени.
Кроме описанных выше двух технологий компания Helicos Biosсiences пыталась продвинуть на биотехнологический рынок свою технологию одномолекулярного секвенирования — true Single Molecule Sequencing (tSMS). Данный подход во многом схож с технологией секвенирования на молекулярных кластерах (Illumina), однако позволяет обходиться без ПЦР при пробоподготовке.
Суть метода заключается в определении нуклеотидной последовательности фрагментов геномной ДНК размером до 50 п.о. К обоим концам предварительно фрагментированной ДНК лигируют адаптеры. Полученные ДНК-библиотеки иммобилизуют на поверхности проточной ячейки, где и проводят циклический процесс секвенирования. Один цикл состоит из удлинения синтезируемой на матрице цепочки за счет одного из четырех флуоресцентно меченых нуклеотидов, присоединение которого детектируется прибором.
Небольшая длина чтения (до 50 п.о., медиана — 30 п.о.) и большое количество ошибок (3–5%) данной платформы привели к оттоку потенциальных покупателей. Технология не получила широкого распространения, несмотря на потенциальную применимость в работе со сложными образцами, например, в палеогеномике [29], где отказ от ПЦР мог бы привести к сокращению процентного соотношение экзогенной (мусорной) ДНК в анализируемых образцах древней ДНК [30]. В итоге, в конце 2012 года компания Helicos Biosciences была признана банкротом и прекратила свое существование [31].
Одномолекулярное секвенирование длинных фрагментов ДНК может найти свое применение в самых разнообразных областях, и, что самое интересное, при работе с единичными клетками позволяет описывать их молекулярный «портрет» [32]. Это особенно важно при анализе транскриптомов клеток, позволяя описывать все возможные изоформы активных генов — благодаря длине чтений, недоступных для технологии Solexa или PostLight [33].
Использование секвенирования нового поколения
Производительность и относительная доступность NGS-методов привели к настоящей революции в биологической и медицинской науке. Более того, благодаря новым подходам появилась реальная возможность проводить ранее технически недоступные исследования. Использование секвенирования нового поколения позволяет проводить такие проекты как:
- Полногеномный анализ (в том числе, ресеквенирование и секвенирование de novo). Ресеквенирование полных геномов человека в интересах персонализированной медицины или секвенирование ранее не изученных геномов вирусов, бактерий, архей, растений, грибов и животных как с чисто фундаментальными, так и прикладными целями.
- Секвенирование РНК (RNA-Seq), позволяющее оценивать экспрессию генов не только качественно, но и количественно. Существует возможность отдельно оценивать экспрессию кодирующих и регуляторных РНК. Данные методики направлены на изучение работы генома (активности его генов, в том числе генов-регуляторов) в разных клетках, тканях и органах.
- Метагеномное секвенирование — оценка разнообразия микроорганизмов в различных образцах. Позволяет оценивать бактериальное разнообразие в различных средах, например, в кишечнике человека, донных отложениях озера Байкал или в горячих источниках Камчатки.
- Анализ ДНК-белковых взаимодействий (ChIP-Seq) — изучение влияния транскрипционных факторов и других ДНК-связывающих белков на экспрессию генов, а через нее на фенотипические и физиологические особенности клеток, органов и тканей.
- Бисульфитное секвенирование и его модификации (например, RRBS) — оценка метилирования в геноме или его участках. Влияние метилирования регуляторных участков генома на уровень экспрессии генов через подавление их транскрипционной активности.
- Таргетное секвенирование (экзомное секвенирование, секвенирование митохондриальных генов, секвенирование ампликонов). Секвенирование отдельных (выбранных исследователем) участков генома, например, только генов митохондриальной ДНК, кодирующих белки генов или генов, для которых уже описано участие в процессах онкогенеза. Таргетное секвенирование позволяет значительно снизить стоимость эксперимента (из расчета на один образец) и многократно увеличить количество анализируемых образцов.
Заключение
В наши дни происходит бурное развитие технологий, связанных с исследованием генов, белков и других молекулярных структур живых организмов. Разрабатываются портативные, быстрые, точные и универсальные методы исследований биологических объектов. Появление высокопроизводительных технологий секвенирования НК сопровождается развитием в области программного обеспечения, создаются алгоритмы с открытым программным кодом. Новые математические и информационные технологии позволяют геномике развиваться быстрее и использовать более сложные алгоритмы (например, нейронные сети).
На сегодняшний день объемы получаемой секвенаторами информации значительно обогнали возможности математического анализа получаемых результатов. Но даже несмотря на это, биомедицинская наука вовлечена в круговорот геномной революции, когда новые данные появляются ежедневно, а биотехнологические компании предлагают все новые и новые решения, значительно облегчающие диагностику заболеваний, приближая мир к новому направлению — персонализированной медицине [34].
Календарь
На основе статей спецпроекта мы решили сделать календарь «12 методов биологии» на 2019 год. Эта статья представляет апрель.
- Геном человека: как это было и как это будет;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Генофонд австралийских аборигенов хранит ключ к тайне выхода человека из Африки;
- Erwin L. van Dijk, Hélène Auger, Yan Jaszczyszyn, Claude Thermes. (2014). Ten years of next-generation sequencing technology. Trends in Genetics. 30, 418-426;
- Код жизни: прочесть не значит понять;
- Наука витает в облаках;
- F. Sanger, A.R. Coulson. (1975). A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. Journal of Molecular Biology. 94, 441-448;
- Важнейшие методы молекулярной биологии и генной инженерии;
- Sanger F., Niclein S., Coulson A.R. (1977). DNA sequencing with chain-terminating inhibitors. Proc. Natl. Acad. Sci. USA. 74, 5463–5467;
- Maxam A.M. and Gilbert W. (1977). A new method of sequencing DNA. Proc. Natl. Acad. Sci. USA. 74, 560–564;
- Zhisong He, Dingding Han, Olga Efimova, Patricia Guijarro, Qianhui Yu, et. al.. (2017). Comprehensive transcriptome analysis of neocortical layers in humans, chimpanzees and macaques. Nat Neurosci. 20, 886-895;
- Dolina I.A., Efimova O.I., Kildyushov E.M., Sokolov A.S., Khaitovich P.E., Nedoluzhko A.V. et al. (2017). Exploring terra incognita of cognitive science: Lateralization of gene expression at the anterior pole of the human brain. Psychology in Russia: State of the Art. 10, in press;
- Hu B., Li X., Huo Y., Yu Y., Zhang Q., Chen G. et al. (2016). Cellular responses to HSV-1 infection are linked to specific types of alterations in the host transcriptome. Sci. Rep. 6, 28075;
- Wang M., Sun X., Yu D., Xu J., Chung K., Li H. (2016). Genomic and transcriptomic analyses of the tangerine pathotype of Alternaria alternata in response to oxidative stress. Sci. Rep. 6, 32437;
- Artemov A.V., Mugue N.S., Rastorguev S.M., Zhenilo S., Mazur A.M., Tsygankova S.V. et al. (2017). Genome-wide DNA methylation profiling reveals epigenetic adaptation of stickleback to marine and freshwater conditions. Molecular Biology and Evolution;
- S. M. Rastorguev, A. V. Nedoluzhko, F. S. Sharko, E. S. Boulygina, A. S. Sokolov, et. al.. (2016). Identification of novel microRNA genes in freshwater and marine ecotypes of the three-spined stickleback (Gasterosteus aculeatus). Mol Ecol Resour. 16, 1491-1498;
- O. A. Shulga, A. V. Nedoluzhko, A. V. Shchennikova, N. M. Gruzdeva, A. A. Shelenkov, et. al.. (2017). Profiling of microRNAs in wild type and early flowering transgenic Chrysanthemum morifolium by deep sequencing. Plant Cell Tiss Organ Cult. 128, 283-301;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Mostafa Ronaghi, Samer Karamohamed, Bertil Pettersson, Mathias Uhlén, Pål Nyrén. (1996). Real-Time DNA Sequencing Using Detection of Pyrophosphate Release. Analytical Biochemistry. 242, 84-89;
- Mark A. Osborne, W. Scott Furey, David Klenerman, Shankar Balasubramanian. (2000). Single-Molecule Analysis of DNA Immobilized on Microspheres. Anal. Chem.. 72, 3678-3681;
- J. Shendure. (2005). Accurate Multiplex Polony Sequencing of an Evolved Bacterial Genome. Science. 309, 1728-1732;
- Z. Ma, R. W. Lee, B. Li, P. Kenney, Y. Wang, et. al.. (2013). Isothermal amplification method for next-generation sequencing. Proceedings of the National Academy of Sciences. 110, 14320-14323;
- J. Eid, A. Fehr, J. Gray, K. Luong, J. Lyle, et. al.. (2009). Real-Time DNA Sequencing from Single Polymerase Molecules. Science. 323, 133-138;
- Levene M.J., Korlach J., Turner S.W., Foquet M., Craighead H.G., Webb W.W. (2003). Zero-mode waveguides for single-molecule analysis at high concentrations. Science. 299, 682–686;
- Jonas Korlach, Arek Bibillo, Jeffrey Wegener, Paul Peluso, Thang T. Pham, et. al.. (2008). Long, Processive Enzymatic DNA Synthesis Using 100% Dye-Labeled Terminal Phosphate-Linked Nucleotides. Nucleosides, Nucleotides and Nucleic Acids. 27, 1072-1082;
- PacBio announces termination of agreement with Roche Diagnostics. (2016). Pacific Biosciences of California;
- Kasianowicz J.J., Brandin E., Branton D., Deamer D.W. (1996). Characterization of individual polynucleotide molecules using a membrane channel. Proc. Natl. Acad. Sci. USA. 93, 13770–13773;
- D. Stoddart, A. J. Heron, E. Mikhailova, G. Maglia, H. Bayley. (2009). Single-nucleotide discrimination in immobilized DNA oligonucleotides with a biological nanopore. Proceedings of the National Academy of Sciences. 106, 7702-7707;
- Древняя ДНК: привет из прошлого;
- L. Orlando, A. Ginolhac, M. Raghavan, J. Vilstrup, M. Rasmussen, et. al.. (2011). True single-molecule DNA sequencing of a pleistocene horse bone. Genome Research. 21, 1705-1719;
- Helicos BioSciences files for Chapter 11 bankruptcy protection. (2012). GenomeWeb;
- Секвенирование единичных клеток (версия — Metazoa);
- Donald Sharon, Hagen Tilgner, Fabian Grubert, Michael Snyder. (2013). A single-molecule long-read survey of the human transcriptome. Nat Biotechnol. 31, 1009-1014;
- От медицины для всех — к медицине для каждого!.
Секвенирование днк. Этапы секвенирования днк.
Секвенирование
— представляет собой определение
нуклеотидной последовательности
фрагмента ДНК путем получения серии
комплементарных молекул ДНК, различающихся
по длине на одно основание. Является
последним этапом молекулярного анализа
предварительно отобранного, клонированного
и протестированного более простыми
методами фрагмента ДНК.
Существует
два основных метода секвенирования;
метод Максама-Гилберта (основан на
химическом расщеплении ДНК по одному
основанию) и метод Сэнгера (дидезокси-метод).
Метод Сэнгера более надежен и прост в
исполнении, и на практике его используют
чаше.
Метод
Сэнгера или дидезоксисеквенирование
основан на синтезе изучаемой цепи ДНК
in vitro с остановкой синтеза на заданном
основании путем присоединения
дидезоксинуклеотида. Дидезоксинуклеотид
лишен гидроксильных групп при атомах
сахарного кольца не только в 2′-, но и в
3′-положении, что делает его неспособным
формировать фосфодиэфирную связь со
следующим нуклеотидом.
Для
проведения секвенирования
необходимы:
1)
секвенирующий праймер (искусственно
синтезированная олигонуклеотидная
последовательность, комплементарная
определенному участку исходной молекулы
ДНК),
2)
набором из четырех дезоксинуклеотидов
dATP, dCTP, dGTP и dTTP, один из которых изотопно
меченный
3)
один из четырех дидезоксинуклеотидов
(ddATP, ddCTP, ddGTP и ddTTP)
4)
ДНК-полимераза.
Сам
метод включает
следующие этапы:
1)
гибридизация изучаемого фрагмента ДНК
с праймером
2)
ферментативный синтез ДНК
3)
денатурация полученных продуктов
формамидом (в результате образуются
уникальные различающиеся по длине
олигонуклеотидные последовательности,
содержащие праймер)
4) электрофорез в
полиакриламидном геле на четырех
дорожках (по числу типов нуклеотидов)
и
5) анализ результатов
на радиоавтографе. На большинстве
радиоавтографов можно четко различить
250—350 полос, т.е. прочитать последовательность
в 250-350 п.н. Нуклеотидная последовательность
на радиоавтографе считывается снизу
вверх.
Таким
образом, по размеру синтезированных
фрагментов
может быть определена локализация
дидезоксинуклеотидов и порядок
соответствующих им нуклеотидов в
исходной молекуле ДНК.
Для
прочитывания
более длинных последовательностей
существует ряд методов, представляющих
собой разные модификации метода Сэнгера.
Эти методы основаны на предварительном
клонировании ДНК в векторах,
сконструированных на основе фага М13
E.coli для получения протяженных
одноцепочечных участков ДНК, которые
могут быть непосредственно секвенированы
без денатурации и праймирования.
Особенность фага М13 E.coli состоит в
возможности его существования в двух
формах: двухцепочечной репликативной,
функционирующей как плазмида, и
одноцепочечной фаговой, использующейся
в качестве матрицы для секвенирования.
Выделив после клонирования одноцепочечные
фаговые ДНК со вставкой (размер около
500 п.н.), праймер гибридизуют с
последовательностью вблизи вставки, и
проводят дидезоксисеквенирование.
Для
секвенирования
крупных фрагментов ДНК (около 2000 п,н.)
используют более сложные (комбинированные)
подходы. Один из них заключается в
предварительном клонировании данного
фрагмента в плазмидном векторе и
построении его подробной рестрикционной
карты, идентификации перекрывающихся
рестрикционных фрагментов длиной
100-500 п.н. Далее, субклонировав каждый из
этих фрагментов в ДНК M13 E.coli, их секвенируют
и определяют последовательность
исходного участка ДНК. Так как
субклонированные фрагменты могут быть
встроены в противоположных направлениях,
то праймер в одном случае будет
инициировать синтез первой цепи, а в
другом — комплементарной ей, а значит
возможно одновременное секвенирование
обеих цепей.
Для
секвенирования фрагментов ДНК
более 5000 п.н. используют методы
секвенирования двухцепочечных плазмидных
ДНК, не требующие субклонирования. Один
из них носит название «праймер-опосредованной
прогулки» («блуждающей затравки»). Суть
метода заключается в последовательном
дидезоксисеквенировании по 250-350 п.н.
Этапы метода представляют собой цепочку
циклов, включающих синтез праймера,
дидезоксисеквенирование и идентификацию
нуклеотидной последовательности:
1)
отжиг плазмидной ДНК, содержащей вставку,
с праймером, комплементарным
последовательности одной из цепей
векторной ДНК;
2)
дидезоксисеквенирование и идентификация
первых 250-350 п.н. вставки;
3)
синтез второго праймера, комплементарного
сегменту вставки, который отстоит от
места связывания первого праймера
примерно на 300 п.н., и секвенирование
следующих 250-350 п.н., и так далее, пока не
секвенируют весь фрагмент.
Обязательное
условие при секвенировании
очень длинных фрагментов иметь праймер
длиной не менее 24 нуклеотидов. Это
необходимо для того, чтобы избежать
спаривания праймера внутри вставки
более одного раза.
В
настоящее время широкое распространение
получила методология автоматического
ДНК-секвенирования
с использованием меченных различными
флуорохромами дидезоксинуклеотидов —
электрофорез в этом случае проводят на
одной дорожке и на электрофореграмме
каждому из нуклеотидов соответствует
свой цвет полосы, которую сканируют в
луче лазера, занося данные в компьютер,
который сопоставляет их и идентифицирует,
выводя на экран нуклеотидную
последовательность.. Этот метод широко
применялся в ходе реализации программы
«Геном человека». Использование
автоматических секвенаторов снизило
стоимость секвенирования одного звена
с 1 $ до 0,1 $.
Однако
существуют еще более быстрые методы
автоматического
секвенирования.
Один из них — секвенирование путем
гибридизации исследуемой последовательности
ДНК с набором олигонуклеотидов
(олигонуклеотидной матрицей), включающим
все возможные варианты перестановок
из 4 стандартных нуклеотидов (А, G, С, Т)
определенной длины. Наиболее удобными
считаются наборы матриц (чипы) из
октануклеотидов., при этом количество
возможных вариантов нуклеотидов
составляет 65536. Секвенируемый фрагмент
ДНК, меченный радиоактивным фосфором,
гибридизуется только с комплементарными
его участкам октануклеотидами.
В
результате определяется спектр
октануклеотидов,
составляющих исследуемый фрагмент ДНК.
Локализация октамеров в изучаемом
фрагменте ДНК устанавливается при
помощи специальной компьютерной
программы.
Метод
Максама-Гилберта
Используется
для секвенирования одно- и двухцепочечных
фрагментов ДНК.
Этапы метода:
-
специфическая
химическая фрагментация изучаемого
полинуклеотида -
фрагмент
ДНК метят радиоактивным изотопом 32Р
по 5′- или 3′-концу. У двухцепочечной ДНК
метятся обе цепи -
Подготовка
меченных фрагментов к секвенированию.
Для этого используются клонирующие
векторы, содержащие синтетические
полилинкеры. После гидролиза рестриктазами,
образующими липкие концы, с помощью
фрагмента Кленова избирательно метят
клонированные фрагменты по одному
концу. -
Меченные
фрагменты делят на порции и каждую
подвергают определенной химической
модификации. Еее проводят так, чтобы
на одну молекулу ДНК в среднем приходилось
по одной метке.
Пуриновые основания: диметилсульфат
– метилирование аденина по положению
N3, гуанина – N7. Обработка
0,1М HCl при температуре 0ºС приводит к
отщеплению метиладенина. Инкубация при
90ºС в щелочной среде (0,1М NaOH) вызывает
разрыв цепи ДНК в местах отщепления
оснований. При обработке пиперидином
происходит гидролиз цепи ДНК по остаткам
метилгуанина.
Пиримидиновые основания: гидразин.
Если реакцию вести в бессолевой среде,
то модифицируются тимин и цитозин, а в
присутствии 2М NaCl – только цитозин. При
обработке пиперидином происходит
гидролиз цепи ДНК пр точкам модификации
-
После
параллельного проведения четырех
различных обработок фрагмента ДНК
полученные субфрагменты разделяют
путем электрофореза в полиакриламидном
геле на соседних дорожках -
С помощью
радиоавтографии геля на рентгеновской
пленке считывается нуклеотидная
последовательность ДНК
Экспрессия в
клетках бактерий рекомбинантных ДНК
Одна
из важнейших задач генной инженерии –
создание штаммов бактерий или дрожжей,
линий клеток тканей животных или
растений, а также трансгенных растений
и животных, которые обеспечивали бы
эффективную экспрессию клонируемых в
них генов. Высокий уровень продукции
белков достигается в том случае, если
гены клонируются в многокопийных
векторах, т.к. при этом целевой ген будет
находиться в клетке в большом количестве.
Важно, чтобы кодирующая последовательность
ДНК находилась под контролем промотора,
который эффективно узнаётся РНК-полимеразой
клетки, а образующаяся мРНК была бы
относительно стабильной и эффективно
транслировалась. Кроме того, чужеродный
белок, синтезируемый в реципиентных
клетках, не должен подвергаться быстрой
деградации внутриклеточными протеазами.
При создании трансгенных животных и
растений часто добиваются тканеспецифичной
экспрессии вводимых целевых генов.
Любой полноценный ген состоит из двух
основных частей – регуляторной и
структурной. Регуляторная часть
распознается соответствующими ферментными
системами организма и обеспечивает
упорядоченную экспрессию его структурной
части. Она высокоспецифична в отношении
своих природных эффекторов (РНК-полимераз,
рибосом, факторов транскрипции и
трансляции, факторов сплайсинга и т.д.).
Чаще всего регуляторная часть не может
функционировать в другом генетическом
окружении.
Генетическая
информация передается по схеме ДНК →
(транскрипция) РНК → (трансляция) белок.
Это необходимые этапы для экспрессии
рекДНК.
Экспрессия
эукариотических генов в бактериальной
клетке является фундаментальным вопросом
биологии. Так как генетический код
универсален, то возможность такой
экспрессии определяется:
-
наличием
в изучаемом гене сигналов инициации и
терминации транскрипции и трансляции
2)
правильное узнавание их прокариотической
клеткой
Основные отличия
систем экспрессии про- и эукариот:
-
большинство
генов высших эукариот имеет прерывистую
экзон-интронную структуру, в результате
транскрипции таких генов образуется
матричная РНК–предшественник (пре-мРНК),
из которой при последующем сплайсинге
выщепляются некодирующие последовательности
– интроны, и образуется зрелая мРНК.
Такие гены не могут экспрессироваться
в клетках
бактерий, где отсутствует система
сплайсинга.
Эукариотические гены, имеющие непрерывную
кодирующую последовательность, иногда
способны правильно экспрессироваться
в клетках бактерий. -
У
прокариот существует одна РНК-полимераза,
синтезирующая все типы РНК. У эукариот
существуют три типа РНК-полимераз:
РНК-полимераза I
(синтезирует рибосомные РНК)
РНК-полимераза II
(матричные РНК)
РНК-полимераза
III (транспортные РНК)
-
Различия
по использованию кодонов, терминирующих
трансляцию: в эукариотических мРНК
используются все три терминирующих
кодона, а в прокариотических – только
один.
4)
Различия в последовательностях мРНК,
необходимых для инициации трансляции
5)
Различные последовательности,
ответственные за связывание транскриптов
с рибосомальными РНК
Автономная
экспрессия клонированного
гена возможна только в случае, если
инициация и терминация транскрипции
происходит полностью на клонируемом
фрагменте. В таком случае экспрессия
гена не зависит от типа вектора и
ориентации в нем встроенного фрагмента
ДНК.
При
инициации транскрипции на промоторе
вектора синтез полноценного белка,
детерминируемого клонированной
последовательностью, возможен только
при наличии в транскрипте участка
связывания бактериальной рибосомы.
Установление
экспрессии эукариотических генов в E.
coli
1)
функциональная комплементация (штамм
E. coli,
ауксотрофный по гистидину)
2)
селективные питательные среды: бактерии
не способны расти на питательной среде,
содержащей крахмал к качестве единственного
источника углерода. В плазмиду рВR322
встроили фрагменты хромосомной ДНК
дрозофилы и осуществили трансформацию
клеток E. coli гибридными ДНК. Среди
трансформантов выявлены клоны, растущие
на крахмале. Синтезируемая в E. coli
α-амилаза соответствует по своим
свойствам данному ферменту дрозофилы.
Клонирование
мозаичных генов высших эукариот в
клетках E. coli
-
С
помощью обратной транскриптазы на
молекулах мРНК синтезируется кДНК -
Достраиваются
вторые цепи на кДНК, в результате чего
образуются двухцепочечные ДНК-копии
мРНК -
Фрагменты
ДНК встраиваются в подходящий клонирующий
вектор коннекторным методом или с
помощью синтетических линкеров -
рекДНК
вводится в E. coli
К
генам, способным эффективно экспрессироваться
в эукариотических клетках, относят
гибридные
гены.
Это
гены, у
которых кодирующая последовательность
представлена эукариотической кДНК, а
сигналы инициации транскрипции и
трансляции имеют бактериальное
происхождение.
Пример:
1)
Экспрессирующий вектор + фрагмент гена
lacZ, содержащий промотор, участок
связывания рибосом и триплеты нескольких
первых аминокислот β-галактозидазы E.
coli, которые задают рамку трансляции
клонированной последовательности. При
совпадении рамок трансляции β-галактозидазы
и клонированной ДНК в бактериальных
клетках синтезируется эукариотический
белок, содержащий на N-конце дополнительно
несколько аминокислот β-галактозидазы.
Продукт экспрессии рекДНК представляет
собой химерный
белок.
2)
Плазмида pBR322, в которую по PstI участку
встроили кДНК проинсулина крысы в
составе гена β-лактамазы. При совпадении
рамок трансляции E. coli синтезирует
химерный белок, содержащий антигенные
детерминанты как инсулина, так и
β-лактамазы.
Целевой белок из
состава химерного можно извлечь с
помощью соответствующих протеаз.
Экспрессия
ген-эквивалентов эукариотических
полипептидов в клетках E. Coli
Ген-эквивалент
– это последовательность ДНК, кодирующая
зрелую форму полипептида.
Часть активных
полипептидов, таких как нейропептиды
или гормоны, обычно синтезируются в
виде предшественников, имеющих большую
молекулярную массу. В результате
специфического процессинга образуется
зрелый полипептид и низкомолекулярный
пептид. В бактериальной клетке для
большинства полипептидов правильный
процессинг из пре-белка невозможен. В
этих случаях в бактериальной клетке
необходимо клонировать последовательность
ДНК, кодирующую уже зрелую форму
полипептида.
Пример
Ген-эквивалент
соматостатина человека синтезируют
химическим методом и встраивают в
векторные плазмиды, содержащие фрагменты
lac-оперона E. coli. Если синтетический
фрагмент встраивали по сайту EcoRI
в конце гена β-галактозидазы, синтезировался
химерный белок, содержащий последовательности
как большей части β-галактозидазы, так
и соматостатина. Соматостатин высвобождают
из химерного белка, обрабатывая его
бромистым цианом.
Таким образом,
суть разработанного метода заключается
в следующем:
-
искусственный
ген встраивается внутрь структурного
гена, кодирующего определенный
бактериальный белок -
Инициация
синтеза РНК и белка происходят на
регуляторных участках бактериального
оперона, а терминация трансляции – на
нонсенс-кодонах синтетического гена -
Экспрессия
гибридного гена приводит к появлению
химерного белка, содержащего аминокислотную
последовательность бактериального
белка и пептида, кодируемого синтетическим
фрагментом ДНК -
Целевой
пептид выщепляется из состава химерного
белка специфическим химическим или
ферментативным гидролизом.
Этот
подход использовался для микробиологического
синтеза инсулина человека.
Инсулин
в клетках человека синтезируется в виде
препроинсулина.
Это препгормон, который синтезируется
на мембраносвязанных рибосомах и
содержит сигнальный пептид, обуславливающий
секрецию белка из клетки. В процессе
секреции сигнальный пептид отщепляется
от молекулы. Образующийся в результате
проинсулин
представляет собой сложную трехмерную
структуру с тремя дисульфидными
мостиками. Из середины проинсулина
выщепляется 35 аминокислот (С-цепь),
образуя А- и В-цепи, связанные дисульфидными
мостиками, обеспечивающими стабильность
четвертичной структуры зрелого белка.
Этапы микробиологического
синтеза инсулина:
-
химическим
путем синтезируются гены А и В-цепи
инсулина -
Синтезированные
фрагменты встраиваются в структурную
часть гена антранилсинтетазы в составе
векторной плазмиды в правильной рамке
трансляции -
Из
образовавшихся химерных полипептидов
бромистым цианом выщепляется
последовательность А и В-цепей -
А
и В-цепи смешиваются и химически
генерируются дисульфидные связи
Таким же способом
в 1981 г. был синтезирован лейкоцитарный
интерферон человека, а в 1983 г. – иммунный
интерферон.
Регуляция
транскрипции рекДНК в клетках E.
coli
У
бактерий транскрипция большинства
генов регулируется с помощью системы
белков-репрессоров и активаторов,
которые влияют на взаимодействие
РНК-полимеразы с транкрибируемыми
генами. В генной инженерии экспрессия
клонированных генов также должна
регулироваться, поскольку при избыточной
экспрессии продукты экспрессии могут
оказывать токсическое действие на
бактерии. Для этого конструируют системы,
в которых экспрессия клонируемых генов
подавлена (репрессирована) на ранних
фазах роста культур и дерепрессирована
в нужный момент времени.
Рассмотрим
две такие системы. В одном случае для
контроля экспрессии клонированных
генов используют систему регуляторных
элементов лактозного оперона, в другом
– систему промотор-репрессор-оператор
фага λ.
В
векторы вводятся регуляторные
последовательности фага λ и lac-оперона,
за которыми следуют полилинкеры с
несколькими уникальными сайтами
рестрикции. В тот же вектор вводится
ген-регулятор, кодирующий белок-репрессор.
В отсутствие индуцирующего воздействия
репрессор связывается с оператором,
препятствуя взаимодействию РНК-полимеразы
с промотором, под контролем которого
находится клонированный ген. Это приводит
к резкому снижению уровня транскрипции
этого гена и, соответственно низкому
содержанию белкового продукта. Для
индукции экспрессии в случае с lac—опероном
используют синтетический аналог
природного индуктора (алло-лактозы) –
изопропил-β-D-тиогалактопиранозид.
Индуктор связывается с молекулой
репрессора и нарушает его взаимодействие
с оператором. lac-промотор
становится доступным для РНК-полимеразы,
которая начинает транскрибировать
гены, расположенные за промотором.
В
системе репрессии –дерепрессии фага
λ используют ген репрессора, содержащий
температурочувствительную мутацию.
Мутантный белок –репрессор сохраняет
способность подавлять синтез РНК только
при температуре (28-30ºС). При повышении
температуры до 42ºС происходят инактивация
белка-репрессора и репрессия генов,
расположенных под контролем соответствующих
промоторов.
Для
обеспечения регулируемой тканеспецифической
экспрессии рекДНК в соматических клетках
животных и растений в составе векторов
используют энхансеры,
которые избирательно стимулируют
транскрипцию в соответствующих тканях,
клетки которых не экспрессируют
необходимые регуляторные белки.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #