27 октября 2021
В закладки
Обсудить
Жалоба
Одно из самых сложных заданий 1-й части ЕГЭ по химии 8-е задание на соответствие между названиями неорганических веществ и формулами реагентов, с каждым из которых возможна химическая реакция.
Согласно «Методическому анализу результатов ЕГЭ по химии» с 8-м заданием справляются менее 40% абитуриентов. Поэтому при подготовке к ЕГЭ этому заданию уделяем дополнительное внимание.
him-8.docx
him-8.pdf
Автор: Нарыжный Владимир Петрович.
Материал по химии
- Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
- 1) Взаимодействие металлов с кислородом
- 2) Взаимодействие металлов с водой
- 3) Амфотерные металлы
- 4) Амфотерные оксиды и гидроксиды
- 5) Комплексные соли
- 6) Амфотерные соли
- 7) Углерод на ЕГЭ
-
Азот на ЕГЭ
- 9) Фосфор на ЕГЭ
- 10) Сера на ЕГЭ
- 11) Замещение неметаллов
- 12) Взаимодействие неметаллов с другими неметаллами
- 13) Медь и её соединения
- 14) Серебро и его соединения
- 15) Хром и его соединения
- 16) Железо и его соединения
- 17) Соединения марганца
- 18) Неметаллы с щелочами
- 19) Кислотные оксиды с щелочами
- 20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
- 21) Гидролиз бинарных соединений с ковалентной полярной связью
- 22) Взаимный гидролиз
В данном материале мы рассмотрим только те реакции неорганической химии, что выходят за пределы свойств классов (солей, кислот, оксидов, оснований) и часто встречаются в 8 задании. В материале Вы познакомитесь с самыми популярными реакциями, которые встречаются на экзамене.
Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
1) Взаимодействие металлов с кислородом
- Натрий, как и другие щелочные металлы (кроме лития), а также барий, при взаимодействии с кислородом образуют пероксиды или надпероксиды:
2Na + O2 = Na2O2
Причем, для натрия более характерен пероксид, а для калия – надпероксид:
K + O2 = KO2
- Пероксиды реагируют с холодной и горячей водой по-разному: с холодной водой происходит реакция обмена:
Na2O2 + 2H2O = 2NaOH + H2O2
В горячей воде происходит окислительно-восстановительная реакция:
2Na2O2 + H2O = 4NaOH + O2↑
2) Взаимодействие металлов с водой
Основные продукты при взаимодействии металлов с водой можно представить в виде следующей схемы:
Задание 8 ЕГЭ по химии
- Активные металлы, такие как натрий, калий, кальций, легко реагируют с водой, вытесняя водород. Реакции относятся к экзотермическим (проходят с выделением большого количества тепла), натрий и калий так активно реагируют с водой, что при контакте происходит их возгорание.
2Na + 2H2O = 2NaOH + H2↑
- Магний и алюминий тоже образуют гидроксиды, но для реакции необходимо нагревание. Алюминий берут в виде амальгамы.
Mg + 2H2O = Mg(OH)2 + H2↑
- Металлы средней активности требуют нагревания для взаимодействия с водой, при этом образуется оксид, а не гидроксид:
Zn + H2O = ZnO + H2↑
- Железо при взаимодействии с водой образует окалину (смесь оксида железа II и оксида железа III):
3Fe + 4H2O = Fe3O4 + 4H2
- На влажном воздухе железо превращается в бурый гидроксид железа III:
2Fe + 3H2O + 3O2 = 2Fe(OH)3
Задание в формате ЕГЭ с ответом:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- K + H2O →
- K2O + H2O →
- K + O2 →
- K2O2 + H2Oхолод. →
- KOH
- K2O
- KOH + H2O2
- KOH + H2
- KO2
Пример задания из КИМ ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba + O2 →
- BaO + H2O →
- Ba + H2O →
- BaO2 + H2O (горяч.) →
- Ba(OH) 2 + O2
- BaO2
- Ba(OH) 2
- BaO
- Ba(OH) 2 + H2
От активности металла зависит продукт реакции
3) Амфотерные металлы
Алюминий, цинк и бериллий отличаются от других металлов тем, что могут вступать во взаимодействие с концентрированными растворами щелочей, понятие «амфотерные металлы» использовано для облегчения поиска, такое понятие не совсем верно.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4) Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды реагируют с концентрированными растворами щелочей, причем продукт зависит от агрегатного состояния исходной щелочи: если она твердая, то применяют сплавление и образуется средняя соль, если же щелочь дана в растворенном виде, то образуется комплексная соль. Эти различия очень часто встречаются в задании 8 на ЕГЭ по химии!
- При сплавлении:
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O↑
- При растворении в концентрированной щелочи:
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH = K2[Be(OH)4]
Можно брать любую щелочь и любой амфотерный оксид или гидроксид.
- Амфотерные оксиды, при сплавлении с солями, вытесняют летучие кислотные оксиды:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
K2SO3 + ZnO = K2ZnO2 + SO2↑
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Be + KOH р-р →
- BeO + KOH р-р →
- BeO + KOH тв. →
- Be(OH) 2 + KOH тв. →
- K2 [Be(OH) 4] + H2O
- K2 [Be(OH) 4] + H2
- K2O + Be(OH) 2
- K2 [Be(OH) 4]
- K2BeO2 + H2O
5) Комплексные соли
- Комплексные соли разлагаются при нагревании с потерей воды:
Na[Al(OH)4] = NaAlO2 + 2H2O
K2[Zn(OH)4] = K2ZnO2 + 2H2O
- Комплексные соли реагируют с сильными кислотами в двух вариантах (при избытке и при недостатке кислоты):
Na[Al(OH)4] + HCl = NaCl + H2O + Al(OH)3↓ (при недостатке кислоты)
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O (при избытке кислоты)
- Комплексные соли реагируют со слабыми кислотами и летучими кислотными оксидами, получаемые сульфиды, карбонаты, сульфиты алюминия неустойчивы, поэтому вместо них записывают гидроксид амфотерного металла:
2Na[Al(OH)4] + H2S = Na2S + 2Al(OH)3 + 2H2O (при недостатке сероводородной кислоты)
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O (при избытке сероводородной кислоты)
2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3 + H2O (при недостатке углекислого газа)
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 (в условиях избытка углекислого газа)
Попробуйте решить задание ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2 [Zn(OH) 4] нагревание →
- Na2 [Zn(OH) 4] + H2S изб. →
- Na2 [Zn(OH) 4] + H2S нед. →
- NaOH тв. + Zn(OH) 2 →
- NaHS + ZnS + H2O
- Na2S + Zn(OH) 2 + H2O
- Na2ZnO2 + H2O
- Na2S + Zn + H2O
- Na2ZnO2 + H2
6) Амфотерные соли
Термин «амфотерные соли» некорректен, однако за последний месяц было более четырех тысяч запросов с таким сочетанием слов, под амфотерными солями школьник понимает соли, в анионе которого стоит амфотерный металл, а также комплексные соли, описанные выше. На самом деле, соли в которых амфотерный металл принадлежит аниону следует относить к самым обычным средним солям. Рассмотрим свойства некоторых из них, например, цинката натрия (Na2ZnO2) и алюмината калия (KAlO2).
- Реагируют с сильными кислотами:
Na2ZnO2 + 4HCl = 2NaCl + ZnCl2 + 2H2O
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Б) Растворяются в воде с образованием соответствующей комплексной соли:
KAlO2 + 2H2O = K[Al(OH)4]
- Также под амфотерными солями школьники подразумевают соли, содержащие в катионе металл в третьей валентности (что тоже является неверным, это средние соли) или цинк и бериллий, такие соли могут по-разному реагировать с растворами щелочей, например:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 (недостаток щелочи, разбавленный раствор щелочи)
AlCl3 + 4NaOH = NaCl + Na[Al(OH)4] (избыток щелочи, концентрированный раствор щелочи)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2BeO2 + H2SO4 →
- Na2 [Be(OH) 4] + H2SO4 изб. →
- Na2 [Be(OH) 4] + H2SO4 нед. →
- Na2BeO2 + H2O →
- Na2SO4 + BeSO4 + H2O
- Na2SO4 + Be(OH) 2
- Na2SO4 + Be(OH) 2 + H2O
- Na2 [Be(OH) 4]
- NaOH + BeSO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + KOH разб. →
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH конц. →
- Al2O3 + K2CO3 тв. →
- Al(OH) 3 + KCl
- KCl + KAlO2 + H2O
- KAlO2 + CO2
- K[Al(OH) 4] + KCl
- Al(OH) 3 + KCl + CO2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba(OH) 2 нед. + AlCl3 →
- Ba(OH) 2 изб. + AlCl3 →
- Ba(AlO2)2 + HCl →
- Ba[Al(OH) 4]2 + HCl изб. →
- Ba(OH) 2 + AlCl3 + H2O
- BaCl2 + Ba[Al(OH) 4]2
- BaCl2 + AlCl3 + H2O
- BaCl2 + Al(OH) 3 + H2O
- BaCl2 + Al(OH) 3
7) Углерод на ЕГЭ
В задании 8 часто встречаются гидрокарбонаты, рассмотрим их важнейшие свойства на примере гидрокарбоната кальция.
Гидрокарбонаты, как и другие кислые соли, при взаимодействии с щелочами, оксидами, солями, кислотами и при нагревании часто превращаются в средние соли.
- Разложение при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Взаимодействие с щелочами:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Взаимодействие с кислотами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Реакция с карбонатами. Эти реакции идут с образованием кислых солей, необходимый для их образования водород поступает из воды, поэтому составители используют такие обозначения как CO2 р-р или CaCO3 влажн., реакция идет по следующей схеме:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ
Восстановление углерода активными металлами и углеродом:
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
- Реакции с монооксидом углерода:
- CO или угарный газ – хороший восстановитель, реагирует с окислителями:
CO + CuO = CO2 + Cu
CO + Cl2 = COCl2
CO + Br2 = COBr2
2CO + O2 = 2CO2
- Монооксид углерода проявляет и окислительные свойства:
СO + H2 = CH3OH
- Вступает в реакции без изменения степени окисления:
CO + NaOHтв. = HCOONa (при сплавлении)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KHCO3 + Ca(OH) 2 →
- Mg(HCO3)2 + H2CrO4 →
- MgCO3 + H2CrO4 →
- Ca(HCO3)2 + KOH →
- Cr2O3 + MgCO3 + H2O
- KOH + Ca(HCO3)2
- CaCO3 + K2CO3 + H2O
- MgCrO4 + H2O + CO2
- CaO + K2CO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Mg + CO2 →
- MgO + CO2 →
- Mg(HCO3)2 + NaOH →
- MgCl2 + Na2CO3 →
- MgO + C
- MgCO3
- Mg + CO
- MgCO3 + Na2CO3 + H2O
- MgCO3 + NaCl
 Азот на ЕГЭ
Азот на ЕГЭ
Очень популярной в заданиях ЕГЭ по химии является азотная кислота, в отличие от обычных кислот, в качестве окислителя выступает не протон водорода, а азот в высшей степени окисления.
В общем, схему реакции кислоты с металлами можно представить в следующем виде:
HNO3 + Me → Me+x(NO3)x + H2O + особый продукт
Особые продукты зависят от характера металла, приведем из в виде таблицы:
Таблица – свойства азотной кислоты
|
Реагент |
HNO3 концентрированная |
HNO3 разбавленная |
|
Активные металлы (металлы IA и IIА-группы в таблице Менделеева) |
N2O (редко NO) |
NH4NO3 (редко N2 или NH3) |
|
Неактивные металлы Cu, Ag, Hg |
NO2 |
NO |
|
Cr, Al, Fe |
На холоде реакция не идёт в следствие пассивации, При нагревании образуется NO2, а металл приобретает степень окисления +3 |
NO (редко N2, N2O) |
|
Металлы средней активности (все остальные металлы, например, Zn, Ni, Co) |
NO2 |
NO (редко N2, N2O) |
|
Au, Pt |
Реакция не идет |
Реакция не идет |
- Примеры реакций металлов с азотной кислотой:
4HNO3 разб. + Al = Al(NO3)3 + NO + 2H2O (при любой температуре)
6HNO3 конц. + Al = Al(NO3)3 + 3NO2 + 3H2O (реакция идет только при нагревании)
10HNO3 разб. + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3 конц. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- C другими восстановителями азотные кислоты ведут себя аналогичным образом: у концентрированной продуктом является NO2, а у разбавленной – NO:
FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O
3FeO + 10HNO3 разб. = 3Fe(NO3)3 + NO + 5H2O
- Азотная кислота реагирует и с неметаллами, например, с серой и углеродом:
6HNO3 конц. + S = H2SO4 + 6NO2 + 2H2O
4HNO3 конц. + С = CO2 + 4NO2 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CuO + HNO3 конц. →
- CuO + HNO3 разб. →
- Cu + HNO3 конц. →
- Cu + HNO3 разб. →
- Cu(NO3)2 + H2O + NO2
- CuO + NO2 + O2
- Cu(NO3)2 + H2O
- Cu(NO3)2 + H2O + NO
- CuNO3 + H2O + NO
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- FeO + HNO3 конц. →
- Fe + HNO3 конц. tºC →
- Fe(NO3)2 + HNO3 конц. →
- FeO + HNO3 разб. →
- Fe(NO3)2 + H2O + NO2
- Fe(NO3)3 + H2O + NO2
- Fe(NO3)2 + H2O + NO
- Fe(NO3)3 + H2O + NO
- Fe(NO3)2 + H2O
9) Фосфор на ЕГЭ
- Фосфор выступает в роли окислителя и восстановителя в реакции с щелочами:
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
Это одна из самых популярных окислительно-восстановительных реакций с фосфором на ЕГЭ по химии.
- оксид фосфора III реагирует с холодными растворами щелочей и водой без изменения степени окисления:
P2O3 + 2KOH + H2O → 2KH2PO3
P2O3 + 3H2O → 2H3PO3 (или HPO2)
- Соединения фосфора III – хорошие восстановители, стремятся превратиться в соединения фосфора V:
P2O3 + окислитель → PO43‒ + продукты восстановления
P2O3 + 4KMnO4 + 10KOH → 2K3PO4 + 4K2MnO4 + 5H2O
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
- Оксид фосфора V реагирует с водой, образуя ряд кислот:
P2O5 + H2O → 2HPO3 – метафосфорная (в сильном недостатке воды)
P2O5 + 2H2O → H4P2O7 – пирофосфорная (в небольшом недостатке воды)
P2O5 + 3H2O → 2H3PO4 – ортофосфорная (в избытке воды)
- Фосфаты могут образовывать кислые соли, при взаимодействии с фосфорной кислотой:
2K3PO4 + H3PO4 → 3K2HPO4
K3PO4 + 2H3PO4(большой избыток) → 3KH2PO4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaH2PO4 + NaOH нед. →
- NaH2PO4 + NaOH изб. →
- NaH2PO4 изб. + NaOH →
- NaH2PO4 нед. + NaOH →
- Na3PO4 + H2O
- NaH2PO3 + H2O
- Na3PO4 + P2O5
- NaH2PO2 + H2O
- Na2HPO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P2O5 + H2O нед. →
- P2O3 + KOH →
- P + KOH →
- P2O5 нед. + H2O →
- K2HPO3 + H2O
- KH2PO2 + PH3
- HPO3
- H3PO4
- HPO2
10) Сера на ЕГЭ
Таблица ‒ Серная кислота
|
Свойства |
Разбавленная H2SO4 |
Концентрированная H2SO4 |
|
Окислительные свойства |
Окислитель за счет протона водорода |
Окислитель за счет серы |
|
Активные металлы |
2Na + H2SO4 = Na2SO4 + H2 |
8Na + 5H2SO4 = 4Na2SO4 + 4H2O + H2S↑ |
|
Металлы средней активности |
Zn + H2SO4 = ZnSO4 + H2 |
3Zn + 4H2SO4 = 3ZnSO4 + 4H2O + S↓ (в зависимости от концентрации кислоты может выделиться SO2 или H2S) |
|
Al, Cr, Fe |
Как с другими металлами до водорода: Fe + H2SO4 = FeSO4 + H2 |
На холоде реакция не идет (пассивация), при нагревании: 2Fe + 6H2SO4 = Fe2(SO4)3 + 6H2O + 3SO2 |
|
Металлы средней активности |
Реакция не идет, так как эти металлы не могут вытеснить водород |
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 |
- Обменная реакция с концентрированной серной кислотой:
NaCl + H2SO4 конц. = NaHSO4 + HCl↑ (при сильном нагревании)
Остальные обменные реакции стандартны и в этом материале рассмотрены не будут.
- Сероводород:
SO2 + 2H2S = 3S↓ + 2H2O
2H2S + 3O2 = 2H2O + 2SO2 (кислород в избытке)
2H2S + O2 = 2H2O + 2S↓ (кислород в недостатке)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KCl тв. + H2SO4 конц. →
- KI + H2SO4 конц. →
- Fe + H2SO4 конц. tºC →
- FeO + H2SO4 конц. →
- Cl2 + K2SO4 + H2O
- KHSO4 + HI
- KHSO4 + HCl
- I2 + K2SO4 + H2S
- Fe2 (SO4)2 + H2O + SO2
- FeSO4 + H2O
11) Замещение неметаллов
Часто в задании 8 ЕГЭ по химии встречается замещение брома на хлор, или йода на хлор или бром. Галогены могут вытеснять друг друга и другие неметаллы из соединений. Чтобы понимать, какие неметаллы могут вытеснить другие неметаллы, нужно помнить о том, что в ПС Д.И. Менделеева элементы стоят таким образом, что чем правее и выше стоит элемент, тем сильнее проявляются его неметаллические свойства, и тем выше его электроотрицательность. Более электроотрицательные неметаллы могут вытеснять менее электроотрицательные. Так, хлор и бром стоят выше в таблице Менделеева, чем йод, поэтому могут вытеснить его из соединений:
2NaI + Br2 = 2NaBr + I2
2KI + Cl2 = 2KCl + I2
Хлор может вытеснить бром:
2NaBr + Cl2 = 2NaCl + Br2
Йод не может вытеснить другие галогены, так как расположен в ПС ниже хлора, брома и фтора, но йод может вытеснить те элементы-неметаллы, что стоят левее в Периодической системе, например, серу:
H2S + I2 = 2HI + S
Можно использовать ряд электроотрицательности неметаллов, на реальном ЕГЭ его не будет, легче запомнить Периодический закон, тем более что эти знания также нужны для выполнения задания 2 ЕГЭ по химии.
12) Взаимодействие неметаллов с другими неметаллами
Более электроотрицательные неметаллы могут окислить менее электроотрицательные неметаллы. То есть те элементы, которые стоят в ПС выше и правее отнимают электроны у тех неметаллов, которые стоят ниже и левее.
Например, хлор, бром и фтор могут окислить йод, серу, фосфор (наиболее популярные на ЕГЭ реакции). В таблице представлены наиболее популярные продукты:
Таблица – взаимодействие неметаллов
|
Восстановители |
Окислители |
|||||
|
F2 |
Cl2 |
Br2 |
I2 |
O2 |
S |
|
|
I2 |
IF7 IF5 |
ICl5 ICl3 ICl |
IBr5 IBr3 IBr |
‒ |
‒ |
‒ |
|
S |
SF6 |
SCl4 |
SBr4 |
‒ |
SO2 |
‒ |
|
P |
PF5 |
PCl5 PCl3 |
PBr5 PBr3 |
PI3 |
P2O3 P2O5 |
P2S3 P2S5 |
|
Si |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiO2 |
SiS2 |
|
H2 |
HF |
HCl |
HBr |
HI |
H2O |
H2S |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + O2 →
- SO2 + O2 →
- H2S + SO2 →
- S + P →
- S + H2O
- SO2
- P2S3
- SO3
- S3P2
13) Медь и её соединения
2CuCl2 + 4KI = 2CuI↓ + I2 + 4KCl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 – темно-синий комплекс
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH – прозрачный раствор
3CuO + 2NH3 = 3Cu + N2 + 3H2O
14) Серебро и его соединения
AgCl + 2NH3 = [Ag(NH3)2]Cl
8AgNO3 + PH3 + 4H2O = H3PO4 + 8Ag + 8HNO3
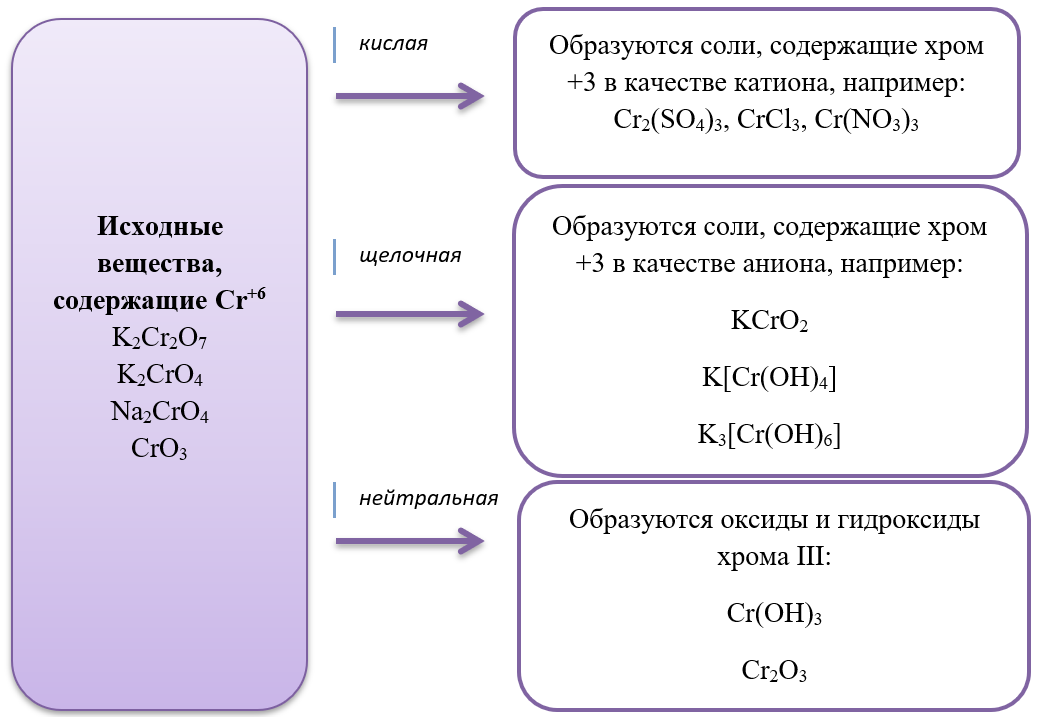
15) Хром и его соединения
- Соединения хрома II – хорошие восстановители, при взаимодействии с окислителями превращаются в соединения хрома III
4CrO + O2 = 2Cr2O3
CrO + 4HNO3 = Cr(NO3)3 + 2H2O + NO2
- соединения хрома III проявляют как окислительные, так и восстановительные свойства:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 6NaBr + 8H2O + 2Na2CrO4 (хром в степени окисления +3 является восстановителем)
2CrCl3 + H2 = 2CrCl2 + 2HCl (хром в степени окисления +3 является восстановителем)
- Дихроматы – соли, окрашивающие растворы в оранжевый цвет и хроматы – соли желтого цвета устойчивы в разных средах: в кислой среде устойчивы оранжевые дихроматы, а в щелочной – желтые хроматы. В зависимости от среды, они могут взаимно превращаться:
Хромат превращается в дихромат в кислой среде, раствор меняет цвет с желтого на оранжевый.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Дихромат превращается в хромат в щелочной среде, раствор меняет цвет с оранжевого на желтый.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
В ЕГЭ по химии стали уже традиционными задания с соединениями хрома, особенно с дихроматами, в основном встречается их окислительно-восстановительные свойства:
16) Железо и его соединения
- Железо реагирует с концентрированной азотной и серной кислотой только при нагревании, с разбавленными кислотами реагирует при нормальных условиях, например:
Fe + 6HNO3 конц = Fe(NO3)3 + 3NO2 + 3H2O (при нагревании)
- Взаимодействие железа с галогенами и галогенводородами:
Таблица – Железо с галогенами и галогеноводородами
|
С галогенами |
С галогенводородом |
|
2Fe + 3Cl2 = 2FeCl3 |
Fe + 2HCl = FeCl2 + H2 |
|
2Fe + 3Br2 = 2FeBr3 |
Fe + 2HBr = FeBr2 + H2 |
|
Fe + I2 = FeI2 |
Fe + 2HI = FeI2 + H2 |
- Соединения двухвалентного железа – хорошие восстановители, с окислителями превращаются в соединения трехвалентного железа:
FeO + 4HNO3 конц = Fe(NO3)3 + NO2 + 2H2O
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- Железная окалина – двойной оксид Fe3O4 или FeO·Fe2O3, проявляет как окислительные (за счет оксида железа III), так и восстановительные (за счет железа II) свойства, а также растворяется в кислотах, образуя две соли (железа II и железа III)
Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O (оксиды железа растворились в разбавленной серной кислоте без изменения степени окисления)
Fe3O4 + 8KI + 4H2SO4 = 3FeI2 + 4K2SO4 + I2 + 4H2O (железная окалина проявляет окислительные свойства за счет наличия железа III)
Fe3O4 + 10HNO3конц = 3Fe(NO3)3 + NO2 + 5H2O (железная окалина проявляет восстановительные свойства за счет железа II)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + I2 →
- Fe + Cl2 →
- Fe + HCl →
- Fe + O2 →
- FeI3
- FeCl2
- FeI2
- FeCl3
- FeO
- Fe3O4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + CuSO4 →
- Fe + H2SO4 р-р →
- Fe + H2SO4 конц. tºC →
- Fe + H2O + O2 →
- FeSO4 + Cu
- FeSO4 + H2
- Fe2(SO4)3 + Cu
- Fe2 (SO4)3 + H2
- Fe2(SO4)3 + SO2 + H2O
- Fe(OH) 3
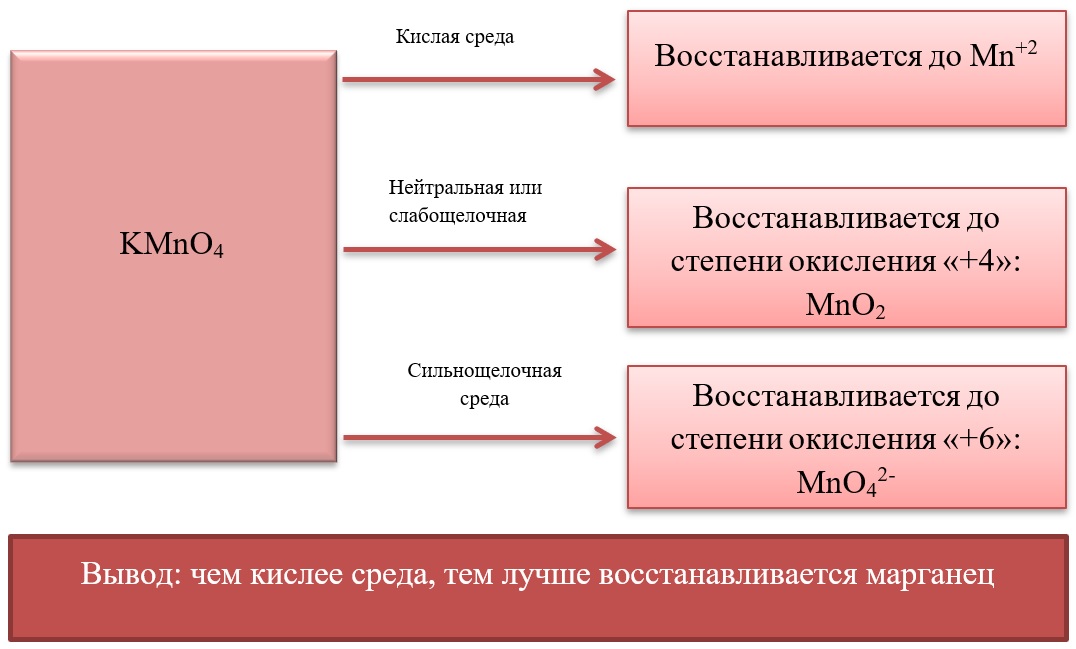
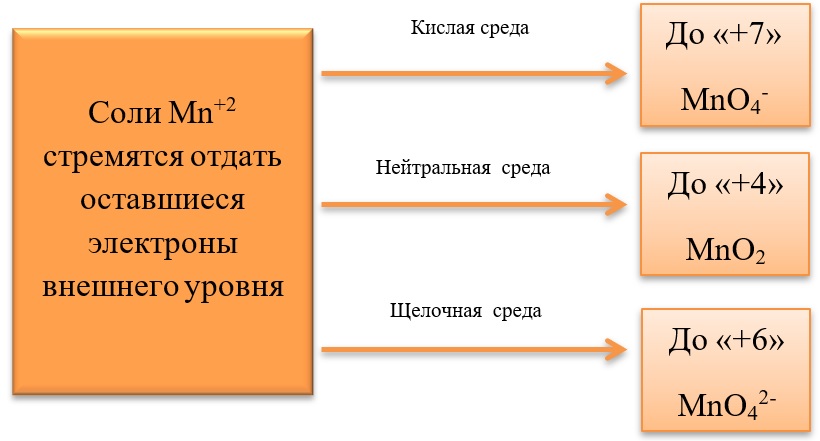
17) Соединения марганца
- Марганец в степени окисления +7 проявляет окислительные свойства. Продукты его восстановления зависят от среды:
Примеры реакция перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2KMnO4 + SO2 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
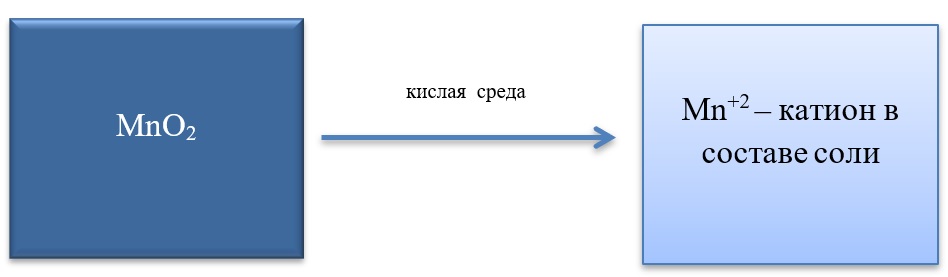
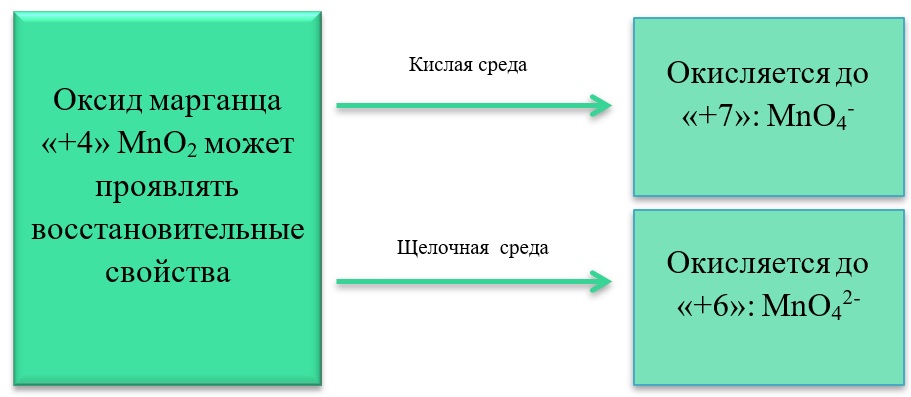
- Марганец в степени окисления +4 проявляет как окислительные. Так и восстановительные свойства.
Окислительные свойства чаще проявляет в кислой среде, восстанавливаясь до катиона +2.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + H2O2 + H2SO4 → O2 + MnSO4 + 2H2O
В) Марганец в степени окисления +4 проявляет и восстановительные свойства, окисляясь до +6 в щелочной среде, и до +7 в кислой:
MnO2 + Br2 + 4KOH = K2MnO4 + 2KBr + 2H2O
- Соединения марганца II, например, MnSO4 проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства проявляет в реакциях с более активными металлами, например, с алюминием:
3MnSO4 + 2Al = 3Mn + Al2(SO4)3
Восстановительные свойства проявляет при взаимодействии с типичными окислителями.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
18) Неметаллы с щелочами
- Галогены с щелочами:
Хлор, бром и йод реагируют с щелочами при разных условиях. На холоде окисления галогена происходит чаще до степени окисления +1 (восстановление в любых условиях происходит до степени окисления ‒1). Описать данную реакцию можно уравнением:
Г2 + 2NaOH = NaГ + NaГO + H2O (вместо гидроксида натрия можно взять любую щелочь, содержащую одновалентный металл: K, Cs, Rb)
2Г2 + 2Ca(OH)2 = CaГ2 + Ca(ГO)2 + 2H2O (вместо гидроксида кальция можно брать гидроксид бария и стронция).
Где Г = I, Cl, Br
Например:
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
При нагревании окисление галогена часто проходит до степени окисления +5:
3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O
6Г2 + 6Ca(OH)2 = 5CaГ2 + Ca(ГO3)2 + 6H2O
Например:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
6Cl2 + 6Ca(OH)2 = 5CaCl2 + Ca(ClO3)2 + 6H2O
Обращайте внимание на температуру, от Вашей внимательности зависят Ваши баллы на ЕГЭ по химии!
- Сера, селен и теллур тоже реагируют с щелочами по одной схеме:
3Э + 6NaOH = 2Na2Э + Na2ЭO3 + 3H2O
3Э + 3Ca(OH)2 = 2CaЭ + CaЭO3 + 3H2O
Например:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O
- Фосфор с щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Кремний с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + NaOH →
- SO2 + NaOH →
- SO3 + NaOH →
- H2S + NaOH →
- NaHS + S + H2O
- Na2SO4 + H2O
- Na2S + Na2SO3 + H2O
- Na2SO3 + H2O
- Na2S + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P + NaOH →
- P2O3 + NaOH →
- P2O5 + NaOH изб. →
- P2O5 + NaOH нед. →
- NaH2PO2
- NaH2PO3
- Na3P
- Na3PO4
- NaH2PO4
19) Кислотные оксиды с щелочами
Кислотные оксиды реагируют с щелочами, образуя соль и воду, к нестандартным реакциям относят взаимодействие диоксида азота с щелочами, продукты которого зависят от наличия в среде кислорода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + Cl2O →
- NaOH + NO2 + O2 →
- NaOH + Cl2O3 →
- NaOH + HNO3 →
- NaClO + H2O
- NaCl + HCl
- NaClO2 + H2O
- NaNO3 + H2O
- NaNO2 + NaNO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + SO2 →
- NaOH + SO3 →
- NaOH + NO2 →
- NaOH + P2O5 →
- NaNO3 + NaNO2 + H2O
- Na2SO4 + H2O
- NaNO2 + H2O
- NaH2PO4
- NaH2PO3
- Na2SO3 + H2O
20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
Многие неметаллы реагируют с активными металлами, образуя соли или солеподобные вещества, легко гидролизующиеся в воде или кислотах.
Для начала рассмотрим схемы образования этих веществ. В них неметалл часто проявляет низшую степень окисления (значение низшей степени окисления легко определяется по номеру группы: для этого от номера группы нужно отнять 8, например, для азота это будет 5 ‒ 8 = ‒3)
Таблица – Степени окисления, которые принимают неметаллы при взаимодействии с активными металлами:
|
С |
Si |
N и P |
S, Se, Te |
F, Cl, Br, I |
|
‒4 (с Na, K, Al) ‒1 (с Ca, Mg) |
‒4 |
‒3 |
‒2 |
‒1 |
|
Карбиды |
Силициды |
Нитриды и фосфиды |
Сульфиды, селениды, теллуриды |
Фториды, хлориды, бромиды, йодиды |
Степени окисления активных металлов равны номеру группы, в которой они стоят в ПС.
4Na + C = Na4C
4Al + 3C = Al4C3
Ca + 2C = CaC2
4K + Si = K4Si
3Ca + N2 = Ca3N2
3K + P = K3P
2Al + 3S = Al2S3
Ba + Cl2 = BaCl2
Практически все эти вещества, за исключением некоторых сульфидов и галогенидов (хлоридов, бромидов, йодидов, фторидов) неустойчивы в растворах и подвергаются мгновенному гидролизу, который стоит рассматривать как обычную обменную реакцию с водой:
K3P + 3HOH = 3KOH + PH3↑
Na4Si + 4HOH = 4NaOH + SiH4↑
Ca3N2 + 6HOH = 3Ca(OH)2 + 2NH3↑
Продукт гидролиза карбидов зависит от степени окисления углерода в исходном веществе: если она равна ‒1, то образуется ацетилен (C2H2), а если ‒4, то метан (CH4).
Al4C3 + 12HOH = 4Al(OH)3 + 3CH4↑
CaC2 + 2HOH = Ca(OH)2 + C2H2↑
Так же происходит их кислотный гидролиз:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Ba3P2 + 3H2SO4 = 3BaSO4 + 2PH3↑
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- MgC2 + H2O →
- Na4C + H2O →
- Mg3P2 + H2O →
- Na3P + H2O →
- NaOH + C2H2
- Mg(OH) 2 + CH4
- Mg(OH) 2 + PH3
- NaOH + CH4
- Mg(OH) 2 + C2H2
- NaOH + PH3
21) Гидролиз бинарных соединений с ковалентной полярной связью
При гидролизе бинарных соединений неметаллов важно помнить, что степень окисления неметаллов не изменяется, из неметалла с положительной степенью окисления образуется кислотный гидроксид (кислородсодержащая кислота), из отрицательно заряженного неметалла образуется бескислородная кислота:
PCl5 + 4H2O = H3PO4 + 5HCl
SF6 + 4H2O = H2SO4 + 6HF
ICl3 + 2H2O = HIO2 + 3HCl
Для образования гидроксидов неметаллов можно воспользоваться следующей таблицей:
|
Степень окисления неметалла |
Э+1 |
Э+3 |
Э+4 |
Э+5 |
Э+6 |
Э+7 |
|
Соответствующая кислота (кислотный гидроксид) |
НЭО |
HЭO2 Или H3ЭO3 |
H2ЭO3 |
HЭO3 Или H3ЭO4 |
H2ЭO4 |
HЭO4 |
|
Примеры |
HClO |
HClO2 H3PO3 |
H2SO3 |
HIO3 H3PO4 |
H2SO4 |
HClO4 |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- ICl + H2O →
- ICl3 + H2O →
- ICl5 + H2O →
- ICl7 + H2O →
- HClO3 + HI
- HIO + HCl
- HIO4 + HCl
- HIO2 + HCl
- HIO3 + HCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- PCl3 + H2O →
- SCl4 + H2O →
- SiCl4 + H2O →
- PCl5 + H2O →
- H2SO4 + HCl
- H2SiO3 + HCl
- H3PO3 + HCl
- SO2 + HCl
- HPO3 + HCl
22) Взаимный гидролиз
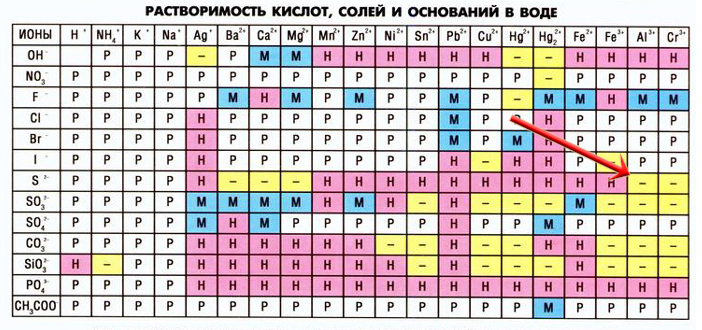
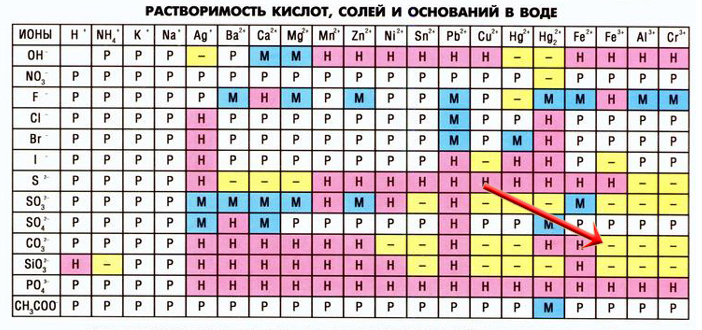
При взаимодействии некоторых солей могут образоваться новые соли, неустойчивые в растворах, в таких случаях в таблице растворимости на пересечении катиона и аниона мы видим прочерк (не существует или необратимо разлагается водой), например, сульфид алюминия:
Сульфид алюминия образуется в реакциях между растворимыми сульфидами и солями алюминия:
3Na2S + 2AlCl3 = 6NaCl + Al2S3
Но данная запись неверна, так как сульфида алюминия не существует в растворах, записываем уравнение гидролиза этой соли:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Объединим первое уравнение со вторым(левую часть первого уравнение соединяем с левой частью второго уравнения, а правую с правой, все коэффициенты сохраняем):
3Na2S + 2AlCl3 + Al2S3 + 6H2O = 6NaCl + Al2S3 + 2Al(OH)3↓ + 3H2S↑
Сокращаем сульфид алюминия, так как он есть и в правой части реакции, и в левой:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3H2S↑ — так выглядит реакция взаимодействия растворов сульфида натрия и хлорида алюминия.
Рассмотрим еще один пример — взаимодействие карбоната калия и нитрата железа III:
3K2CO3 + 2Fe(NO3)3 = Fe2(CO3)3 + 6KNO3
Образовавшийся карбонат железа III разлагается в воде:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Соединяем два уравнения:
3K2CO3 + 2Fe(NO3)3 + Fe2(CO3)3 + 3H2O = Fe2(CO3)3 + 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Сокращаем карбонат железа III с обеих сторон:
3K2CO3 + 2Fe(NO3)3 + 3H2O = 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Взаимный гидролиз попался мне на реальном досрочном ЕГЭ по химии 2022 во второй части!
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CrCl3 + NaOH изб. →
- CrCl3 + NaOH нед. →
- CrCl3 + Na2S р-р →
- Cr2O3 + Na2SO3 →
- Cr(OH) 3 + NaCl + SO2
- NaCl + Cr(OH) 3
- Cr(OH) 3 + NaCl + H2S
- NaCrO2 + SO2
- Na3 [Cr(OH) 6] + NaCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH изб. →
- AlCl3 + KOH нед. →
- Al2O3 + K2CO3 →
- KCl + K[Al(OH) 4]
- Al(OH) 3 + KCl + CO2
- Al2 (CO3)3 + KCl
- KAlO2 + CO2
- Al(OH) 3 + KCl
За это задание ты можешь получить 2 балла. На решение дается около 7 минут. Уровень сложности: повышенный.
Средний процент выполнения: 48.6%
Ответом к заданию 8 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Установите соответствие между реагирующими веществами и продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) $NH_4Cl$ и $NaNO_2$ Б) $(NH_4)_2Cr_2O_7$ (нагревание) В) Mg и $HNO_3$ (оч. разб.) Г) Ag и $HNO3$ (конц.) |
1) $NO_2$ 2) $N_2$ 3) $NH_4NO_2$ 4) $(NH_4)_2CrO_4$ 5) NO 6) $NH_4NO_3$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $NH_4Cl + NaNO_2 = N_2 + 2H_2O + NaCl$
Б) $(NH_4)_2Cr_2O_7 →↖{t°C} N_2 + Cr_2O_3 + 4H_2O$
В) $4Mg + 10HNO_3 → 4Mg(NO_3)_2 + NH_4NO_3 + 3H_2O$
Г) $Ag+2HNO_{3(конц.)} =AgNO_3+NO_2+H_2O$
Ответ: 2261
Задача 2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $H_2SO_4$ (конц.) и C Б) $H_2SO_4$ (конц.) и S В) $H_2SO_4$ (конц.) и Cu Г) $H_2SO_4$ (конц.) и Ag |
1) $CO_2$, $SO_2$ и $H_2O$ 2) $Ag_2SO_4$, $SO_2$ и $H_2O$ 3) $SO_2$ и $H_2O$ 4) $CuSO_4$ и $H_2$ 5) $CuSO_4$, $SO_2$ и $H_2O$ 6) $Ag_2SO_4$ и $H_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Окисляющие кислоты окисляют углерод в углекислый газ (1)
Б) овр, где сера принимает среднюю степень окисления +4, ответ (3)
В) так как кислота конц., а металл неактивный, то в продуктах должен быть сернистый газ как продукт восстановления серной кислоты, ответ (5)
Г) рассуждаем так же, как в В, ответ (2)
Ответ: 1352
Задача 3
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Al и KOH (р-р) Б) Al и $H_2SO_4$ (разб.) В) $Al_2S_3$ и $H_2O$ Г) Al (без плёнки) и $H_2O$ |
1) гидроксид алюминия и сера 2) гидроксид алюминия и сероводород 3) тетрагидроксоалюминат калия и водород 4) сульфат алюминия и водород 5) сульфит алюминия и водород 6) гидроксид алюминия и водород |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Алюминий — амфотерный металл, поэтому в реакциях с раствором щелочей он даёт комплексные соли — тетрагидроксоалюминаты, в данном случае — калия, при этом также выделяется водород.
Б) В реакции с разбавленной серной кислотой алюминий не проявляет способность к пассивации и реагирует как типичный металл — замещая водород. Продукт реакции — сульфат алюминия и водород.
В) $Al_2S_3$ — сульфид алюминия — соль с катионом слабого основания и анионом слабой кислоты, подвергается полному гидролизу, при этом образуется осадок гидроксида алюминия и газообразный сероводород.
Г) Взаимодействуя с водой (реакция идёт при нагревании), алюминий замещает водород, который выделяется в виде простого вещества, при этом образуется нерастворимый гидроксид алюминия.
Ответ: 3426
Задача 4
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) РЕАКЦИИ |
| А) Fe и $HNO_3$ (конц.) Б) Fe и $H_2SO_4$ (разб.) В) Fe, $O_2$ и $H_2O$ Г) FeS и $O_2$ |
1) оксид железа(III) и оксид серы(IV) 2) гидроксид железа(II) 3) гидроксид железа(III) 4) сульфат железа(II) и водород 5) нитрат железа(II), оксид азота(II) и вода 6) нитрат железа(III), оксид азота(IV) и вода |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Fe и $HNO_{3(конц.)}$. Железо в реакциях с окисляющими кислотами точно окисляется до степени окисления +3. А вот продукты восстановления азотки могут быть разные в пределах подходящих продуктов по табличке. Но ориентируемся на степень окисления железа в первую очередь. Продукты реакции: нитрат железа (III), оксид азота (IV) и вода.
Б) Fe и $H_2SO_{4(разб.)}$. Разбавленная серная кислота не проявляет особенных свойств и реагирует с металлами как большинство других кислот — металл замещает водород, в данном случае образуется сульфат железа (II) и водород.
В) Fe, $O_2$ и $H_2O$. Реагируя с водой в присутствии кислорода железо ржавеет — образуется осадок гидроксида железа(III).
Г) При горении FeS образуется два оксида: оксид железа (III) и оксид серы (IV).
Ответ: 6431
Задача 5
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) РЕАКЦИИ |
| А) Fe и $Cl_2$ Б) Fe и HCl (конц.) В) Cu и $HNO_3$ (конц.) Г) Cu и $HNO_3$ (разб.) |
1) $FeCl_2$ 2) $FeCl_3$ 3) $FeCl_2$ и $H_2$ 4) $Cu(NO_3)_2$ и $H_2$ 5) $Cu(NO_3)_2$, NO и $H_2O$ 6) $Cu(NO_3)_2$, $NO_2$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) $2Fe + 3Cl_2 = 2FeCl_3$
Б) $Fe + 2HCl_{(конц.)} = FeCl_2 + H_2$
В) $Cu + 4HNO_{3(конц.)} = Cu(NO_3)_2 + 2NO_2 + 2H_2O$
Г) $3Cu + 8HNO_{3(разб.)} = 3Cu(NO_3)_2 + 2NO + 4H_2O$
Ответ: 2365
Задача 6
Установите соответствие между реагирующими веществами и формулой газа, выделяющегося при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ФОРМУЛА ГАЗА |
| А) Zn и HCl (конц.) Б) Cu и $H_2SO_4$ (конц.) В) Mg и $H_2SO_4$ (разб.) Г) Ag и $HNO_3$ (конц.) |
1) $H_2$ 2) NO 3) $NO_2$ 4) $SO_2$ 5) $Cl_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Здесь цинк, являясь активным металлом, вытесняет водород из кислоты, образует соль, а водород выделяется в чистом виде.
Б: Концентрированная серная кислота — кислота окисляющая и реагирует с металлами за счет окислительных свойств S(VI). Неактивные металлы, как медь, восстанавливают серу только до сернистого газа.
В: Реакция похожа на первую: активный металл вытесняет водород из кислоты, поскольку разбавленная серная кислота реагирует с металлами за счет выделения водорода, как неокисляющие кислоты.
Г: Серебро неактивный металл, значит концентрированная(!) азотка восстановится только до $NO_2$.
Ответ: 1413
Задача 7
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $Na_2SiO_3$ и $CO_2$ (водн. р-р) Б) $Na_2SiO_3$ и HCl В) $AlCl_3$ и $Na_2CO_3$ (водн. р-р) Г) $AlCl_3$ и NaOH (водн. р-р) |
1) $Al(OH)_3$ и NaCl 2) $Al(OH)_3$, NaCl и $CO_2$ 3) $SiO_2$ и $NaHCO_3$ 4) NaCl и $H_2SiO_3$ 5) $H_2SiO_3$ и $Na_2CO_3$ 6) NaCl, $SiO_2$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) При реакции силиката и углекислого газа в водном растворе вода тоже вступает в реакцию, тогда получается кремниевая кислота и карбонат калия.
Б) В данном случае реагирует сильная кислота и соль, поэтому протекает обычный обмен, образуется хлорид натрия и кремниевая кислота.
В) В данном случае вода снова вступает в реакцию, происходит гидролиз карбоната алюминия, получается гидроксид алюминия (III), алюминий не меняет степень окисления, хлорид натрия и углекислый газ.
Г) В этой реакции протекает обмен.
Ответ: 5421
Задача 8
Установите соответствие между реагирующими веществами и продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) Ca и $HNO_3$ (оч. разб.) Б) Cu и $HNO_3$ (конц.) В) Fe и $HNO_3$ (конц.) (н. у.) Г) Al и $HNO_3$ (конц.) (н. у.) |
1) оксид азота(II) 2) оксид азота(IV) 3) аммиак 4) не взаимодействуют 5) нитрат аммония |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) $4Ca + 10HNO_{3(оч. разб.)} = 4Ca(NO_3)_2 + NH_4NO_3 + 3H_2O$
Б) $Cu + 4HNO_3 = Cu(NO_3)_2 + 2NO_2 + 2H_2O$
В) Fe и $HNO_{3(конц)}$ при нормальных условиях не реагирует, происходит пассивация
Г) Al и $HNO_{3(конц)}$ при нормальных условиях не реагирует, происходит пассивация
Ответ: 5244
Задача 9
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $КHCO_3$ и $Ca(OH)_2$ Б) $КHCO_3$ и HCl В) $КHCO_3$ (нагревание) Г) $КHCO_3$, $CO_2$ и $H_2O$ |
1) $Ca(HCO_3)_2$ и КOH 2) $CaCO_3$, КOH и $H_2O$ 3) $CO_2$, $H_2O$ и КCl 4) КCl и $H_2CO_3$ 5) $К_2CO_3$, $H_2O$ и $CO_2$ 6) не реагируют |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Кислая соль слабой кислоты и щелочь реагируют с образованием новой нерастворимой соли, новой щелочи и воды.
Б) Кислая соль слабой кислоты с
сильной кислотой образуется среднюю соль и слабую кислоту (угольная кислота неустойчива и сразу распадается на оксид и воду).
В) При нагревании кислой соли образуется средняя соль и кислота, но угольная сразу распадается на воду и газ.
Г) Должна идти реакция обратная предыдущей, но это невозможно, так как кислая соль не может реагировать с слабой кислотой.
Ответ: 2356
Задача 10
Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $Cl_2$ и NaOH (хол. р-р) Б) C и $H_2SO_4$ (конц.) В) C и FeO Г) Cu и $H_2SO_4$ (конц.) |
1) $CuSO_4$, $SO_2$ и $H_2O$ 2) NaCl, NaClO и $H_2O$ 3) Fe и CO 4) $CuSO_4$ и $H_2$ 5) $CO_2$, $H_2O$ и $SO_2$ 6) NaCl, $NaClO_3$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Взаимодействие $Cl_2$ с холодным раствором NaOH — реакция диспропорционирования, хлор и понижает, и повышает свою степень окисления. Поскольку среда щелочная, а раствор холодный, то получаются соли — соляной кислоты (хлорид натрия NaCl) и хлорноватистой кислоты (гипохлорит натрия NaClO), а также вода, которые предложены во второй строке.
Б) В реакции углерода с концентрированной серной кислотой углерод является восстановителем и окисляется до углекислого газа $СО_2$, а серная кислота — окислителем и восстанавливается до оксида серы (IV) $SO_2$, оставшиеся водород и кислород образуют воду.
В) Взаимодействие оксидов среднеактивных и малоактивных металлов с углеродом — один из способов получения чистых металлов, в реакции углерода с оксидом железа (II) образуется железо Fe и угарный газ СО.
Г) В реакции меди с концентрированной серной кислотой медь является восстановителем и окисляется до сульфата меди (II), а серная кислота — окислителем и восстанавливается до до оксида серы (IV) $SO_2$, оставшиеся водород и кислород образуют воду.
Ответ: 2531
Задача 11
Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $Al(OH)_3$ и $H_2SO_4$ Б) $Al(OH)_3$ и NaOH (р-р) В) $Al(OH)_3$ и NaOH (сплавление) Г) $Al(OH)_3$ (нагревание) |
1) $Al_2(SO_4)_3$ и $H_2$ 2) $Al_2(SO_4)_3$ и $H_2O$ 3) $NaAlO_2$ и $H_2$ 4) $NaAlO_2$ и $H_2O$ 5) $Na[Al(OH)_4]$ 6) $Al_2O_3$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) В реакции кислоты и основания образуется соль и вода. Продукты взаимодействия $Al(OH)_3$ + $H_2SO_4$ = $Al_2(SO_4)_3$ и $H_2O$.
Б) $Al(OH)_3$ — амфотерный гидроксид, поэтому способен реагировать с щелочами. Если реакция протекает в растворе, то образуется комплексная соль — тетрагидроксоалюминат натрия $Na[Al(OH)_4]$.
В) Если в реакции амфотерного гидроксида со щёлочью отсутствует вода (происходит сплавление), то образуется средняя соль и вода. Продукт сплавления гидроксида алюминия с гидроксидом натрия — алюминат натрия $NaAlO_2$ и вода $H_2О$.
Г) При нагревании слабые основания разлагаются на оксид и воду. Продукты разложения $Al(OH)_3$ = $Al_2O_3$ + $H_2O$.
Ответ: 2546
Задача 12
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) преимущественно образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) РЕАКЦИИ |
| А) $Al_2O_3$ и KOH (сплавление) Б) $Al_2O_3$ и KOH (р-р) В) $Al_2O_3$ и $K_2CO_3$ (сплавление) Г) $Al_2O_3$ и HCl (р-р) |
1) $KAlO_2$ 2) $KAlO_2$ и $H_2O$ 3) $KAlO_2$ и $CO_2$ 4) $K[Al(OH)_4]$ 5) $AlCl_3$ и $H_2O$ 6) $AlCl_3$ и $H_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) $2KOH + Al_2O_3$ =(сплавление) $2KAlO_2 + H_2O$
Б) $Al_2O_3 + 2KOH + 3H_2O = 2K[Al(OH)_4]$
В) $Al_2O_3 + K_2CO_3 = CO_2 + 2KAlO_2$
Г) $Al_2O_3 + 6HСl$(р-р) $= 2AlCl_3 + 3H_2O$
Ответ: 2435
Задача 13
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $K_2HPO_4 + H_3PO_4$ Б) $PH_3 + HNO_{3(конц.)}$ В) $KH_2PO_4 + KOH$ Г) $P + HNO_{3(конц.)}$ |
1) $KH_2PO_4$ 2) $K_3PO_4$ 3) $К_2HPO_4, H_2O$ 4) $NO_2, H_2O, H_3PO_4$ 5) $NO_2, H_2O, P_2O_5$ 6) $PH_3, NO_2, H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Гидрофосфат калия $K_2HPO_4$ — дизамещённая соль трёхосновной фосфорной кислоты, может реагировать с $H_3PO_4$, образуя $KH_2PO_4$:
$К_2HPO_4 + H_3PO_4 = 2КH_2PO_4$ (ответ А — 1)
Б) Фосфин $PH_3$ проявляет восстановительные свойства и при взаимодействии с окислителями будет переходить в соединения $P^{+5}$:
$PH_3 + 8HNO_3 = H_3PO_4 + 8NO_2↑ + 4H_2O$ (ответ Б — 4)
В) Дигидрофосфат калия $KH_2PO_4$ — кислая соль трёхосновной кислоты, может реагировать со щелочами с образованием гидрофосфата или фосфата, в зависимости от соотношения реагентов:
$KH_2PO_4 + KOH = K_2HPO_4 + H_2O$ (ответ В — 3) или
$KH_2PO_4 + 2KOH = K_3PO_4 + H_2O$
Г) Фосфор окисляется сильными окислителями до степени окисления +5:
$P + 5HNO_3 = H_3PO_4 + 5NO_2↑ + H_2O$ (ответ Г — 4)
Ответ: 1434
Задача 14
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Zn и $H_2SO_4$ (разб.) Б) ZnO и $H_2SO_4$ (разб.) В) Zn и $H_2SO_4$ (конц.) Г) ZnS и $O_2$ (изб., нагревание) |
1) $ZnSO_4$ и $H_2O$ 2) ZnO и $SO_2$ 3) $ZnSO_4$, $H_2S$ и $H_2O$ 4) ZnO и $SO_3$ 5) $ZnSO_4$ и $H_2$ 6) ZnS, $SO_2$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Цинк Zn — активный металл. Может реагировать с неметаллами, кислотами с выделением водорода (за исключением азотной и концентрированной серной кислот), солями и оксидами менее активных металлов и некоторыми другими окислителями.
Серная кислота $H_2SO_{4(разб.)}$ — сильная двухоснóвная кислота, проявляет все общие свойства кислот: диссоциация, окрашивание индикаторов, взаимодействие с металлами, находящимися в ряду активности левее водорода с выделением водорода, взаимодействие с оснóвными и амфотерными оксидами и гидроксидами, а также солями, если соблюдаются условия протекания реакций обмена.
$Zn + H_2SO_{4(разб.)} = ZnSO_4 + H_2$
Вывод: ответ А — 5.
Б) Оксид цинка ZnO — амфотерный оксид, $H_2SO_4$ — сильная кислота. Возможна реакция
$ZnO + H_2SO_{4(разб.)} = ZnSO_4 + H_2O$
Вывод: ответ Б — 1.
В) Концентрированная серная кислота $H_2SO_4$ является сильным окислителем. Окислительные свойства проявляет сера в степени окисления +6. С малоактивными восстановителями (тяжёлые металлы, неметаллы) восстанавливается до степени окисления +4, с активными металлами — преимущественно до степени окисления –2.
$4Zn + 5H_2SO_{4(конц.)} = 4ZnSO_4 + H_2S + 4H_2O$
Вывод: ответ В — 3.
Г) При обжиге сульфидов всегда образуется оксид серы(IV) и, как правило, оксид второго элемента в высокой устойчивой степени окисления.
$2ZnS + 3O_2 = 2ZnO + 2SO_2$
Вывод: ответ Г — 2.
Ответ: 5132
Задача 15
Установите соответствие между формулой вещества и продуктами термического разложения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ РАЗЛОЖЕНИЯ |
| А) KNO3 Б) Fe(NO3)3 В) Ni(NO3)2 Г) Hg(NO3)2 |
1) нитрит металла, кислород 2) оксид металла, кислород, оксид азота(IV) 3) металл, оксид азота(IV), кислород 4) металл, оксид азота(II), кислород 5) металл, азот, кислород 6) оксид металла, оксид азота(I), кислород |
Запишите выбранные цифры под соответствующими буквами.
Решение
Продукты термического разложения солей азотной кислоты и металлов определяются положением металла в ряду активности. При разложении солей, образованных металлами, расположенными левее магния (кроме лития), образуются нитрит металла и кислород. Если металл расположен от магния до меди или это литий, то образуются оксид металла, оксид азота(IV) и кислород. Продукты разложения солей менее активных, чем медь, металлов — металл, оксид азота(IV) и кислород.
А) $2KNO_3 = 2KNO_2 + O_2$
Вывод: ответ А — 1.
Б) $4Fe(NO_3)_3 = 2Fe_2O_3 + 12NO_2 + 3O_2$
Вывод: ответ Б — 2.
В) $2Ni(NO_3)_2 = 2NiO + 4NO_2 + O_2$
Вывод: ответ В — 2.
Г) $Hg(NO_3)_2 = Hg + 2NO_2 + O_2$
Вывод: ответ Г — 3.
Ответ: 1223
Рекомендуемые курсы подготовки
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Тип 7 № 91
Установите соответствие между простым веществом и реагентами, с каждым из которых оно может реагировать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Название вещества
А) Азот
Б) Иод
В) Графит
Г) Железо
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
2
Установите соответствие между формулой вещества и формулами простых веществ, которые могут с ним реагировать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества
А) (раствор)
Б)
В)
Г) (раствор)
Формулы простых веществ, реагирующих с данным веществом
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
3
Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
4
Установите соответствие между реагирующими веществами и продуктами реакции, содержащими азот: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
5
Установите соответствие между схемами превращений и формулами веществ, необходимых для их последовательного осуществления: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Пройти тестирование по этим заданиям
Учебно-методический
материал по химии по теме: «Способы решения задания 8 ЕГЭ по химии»
Цель
занятия:
овладение методикой решения 8 задания по химии па примере свойств оксидов;
повторение химических свойств оксидов.
Задачи:
развитие интеллектуальных умений: выделять главное,
устанавливать причинно-следственные связи,
анализировать информацию, формулировать выводы.
Одно из самых сложных
заданий 1-й части ЕГЭ по химии 8-е задание на соответствие между названиями
неорганических веществ и формулами реагентов, с каждым из которых возможна
химическая реакция.
Согласно «Методическому анализу
результатов ЕГЭ по химии» с 8-м заданием справляются менее 40%
абитуриентов. Поэтому при подготовке к ЕГЭ этому заданию уделяем дополнительное
внимание.
Задание 8
Установите
соответствие между названиями оксидов и перечнем веществ, с которыми они могут
взаимодействовать: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
Запишите в ответ |
||||||||
Проводим анализ задания:
1)
Определяем
класс вещества слева, в данном случае это оксиды.
2)
Вспоминаем
свойства оксидов в зависимости от классификации.
3)
Поступаем
от «обратного» -в каждой строчке справа находим хотя бы одно вещество, которое
с данным оксидом не реагирует.
4)
Если
такое вещество найдено – вычеркиваем всю строчку!
5)
Оставшийся
вариант проверяем на возможность протекания реакций с веществом слева.
Вещество А
1) Оксид кремния (IV) –учащиеся
проводят анализ, выясняют, что оксид кремния – это кислотный оксид, который
взаимодействует с основными оксидами, щелочами и имеет особые свойства – взаимодействие
с фтороводородом и восстанавливается углеродом.
2) Поступаем от «обратного» —
определяем вещества, с которыми оксид кремния не реагирует. Оксид кремния точно не реагирует с водой и кислотами!
3) В каждой строчке находим хотя бы
одно вещество, с которым реакция не идет
|
A) оксид кремния (IV) |
3)
5)
|
Вывод:
·
Оксид
кремния (IV) —
кислотный оксид.
·
Оксид
кремния (IV),
являясь кислотным оксидом, не реагирует с кислотами, с кислотными оксидами.
·
Оксид
кремния (IV) не
реагирует с водой, так как кремниевая кислота не растворима.
·
Вычеркиваем
справа
последовательно строки 1,2, 4,5,6
·
Остается
строка 3.
·
Проверяем
возможность протекания реакций:
1.Взаимодействует с углеродом:
SiO2 + 3С → SiС + 2СO
2.При сплавлении взаимодействует со
щелочами, а также с карбонатами щелочных и щелочноземельных металлов с
образованием солей — силикатов:
SiO2 + 2КOH → К2SiO3 + H2O
3.Химически SiO2 устойчив
к действию кислот, однако вступает в реакцию с газообразным фтороводородом
(газом) и плавиковой кислотой (жидкостью).
SiO2 + 4HF → SiF4 +
2H2O
Вещество Б
|
Б) оксид азота (IV) |
3)
6) |
Анализ задания:
·
Оксид азота
(IV)— кислотный оксид.
·
Оксид азота
(IV), являясь кислотным
оксидом, не
реагирует с кислотами, с кислотными
оксидами.
·
Вычеркиваем
справа последовательно строки 1,2, ,5,6.
·
Остаются
строки 3 и 4.
·
Вспоминаем
свойства кислотных оксидов – взаимодействие с основаниями, основными
оксидами и водой(если образуется растворимая кислота).
·
Делаем
вывод –на основании выше перечисленных свойств из двух строк выбираем 4 строку
и проверяем возможность протекания реакций:
1. При
растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
2NO2 + 2NaOH →
NaNO3 + NaNO2 + H2O
2. Оксид
азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
2NO2 + H2O → HNO3 + HNO2
3.4NO2 +2CaO → Ca(NO2)2 + Ca(NO3)2
Вещество В
|
B) оксид бария |
3)
5)
|
Анализ задания:
·
Оксид бария—
основный оксид.
·
Оксид
бария, являясь основным оксидом, не реагирует с основными оксидами, с основаниями.
·
Вычеркиваем
справа последовательно строки 2, 3, 4,6
·
Остаются
строки 1 и 5. Анализируя состав веществ первой строки, мы находим
несолеобразующий оксид СО, который не реагирует ни с основными, ни с кислотными
оксидами. Исключаем строку 1.
·
Остается
строка 5.
·
Вспоминаем
свойства основных оксидов – взаимодействие с кислотами, кислотными оксидами и
водой (если образуется растворимое основание) и проверяем возможность
протекания реакций.
1.Оксид бария взаимодействует с водой при комнатной температуре,
образуя гидроксид бария:
BaO + H2O = Ba(OH)2
2. Взаимодействует с кислотными оксидами с
образованием соли:
BaO
+ SO3 ⟶ BaSO4↓
3. Взаимодействует с кислотами с
образованием соли и воды:
3BaO + 2H3РO4 ⟶ Ba3(РO4)2 + 3H2O
Вещество Г
|
Г) оксид железа (II) |
1) 2) 3) 4) 5) 6) |
|
Анализ задания:
·
Оксид железа
(II)- основный оксид.
·
Оксид железа (II), являясь основным
оксидом, не
реагирует с основными оксидами, с
основаниями. Оксид
железа (II) не будет реагировать с водой, так как оксиды реагируют с водой только, если в
результате образуется растворимый гидроксид (щелочь).
·
Вычеркиваем
справа последовательно строки 2, 3, 4,5,6
·
Остается
строка 1.
·
Вспоминаем
свойства основных оксидов – взаимодействие с кислотами, кислотными оксидами и
водой (если образуется растворимое основание). Для оксида железа (II) будут характерны
реакции взаимодействия с восстановителями. Проверяем возможность
протекания реакций.
Примеры заданий для закрепления
1.Установите соответствие между формулой вещества и
реагентами, с каждым из которых оно может взаимодействовать: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
РЕАГЕНТЫ |
|
|
А) Б) В) Г) |
1) 2) 3) 4) 5) |
Ответ: 1352
2.Установите
соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать:
к каждой позиции, обозначенной буквой, подберите соответствующую позицию,
обозначенную цифрой.
|
НАЗВАНИЕ ОКСИДА |
ФОРМУЛЫ ВЕЩЕСТВ |
|
|
А) оксид калия Б) оксид углерода (II) В) оксид хрома (III) Г) оксид фосфора (V) |
1) 2) 3) 4) 5) 6) |
Ответ: 4351

Сроки проведения ЕГЭ по химии в 2020 году:Досрочный этап — отменен; _____________
Минимальный пороговый балл ЕГЭ-2020 по химии — 36 баллов(информация )
Открытый банк заданий ЕГЭ по химии: ГИА 11 класс >> |
||
|
ГИА по химии (9-й класс) |
Поделиться в | Абитуриенту |

Планируемые изменения в КИМ ЕГЭ-2020 по химии
Изменения в содержании и структуре проекта КИМ ЕГЭ 2020 года по сравнению с работой 2019 года отсутствуют.
Работа состоит из из двух частей:
— часть 1 содержит 29 заданий с кратким ответом, в их числе 21 задание базового уровня сложности и 8 заданий повышенного уровня сложности,
— часть 2 — задания с развернутым ответом (6 заданий высокого уровня сложности).
Максимальное число первичных баллов также остается прежним: 60.
Проект демоверсии КИМ ЕГЭ-2020 предложен для обсуждения. Замечания и предложения принимаются на электронный адрес: fipi@fipi.ru до 01 октября 2019 г.
— Методические рекомендации для учителей химии на основе анализа типичных ошибок участников ЕГЭ-2019:
открыть >>
.
Видеоконсультация Дмитрия Добротина ;
Варианты ЕГЭ досрочного периода 2020 г., Химия.
—
Ответы и критерии 2-х вариантов ЕГЭ, Химия. ;
Рекомендации по индивидуальной подготовке, Химия
Материалы ЕГЭ-2020 по другим предметам на
сайте ФИПИ.
Изменения в КИМ ЕГЭ-2018 по химии
Будет изменено:
В экзаменационной работе 2018 года по сравнению с работой 2017 года предполагаются следующие изменения. Подробнее: Демо-версия КИМ ЕГЭ-2018 (ZIP архив, 953 Kb) Сопоставление структуры КИМ-2018 и КИМ-2017 Вариант КИМ ЕГЭ-2018 по химии досрочного этапа |
. |
Новый тип вопросов части 2 (демоверсия):
|
Изменения в КИМ ЕГЭ-2017 по химии
Будет изменено:Как и в предыдущие годы КИМ ЕГЭ по химии 2017 года будет состоять из двух частей: 1. Задания с кратким ответом; 2. Задания с развернутым ответом. Изменения в основном произойдут в первой части КИМа.
— Первая часть будет разбита на отдельные тематические блоки в примерном соответствии со структурой школьного курса химии. |
. |
Будет сокращено:— Изменение структуры заданий приводит к росту их дифференциирующей способности, поэтому число заданий будет снижено с 40 до 34-х; Подробнее: Сопоставление структуры КИМ-2017 и КИМ-2016 Эти изменения предложены для обсуждения в проекте демоверсии КИМ ЕГЭ-2017. Свое мнение можно высказать по адресу reception@fipi.org до 30 сентября 2016 г. Источники |
Изменения в КИМ ЕГЭ-2016 по химии по сравнению с КИМ-2015
Согласно проекту КИМ 2016 года содержание и структура ЕГЭ по химии в целом будет отвечать КИМ-2015 года.Работа состоит из из двух частей: 1. В задания базового уровня сложности (бывшая часть А) будут включены: 2. Задания повышенного уровня (бывшая часть B) будут представлены одним типом: задания на установления соответствия. Оцениваться они будут в 2 балла (при наличии одной ошибки — 1 балл); 3. Из заданий базового уровня в повышенный перенесен вопрос по теме: «Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов«. 4. Время проведения единого экзамена по химии будет увеличено с 3-х часов до 3,5 часа (со 180 до 210 минут). На сайте ФИПИ опубликованы по одному варианту КИМов ЕГЭ-2016 (досрочный период) по 14 предметам >>. |
. |
Примеры некоторых заданий: (демоверсия) Методические рекомендации ФИПИ для учителей |
Основные типы заданий с кратким ответом, ошибки, советы
«Химия — наука естественная, но не точная»
Г.В.Лисичкин
|
Наиболее трудные вопросы базового уровня (часть А) по материалам
|
||||||||||||||||
Типы заданийСтандартный вопрос Щелочную среду имеет водный раствор
|
Рекомендации
Задания с выбором 1 ответа из 4-х предложенных вариантов в ЕГЭ-2017 будут исключены. Тем не менее, выбирать придется и других типах заданий. Поэтому общий совет: прочитывать все варианты до конца, отбрасывать явно неверные, выбирать из оставшихся. |
|||||||||||||||
|
|
||||||||||||||||
|
2. Задания с множественным выбором 2.2. В схеме превращений |
Задания с множественным выбором, сложнее тем, что вариантов ответа больше, и правильный выбор надо сделать не один, а два или три раза, причем одна ошибка сразу обнуляет результат.
2-1. Классификация веществ. Конечно, надо знать, что такое соли, и что такое кислые соли. Но не надо забывать, что соли образуют и органические вещества, в частности амины, аминокислоты и их формулы могут выглядеть необычно. 2.2. Взаимосвязь между классами веществ. Этот вопрос по своей сути — вопрос на установление соответствия, т.к. для каждой буквы надо найти соответствующий ей ответ. И выбирая вариант для «Х» надо учитывать, что он должен походить не только для первой, но и для второй реакции. Здесь вторая реакция — реакция обмена, значит «Х» должен быть хорошо растворимой солью |
|||||||||||||||
|
Задания на соответствие 1. Установите соответствие между веществом и продуктами его гидролиза.
|
Рекомендации
Вообще, задание на соответствие можно воспринимать как несколько заданий из части А собранных вместе: для каждой цифры надо найти один правильный вариант ответа. Цифры в ответе могут повторяться! |
|||||||||||||||
|
2. Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
|
2. Выбор группы, вопрос действительно сложный, групп много, в каждой по три вещества… Для правильного ответа необходимо учитывать и кислотно-основные и окислительно-восстановительные свойства оксидов, а также способность их взаимодействия с водой. |
|||||||||||||||
3. Установите соответствие между исходными веществами и суммой всех коэффициентов в сокращенном ионном уравнении реакции.
|
3. Считаем коэффициенты. Задание распространенное, как для части А, так и для части В. Не забывать про коэффициент 1, который не пишется! Правильный ответ: 3141 (цифры могут повторяться!) Внимание! Не путайте номера вариантов и сами ответы в численном виде: ответ 5363 будет оценен как неверный! |
|||||||||||||||
|
|
||||||||||||||||
|
3. Расчетные задачи 1. Какую массу оксида калия необходимо взять для приготовления 280 г раствора гидроксида калия с массовой долей 2%? 2. Для полного сжигания 4 л этиламина потребуется воздух объемом _________ л. (Запишите число с точностью до целых.) Примеры наиболее трудных заданий части В прошлых лет можно посмотреть |
Расчетные задачи части В не слишком сложны, но надо быть внимательным при округлении. Чтобы уменьшить число ошибок, рекомендуется предполагаемый ответ сначала записывать в предложенном поле, и только после проверки единиц измерения и округления переносить в бланк ответов. 2. Объемные отношения реагирующих газов. |
|||||||||||||||
Общие рекомендации Запланируйте 2-3 круга работы над вопросами. На первом круге, все слишком трудное пропускайте. Работая над трудным вопросом подумайте, нельзя ли использовать для поиска ответа Если в предложенных вариантах ответов вы видите несколько подходящих: Если в предложенных вариантах ответов вы не видите ни одного верного: Анализ наиболее сложных вопросов предыдущих лет можно посмотреть здесь |
Задать вопрос
Наверх
Тесты для подготовки к ЕГЭ. Часть B (повышенный уровень)
.
Задания с развернутым ответом (высокого уровня сложности),
примеры, ошибки, советы
«Напичканый знаниями, но не умеющий их использовать ученик
напоминает фаршированную рыбу, которая не может плавать»
А.Л.Минц
|
|
||
Типы заданийС1. (30) Уравнение окислительно-восстановительной реакции. с 2018 г. два первичных балла (ранее — 3 балла). |
. |
РекомендацииДо 2018 г в задании предлагалась неполная схема реакции, где формулы одного-двух веществ были заменены многоточиями. Надо было определить недостающие вещества с учетом среды реакции, написать электронный баланс, используя степени окисления атомов, расставить коэффициенты в ОВР, указать окислитель и восстановитель. |
|
C1-b (31). Ионное уравнение реакции |
. |
Как и в предыдущем задании, нужно выбрать из списка вещества, способные вступить между собой в реакцию, учтя, что растворимые вещества даны в виде растворов, и написать молекулярное уравнение реакции (1 балл). |
|
С2 (32). «Мысленный эксперимент» «Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. |
. |
Задание «Мысленный эксперимент» используется с 2012 года. Можно рекомендовать следующий алгоритм выполнения задания:
|
|
С3 (33). Цепочка превращений органических веществ Задание включает пять превращений и оценивается в пять первичных баллов. Примеры заданий прошедших лет можно посмотреть |
. |
С 2012 года в условие задания добавлена фраза: «При написании уравнений реакций используйте структурные формулы органических веществ» Это значит, что если в уравнении записана формула С4Н9Сl, то это будет расценено, как ошибка, поскольку не дает представления о том, как соединены атомы углерода и у какого из них стоит заместитель. Типичные ошибки. Верно указывая основной продукт, не указывают побочные (напр., образование воды в реакции этерификации), не расставляют коэффициенты. Типичные ошибки — 2. Не учитываются условия протекания реакции при определении их продуктов. Так, при гидролизе эфиров в щелочной среде в качестве продуктов указываются свободные кислоты, также кислоты указываются при окислении альдегида в реакции «серебряного зеркала», хотя эта реакция протекает в избытке раствора аммиака и ее продуктами являются аммонийные соли. Трудные реакции: взаимодействие галогенпроизводных со спиртовым и водным раствором щелочи, окисление перманганатом, электролиз растворов солей карбоновых кислот… |
|
С4 (34). Комбинированная задача Примеры задач прошлых лет с решениями можно посмотреть |
. |
Типичные ошибки: Ошибки в номенклатуре, сдающий не понимает разницы между нитратом-нитритом-нитридом, карбонатом-карбидом, фосфатом-фосфидом, хлоратом-хлоритом-хлоридом… |
|
С5 (35). Определение формулы вещества
С 2018 г. задание оценивается в три первичных балла в соответствии с требованиями: Примеры задач 2004-2005 года и их решение можно посмотреть |
. |
Задание предполагает определение формулы определяемого вещества по продуктам сгорания или по массовым долям элементов. В условии также имеются данные для нахождения молекулярной массы вещества (но не всегда!) и указание на реакцию этого вещества с каким либо реагентом. Баллы даются за предварительные расчеты и определение молекулярной формулы, за написание структурной формулы вещества и уравнение реакции. Типичные ошибки прошлых лет: В задачах на продукты сгорания теряется водород, находящийся в составе галогенводородов. Иногда — неправильный переход от количества вещества продукта сгорания к количеству вещества элемента (n(H2O) -> n(H), совет: проверять себя: чего больше молекул или атомов?). Часто теряется водород при чрезмерном округлении в расчетах. Используя относительную плотность по азоту, кислороду, иногда ученик «забывает», что молекулы этих газов двухатомны. |
Общие рекомендации
Внимание! Как показывают обсуждения на интернет-форумах, экспертные комиссии некоторых территорий не засчитывают решения задач С4, если расчет по уравнению реакций выполнен не в МОЛЯХ, а в пропорциях масс, объемов и т.п. По мнению автора сайта это есть некоторый бзик данных экспертных комиссий, поскольку любое правильное решение должно оцениваться максимальным баллом. Пропорция в единицах массы также оправдана, как и в единицах количества вещества (хотя и менее рациональна). Но, поскольку свой ум в чужую голову не переложишь, и переучивать экпертов не задача для сдающих экзамен, настоятельно рекомендуется освоить решение расчетных задач в единицах количества вещества!
Хотя часть С самая сложная, но в ней есть и простые элементы, поэтому, постарайся что-то сделать, и,
поскольку задания проверяют не бездушная железяка, а эксперты,
они постараются это что-то оценить…
Но надо это что-то представить максимально разборчиво.
«Первым ключом мудрости является постоянное и частое вопрошание.»
Пьер Абеляр. Задать вопрос
Смотрите также: Рекомендации от разработчиков КИМ
Наиболее трудные вопросы и типичные ошибки
заданий с развернутым ответом (часть С)
по материалам
ЕГЭ-2006,
ЕГЭ-2007
Бесплатный интенсив по химии
3 огненных вебинара, домашние задания, беседа курса, личный кабинет, связь с
преподавателем
и
многое другое.
Курс стартует 27 марта.
Задание 8 из ЕГЭ по химии
Тема: «Химические свойства простых веществ, оксидов, гидроксидов и солей»
За это задание вы можете получить 2 балла на ЕГЭ в 2023 году
Разбор сложных заданий в тг-канале:
Задача 1
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обоз…
Задача 2
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обоз…
Задача 3
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обоз…
Задача 4
Установите соответствие между исходными веществами и продуктами их термического разложения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную ц…
Задача 5
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обоз…
Задача 6
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обоз…
Задача 7
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обоз…
Задача 8
Установите соответствие между исходными веществами, вступающими в реакцию при нагревании, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующу…
Задача 9
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обоз…
Задача 10
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обоз…
Задача 11
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обоз…
Задача 12
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подб…
Задача 13
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подб…
Задача 14
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответству…
Задача 15
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подб…
Задача 16
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответству…
Задача 17
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответству…
Задача 18
Установите соответствие между реагирующими веществами и продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подбер…
Задача 19
Установите соответствие между реагирующим(-ими) веществом(-ами) и продуктом, который преимущественно образуется в процессе реакции: к каждой позиции, обозначенной буквой, подберите…
Задача 20
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подб…
Тест №8 Единого государственного экзамена представлен в разных вариантах, но все они скомпонованы одинаково. Проверяются знания по теме «Свойства неорганических веществ». Упражнения, которые предстоит решить, составлены следующим образом: вам предлагается перечень формул или названий веществ, а также список реагентов. Ваша задача — соотнести элементы первой группы со второй. Ответ нужно будет вписать в таблицу, а в бланк перенести последовательность цифр.
За задание можно получить 2 первичных балла, на выполнение не рекомендуется тратить более пяти минут, чтобы осталось достаточно времени для номеров с высоким уровнем сложности.
Для того чтобы успешно справиться с билетом №8 в ЕГЭ по химии, необходимо свободно ориентироваться в теории и понимать, с какими реагентами то или иное вещество может взаимодействовать.
Популярные материалы
- Задание 34. Задачи на материальный баланс
- Задание 33. Нахождение молекулярной и структурной формул вещества
- Задание 26. Массовая доля
- Задание 11. Изомерия
- Теория к заданию 26
- Теория к заданию 11


 Азот на ЕГЭ
Азот на ЕГЭ