Слайд 1
Молекулярная физика Подготовка к ЕГЭ
Слайд 2
Основные положения МКТ Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества. В основе молекулярно-кинетической теории лежат три основных положения : Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Атомы и молекулы находятся в непрерывном хаотическом движении . Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Слайд 3
Модели строения газов, жидкостей и твердых В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей . В газах расстояния между молекулами обычно значительно больше их размеров, каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда.
Слайд 4
Тепловое движение атомов и молекул Беспорядочное хаотическое движение молекул называется тепловым движением. Тепловое движение атомов в твердых телах: Тепловое движение молекул в жидкости: Тепловое движение молекул в газе:
Слайд 5
Модель идеального газа Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12 C. в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро N А : N А = 6,02·10 23 моль –1 . Массу одного моля вещества принято называть молярной массой M . Молярная масса выражается в килограммах на моль ( кг/моль ) Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12 C называется относительной массой.
Слайд 7
= — относительная молекулярная (атомарная) масса вещества (из таблицы Менделеева) Ν 14,00 азот Один моль – это количество вещества, в котором содержится столько же молекул и атомов, сколько а томов содержится в 0,012 кг углерода 1 моль – 0,012 кг С — моль -1 Количество вещества число Авогадро 1моль О 2 1 моль Ν 2 Ν = Ν V = V
Слайд 8
М = m 0 N А – молярная масса вещества (это масса 1 моля вещества) ν = = — количество вещества или количество молей вещества. N = ν∙ N А = ∙ N А — число молекул в данной массе вещества. m = m 0 N = ν N А m 0 = ν∙ М — масса вещества . М = М r ∙10 -3
Слайд 9
Связь между давлением и средней кинетической энергией теплового движения молекул идеального газа Основное уравнение МКТ газов. Давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема p = nkT , где n = N / V – концентрация молекул (т. е. число молекул в единице объема сосуда) k –постоянной Больцмана, в честь австрийского физика. Ее численное значение в СИ равно: k = 1,38·10 –23 Дж/К. Закон Дальтона: давление в смеси химически невзаимодействующих газов равно сумме их парциальных давлений p = p 1 + p 2 + p 3 + … = (n 1 + n 2 + n 3 + …)kT.
Слайд 10
Броуновское движение – это непрерывное хаотическое движение частиц, помещенных в жидкость или газ, находящихся во взвешенном состоянии. Причина броуновского движения частиц в том, что удары молекул о нее не компенсируют друг друга. (Частицы краски в воде, пылинки в луче света.)
Слайд 11
Броуновское движение Диффузия Броуновское движение — это тепловое движение мельчайших частиц, взвешенных в жидкости или газе. Броуновское движение : Броуновская частица среди молекул: Траектория движения 3-х броуновских частиц : Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга. Диффузия приближает систему к состоянию термодинамического равновесия
Слайд 12
Силы взаимодействия молекул. r r r r – расстояние между центрами частиц d – сумма радиусов взаимодействующих частиц. r = d → F =0 r →∞ → F → 0 R ˃ d → F пр. ˃ F от. R ˂ d → F пр. ˂ F от.
Слайд 13
Идеальный газ. Идеальный газ – п ростейшая ф изическая модель реального газа. Расстояние между молекулами ˃ d Молекулы – упругие шары Силы притяжения стремятся к 0 Отталкивание только при ударах Движение только по законам Ньютона
Слайд 14
p Давление газа возникает в результате столкновений молекул с о стенками сосуда, в котором н аходится газ.
Слайд 15
Основное уравнение МКТ. P = — масса одной молекулы газа n – концентрация молекул газа — средняя квадратичная скорость движения газовых молекул P = P =
Слайд 16
Тепловое равновесие. Температура. р – давление V – объем t — температура Макроскопические или термодинамические п араметры, характеризующие состояние вещества без учета его молекулярного строения. А В С С Два тела – А и В, каждое из которых находится в теплом равновесии с телом С. Находится в тепловом равновесии друг с другом. Тело С может с лужить прибором, измеряющим степень нагретости т ела А и В.
Слайд 17
Газы в состоянии теплового равновесия. He При тепловом равновесии, к огда давление газа данной м ассы и его объем фиксированы, с редняя кинетическая энергия молекул всех газов одинакова (как и температура.) k = 1,38∙ Постоянная Больцмана
Слайд 18
Абсолютная температура как мера средней кинетической энергии его частиц Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии. Для измерения температуры используются физические приборы – термометры В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой K. T К = T С + 273,15 Температурная шкала Кельвина называется абсолютной шкалой температур . Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры , достаточно принять еще одну фиксированную опорную точку — температура тройной точки воды (0,01° С) , в которой в тепловом равновесии находятся все три фазы – лед, вода и пар — 273,16 К.
Слайд 20
Абсолютный нуль t = — 273 T = t+273 t = T — 273 p = n Е =
Слайд 21
E = E = = Средне квадратичная скорость молекул
Слайд 22
Абсолютная температура как мера средней кинетической энергии его частиц Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре. Температура есть мера средней кинетической энергии поступательного движения молекул.
Слайд 23
Уравнение Менделеева – Клапейрона . pV = pV = R = 8,31
Слайд 24
Изотермическй процесс pV – const T – const p p V V T T
Слайд 25
Изопроцессы : изотермический процесс. Изопроцессы – это процессы, в которых один из параметров ( p , V или T ) остается неизменным . Изотермический процесс ( T = const ) -квазистатический процесс, протекающий при постоянной температуре T. Закон Бойля–Мариотта : при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления p газа на его объем V должно оставаться постоянным : pV = const T 3 > T 2 > T 1
Слайд 27
Изобарный процесс P = const p p V V T T
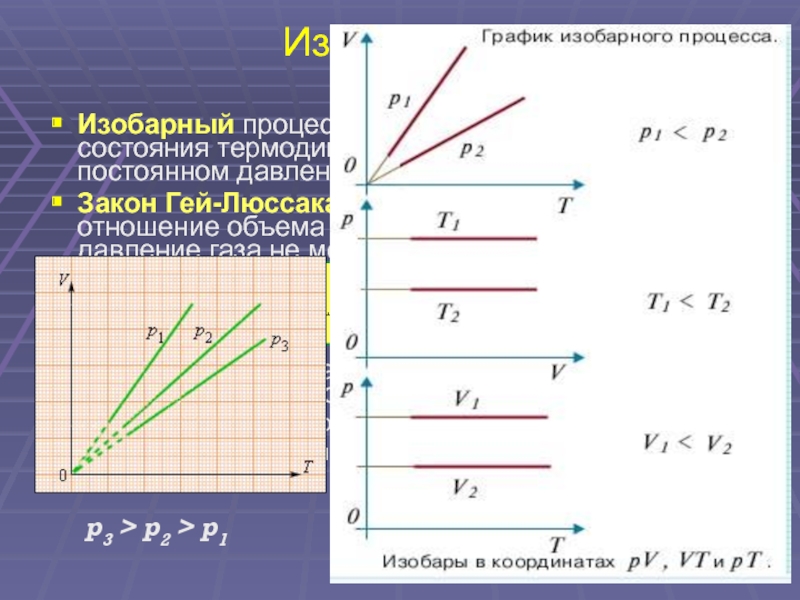
Слайд 28
Изопроцессы : изобарный . процесс Изопроцессы – это процессы, в которых один из параметров ( p , V или T ) остается неизменным . Изобарным процессом называют квазистатический процесс, протекающий при неизменным давлении p . Закон Гей-Люссака : где V 0 – объем газа при температуре 0 °С . α = 1/273,15 К –1 — температурныЙ коэффициент объемного расширения газов. p 3 > p 2 > p 1
Слайд 30
Изохорный процесс V – const p p V V T T
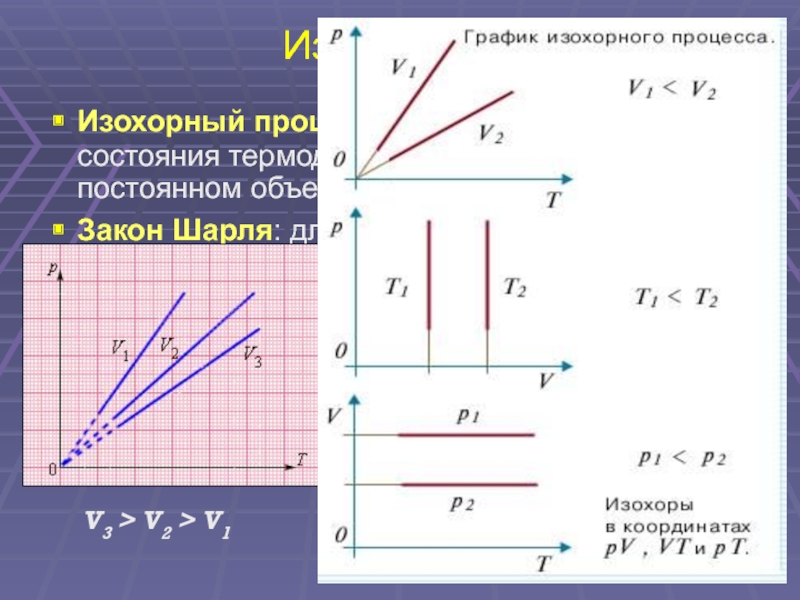
Слайд 31
Изопроцессы : , изохорный, процесс. Изопроцессы – это процессы, в которых один из параметров ( p , V или T ) остается неизменным . Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным. Закон Шарля : при постоянном объеме V и неизменном количестве вещества ν в сосуде давление газа p изменяется прямо пропорционально его абсолютной температуре : V 3 > V 2 > V 1
Слайд 33
Рассмотрим задачи: ЕГЭ 2001-2010 ( Демо , КИМ) ГИА-9 2008-2010 ( Демо )
Слайд 34
(ЕГЭ 2001 г.) А10. Согласно расчетам, температура жидкости должна быть равна 143 К. Между тем термометр в сосуде показывает температуру не более –130 0 С. Это означает, что термометр не рассчитан на высокие температуры и требует замены термометр показывает более высокую температуру термометр показывает более низкую температуру термометр показывает расчетную температуру
Слайд 35
(ЕГЭ 2001 г., Демо ) А11. На рисунке показана часть шкалы термометра, висящего за окном. Температура воздуха на улице равна ….. 18 0 С. 14 0 С 21 0 С. 22 0 С.
Слайд 36
(ЕГЭ 2001 г.) А12. Кастрюлю с водой поставили на газовую плиту. Газ горит постоянно. Зависимость температуры воды от времени представлена на графике. График позволяет сделать вывод, что теплоемкость воды увеличивается со временем через 5 минут вся вода испарилась при температуре 350 К вода отдает воздуху столько тепла, сколько получает от газа через 5 минут вода начинает кипеть
Слайд 37
(ЕГЭ 2001 г., Демо ) А13. Экспериментально исследовалось, как меняется температура t некоторой массы воды в зависимости от времени ее нагревания. По результатам измерений построен график, приведенный на рисунке. Какой вывод можно сделать по результатам эксперимента ? Вода переходит из твердого состояния в жидкое при 0 0 С. Вода кипит при 100 0 С. Теплоемкость воды равна 4200 Дж/(кг 0С). Чем дольше нагревается вода, тем выше ее температура.
Слайд 38
(ЕГЭ 2001 г., Демо ) А14. Испарение жидкости происходит потому, что . . . разрушается кристаллическая решетка. самые быстрые частицы покидают жидкость. самые медленные частицы покидают жидкость. самые крупные частицы покидают жидкость.
Слайд 39
(ЕГЭ 2001 г., Демо ) А15. Тела, имеющие разные температуры, привели в соприкосновение двумя способами ( I и II ). Какое из перечисленных ниже утверждений является верным? В положении I теплопередача осуществляется от тела 1 к телу 2. В положении II теплопередача осуществляется от тела 1 к телу 2. В любом положении теплопередача осуществляется от тела 2 к телу 1. Теплопередача осуществляется только в положении II.
Слайд 40
(ЕГЭ 2001 г.) А33. Представления о строении вещества в XVIII веке не позволяли получить объяснения закона Шарля и других газовых законов. На основании этого мы можем признать, что опыты давали искаженные результаты, не соответствующие действительности представления требовали дополнений или корректировки теория имеет дело с идеальными объектами, а эксперимент – с реальными. Они не могут друг другу соответствовать ни опыты, ни научные представления в XVIII веке не отражали истинную картину строения веществ
Слайд 41
(ЕГЭ 2001 г.) А34. При исследовании зависимости давления газа от объема были получены некоторые данные. Какой график правильно проведен по экспериментальным точкам?
Слайд 42
(ЕГЭ 2001 г.) А35. Одинаковые количества одного и того же газа нагревают в двух разных сосудах. Зависимость давления от температуры в этих сосудах представлена на графике. Что можно сказать об объемах этих сосудов? V 1 больше V 2 V 1 меньше V 2 V 1 равно V 2 Связь V 1 и V 2 зависит от свойств газов в сосудах
Слайд 43
(ЕГЭ 2002 г., Демо ) А8. Какой из перечисленных ниже опытов ( А, Б или В) подтверждает вывод молекулярно-кинетической теории о том, что скорость молекул растет при увеличении температуры? А. Интенсивность броуновского движения растет с повышением температуры. Б. Давление газа в сосуде растет с повышением температуры. В. Скорость диффузии красителя в воде повышается с ростом температуры. только А только Б только В А, Б и В
Слайд 44
(ЕГЭ 2002 г., Демо ) А9. Какой график (см. рис.) – верно изображает зависимость средней кинетической энергии частиц идеального газа от абсолютной температуры? 1 2 3 4
Слайд 45
2002 г. А 9 (КИМ). В баллоне находится 6 моль газа. Сколько примерно молекул газа находится в баллоне?
Слайд 46
(ЕГЭ 2002 г., Демо ) А12. Какой из графиков, изображенных на рисунке соответствует процессу, проведенному при постоянной температуре газа? А Б В Г
Слайд 47
(ЕГЭ 2002 г., Демо ) А13. При испарении жидкость остывает. Молекулярно-кинетическая теория объясняет это тем, что чаще всего жидкость покидают молекулы, кинетическая энергия которых равна средней кинетической энергии молекул жидкости превышает среднюю кинетическую энергию молекул жидкости меньше средней кинетической энергии молекул жидкости равна суммарной кинетической энергии молекул жидкости
Слайд 48
2002 г. А 1 3 (КИМ). При сжатии идеального газа объем уменьшился в 2 раза, а температура газа увеличилась в 2 раза. Как изменилось при этом давление газа? 1. увеличилось в 4 раза 2. уменьшилось в 2 раза 3. у величилось в 2 раза 4. не изменилось
Слайд 49
2002 г. А 1 4 (КИМ). В результате нагревания газа средняя кинетическая энергия теплового движения его молекул увеличилась в 4 раза. Как изменилась при этом абсолютная температура газа? 1. увеличилась в 2 раза 2. увеличилась в 4 раза 3. уменьшилась в 4 раза 4. не изменилась
Слайд 50
2002 г. А29 (КИМ). Идеальный газ сначала нагревался при постоянном давлении, потом его давление увеличивалось при постоянном объеме, затем при постоянной температуре давление газа уменьшилось до первоначального значения. Какой из графиков в координатных осях p – V соответствует этим изменениям состояния газа?
Слайд 51
(ЕГЭ 2002 г., Демо ) А30. Какова температура идеального газа в точке 2, если в точке 4 она равна 200К 200 К 400 К 600 К 1200 К
Слайд 52
(ЕГЭ 2003 г., КИМ) А8. Диффузия происходит быстрее при повышении температуры вещества, потому что увеличивается скорость движения частиц увеличивается взаимодействие частиц тело при нагревании расширяется уменьшается скорость движения частиц
Слайд 53
(ЕГЭ 2003 г., КИМ) А9. При неизменной концентрации частиц идеального газа средняя кинетическая энергия теплового движения его молекул увеличилась в 3 раза. При этом давление газа уменьшилось в 3 раза увеличилось в 3 раза увеличилось в 9 раз не изменилось
Слайд 54
(ЕГЭ 2003 г., КИМ) А10. На рисунке изображен график зависимости давления газа на стенки сосуда от температуры. Какой процесс изменения состояния газа изображен? изобарное нагревание изохорное охлаждение изотермическое сжатие изохорное нагревание
Слайд 55
(ЕГЭ 2004 г., демо ) А7. Давление идеального газа зависит от А. концентрации молекул. Б. средней кинетической энергии молекул. только от А только от Б и от А, и от Б ни от А, ни от Б
Слайд 56
(ЕГЭ 2004 г., демо ) А23. При переходе из состояния А в состояние В температура идеального газа увеличилась в 2 раза увеличилась в 4 раза уменьшилась в 2 раза уменьшилась в 4 раза
Слайд 57
(ЕГЭ 2006 г., ДЕМО) А8. В жидкостях частицы совершают колебания возле положения равновесия, сталкиваясь с соседними частицами. Время от времени частица совершает «прыжок» к другому положению равновесия. Какое свойство жидкостей можно объяснить таким характером движения частиц? малую сжимаемость текучесть давление на дно сосуда изменение объема при нагревании
Слайд 58
(ЕГЭ 2006 г., ДЕМО) А27. Экспериментаторы закачивают воздух в стеклянный сосуд, одновременно охлаждая его. При этом температура воздуха в сосуде понизилась в 2 раза, а его давление возросло в 3 раза. Во сколько раз увеличилась масса воздуха в сосуде? в 2 раза в 3 раза в 6 раз в 1,5 раза
Слайд 59
ЕГЭ – 2006, ДЕМО. А 28. В сосуде, закрытом поршнем, находится идеальный газ. График зависимости объема газа от температуры при изменении его состояния представлен на рисунке. В каком состоянии давление газа наибольшее? А В С D
Слайд 60
(ЕГЭ 2007 г., ДЕМО) А10. 3 моль водорода находятся в сосуде при температуре Т. Какова температура 3 моль кислорода в сосуде того же объема и при том же давлении? (Водород и кислород считать идеальными газами.) 32Т 16Т 2Т Т
Слайд 61
(ЕГЭ 2007 г., ДЕМО) А15. В сосуде постоянного объема находится идеальный газ, массу которого изменяют. На диаграмме (см. рисунок) показан процесс изменения состояния газа. В какой из точек диаграммы масса газа наибольшая? А В С D
Слайд 62
(ЕГЭ 2009 г., ДЕМО) А8. При понижении абсолютной температуры одноатомного идеального газа в 1,5 раза средняя кинетическая энергия теплового движения его молекул увеличится в 1,5 раза уменьшится в 1,5 раза уменьшится в 2,25 раза не изменится
Слайд 63
(ЕГЭ 2009 г., ДЕМО) А12. В сосуде находится постоянное количество идеального газа. Как изменится температура газа, если он перейдет из состояния 1 в состояние 2 (см. рисунок)?
Слайд 64
(ЕГЭ 2009 г., ДЕМО) В2. Используя первый закон термодинамики, установите соответствие между описанными в первом столбце особенностями изопроцесса в идеальном газе и его названием. ОСОБЕННОСТИ ИЗОПРОЦЕССА НАЗВАНИЕ ИЗОПРОЦЕССА А) Все переданное газу количество теплоты идет на совершение работы, а внутренняя энергия газа остается неизменной. 1) изотермический Б) Изменение внутренней энергии газа происходит только за счет совершения работы, так как теплообмен с окружающими телами отсутствует. 2) изобарный 3) изохорный 4) адиабатный А Б 1 4
Слайд 65
(ЕГЭ 2010 г., ДЕМО) А9. На рисунке приведены графики зависимости давления 1 моль идеального газа от абсолютной температуры для различных процессов. Какой из графиков соответствует изохорному процессу?
Слайд 66
(ЕГЭ 2010 г., ДЕМО) В1. В сосуде неизменного объема находилась при комнатной температуре смесь двух идеальных газов, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль первого газа. Температура газов в сосуде поддерживалась неизменной. Как изменились в результате парциальные давления газов и их суммарное давление? Для каждой величины определите соответствующий характер изменения: 1) увеличилось 2) уменьшилось 3) не изменилось 1 2 3
Скачать материал
Выберите документ из архива для просмотра:
подготовка к ЕГЭ.pptx
Выбранный для просмотра документ подготовка к ЕГЭ.pptx

Скачать материал


- Сейчас обучается 460 человек из 72 регионов


- Сейчас обучается 46 человек из 28 регионов




Описание презентации по отдельным слайдам:
-
1 слайд
МКТ и ТЕРМОДИНАМИКА
Подготовка к ЕГЭ по физике -
2 слайд
Связь между давлением и средней кинетической энергией.
Связь температуры и средней кинетической энергией. -
3 слайд
АБСОЛЮТНАЯ ТЕМПЕРАТУРА
Температура – термодинамический параметр, одинаковый во всех точках системы, находящейся в тепловом равновесии. По значениям температуры в разных точках системы можно судить о направлении процесса теплопередачи.
В Европе для практического применения используется температурная шкала Цельсия. В СИ принята абсолютная термодинамическая шкала температуры, в которой температуру измеряют в градусах Кельвина и называют абсолютной или термодинамической температурой. Связь между абсолютной температурой T и температурой Цельсия t:T ≈ 273 + t; [T] = K; [t] = °С.
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры:
абсолютный ноль — наиболее низкая возможная температура, при которой ничего не может быть холоднее и теоретически невозможно извлечь из вещества тепловую энергию. Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана:
Eср = 3/2kT где:
k = 1.380 6505 × 10−23 Дж/K — постоянная Больцмана
T — термодинамическая температура, К -
-
-
6 слайд
Первый закон термодинамики
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
ΔU = A + Q,где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
Из (ΔU = A + Q) следует закон сохранения внутренней энергии. Если систему изолировать от внешних воздействий, то A = 0 и Q = 0, а следовательно, и ΔU = 0.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:где A’ — работа, совершаемая системой (A’ = -A).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами. -
7 слайд
Применение первого закона термодинамики к различным процессам
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики Первый закон термодинамики,
ΔU = Q,
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.Если газ нагревается, то Q > 0 и ΔU > 0, его внутренняя энергия увеличивается. При охлаждении газа Q < 0 и ΔU < 0, внутренняя энергия уменьшается.
-
8 слайд
Изотермический процесс.
Поскольку при изотермическом процессе внутренняя энергия газа не меняется (Т = const), то все переданное газу количество теплоты идет на совершение работы:
Q = A’,
При получении газом теплоты (Q > 0) он совершает положительную работу (A’ > 0). Если газ отдает тепло окружающей среде Q < 0 и A’ < 0. В этом случае над газом совершается работа внешними силами. Для внешних сил работа положительна. Геометрически работа при изотермическом процессе определяется площадью под кривой p(V). -
9 слайд
Изобарный процесс.
Изобарный (изобарический) процесс — термодинамический процесс, происходящий в системе с постоянным давлением р.
Примером изобарного процесса является расширение газа в цилиндре со свободно ходящим нагруженным поршнем.
При изобарном процессе, согласно формуле Первый закон термодинамики, передаваемое газу количество теплоты идет на изменение его внутренней энергии ΔU и на совершение им работы A’ при постоянном давлении:
Q = ΔU + A’.
Работа идеального газа определяется по графику зависимости p(V) для изобарного процесса
(A’ = pΔV). -
10 слайд
Адиабатический процесс
Адиабатический процесс (адиабатный процесс) — это термодинамический процесс, происходящий в системе без теплообмена с окружающей средой (Q = 0).
На адиабатически изолированную систему не оказывает влияния изменение температуры окружающих тел. Ее внутренняя энергия U может меняться только за счет работы, совершаемой внешними телами над системой, или самой системой.
Согласно первому началу термодинамики (ΔU = А + Q), в адиабатной системе ΔU = A,
где A — работа внешних сил.
При адиабатном расширении газа А < 0.
Это означает уменьшение температуры при адиабатном расширении. Оно приводит к тому, что давление газа уменьшается более резко, чем при изотермическом процессе. Площадь под адиабатой численно равна работе, совершаемой газом при его адиабатическом расширении от объема V1, до V2.
Адиабатное сжатие приводит к повышению температуры газа, т. к. в результате упругих соударений молекул газа с поршнем их средняя кинетическая энергия возрастает, в отличие от расширения, когда она уменьшается (в первом случае скорости молекул газа увеличиваются, во втором — уменьшаются).Резкое нагревание воздуха при адиабатическом сжатии используется в двигателях Дизеля.
-
-
12 слайд
Насыщенный пар и его свойства
1. При неизменной температуре плотность насыщенного пара не зависит от его объёма. Давление насыщенного пара не зависит от его объёма.
При неизменном объёме плотность насыщенного пара растёт с повышением темпера- туры и уменьшается с понижением температуры
Давление насыщенного пара растёт с температурой быстрее, чем по линейному законуВ точке 2 вся жидкость испаряется; при дальнейшем повышении температуры пар становится ненасыщенным, и его давление растёт линейно по закону Шарля (участок 2–3). Вспомним, что линейный рост давления идеального газа вызван увеличением интенсивности ударов молекул о стенки сосуда. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще — ведь пара становится больше. Одновременным действием этих двух факторов и вызван экспоненциальный рост давления насыщенного пара.
-
-
-
15 слайд
газ получает теплоту, если:
Увеличиваются и его температура, и объем;
Увеличивается объем, а температура постоянна;
Увеличивается температура, а объем постоянен.Газ отдает теплоту, если:
Уменьшаются и его температура, и объем;
Уменьшается объем, а температура постоянна;
Уменьшается температура, а объем постоянен. -
-
-
-
-
-
-
-
-
-
25 слайд
Задание 11. При одинаковой температуре 100 °С давление насыщенных паров воды равно Па, аммиака — Па и ртути — 37 Па. Из предложенного перечня утверждений выберите два правильных и укажите их номера.
1) Ртуть кипит при более высокой температуре, чем аммиак.
2) Температура кипения воды ниже, чем у аммиака.
3) Для нагревания 1 кг ртути до температуры кипения необходимо количество теплоты, равное 37 кДж.
4) При кипении в открытом сосуде давление насыщенных паров аммиака равно нормальному атмосферному давлению.
5) Аммиак закипит, когда давление его насыщенных паров превысит Па.
-
-
-
-
-
Краткое описание документа:
В презентации содержится справочный (формулы, определения т т.д.) материал по теме МКТ и термодинамика, а так же подобраны задания различного типа, наиболее часто встречающиеся на ЕГЭ. Это позволяет изучить, повторить, закрепить материал по данному разделу физики. Презентация будет полезна как педагогам, так и учащимся при подготовке к экзамену
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 154 373 материала в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
Другие материалы
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Информационные технологии в деятельности учителя физики»
-
Курс повышения квалификации «Основы управления проектами в условиях реализации ФГОС»
-
Курс повышения квалификации «Экономика и право: налоги и налогообложение»
-
Курс повышения квалификации «История и философия науки в условиях реализации ФГОС ВО»
-
Курс профессиональной переподготовки «Логистика: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «ЕГЭ по физике: методика решения задач»
-
Курс профессиональной переподготовки «Уголовно-правовые дисциплины: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Организация и управление процессом по предоставлению услуг по кредитному брокериджу»
-
Курс профессиональной переподготовки «Технический контроль и техническая подготовка сварочного процесса»
-
Курс профессиональной переподготовки «Информационная поддержка бизнес-процессов в организации»
Молекулярная физика Подготовка к ЕГЭ
Цель : повторение основных понятий, законов и формул раздела в соответствии с кодификатором ЕГЭ .
Элементы содержания, проверяемые на ЕГЭ :
- Модель идеального газа МКТ
- Основное уравнение МКТ
- Связь температуры газа со средней кинетической энергией поступательного теплового движения его частиц
- Уравнение p = n k T
- Уравнение Менделеева – Клапейрона: pV =(m/M)*RT = ν RT = NkT
- Закон Дальтона
- Изопроцессы в разряженном газе с постоянным числом частиц: изотермический, изобарный, изохорный
- Влажность воздуха
- Относительная влажность
Основные понятия раздела
Идеальный газ – это модель газа, в которой пренебрегают взаимодействием молекул друг с другом на расстоянии.
Изопроцесс – процесс изменения состояния газа, происходящий при каком либо постоянном параметре (давлении, объеме или температуре).
Парциальное давление газа — давление газа, входящего в смесь газов, которое он оказывал бы, находясь в том же объеме и при той же температуре в отсутствие всех остальных газов смеси.
Абсолютная влажность воздуха — величина, равная парциальному давлению паров воды, содержащихся, в воздухе (плотность водяных паров в воздухе, выраженная в г / м 3 )
Относительная влажность воздуха – величина, равная отношению парциального давления водяного пара , содержащегося в воздухе, к давлению насыщенного пара, при данной температуре, выраженная в процентах.
Точка росы – температура , при которой данный пар является насыщенным.
Относительная молекулярная масса — отношение массы молекулы к 1/12 массы атома углерода. Моль — количество вещества, содержащее столько же структурных единиц, сколько их в 12 г углерода.
Молярная масса – масса одного моля вещества.
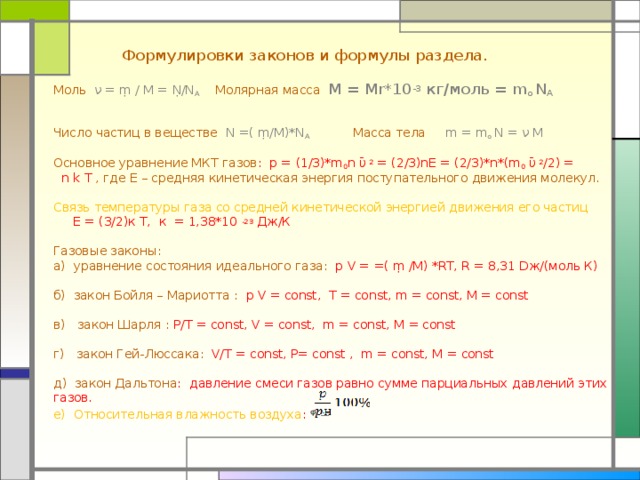
Формулировки законов и формулы раздела.
Моль ν = ṃ / М = Ṇ/N A Молярная масса M = Mr*10 -3 кг/моль = m o N A
Число частиц в веществе N = ( ṃ/ М) *N A Масса тела m = m o N = ν M
Основное уравнение МКТ газов : p = (1/3)*m 0 n ῡ 2 = (2/3)nE = (2/3)*n*(m 0 ῡ 2 /2) =
n k T , где Е – средняя кинетическая энергия поступательного движения молекул.
Связь температуры газа со средней кинетической энергией движения его частиц Е = (3/2)к Т, к = 1,38*10 -23 Дж/К
Газовые законы:
а) уравнение состояния идеального газа : p V = =( ṃ /М) *RT , R = 8,31 D ж/(моль К)
б) закон Бойля – Мариотта : p V = const, T = const, m = const, M = const
в) закон Шарля : P/T = const, V = const, m = const, M = const
г) закон Гей-Люссака : V/T = const, Р= const , m = const, M = const
д) закон Дальтона : давление смеси газов равно сумме парциальных давлений этих газов.
е) Относительная влажность воздуха : ᵠ =
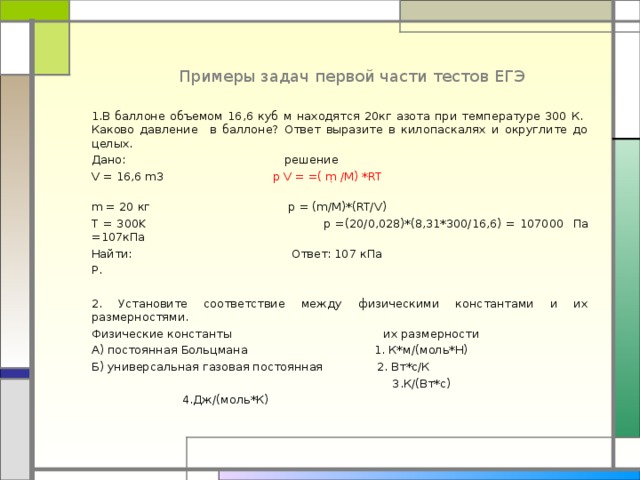
Примеры задач первой части тестов ЕГЭ
1.В баллоне объемом 16,6 куб м находятся 20кг азота при температуре 300 К. Каково давление в баллоне? Ответ выразите в килопаскалях и округлите до целых.
Дано: решение
V = 16,6 m3 p V = =( ṃ /М) *RT
m = 20 кг p = (m/M)*(RT/V)
T = 300K p =(20/0,028)*(8,31*300/16,6) = 107000 Па =107кПа
Найти: Ответ: 107 кПа
Р.
2. Установите соответствие между физическими константами и их размерностями.
Физические константы их размерности
А) постоянная Больцмана 1. К*м/(моль*Н)
Б) универсальная газовая постоянная 2. Вт*с/К
3.К/(Вт*с)
4.Дж/(моль*К)
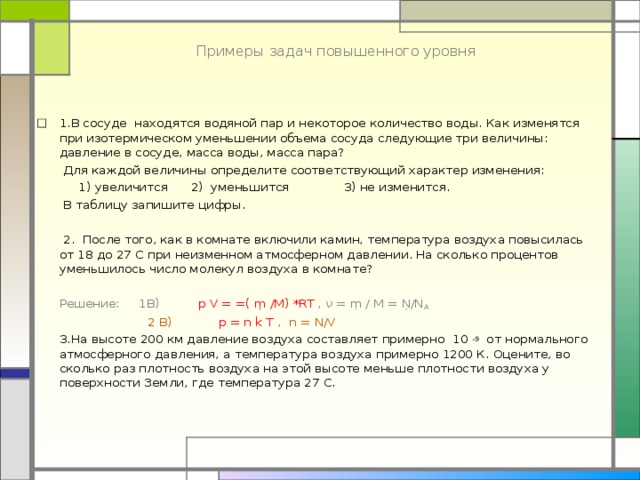
Примеры задач повышенного уровня
- 1.В сосуде находятся водяной пар и некоторое количество воды. Как изменятся при изотермическом уменьшении объема сосуда следующие три величины: давление в сосуде, масса воды, масса пара?
Для каждой величины определите соответствующий характер изменения:
1) увеличится 2) уменьшится 3) не изменится.
В таблицу запишите цифры.
2. После того, как в комнате включили камин, температура воздуха повысилась от 18 до 27 С при неизменном атмосферном давлении. На сколько процентов уменьшилось число молекул воздуха в комнате?
Решение: 1В) p V = =( ṃ /М) *RT , ν = ṃ / М = Ṇ/N A
2 В) p = n k T , n = N/V
3.На высоте 200 км давление воздуха составляет примерно 10 -9 от нормального атмосферного давления, а температура воздуха примерно 1200 К. Оцените, во сколько раз плотность воздуха на этой высоте меньше плотности воздуха у поверхности Земли, где температура 27 С.
Примеры задач высокого уровня (часть С)
1. В сосуде неизменного объема находится двухатомный газ при температуре 300 К. Во сколько раз увеличится давление газа в сосуде при нагревании до 600 К, если при этой температуре 40% молекул диссоциируют?
Решение. Начальное состояние газа можно охарактеризовать основным уравнением МКТ: p = n 0 k T . После нагревания 0,4 n 0 молекул распадутся на атомы, а 0,6 n 0 молекул останутся в прежнем виде. Согласно закону Дальтона
P 1 = 0,4*2 n 0 kT 1 + 0,6 n 0 kT 1 = 1,4 n 0 kT 1
P 1 / P = T 1 /T = 1,4
2. Газонепроницаемая оболочка воздушного шара имеет массу 400 кг. Шар наполнен гелием. Он может удерживать груз массой 225 кг в воздухе на высоте, где температура воздуха 17 С, а давление равно 100 000 Па. Какова масса гелия в оболочке шара? Объем груза пренебрежительно мал по сравнению с объемом шара.
Решение: шар с грузом находится в равновесии, значит сумма сил, действующих на него, равна нулю : Mg + mg + m 1 g – ρ g v =0, где М – масса оболочки, m -масса груза, m 1 – масса гелия , ρ g V = m 2 g – сила Архимеда, действующая на шар. Или M + m + m 1 – m 2 =0 Затем воспользуемся уравнением М. –К. Т.к давление и температура гелия и воздуха одинаковы, то pV =( m 1 / M г)* RT = ( m 2 / M в)* RT . Откуда m 2 = m 1 M в/Мг . Подставив последнее равенство в условие равновесия, получим m 1 = ( M + m )* M г/( M в – M г) = 100 кг. Ответ: 100 кг.
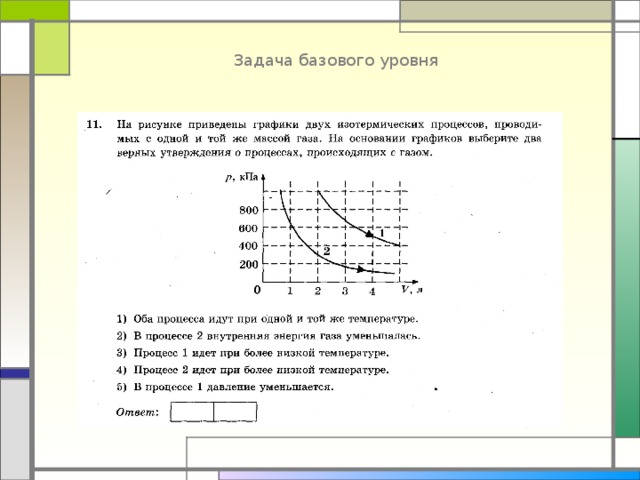
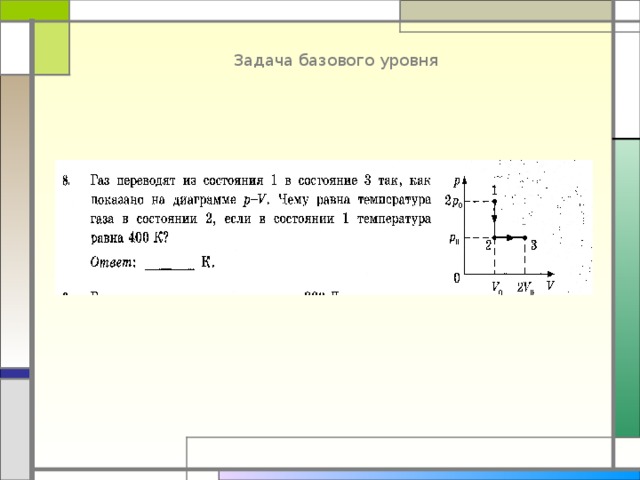
Задача базового уровня
Задача базового уровня
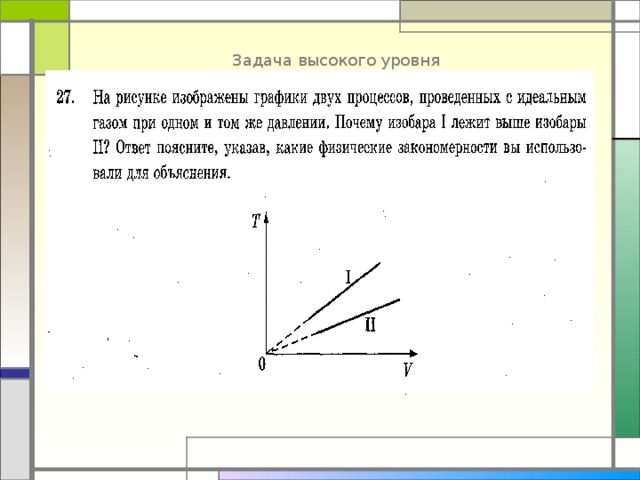
Задача высокого уровня
Процессы изобарные, можно использовать уравнение М-К: PV = ν RT . Запишем его для двух изобар: PV 1 = ν 1 RT 1 , PV 2 = ν 2 RT 2
Найдем отношение последних равенств для одинаковых объемов газа: 1 =( ν 1 /ν 2 )* T 1 / T 2 , откуда получим T 1 / T 2 = ν 2 /ν 1 . Так как T 1 больше T 2, то ν 2 больше ν 1 , т.е в этих процессах разное количество вещества.
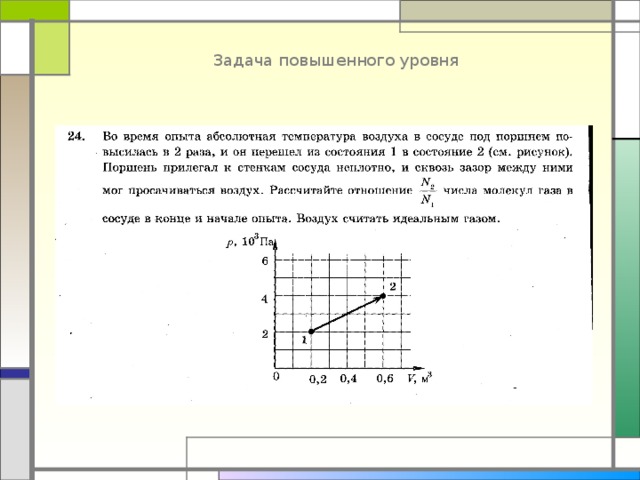
Задача повышенного уровня
1. Молекулярная физика Курс подготовки к Единому государственному экзамену
2. Цель: повторение основных понятий, законов и формул молекулярной физики в соответствии с кодификатором ЕГЭ
Элементы содержания, проверяемые на ЕГЭ 2012:
1.Основные положения МКТ.
2.Модели строения газов, жидкостей и твердых тел.
3.Модель идеального газа.
4.Основное уравнение МКТ идеального газа.
5.Абсолютная температура как мера средней кинетической энергии его
частиц.
6.Уравнение Менделеева-Клапейрона.
7.Изопроцессы.
8.Взаимные превращения жидкостей и газов.
9.Насыщенные и ненасыщенные пары. Влажность воздуха.
10.Изменение агрегатных состояний вещества. Плавление и
отвердевание.
11.Термодинамика: внутренняя энергия, количество теплоты, работа.
12.Первый закон термодинамики
13.Второй закон термодинамики.
14.Применение первого закона термодинамики к изопроцессам.
15.КПД тепловых двигателей.
3. Основные положения МКТ
Молекулярно-кинетической теорией называют
учение о строении и свойствах вещества на основе
представления о существовании атомов и молекул как
наименьших частиц химического вещества.
Основные положения МКТ:
1. Все вещества – жидкие, твердые и газообразные –
образованы из мельчайших частиц – молекул,
которые сами состоят из атомов.
2. Атомы и молекулы находятся в непрерывном
хаотическом движении.
3. Частицы взаимодействуют друг с другом силами,
имеющими электрическую природу (притягиваются и
отталкиваются).
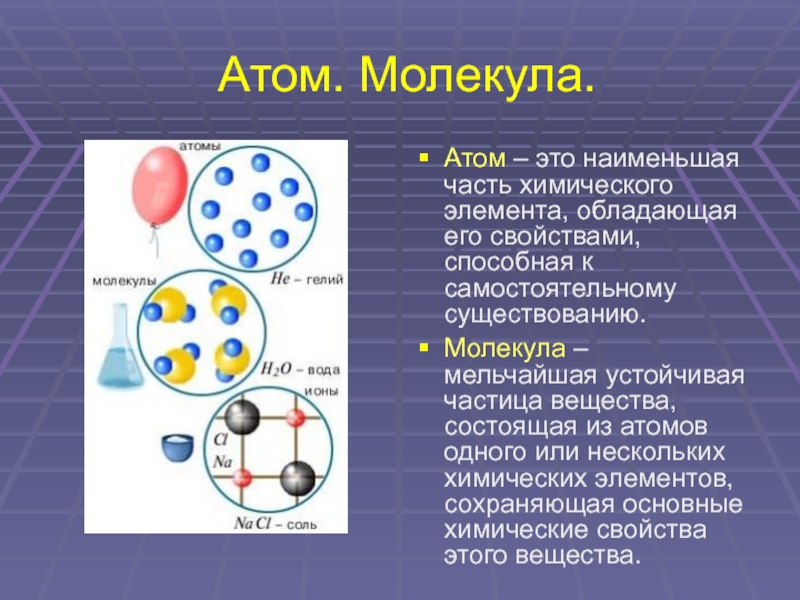
4. Атом. Молекула.
Атом – это наименьшая
часть химического
элемента, обладающая
его свойствами,
способная к
самостоятельному
существованию.
Молекула –
мельчайшая устойчивая
частица вещества,
состоящая из атомов
одного или нескольких
химических элементов,
сохраняющая основные
химические свойства
этого вещества.
5. Масса молекул. Количество вещества.
Относительной молекулярной (или атомной)
массой вещества называют отношение
массы
m0
M r вещества к 1/12
молекулы (или атома) данного
1
массы атома углерода 12С.
m0C
Количество вещества – это 12
число молекул в
теле, но выраженное в относительных единицах.
Моль – это количество вещества, содержащее
столько же частиц (молекул), сколько атомов
содержится в 0,012 кг углерода 12C.
23
1
Значит
любого
вещества содержится
N A 6в 110моль
моль
одно и то же число частиц (молекул). Это число
называется постоянной Авогадро NА.
Количество вещества равноN отношению числа
молекул в данном теле к постоянной
Авогадро, т.е.
NA
к числу молекул в 1 моль вещества.
кг
3
m
MM
M
r 10
m0 N A
Молярной массой вещества называют
массу
моль
вещества, взятого в количестве 1 моль.
6. Модели строения твердых тел, жидкостей и газов
Молекулы большинства твердых тел
расположены в определенном порядке.
Такие твердые тела называют
кристаллическими.
Движения частиц представляют собой
колебания около положений равновесия.
Если соединить центры положений
равновесия частиц, то получится
правильная пространственная решетка,
называемая кристаллической.
Расстояния между молекулами сравнимо
с размерами молекул.
Основные свойства: сохраняют форму и
объем. Монокристаллы анизотропны.
Анизотропия – зависимость физических
свойств от направления в кристалле.
l r0
7. Модели строения твердых тел, жидкостей и газов
Расстояния между молекулами
жидкости сравнимо с размерами
молекул, поэтому жидкость мало
сжимается.
Молекула жидкости колеблется
около положения временного
равновесия, сталкиваясь с другими
молекулами из ближайшего
окружения. Время от времени ей
удается совершить «прыжок»,
чтобы продолжать совершать
колебания среди других соседей.
«Прыжки» молекул происходят по
всем направлениям с одинаковой
частотой, этим объясняется
текучесть жидкости и то, что она
принимает форму сосуда
l r0
8. Модели строения твердых тел, жидкостей и газов
Расстояние между молекулами газов
намного больше размеров самих
молекул, поэтому газ можно сжать так,
что его объем уменьшится в несколько
раз.
Молекулы с огромными скоростями
движутся в пространстве между
столкновениями. Во время
столкновений молекулы резко меняют
скорость и направление движения.
Молекулы очень слабо притягиваются
друг к другу, поэтому газы не имеют
собственной формы и постоянного
объема.
l r0
9. Тепловое движение молекул
Беспорядочное хаотическое движение
молекул называется тепловым
движением. Доказательством
теплового движения является
броуновское движение и диффузия.
Броуновское движение – это тепловое
движение мельчайших частиц,
взвешенных в жидкости или газе,
происходящее под действием ударов
молекул окружающей среды.
Диффузией называется явление
проникновения двух или нескольких
соприкасающихся веществ друг в
друга.
Скорость диффузии зависит от
агрегатного состояния вещества и
температуры тела.
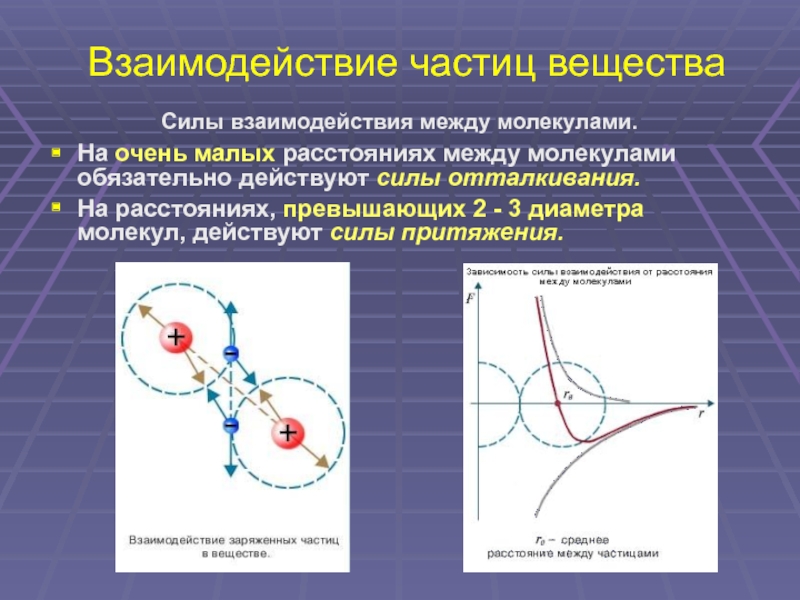
10. Взаимодействие частиц вещества
Силы взаимодействия между молекулами.
На очень малых расстояниях между молекулами
обязательно действуют силы отталкивания.
На расстояниях, превышающих 2 — 3 диаметра
молекул, действуют силы притяжения.
11. Модель идеального газа
Идеальный газ – это теоретическая модель
газа, в которой пренебрегают размерами и
взаимодействиями частиц газа и учитывают
лишь их упругие столкновения.
В кинетической модели идеального газа
молекулы рассматриваются как идеально
упругие шарики, взаимодействующие между
собой и со стенками только во время упругих
столкновений.
Суммарный объем всех молекул предполагается
малым по сравнению с объемом сосуда, в
котором находится газ.
Сталкиваясь со стенкой сосуда, молекулы газа
оказывают на нее давление.
Микроскопические параметры: масса,
скорость, кинетическая энергия молекул.
Макроскопические параметры: давление,
объем, температура.
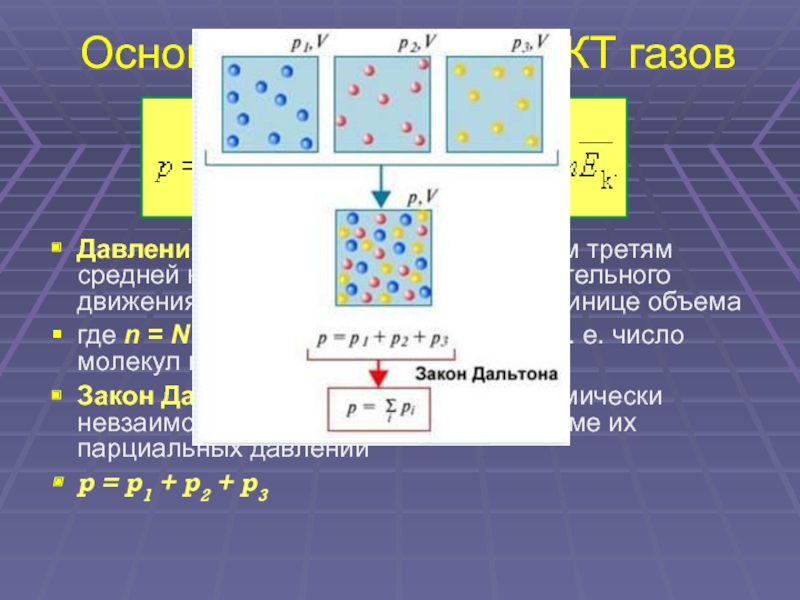
12. Основное уравнение МКТ газов
Давление идеального газа равно двум третям
средней кинетической энергии поступательного
движения молекул, содержащихся в единице объема
где n = N / V – концентрация молекул (т. е. число
молекул в единице объема сосуда)
Закон Дальтона: давление в смеси химически
невзаимодействующих газов равно сумме их
парциальных давлений
p = p1 + p2 + p3
13. Абсолютная температура
Температура характеризует степень нагретости тела.
Тепловое равновесие – это такое состояние системы
тел, находящихся в тепловом контакте, при котором не
происходит теплопередачи от одного тела к другому, и
все макроскопические параметры тел остаются
неизменными.
Температура – это физический параметр, одинаковый
для всех тел, находящихся в тепловом равновесии.
Для измерения температуры используются физические
приборы – термометры.
Существует минимально возможная температура, при
которой прекращается хаотическое движение молекул.
Она называется абсолютным нулем температуры.
Температурная шкала Кельвина называется абсолютной
шкалой температур.
T t 273
14. Абсолютная температура
Средняя кинетическая энергия хаотического движения
молекул газа прямо пропорциональна абсолютной
температуре.
3
E kT
2
2
p nE p nkT
3
k – постоянная Больцмана – связывает температуру в
энергетических единицах с температурой в кельвинах
Температура есть мера средней кинетической энергии
поступательного движения молекул.
При одинаковых давлениях и температурах концентрация
молекул у всех газов одинакова
Закон Авогадро: в равных объемах газов при одинаковых
температурах и давлениях содержится одинаковое число
молекул
15. Уравнение Менделеева-Клапейрона
Уравнение состояния идеального газа – это зависимость между
параметрами идеального газа – давлением, объемом и
абсолютной температурой, определяющими его состояние.
pV RT
m
RT
M
R kN A 8,31
Дж
моль К
R — универсальная газовая постоянная.
Закон Авогадро: один моль любого газа при нормальных условиях
занимает один и тот же объем V0, равный 0,0224 м3/моль .
Из уравнения состояния вытекает связь между давлением,
объемом и температурой идеального газа, который может
находиться в двух любых состояниях.
Уравнение Клапейрона
pV
pV
1 1
T1
2 2
T2
const .
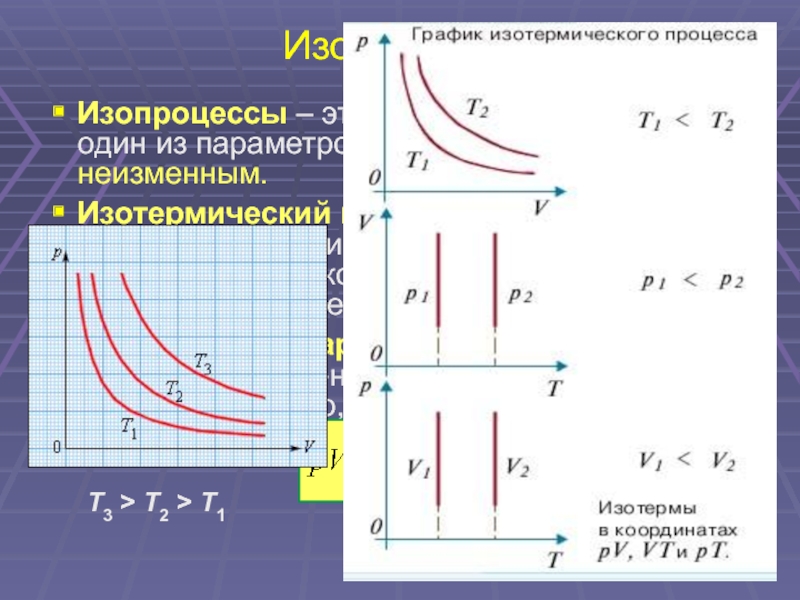
16. Изопроцессы
Изопроцессы – это процессы, в которых
один из параметров (p, V или T) остается
неизменным.
Изотермический процесс (T = const) –
процесс изменения состояния
термодинамической системы, протекающий
при постоянной температуре T.
Закон Бойля–Мариотта: для газа данной
массы произведение давления газа на его
объем постоянно, если температура газа не
меняется.
const
pV const p
V
T3 > T2 > T1
17. Изопроцессы
Изохорный процесс – это процесс изменения
состояния термодинамической системы при
постоянном объеме.
Закон Шарля: для газа данной массы
отношение давления к температуре постоянно,
если объем не меняется.
p
const p const T
T
V3 > V2 > V1
18. Изопроцессы
Изобарный процесс – это процесс изменения
состояния термодинамической системы при
постоянном давлении.
Закон Гей-Люссака: для газа данной массы
отношение объема к температуре постоянно, если
давление газа не меняется.
V
V V0 1 t
const V const T
T
При постоянном давлении объем идеального газа
меняется линейно с температурой.
где V0 – объем газа при температуре 0 °С.
α = 1/273,15 К–1 — температурный коэффициент объемного
расширения газов.
p3 > p2 > p1
19. Взаимные превращения жидкостей и газов
Парообразование – это переход вещества из
жидкого состояния в газообразное.
Конденсация – переход вещества из
газообразного состояния в жидкое.
Испарение – это парообразование,
происходящее со свободной поверхности
жидкости.
С точки зрения молекулярно-кинетической
теории, испарение – это процесс, при котором с
поверхности жидкости вылетают наиболее
быстрые молекулы, кинетическая энергия
которых превышает энергию их связи с
остальными молекулами жидкости. Это приводит
к уменьшению средней кинетической энергии
оставшихся молекул, т. е. к охлаждению
жидкости.
При конденсации происходит выделение
некоторого количества теплоты в окружающую
среду.
20. Взаимные превращения жидкостей и газов Насыщенные и ненасыщенные пары
В закрытом сосуде жидкость и ее
пар могут находиться в состоянии
динамического равновесия, когда
число молекул, вылетающих из
жидкости, равно числу молекул,
возвращающихся в жидкость из
пара, т. е. когда скорости процессов
испарения и конденсации
одинаковы.
Пар, находящийся в равновесии со
своей жидкостью, называют
насыщенным.
Давление насыщенного пара p0
данного вещества зависит только от
его температуры и не зависит от
объема
Давление насыщенного пара растет
не только в результате повышения
температуры жидкости, но и
вследствие увеличения
концентрации молекул пара.
p0 nkT
21. Взаимные превращения жидкостей и газов Кипение
Кипение – это парообразование,
происходящее по всему объему жидкости.
Кипение жидкости начинается при
такой температуре, при которой
давление ее насыщенных паров
становится равным давлению в
жидкости, которое складывается из
давления воздуха на поверхность
жидкости (внешнее давление) и
гидростатического давления столба
жидкости.
У каждой жидкости своя температура
кипения, которая зависит от давления
насыщенного пара. Чем ниже давление
насыщенного пара, тем выше
температура кипения соответствующей
жидкости
22. Влажность воздуха
Влажность воздуха – это содержание в воздухе водяного
пара.
Чем больше водяных паров находится в определенном объеме
воздуха, тем ближе пар к состоянию насыщения. Чем выше
температура воздуха, тем большее количество водяных паров
требуется для его насыщения.
Абсолютная влажность – это плотность водяного пара,
выраженная в кг/м3 или его парциальное давление — давление
водяного пара, которое он производил бы, если бы все другие
газы отсутствовали.
Относительная влажность воздуха – это отношение
абсолютной влажности воздуха к плотности насыщенного пара
при той же температуре или это отношение парциального
давления пара в воздухе к давлению насыщенного пара при той
же температуре.
p
100%;
100%
0
p0
Для определения влажности воздуха используют гигрометры:
конденсационный и волосной; и психрометр.
23. Изменение агрегатных состояний вещества: плавление и кристаллизация
Плавление — переход вещества из
твёрдого состояния в жидкое.
Отвердевание или кристаллизация переход вещества из жидкого состояния в
твердое.
Температура при которой вещество
начинает плавиться называется
температурой плавления.
Во время плавления вещества его
температура не изменяется, т.к. энергия,
получаемая веществом, тратится на
разрушение кристаллической решетки. При
отвердевании образуется кристаллическая
решетка, при этом энергия выделяется и
температура вещества не изменяется.
У аморфных тел нет определенной
температуры плавления.
24. Термодинамика
Термодинамика – это теория тепловых процессов,
в которой не учитывается молекулярное строение
тел.
Основные понятия термодинамики:
Макроскопическая система – система, состоящая
из большого числа частиц.
Замкнутая система – система, изолированная от
любых внешних воздействий.
Равновесное состояние – это состояние
макроскопической системы, при котором
параметры, характеризующие ее состояние,
остаются неизменными во всех частях системы.
Процессом в термодинамике называется
изменение состояния тела со временем.
25. Внутренняя энергия
Внутренняя энергия тела – это сумма
кинетической энергии всех его молекул и
потенциальной энергии их взаимодействия.
Внутренняя энергия идеального газа
определяется только кинетической энергией
беспорядочного поступательного движения его
молекул.
3 m
3
U
RT
U pV
2M
2
Внутренняя энергия идеального одноатомного
газа прямо пропорциональна его температуре.
Внутреннюю энергию можно изменить двумя
способами: совершением работы и
теплопередачей.
26. Теплопередача
Теплопередача – это
самопроизвольный процесс передачи
теплоты, происходящий между телами
с разной температурой.
Виды теплопередачи
Теплопроводность
Конвекция
Излучение
27. Количество теплоты
Количеством теплоты называют
количественную меру изменения
внутренней энергии тела при
теплообмене (теплопередаче).
Количество теплоты, необходимое для
нагревания тела или выделяемого им
при охлаждении:
с – удельная теплоемкость –
физическая величина, показывающая,
какое количество теплоты требуется
для нагревания 1 кг вещества на 1 0С.
Количество теплоты, выделяемое при
полном сгорании топлива.
q – удельная теплота сгорания –
величина, показывающая, какое
количество теплоты выделяется при
полном сгорании топлива массой 1 кг.
Q cm t2 t1
Q qm
28. Количество теплоты
Количество теплоты, необходимое для
плавления кристаллического тела или
выделяемое телом при отвердевании.
λ – удельная теплота плавления –
величина, показывающая, какое
количество теплоты необходимо
сообщить кристаллическому телу
массой 1 кг, чтобы при температуре
плавления полностью перевести его в
жидкое состояние.
Количество теплоты, необходимое для
полного превращения жидкого
вещества в пар или выделяемое телом
при конденсации.
r или L – удельная теплота
парообразования – величина,
показывающая, какое количество
теплоты необходимо, чтобы обратить
жидкость массой 1 кг в пар без
изменения температуры.
Q m
Q rm; Q Lm
29. Работа в термодинамике
В термодинамике, в отличие от механики,
рассматривается не движение тела как целого,
а лишь перемещение частей
макроскопического тела относительно друг
друга. В результате меняется объем тела, а
его скорость остается равной нулю.
При расширении газ совершает
положительную работу А’ = pΔV. Работа А,
совершаемая внешними телами над газом
отличается от работы газа А’ только знаком: А
= — А’.
На графике зависимости давления от объема
работа определяется как площадь фигуры под
графиком.
30. Первый закон термодинамики
Первый закон термодинамики – это закон сохранения и
превращения энергии для термодинамической системы.
Изменение внутренней энергии системы при переходе ее
из одного состояния в другое равно сумме работы
внешних сил и количества теплоты, переданного системе.
U A Q
Если работу совершает система, а не внешние силы:
Q U A
Количество теплоты, переданное системе, идет на
изменение ее внутренней энергии и на совершение
системой работы над внешними телами.
31. Применение первого закона термодинамики к различным процессам
Изобарный процесс.
Количество теплоты, переданное системе,
Q U A
идет на изменение ее внутренней энергии и на
совершение системой работы над внешними
телами.
Изохорный процесс: V – const => A = 0
Изменение внутренней энергии равно
количеству переданной теплоты.
Изотермический процесс: Т – const => ΔU = 0
Все переданное газу количество теплоты идет
на совершение работы.
Адиабатный процесс: протекает в системе,
которая не обменивается теплотой с
окружающими телами, т.е. Q = 0
Изменение внутренней энергии происходит
только за счет совершения работы.
U Q
Q A
U A
32. Второй закон термодинамики
Все процессы самопроизвольно протекают в
одном определенном направлении. Они
необратимы. Теплота всегда переходит от
горячего тела к холодному, а механическая
энергия макроскопических тел – во внутреннюю.
Направление процессов в природе указывает
второй закон термодинамики.
Р. Клаузиус (1822 – 1888): невозможно
перевести теплоту от более холодной системы к
более горячей при отсутствии других
одновременных изменений в обеих системах или
в окружающих телах.
33. КПД тепловой машины
Тепловые двигатели – устройства,
превращающие внутреннюю энергию
топлива в механическую.
Рабочим телом у всех ТД является газ,
который получает при сгорании топлива
количество теплоты Q1, совершает
работу А’ при расширении. Часть
теплоты Q2 неизбежно передается
холодильнику, т.е. теряется.
Коэффициентом полезного действия
теплового двигателя называют
отношение работы, совершаемой
двигателем, к количеству теплоты,
полученному от нагревателя:
Идеальная тепловая машина Карно с
идеальным газом в качестве рабочего
тела имеет максимально возможный
КПД:
A Q1 Q2
A Q1 Q2
Q1
Q1
max
T1 T2
T1
34.
35.
1. термометр не рассчитан на высокие температуры
и требует замены
2. термометр показывает более высокую
температуру
3. термометр показывает более низкую температуру
4. термометр показывает расчетную температуру
36.
1. 180С.
2. 190С
3. 210С.
4. 220С.
37.
Т,К
350
300
0
t(мин)
2
4
6
8
1. теплоемкость воды увеличивается со временем
2. через 5 минут вся вода испарилась
3. при температуре 350 К вода отдает воздуху столько тепла,
сколько получает от газа
4. через 5 минут вода начинает кипеть
38.
1. Вода переходит из
твердого состояния в
жидкое при 00С.
2. Вода кипит при 1000С.
3. Теплоемкость воды
равна 4200 Дж/(кг 0С).
4. Чем дольше нагревается
вода, тем выше ее
температура.
39.
1. В положении I теплопередача осуществляется от тела 1 к телу 2.
2. В положении II теплопередача осуществляется от тела 1 к телу 2.
3. В любом положении теплопередача осуществляется от тела 2
к телу 1.
4. Теплопередача осуществляется только в положении II.
40.
Р
Р
P
Р
50
50
50
50
(В)
40
40
(A)
(Б)
30
(Г)
40
30
30
20
20
20
10
10
10
0
0
0
0
2
4
6
8
2
4
6
8
10
00
10
2
4
6
8
10
10
1) График А
V
V
V
2) График Б
3) График В
V
4) График Г.
41.
1. только А
2. только Б
3. только В
4. А, Б и В
42.
E k
1
1. 1
2. 2
3. 3
4. 4
1
2
3
4
0
T
43.
44.
1. А
2. Б
3. В
4. Г
P, кПа
А
Б
2
В
1
0
Г
1
2
3
V,м
45.
1. равна средней кинетической энергии молекул
жидкости
2. превышает среднюю кинетическую энергию
молекул жидкости
3. меньше средней кинетической энергии молекул
жидкости
4. равна суммарной кинетической энергии молекул
жидкости
46.
1. Увеличилось в 4 раза
2. Уменьшилось в 2 раза
3. Увеличилось в 2 раза
4. Не изменилось
pV
const T
const p
T
V
47.
48.
1.
2.
3.
4.
200 К
400 К
600 К
1200 К
P, кПа
200
100
0
2
1
4
1
3
2
3
3 V, м
p4V4 p2V2
p2V2
200 3 200
T2
T4
1200 K
T4
T2
p4V4
100 1
49.
1.
2.
3.
4.
уменьшилось в 3 раза
увеличилось в 3 раза
увеличилось в 9 раз
не изменилось
2
p nE
3
50.
1.
2.
3.
4.
изобарное нагревание
изохорное охлаждение
изотермическое сжатие
изохорное нагревание
51.
1. мощности нагревателя
2. вещества сосуда, в котором нагревается вода
3. атмосферного давления
4. начальной температуры воды
52.
1. точка 2
2. точка 4
3. точка 5
4. точка 6
53.
1.
2.
3.
4.
уменьшается
увеличивается
не изменяется
может увеличиваться или уменьшаться
54.
1. увеличилась на 1000 Дж
2. увеличилась на 200 Дж
3. уменьшилась на 1000 Дж
4. уменьшилась на 200 Дж
Q A U U Q A 400 600 200 Дж
55.
1. увеличивается для любого кристаллического
вещества
2. уменьшается для любого кристаллического
вещества
3. для одних кристаллических веществ
увеличивается, для других – уменьшается
4. не изменяется
56.
1. при низкой, так как при этом пот испаряется
быстро
2. при низкой, так как при этом пот испаряется
медленно
3. при высокой, так как при этом пот
испаряется быстро
4. при высокой, так как при этом пот
испаряется медленно
57.
1.
2.
3.
4.
в 2 раза
в 3 раза
в 6 раз
в 1,5 раза
m
pVM
pV
RT m
M
RT
58.
V
1. А
2. В
3. С
4. D
D
A
B
0
C
Т
59.
1. 32Т
2. 16Т
3. 2Т
4. Т
pV RT
60.
1. вода аммиак ртуть
2. аммиак ртуть вода
3. вода ртуть аммиак
4. ртуть вода аммиак
61.
1.
2.
3.
4.
А
В
р
D
A
С
D
m
pVM
pV
RT m
M
RT
B
0
C
Т
62.
1.
2.
3.
4.
37%
40%
48%
59%
63.
64.
1.
2.
3.
4.
только в жидком состоянии
только в твердом состоянии
и в жидком, и в твердом состояниях
и в жидком, и в газообразном состояниях
65.
ОСОБЕННОСТИ ИЗОПРОЦЕССА
НАЗВАНИЕ
ИЗОПРОЦЕССА
А) Все переданное газу количество теплоты идет на
совершение работы, а внутренняя энергия газа
остается неизменной.
1) изотермический
Б) Изменение внутренней энергии газа происходит
только за счет совершения работы, так как
теплообмен с окружающими телами отсутствует.
2) изобарный
3) изохорный
4) адиабатный
А
Б
1
4
66.
1
2
3
67.
1. После помещения банки на огонь вода в ней
нагревалась через тонкую стенку банки от горячих
продуктов горения газа. При этом с ростом температуры
вода испарялась, и возрастало давление ее паров в
банке, которые постепенно вытесняли из нее воздух.
Когда вода закипела и почти вся испарилась, воздуха
внутри банки практически не осталось. Давление
насыщенных паров в банке при этом стало равно
внешнему атмосферному давлению.
2. Когда банку сняли с огня, закрыли крышкой и охладили
холодной водой почти до комнатной температуры,
горячие пары воды внутри банки остыли и практически
целиком сконденсировались на ее стенках, отдавая
теплоту конденсации наружу, холодной воде, благодаря
процессу теплопроводности через стенки.
68.
1. В соответствии с уравнением Клапейрона–Менделеева
2.
давление пара в банке резко упало – во-первых, из-за
уменьшения массы оставшегося в банке пара, и, во-вторых –
из-за падения его температуры. Заметим, что резкое
уменьшение давления в банке можно объяснить и так: при
понижении температуры до комнатной пары конденсируются,
оставаясь насыщенными, но их давление становится намного
меньше давления насыщенных паров воды при температуре
кипения (примерно в 40 раз).
Поскольку при комнатной температуре давление насыщенных
паров воды составляет лишь малую долю от атмосферного
давления (не более 3–4%), тонкая банка после поливания ее
водой окажется под действием разности этого большого
внешнего давления и низкого давления пара внутри. По этой
причине на банку начнут действовать большие сдавливающие
силы, которые будут стремиться сплющить банку. Как только
эти силы превысят предельную величину, которую могут
выдержать стенки банки, то она сплющится и резко
уменьшится в объеме.
69.
Согласно первому началу
термодинамики количество теплоты,
необходимое для плавления льда, ΔQ1
= λm, где λ – удельная теплота
плавления льда. ΔQ2 –подведённое
джоулево тепло: ΔQ2 = ηPt. В
соответствии с заданными условиями
ΔQ1 = 66 кДж и ΔQ2 = 84 кДж, а значит,
ΔQ1 < ΔQ2, и поставленная задача
выполнима
70.
Согласно первому началу термодинамики, количество
теплоты Q, переданное газу, идет на изменение его
внутренней энергии ΔU и совершение этим газом работы
A, то есть Q = ΔU + A. При нагревании газа происходит
его изобарное расширение. В этом процессе работа газа
равна A = pΔV , где изменение объема газа ΔV = Sl = πR2l.
Из условия равновесия поршня (см. рисунок) найдем
давление газа:pS = p0S + Mgcosα, откуда
Mg cos
p p0
S
Тогда искомая величина равна
Mg cos
U Q R l p0
2
R
2
71.
1. Берков, А.В. и др. Самое полное издание типовых вариантов
реальных заданий ЕГЭ 2010, Физика [Текст]: учебное пособие для
выпускников. ср. учеб. заведений / А.В. Берков, В.А. Грибов. – ООО
«Издательство Астрель», 2009. – 160 с.
2. Касьянов, В.А. Физика, 11 класс [Текст]: учебник для
общеобразовательных школ / В.А. Касьянов. – ООО «Дрофа», 2004. –
116 с.
3. Мякишев, Г.Я. и др. Физика. 11 класс [Текст]: учебник для
общеобразовательных школ / учебник для общеобразовательных
школ Г.Я. Мякишев, Б.Б. Буховцев . –» Просвещение «, 2009. – 166 с.
4. Открытая физика [текст, рисунки]/ http://www.physics.ru
5. Подготовка к ЕГЭ /http://egephizika
6. Федеральный институт педагогических измерений. Контрольные
измерительные материалы (КИМ) Физика //[Электронный ресурс]//
http://fipi.ru/view/sections/92/docs/
7. Физика в школе. Физика — 10 класс. Молекулярная физика.
Молекулярно-кинетическая теория. Рисунки по физике/
http://gannalv.narod.ru/mkt/
8. Эта удивительная физика/ http://sfiz.ru/page.php?id=39
Молекулярная физика. Подготовка к ЕГЭ (презентация)
Аннотация:
Методическое пособие (презентация) «МОЛЕКУЛЯРНАЯ ФИЗИКА» составлена в соответствии с требованиями к Единому Государственному Экзамену (ЕГЭ) по физике 2010 года и предназначено для подготовки выпускников к экзамену.
В разработке приведены краткие сведения по молекулярной физике в соответствии с элементами содержания, проверяемыми на ЕГЭ (кодификатором ЕГЭ) по вопросам:
1. Модели строения газов, жидкостей и твердых
2. Тепловое движение атомов и молекул
3. Броуновское движение
4. Диффузия
5. Взаимодействие частиц вещества
6. Модель идеального газа
7. Связь между давлением и средней кинетической энергией теплового движения молекул идеального газа
8. Абсолютная температура
9. Абсолютная температура как мера средней кинетической энергии его частиц
10. Уравнение Менделеева-Клапейрона
11. Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы
12. Насыщенные и ненасыщенные пары
13. Влажность воздуха
14. Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
15. Изменение агрегатных состояний вещества: плавление и кристаллизация
Краткость и наглядность изложения позволяет быстро и качественно повторить пройденный материал при повторении курса физики в 11 классе, а также на примерах демоверсий ГИА-9 и ЕГЭ по физике 2001-2010 годов показать применение основных законов и формул в вариантах экзаменационных заданий уровня А (приведены задания А1-А4)
Пособие можно использовать и для 9-10 класса при повторении темы «МОЛЕКУЛЯРНАЯ ФИЗИКА», что позволит сориентировать обучающихся на экзамен по выбору в предвыпускные годы. Для 9-классников пособие может служить подготовкой к ГИА-9.
Целевая аудитория: для 11 класса
Автор: Попова И.А.
Место работы: МОУ СОШ № 30 г. Белово
Добавил: rina
Уважаемые коллеги! Автор ждёт Ваши отзывы! Оставьте своё мнение о разработке!
Всего комментариев: 2
Порядок вывода комментариев:

Физкультминутки
Физкультминутки обеспечивают кратковременный отдых детей на уроке, а также способствуют переключению внимания с одного вида деятельности на другой.

В помощь учителю
Уважаемые коллеги! Добавьте свою презентацию на Учительский портал и получите бесплатное свидетельство о публикации методического материала в международном СМИ.
Для добавления презентации на портал необходимо зарегистрироваться.
Конкурсы
Диплом и справка о публикации каждому участнику!
© 2007 — 2023 Сообщество учителей-предметников «Учительский портал»
Свидетельство о регистрации СМИ: Эл № ФС77-64383 выдано 31.12.2015 г. Роскомнадзором.
Территория распространения: Российская Федерация, зарубежные страны.
Учредитель / главный редактор: Никитенко Е.И.
Сайт является информационным посредником и предоставляет возможность пользователям размещать свои материалы на его страницах.
Публикуя материалы на сайте, пользователи берут на себя всю ответственность за содержание этих материалов и разрешение любых спорных вопросов с третьими лицами.
При этом администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта.
Если вы обнаружили, что на сайте незаконно используются материалы, сообщите администратору через форму обратной связи — материалы будут удалены.
Все материалы, размещенные на сайте, созданы пользователями сайта и представлены исключительно в ознакомительных целях. Использование материалов сайта возможно только с разрешения администрации портала.
Фотографии предоставлены
Слайд 1Молекулярная физика
Курс подготовки к Единому государственному экзамену

Слайд 2Цель: повторение основных понятий, законов и формул молекулярной физики в соответствии
с кодификатором ЕГЭ
Элементы содержания, проверяемые на ЕГЭ 2012:
Основные положения МКТ.
Модели строения газов, жидкостей и твердых тел.
Модель идеального газа.
Основное уравнение МКТ идеального газа.
Абсолютная температура как мера средней кинетической энергии его частиц.
Уравнение Менделеева-Клапейрона.
Изопроцессы.
Взаимные превращения жидкостей и газов.
Насыщенные и ненасыщенные пары. Влажность воздуха.
Изменение агрегатных состояний вещества. Плавление и отвердевание.
Термодинамика: внутренняя энергия, количество теплоты, работа.
Первый закон термодинамики
Второй закон термодинамики.
Применение первого закона термодинамики к изопроцессам.
КПД тепловых двигателей.

Слайд 3Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе
представления о существовании атомов и молекул как наименьших частиц химического вещества.
Основные положения МКТ:
Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов.
Атомы и молекулы находятся в непрерывном хаотическом движении.
Частицы взаимодействуют друг с другом силами, имеющими электрическую природу (притягиваются и отталкиваются).
Основные положения МКТ

Слайд 4Атом. Молекула.
Атом – это наименьшая часть химического элемента, обладающая его свойствами,
способная к самостоятельному существованию.
Молекула – мельчайшая устойчивая частица вещества, состоящая из атомов одного или нескольких химических элементов, сохраняющая основные химические свойства этого вещества.
Слайд 5Масса молекул. Количество вещества.
Относительной молекулярной (или атомной) массой вещества называют отношение
массы молекулы (или атома) данного вещества к 1/12 массы атома углерода 12С.
Количество вещества – это число молекул в теле, но выраженное в относительных единицах.
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько атомов содержится в 0,012 кг углерода 12C.
Значит в 1 моль любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА.
Количество вещества равно отношению числа молекул в данном теле к постоянной Авогадро, т.е. к числу молекул в 1 моль вещества.
Молярной массой вещества называют массу вещества, взятого в количестве 1 моль.

Слайд 6Модели строения твердых тел, жидкостей и газов
Молекулы большинства твердых тел расположены
в определенном порядке. Такие твердые тела называют кристаллическими.
Движения частиц представляют собой колебания около положений равновесия.
Если соединить центры положений равновесия частиц, то получится правильная пространственная решетка, называемая кристаллической.
Расстояния между молекулами сравнимо с размерами молекул.
Основные свойства: сохраняют форму и объем. Монокристаллы анизотропны.
Анизотропия – зависимость физических свойств от направления в кристалле.

Слайд 7Модели строения твердых тел, жидкостей и газов
Расстояния между молекулами жидкости сравнимо
с размерами молекул, поэтому жидкость мало сжимается.
Молекула жидкости колеблется около положения временного равновесия, сталкиваясь с другими молекулами из ближайшего окружения. Время от времени ей удается совершить «прыжок», чтобы продолжать совершать колебания среди других соседей. «Прыжки» молекул происходят по всем направлениям с одинаковой частотой, этим объясняется текучесть жидкости и то, что она принимает форму сосуда

Слайд 8Модели строения твердых тел, жидкостей и газов
Расстояние между молекулами газов намного
больше размеров самих молекул, поэтому газ можно сжать так, что его объем уменьшится в несколько раз.
Молекулы с огромными скоростями движутся в пространстве между столкновениями. Во время столкновений молекулы резко меняют скорость и направление движения.
Молекулы очень слабо притягиваются друг к другу, поэтому газы не имеют собственной формы и постоянного объема.

Слайд 9Тепловое движение молекул
Беспорядочное хаотическое движение молекул называется тепловым движением. Доказательством теплового
движения является броуновское движение и диффузия.
Броуновское движение – это тепловое движение мельчайших частиц, взвешенных в жидкости или газе, происходящее под действием ударов молекул окружающей среды.
Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга.
Скорость диффузии зависит от агрегатного состояния вещества и температуры тела.

Слайд 10Взаимодействие частиц вещества
Силы взаимодействия между молекулами.
На очень малых расстояниях между молекулами
обязательно действуют силы отталкивания.
На расстояниях, превышающих 2 — 3 диаметра молекул, действуют силы притяжения.
Слайд 11Идеальный газ – это теоретическая модель газа, в которой пренебрегают размерами
и взаимодействиями частиц газа и учитывают лишь их упругие столкновения.
В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений.
Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ.
Сталкиваясь со стенкой сосуда, молекулы газа оказывают на нее давление.
Микроскопические параметры: масса, скорость, кинетическая энергия молекул.
Макроскопические параметры: давление, объем, температура.
Модель идеального газа

Слайд 12Основное уравнение МКТ газов
Давление идеального газа равно двум третям средней кинетической
энергии поступательного движения молекул, содержащихся в единице объема
где n = N / V – концентрация молекул (т. е. число молекул в единице объема сосуда)
Закон Дальтона: давление в смеси химически невзаимодействующих газов равно сумме их парциальных давлений
p = p1 + p2 + p3
Слайд 13Абсолютная температура
Температура характеризует степень нагретости тела.
Тепловое равновесие – это такое состояние
системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными.
Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии.
Для измерения температуры используются физические приборы – термометры.
Существует минимально возможная температура, при которой прекращается хаотическое движение молекул. Она называется абсолютным нулем температуры.
Температурная шкала Кельвина называется абсолютной шкалой температур.

Слайд 14Абсолютная температура
Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной
температуре.
k – постоянная Больцмана – связывает температуру в энергетических единицах с температурой в кельвинах
Температура есть мера средней кинетической энергии поступательного движения молекул.
При одинаковых давлениях и температурах концентрация молекул у всех газов одинакова
Закон Авогадро: в равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул

Слайд 15Уравнение Менделеева-Клапейрона
Уравнение состояния идеального газа – это зависимость между параметрами
идеального газа – давлением, объемом и абсолютной температурой, определяющими его состояние.
R — универсальная газовая постоянная.
Закон Авогадро: один моль любого газа при нормальных условиях занимает один и тот же объем V0, равный 0,0224 м3/моль .
Из уравнения состояния вытекает связь между давлением, объемом и температурой идеального газа, который может находиться в двух любых состояниях.
Уравнение Клапейрона

Слайд 16Изопроцессы
Изопроцессы – это процессы, в которых один из параметров (p, V
или T) остается неизменным.
Изотермический процесс (T = const) –процесс изменения состояния термодинамической системы, протекающий при постоянной температуре T.
Закон Бойля–Мариотта: для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
T3 > T2 > T1
Слайд 17Изопроцессы
Изохорный процесс – это процесс изменения состояния термодинамической системы при постоянном
объеме.
Закон Шарля: для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
V3 > V2 > V1
Слайд 18Изопроцессы
Изобарный процесс – это процесс изменения состояния термодинамической системы при постоянном
давлении.
Закон Гей-Люссака: для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
При постоянном давлении объем идеального газа меняется линейно с температурой.
где V0 – объем газа при температуре 0 °С.
α = 1/273,15 К–1 — температурный коэффициент объемного расширения газов.
p3 > p2 > p1
Слайд 19Взаимные превращения жидкостей и газов
Парообразование – это переход вещества из жидкого
состояния в газообразное.
Конденсация – переход вещества из газообразного состояния в жидкое.
Испарение – это парообразование, происходящее со свободной поверхности жидкости.
С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости.
При конденсации происходит выделение некоторого количества теплоты в окружающую среду.

Слайд 20Взаимные превращения жидкостей и газов
Насыщенные и ненасыщенные пары
В закрытом сосуде жидкость
и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы.
Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема
Давление насыщенного пара растет не только в результате повышения температуры жидкости, но и вследствие увеличения концентрации молекул пара.

Слайд 21Взаимные превращения жидкостей и газов
Кипение
Кипение – это парообразование, происходящее по всему
объему жидкости.
Кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным давлению в жидкости, которое складывается из давления воздуха на поверхность жидкости (внешнее давление) и гидростатического давления столба жидкости.
У каждой жидкости своя температура кипения, которая зависит от давления насыщенного пара. Чем ниже давление насыщенного пара, тем выше температура кипения соответствующей жидкости

Слайд 22Влажность воздуха
Влажность воздуха – это содержание в воздухе водяного пара.
Чем больше
водяных паров находится в определенном объеме воздуха, тем ближе пар к состоянию насыщения. Чем выше температура воздуха, тем большее количество водяных паров требуется для его насыщения.
Абсолютная влажность – это плотность водяного пара, выраженная в кг/м3 или его парциальное давление — давление водяного пара, которое он производил бы, если бы все другие газы отсутствовали.
Относительная влажность воздуха – это отношение абсолютной влажности воздуха к плотности насыщенного пара при той же температуре или это отношение парциального давления пара в воздухе к давлению насыщенного пара при той же температуре.
Для определения влажности воздуха используют гигрометры: конденсационный и волосной; и психрометр.

Слайд 23Изменение агрегатных состояний вещества:
плавление и кристаллизация
Плавление — переход вещества из твёрдого
состояния в жидкое.
Отвердевание или кристаллизация — переход вещества из жидкого состояния в твердое.
Температура при которой вещество начинает плавиться называется температурой плавления.
Во время плавления вещества его температура не изменяется, т.к. энергия, получаемая веществом, тратится на разрушение кристаллической решетки. При отвердевании образуется кристаллическая решетка, при этом энергия выделяется и температура вещества не изменяется.
У аморфных тел нет определенной температуры плавления.

Слайд 24Термодинамика
Термодинамика – это теория тепловых процессов, в которой не учитывается молекулярное
строение тел.
Основные понятия термодинамики:
Макроскопическая система – система, состоящая из большого числа частиц.
Замкнутая система – система, изолированная от любых внешних воздействий.
Равновесное состояние – это состояние макроскопической системы, при котором параметры, характеризующие ее состояние, остаются неизменными во всех частях системы.
Процессом в термодинамике называется изменение состояния тела со временем.

Слайд 25Внутренняя энергия
Внутренняя энергия тела – это сумма кинетической энергии всех его
молекул и потенциальной энергии их взаимодействия.
Внутренняя энергия идеального газа определяется только кинетической энергией беспорядочного поступательного движения его молекул.
Внутренняя энергия идеального одноатомного газа прямо пропорциональна его температуре.
Внутреннюю энергию можно изменить двумя способами: совершением работы и теплопередачей.

Слайд 26Теплопередача
Теплопередача – это самопроизвольный процесс передачи теплоты, происходящий между телами с
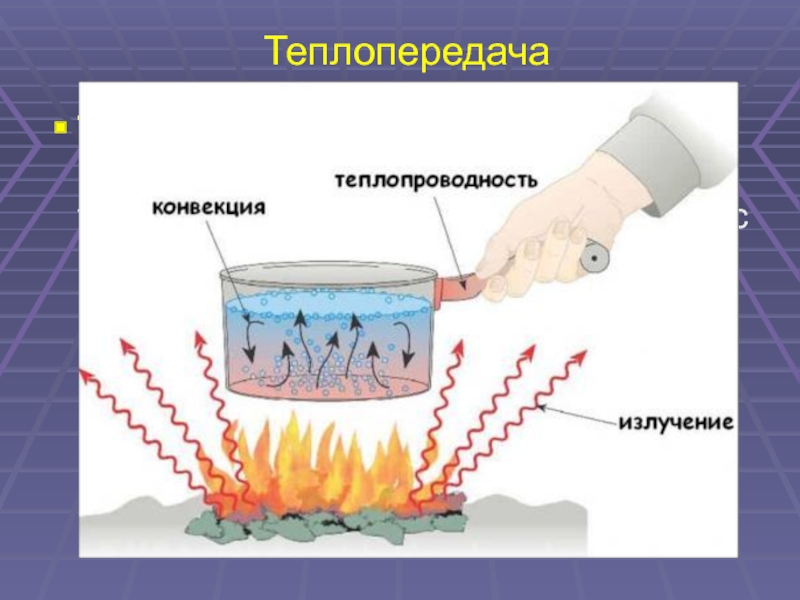
Слайд 27Количество теплоты
Количеством теплоты называют количественную меру изменения внутренней энергии тела при
теплообмене (теплопередаче).
Количество теплоты, необходимое для нагревания тела или выделяемого им при охлаждении:
с – удельная теплоемкость – физическая величина, показывающая, какое количество теплоты требуется для нагревания 1 кг вещества на 1 0С.
Количество теплоты, выделяемое при полном сгорании топлива.
q – удельная теплота сгорания – величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой 1 кг.

Слайд 28Количество теплоты
Количество теплоты, необходимое для плавления кристаллического тела или выделяемое телом
при отвердевании.
λ – удельная теплота плавления – величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления полностью перевести его в жидкое состояние.
Количество теплоты, необходимое для полного превращения жидкого вещества в пар или выделяемое телом при конденсации.
r или L – удельная теплота парообразования – величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры.

Слайд 29Работа в термодинамике
В термодинамике, в отличие от механики, рассматривается не движение
тела как целого, а лишь перемещение частей макроскопического тела относительно друг друга. В результате меняется объем тела, а его скорость остается равной нулю.
При расширении газ совершает положительную работу А’ = pΔV. Работа А, совершаемая внешними телами над газом отличается от работы газа А’ только знаком: А = — А’.
На графике зависимости давления от объема работа определяется как площадь фигуры под графиком.
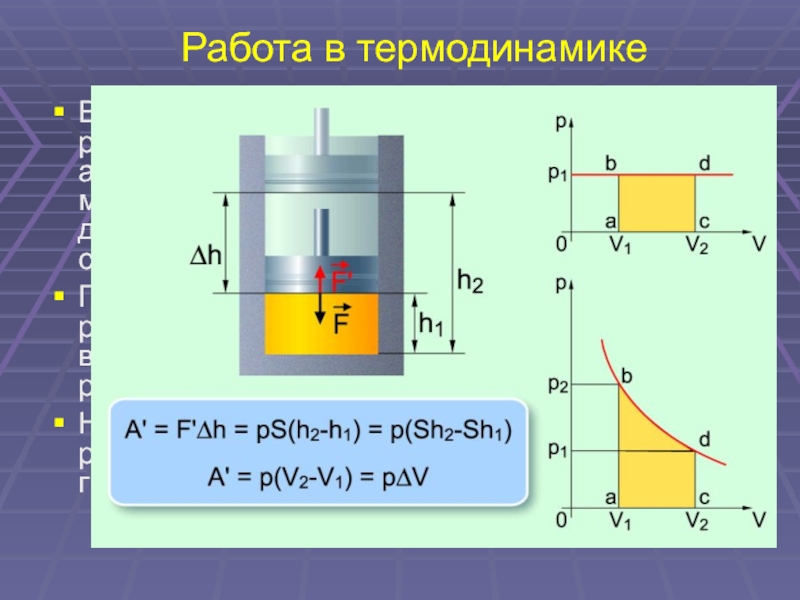
Слайд 30Первый закон термодинамики
Первый закон термодинамики – это закон сохранения и превращения
энергии для термодинамической системы.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе.
Если работу совершает система, а не внешние силы:
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.

Слайд 31Применение первого закона термодинамики к различным процессам
Изобарный процесс.
Количество теплоты, переданное системе,
идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Изохорный процесс: V – const => A = 0
Изменение внутренней энергии равно количеству переданной теплоты.
Изотермический процесс: Т – const => ΔU = 0
Все переданное газу количество теплоты идет на совершение работы.
Адиабатный процесс: протекает в системе, которая не обменивается теплотой с окружающими телами, т.е. Q = 0
Изменение внутренней энергии происходит только за счет совершения работы.

Слайд 32Второй закон термодинамики
Все процессы самопроизвольно протекают в одном определенном направлении. Они
необратимы. Теплота всегда переходит от горячего тела к холодному, а механическая энергия макроскопических тел – во внутреннюю.
Направление процессов в природе указывает второй закон термодинамики.
Р. Клаузиус (1822 – 1888): невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или в окружающих телах.

Слайд 33КПД тепловой машины
Тепловые двигатели – устройства, превращающие внутреннюю энергию топлива в
механическую.
Рабочим телом у всех ТД является газ, который получает при сгорании топлива количество теплоты Q1, совершает работу А’ при расширении. Часть теплоты Q2 неизбежно передается холодильнику, т.е. теряется.
Коэффициентом полезного действия теплового двигателя называют отношение работы, совершаемой двигателем, к количеству теплоты, полученному от нагревателя:
Идеальная тепловая машина Карно с идеальным газом в качестве рабочего тела имеет максимально возможный КПД:
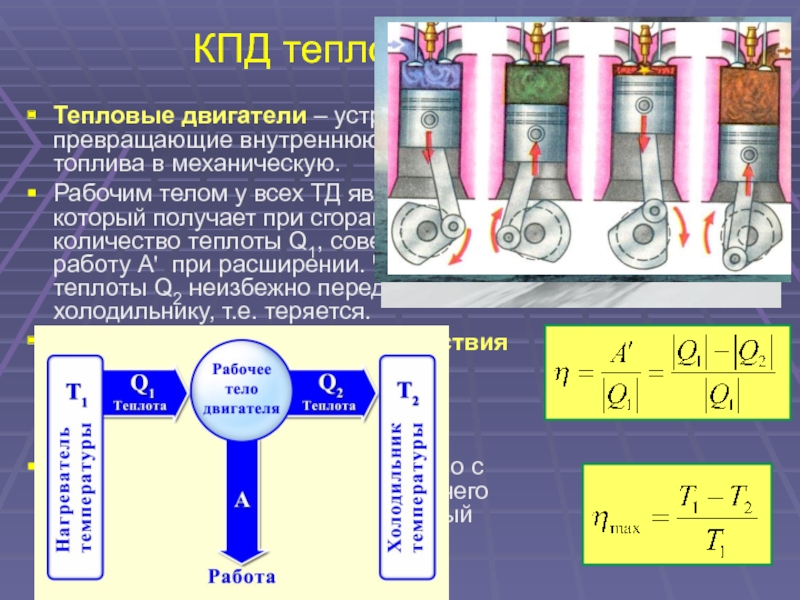
Слайд 35Согласно расчетам, температура жидкости должна быть равна 143 К. Между тем
термометр в сосуде показывает температуру не более –1300 С. Это означает, что
термометр не рассчитан на высокие температуры и требует замены
термометр показывает более высокую температуру
термометр показывает более низкую температуру
термометр показывает расчетную температуру

Слайд 36На рисунке показана часть шкалы термометра, висящего за окном. Температура воздуха
на улице равна …..
180С.
190С
210С.
220С.

Слайд 37Кастрюлю с водой поставили на газовую плиту. Газ горит постоянно. Зависимость
температуры воды от времени представлена на графике. График позволяет сделать вывод, что
теплоемкость воды увеличивается со временем
через 5 минут вся вода испарилась
при температуре 350 К вода отдает воздуху столько тепла, сколько получает от газа
через 5 минут вода начинает кипеть
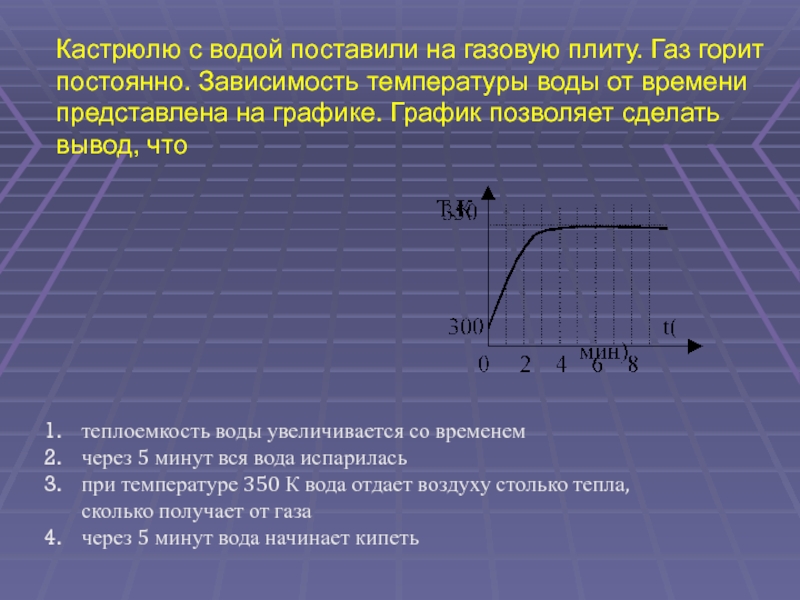
Слайд 38Экспериментально исследовалось, как меняется температура t некоторой массы воды в зависимости
от времени ее нагревания. По результатам измерений построен график, приведенный на рисунке. Какой вывод можно сделать по результатам эксперимента?
Вода переходит из твердого состояния в жидкое при 00С.
Вода кипит при 1000С.
Теплоемкость воды равна 4200 Дж/(кг⋅0С).
Чем дольше нагревается вода, тем выше ее температура.
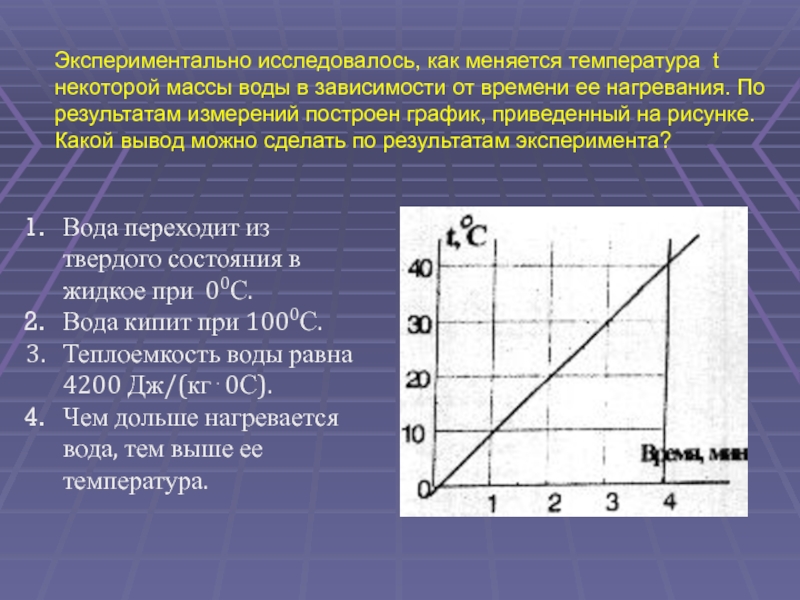
Слайд 39Тела, имеющие разные температуры, привели в соприкосновение двумя способами ( I
и II ). Какое из перечисленных ниже утверждений является верным?
В положении I теплопередача осуществляется от тела 1 к телу 2.
В положении II теплопередача осуществляется от тела 1 к телу 2.
В любом положении теплопередача осуществляется от тела 2 к телу 1.
Теплопередача осуществляется только в положении II.

Слайд 40При исследовании зависимости давления газа от объема были получены некоторые данные.
Какой график правильно проведен по экспериментальным точкам?
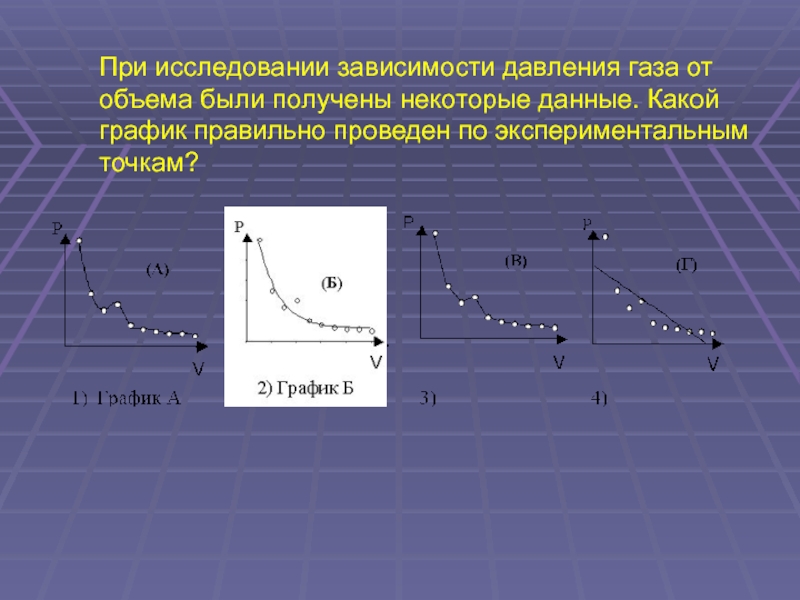
Слайд 41Какой из перечисленных ниже опытов (А, Б или В) подтверждает вывод
молекулярно-кинетической теории о том, что скорость молекул растет при увеличении температуры?
А. Интенсивность броуновского движения растет с повышением температуры.
Б. Давление газа в сосуде растет с повышением температуры.
В. Скорость диффузии красителя в воде повышается с ростом температуры.
только А
только Б
только В
А, Б и В

Слайд 42Какой график (см. рис.) – верно изображает зависимость средней кинетической энергии
частиц идеального газа от абсолютной температуры?
1
2
3
4
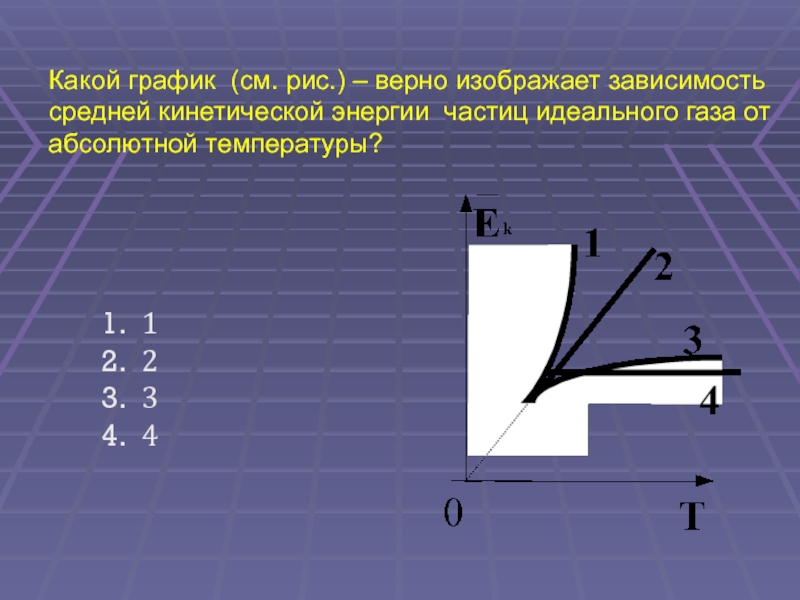
Слайд 43В баллоне находится 6 моль газа. Сколько примерно молекул газа находится в
баллоне?

Слайд 44Какой из графиков, изображенных на рисунке соответствует процессу, проведенному при постоянной
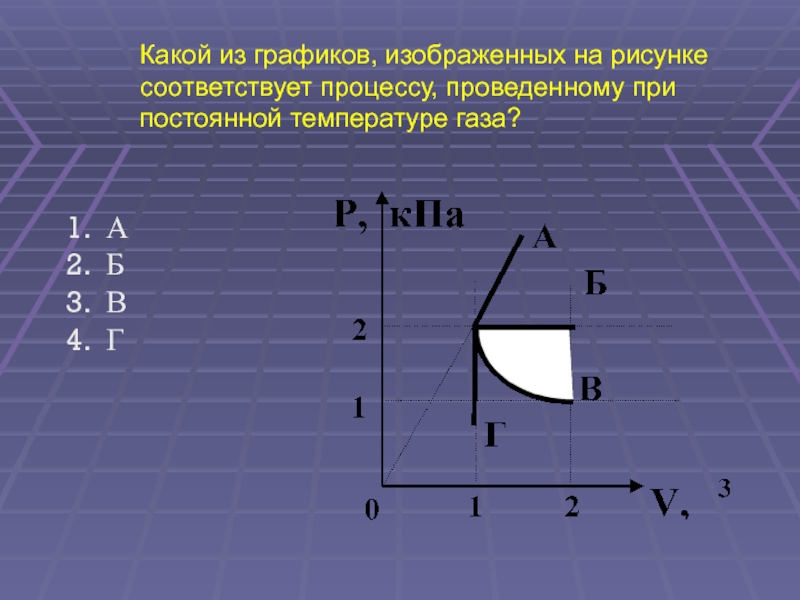
Слайд 45При испарении жидкость остывает. Молекулярно-кинетическая теория объясняет это тем, что чаще
всего жидкость покидают молекулы, кинетическая энергия которых
равна средней кинетической энергии молекул жидкости
превышает среднюю кинетическую энергию молекул жидкости
меньше средней кинетической энергии молекул жидкости
равна суммарной кинетической энергии молекул жидкости

Слайд 46При сжатии идеального газа объем уменьшился в 2 раза, а температура
газа увеличилась в 2 раза. Как изменилось при этом давление газа?
Увеличилось в 4 раза
Уменьшилось в 2 раза
Увеличилось в 2 раза
Не изменилось

Слайд 47Идеальный газ сначала нагревался при постоянном давлении, потом его давление увеличивалось
при постоянном объеме, затем при постоянной температуре давление газа уменьшилось до первоначального значения. Какой из графиков в координатных осях p–V соответствует этим изменениям состояния газа?

Слайд 48Какова температура идеального газа в точке 2, если в точке 4
она равна 200К
200 К
400 К
600 К
1200 К
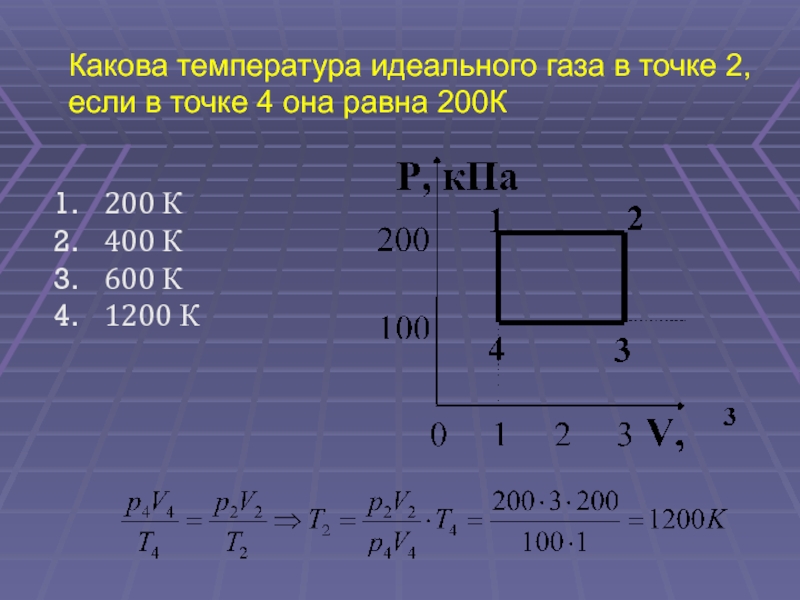
Слайд 49При неизменной концентрации частиц идеального газа средняя кинетическая энергия теплового движения
его молекул увеличилась в 3 раза. При этом давление газа
уменьшилось в 3 раза
увеличилось в 3 раза
увеличилось в 9 раз
не изменилось

Слайд 50На рисунке изображен график зависимости давления газа на стенки сосуда от
температуры. Какой процесс изменения состояния газа изображен?
изобарное нагревание
изохорное охлаждение
изотермическое сжатие
изохорное нагревание
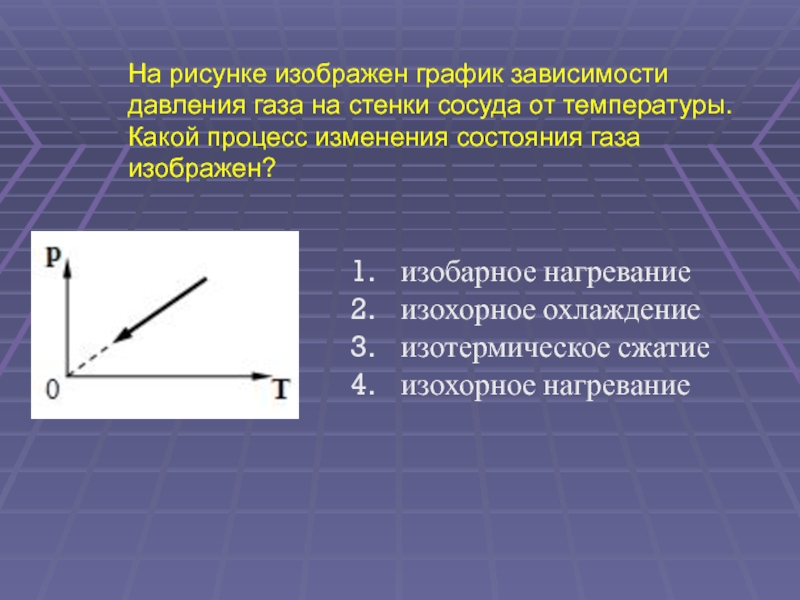
Слайд 51Температура кипения воды зависит от
мощности нагревателя
вещества сосуда, в котором нагревается вода
атмосферного
давления
начальной температуры воды

Слайд 52На рисунке изображен график плавления и кристаллизации нафталина. Какая из точек
соответствует началу отвердевания вещества?
точка 2
точка 4
точка 5
точка 6
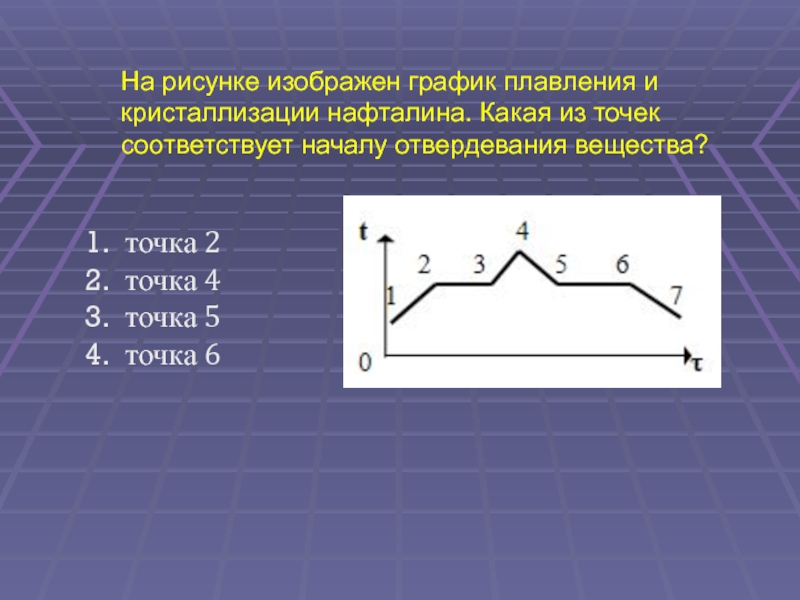
Слайд 53
Весной при таянии льда в водоеме температура окружающего воздуха
уменьшается
увеличивается
не изменяется
может увеличиваться

Слайд 54Идеальному газу сообщили количество теплоты 400 Дж. Газ расширился, совершив работу
600 Дж. Внутренняя энергия газа при этом
увеличилась на 1000 Дж
увеличилась на 200 Дж
уменьшилась на 1000 Дж
уменьшилась на 200 Дж

Слайд 55Как изменяется внутренняя энергия кристаллического вещества в процессе его плавления?
увеличивается для
любого кристаллического вещества
уменьшается для любого кристаллического вещества
для одних кристаллических веществ увеличивается, для других – уменьшается
не изменяется

Слайд 56При какой влажности воздуха человек легче переносит высокую температуру воздуха и
почему?
при низкой, так как при этом пот испаряется быстро
при низкой, так как при этом пот испаряется медленно
при высокой, так как при этом пот испаряется быстро
при высокой, так как при этом пот испаряется медленно

Слайд 57Экспериментаторы закачивают воздух в стеклянный сосуд, одновременно охлаждая его. При этом
температура воздуха в сосуде понизилась в 2 раза, а его давление возросло в 3 раза. Во сколько раз увеличилась масса воздуха в сосуде?
в 2 раза
в 3 раза
в 6 раз
в 1,5 раза

Слайд 58В сосуде, закрытом поршнем, находится идеальный газ. График зависимости объема газа
от температуры при изменении его состояния представлен на рисунке. В каком состоянии давление газа наибольшее?
А
В
С
D
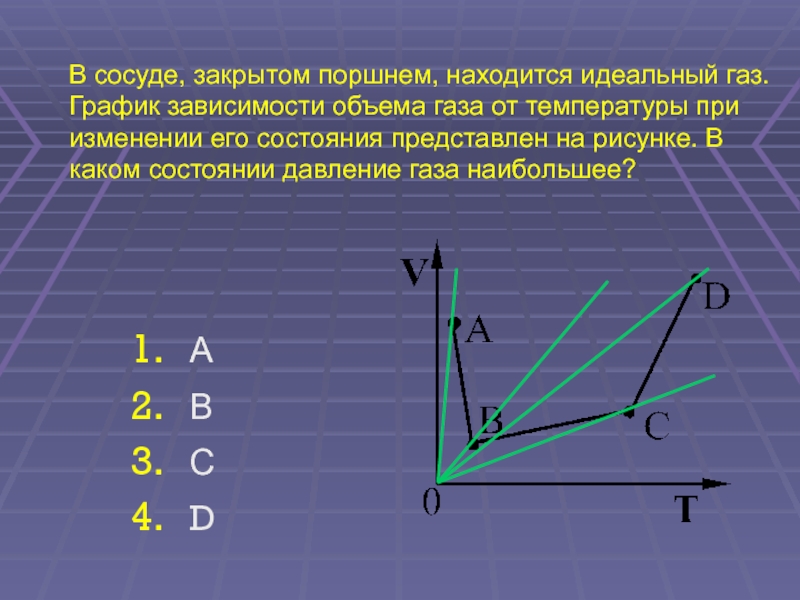
Слайд 593 моль водорода находятся в сосуде при температуре Т. Какова температура 3 моль
кислорода в сосуде того же объема и при том же давлении? (Водород и кислород считать идеальными газами.)
32Т
16Т
2Т
Т

Слайд 60При одинаковой температуре 100°С давление насыщенных паров воды равно 105 Па,
аммиака — 59⋅105 Па и ртути — 37 Па. В каком из вариантов ответа эти вещества расположены в порядке убывания температуры их кипения в открытом сосуде?
вода → аммиак → ртуть
аммиак → ртуть→ вода
вода → ртуть → аммиак
ртуть → вода → аммиак

Слайд 61В сосуде постоянного объема находится идеальный газ, массу которого изменяют. На
диаграмме (см. рисунок) показан процесс изменения состояния газа. В какой из точек диаграммы масса газа наибольшая?
А
В
С
D
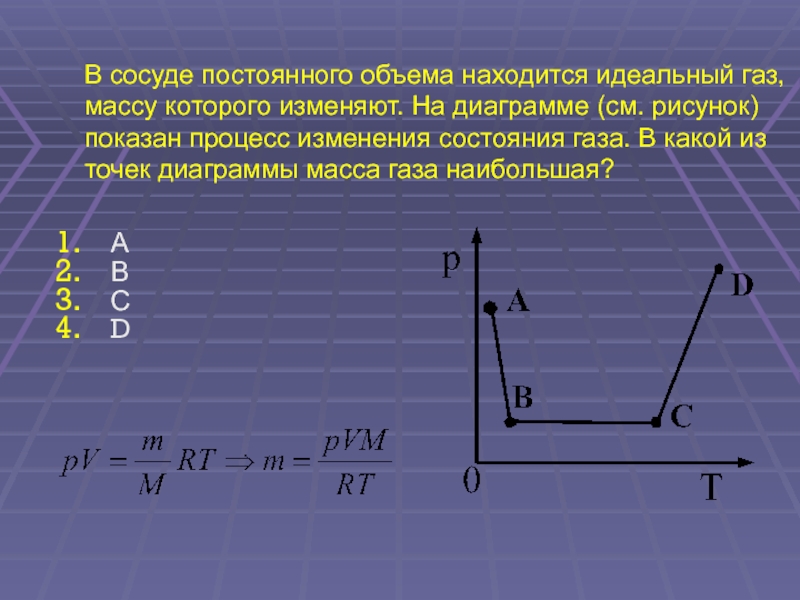
Слайд 62На фотографии представлены два термометра, используемые для определения относительной влажности воздуха.
Ниже приведена психрометрическая таблица, в которой влажность указана в процентах.
Относительная влажность воздуха в помещении, в котором проводилась съемка, равна
37%
40%
48%
59%

Слайд 63На рисунке представлен график зависимости абсолютной температуры T воды массой m
от времени t при осуществлении теплоотвода с постоянной мощностью P. В момент времени t = 0 вода находилась в газообразном состоянии. Какое из приведенных ниже выражений определяет удельную теплоемкость льда по результатам этого опыта?
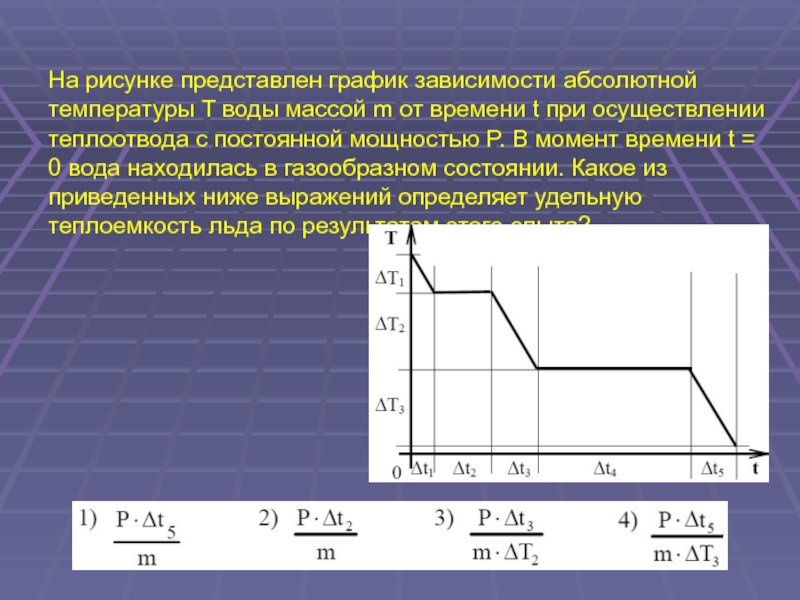
Слайд 64Горячая жидкость медленно охлаждалась в стакане. В таблице приведены результаты измерений
ее температуры с течением времени.
только в жидком состоянии
только в твердом состоянии
и в жидком, и в твердом состояниях
и в жидком, и в газообразном состояниях
В стакане через 7 мин после начала измерений находилось вещество
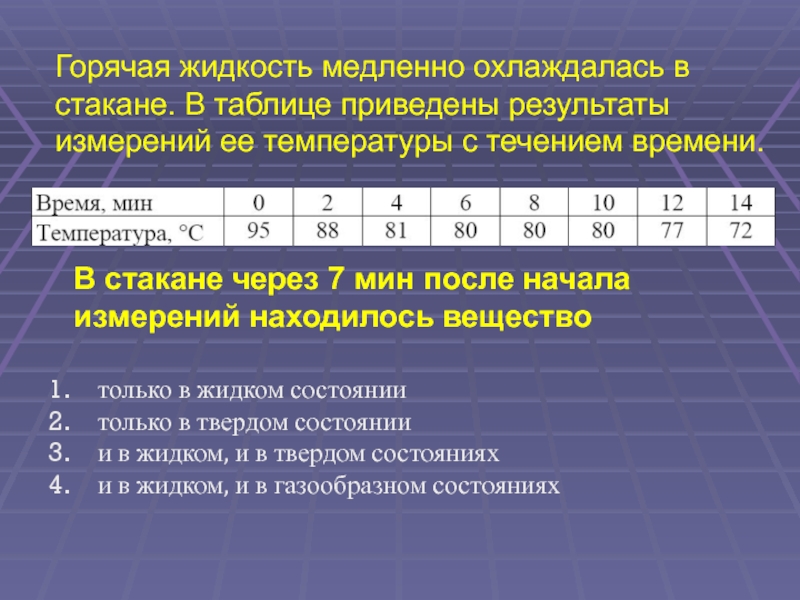
Слайд 65
Используя первый закон термодинамики, установите соответствие между описанными в первом
столбце особенностями изопроцесса в идеальном газе и его названием.
1
4

Слайд 66
В сосуде неизменного объема находилась при комнатной температуре смесь двух
идеальных газов, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль первого газа. Температура газов в сосуде поддерживалась неизменной. Как изменились в результате парциальные давления газов и их суммарное давление?
Для каждой величины определите соответствующий характер изменения:
1) увеличилось
2) уменьшилось
3) не изменилось
1
2
3

Слайд 67
После помещения банки на огонь вода в ней нагревалась через тонкую
стенку банки от горячих продуктов горения газа. При этом с ростом температуры вода испарялась, и возрастало давление ее паров в банке, которые постепенно вытесняли из нее воздух. Когда вода закипела и почти вся испарилась, воздуха внутри банки практически не осталось. Давление насыщенных паров в банке при этом стало равно внешнему атмосферному давлению.
Когда банку сняли с огня, закрыли крышкой и охладили холодной водой почти до комнатной температуры, горячие пары воды внутри банки остыли и практически целиком сконденсировались на ее стенках, отдавая теплоту конденсации наружу, холодной воде, благодаря процессу теплопроводности через стенки.

Слайд 68
В соответствии с уравнением Клапейрона–Менделеева давление пара в банке резко упало
– во-первых, из-за уменьшения массы оставшегося в банке пара, и, во-вторых – из-за падения его температуры. Заметим, что резкое уменьшение давления в банке можно объяснить и так: при понижении температуры до комнатной пары конденсируются, оставаясь насыщенными, но их давление становится намного меньше давления насыщенных паров воды при температуре кипения (примерно в 40 раз).
Поскольку при комнатной температуре давление насыщенных паров воды составляет лишь малую долю от атмосферного давления (не более 3–4%), тонкая банка после поливания ее водой окажется под действием разности этого большого внешнего давления и низкого давления пара внутри. По этой причине на банку начнут действовать большие сдавливающие силы, которые будут стремиться сплющить банку. Как только эти силы превысят предельную величину, которую могут выдержать стенки банки, то она сплющится и резко уменьшится в объеме.

Слайд 69
Согласно первому началу термодинамики количество теплоты, необходимое для плавления льда, ΔQ1
= λm, где λ – удельная теплота плавления льда. ΔQ2 –подведённое джоулево тепло: ΔQ2 = ηPt. В соответствии с заданными условиями ΔQ1 = 66 кДж и ΔQ2 = 84 кДж, а значит, ΔQ1 < ΔQ2, и поставленная задача выполнима

Слайд 70
Согласно первому началу термодинамики, количество теплоты Q, переданное газу, идет на
изменение его внутренней энергии ΔU и совершение этим газом работы A, то есть Q = ΔU + A. При нагревании газа происходит его изобарное расширение. В этом процессе работа газа равна A = pΔV , где изменение объема газа ΔV = Sl = πR2l. Из условия равновесия поршня (см. рисунок) найдем давление газа:pS = p0S + Mgcosα, откуда
Тогда искомая величина равна

Слайд 71Используемая литература
Берков, А.В. и др. Самое полное издание типовых вариантов реальных
заданий ЕГЭ 2010, Физика [Текст]: учебное пособие для выпускников. ср. учеб. заведений / А.В. Берков, В.А. Грибов. – ООО «Издательство Астрель», 2009. – 160 с.
Касьянов, В.А. Физика, 11 класс [Текст]: учебник для общеобразовательных школ / В.А. Касьянов. – ООО «Дрофа», 2004. – 116 с.
Мякишев, Г.Я. и др. Физика. 11 класс [Текст]: учебник для общеобразовательных школ / учебник для общеобразовательных школ Г.Я. Мякишев, Б.Б. Буховцев . –» Просвещение «, 2009. – 166 с.
Открытая физика [текст, рисунки]/ http://www.physics.ru
Подготовка к ЕГЭ /http://egephizika
Федеральный институт педагогических измерений. Контрольные измерительные материалы (КИМ) Физика //[Электронный ресурс]// http://fipi.ru/view/sections/92/docs/
Физика в школе. Физика — 10 класс. Молекулярная физика. Молекулярно-кинетическая теория. Рисунки по физике/ http://gannalv.narod.ru/mkt/
Эта удивительная Эта удивительная физика/ http://sfiz.ru/page.php?id=39

№1 слайд
Содержание слайда: МОЛЕКУЛЯРНАЯ ФИЗИКА . Подготовка к ЕГЭ
Учитель: Попова И.А.
МОУ СОШ № 30
Белово 2010
№2 слайд
Содержание слайда: Цель: повторение основных понятий, законов и формул
МОЛЕКУЛЯРНОЙ ФИЗИКИ
в соответствии с кодификатором ЕГЭ.
Элементы содержания, проверяемые на ЕГЭ 2010:
Модели строения газов, жидкостей и твердых
Тепловое движение атомов и молекул
Броуновское движение
Диффузия
Взаимодействие частиц вещества
Модель идеального газа
Связь между давлением и средней кинетической энергией теплового движения молекул идеального газа
Абсолютная температура
Абсолютная температура как мера средней кинетической энергии его частиц
Уравнение Менделеева-Клапейрона
Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы
Насыщенные и ненасыщенные пары
Влажность воздуха
Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Изменение агрегатных состояний вещества: плавление и кристаллизация
№3 слайд
Содержание слайда: Основные положения МКТ
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества.
В основе молекулярно-кинетической теории лежат
три основных положения:
№4 слайд
Содержание слайда: Модели строения газов, жидкостей и твердых
№5 слайд
Содержание слайда: Тепловое движение атомов и молекул
Беспорядочное хаотическое движение молекул называется тепловым движением.
№6 слайд
Содержание слайда: Броуновское движение
Диффузия
Броуновское движение — это тепловое движение мельчайших частиц, взвешенных в жидкости или газе.
№7 слайд
Содержание слайда: Взаимодействие частиц вещества
На очень малых расстояниях между молекулами обязательно действуют силы отталкивания
№8 слайд
Содержание слайда: Модель идеального газа
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C.
в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА:
NА = 6,02·1023 моль–1.
Массу одного моля вещества принято называть молярной массой M.
Молярная масса выражается в килограммах на моль (кг/моль)
Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12C называется относительной массой.
№9 слайд
Содержание слайда: Модель идеального газа
В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений.
Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ.
Микроскопические параметры (масса, скорость, кинетическая энергия молекул)
Макроскопическими параметрами (давление, газ, температура)
№10 слайд
Содержание слайда: Связь между давлением и средней кинетической энергией теплового движения молекул идеального газа
Основное уравнение МКТ газов.
№11 слайд
Содержание слайда: Абсолютная температура
Абсолютная температура как мера средней кинетической энергии его частиц
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными.
Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии.
Для измерения температуры используются физические приборы – термометры
В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой K.
TК = TС + 273,15
Температурная шкала Кельвина называется абсолютной шкалой температур.
Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры, достаточно принять еще одну фиксированную опорную точку — температура тройной точки воды (0,01° С), в которой в тепловом равновесии находятся все три фазы – лед, вода и пар — 273,16 К.
№12 слайд
Содержание слайда: Абсолютная температура
Абсолютная температура как мера средней кинетической энергии его частиц
Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре.
Температура есть мера средней кинетической энергии поступательного движения молекул.
№13 слайд
Содержание слайда: Уравнение Менделеева-Клапейрона
Уравнение состояния идеального газа.
№14 слайд
Содержание слайда: Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы
Изопроцессы – это процессы, в которых один из параметров (p, V или T) остается неизменным.
№15 слайд
Содержание слайда: Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы
Изопроцессы – это процессы, в которых один из параметров (p, V или T) остается неизменным.
№16 слайд
Содержание слайда: Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы
Изопроцессы – это процессы, в которых один из параметров (p, V или T) остается неизменным.
№17 слайд
Содержание слайда: Насыщенные и ненасыщенные пары
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы.
Такую систему называют двухфазной.
Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения.
№18 слайд
Содержание слайда: Влажность воздуха
Отношение p / p0, выраженное в процентах, называется относительной влажностью воздуха
№19 слайд
Содержание слайда: Влажность воздуха
Давление и плотность насыщенного водяного пара при различных температурах
№20 слайд
Содержание слайда: Изменение агрегатных состояний вещества:
испарение и конденсация, кипение жидкости
Переход из одного состояния в другое называется фазовым переходом
№21 слайд
Содержание слайда: Изменение агрегатных состояний вещества:
испарение и конденсация, кипение жидкости
Переход из одного состояния в другое называется фазовым переходом
№22 слайд
Содержание слайда: Изменение агрегатных состояний вещества:
плавление и кристаллизация
Плавление — переход из кристаллического твёрдого состояния в жидкое.
Плавление происходит с поглощением удельной теплоты плавления и является фазовым переходом первого рода.
Способность плавиться относится к физическим свойствам вещества.
При нормальном давлении, наибольшей температурой плавления среди металлов обладает вольфрам (3422 °C), простых веществ вообще — углерод (по разным данным 3500 — 4500 °C) а среди произвольных веществ — карбид гафния HfC (3890 °C).
Можно считать, что самой низкой температурой плавления обладает гелий: при нормальном давлении он остаётся жидким при сколь угодно низких температурах.
Многие вещества при нормальном давлении не имеют жидкой фазы. При нагревании они путем сублимации сразу переходят в газообразное состояние.
№23 слайд
Содержание слайда: Молекулярно-кинетическая теория.
Основные формулы
Основы молекулярно-кинетической теории:
NA – постоянная Авогадро.
Основное уравнение МКТ идеального газа:
Среднеквадратичная скорость молекул:
R – универсальная газовая постоянная.
Давление идеального газа на стенки сосуда:
k – постоянная Больцмана.
Средняя кинетическая энергия поступательного движения молекул:
Закон Дальтона:
Уравнение состояния идеального газа:
R = kNA – универсальная газовая постоянная
№24 слайд
Содержание слайда: Молекулярно-кинетическая теория.
Основные формулы
Изотермический процесс (закон Бойля-Мариотта):
Изохорный процесс (закон Шарля):
Изобарный процесс (закон Гей-Люссака):
Потенциальная энергия свободной поверхности жидкости:
σ – коэффициент поверхностного натяжения
Высота подъема смачивающей жидкости в капилляре:
Абсолютная температура:
№25 слайд
Содержание слайда: Словарь по Молекулярной Физике и Тепловым Явлениям
Абсолютная влажность(р) — парциальное давление водяных паров, содержащихся в воздухе, или количество водяных паров, содержащихся в 1 м3воздуха, выраженного в граммах. Абсолютный нуль температур — температура, при которой прекращается тепловое движение молекул.
Агрегатное состояние вещества — состояние одного и того же вещества, переходы между которыми сопровождаются скачкообразным изменением ряда физических свойств.
Аморфные тела — твердые тела, не имеющие упорядоченного, периодического расположения частиц в пространстве.
Анизотропия — неодинаковость физических свойств среды в различных направлениях, связанная с внутренним строением сред.
Атом — наименьшая часть химического элемента, являющаяся носителем его свойств.
Броуновское движение — беспорядочное движение малых частиц, взвешенных в жидкости или газе, происходящее под действием молекул.
Влажность (кг/м3) — содержание водяного пара в воздухе.
Внутренняя энергия идеального одноатомного газа — суммарная кинетическая энергия теплового движения атомов газа.
Внутренняя энергия тела (U) — сумма энергии хаотического (теплового) движения всех микрочастиц тела (молекул, атомов, ионов и т. д.) и энергии взаимодействия этих частиц.
№26 слайд
Содержание слайда: Словарь по Молекулярной Физике и Тепловым Явлениям
Деформация — изменение формы или размеров тела (или части тела) под действием внешних сил (механических нагрузок) при нагревании, охлаждении, изменении влажности и других воздействиях, вызывающих изменение относительного расположения частиц тела.
Динамическое равновесие — процесс, при котором скорость парообразования равна скорости конденсации.
Диффузия — взаимное проникновение соприкасающихся веществ друг в друга вследствие теплового движения частиц.
Жидкость — агрегатное состояние вещества, промежуточное между твердым и газообразным. Жидкости сохраняют свой объем и принимают форму сосуда.
Закон Бойля-Мариотта. Для газа данной массы произведение давления на его объем постоянно, если его температура не меняется.
Закон Гей-Люссака. Для данной массы газа отношение его объема к абсолютной температуре постоянно, если давление газа не меняется.
Закон Гука. Относительное удлинение прямо пропорционально механическому напряжению.
Закон Шарля. Для данной массы газа отношение его давления к абсолютной температуре постоянно, если его объем не меняется
№27 слайд
Содержание слайда: Словарь по Молекулярной Физике и Тепловым Явлениям
Идеальный газ — модель, в которой не учитывается взаимодействие частиц и их собственный объем. Соударение частиц происходит по закону упругого взаимодействия.
Изобарический процесс — процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении.
Изопроцесс — процесс, протекающий в термодинамической системе с неизменной массой при постоянном значении одного из параметров состояния.
Изотермический процесс — процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре.
Изохорический процесс — процесс изменения состояния термодинамической системы при постоянном объеме.
Испарение — парообразование со свободной поверхности жидкости при любой температуре.
Кипение — процесс парообразования внутри и с поверхности жидкости при температуре кипения.
Количество вещества — отношение числа молекул в данном теле к числу атомов в 0,012 кг углерода.
Коэффициент полезного действия теплового двигателя (КПД, n) — физическая величина, определяемая отношением работы А, совершенной тепловым двигателем за один цикл, к количеству теплоты Q1, полученной от нагревателя.
Кристаллические тела — твердые тела, имеющие упорядоченное, периодическое расположение частиц в пространстве.
Критическая температура — температура, при которой исчезают различия в физических свойствах между жидкостью и ее насыщенным паром.
№28 слайд
Содержание слайда: Словарь по Молекулярной Физике и Тепловым Явлениям
Молекула — наименьшая частица данного вещества, обладающая его основными химическими свойствами.
Молекулярно-кинетическая теория объясняет свойства макроскопических тел и тепловых процессов, протекающих в них, на основе представлений о том, что все тела состоят из отдельных беспорядочно движущихся частиц.
Моль (v) — количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг.
Молярная масса (n) — масса одного моля вещества.
Молярная теплоемкость (с) — физическая величина, показывающая, какое количество теплоты требуется для изменения температуры 1 моля вещества на 1 °С (1 К).
Насыщенный пар — пар, находящийся в термодинамическом равновесии с жидкостью того же состава.
Ненасыщенный пар — пар, находящийся при давлении ниже давления насыщенного пара.
Необратимый термодинамический процесс — процесс, который самопроизвольно может протекать только в одном направлении.
Обратимый термодинамический процесс — термодинамический процесс, который может происходить как в прямом, так и в обратном направлении, причем система возвращается в исходное положение, а в окружающей среде и самой системе не происходит никаких изменений.
Относительная влажность (f, ф) — отношение парциального давления р водяного пара так же, как содержащегося в воздухе при данной температуре к парциальному давлению р0 насыщенного пара при той же температуре, выраженное в процентах.
№29 слайд
Содержание слайда: Словарь по Молекулярной Физике и Тепловым Явлениям
Парообразование — процесс перехода вещества из жидкого или твердого состояния в газообразное.
Первый закон термодинамики (первая формулировка). Изменение внутренней энергии тела (системы) при переходе из одного состояния в другое равно сумме совершенной над телом работы и полученного им количества теплоты.
Первый закон термодинамики (вторая формулировка). Количество тепла, полученного телом (системой) расходуется на изменение внутренней энергии системы и на работу против внешних сил.
Плавление — процесс перехода вещества из твердого (кристаллического) состояния в жидкое.
Плазма — частично или полностью ионизированный газ, в котором плотности отрицательных и положительных зарядов равны.
Пластическая (остаточная) деформация — деформация, не исчезающая после прекращения действия внешних сил.
Пластичность — свойства твердых тел под действием внешних сил изменять, не разрушаясь, свою форму и раз4 меры и сохранять остаточные деформации после прекращения действия этих сил.
Полиморфизм — способность твердых тел существовать в двух или нескольких кристаллических структурах.
Постоянная Авогадро (NA) — количество структурных элементов (атомов, молекул, ионов или других частиц) в одном моле вещества.
Предел пропорциональности (бпроп) — максимальное напряжение, при котором еще выполняется закон Гука.
Предел прочности (бпр) — наибольшее напряжение, возникающее в теле перед началом его разрушения.
Предел упругости (бупр) — напряжение, при котором тело полностью утрачивает упругость.
№30 слайд
Содержание слайда: Словарь по Молекулярной Физике и Тепловым Явлениям
Твердые тела — агрегатное состояние вещества, характеризующееся стабильностью формы и объема при постоянной температуре.
Температура (Т, t°) — величина, характеризующая состояние термодинамического равновесия макроскопической системы и пропорциональная средней кинетической энергии частиц системы.
Температура кипения — температура жидкости, при которой давление ее насыщенного пара равно или превышает внешнее давление.
Температура плавления — температура, при которой кристаллическое вещество плавится.
Тепловое движение — беспорядочное (хаотическое) движение микрочастиц, из которых состоят все тела.
Тепловой двигатель — устройство, в котором осуществляется преобразование внутренней энергии топлива в механическую.
Теплоемкость тела (С) — количество теплоты, которое нужно сообщить данному телу, чтобы повысить его температуру на один градус.
Теплопередача — процесс изменения внутренней энергии без совершения работы над телом или самим телом.
Теплопроводность — передача тепла в телах, не сопровождаемая перемещением составляющих их частиц. При теплопроводности перенос энергии осуществляется в результате непосредственной передачи энергии от частиц (молекул, атомов, электронов), обладающих большей энергией, частицам с меньшей энергией.
Термодинамические параметры — физические величины, которые служат в термодинамике для характеристики состояния рассматриваемой системы.
Термодинамическое равновесие — состояние термодинамической системы, в которое она самопроизвольно приходит через достаточно большой промежуток времени в условиях изоляции от окружающей среды.
Термометр — прибор для измерения температуры посредством контакта его с исследуемой средой.
№31 слайд
Содержание слайда: Словарь по Молекулярной Физике и Тепловым Явлениям
Удельная теплоемкость (с) — физическая величина, показывающая, какое количество теплоты требуется для изменения температуры вещества массой 1 кг на 1 °С.
Удельная теплота парообразования (L) — величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры.
Удельная теплота плавления (А) — физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления перевести его в жидкое состояние.
Упругая деформация — деформация, полностью исчезающая после прекращения действия внешних сил.
Упругость — свойство тел восстанавливать свою форму и объем после прекращения действия внешних сил и других причин, вызывающих деформацию тел.
Уравнение состояния идеального газа. Для данной массы газа произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная.
Хрупкость — способность твердых тел разрушаться при механических воздействиях без заметной пластической деформации
№32 слайд
Содержание слайда: Рассмотрим задачи:
ЕГЭ 2001-2010 (Демо, КИМ)
ГИА-9 2008-2010 (Демо)
№33 слайд
Содержание слайда: (ЕГЭ 2001 г.) А10. Согласно расчетам, температура жидкости должна быть равна 143 К. Между тем термометр в сосуде показывает температуру не более –1300 С. Это означает, что
№34 слайд
Содержание слайда: (ЕГЭ 2001 г., Демо) А11. На рисунке показана часть шкалы термометра, висящего за окном. Температура воздуха на улице равна …..
№35 слайд
Содержание слайда: (ЕГЭ 2001 г.) А12. Кастрюлю с водой поставили на газовую плиту. Газ горит постоянно. Зависимость температуры воды от времени представлена на графике. График позволяет сделать вывод, что
№36 слайд
Содержание слайда: (ЕГЭ 2001 г., Демо) А13. Экспериментально исследовалось, как меняется температура t некоторой массы воды в зависимости от времени ее нагревания. По результатам измерений построен график, приведенный на рисунке. Какой вывод можно сделать по результатам эксперимента?
№37 слайд
Содержание слайда: (ЕГЭ 2001 г., Демо) А14. Испарение жидкости происходит потому, что . . .
№38 слайд
Содержание слайда: (ЕГЭ 2001 г., Демо) А15. Тела, имеющие разные температуры, привели в соприкосновение двумя способами ( I и II ). Какое из перечисленных ниже утверждений является верным?
№39 слайд
Содержание слайда: (ЕГЭ 2001 г.) А33. Представления о строении вещества в XVIII веке не позволяли получить объяснения закона Шарля и других газовых законов. На основании этого мы можем признать, что
№40 слайд
Содержание слайда: (ЕГЭ 2001 г.) А34. При исследовании зависимости давления газа от объема были получены некоторые данные. Какой график правильно проведен по экспериментальным точкам?
№41 слайд
Содержание слайда: (ЕГЭ 2001 г.) А35. Одинаковые количества одного и того же газа нагревают в двух разных сосудах. Зависимость давления от температуры в этих сосудах представлена на графике. Что можно сказать об объемах этих сосудов?
№42 слайд
Содержание слайда: (ЕГЭ 2002 г., Демо) А8. Какой из перечисленных ниже опытов (А, Б или В) подтверждает вывод молекулярно-кинетической теории о том, что скорость молекул растет при увеличении температуры?
А. Интенсивность броуновского движения растет с повышением температуры.
Б. Давление газа в сосуде растет с повышением температуры.
В. Скорость диффузии красителя в воде повышается с ростом температуры.
№43 слайд
Содержание слайда: (ЕГЭ 2002 г., Демо) А9. Какой график (см. рис.) – верно изображает зависимость средней кинетической энергии частиц идеального газа от абсолютной температуры?
№44 слайд
Содержание слайда: 2002 г. А9 (КИМ). В баллоне находится 6 моль газа. Сколько примерно молекул газа находится в баллоне?
№45 слайд
Содержание слайда: (ЕГЭ 2002 г., Демо) А12. Какой из графиков, изображенных на рисунке соответствует процессу, проведенному при постоянной температуре газа?
№46 слайд
Содержание слайда: (ЕГЭ 2002 г., Демо) А13. При испарении жидкость остывает. Молекулярно-кинетическая теория объясняет это тем, что чаще всего жидкость покидают молекулы, кинетическая энергия которых
№47 слайд
Содержание слайда: 2002 г. А13 (КИМ). При сжатии идеального газа объем уменьшился в 2 раза, а температура газа увеличилась в 2 раза. Как изменилось при этом давление газа?
№48 слайд
Содержание слайда: 2002 г. А14 (КИМ). В результате нагревания газа средняя кинетическая энергия теплового движения его молекул увеличилась в 4 раза. Как изменилась при этом абсолютная температура газа?
№49 слайд
Содержание слайда: 2002 г. А29 (КИМ). Идеальный газ сначала нагревался при постоянном давлении, потом его давление увеличивалось при постоянном объеме, затем при постоянной температуре давление газа уменьшилось до первоначального значения. Какой из графиков в координатных осях p–V соответствует этим изменениям состояния газа?
№50 слайд
Содержание слайда: (ЕГЭ 2002 г., Демо) А30. Какова температура идеального газа в точке 2, если в точке 4 она равна 200К
№51 слайд
Содержание слайда: (ЕГЭ 2003 г., КИМ) А8. Диффузия происходит быстрее при повышении температуры вещества, потому что
№52 слайд
Содержание слайда: (ЕГЭ 2003 г., КИМ) А9. При неизменной концентрации частиц идеального газа средняя кинетическая энергия теплового движения его молекул увеличилась в 3 раза. При этом давление газа
№53 слайд
Содержание слайда: (ЕГЭ 2003 г., КИМ) А10. На рисунке изображен график зависимости давления газа на стенки сосуда от температуры. Какой процесс изменения состояния газа изображен?
№54 слайд
Содержание слайда: (ЕГЭ 2003 г., КИМ) А13.
Температура кипения воды зависит от
№55 слайд
Содержание слайда: (ЕГЭ 2003 г., КИМ) А14. На рисунке изображен график плавления и кристаллизации нафталина. Какая из точек соответствует началу отвердевания вещества?
№56 слайд
Содержание слайда: (ЕГЭ 2004 г., демо) А7. Давление идеального газа зависит от
А. концентрации молекул.
Б. средней кинетической энергии молекул.
№57 слайд
Содержание слайда: (ЕГЭ 2004 г., демо) А10.
Весной при таянии льда в водоеме температура окружающего воздуха
№58 слайд
Содержание слайда: (ЕГЭ 2004 г., демо) А23. При переходе из состояния А в состояние В температура идеального газа
№59 слайд
Содержание слайда: (ЕГЭ 2004 г., демо) А24. Идеальному газу сообщили количество теплоты 400 Дж. Газ расширился, совершив работу 600 Дж. Внутренняя энергия газа при этом
№60 слайд
Содержание слайда: 2005 г. А8 (КИМ). Если положить огурец в соленую воду, то через некоторое время он станет соленым. Это можно объяснить
взаимодействием молекул
конвекцией
диффузией
теплопередачей
№61 слайд
Содержание слайда: (ЕГЭ 2005 г., ДЕМО) А8. Наименьшая упорядоченность в расположении частиц характерна для
№62 слайд
Содержание слайда: (ЕГЭ 2005 г., ДЕМО) А11. Как изменяется внутренняя энергия кристаллического вещества в процессе его плавления?
№63 слайд
Содержание слайда: (ЕГЭ 2005 г., ДЕМО) А13.
Парциальное давление водяного пара в воздухе при 20 С равно 0,466 кПа, давление насыщенных водяных паров при этой температуре 2,33 кПа. Относительная влажность воздуха равна
№64 слайд
Содержание слайда: (ЕГЭ 2006 г., ДЕМО) А8. В жидкостях частицы совершают колебания возле положения равновесия, сталкиваясь с соседними частицами. Время от времени частица совершает «прыжок» к другому положению равновесия. Какое свойство жидкостей можно объяснить таким характером движения частиц?
малую сжимаемость
текучесть
давление на дно сосуда
изменение объема при нагревании
№65 слайд
Содержание слайда: (ЕГЭ 2006 г., ДЕМО) А9. Лед при температуре 0С внесли в теплое помещение. Температура льда до того, как он растает,
не изменится, так как вся энергия, получаемая льдом в это время, расходуется на разрушение кристаллической решетки
не изменится, так как при плавлении лед получает тепло от окружающей среды, а затем отдает его обратно
повысится, так как лед получает тепло от окружающей среды, значит, его внутренняя энергия растет, и температура льда повышается
понизится, так как при плавлении лед отдает окружающей среде некоторое количество теплоты
№66 слайд
Содержание слайда: (ЕГЭ 2006 г., ДЕМО) А10. При какой влажности воздуха человек легче переносит высокую температуру воздуха и почему?
при низкой, так как при этом пот испаряется быстро
при низкой, так как при этом пот испаряется медленно
при высокой, так как при этом пот испаряется быстро
при высокой, так как при этом пот испаряется медленно
№67 слайд
Содержание слайда: (ЕГЭ 2006 г., ДЕМО) А11. Абсолютная температура тела равна 300 К. По шкале Цельсия она равна
– 27С
27С
300С
573С
№68 слайд
Содержание слайда: (ЕГЭ 2006 г., ДЕМО) А27. Экспериментаторы закачивают воздух в стеклянный сосуд, одновременно охлаждая его. При этом температура воздуха в сосуде понизилась в 2 раза, а его давление возросло в 3 раза. Во сколько раз увеличилась масса воздуха в сосуде?
в 2 раза
в 3 раза
в 6 раз
в 1,5 раза
№69 слайд
Содержание слайда: ЕГЭ – 2006, ДЕМО. А 28. В сосуде, закрытом поршнем, находится идеальный газ. График зависимости объема газа от температуры при изменении его состояния представлен на рисунке. В каком состоянии давление газа наибольшее?
А
В
С
D
№70 слайд
Содержание слайда: (ЕГЭ 2007 г., ДЕМО) А10. 3 моль водорода находятся в сосуде при температуре Т. Какова температура 3 моль кислорода в сосуде того же объема и при том же давлении? (Водород и кислород считать идеальными газами.)
32Т
16Т
2Т
Т
№71 слайд
Содержание слайда: (ЕГЭ 2007 г., ДЕМО) А12. При одинаковой температуре 100С давление насыщенных паров воды равно 105 Па, аммиака — 59105 Па и ртути — 37 Па. В каком из вариантов ответа эти вещества расположены в порядке убывания температуры их кипения в открытом сосуде?
вода аммиак ртуть
аммиак ртуть вода
вода ртуть аммиак
ртуть вода аммиак
№72 слайд
Содержание слайда: (ЕГЭ 2007 г., ДЕМО) А15. В сосуде постоянного объема находится идеальный газ, массу которого изменяют. На диаграмме (см. рисунок) показан процесс изменения состояния газа. В какой из точек диаграммы масса газа наибольшая?
А
В
С
D
№73 слайд
Содержание слайда: (ЕГЭ 2007 г., ДЕМО) А13. На графике (см. рисунок) представлено изменение температуры Т вещества с течением времени t. В начальный момент времени вещество находилось в кристаллическом состоянии. Какая из точек соответствует окончанию процесса отвердевания?
5
6
3
7
№74 слайд
Содержание слайда: (ЕГЭ 2008 г., ДЕМО) А10. Постоянная масса идеального газа участвует в процессе, показанном на рисунке. Наибольшее давление газа в процессе достигается
№75 слайд
Содержание слайда: (ЕГЭ 2008 г., ДЕМО) А11. На фотографии представлены два термометра, используемые для определения относительной влажности воздуха. Ниже приведена психрометрическая таблица, в которой влажность указана в процентах.
№76 слайд
Содержание слайда: (ЕГЭ 2008 г., ДЕМО) А12. При постоянной температуре объём данной массы идеального газа возрос в 4 раза. Давление газа при этом
№77 слайд
Содержание слайда: (ЕГЭ 2008 г., ДЕМО) А13. На рисунке представлен график зависимости абсолютной температуры T воды массой m от времени t при осуществлении теплоотвода с постоянной мощностью P. В момент времени t = 0 вода находилась в газообразном состоянии. Какое из приведенных ниже выражений определяет удельную теплоемкость льда по результатам этого опыта?
№78 слайд
Содержание слайда: (ЕГЭ 2009 г., ДЕМО) А8. При понижении абсолютной температуры одноатомного идеального газа в 1,5 раза средняя кинетическая энергия теплового движения его молекул
№79 слайд
Содержание слайда: (ЕГЭ 2009 г., ДЕМО) А9. Горячая жидкость медленно охлаждалась в стакане. В таблице приведены результаты измерений ее температуры с течением времени.
№80 слайд
Содержание слайда: (ЕГЭ 2009 г., ДЕМО) А12. В сосуде находится постоянное количество идеального газа. Как изменится температура газа, если он перейдет из состояния 1 в состояние 2 (см. рисунок)?
№81 слайд
Содержание слайда: (ЕГЭ 2009 г., ДЕМО) В2.
Используя первый закон термодинамики, установите соответствие между описанными в первом столбце особенностями изопроцесса в идеальном газе и его названием.
№82 слайд
Содержание слайда: (ЕГЭ 2010 г., ДЕМО) А9. На рисунке приведены графики зависимости давления 1 моль идеального газа от абсолютной температуры для различных процессов. Какой из графиков соответствует изохорному процессу?
№83 слайд
Содержание слайда: (ЕГЭ 2010 г., ДЕМО) А8. В результате нагревания неона абсолютная температура газа увеличилась в 4 раза. Средняя кинетическая энергия теплового движения его молекул при этом
№84 слайд
Содержание слайда: (ЕГЭ 2010 г., ДЕМО) В1.
В сосуде неизменного объема находилась при комнатной температуре смесь двух идеальных газов, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль первого газа. Температура газов в сосуде поддерживалась неизменной. Как изменились в результате парциальные давления газов и их суммарное давление?
Для каждой величины определите соответствующий характер изменения:
1) увеличилось
2) уменьшилось
3) не изменилось
№85 слайд
Содержание слайда: Используемая литература
Берков, А.В. и др. Самое полное издание типовых вариантов реальных заданий ЕГЭ 2010, Физика [Текст]: учебное пособие для выпускников. ср. учеб. заведений / А.В. Берков, В.А. Грибов. – ООО «Издательство Астрель», 2009. – 160 с.
Касьянов, В.А. Физика, 11 класс [Текст]: учебник для общеобразовательных школ / В.А. Касьянов. – ООО «Дрофа», 2004. – 116 с.
Мякишев, Г.Я. и др. Физика. 11 класс [Текст]: учебник для общеобразовательных школ / учебник для общеобразовательных школ Г.Я. Мякишев, Б.Б. Буховцев . –» Просвещение «, 2009. – 166 с.
Открытая физика [текст, рисунки]/ http://www.physics.ru
Подготовка к ЕГЭ /http://egephizika
Федеральный институт педагогических измерений. Контрольные измерительные материалы (КИМ) Физика //[Электронный ресурс]// http://fipi.ru/view/sections/92/docs/
Физика в школе. Физика — 10 класс. Молекулярная физика. Молекулярно-кинетическая теория. Рисунки по физике/ http://gannalv.narod.ru/mkt/
Эта удивительная физика/ http://sfiz.ru/page.php?id=39