Все формулы взяты в строгом соответствии с Федеральным институтом педагогических измерений (ФИПИ)
2.1 МОЛЕКУЛЯРНАЯ ФИЗИКА
2.1.1 Модели строения газов, жидкостей и твердых тел
Газ
Газ — это агрегатное состояние вещества, в котором составляющие его атомы и молекулы почти свободно и хаотически движутся в промежутках между столкновениями. Во время столкновения молекулы резко меняют скорость и направление своего движения. Время столкновения молекул намного меньше промежутка времени между двумя столкновениями.
Объем, занимаемый газом, значительно сильнее зависит от давления и температуры, чем объем жидкостей и твердых тел. Газ можно сжать так, что его объем уменьшится в несколько раз. Это значит, что расстояние между молекулами намного больше размеров самих молекул. На таких расстояниях молекулы очень слабо притягиваются друг к другу. По этой причине газы не имеют собственной формы и постоянного объема. Нельзя заполнить газом, например, половину бутылки или стакана. В отличие от жидкостей и твердых тел газы не образуют свободной поверхности и заполняют весь доступный им объем.
Газообразное состояние — самое распространенное состояние вещества Вселенной (межзвездное вещество, туманности, звезды, атмосферы планет). По химическим свойствам газы и их смеси очень разнообразны — от малоактивных инертных газов до взрывчатых смесей.
Давление газа. Беспрерывно и хаотически двигаясь, молекулы газа сталкиваются не только друг с другом, но и со стенками сосуда, в котором находится газ. Молекул в газе много, потому и число их ударов очень велико. Например, число ударов молекул воздуха, находящегося в комнате, о поверхность площадью 1 см2 за 1 с, выражается двадцатитрехзначным числом. Хотя сила удара одной молекулы мала, но действие всех молекул на стенки сосуда значительно, оно и составляет давление газа. Итак, давление газа на стенки сосуда и на помещенное в газ тело вызывается ударами молекул газа.
Жидкость
Жидкость — вещество в состоянии, промежуточном между твердым и газообразным. Это агрегатное состояние вещества, в котором молекулы (или атомы) связаны между собой настолько, что это позволяет ему сохранять свой объем, но недостаточно сильно, чтобы сохранять и форму.
Свойства жидкостей. Жидкости легко меняют свою форму, но сохраняют объем. В обычных условиях они принимают форму сосуда, в котором находятся.
Строение жидкостей. Свойства жидкостей объясняются тем, что промежутки между их молекулами малы: молекулы в жидкостях упакованы так плотно, что расстояние между каждыми двумя молекулами меньше размеров молекул. Оно заключается в следующем. Молекула жидкости колеблется около положения временного равновесия, сталкиваясь с другими молекулами из ближайшего окружения. Время от времени ей удается совершить «прыжок», чтобы покинуть своих соседей из ближайшего окружения и продолжать совершать колебания уже среди других соседей. Поскольку расстояния между молекулами жидкости малы, то попытка уменьшить объем жидкости приводит к деформации молекул, они начинают отталкиваться друг от друга, чем и объясняется малая сжимаемость жидкости. Текучесть жидкости объясняется тем, что «прыжки» молекул из одного оседлого положения в другое происходят по всем направлениям с одинаковой частотой. Внешняя сила не меняет заметным образом число «прыжков» в секунду, она лишь задает их преимущественное направление, чем и объясняется текучесть жидкости и то, что она принимает форму сосуда.
Твердое тело. Кристаллические и аморфные тела
Твердое тело — агрегатное состояние вещества, характеризующееся постоянством формы и характером движения атомов, которые совершают малые колебания около положений равновесия.
Кристаллические тела. Твердое тело в обычных условиях трудно сжать или растянуть. Для придания твердым телам нужной формы или объема на заводах и фабриках их обрабатывают на специальных станках: токарных, строгальных, шлифовальных. В отсутствие внешних воздействий твердое тело сохраняет свою форму и объем.
Это объясняется тем, что притяжение между атомами (или молекулами) у них больше, чем у жидкостей (и тем более газов). Оно достаточно, чтобы удержать атомы около положений равновесия.
Молекулы или атомы большинства твердых тел, таких, как лед, соль, алмаз, металлы, расположены в определенном порядке. Такие твердые тела называют кристаллическими. Хотя частицы этих тел и находятся в движении, движения эти представляют собой колебания около определенных точек (положений равновесия). Твердое тело сохраняет свою форму и объем.
Кроме того, в отличие от жидкостей, точки положений равновесия атомов или ионов твердого тела, будучи соединенными, располагаются в вершинах правильной пространственной решетки, которая называется кристаллической. Положения равновесия, относительно которых происходят тепловые колебания частиц, называются узлами кристаллической решетки.
Монокристалл — твердое тело, частицы которого образуют единую кристаллическую решетку (одиночный кристалл).
Анизотропия монокристаллов. Одним из главных свойств монокристаллов, которым они отличаются от жидкостей и газов, является анизотропия их физических свойств. Поданизотропией понимают зависимость физических свойств от направления в кристалле. Анизотропными являются механические свойства (например, известно, что слюду легко расслоить в одном направлении и очень трудно — в перпендикулярном), электрические свойства (электропроводность многих кристаллов зависит от направления), оптические свойства (явление двойного лучепреломления, и дихроизма — анизотропии поглощения; так, например, монокристалл турмалина «окрашен» в разные цвета — зеленый и бурый, в зависимости от того, с какой стороны на него посмотреть).
Поликристалл — твердое тело, состоящее из беспорядочно ориентированных монокристаллов. Поликристаллическими являются большинство твердых тел, с которыми мы имеем дело в быту — соль, сахар, различные металлические изделия. Беспорядочная ориентация сросшихся микрокристалликов, из которых они состоят, приводит к исчезновению анизотропии свойств.
Аморфные тела — это твердые тела, для которых характерно неупорядоченное расположение частиц в пространстве.
В этих телах молекулы (или атомы) колеблются около хаотически расположенных точек и, подобно молекулам жидкости, имеют определенное время оседлой жизни. Но, в отличие от жидкостей, время это у них очень велико. У аморфных тел нет определенной температуры, плавления. Этим они отличаются от кристаллических тел, которые при повышении температуры переходят в жидкое состояние не постепенно, а скачком (при вполне определенной температуре — температуре плавления). Все аморфные тела изотропны, т. е. имеют одинаковые физические свойства по разным направлениям. При ударе они ведут себя как твердые тела — раскалываются, а при очень длительном воздействии — текут.
2.1.2 Тепловое движение атомов и молекул вещества — процесс хаотичного (беспорядочного) движения частиц, образующих вещество.
2.1.3 Взаимодействие частиц вещества
Природа этого взаимодействия — электрическая. Молекула состоит из заряженных частиц — электронов и ядер. Заряженные частицы одной молекулы при соответствующих расстояниях взаимодействуют (притягиваются или отталкиваются) с заряженными частицами других молекул. На расстояниях, превышающих 2-3 диаметра молекул, результирующая сила взаимодействия определяется силами притяжения. Вклад последних по мере уменьшения расстояния между молекулами сначала растет, затем убывает. Силы взаимодействия обращаются в нуль, когда расстояние между молекулами становится равным сумме радиусов молекул. Дальнейшее уменьшение расстояния приводит к перекрыванию электронных оболочек, что вызывает быстрое нарастание сил отталкивания.
2.1.4 Диффузия — явление, при котором происходит взаимное проникновение молекул одного вещества между молекулами другого.
Броуновское движение — беспорядочное тепловое движение частиц.
2.1.5 Модель идеального газа в МКТ: частицы газа движутся хаотически и не взаимодействуют друг с другом
Идеальный газ — это теоретическая модель газа, в которой пренебрегают размерами и взаимодействиями частиц газа и учитывают лишь их упругие столкновения.
Предполагается, что внутренняя энергия идеального газа определяется лишь кинетической энергией его частиц (т. е. потенциальной энергией взаимодействия молекул пренебрегают).
В простейшей модели газа молекулы рассматриваются как очень маленькие твердые шарики, обладающие массой. Движение отдельных молекул подчиняется законам механики Ньютона.В современной физике эту модель используют также для описания ансамблей любых слабовзаимодействующих частиц. Модель идеального газа справедлива для реальных классических газов при достаточно высоких температурах и разрежениях, когда среднее расстояние между молекулами много больше размеров самих молекул. В этом случае силами притяжения можно пренебречь. Силы же отталкивания проявляются лишь при столкновении друг с другом в течение ничтожно малых интервалов времени.
2.1.6 Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа (основное уравнение МКТ):
Основное уравнение молекулярно-кинетической теории устанавливает связь между давлением идеального газа и средней кинетической энергией его молекул.
2.1.7 Абсолютная температура:
T = t° + 273K
Температура — физическая величина, характеризующая тепловое состояние тел (характеристика теплового равновесия системы).
2.1.8 Связь температуры газа со средней кинетической энергией поступательного теплового движения его частиц:
2.1.9 Уравнение p = nkT — зависимость давления газа от абсолютной температуры Т и концентрации его молекул.
2.1.10 Модель идеального газа в термодинамике:
Уравнение состояния идеального газа — это зависимость между параметрами идеального газа — давлением р, объемом V и абсолютной температурой Т, определяющими его состояние.
Выражение для внутренней энергии Уравнение Менделеева–Клапейрона (применимые формы записи):
Выражение для внутренней энергии одноатомного идеального газа (применимые формы записи):
2.1.11 Закон Дальтона для давления смеси разреженных газов:
2.1.12 Изопроцессы в разреженном газе с постоянным числом частиц N (с постоянным количеством вещества ν):
- Закон Бойля-Мориотта — для данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
- Закон Шарля — давление р данной массы газа при постоянном объеме пропорционально температуре.
- Закон Гей-Люссака — при постоянном давлении р объем V идеального газа меняется линейно с температурой.
Графическое представление изопроцессов на pV-, pT- и VT- диаграммах
2.1.13 Насыщенные и ненасыщенные пары
Насыщенный пар — пар, находящийся в динамическом равновесии со своей жидкостью.
Ненасыщенный пар — пар, не находящийся в состоянии равновесия со своей жидкостью, называется ненасыщенным.
При динамическом равновесии масса жидкости в закрытом сосуде не изменяется, хотя жидкость продолжает испаряться. Точно так же не изменяется и масса насыщенного пара над этой жидкостью, хотя пар продолжает конденсироваться.
Качественная зависимость плотности и давления насыщенного пара от температуры, их независимость от объёма насыщенного пара
Давление насыщенного пара. При сжатии насыщенного пара, температура которого поддерживается постоянной, равновесие сначала начнет нарушаться: плотность пара возрастет, и вследствие этого из газа в жидкость будет переходить больше молекул, чем из жидкости в газ; продолжаться это будет до тех пор, пока концентрация пара в новом объеме не станет прежней, соответствующей концентрации насыщенного пара при данной температуре (и равновесие восстановится). Объясняется это тем, что число молекул, покидающих жидкость за единицу времени, зависит только от температуры.
Итак, концентрация молекул насыщенного пара при постоянной температуре не зависит от его объема.
Поскольку давление газа пропорционально концентрации его молекул, то и давление насыщенного пара не зависит от занимаемого им объема. Давление р0, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
При сжатии насыщенного пара большая его часть переходит в жидкое состояние. Жидкость занимает меньший объем, чем пар той же массы. В результате объем пара при неизменной его плотности уменьшается.
Зависимость давления насыщенного пара от температуры. Для идеального газа справедлива линейная зависимость давления от температуры при постоянном объеме. Применительно к насыщенному пару с давлением р0 эта зависимость выражается равенством:
Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры.
Влажность воздуха — это количество граммов водяного пара, содержащееся в 1 м3 воздуха при данных условиях, т. е. это плотность водяного пара р, выраженная в г/м3.
2.1.14 Относительная влажность (φ) — это отношение абсолютной влажности воздуха р к плотности ρо насыщенного пара при той же температуре:
Под парциальным давлением (Pпара) понимают давление водяного пара, которое он производил бы, если бы все другие газы в атмосферном воздухе отсутствовали.
2.1.15 Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Испарение — это переход вещества из жидкого состояния в газообразное (пар), происходящее со свободной поверхности жидкости.
Кипение — это интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объему жидкости при определенной температуре.
В отличие от испарения, которое происходит при любой температуре жидкости, другой вид парообразования — кипение — возможен лишь при совершенно определенной (при данном давлении) температуре — температуре кипения.
Конденсация — переход вещества из газообразного состояния (пара) в жидкое или твердое состояние.
2.1.16 Изменение агрегатных состояний вещества: плавление и кристаллизация
Плавление — переход вещества из твердого кристаллического состояния в жидкое.
Чтобы расплавить твердое кристаллическое тело, его нужно нагреть до определенной температуры, т. е. подвести тепло.
Температура плавления вещества — температура, при которой вещество плавится.
Обратный процесс — переход из жидкого состояния в твердое — происходит при понижении температуры, т. е. тепло отводится.
Кристаллизация — переход вещества из жидкого состояния в твердое.
Температура кристаллизации — температура, при которой вещество кристаллизуется.
2.1.17 Преобразование энергии в фазовых переходах
Плавление и кристаллизация
Как уже было сказано ранее, это два взаимообратных процесса. Во время плавления для разрушения связей между структурными единицами необходима энергия. Поэтому, чтобы тело перешло в жидкое состояние, ему требуется энергия. Поэтому в результате подвода тепла внутренняя энергия тела увеличивается.
Во время процесса кристаллизации происходит обратный процесс — молекулы становятся в узлы кристаллической решетки, для этого температуру тела уменьшают, поэтому внутренняя энергия так же уменьшается.
Испарение и конденсация
Когда жидкости передается достаточное количество энергии, она переходит в газообразное состояние. Это значит, что внутренняя энергия тела увеличивается. В момент конденсации жидкость наоборот отдает энергию, следовательно, внутренняя энергия тела уменьшается.
Во время процессов кристаллизации и конденсации внутренняя энергия структурных единиц уменьшается, а при испарении и плавлении — увеличивается.
Подборка по базе: Конспект урока по математике по теме_ «Подготовка к изучению уст, Физика 9 сынып Кинематика. Векторларға қолданылатын амалдар. Қал, 779- Конституционное право РФ. Шпаргалка_РИОР, 2010 -102с.doc, Лекции. Статика и кинематика141100.62_ЭМС_.pdf, Классикалы_ механика_а кіріспе. Н_кте кинематикасы.doc, Жданова Т.С. Шпаргалка по уп.pdf, математика шпаргалка 10 кл.pdf, Твоя шпаргалка by Domi.pdf, Что узнали. Чему научились. Повторение пройденного «Переместите, Что узнали. Чему научились. Повторение пройденного «Переместите
8. МОЛЕКУЛЯРНАЯ ФИЗИКА И ГАЗОВЫЕ ЗАКОНЫ
| ИЗ ХИМИИ | МОЛЕКУЛЫ | ЧИСЛО ЧАСТИЦ |
| Относительная атомная масса Ar в т. Менделеева
, где — масса одного атома, — масса атома углерода Относительная молекулярная масса Mr = ∑Аr Молярная масса (кг/моль) |
Масса молекулы
Количество вещества Концентрация Плотность Масса вещества |
Число частиц
Число молекул Число атомов , где — количество атомов в молекуле |
| СЛЕДУЕТ ЗНАТЬ | ОСНОВНОЕ УРАВНЕНИЕ МКТ | УРАВ. СОСТОЯНИЯ При изменении М, m,v,N |
| Абсолютная температ.
Т = t+ 273 Изменение температуры ∆T = ∆t Нормальные условия То = 273 К; ро = 105 Па Двухатомные газы Н2, О2, N2, Cl2 Двухатомный газ перешёл в атомарное состояние ; |
1. 2.
3. 4.p = nkT Скорость движения частиц или Температура и средняя кинетическая энергия |
1.
2. 3. Все величины должны быть выражены в СИ! |
| ГАЗОВЫЕ ЗАКОНЫ При неизменной М, m,v,N | ЗАКОН ДАЛЬТОНА | НАСЫЩЕННЫЙ ПАР. ВЛАЖНОСТЬ ВОЗДУХА |
| Объединенный газовый закон
Бойля – Мариотта ( Т ) Гей – Люссака (р) Шарля (V) Температура в ! |
Открыли кран, соединяющий сосуды
Смесь газов в одном сосуде |
Давление насыщенного пара
; p = nkT Относительная влажность ; |
9. ГРАФИКИ ИЗОПРОЦЕССОВ
| Изотермический процесс | Изобарический процесс | Изохорный процесс |
|
Особый случай p 0 |
p 0 |
p 0 |
|
V 0 T |
Особый случай V 0 T |
V 0 T |
|
p 0 T |
p 0 T |
Особый случай
p 0 T |
ТЕПЛОВЫЕ ПРОЦЕССЫ ПРИ НАГРЕВАНИИ И ОХЛАЖДЕНИИ
6
8
7
5
4
3
10
9
2
1
11
| 1-2 | Нагревание твердого тела | Q = cт m (tпл – tо) |
| 2-3 | Плавление (tпл) | Q = λ m |
| 3-4 | Нагревание жидкости | Q=cжm(tкип – tпл) |
| 4-5 | Кипение (tкип) | Q = r m |
| 5-6 | Нагревание пара | Q = cп m(t – tкип ) |
| 6-7 | Охлаждение пара | Q = cп m (tкип – t) |
| 7-8 | Конденсация (tкип) | Q = — r m |
| 8-9 | Охлаждение жидкости | Q=cжm(tпл – tкип) |
| 9-10 | Отвердевание (tпл) | Q = — λ m |
| 10-11 | Охлаждение твердого тела | Q = cт m (tо – tпл) |
10. ТЕРМОДИНАМИКА
| КОЛИЧЕСТВО ТЕПЛОТЫ | ВНУТРЕННЯЯ ЭНЕРГИЯ ИД. ГАЗА |
| Нагревание и охлаждение
Теплоемкость и удельная теплоемкость С = с m Сгорание топлива Q = qm Плавление и отвердевание Кипение и конденсация «+» энергия поглощается «-» энергия выделяется Мощность теплопередачи или теплоотвода |
Внутренняя энергия
Степень свободы газа i Одноатомного 3, двухатомного 5, трех- и более 6 Изменение внутренней энергии Работа в термодинамике Геометрический смысл работы |
| ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ | МАКСИМАЛЬНЫЙ КПД тепловой машины |
| , где — работа газа
Изотермический процесс ∆U=0 ; Изохорный процесс ; ∆U= Q Изобарное расширение газа Адиабатный процесс Q=0; |
1.
2. 4. ; ; Температура в ! |
| КПД электронагревателей | КПД нагревателей |
| Чайник
Кофейник, самовар |
Газовый или спиртовой нагреватель
Плавильная печь |
11. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Изотермический процесс
|
p 0 |
V 0 T |
p 0 T |
|
| Что можно определить по графику |
| Первое начало | |||||
| 1-2 | 0 | ||||
| 2-1 | 0 |
Изохорный процесс
|
p 0 |
V |
p 0 T |
|
| Что можно определить по графику |
| Первое начало | |||||
| 1-2 | 0 | ||||
| 2-1 | 0 |
12.
Изобарный процесс
|
p 0 |
V 0 T |
p |
|
| Что можно определить по графику |
| Первое начало | |||||
| 1-2 | |||||
| 2-1 |
Произвольный процесс
| ; | |
| ; | |
13. ЭЛЕКТРОСТАТИКА
| СИЛА КУЛОНА | ТОЧЕЧНЫЙ ЗАРЯД | СИСТЕМА ЗАРЯДОВ |
| Закон Кулона
; Определение напряженности Избыток электронов |
Модуль напряженности
где — модуль заряда, создающего поле Потенциал (учитывайте знак заряда) Потенциальная энергия двух зарядов (учиты-вайте знак заряда) |
Результирующая сила
Общая напряженность Общий потенциал Потенциальная энергия |
| НАПРЯЖЕННОСТЬ СФЕР. ПРОВОДНИКА | ПОТЕНЦИАЛ СФЕР. ПРОВОДНИКА | ОДНОРОДНОЕ ПОЛЕ |
| Внутри (r
E=0 На поверхности (r=R) Вне (r>R) |
Внутри и на поверхности
( ) Вне (r>R) |
Разность потенциалов
Напряжение Сила Кулона |
| РАБОТА ЭЛ/СТАТИЧ. ПОЛЯ | КОНДЕНСАТОРЫ | СОЕДИНЕНИЕ
КОНДЕНСАТОРОВ |
| Учитывайте знак заряда
1. 2. 3. 4. 5. 6. 7. 8. |
Электроемкость
Заряд, напряжение, электроёмкость «Конденсатор отключен от источника» «Конденсатор подключен к источнику» Энергия конденсатора |
Последов. соединение
Параллельное соединение Параллельное соединение конденсаторов одноименно («+») и разноименно («-») заряженными пластинами |
14. ЗАКОНЫ ПОСТОЯННОГО ТОКА
| СИЛА ТОКА, СОПРОТИВЛЕНИЕ, НАПРЯЖЕНИЕ | СОЕДИНЕНИЯ ПРОВОДНИКОВ | ЗАКОНЫ ОМА |
| Определение силы тока
Заряд при равномерном изменении тока Сила тока и скорость движения электронов Определение сопрот. Зависимость от температуры Напряжение |
Последовательное
Одинаковые сопротивления Параллельное Одинаковые сопротивления |
Для участка цепи
Для полной цепи ЭДС Падение напряжения, напряжение на полюсах источника Ток короткого замыкания КПД источника |
| МОЩНОСТЬ | РАБОТА, КОЛИЧЕСТВО ТЕПЛОТЫ | |
| На внешней цепи, на нагрузке, полезная | ||
| Максимальная на внешней цепи, при R=r | ||
| Внутренней цепи, внутри источника | ||
| Полная | ||
| Работа, энергия, количество теплоты, мощность и время
Закон Джоуля – Ленца КПД электродвигателя |
Шпаргалки (шпора) по Физике.
| Основные положения, законы и формулы. | |||||||||||||||||||
| Молекулярная физика. | |||||||||||||||||||
|
|||||||||||||||||||
| В зависимости от соотношения Еk и Еn все вещества делятся на: |
|||||||||||||||||||
|
|||||||||||||||||||
| Идеальный газ: | |||||||||||||||||||
|
|||||||||||||||||||
| Газ: | |||||||||||||||||||
|
|||||||||||||||||||
| Постоянная Авогадро | |||||||||||||||||||
| Количество вещества | |||||||||||||||||||
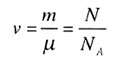 |
|||||||||||||||||||
| Молярная масса | |||||||||||||||||||
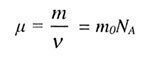 |
|||||||||||||||||||
| Постоянная Больцмана | |||||||||||||||||||
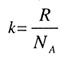 |
|||||||||||||||||||
| Масса одной молекулы | |||||||||||||||||||
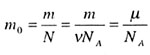 |
|||||||||||||||||||
| Основное уравнение МКТ | |||||||||||||||||||
| Концентрация молекул | |||||||||||||||||||
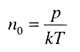 |
|||||||||||||||||||
| Средняя кинетическая энергия | |||||||||||||||||||
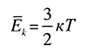 |
|||||||||||||||||||
| Средняя длина свободного пробега | |||||||||||||||||||
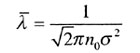 |
|||||||||||||||||||
| Давление идеального газа | |||||||||||||||||||
| Плотность газов | |||||||||||||||||||
| Средняя квадратичная скорость движения молекул | |||||||||||||||||||
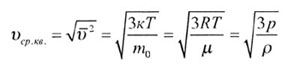 |
|||||||||||||||||||
| При одинаковой температуре средние квадратичные скорости движения молекул обратно пропорциональны корням квадратным из масс молекул: |
|||||||||||||||||||
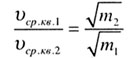 |
|||||||||||||||||||
| Закон Авогадро:один моль любого газа при нормальных условиях (Т0 = 273 К, р0 = 1,013 • 105 Па) занимает один и тот же объем |
|||||||||||||||||||
| называемый молярным объемом | |||||||||||||||||||
| Объединенный газовый закон | |||||||||||||||||||
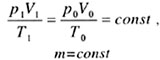 |
|||||||||||||||||||
| Закон Бойля-Мариотта | |||||||||||||||||||
| p0V0 = p1V1 = const, T = const, m = const. |
|||||||||||||||||||
| Закон Гей-Люссака | |||||||||||||||||||
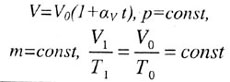 |
|||||||||||||||||||
| Закон Шарля | |||||||||||||||||||
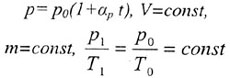 |
|||||||||||||||||||
| Графики изобарного процесса представлены на рисунке 36 и называются изобарами: |
|||||||||||||||||||
 |
|||||||||||||||||||
| Рис. 36 | |||||||||||||||||||
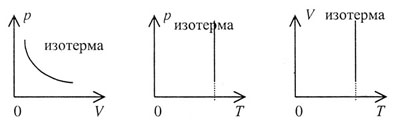
| Графики изотермического процесса представлены на рисунке 37 и называются изотермами: |
|||||||||||||||||||
 |
|||||||||||||||||||
| Рис. 37 | |||||||||||||||||||
| Графики изохорного процесса представлены на рисунке 38 и называются изохорами: |
|||||||||||||||||||
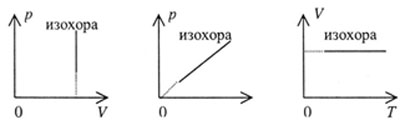 |
|||||||||||||||||||
| Рис. 38 | |||||||||||||||||||
| Закон Дальтона: | |||||||||||||||||||
| давление смеси газов равно сумме парциальных давлений: | |||||||||||||||||||
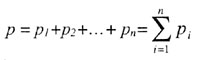 |
|||||||||||||||||||
| Парциальное давление — давление, которое бы занимал газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при данной температуре. |
|||||||||||||||||||
| Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа) для произвольной массы газа с молярной массой |
|||||||||||||||||||
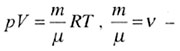 число молей число молей |
|||||||||||||||||||
| Если v = 1 => уравнение состояния идеального газа для одного моля: |
|||||||||||||||||||
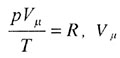 — молярный объем — молярный объем
|
|||||||||||||||||||
| Внутренняя энергия одного моля одноатомного идеального газа |
|||||||||||||||||||
| Изменение внутренней энергии идеального одноатомного газа | |||||||||||||||||||
Механика
Молекулярная физика и термодинамика
Электричество и магнетизм
Оптика
Теория относительности
Квантовая физика
Механика
Кинематика
| Равноускоренное движение: | ||
| Ускорение: | `a=(v-v_0)/t` | |
| Скорость: | `v=v_0+at` | |
| Путь, пройденный телом: | `S=v_0t+(at^2)/2` | |
| `S=(v^2-v_0^2)/(2a)` | ||
| `S=(v+v_0)/2t` | ||
| `v(t)=S'(t)` | ||
| `a(t)=v'(t)=S»(t)` |
| Тело брошено под углом к горизонту: | ||
| Горизонтальная проекция скорости: | `v_x=v_0*cosalpha=const` | |
| Вертикальная проекция скорости: | `v_y=v_0*sinalpha` |
| Движение по окружности: | |
| Центростремительное ускорение: | `a_(цс)=v^2/R=omega^2R` |
| Угловая скорость: | `omega=(Deltavarphi)/(Deltat)=(2pi)/T=2pinu` |
| Связь линейной и угловой скоростей: | `v=omegaR` |
Динамика
| Плотность: | `rho=m/V` | |
| Второй закон Ньютона: | `vec F=mvec a` | |
| Гравитационное притяжение: | `F=G(m_1m_2)/R^2` | |
| 1-я космическая скорость: | `v_I=sqrt(gR)=sqrt((GM)/R)` | |
| 2-я космическая скорость: | `v_(II)=sqrt(2)*v_I` | |
| Закон Гука: | `F=-kx` | |
| Сила трения: | `F_(тр)=muN` | |
| Давление: | `p=F/S` |
Статика
| Момент силы: | `M=F*l` | |
| Условие равновесия: | `{(M_1+M_2+…=0),(vec F_1+vec F_2+…=0):}` | |
| Правило рычага: | `F_1*l_1=F_2*l_2` | |
| Давление жидкости: | `p=rhogh` | |
| Сила Архимеда: | `F_A=rho_жgV_т` |
Импульс и энергия
| Импульс: | `vec p=mvec v` |
| Изменение импульса: | `Deltavec p=vec FDeltat` |
| Работа силы: | `A=F*l*cosalpha` |
| Мощность: | `P=A/t` |
| КПД: | `eta=A_(полезная)/A_(затраченная)` |
| Кинетическая энергия: | `E_к=(mv^2)/2` |
| Потенциальная энергия тяжести: | `E_п=mgh` |
| Потенциальная энергия пружины: | `E_п=(kx^2)/2` |
Механические колебания и волны
| `x(t)=Asin(omegat+varphi_0)` | |
| `v(t)=x'(t)=Aomegacos(omegat+varphi_0)` | |
| `a(t)=v'(t)=-Aomega^2sin(omegat+varphi_0)` | |
| Период колебаний: | `T=1/nu=(2pi)/omega` |
| Период математического маятника: | `T=2pisqrt(l/g)` |
| Период пружинного маятника: | `T=2pisqrt(m/k)` |
| Скорость волны: | `v=lambdanu` |
Молекулярная физика и термодинамика
Молекулярная физика
| Средняя кинетическая энергия молекул | `bar E_к=3/2kT` | |
| Давление газа: | `p=nkT` | |
| Уравнение Менделеева-Клайперона: | `pV=nuRT` | |
| Количество вещества в молях: | `nu=m/M=N/N_A` | |
| Внутренняя энергия: | `U=3/2nuRT` | |
| Закон Дальтона для смеси: | `p=p_1+p_2+…` | |
| Относительная влажность: | `varphi=p_(парц)/p_(насыщ)=rho_(парц)/rho_(насыщ)` | |
| Уравнение теплобаланса: | `Q_1+Q_2+Q_3+…=0` |
Термодинамика
| `Q=cmDeltaT` |
| `Q=lambdam` |
| `Q=rm` |
| `Q=qm` |
| Первое начало термодинамики: | `Q=DeltaU+A` | |
| Работа газа в любом термодинамическом процессе — это площадь под pV-графиком | ||
| Работа в изобарном процессе: | `A=p*DeltaV` | |
| Работа газа всегда связана с изменением объёма: | `Vuarr rArr A>0` `Vdarr rArr A`V=const rArr A=0` |
|
| Работа внешних сил над газом: | `A_(внеш.сил)=-A_(газа)` | |
| КПД: | `eta=A_(цикл)/Q_н=(Q_н-Q_х)/Q_н` | |
| Машина Карно: | `eta=(T_н-T_х)/T_н` |
Электричество и магнетизм
Электрическое поле
| Сила Кулона: | `F=k(q_1*q_2)/r^2` |
| Поле точечного заряда: | `E=kq/r^2` | |
| Сила, действующая на заряд в эл.поле: | `F=q*E` | |
| Потенциал поля: | `varphi=W/q` | |
| Работа по перемещению заряда: | `A=DeltaW=qDeltavarphi=qU` | |
| Напряжение в однородном поле: | `U=Ed` | |
| Ёмкость конденсатора (любого): | `C=q/U` | |
| Ёмкость плоского конденсатора: | `C=(epsilonepsilon_0S)/d` | |
| Параллельное соединение конденсаторов: | `C_(общ)=C_1+C_2+…` | |
| Последовательное соединение конденсаторов: | `1/C_(общ)=1/C_1+1/C_2+…` | |
| Энергия конденсатора: | `W_c=(CU^2)/2=(qU)/2=q^2/(2C)` |
Постоянный ток
| Сила тока: | `I=(Deltaq)/(Deltat)` |
| Переменный ток: | `I(t)=q'(t)` |
| Сопротивление: | `R=rhol/S` |
| Закон Ома для участка цепи: | `I=U/R` |
| Закон Ома для полной цепи: | `I=varepsilon/(R+r)` |
| Параллельное соединение проводников: | `1/R=1/R_1+1/R_2+…` |
| `R=(R_1*R_2*…)/(R_1+R_2+…)` | |
| `I=I_1+I_2+…` | |
| `U=U_1=U_2=…` | |
| Последовательное соединение проводников: | `R=R_1+R_2+…` |
| `I=I_1=I_2=…` | |
| `U=U_1+U_2+…` | |
| Мощность тока: | `P=UI=I^2R=U^2/R` |
| Закон Джоуля-Ленца: | `Q=I^2Rt` |
Магнитное поле
| Сила Ампера: | `F_A=BIl*sinalpha` |
| Сила Лоренца: | `F_Л=qvB*sinalpha` |
Электромагнитная индукция:
| Магнитный поток: | `Ф=BScosalpha` |
| Закон электромагнитной индукции: | `varepsilon_i=-(DeltaФ)/(Deltat)=-Ф’_t` |
| ЗДС в движущемся проводнике: | `varepsilon_i=Blvsinalpha` |
| Индуктивность: | `L=Ф/I` |
| ЭДС самоиндукции: | `varepsilon_(si)=-L(DeltaI)/(Deltat)=-LI’_t` |
| Энергия катушки с током: | `W_L=(LI^2)/2` |
Электромагнитные колебания и волны:
| `q(t)=q_0sin(omegat+varphi_0)` |
| `I(t)=q'(t)=q_0omegacos(omegat+varphi_0)=I_0cos(omegat+varphi_0)` |
| Формула Томсона: | `T=2pisqrt(LC)` |
| `omega=(2pi)/T=1/sqrt(LC)` | |
| Скорость электромагнитной волны: | `c=lambdanu` |
Оптика
Прохождение границы двух сред:
| Закон отражения: | `alpha=gamma` | |
| Показатель преломления: | `n=c/v` | |
| Закон преломления: | `sinalpha/sinbeta=n_2/n_1` | |
| `nu_1=nu_2` | ||
| `n_1lambda_1=n_2lambda_2` |
Линзы:
| Оптическая сила линзы: | `D=1/F` |
| Формула тонкой линзы: | `1/F=1/d+1/f` |
| Линейное увеличение: | `Г=h/H=f/d` |
Волновая оптика:
| Условие максимумов интерференции: | `Deltad=klambda, kinZZ` |
| Условие минимумов интерференции: | `Deltad=(2k+1)lambda/2, kinZZ` |
| Формула дифракционной решётки: | `dsinvarphi=klambda, kinZZ` |
Основы специальной теории относительности
| Энергия частицы: | `E=(mc^2)/sqrt(1-v^2/c^2)` |
| Импульс частицы: | `vec p=(mvec v)/sqrt(1-v^2/c^2)` |
| Связь энергии и массы: | `E^2-(pc)^2=(mc^2)^2` |
| Энергия покоя частицы: | `E_0=mc^2` |
Квантовая физика
Корпускулярно-волновой дуализм:
| Энергия фотона: | `Е=hnu=(hc)/lambda` |
| Импульс фотона: | `p=h/lambda=(hnu)/c` |
| Уравнение фотоэффекта: | `hnu=A_(вых)+(mv^2)/2` |
| Запирающее напряжение: | `eU_(зап)=(mv^2)/2` |
Постулаты Бора:
| Уровнии энергии атома водорода: | `E_n=(-13,6 эВ)/n^2` |
| Излучение и поглощение фотона при переходе между уровнями: | `hnu_(mn)=|E_n-E_m|` |
Ядерная физика:
| Дефект массы ядра: | `Deltam=Z*m_p+(A-Z)*m_n-m_(ядра)` | |
| `alpha`-распад: | `color(white)(*)_Z^AX->_(Z-2)^(A-4)Y+_2^4He` | |
| `beta`-распад электронный: | `color(white)(*)_Z^AX->_(Z+1)^AY+_(-1)^0e` | |
| `beta`-распад позитронный: | `color(white)(*)_Z^AX->_(Z-1)^AY+_(+1)^0e` | |
| Закон радиоактивного распада: | `N(t)=N_0*2^(-t/T)` | |
| См. также таблицу Менделеева с комментариями |
Подборка тренировочных вариантов ЕГЭ 2022 по физике для 11 класса с ответами из различных источников.
Соответствуют демоверсии ЕГЭ 2022 по физике
Структура варианта КИМ ЕГЭ 2022 по физике
Каждый вариант экзаменационной работы состоит из двух частей и включает в себя 30 заданий, различающихся формой и уровнем сложности.
Часть 1 содержит 23 задания с кратким ответом, из них 11 заданий с записью ответа в виде числа или двух чисел и 12 заданий на установление соответствия и множественный выбор, в которых ответы необходимо записать в виде последовательности цифр.
Часть 2 содержит 7 заданий с развёрнутым ответом, в которых необходимо представить решение задачи или ответ в виде объяснения с опорой на изученные явления или законы.
При разработке содержания КИМ учитывается необходимость проверки усвоения элементов знаний, представленных в разделе 2 кодификатора.
Продолжительность ЕГЭ по физике
На выполнение всей экзаменационной работы отводится 235 минут. Примерное время на выполнение заданий экзаменационной работы составляет:
− для каждого задания с кратким ответом – 2–5 минут;
− для каждого задания с развёрнутым ответом – от 5 до 20 минут.
Дополнительные материалы и оборудование
Перечень дополнительных устройств и материалов, пользование которыми разрешено на ЕГЭ, утверждён приказом Минпросвещения России и Рособрнадзора. Используется непрограммируемый калькулятор (на каждого участника экзамена) с возможностью вычисления тригонометрических функций (cos, sin, tg) и линейка
Связанные страницы:
Изменения в КИМ ЕГЭ 2022 г. по физике нет.
Структура заданий ЕГЭ по физике-2022
Экзаменационная работа состоит из двух частей, включающих в себя 32 задания.
Часть 1 содержит 26 заданий.
- В заданиях 1–4, 8–10, 14, 15, 20, 25–26 ответом является целое число или конечная десятичная дробь.
- Ответом к заданиям 5–7, 11, 12, 16–18, 21, 23 и 24 является последовательность двух цифр.
- Ответом к заданию 13 является слово.
- Ответом к заданиям 19 и 22 являются два числа.
Часть 2 содержит 6 заданий. Ответ к заданиям 27–32 включает в себя подробное описание всего хода выполнения задания. Вторая часть заданий (с развёрнутым ответом) оцениваются экспертной комиссией на основе критериев.
Темы ЕГЭ по физике, которые будут в экзаменационной работе
- Механика (кинематика, динамика, статика, законы сохранения в механике, механические колебания и волны).
- Молекулярная физика (молекулярно-кинетическая теория, термодинамика).
- Электродинамика и основы СТО (электрическое поле, постоянный ток, магнитное поле, электромагнитная индукция, электромагнитные колебания и волны, оптика, основы СТО).
- Квантовая физика и элементы астрофизики (корпускулярноволновой дуализм, физика атома, физика атомного ядра, элементы астрофизики).
Продолжительность ЕГЭ по физике
На выполнение всей экзаменационной работы отводится 235 минут.
Примерное время на выполнение заданий различных частей работы составляет:
- для каждого задания с кратким ответом – 3–5 минут;
- для каждого задания с развернутым ответом – 15–20 минут.
Что можно брать на экзамен:
- Используется непрограммируемый калькулятор (на каждого ученика) с возможностью вычисления тригонометрических функций (cos, sin, tg) и линейка.
- Перечень дополнительных устройств и материалов, использование которых разрешено на ЕГЭ, утверждается Рособрнадзором.
Важно!!! не стоит рассчитывать на шпаргалки, подсказки и использование технических средств (телефонов, планшетов) на экзамене. Видеонаблюдение на ЕГЭ-2022 усилят дополнительными камерами.
Баллы ЕГЭ по физике
- 1 балл — за 1-4, 8, 9, 10, 13, 14, 15, 19, 20, 22, 23, 25, 26, задания.
- 2 балла — 5, 6, 7, 11, 12, 16, 17, 18, 21, 24, 28.
- 3 балла — 27, 29, 30, 31, 32.
Всего: 53 баллов (максимальный первичный балл).
Что необходимо знать при подготовки заданий в ЕГЭ:
- Знать/понимать смысл физических понятий, величин, законов, принципов, постулатов.
- Уметь описывать и объяснять физические явления и свойства тел (включая космические объекты), результаты экспериментов… приводить примеры практического использования физических знаний
- Отличать гипотезы от научной теории, делать выводы на основе эксперимента и т.д.
- Уметь применять полученные знания при решении физических задач.
- Использовать приобретенные знания и умения в практической деятельности и повседневной жизни.
С чего начать подготовку к ЕГЭ по физике:
- Изучать теорию, необходимую для каждого заданий.
- Тренироваться в тестовых заданиях по физике, разработанные на основе демонстрационного варианта ЕГЭ. На нашем сайте задания и варианты по физике будут пополняться.
- Правильно распределяйте время.
Желаем успеха!
*В логине разрешены латинские буквы/цифры/точка/@
Регистрируясь через данную форму, я соглашаюсь с политикой конфеденциальности и согласен на обработку персональных данных.
Хочу, что вы отправляли мне индивидуальные подборки и лучшие предложения от вузов по нужным мне критериям.
17 января 2020
В закладки
Обсудить
Жалоба
В сборник включены все формулы базового курса школьной программы по физике.
Они полностью соответствуют кодификатору ЕГЭ — перечню всех теоретических фактов, которыми должен владеть выпускник школы, сдающий физику. Формулы, отмеченные звёздочками, рекомендуется запомнить и применять при решении задач. Но они не входят в кодификатор ЕГЭ. Поэтому при оформлении развёрнутого решения заданий второй части экзамена эти формулы необходимо вывести самостоятельно.
formuls.pdf
Этапы закрепощения крестьян в России
Крепостное право на Руси появилось позже, чем во многих средневековых европейских королевствах. Это было связано с объективными причинами – низкая плотность населения, зависимость от ордынского ига.
Задания 12-18 досрочного ЕГЭ по математике
3 примера по каждому заданию. Досрочный ЕГЭ по математике прошёл 28 марта.
ОГЭ по математике. Тренировочный вариант СтатГрад
Видеоуроки ОГЭ | Вчера, 21:46
Решение тестовой части (№1-19) тренировочной работы по математике от 18 апреля 2022 года.
Основные формулы молекулярной физики
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
В кодификаторе ЕГЭ нет тем, непосредственно относящихся к содержанию данного листка. Однако без этого вводного материала дальнейшее изучение молекулярной физики невозможно.
Введём основные величины молекулярной физики и соотношения между ними.
— масса вещества,
— объём вещества,
— плотность вещества (масса единицы объёма). Отсюда
— число частиц вещества (атомов или молекул).
— масса частицы вещества. Тогда
— концентрация вещества (число частиц в единице объёма),
. Отсюда
Что получится, если умножить на
? Произведение массы частицы на число частиц в единице объёма даст массу единицы объёма, т. е. плотность. Формально:
Итак,
Массы и размеры частиц невообразимо малы по нашим обычным меркам. Например, масса атома водорода порядка г, размер атома порядка
см. Из-за столь малых значений масс и размеров число частиц в макроскопическом теле огромно.
Оперировать столь грандиозными числами, как число частиц, неудобно. Поэтому для измерения количества вещества используют специальную единицу — моль.
Один моль — это количество вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в граммах углерода. А в
граммах углерода содержится примерно
атомов. Стало быть, в одном моле вещества содержится
частиц. Это число называется постоянной Авогадро:
моль
.
Количество вещества обозначается . Это число молей данного вещества.
Что получится, если умножить на
? Число молей, умноженное на число частиц в моле, даст общее число частиц:
Масса одного моля вещества называется молярной массой этого вещества и обозначается (
= кг/моль). Ясно, что
Как найти молярную массу химического элемента? Оказывается, для этого достаточно заглянуть в таблицу Менделеева! Нужно просто взять атомную массу (число нуклонов) данного элемента — это будет его молярная масса, выраженная в г/моль. Например, для алюминия
, поэтому молярная масса алюминия равна
г/моль или
кг/моль.
Почему так получается? Очень просто. Молярная масса углерода равна г/моль по определению. В то же время ядро атома углерода содержит
нуклонов. Выходит, что каждый нуклон вносит в молярную массу
г/моль. Поэтому молярная масса химического элемента с атомной массой
оказывается равной
г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием молярных масс. Так, молярная масса углекислого газа равна
г/моль
кг/моль.
Будьте внимательны с молярными массами некоторых газов! Так, молярная масса газообразного водорода равна г/моль, поскольку его молекула состоит из двух атомов
. То же касается часто встречающихся в задачах азота и кислорода
Вместе с тем, наиболее частый персонаж задач — гелий
— является одноатомным газом и имеет молярную массу
г/моль, предписанную таблицей Менделеева.
Ещё раз предостережение: при расчётах не забывайте переводить молярную массу в кг/моль! Если ваш ответ отличается от правильного на три порядка, то вы наверняка сделали именно эту, очень распространённую ошибку 
Что получится, если умножить на
? Масса частицы, умноженная на число частиц в моле, даст массу моля, т. е. молярную массу:
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Основные формулы молекулярной физики» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
09.03.2023
По теме: методические разработки, презентации и конспекты
Бинарный урок по химии и физике «Основные понятия химии и физики» (брейн-ринг)
Тип урока: обобщающий, бинарный, с элементами ИКТФорма урока: брейн-рингЦель: повторение и обощение знаний об основных химических и физических понятиях.Задачи: актуализация знаний учащихсяобощен…
Подготовка к ЕГЭ по физике в 11 классе,презентация на тему «Молекулярная физика»
…
формулы физики МКТ и ТЕРМОДИНАМИКА
ВСЕ — формулы физики МКТ и ТЕРМОДИНАМИКА…
Основные понятия по физике за 7 класс
Список понятий по физике за 7 класс….
Основные понятия по физике за 8 класс
Основные понятия по физике за 8 класс…
Интерактивный сборник тестов по физике «Молекулярная физика. Термодинамика»
Тестовые задания созданы в программе MS Excel 2007 и предназначены для проверки знаний по теме «Молекулярная физика. Термодинамика» для студентов 1 курса (учащихся 10 класса). Тесты можно применять на…
Дидактический пакет по проектированию образовательного процесса по физике в 10 классе на примере раздела «Молекулярная физика. Термодинамика».
Дидактический пакет по проектированию образовательного процесса по физике в 10 классе на примере раздела «Молекулярная физика. Термодинамика»….
Основные положения МКТ
- Все вещества состоят из мельчайших частиц – молекул и атомов.
- Частицы хаотично движутся.
Доказательство этого положения – диффузия. (Проникновение молекул одного вещества между молекулами другого, например, соленые огурцы – это пример диффузии).
- Частицы взаимодействуют друг с другом.
Сейчас немного формул из химии
- Количество вещества (сколько стаканов в мешке с семечками/сколько моль в веществе). Так как молекул огромное количество считать их поштучно неудобно, для этого вводят величину «количество вещества». Ведь вы не можете купить у бабушки на улице одну семечку или две семечки, а вот приобрести стакан семечек можете.
- Постоянная Авогадро (сколько семечек в одном стакане/сколько молекул в 1 моле вещества).
- Молярная масса (какова масса семечек в одном стакане/масса одного моля вещества).
Сводные формулы и мнемонические правила для запоминания
Сколько стаканов в мешке с семечками = сколько моль в веществе:
Сколько семечек в мешке = сколько молекул в веществе:
Теперь переходим к физическим формулам
Основное уравнение МКТ
- Домножим основное уравнение МКТ на 2 и разделим на 2 одновременно:
Преобразуем и получим:
Формула с плотностью
Распишем концентрацию по определению:
Температуру в МКТ мы измеряем в Кельвинах «К», чтобы перевести градусы Цельсия в Кельвины.
K = °С + 273
Формула для тепловой скорости частиц
Её легко запомнить, выучив «три кота на мясо».
Уравнение Менделеева-Клапейрона
Запомните: не КлАЙперона, а КлапЕЙрона!
СКАЧАТЬ ШПАРГАЛКУ ПО ФИЗИКИ ДЛЯ ЕГЭ
Молекулярно-кинетическая теория
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!






















