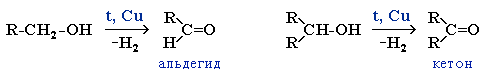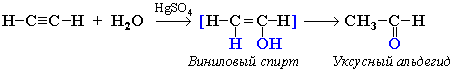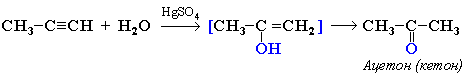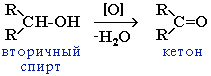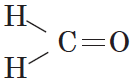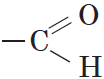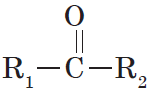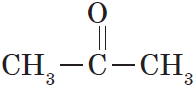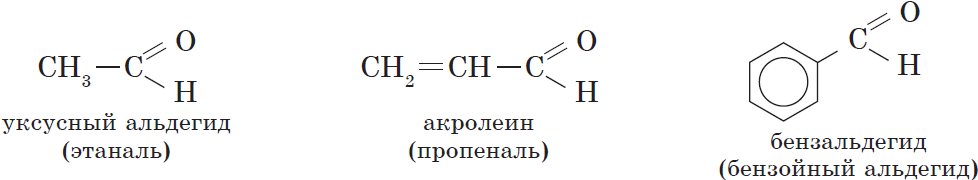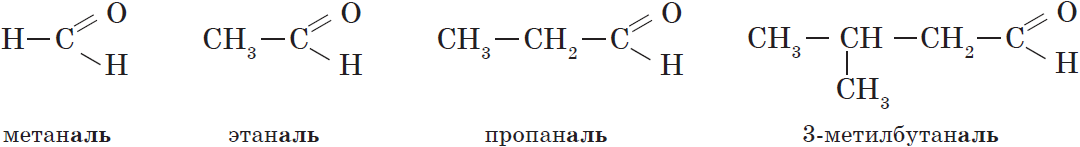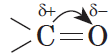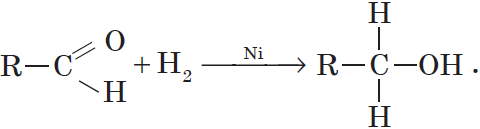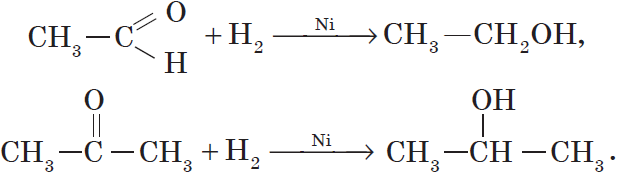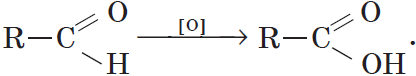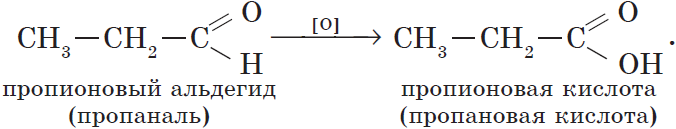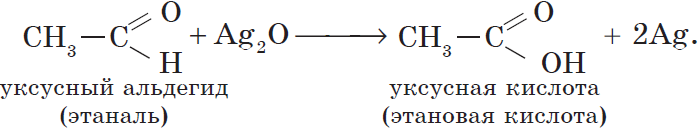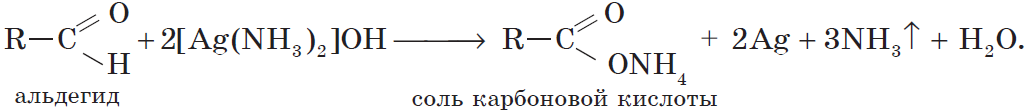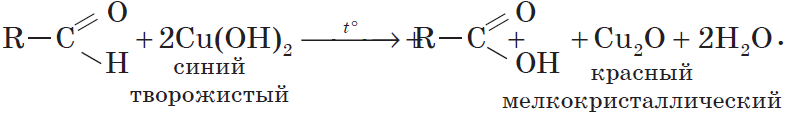Skip to content
Чтобы поделиться, нажимайте
Получение
I. В промышленности
Этот способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
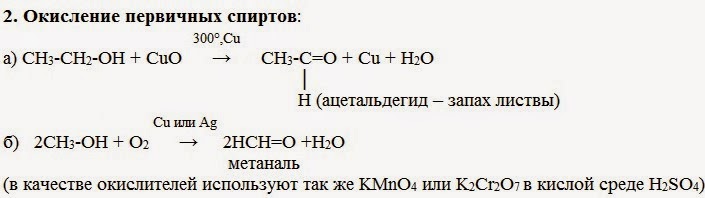
В промышлености альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
II. В лаборатории
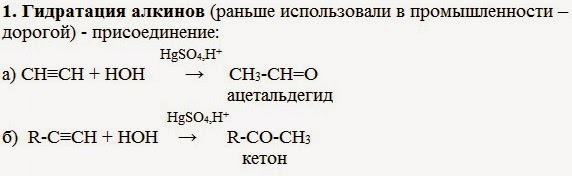
1. Гидратация алкинов (раньше использовали в промышленности – способ дорогой) — присоединение:
Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:
Кетоны получают при гидратации других гомологов ряда алкинов:
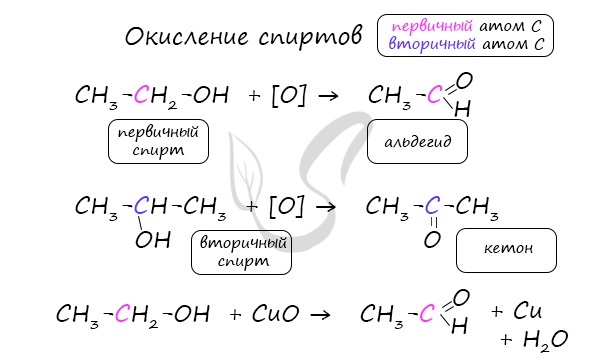
2. Окисление спиртов:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, ниже tкип спирта и кислоты).
При окислении вторичных спиртов образуются кетоны.
Применение альдегидов и кетонов
Метаналь (муравьиный альдегид) CH2=O
- получение фенолформальдегидных смол;
- получение мочевино-формальдегидных (карбамидных) смол;
- полиоксиметиленовые полимеры;
- синтез лекарственных средств (уротропин);
- дезинфицирующее средство;
- консервант биологических препаратов (благодаря способности свертывать белок).
Этаналь (уксусный альдегид, ацетальдегид) СН3СН=О
- производство уксусной кислоты;
- органический синтез.
Ацетон СН3-СО-СН3
- растворитель лаков, красок, ацетатов целлюлозы; сырье для синтеза различных органических веществ.
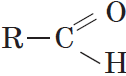
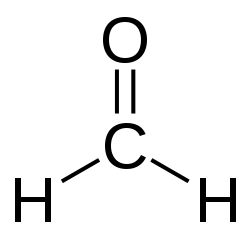
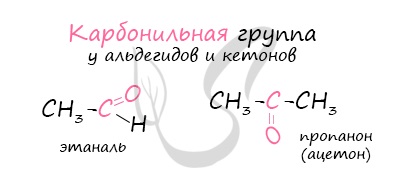
Альдегиды — органические вещества, молекулы которых содержат карбонильную группу 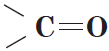
Общая формула альдегидов имеет вид:
В простейшем альдегиде — формальдегиде — роль углеводородного радикала играет второй атом водорода:
Карбонильную группу, связанную с атомом водорода, называют альдегидной:
Органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами, называют кетонами.
Очевидно, общая формула кетонов имеет вид:
Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
Номенклатура и изомерия
В зависимости от строения углеводородного радикала, связанного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:
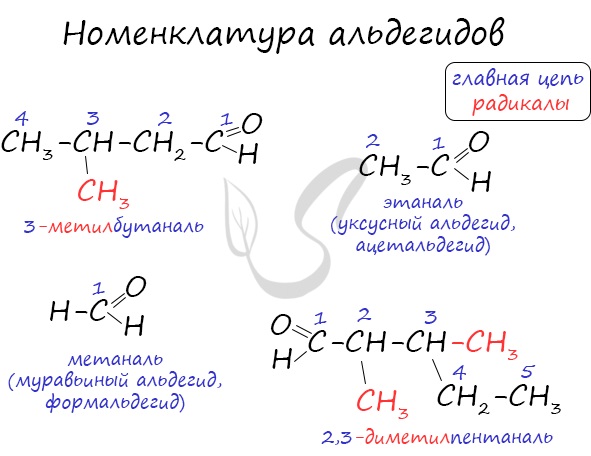
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль. Например:
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. По этому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:
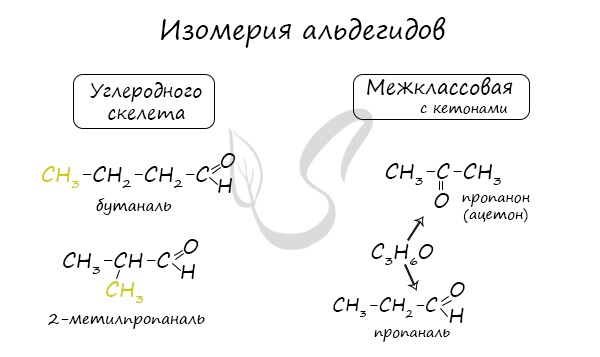
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов — также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Тривиальные названия и температуры кипения некоторых альдегидов.
| Альдегид | Систематическое название (ИЮПАК) | Тривиальное название | $t_{кип.}, °С$ |
| $НСНО$ | Метаналь | Муравьиный альдегид, формальдегид | $–21$ |
| $СН_3CHО$ | Этаналь | Уксусный альдегид | $21$ |
| $СН_3CH_2CHО$ | Пропаналь | Пропионовый альдегид | $48$ |
| $СН_2=CHCHО$ | 2-Пропеналь | Акролеин | $53$ |
| $CH_3СН_2CH_2CHО$ | Бутаналь | Масляный альдегид | $74$ |
| $CH_3СН_2CH_2CH_2CHО$ | Пентаналь | Валериановый альдегид | $103$ |
| $C_6Н_5CHО$ | Бензальдегид | Бензойный альдегид | $179$ |
Физические и химические свойства
Физические свойства.
В молекуле альдегида или кетона вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь $С=О$ сильно поляризована за счет смещения электронной плотности $π$-связи к кислороду:
Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов, в отличие от спиртов, нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей. Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Химические свойства
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
Реакции восстановления.
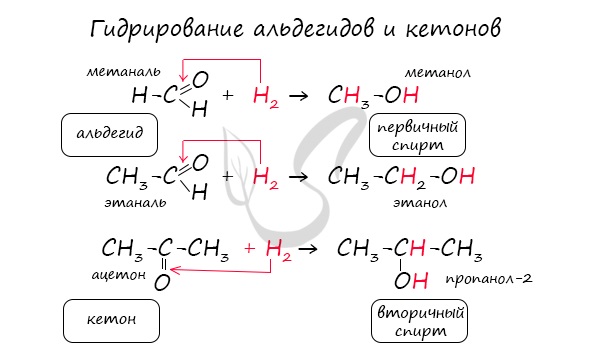
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:
Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2:
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Реакции окисления.
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
Из пропионового альдегида (пропаналя), например, образуется пропионовая кислота:
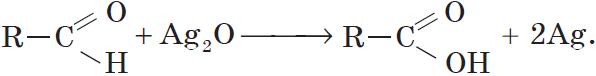
Альдегиды окисляются даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор оксида серебра. В упрощенном виде этот процесс можно выразить уравнением реакции:
Например:
Более точно этот процесс отражают уравнения:
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее ровной тонкой пленкой. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Окислителем альдегидов может выступать и свежеосажденный гидроксид меди (II). Окисляя альдегид, $Cu^{2+}$ восстанавливается до $Cu^+$. Образующийся в ходе реакции гидроксид меди (I) $CuOH$ сразу разлагается на оксид меди (I) красного цвета и воду:
Эта реакция, так же, как и реакция «серебряного зеркала», используется для обнаружения альдегидов.
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Отдельные представители альдегидов и их значение
Формальдегид (метаналь, муравьиный альдегид $HCHO$) — бесцветный газ с резким запахом и температурой кипения $–21С°$, хорошо растворим в воде. Формальдегид ядовит! Раствор формальдегида в воде ($40%$) называют формалином и применяют для дезинфекции. В сельском хозяйстве формалин используют для протравливания семян, в кожевенной промышленности — для обработки кож. Формальдегид используют для получения уротропина — лекарственного вещества. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида расходуется при получении фенолформальдегидных смол и некоторых других веществ.
Уксусный альдегид (этаналь, ацетальдегид $CH_3CHO$) — жидкость с резким неприятным запахом и температурой кипения $21°С$, хорошо растворим в воде. Из уксусного альдегида в промышленных масштабах получают уксусную кислоту и ряд других веществ, он используется для производства различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!
| Формальдегид | |
|---|---|
 |
|
| Общие | |
| Другие названия | Муравьиный альдегид Метаналь |
| Молекулярная формула | CH2O |
| Молярная масса | 30,03 г/моль |
| Вид | газ с острым запахом |
| Свойства | |
| Плотность | 0,9151 г/см³ (при −80 °C) |
| Растворимость в воде | до 37% |
| Температура плавления | −92 °C |
| Температура кипения | −19,2 °C (в др. источниках, −19,3 °C) |
| Опасность | |
| Описание | Обладает токсичными, канцерогенными свойствами Оказывает сильное влияние на ЦНС Опасен для окружающей среды |
| Категория взрывоопасности | II B |
| Группа взрывоопасности | Т2 |
| Концентрационные пределы воспламенения | 7-73% об. |
| Температура самовоспламенения | 435 °C |
| Термодинамические свойства | |
| Ст. энтальпия образования ΔH | −115,9 кДж/моль (г) |
| Ст. энергия Гиббса образования ΔG | −110 кДж/моль (г) |
| Ст. энтропия образования S | 218,66 Дж/моль·K (г) |
| Ст. мольная теплоёмкость Cp | 35,35 Дж/моль·K (г) |
| Энтальпия кипения ΔHкип | 23,3 кДж/моль |
| Если не указано другое, параметры даны для 25 °C, 100 кПа |
Формальдегид (от лат. formica — муравей), рекомендуемое международное название метаналь, устаревшее — муравьиный альдегид (CH2=O) — газообразное бесцветное вещество с острым запахом, первый член гомологического ряда алифатических альдегидов.
Содержание
- 1 Токсические свойства
- 1.1 Канцерогенность
- 2 Получение
- 3 Применение
- 4 Примечания
- 5 См. также
- 6 Ссылки
Токсические свойства
Обладает токсичностью, негативно воздействует на генетический материал, репродуктивные органы, дыхательные пути, глаза, кожный покров. Оказывает сильное действие на центральную нервную систему.
Предельно допустимая концентрация (ПДК) формальдегида в воздухе:
- ПДКм.р. = 0,5 мг/м³
- ПДКс.с. = 0,003 мг/м³
Смертельная доза 35 % водного раствора формальдегида (формалина) составляет 10 — 50 г.
Канцерогенность
Формальдегид внесен в список канцерогенных веществ[1][2][3].
Получение
Основной способ получения формальдегида — окисление метанола:
2CH3OH + O2 → 2HCHO + 2H2O
Окисление метанола в формальдегид проводится с использованием серебряного катализатора при температуре 650 °C и атмосферном давлении. Это хорошо освоенный технологический процесс, и 80 % формальдегида получается именно по этому методу. Недавно разработан более перспективный способ, основанный на использовании железо-молибденовых катализаторов. При этом реакция проводится при 300 °C. В обоих процессах степень превращения составляет 99 %.
Процесс дегидрирования метанола, осуществленный на цинк-медных катализаторах при 600 °C, пока не получил широкого развития, однако он является очень перспективным, поскольку позволяет получать формальдегид, не содержащий воды.
Существует также промышленный способ получения формальдегида окислением метана:
CH4 + O2 → HCHO + H2O
Процесс проводят при температуре 450 °C и давлении 1—2 МПа, в качестве катализатора применяется фосфат алюминия AlPO4
Применение
Водный раствор формальдегида — формалин — свёртывает белки, поэтому он применяется для дубления желатина при производстве кинофотоплёнки, для консервации биологических материалов (создание анатомических и других биомоделей), а также как антисептик.
Формальдегид широко применяется при изготовлении пластмасс (таких, как фенопласт и аминопласты), искусственных волокон, из него получают пентаэритрит (сырьё для производства взрывчатых веществ и пластификаторов), триметилопропан. Основная часть формальдегида идет на изготовление древесностружечных материалов, где он используется для получения карбамидной смолы.
Также формальдегид широко используется в качестве консерванта в различных вакцинах, вводимых человеку, последствия чего до сих пор не изучены.
Примечания
- ↑ «Перечень веществ, продуктов, производственных процессов, бытовых и природных факторов, канцерогенных для человека», Приложение 2 к нормативам ГН 1.1.725-98 от 23 декабря 1998 г. N 32]
- ↑ Этот же перечень, Лаборатория аналитической экотоксикологии института проблем экологии и эволюции им. А.Н. Северцова РАН
- ↑ Территориальное управление Роспотребнадзора по Тульской области
См. также
- Formaldehyde(en)
- Канцероген
- ПДК
Ссылки
- [1]
- [2]
- [3]
|
Альдегиды |
|---|
| Формальдегид · Ацетальдегид · Пропаналь · Бутаналь · Акролеин · Кротоновый альдегид · Бензальдегид · Салициловый альдегид · Фурфурол |
Wikimedia Foundation.
2010.
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
Строение, изомерия и гомологический ряд альдегидов и кетонов
Химические свойства альдегидов и кетонов
Способы получения альдегидов и кетонов
Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода.
Структурная формула альдегидов:
Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами.
Структурная формула кетонов:
Строение карбонильных соединений
Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три σ-связи и одну π-связь.
Одна из σ–связей – связь С–О, все три σ–связи расположены в одной плоскости под углом 120о друг к другу.
π-Связь образована р-электронами атомов углерода и кислорода.
Из-за большей электроотрицательности атома кислорода по сравнению с атомом углерода связь С=О сильно поляризована, электронная плотность смещена к более электроотрицательному атому кислорода.
На атоме кислорода возникает частичный отрицательный (δ–), а на атоме углерода – частичный положительный (δ+) заряды.
Номенклатура карбонильных соединений
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-АЛЬ».
Нумерация ведется от атома углерода карбонильной группы.
Например, 2-метилпропаналь
- К названию кетонов добавляют в название суффикс «-ОН». После этого добавляют номер атомов углерода карбонильной группы.
- Тривиальные названия альдегидов и кетонов приведены в таблице.
Изомерия карбонильных соединений
Изомерия альдегидов
Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н8О соответствуют два альдегида-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Альдегиды являются межклассовыми изомерами с кетонами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для альдегидов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют кетоны-изомеры углеродного скелета
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют два кетона-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Физические свойства альдегидов и кетонов
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
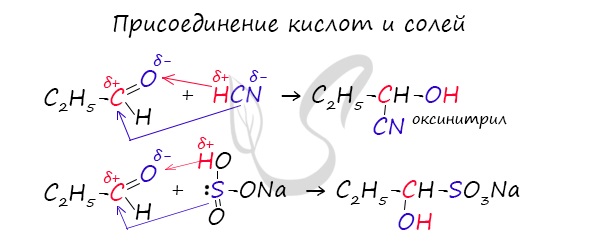
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Альдегид → карбоновая кислота
Формальдегид→ муравьиная кислота→ углекислый газ
вторичные спирты → кетоны
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
Видеоопыт окисления муравьиного альдегида гидроксидом меди (II) можно посмотреть здесь.
Например, муравьиный альдегид окисляется гидроксидом меди (II)
HCHO + Cu(OH)2 = Cu + HCOOH + H2O
Чаще в этой реакции образуется оксид меди (I):
HCHO + 2Cu(OH)2 = Cu2O + HCOOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония
Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота
Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2nО + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания метаналя:
CH2O + O2 = CO2 + H2O
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя
Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:
Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
Получение карбонильных соединений
1. Окисление спиртов
При окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов – кетоны.
1.1. Окисление спиртов оксидом меди (II)
Например, при окислении этанола оксидом меди образуется уксусный альдегид
Например, при окислении изопропанола оксидом меди образуется ацетон
1.2. Окисление спиртов кислородом на меди
При пропускании паров спирта с кислородом над медной сеткой образуются альдегиды и кетоны.
Например, при окислении пропанола-1 кислородом в присутствии меди образуется пропаналь
В промышленности формальдегид получают окислением метанола на серебряном катализаторе при температуре 650оС и атмосферном давлении:
1.3. Окисление спиртов сильными окислителями
Вторичные спирты при этом окисляются до кетонов. Первичные спирты можно окислить до альдегидов, если предотвратить дальнейшее окисление альдегида (например, отгонять образующийся альдегид в ходе реакции).
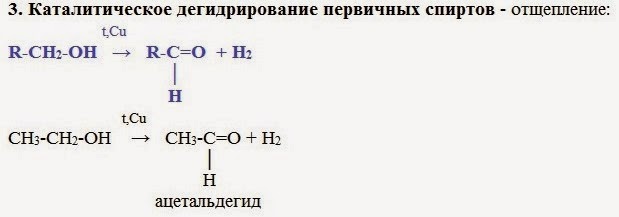
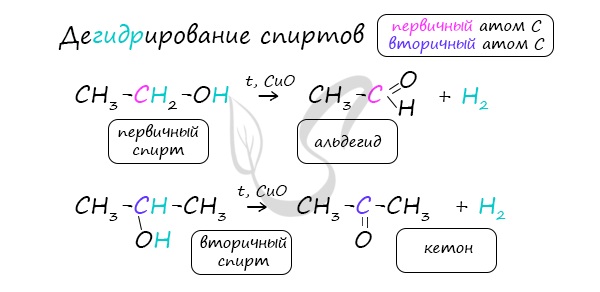
2. Дегидрирование спиртов
При пропускании спирта над медной сеткой при нагревании образуются карбонильные соединения.
Например, при дегидрировании этанола образуется этаналь
3. Гидратация алкинов
Присоединение воды к алкинам в присутствии солей ртути (II) приводит к образованию карбонильных соединений.
Например, при гидратации ацетилена образуется уксусный альдегид
Например: при гидратации пропина образуется ацетон
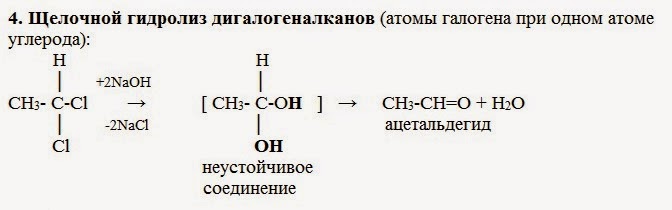
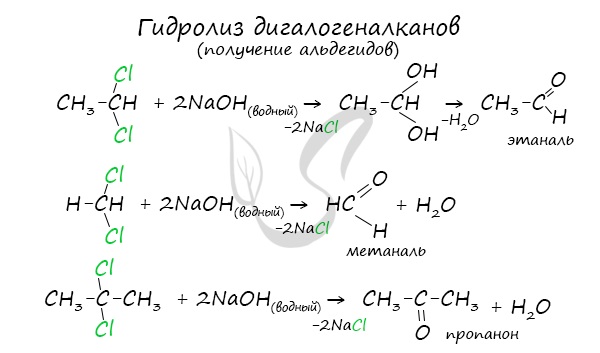
4. Гидролиз дигалогенпроизводных алканов
Под действием водного раствора щелочи образуется неустойчивый диол с двумя ОН-группами при одном атоме С, он теряет воду, превращаясь в альдегид или кетон.
Например: при гидролизе 1,1-дихлорэтана образуется этаналь
5. Пиролиз солей карбоновых кислот
При нагревании солей карбоновых кислот и двухвалентных металлов образуются неорганические соли (карбонаты) и кетоны.
Например: при пиролизе ацетата кальция образуется ацетон и карбонат кальция:
6. Кумольный способ получения ацетона
Ацетон в промышленности получают каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
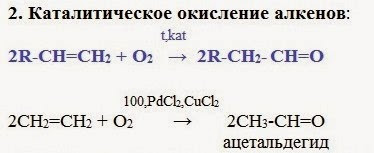
7. Каталитическое окисление алкенов
При окислении этилена кислородом в присутствии катализаторов образуется уксусный альдегид.
Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа
в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных.
Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь,
этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь —
CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином
называется 40% раствор формальдегида.
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
- Окисление спиртов
- Пиролиз солей карбоновых кислот
- Каталитическое дегидрирование спиртов
- Реакция Кучерова
- Гидролиз дигалогеналканов
- Окисление метана
- Кумольный способ получения ацетона (и фенола)
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны.
Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или
бариевых солей карбоновых кислот возможно получение кетонов.

В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по
атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в
соответствующие кетоны.

Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы
и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.

В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.

Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
- Реакции присоединения
- Окисление альдегидов
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный
элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме
углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить
при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе.
Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
2CH3CHO + 5O2 → 4CO2 + 4H2O
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции
серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая
распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты.

Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для
альдегидов, в результате образуется кирпично-красный осадок оксида меди I.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Формальдегид – это простейший представитель альдегидов. Наверняка абсолютно все хоть раз слышали об этом веществе: оно пользуется огромной популярностью в самых разных сферах – начиная производством продуктов питания, присутствующих в рационе каждого человека, и заканчивая изготовлением мебели. И, наверное, все слышали, что влияние на организм человека весьма негативное.
В составе продуктов питания формальдегид можно распознать под кодовым значением Е240. В народе его называют муравьиным альдегидом или альдегидом муравьиной кислоты.
Наиболее привычная форма для вещества – газ. Он легко растворяется в разного рода жидкостях, благодаря чему его активно применяют в промышленности: например, без водного раствора формальдегида не обойтись в работе со спрессованной древесиной – именно поэтому часто можно слышать о том, что от мебели исходит запах формальдегида. Впрочем, пахнут новые шкафы и стулья не только им – любую деревянную мебель сопровождает целый букет запахов.
Молекулы формальдегида
Формальдегид также активно задействуют в производстве изделий из пластика, в изготовлении смол, лакокрасочных изделий, текстиля, кожных изделий и бытовой химии. В производстве косметики Е240 используют как сильный консервант – он отвечает за продолжительность хранения уходовой и декоративной косметики.
Чистый формальдегид имеет насыщенный специфический запах. Никакого цвета газ не имеет – определить его присутствие можно только при помощи обоняния.
Е240 в производстве продуктов питания применяют редко из-за достаточно высокого показателя канцерогенности.
Содержание
- Что такое формальдегид: узнаем больше о веществе
- История применения формальдегида
- Формула формальдегида и его свойства
- Физические свойства
- Химические свойства
- Получение формальдегида
- Реакции с формальдегидом
- Влияние формальдегида на организм человека
- Влияние формальдегида на взрослых
- Влияние формальдегида на детей
- Вред формальдегида и симптомы отравления
- Симптомы отравления формальдегидом
- Помощь при отравлении
- Сферы применения формальдегида
- Формальдегид в пищевой промышленности
- Формальдегид в биологии
- Формальдегид в медицине
- Формальдегид в промышленности
- Формальдегид в природе
- Нормы выделения формальдегида
- Ответы на самые распространенные вопросы о формальдегиде
- Где мы сталкиваемся с формальдегидом в повседневной жизни и в быту?
- Как долго формальдегид выделяется из мебели?
- Как проверить мебель на выделение формальдегида?
- Как определить содержание формальдегида в помещении?
- Как снизить содержание формальдегида в помещении?
- Особенности хранения формальдегида
- Где можно приобрести формальдегид и сколько он стоит
- Заключение
Что такое формальдегид: узнаем больше о веществе
Формальдегид – это бесцветный газ с резким запахом, прекрасно растворяющийся в воде и спиртовой среде. Влияние на организм человека до конца не изучено, однако с уверенностью можно отнести его к категории ядов. Эффект от употребления формальдегида аналогичен эффекту от употребления мышьяка: наибольший вред испытывают органы дыхания, мозг, слизистая глаз и носа. Основными симптомами интоксикации считаются:
- сильная диарея;
- острая боль в области желудка;
- тошнота и рвота;
- обезвоживание.
При слишком сильном отравлении возможны паралич, судороги, потеря слуха и даже кома.
Основным сырьем для производства формальдегида служит метанол. Окисление осуществляется в присутствии серебряного катализатора, для протекания реакции необходима температура не ниже 650 градусов.
Формальдегид способен самостоятельно вырабатываться как в организме человека, так и в организме животного. Он крайне важен для исправной выработки незаменимых аминокислот, а также строительства белков. В естественном виде формальдегид содержится также в некоторых фруктах, в частности – яблоках и грушах.
Формальдегид (формалин)
Раньше формальдегид применялся преимущественно в фармацевтической промышленности и медицинских лабораториях. В наши дни встретить его можно и во многих других отраслях.
История применения формальдегида
Впервые работы с формальдегидом начались в середине 19 столетия. Открыл соединение миру российский ученый Бутлеров в 1859 году.
Благодаря способности ускорять денатурации белков еще в 19 веке формальдегид применялся в кожевенном производстве – там он выполнял роль дубителя. С началом развития киноиндустрии рассматриваемое вещество нашло свое место в изготовлении кино- и фотопленки.
Коме того, формальдегид с самого своего открытия стал широко применяться в медицине и производстве лекарственных препаратов – он является мощным антисептиком, поэтому медики задействовали его во время проведения хирургических манипуляций, а также для консервации биологических материалов. Высококонцентрированные растворы использовали для прижигания свежих ран.
Формула формальдегида и его свойства
Химическая формула формальдегида: CH2O.
Физические свойства
Визуально формальдегид представляет собой бесцветный газ с характерным запахом. Даже в низких концентрациях вещество способно вызывать раздражение органов зрения и органов дыхания. Активность формальдегида снижается при понижении температуры.
При -20˚С вещество переходит в жидкое состояние, а при понижении температуры до 118 градусов и вовсе превращается в белый гель. Жидкий и гелеобразный формальдегида легко полимеризуются при температуре 80 градусов, однако при превышении этой отметки не изменяют свою структуру.
- Молярная масса формальдегида: 30 г/моль.
- Температура плавления: -118 градусов.
- Температура кипения: -19 градусов.
Химические свойства
Наиболее активно рассматриваемое вещество реагирует со слабыми нуклеофилами. Оно также с легкостью вступает во все реакции, характерные для алифатических альдегидов. Формальдегид не способен вступать в реакцию с простыми эфирами.
Качественной реакцией формальдегида считается его взаимодействие с хромотроповой кислотой, а также с резорцином и фуксинсернистой кислотой.
Формальдегид способен конденсироваться с фенолами, карбамидом и различными белковыми соединениями.
В нормальных условиях формальдегид плохо растворяется в диэтиловом и этиловом спирте, хлороформе, ацетоне и бензоле.
Получение формальдегида
Как уже было сказано выше, впервые формальдегид был получен в 1859 году Бутлеровым, спустя 8 лет производством вещества занялся Гофман, а в 1882 году точную методику выделения вещества описал Кекуле.
Производство формальдегида приобрело промышленные масштабы благодаря немецкой фирме Mercklin und Lösekann в 1889 году. А в 1910 году уже друга крупная компания начала синтезировать рассматриваемое соединение с применением серебряного катализатора.
Молекула формальдегида
Основным методом получения формальдегида считается окисление метанола. Реакция проводится в присутствии серебряного катализатора. Формула реакции выглядит следующим образом:
2СН3ОН + О2 → 2НСНО + 2Н2О
В процессе соединения компонентов крайне важно поддерживать температуру на отметке 650 градусов и внимательно следить за показателем атмосферного давления. Данная методика изучена и освоена в совершенстве – благодаря ей у специалистов есть возможность получать качественный чистый формальдегид. Более 80% вещества в мире производят именно таким образом. При замене серебряного катализатора другим требуется изменение температуры, при которой протекает реакция. Так, в случае с железно-молибденовым катализатором необходимо поддержание температуры на отметке 300 градусов.
Вторым по популярности считается способ получения формальдегида посредством дегидрирования метана (в процессе осуществляется отщепление водорода от органического соединения):
CH4+O2 → HCHO+H2O
Данная методика предполагает использование цинк-медных катализаторов и поддержание температуры на отметке 600 градусов. В результате можно получить чистые формальдегид, полностью избавленный от воды.
Кроме того, в лабораторных условиях можно получить формальдегид методом разложения формиата цинка и методом деполимеризации параформа.
Реакции с формальдегидом
Формальдегид, как и прочие альдегиды, принимает активное участие в реакциях нуклеофильного присоединения. В процессе присоединения к веществу спиртов происходит образование ацеталей.
При смешивании формальдегида с ацетиленом получают бутадиен. Для правильного протекания реакции крайне важно присутствие углеводов, в частности – гексозы.
При попадании в водные растворы формальдегид присоединяет к себе молекулу воды, становится неустойчивым соединением.
Гидрирование:
RCOH + H2 → RCH2OH
Присоединение фенола:
CH2OH + 4Cu(OH)2 → CO2 + 2Cu2O + 5h3O
Реакция окисления формальдегида:
5CH2O + 4KMnO4 + 6H2SO4 → 4MnSO4 + 2K2SO4 + 5CO2 + 11H2O
При окислении формальдегида в присутствии перманганатом или соединений хрома альдегиды окисляются до карбоновых кислот.
В процессе горения формальдегида образуются оксид углерода и обычная вода и выделяется небольшое количество тепла.
CnH2nО + 3n/2O2 → nCO2 + nH2O + Q
Влияние формальдегида на организм человека
В первую очередь необходимо дать четкий ответ на вопрос, опасен ли формальдегид и какое влияние на организм человека он оказывает. Так, в России данное вещество принадлежит ко второму (из пяти существующих) классу опасности – то есть, веществам с высокой степенью опасности. Действие соединений, принадлежащих ко второму классу, мало чем отличается от действия соединений первого класса опасности. Они также нарушают целостность кожного покрова и даже вызывают некроз тканей, причем чем выше концентрация – тем серьезнее последствия. При попадании в воду формальдегид вызывает постепенное отравление обитателей подводного мира.
Степень опасности конкретной разновидности формальдегида зависит от следующих показателей:
- степени эмиссии (испускания рассматриваемого соединения из того или иного объекта) – чем больше площадь объекта и чем больше формальдегида в нем содержится – тем серьезнее будут последствия;
- время воздействия вещества – чем дольше вы контактируете с предметом, пропитанным формальдегидом – тем серьезнее будут последствия.
Формальдегид, содержащийся в воздухе в свободном состоянии, может быть опасен для кожных покровов и слизистых оболочек. При особенно высоких концентрациях данное соединение способно провоцировать появление сыпи, зуда и раздражения. При вдыхании формальдегида возможно возникновение головных болей.
Однако, не все так плохо. Формальдегид начали применять в производстве лекарственных препаратов и пищевой промышленности еще в 20 столетии. Так, встретить данное соединение можно в составе мазей, растворов, присыпок и вакцин. Добавка препятствует развитию патогенной микрофлоры и продлевает срок годности лекарственных препаратов. Отсюда следует, что в небольших количествах вещество не так опасно, как кажется на первый взгляд.
Влияние формальдегида на взрослых
По данным Всемирной Организации Здравоохранения использования формальдегида в производстве продуктов питания небезопасно, более того – специалисты не рекомендуют не только вводить соединение в состав пищи, но и держать его рядом с продуктами питания. Формальдегид может спровоцировать острое отравление, раздражение слизистых оболочек. Кроме того, стоит отметить негативное воздействие рассматриваемого соединения на состав крови. Строго не рекомендуется употреблять формальдегид людям с повышенным риском образования злокачественных новообразований.
Смертельной дозой для взрослого человека считается полная чайная ложка формальдегида.
Влияние формальдегида на детей
Формальдегид, как уже было сказано выше, крайне опасен для взрослых и еще более опасен для детей и беременных женщин. Влияние на организм крайне негативное. Избегать добавки стоит также людям с аллергией, астмой и другими заболеваниями дыхательных путей.
Если взрослые люди с хорошим здоровьем могут ощутить негативное воздействие формальдегида только при употреблении его в пищу или при работе с большими объемами вещества, то дети подвержены отрицательному влиянию соединения и в других формах. Так, например, опасность для малышей представляет мебель, в обработке которой применялся формальдегид.
Многие специалисты связывают появление астмы у детей с вдыханием паров формальдегида.
Вред формальдегида и симптомы отравления
Наиболее широко формальдегид применяется в производстве мебели и строительстве. Люди, регулярно взаимодействующие с рассматриваемым соединением, особенно подвержены отрицательному воздействию паров. Одноразовое вдыхание формальдегида, в целом, безопасно, а вот при продолжительном взаимодействии с данным веществом могут дать о себе знать неприятные симптомы, сигнализирующие об отравлении организма.
Формальдегид представляет собой крайне опасный для здоровья газ, который может спровоцировать появление следующих проблем со здоровьем:
- почечная недостаточность;
- нарушение целостности слизистой оболочки желудка;
- отмирание тканей ЖКТ.
При регулярном вдыхании формальдегида могут проявиться следующие заболевания:
- бронхит;
- астма;
- обструкция легких.
При попадании формальдегида на кожу может появляться сыпь, наблюдаться расслоение ногтевых пластин и жжение.
Стоит отметить, что особенностью формальдегида считается следующее: чем чаще и дольше вы вдыхаете пары этого соединения, тем выше восприимчивость организма к нему.
Специалисты рекомендуют избегать работы с формальдегидом людям, страдающим от хронических заболеваний органов дыхательной системы. Наибольший вред от данного соединения испытывают работники, занятые в следующих отраслях:
- химическое производство;
- целлюлозное производство;
- изготовление мебели;
- производство пищевых добавок;
- работа с тканями;
- медицина (без формальдегида сложно представить работу патологоанатома).
При частой работе с формальдегидом велик риск появления злокачественных новообразований.
Симптомы отравления формальдегидом
Симптомы отравления формальдегидом проявляются не сразу – им нужно время. Так, ухудшение самочувствия человек начинает испытывать спустя 12 часов с момента отравления. Если до этого момента не предпринять определенные мероприятия по предупреждению возникновения негативных последствий, человек может ощутить следующие симптомы:
- головные боли;
- изменение цвета кожного покрова – он становится бледным, сереет;
- снижение трудоспособности, вялость, потеря интереса к окружающему миру;
- слабость, потеря веса;
- нарушение сна;
- нарушение работы органов дыхательной системы;
- появление бронхиальной астмы.
Помощь при отравлении
В случае острого отравления парами формальдегида необходимо предпринять следующие действия:
- вызвать скорую помощь;
- обеспечить доступ свежего воздуха;
- дать подышать человеку нашатырным спиртом;
- дать пострадавшему активированный уголь из расчета 1 таблетка на 10 килограммов веса;
- если человека не тошнит, можно предложить ему выпить коровьего молока;
- при тошноте вместо молока необходимо предложить больному воду;
- промыть места поражения чистой водой.
Дабы избежать отравления при работе с формальдегидом необходимо использовать средства индивидуальной защиты.
Сферы применения формальдегида
Формальдегид обладает высокой химической активностью. Наиболее широкое распространение вещество получило в науке и промышленности.
Формальдегид в пищевой промышленности
В большинстве стран эта пищевая добавка запрещена. Однако, это не значит, что вы точно не найдете на полке магазина продукты, в состав которых входит формальдегид – некоторые производители просто не указывают Е240 в списке ингредиентов.
Так, например, обнаружить формальдегид можно в икре низкого качества, в мясных и колбасных изделиях. Впрочем, производители клянутся, что используют формальдегид в минимальных количествах, так что их продукты не способны нанести вред здоровью человека.
Формальдегид в биологии
Очень широкое распространение формальдегид получил в биологии: там его применяют для сохранения медицинских образцов. Раствор данного вещества позволяет сохранить целостность тканей и подготовить препараты. Формальдегид необходим для предотвращения жизнедеятельности патогенных микроорганизмов.
Однако, данное соединение не способно полностью предотвратить разрушение тканей – для того чтобы образцы сохранялись на протяжении долгого времени необходима дополнительная пластификация, в ходе которой ткани заменяются полимерами.
Формальдегид в медицине
В медицине рассматриваемое соединение применяется в качестве антисептика, способного устранить большую часть бактерий и белков. Кроме того, формальдегид получил большое распространение в лечении бородавок, в устранении паразитов.
Немного реже формальдегид применяют в производстве некоторых вакцин.
Добавку также вводя в средства личной гигиены – они необходимы для предотвращения роста бактерий.
Формальдегид в промышленности
Формальдегид необходим для обработки многих искусственных материалов, в частности – смол. Кроме того, он применяется для обработки изделий из пластмасс.
Вещество используют в обработке одежды – оно необходимо для того чтобы сделать ткани более устойчивыми к воздействию внешних факторов, защитить их от выгорания и вымывания краски.
Формальдегид необходим в обработке древесины и изделий из нее, поэтому часто от мебели исходит характерный запах.
Вещество используется в изготовлении лакокрасочных изделий.
Формальдегид в природе
Встретить формальдегид можно не только на крупных предприятиях – обнаружить его можно и в живой природе. Так, данное вещество является важным компонентом обмена веществ, поскольку связано с синтезом тетрагидрофолиевой кислоты в организме. Такой формальдегид не представляет опасность для здоровья и с легкостью выводится почками.
Также формальдегид содержится в воздухе. Его концентрация особенно высока в крупных промышленных городах.
Нормы выделения формальдегида
Объем формальдегида определяется классом эмиссии. Так, существуют следующие нормы:
| Класс эмиссии | Выделение формальдегида | |
| Камерный метод (ГОСТ 30255), мг/м3 | Газоаналитический метод (ГОСТ 32155), мг/м2 | |
| Е0 | ≤0,062 | ≤0,5 или <0,9 в течение 3 дней с момента производства изделия |
| Е1 | 0,062 – 0,124 | 0,5 – 3,5 или 0,9 – 5 в течение 3 дней с момента производства изделия |
| Е2 | 0,124 – 0,5 | 3,5 – 8 или 5 -12 в течение 3 дней с момента производства изделия |
Ответы на самые распространенные вопросы о формальдегиде
Где мы сталкиваемся с формальдегидом в повседневной жизни и в быту?
Формальдегид – это достаточно распространенное вещество. Наиболее часто он встречается во время ремонта: вещество входит в состав клея, некоторых отделочных материалов, данное вещество входит в состав изделий из фанеры, ламината, лакокрасочных изделий. Поэтому часто мы слышим запах формальдегида от мебели.
Формальдегид также можно обнаружить на дешевой посуде и бытовой технике, одежде из секонд-хенда и детских игрушках из недобросовестных магазинов. Рассматриваемое соединение встречается в дезинфицирующих средствах и некоторых лекарственных препаратах, в средствах для обработки выращиваемых растений.
Как долго формальдегид выделяется из мебели?
Чувствуете запах от мебели? При помощи интенсивного проветривания можно значительно ускорить процесс выветривания формальдегида из мебели. Так, избавиться от паров вещества можно за 2-3 месяца при условии регулярного проветривания помещения.
Как проверить мебель на выделение формальдегида?
При приобретении мебели необходимо обратить внимание на маркировку на ней, обозначающую присутствие формальдегида в составе. Так, мебель с пометкой Е-0 наиболее безопасна, пометка Е-1 говорит о присутствии 11 мг формальдегида на 100 граммов веса мебели, а вот от мебели с маркировкой Е-2 лучше отказаться: она свидетельствует о присутствии 35 мг формальдегида на 100 граммов изделия. Соответственно запах от мебели при маркировке Е-2 будет исходить наиболее долго.
Как определить содержание формальдегида в помещении?
Произвести замеры формальдегида в квартире самостоятельно будет достаточно проблематично – для этого вам потребуется специальный прибор. Впрочем, обращаться с ним без должной подготовки не получится, так что если вам необходима проверка уровня формальдегида в жилище, обращайтесь за помощью в Роспотребнадзор, а точнее – в Центр гигиены.
Как снизить содержание формальдегида в помещении?
Первый способ снижения содержания формальдегида – активное проветривание. Если за окном мороз и окна открывать не хочется, можно воспользоваться бризером.
Второй способ – использовать очиститель воздуха.
Особенности хранения формальдегида
Наиболее часто формальдегид транспортируют и хранят не в его привычной форме (то есть, в форме газа), а в форме жидкости. Часто для этих целей применяют стеклянную посуду: бутылки и бочки, реже – емкости из нержавеющей стали.
Хранить формальдегид рекомендуется в сухом, прохладном, хорошо вентилируемом месте, защищенном от попадания прямых солнечных лучей.
Где можно приобрести формальдегид и сколько он стоит
Лекарственные препараты, в состав которых входит формальдегид, можно приобрести в обычной аптеке, а вот чтобы достать чистое вещество придется заморочиться.
Наиболее простой способ приобретения формальдегида – это онлайн-шоппинг. Стоимость добавки различается в зависимости от формы выпуска.
10 литров раствора формальдегида обойдется вам примерно в 600 рублей.
Заключение
Формальдегид – это достаточно распространенное в разных отраслях промышленности соединение. Как правило, оно имеет газообразную форму, но в определенных условиях может приобретать форму жидкости или белого геля.
Формальдегиду характерен неприятный запах – его присутствие в воздухе определить достаточно легко. Стоит отметить, влияние на организм – оно вызывает массу негативных реакций: например, при попадании на кожу возникают сыпь и ожоги, а при продолжительном вдыхании – сильное отравление.
Наиболее часто рассматриваемое вещество применяют в производстве мебели, красок и лаков, вводят в состав лекарственных препаратов и используют для изготовления медицинских препаратов. В пищевой промышленности формальдегид использовать запрещено, но недобросовестные производители пренебрегают этими запретами.
Читайте также:
- Бензоат натрия (Е211): применение, вред и польза, инструкция, описание
- Нитрит натрия (Е250): что это, свойства, вредно или нет, использование
- Глутамат натрия: вред и польза, что это такое мифы о добавке Е621
- Сульфит натрия: описание, вред и польза, формула, получение, реакции
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…