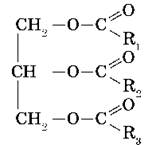
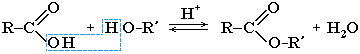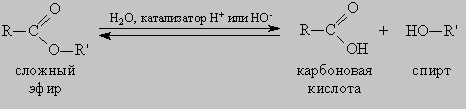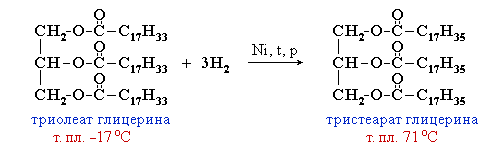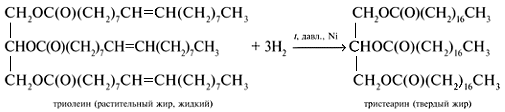Жиры — органические соединения, по строению являющиеся сложными эфирами трехатомного спирта глицерина и высших карбоновых (жирных)
кислот.
К жирным кислотам (их формулы лучше выучить 
- Пальмитиновая — C15H31COOH (предельная)
- Стеариновая — C17H35COOH (предельная)
- Олеиновая — C17H33COOH (непредельная, 1 двойная связь в радикале)
- Линолевая — C17H31COOH (непредельная, 2 двойные связи в радикале)
- Линоленовая — C17H29COOH (непредельная, 3 двойные связи в радикале)
Растительные и животные жиры
Жиры образуются в организме растений и животных, служат запасным питательным веществом. В строении растительных и животных жиров
есть некоторые важные отличия.
Заметьте, что растительные жиры чаще жидкие и в них входят преимущественно остатки непредельных жирных кислот, а животные жиры — твердые и
содержат остатки предельных жирных кислот.

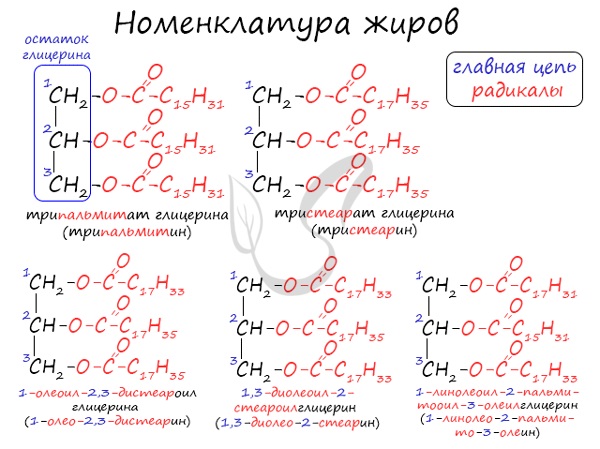
Номенклатура жиров
По систематической номенклатуре жиры принято называть триацилглицеринами. Названия жирам дают в зависимости от ацилов — остатков жирных
кислот, входящих в их состав. Для формирования единого названия к остаткам кислот добавляют суффикс «оил».
В соответствии с тривиальной номенклатурой, жиры называют, добавляя окончание «ин» к названию кислоты и приставку, указывая, сколько гидроксогрупп
в молекуле глицерина подверглось этерификации. В общем лучше 1 раз увидеть, чем 100 раз услышать 
Получение жиров
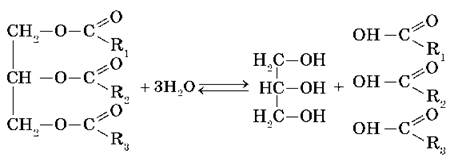
Жиры (по строению сложные эфиры) получаются в реакции этерификации, протекающей между трехатомным спиртом глицерином и высшими карбоновыми
(жирными) кислотами.
В зависимости от того, какие именно кислоты участвуют в реакции, образуются различные жиры.

Химические свойства жиров
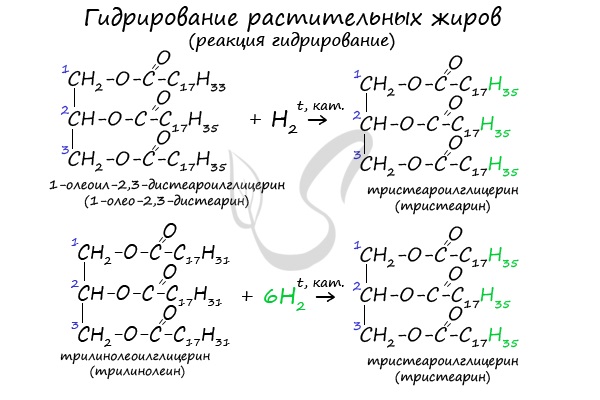
- Гидрирование растительных жиров
- Гидролиз
В состав растительных жиров входят непредельные кислоты, которые поддаются гидрированию и превращаются в предельные. Таким путем в пищевой
промышленности получают маргарин.
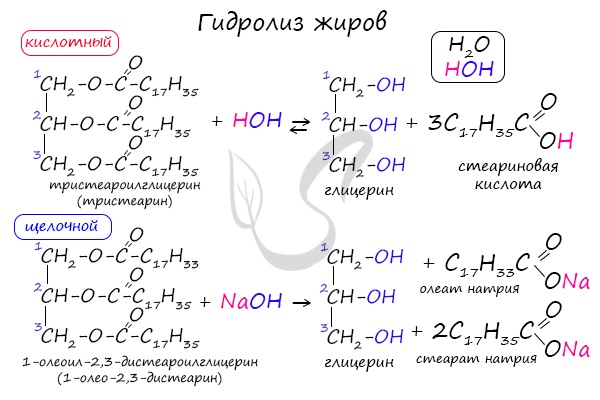
Как сложные эфиры, жиры способны вступать в реакцию гидролиза, который может быть кислотным и щелочным. В результате кислотного гидролиза
образуется глицерин и исходные жирные кислоты, в результате щелочного гидролиза — глицерин и соли жирных кислот.
Реакция щелочного гидролиза жиров называется реакцией омыления, в результате получаются соли жирных кислот — мыла. Кислотный гидролиз протекает
обратимо, щелочной — необратимо.
В состав твердого мыла входят соли Na, в состав жидкого — K.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Жиры – это сложные эфиры, образованные глицерином и высшими одноосновными карбоновыми кислотами (жирными кислотами).
.
Жиры образуются при взаимодействии глицерина и высших карбоновых кислот:
| Жирные (высшие) кислоты | |
| Предельные кислоты | Непредельные кислоты |
| Масляная кислота С3Н7 -СООН | Олеиновая кислота С17Н33СООН
(содержит одну двойную связь в радикале) СН3—(СН2)7—СН = СН—(СН2)7—СООН |
| Пальмитиновая кислота С15Н31 — СООН | Линолевая кислота С17Н31СООН
(две двойные связи в радикале) |
| Стеариновая кислота С17Н35 — СООН | Линоленовая кислота С17Н29СООН
(три двойные связи в радикале) СН3СН2СН=CHCH2CH=CHCH2CH=СН(СН2)4СООН |
Номенклатура жиров
Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:
Физические свойства жиров
Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой.
Все животные жиры, кроме рыбьего – твёрдые. |
Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими.
Все растительные жиры, кроме пальмового масла – жидкие. |
Химические свойства жиров
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
1.1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин
1.2. Щелочной гидролиз — омыление жиров
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия.
2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина:
Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира.
3. Мыло и синтетические моющие средства
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
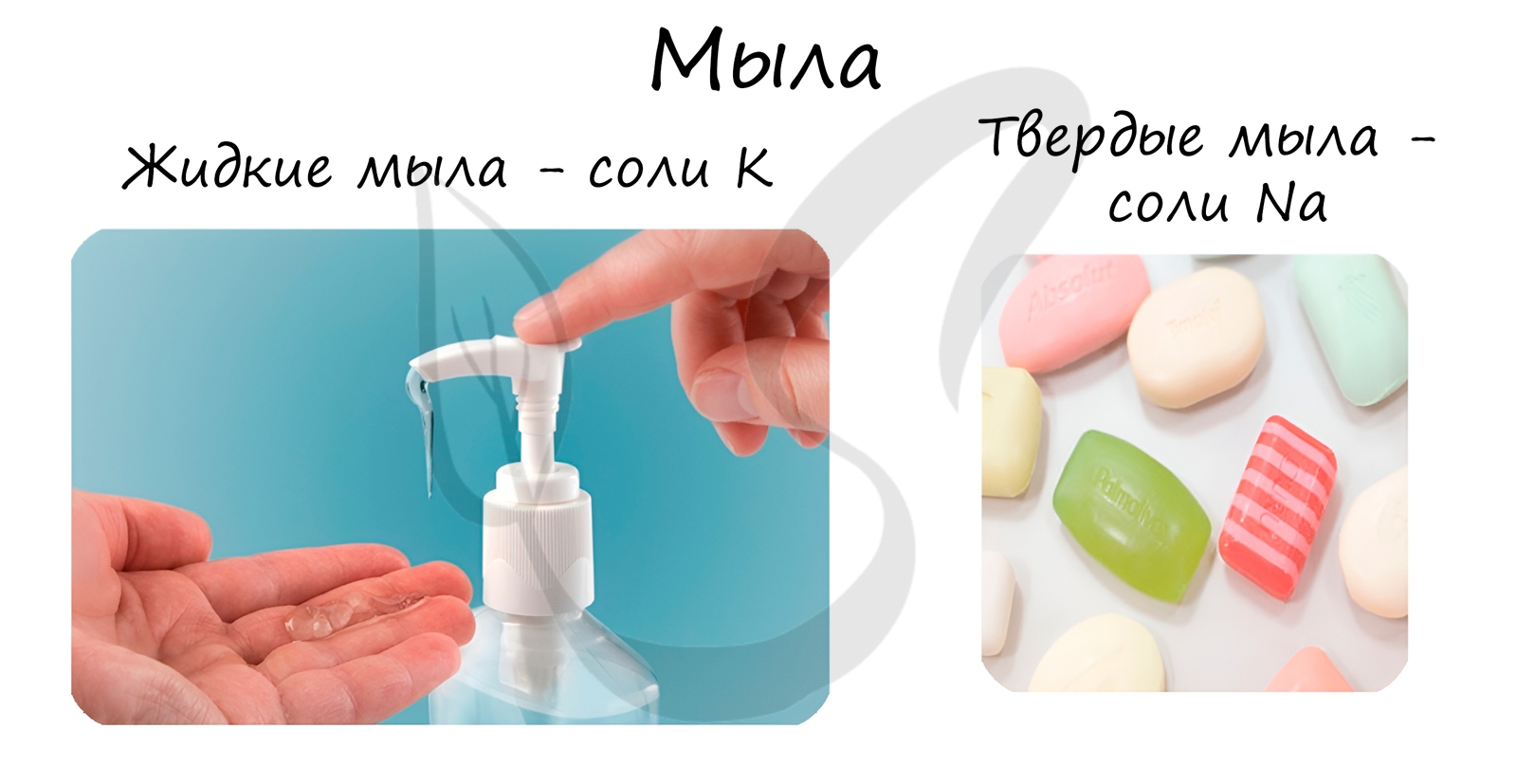
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca2+ и Mg2+ образуют с высшими кислотами нерастворимые в воде соли.
Например, стеарат глицерина взаимодействует с сульфатом кальция
Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата.
Далее алкилсульфат гидролизуется щелочью:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
…
С химической точки зрения мыла представляют собой соли высших жирных (C8–C18), нафтеновых или смоляных кислот.
В бытовом смысле — это технические продукты, обладающие моющим действием.
Классификация мыла
Существует несколько классификаций мыл.
По растворимости мыла делят на:
- Растворимые щелочные мыла — калиевые, натриевые, аммониевые соли жирных кислот. В зависимости от природы катиона мыла растворимость в воде увеличивается в ряду: Li+ — Na+ — K+ — NH4+
- нерастворимые металлические мыла — соли поливалентных металлов (Ca, Mg, Ni, Mn, Al, Co, Pb).
По консистенции:
- Жидкие мыла – соли калия, аммония
- Твердые мыла – соли натрия, лития, поливалентных металлов
По назначению:
- хозяйственные,
- туалетные,
- технические,
- медицинские,
- специальные
По способу получения:
- клеевые,
- ядровые,
- пилированные.
Химические способы получения мыла
Производство мыла (мыловарение) довольно длительный и сложный процесс, состоящий из нескольких стадий.
Если рассматривать только химические реакции, лежащие в основе получения мыла, то как уже было рассмотрено мыла можно получить при щелочном гидролизе жиров, при этом образуются глицерин и соли высших карбоновых кислот – мыла. Кроме этого мыла получаются при нейтрализации высших карбоновых кислот гидроксидом натрия или калия или углекислым натрием:
- Омыление триглицеридов гидроксидами натрия или калия
- Нейтрализация высших карбоновых кислот гидроксидом натрия (каустической содой) или гидроксидом калия
Твердые мыла получают при растворении высших карбоновых кислот в водном растворе гидроксида натрия, жидкие мыла — при растворении высших карбоновых кислот в водном растворе гидроксида калия.
- Нейтрализация высших карбоновых кислот углекислым натрием (кальцинированной содой):
Промышленное получение мыла (варка мыла)
Для производства мыла в промышленности используют как синтетические жирные (высшие) кислоты, так и животные жиры, растительные масла, канифоль.
Для получения хозяйственных мыл применяют саломас с температурой плавления 46–60°С, для туалетного мыла — с температурой плавления 39–43°С.
Салома́с — это твёрдый жир, получаемый в промышленности путём гидрогенизации жидких жиров, в основном растительных масел.
Все жиры, используемые при варке мыла, не должны содержать воду и механические примеси.
Жидкие растительные масла применяют в мыловарении всех видов жидких хозяйственных и туалетных мыл. Наиболее ценным из является хлопковое масло, содержащее до 30 % насыщенных высших кислот, в основном пальмитиновой. Также используют и другие масла, такие как подсолнечное, соевое, кокосовое, пальмовое.
Введение небольших количеств жидких растительных масел в рецептуру хозяйственных мыл способствует снижению температуры их застывания.
Внесение 10–15 % канифоли увеличивает растворимость и пластичность мыла.
Основные стадии варки мыла
В промышленности мыла получают в две стадии – первая стадия химическая, вторая — механическая:
- Химическая стадия – варка мыла. Вначале проводят карбонатное омыление, при котором нейтрализуется около 70 % свободных жирных кислот. Затем проводят каустическое доомыление – нейтрализация оставшихся кислот гидроксидом натрия.
- Механическая стадия – охлаждение, сушка, шлифовка, отделка и упаковка готового продукта
Способы варки мыла
Варку мыла (химическая стадия) можно осуществить прямым и косвенным способом.
Для варки мыла прямым способом исходная жировая смесь должна быть хорошо очищена. Этим способом проводят нейтрализацию жировой смеси растворами содопродуктов и получают мыльный клей, содержащий 67–70 % жирных кислот. Далее его подвергают механической очистке — охлаждению, сушке, шлифовке, отделке. Прямой способ используется при варке хозяйственного мыла.
При варке мыла косвенным способом полученный прямым способом мыльный клей, подвергают дальнейшей обработке растворами электролитов, т.е. проводят высаливание. При этом происходит разделение мыльной массы на фазы: ядро и подмыльный щелок или ядро, подмыльный клей, подмыльный щелок. Полученное мыльное ядро в этом случае содержит 60–63 % жирных кислот. Далее полученное мыльное ядро обрабатывают подобно мылу, сваренному прямым способом. В качестве электролитов используют NaCl, NaOH. Косвенный способ применим для варки мыла из неочищенного жирового сырья. Варка мыла косвенным способом позволяет получить мыло высокой степени чистоты.
Жидкое мыло готовят из растительных масел, канифоли, таллового масли и др. прямым или косвенным способом. В качестве основания применяют соединения калия (KOH, K2CO3).
Если при варке мыла использовалось сырье из животных или растительных жиров, то после отделения ядра выделяют образующийся побочный продукт – глицерин. Глицерин широко применяют в различных отраслях производства.
Кратко схему производства мыла можно представить следующим образом:
Моющие свойства мыла
Итак, мыла – соли высших жирных кислот – состоят из аниона жирной кислоты и катиона металла (чаще всего натрия или калия).
В водных растворах щелочные мыла подвергаются гидролизу, т.к. образованы слабыми кислотами и сильными основаниями. Их растворы имеют щелочную реакцию (рН>7). В сильно разбавленных растворах мыла полностью диссоциируют на ионы:
Способность мыла пениться, отмывать загрязнения связана с образованием мицелл и высокой поверхностной активности. Водорастворимые щелочные мыла являются анионными поверхностно-активными веществами.
Углеводородный остаток жирной кислоты является гидрофобной частью мыла, кабоксильный ион – гидрофильной частью.
Этапы растворения грязи под действием мыла:
- При соприкосновении мыла с грязью, гидрофобная часть мыла окружает гидрофобное загрязняющее вещество и проникает внутрь, а поверхность загрязнения покрывается оболочкой гидрофильных групп.
- Гидрофильная часть мыла взаимодействуют с полярными молекулами воды.
- Ионы мыла «захватывают» загрязнение и отрываются от поверхности, переходя в воду.
- Плавающие частицы удерживаются в растворе до его смены.
В домашних условиях тоже можно приготовить мыло. Имея под рукой необходимые ингредиенты, самостоятельное производство мыла не составит большого труда.
Омыление
— это гидролиз сложных эфиров под действием щёлочи. При этом получается соль органической кислоты и спирт. Исторически это название пошло от процесса получения мыла — гидролиза жиров щёлоком, при котором получается смесь солей высших жирных кислот (собственно — мыло) и глицерин (трёхатомный спирт).
Соответственно
омыление
— это реакция сложного эфира со щелочью.
До изобретения мыла жир и грязь с кожи удаляли золой и мелким речным песком.Технология изготовления мыла из животных жиров складывалась на протяжении многих веков. Посмотрим, как можно приготовить мыло в химической лаборатории. Сначала составляется жировая смесь, которую расплавляют и омыляют – варят со щелочью. Для гидролиза жира в щелочной среде берется немного топленого свиного сала, около 10 мл этилового спирта и 10 мл раствора щелочи. Сюда же добавляют поваренную соль и нагревают полученную смесь. При этом образуются мыло и глицерин. Соль добавляют для осаждения глицерина и загрязнений. Также получают мыло в промышленности.
Состав мыла
Мыла – натриевые или калиевые соли высших карбоновых кислот (кислот, содержащих в своем составе более 10 атомов углерода), полученных в результате гидролиза жиров в щелочной среде (чаще всего из жиров, содержащих в составе стеариновую кислоту С
17
Н
35
СООН) — С
17
Н
35
СООNa – стеарат натрия.
Жир + щелочь = соли жирных кислот и глицерин.
Свойства мыла
Поверхностный слой дистиллированной воды находится в натянутом состоянии подобно упругой пленке. При добавлении мыла и некоторых других растворимых в воде веществ поверхностное натяжение воды уменьшается. Мыло и другие моющие вещества относят к поверхностно-активным веществам (ПАВ). Они уменьшают поверхностное натяжение воды, усиливая тем самым моющие свойства воды.
Молекулы, находящиеся на поверхности жидкости, имеют избыток потенциальной энергии и поэтому стремятся втянуться внутрь так, что при этом на поверхности остается минимальное количество молекул. За счет этого вдоль поверхности жидкости всегда действует сила, стремящаяся сократить поверхность. Это явление в физике получило название поверхностного натяжения жидкости.
Молекулы ПАВ на пограничной поверхности располагаются так, что гидрофильные группы карбоксильных анионов направлены в воду, а углеводородные гидрофобные выталкиваются из нее. В результате поверхность воды покрывается частоколом из молекул ПАВ. Такая водная поверхность имеет меньшее поверхностное натяжение, что способствует быстрому и полному смачиванию загрязненных поверхностей. Уменьшая поверхность натяжения воды, мы увеличиваем ее смачивающую способность.
Секрет очищающего действия мыла
СМС (синтетические моющие средства) – натриевые соли синтетических кислот (сульфокислот, сложных эфиров высших спиртов и серной кислоты).
Рассмотрим свойства моющих веществ и
сравним мыла и СМС (стирального порошка)
. Для начала проверим, какая среда характерна для наших моющих средств. Как мы это сделаем?
С помощью индикаторов.
Будем использовать известные нам индикаторы – лакмус и фенолфталеин. При добавлении лакмуса в раствор мыла и в раствор СМС он приобретает синий цвет, а фенолфталеин – малиновый, то есть реакция среды щелочная.
А что происходит с мылом и СМС в жесткой воде? (понятно, почему мыловары не варят мыло на водопроводной воде, а используют отвары, дистиллированную воду, молоко и тд.)
Добавим в одну пробирку раствор мыла, а в другую раствор СМС, взболтаем их. Что вы наблюдаете? В эти же пробирки добавим хлорид кальция и взболтаем содержимое пробирок. Что вы наблюдаете теперь? Раствор СМС пенится, а в растворе мыла образуются нерастворимые соли:
2С
17
Н
35
СОО
–
+ Са
2+
= Са(С
17
Н
35
СОО)
2
А СМС образуют растворимые соли кальция, которые также обладают поверхностно-активными свойствами.
Использование чрезмерного количества этих средств приводит к загрязнению окружающей среды. Послушаем сообщение об экологических последствиях использования ПАВ.
Многие ПАВ трудно поддаются биологическому разложению. Поступая со сточными водами в реки и озера, они загрязняют окружающую среду. В результате образуются целые горы пены в канализационных трубах, реках, озерах, куда попадают промышленные и бытовые стоки. Использование некоторых ПАВ приводит к гибели всех живых обитателей в воде.
Почему раствор мыла, попадая в реку или озеро, быстро разлагается, а некоторые ПАВ нет?
Дело в том, что мыла, полученные из жиров, содержат неразветвленные углеводородные цепи, которые разрушаются бактериями. В то же время в состав некоторых СМС входят алкилсульфаты или алкил(арил)сульфонаты с углеводородными цепями, имеющими разветвленное или ароматическое строение. Такие соединения бактерии «переварить» не могут. Поэтому при создании новых ПАВ необходимо учитывать не только их эффективность, но и способность к биологическому распаду – уничтожению некоторыми видами микроорганизмов.
Теория
| 1. | Состав и свойства мыла | |
| 2. | Получение и применение мыла | |
| 3. | Синтетические моющие средства (СМС) | |
| 4. | Моющее действие мыла и СМС |
Задания
| 1. |
Определи формулу мыла
Сложность: |
1 |
| 2. |
Состав мыла
Сложность: |
1 |
| 3. |
Способы получения мыла
Сложность: |
1 |
| 4. |
Верные утверждения
Сложность: |
2 |
| 5. |
Признаки реакции
Сложность: |
2 |
| 6. |
Сравнение мыла и СМС
Сложность: |
2 |
| 7. |
Формулы органических соединений
Сложность: |
3 |
| 8. |
Выход продукта реакции
Сложность: |
3 |
Экзаменационные задания (подписка)
| 1. |
Как на ЕГЭ. Характер среды водных растворов
Сложность: |
2 |
Тесты
| 1. |
Тренировка по теме Мыла. СМС
Сложность: среднее |
11 |
Материалы для учителей
| 1. | Методическое описание |
Сложные эфиры и их строение
При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры:
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
Сложные эфиры в природе и технике
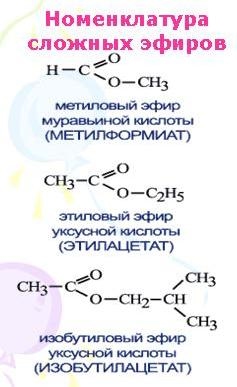
Сложные эфиры широко распространены в природе, находят применение в технике и различных отраслях промышленности. Они являются хорошими растворителями органических веществ, их плотность меньше плотности воды, и они практически не растворяются в ней. Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легко воспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов. Их применяют в качестве растворителей лаков и красок, ароматизаторов изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты — запах ананасов, изобутиловый эфир уксусной кислоты — запах бананов:
Сложные эфиры высших карбоновых кислот и высших одноосновных спиртов называют восками. Так, пчелиный воск состоит главным образом из эфира пальмитиновой кислоты и мирицилового спирта С15Н31СООС31Н63; кашалотовый воск — спермацет — сложный эфир той же пальмитиновой кислоты и цетилового спирта С15Н31СООС16Н33.
Жиры
Важнейшими представителями сложных эфиров являются жиры.
Жиры — природные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
— ЗАПОМНИ. Реакция образования сложных эфиров называется реакцией этерификации (от лат. ester — эфир).
Состав и строение жиров могут быть отражены общей формулой:
Большинство жиров образовано тремя карбоновыми кислотами: олеиновой, пальмитиновой и стеариновой. Очевидно, что две из них — предельные (насыщенные), а олеиновая кислота содержит двойную связь между атомами углерода в молекуле. Таким образом, в состав жиров могут входить остатки как предельных, так и непредельных карбоновых кислот в различных сочетаниях.
В обычных условиях жиры, содержащие в своем составе остатки непредельных кислот, чаще всего бывают жидкими. Их называют маслами. В основном это жиры растительного происхождения — льняное, конопляное, подсолнечное и другие масла. Реже встречаются жидкие жиры животного происхождения, например рыбий жир. Большинство природных жиров животного происхождения при обычных условиях — твердые (легкоплавкие) вещества и содержат в основном остатки предельных карбоновых кислот, например, бараний жир. Так, пальмовое масло — твердый в обычных условиях жир.
Состав жиров определяет их физические и химические свойства. Понятно, что для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция — гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина — твердого жира из растительных масел. Условно этот процесс можно описать уравнением реакции:
Все жиры, как и другие сложные эфиры, подвергаются гидролизу:
Мыла
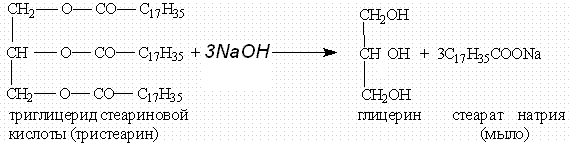
Все жиры, как и другие сложные эфиры, подвергаются гидролизу. Гидролиз сложных эфиров — обратимая реакция. Чтобы сместить равновесие в сторону образования продуктов гидролиза, его проводят в щелочной среде (в присутствии щелочей или Na2CO3). В этих условиях гидролиз жиров протекает необратимо и приводит к образованию солей карбоновых кислот, которые называются мылами. Гидролиз жиров в щелочной среде называют омылением жиров.
При омылении жиров образуются глицерин и мыла — натриевые или калиевые соли высших карбоновых кислот:
Чтобы поделиться, нажимайте
Сложные эфиры – функциональные производные карбоновых кислот,
в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR)
Сложные эфиры карбоновых кислот – соединения с общей формулой
R–COOR’, где R и R’ – углеводородные радикалы.
Физические свойства:
- · Летучие, бесцветные жидкости
- · Плохо растворимы в воде
- · Чаще с приятным запахом
- · Легче воды
Сложные эфиры содержатся в цветах, фруктах, ягодах. Они определяют их специфический запах.
Являются составной частью эфирных масел (известно около 3000 эф.м. – апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
Краткие названия сложных эфиров строятся по названию радикала (R’) в остатке спирта и названию группы RCOO— в остатке кислоты. Например, этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.
Применение
· В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
· В производстве пластмасс, резины в качестве пластификаторов.
Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.
Применение в медицине
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
RCOOR’ + H2O (H+)↔ RCOOH + R’OH
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
Жиры
Жиры — сложные эфиры глицерина и высших одноатомных карбоновых кислот .
Общее название таких соединений — триглицериды или триацилглицерины, где ацил — остаток карбоновой кислоты -C(O)R.
В состав природных триглицеридов входят остатки насыщенных кислот (пальмитиновой C15H31COOH, стеариновой C17H35COOH) и ненасыщенных (олеиновой C17H33COOH, линолевой C17H29COOH).
Жиры содержатся во всех растениях и животных. Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение — рыбий жир). Они состоят главным образом из триглицеридов предельных кислот.
Растительные жиры (подсолнечное масло, соевое, хлопковое и др.) – жидкости (исключение — кокосовое масло). В состав этих триглицеридов входят остатки непредельных кислот.
Жидкие жиры превращают в твердые путем реакции гидрогенизации (гидрирования). При этом водород присоединяется по двойной связи, содержащейся в углеводородном радикале молекул масел .
Продукт гидрогенизации масел — твердый жир (искусственное сало, саломас).
Маргарин — пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Жирам как сложным эфирам свойственна обратимая реакция гидролиза, катализируемая минеральными кислотами. При участии щелочей гидролиз жиров происходит необратимо. Продуктами в этом случае являются мыла – соли высших карбоновых кислот и щелочных металлов.
Натриевые соли — твердые мыла, калиевые — жидкие. Реакция щелочного гидролиза жиров, и вообще всех сложных эфиров, называется также омылением.
Природные жиры содержат следующие жирные кислоты
| Насыщенные:
стеариновая (C17H35COOH) пальмитиновая (C15H31COOH) Масляная (C3H7COOH) |
В СОСТАВЕ
ЖИВОТНЫХ ЖИРОВ |
| Ненасыщенные:
олеиновая (C17H33COOH, 1 двойная связь) линолевая (C17H31COOH, 2 двойные связи) линоленовая (C17H29COOH, 3 двойные связи) арахидоновая (C19H31COOH, 4 двойные связи, реже встречается) |
В СОСТАВЕ
РАСТИТЕЛЬНЫХ ЖИРОВ |
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
Физические свойства жиров
- Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
- Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Химические свойства жиров
1. Гидролиз, или омыление, жиров происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт — глицерин и смесь карбоновых кислот:
или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. Мыла получаются при гидролизе жиров в присутствии щелочей:
Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2.Гидрирование жиров – превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:
В условиях процесса гидрогенизации масел (высокая температура, металлический катализатор) происходит изомеризация части кислотных остатков, содержащих цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.
Реакция получения жиров (этерификация)
Применение жиров
-
- Пищевая промышленность
-
- Фармацевтика
-
- Производство мыла и косметических изделий
-
- Производство смазочных материалов