Все реакции из заданий 32, которые могут вызвать затруднения при составлении. На ЕГЭ 99% реакций в заданиях 32 будут либо они, либо аналогичные.
1) Si + 2Cl2 SiCl4
2) SiCl4 + 3H2O H2SiO3 + 4HCl
3) Ca3(PO4)2 + 5C + 3SiO2 2P + 5CO + 3CaSiO3
4) Ca3N2 + 6H2O 3Ca(OH)2 + 2NH3↑
5) 2NH3 + 3CuO 3Cu + 3H2O + N2↑
6) Cu + 4HNO3(конц.) Cu(NO3)2 + 2NO2↑ + 2H2O
7) 2Cu(NO3)2 2CuO + 4NO2 + O2↑

2Fe2O3 + 4SO2↑
9) 2H2S + SO2 3S↓ + 2H2O
10) S + 6HNO3 H2SO4 + 6NO2↑ + 2H2O
11) 4Al(NO3)3 2Al2O3 + 12NO2↑ + 3O2↑
12) 2Al2O3 4Al + 3O2↑ (электролиз раствора Al2O3 в расплаве криолита)
13) 3KNO3 + 8Al + 5KOH + 18H2O 3NH3↑ + 8K[Al(OH)4]
14) CrO3 + 2KOH K2CrO4 + H2O
15) 2K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O
16) 14HBr + K2Cr2O7 2CrBr3 + 3Br2 + 7H2O + 2KBr
17) H2S + Br2 S↓ + 2HBr
18) 3Mg + N2 Mg3N2
19) Mg3N2 + 6H2O 3Mg(OH)2↓ + 2NH3↑
20) Cr2(SO4)3 + 6NH3 + 6H2O 2Cr(OH)3↓ + 3(NH4)2SO4
21) 2Cr(OH)3 + 4KOH + 3H2O2 2K2CrO4 + 8H2O
22) 2Ag + 2H2SO4(конц.) Ag2SO4 + SO2↑ + 2H2O
23) 2KClO3 2KCl + 3O2↑ (в присутствии кат-ра)
24) 3Fe + 2O2 Fe3O4
25) Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O
26) 6FeCl2 + 14HCl + K2Cr2O7 6FeCl3 + 2CrCl3 + 2KCl + 7H2O
27) 2Na + H2 2NaH
28) NaH + H2O NaOH + H2↑
29) 2NO2 + 2NaOH NaNO2 + NaNO3 + H2O
30) 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2↑
31) Cu + 2H2SO4 CuSO4 + SO2↑ + 2H2O
32) 2CuSO4 + 4KI 2CuI↓ + I2↓ + 2K2SO4
33) 2NaCl + 2H2O H2↑ + Cl2↑ + 2NaOH (электролиз раствора)
34) Fe2O3 + 6HI 2FeI2 + I2↓ + 3H2O
35) Na[Al(OH)4] + CO2 NaHCO3 + Al(OH)3↓
36) Al2O3 + Na2CO3 (тв.) 2NaAlO2 + CO2↑ (сплавление)
37) Al4C3 + 12HBr 4AlBr3 + 3CH4↑
38) 2AlBr3 + 3K2SO3 + 3H2O 2Al(OH)3↓ + 3SO2↑ + 6KBr
39) 3SO2 + K2Cr2O7 + H2SO4 K2SO4 + Cr2(SO4)3 + H2O
40) Zn + 2KOH + 2H2O K2[Zn(OH)4] + H2↑
41) K2[Zn(OH)4] K2ZnO2 + 2H2O
42) K2ZnO2 + 4HCl 2KCl + ZnCl2 + 2H2O
43) HI + KHCO3 KI + H2O + CO2↑
44) 6KI + K2Cr2O7 + 7H2SO4 4K2SO4 + 3I2↓ + Cr2(SO4)3 + 7H2O
45) 2AlI3 + 3Na2S + 6H2O 2Al(OH)3↓ + 3H2S↑ + 6NaI
46) Fe3O4 + 10HNO3 3Fe(NO3)3 + NO2↑ + 5H2O
47) Fe2O3 + Fe 3FeO
48) 2Na + O2 Na2O2 (горение)
49) Na2O2 + 4HCl 2NaCl + 2H2O + Cl2↑
50) 3Cl2 + 10KOH + Cr2O3 2K2CrO4 + 6KCl + 5H2O
51) K2CrO4 + BaCl2 BaCrO4↓ + 2KCl
52) 2Cu(NO3)2 + 2H2O 2Cu + O2↑ + 4HNO3 (электролиз раствора)
53) 6KOH + 3S K2SO3 + 2K2S + 3H2O
54) 6KHCO3 + Fe2(SO4)3 2Fe(OH)3↓ + 3K2SO4 + 6CO2↑
55) KH + H2O KOH + H2↑
56) K2ZnO2 + 2H2SO4 K2SO4 + ZnSO4 + 2H2O
57) FeSO4 + 2NH3 + 2H2O Fe(OH)2↓ + (NH4)2SO4
58) Fe(OH)2 + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 3H2O
59) 2Fe(NO3)3 + 3K2CO3 + 3H2O 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
60) 4NO2 + 2Ca(OH)2 Ca(NO3)2 + Ca(NO2)2 + 2H2O
61) 3Ca + 2P Ca3P2
62) Ca3P2 + 6H2O 3Ca(OH)2 + 2PH3↑
63) PH3 + 8NaMnO4 + 11NaOH 8Na2MnO4 + Na3PO4 + 7H2O
64) Na2MnO4 + Na2SO3 + H2O MnO2↓ + Na2SO4 + 2NaOH
65) P + 5HNO3 H3PO4 + 5NO2↑ + H2O
66) 4Zn + 2NO2 4ZnO + N2↑
67) 2NaNO3 2NaNO2 + O2↑
68) NaNO2 + NH4I NaI + N2↑ + 2H2O
69) 2NaI + H2O2 + H2SO4 Na2SO4 + I2↓ + 2H2O
70) 3I2 + 6NaOH(р−р) NaIO3 + 5NaI + 3H2O
71) H2O2 + Ag2O 2Ag↓ + O2↑ + H2O
72) 2ZnS + 3O2 2ZnO + 2SO2↑
73) Na2[Zn(OH)4] Na2ZnO2 + 2H2O
74) 3Cu2O + Na2Cr2O7 + 10H2SO4 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
75) NaHCO3 + NaOH Na2CO3 + H2O
76) K2Cr2O7(тв.) + 14HCl(конц.) 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
77) 3NaNO2 + 2KMnO4 + H2O 2MnO2↓ + 2KOH + 3NaNO3
78) MnO2 + 4HCl(конц.) MnCl2 + Cl2↑ + 2H2O
79) 2Fe(OH)3 + 6HI 2FeI2 + I2↓ + 6H2O
80) 3Na2CO3 + 2CrBr3 + 3H2O 2Cr(OH)3↓ + 6NaBr + 3CO2↑
81) 5FeCl2 + KMnO4 + 8HCl 5FeCl3 + MnCl2 + KCl + 4H2O
82) K2SiO3(р—р) + 2H2O + 2CO2 H2SiO3↓ + 2KHCO3
83) Ba(OH)2 + 2NaHCO3 = Na2CO3 + BaCO3↓ + 2H2O (при избытке NaHCO3)
либо
Ba(OH)2 + NaHCO3 = BaCO3 + NaOH + H2O (при избытке Ba(OH)2)
84) 6KOH + 3Cl2 KClO3 + 5KCl + 3H2O
85) Cr2O3 + KClO3 + 4KOH 2K2CrO4 + KCl + 2H2O
86) 4NH3 + 5O2 4NO + 6H2O (кат. Pt, Cr2O3, t, p)
87) 2NO + O2 2NO2
88) NaNO2 + 2KMnO4 + 2KOH 2K2MnO4 + NaNO3 + H2O
89) 8KI(тв.) + 9H2SO4(конц.) 8KHSO4 + 4I2↓ + H2S↑ + 4H2O
90) Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4]
91) Na[Al(OH)4] + 4HNO3 NaNO3 + Al(NO3)3 + 4H2O
92) 2Ca(OH)2 + 4NO2 + O2 2Ca(NO3)2 + 2H2O
93) K[Al(OH)4] + SO2 KHSO3 + Al(OH)3↓
94) 8KOH + PCl5 K3PO4 + 5KCl + 4H2O
95) 2KBr(тв) + 2H2SO4(конц., гор.) K2SO4 + Br2 + SO2↑ + 2H2O
96) 3Br2 + 6KOH 5KBr + KBrO3 + 3H2O
97) Br2 + K2SO3 + 2NaOH 2NaBr + K2SO4 + H2O
98) Fe2O3 + 6HI 2FeI2 + I2 + 3H2O
99) Fe2O3 + 2NaOH(тв.) 2NaFeO2 + H2O (сплавление)
100) 4NO2 + O2 + 2H2O 4HNO3
101) NaFeO2 + 4HNO3(изб.) NaNO3 + Fe(NO3)3 + 2H2O
102) FeO + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 2H2O
103) Ca2Si + 4H2O 2Ca(OH)2 + SiH4↑
104) 3Na2SO3 + Na2Cr2O7 + 4H2SO4 Cr2(SO4)3 + 4Na2SO4 + 4H2O
105) 4Mg + 5H2SO4(конц.) 4MgSO4 + H2S↑ + 4H2O
106) CuS + 10HNO3 Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
CuS + 8HNO3(конц.) CuSO4 + 8NO2↑ + 4H2O
107) 3Cu + 8HNO3(разб.) 3Cu(NO3)2 + 2NO↑ + 4H2O
108) 2Cu(NO3)2 + 2H2O 2Cu↓ + O2↑ + 4HNO3 (электролиз раствора)
109) Cu2O + 3H2SO4(конц.) 2CuSO4 + SO2↑ + 3H2O
110) 2NaI + 2NaMnO4 I2↓ + 2Na2MnO4 (в щелочном растворе)
111) 2Na2O2 + 2CO2 2Na2CO3 + O2
112) 8NaOH(р-р, изб.) + Al2S3 2Na[Al(OH)4] + 3Na2S
113) 4Ca + 5H2SO4(конц.) H2S↑ + 4CaSO4↓ + 4H2O
114) 2Fe(OH)2 + H2O2 2Fe(OH)3
115) Na2O2 + 2H2O(хол.) H2O2 + 2NaOH
116) Ag2S + 10HNO3(конц.) = 2AgNO3 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
Ag2S + 8HNO3 → Ag2SO4 + 8NO2 + 4H2O
Материал по химии
- Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
- 1) Взаимодействие металлов с кислородом
- 2) Взаимодействие металлов с водой
- 3) Амфотерные металлы
- 4) Амфотерные оксиды и гидроксиды
- 5) Комплексные соли
- 6) Амфотерные соли
- 7) Углерод на ЕГЭ
-
Азот на ЕГЭ
- 9) Фосфор на ЕГЭ
- 10) Сера на ЕГЭ
- 11) Замещение неметаллов
- 12) Взаимодействие неметаллов с другими неметаллами
- 13) Медь и её соединения
- 14) Серебро и его соединения
- 15) Хром и его соединения
- 16) Железо и его соединения
- 17) Соединения марганца
- 18) Неметаллы с щелочами
- 19) Кислотные оксиды с щелочами
- 20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
- 21) Гидролиз бинарных соединений с ковалентной полярной связью
- 22) Взаимный гидролиз
В данном материале мы рассмотрим только те реакции неорганической химии, что выходят за пределы свойств классов (солей, кислот, оксидов, оснований) и часто встречаются в 8 задании. В материале Вы познакомитесь с самыми популярными реакциями, которые встречаются на экзамене.
Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
1) Взаимодействие металлов с кислородом
- Натрий, как и другие щелочные металлы (кроме лития), а также барий, при взаимодействии с кислородом образуют пероксиды или надпероксиды:
2Na + O2 = Na2O2
Причем, для натрия более характерен пероксид, а для калия – надпероксид:
K + O2 = KO2
- Пероксиды реагируют с холодной и горячей водой по-разному: с холодной водой происходит реакция обмена:
Na2O2 + 2H2O = 2NaOH + H2O2
В горячей воде происходит окислительно-восстановительная реакция:
2Na2O2 + H2O = 4NaOH + O2↑
2) Взаимодействие металлов с водой
Основные продукты при взаимодействии металлов с водой можно представить в виде следующей схемы:
Задание 8 ЕГЭ по химии
- Активные металлы, такие как натрий, калий, кальций, легко реагируют с водой, вытесняя водород. Реакции относятся к экзотермическим (проходят с выделением большого количества тепла), натрий и калий так активно реагируют с водой, что при контакте происходит их возгорание.
2Na + 2H2O = 2NaOH + H2↑
- Магний и алюминий тоже образуют гидроксиды, но для реакции необходимо нагревание. Алюминий берут в виде амальгамы.
Mg + 2H2O = Mg(OH)2 + H2↑
- Металлы средней активности требуют нагревания для взаимодействия с водой, при этом образуется оксид, а не гидроксид:
Zn + H2O = ZnO + H2↑
- Железо при взаимодействии с водой образует окалину (смесь оксида железа II и оксида железа III):
3Fe + 4H2O = Fe3O4 + 4H2
- На влажном воздухе железо превращается в бурый гидроксид железа III:
2Fe + 3H2O + 3O2 = 2Fe(OH)3
Задание в формате ЕГЭ с ответом:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- K + H2O →
- K2O + H2O →
- K + O2 →
- K2O2 + H2Oхолод. →
- KOH
- K2O
- KOH + H2O2
- KOH + H2
- KO2
Пример задания из КИМ ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba + O2 →
- BaO + H2O →
- Ba + H2O →
- BaO2 + H2O (горяч.) →
- Ba(OH) 2 + O2
- BaO2
- Ba(OH) 2
- BaO
- Ba(OH) 2 + H2
От активности металла зависит продукт реакции
3) Амфотерные металлы
Алюминий, цинк и бериллий отличаются от других металлов тем, что могут вступать во взаимодействие с концентрированными растворами щелочей, понятие «амфотерные металлы» использовано для облегчения поиска, такое понятие не совсем верно.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4) Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды реагируют с концентрированными растворами щелочей, причем продукт зависит от агрегатного состояния исходной щелочи: если она твердая, то применяют сплавление и образуется средняя соль, если же щелочь дана в растворенном виде, то образуется комплексная соль. Эти различия очень часто встречаются в задании 8 на ЕГЭ по химии!
- При сплавлении:
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O↑
- При растворении в концентрированной щелочи:
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH = K2[Be(OH)4]
Можно брать любую щелочь и любой амфотерный оксид или гидроксид.
- Амфотерные оксиды, при сплавлении с солями, вытесняют летучие кислотные оксиды:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
K2SO3 + ZnO = K2ZnO2 + SO2↑
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Be + KOH р-р →
- BeO + KOH р-р →
- BeO + KOH тв. →
- Be(OH) 2 + KOH тв. →
- K2 [Be(OH) 4] + H2O
- K2 [Be(OH) 4] + H2
- K2O + Be(OH) 2
- K2 [Be(OH) 4]
- K2BeO2 + H2O
5) Комплексные соли
- Комплексные соли разлагаются при нагревании с потерей воды:
Na[Al(OH)4] = NaAlO2 + 2H2O
K2[Zn(OH)4] = K2ZnO2 + 2H2O
- Комплексные соли реагируют с сильными кислотами в двух вариантах (при избытке и при недостатке кислоты):
Na[Al(OH)4] + HCl = NaCl + H2O + Al(OH)3↓ (при недостатке кислоты)
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O (при избытке кислоты)
- Комплексные соли реагируют со слабыми кислотами и летучими кислотными оксидами, получаемые сульфиды, карбонаты, сульфиты алюминия неустойчивы, поэтому вместо них записывают гидроксид амфотерного металла:
2Na[Al(OH)4] + H2S = Na2S + 2Al(OH)3 + 2H2O (при недостатке сероводородной кислоты)
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O (при избытке сероводородной кислоты)
2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3 + H2O (при недостатке углекислого газа)
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 (в условиях избытка углекислого газа)
Попробуйте решить задание ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2 [Zn(OH) 4] нагревание →
- Na2 [Zn(OH) 4] + H2S изб. →
- Na2 [Zn(OH) 4] + H2S нед. →
- NaOH тв. + Zn(OH) 2 →
- NaHS + ZnS + H2O
- Na2S + Zn(OH) 2 + H2O
- Na2ZnO2 + H2O
- Na2S + Zn + H2O
- Na2ZnO2 + H2
6) Амфотерные соли
Термин «амфотерные соли» некорректен, однако за последний месяц было более четырех тысяч запросов с таким сочетанием слов, под амфотерными солями школьник понимает соли, в анионе которого стоит амфотерный металл, а также комплексные соли, описанные выше. На самом деле, соли в которых амфотерный металл принадлежит аниону следует относить к самым обычным средним солям. Рассмотрим свойства некоторых из них, например, цинката натрия (Na2ZnO2) и алюмината калия (KAlO2).
- Реагируют с сильными кислотами:
Na2ZnO2 + 4HCl = 2NaCl + ZnCl2 + 2H2O
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Б) Растворяются в воде с образованием соответствующей комплексной соли:
KAlO2 + 2H2O = K[Al(OH)4]
- Также под амфотерными солями школьники подразумевают соли, содержащие в катионе металл в третьей валентности (что тоже является неверным, это средние соли) или цинк и бериллий, такие соли могут по-разному реагировать с растворами щелочей, например:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 (недостаток щелочи, разбавленный раствор щелочи)
AlCl3 + 4NaOH = NaCl + Na[Al(OH)4] (избыток щелочи, концентрированный раствор щелочи)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2BeO2 + H2SO4 →
- Na2 [Be(OH) 4] + H2SO4 изб. →
- Na2 [Be(OH) 4] + H2SO4 нед. →
- Na2BeO2 + H2O →
- Na2SO4 + BeSO4 + H2O
- Na2SO4 + Be(OH) 2
- Na2SO4 + Be(OH) 2 + H2O
- Na2 [Be(OH) 4]
- NaOH + BeSO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + KOH разб. →
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH конц. →
- Al2O3 + K2CO3 тв. →
- Al(OH) 3 + KCl
- KCl + KAlO2 + H2O
- KAlO2 + CO2
- K[Al(OH) 4] + KCl
- Al(OH) 3 + KCl + CO2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba(OH) 2 нед. + AlCl3 →
- Ba(OH) 2 изб. + AlCl3 →
- Ba(AlO2)2 + HCl →
- Ba[Al(OH) 4]2 + HCl изб. →
- Ba(OH) 2 + AlCl3 + H2O
- BaCl2 + Ba[Al(OH) 4]2
- BaCl2 + AlCl3 + H2O
- BaCl2 + Al(OH) 3 + H2O
- BaCl2 + Al(OH) 3
7) Углерод на ЕГЭ
В задании 8 часто встречаются гидрокарбонаты, рассмотрим их важнейшие свойства на примере гидрокарбоната кальция.
Гидрокарбонаты, как и другие кислые соли, при взаимодействии с щелочами, оксидами, солями, кислотами и при нагревании часто превращаются в средние соли.
- Разложение при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Взаимодействие с щелочами:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Взаимодействие с кислотами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Реакция с карбонатами. Эти реакции идут с образованием кислых солей, необходимый для их образования водород поступает из воды, поэтому составители используют такие обозначения как CO2 р-р или CaCO3 влажн., реакция идет по следующей схеме:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ
Восстановление углерода активными металлами и углеродом:
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
- Реакции с монооксидом углерода:
- CO или угарный газ – хороший восстановитель, реагирует с окислителями:
CO + CuO = CO2 + Cu
CO + Cl2 = COCl2
CO + Br2 = COBr2
2CO + O2 = 2CO2
- Монооксид углерода проявляет и окислительные свойства:
СO + H2 = CH3OH
- Вступает в реакции без изменения степени окисления:
CO + NaOHтв. = HCOONa (при сплавлении)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KHCO3 + Ca(OH) 2 →
- Mg(HCO3)2 + H2CrO4 →
- MgCO3 + H2CrO4 →
- Ca(HCO3)2 + KOH →
- Cr2O3 + MgCO3 + H2O
- KOH + Ca(HCO3)2
- CaCO3 + K2CO3 + H2O
- MgCrO4 + H2O + CO2
- CaO + K2CO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Mg + CO2 →
- MgO + CO2 →
- Mg(HCO3)2 + NaOH →
- MgCl2 + Na2CO3 →
- MgO + C
- MgCO3
- Mg + CO
- MgCO3 + Na2CO3 + H2O
- MgCO3 + NaCl
 Азот на ЕГЭ
Азот на ЕГЭ
Очень популярной в заданиях ЕГЭ по химии является азотная кислота, в отличие от обычных кислот, в качестве окислителя выступает не протон водорода, а азот в высшей степени окисления.
В общем, схему реакции кислоты с металлами можно представить в следующем виде:
HNO3 + Me → Me+x(NO3)x + H2O + особый продукт
Особые продукты зависят от характера металла, приведем из в виде таблицы:
Таблица – свойства азотной кислоты
|
Реагент |
HNO3 концентрированная |
HNO3 разбавленная |
|
Активные металлы (металлы IA и IIА-группы в таблице Менделеева) |
N2O (редко NO) |
NH4NO3 (редко N2 или NH3) |
|
Неактивные металлы Cu, Ag, Hg |
NO2 |
NO |
|
Cr, Al, Fe |
На холоде реакция не идёт в следствие пассивации, При нагревании образуется NO2, а металл приобретает степень окисления +3 |
NO (редко N2, N2O) |
|
Металлы средней активности (все остальные металлы, например, Zn, Ni, Co) |
NO2 |
NO (редко N2, N2O) |
|
Au, Pt |
Реакция не идет |
Реакция не идет |
- Примеры реакций металлов с азотной кислотой:
4HNO3 разб. + Al = Al(NO3)3 + NO + 2H2O (при любой температуре)
6HNO3 конц. + Al = Al(NO3)3 + 3NO2 + 3H2O (реакция идет только при нагревании)
10HNO3 разб. + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3 конц. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- C другими восстановителями азотные кислоты ведут себя аналогичным образом: у концентрированной продуктом является NO2, а у разбавленной – NO:
FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O
3FeO + 10HNO3 разб. = 3Fe(NO3)3 + NO + 5H2O
- Азотная кислота реагирует и с неметаллами, например, с серой и углеродом:
6HNO3 конц. + S = H2SO4 + 6NO2 + 2H2O
4HNO3 конц. + С = CO2 + 4NO2 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CuO + HNO3 конц. →
- CuO + HNO3 разб. →
- Cu + HNO3 конц. →
- Cu + HNO3 разб. →
- Cu(NO3)2 + H2O + NO2
- CuO + NO2 + O2
- Cu(NO3)2 + H2O
- Cu(NO3)2 + H2O + NO
- CuNO3 + H2O + NO
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- FeO + HNO3 конц. →
- Fe + HNO3 конц. tºC →
- Fe(NO3)2 + HNO3 конц. →
- FeO + HNO3 разб. →
- Fe(NO3)2 + H2O + NO2
- Fe(NO3)3 + H2O + NO2
- Fe(NO3)2 + H2O + NO
- Fe(NO3)3 + H2O + NO
- Fe(NO3)2 + H2O
9) Фосфор на ЕГЭ
- Фосфор выступает в роли окислителя и восстановителя в реакции с щелочами:
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
Это одна из самых популярных окислительно-восстановительных реакций с фосфором на ЕГЭ по химии.
- оксид фосфора III реагирует с холодными растворами щелочей и водой без изменения степени окисления:
P2O3 + 2KOH + H2O → 2KH2PO3
P2O3 + 3H2O → 2H3PO3 (или HPO2)
- Соединения фосфора III – хорошие восстановители, стремятся превратиться в соединения фосфора V:
P2O3 + окислитель → PO43‒ + продукты восстановления
P2O3 + 4KMnO4 + 10KOH → 2K3PO4 + 4K2MnO4 + 5H2O
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
- Оксид фосфора V реагирует с водой, образуя ряд кислот:
P2O5 + H2O → 2HPO3 – метафосфорная (в сильном недостатке воды)
P2O5 + 2H2O → H4P2O7 – пирофосфорная (в небольшом недостатке воды)
P2O5 + 3H2O → 2H3PO4 – ортофосфорная (в избытке воды)
- Фосфаты могут образовывать кислые соли, при взаимодействии с фосфорной кислотой:
2K3PO4 + H3PO4 → 3K2HPO4
K3PO4 + 2H3PO4(большой избыток) → 3KH2PO4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaH2PO4 + NaOH нед. →
- NaH2PO4 + NaOH изб. →
- NaH2PO4 изб. + NaOH →
- NaH2PO4 нед. + NaOH →
- Na3PO4 + H2O
- NaH2PO3 + H2O
- Na3PO4 + P2O5
- NaH2PO2 + H2O
- Na2HPO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P2O5 + H2O нед. →
- P2O3 + KOH →
- P + KOH →
- P2O5 нед. + H2O →
- K2HPO3 + H2O
- KH2PO2 + PH3
- HPO3
- H3PO4
- HPO2
10) Сера на ЕГЭ
Таблица ‒ Серная кислота
|
Свойства |
Разбавленная H2SO4 |
Концентрированная H2SO4 |
|
Окислительные свойства |
Окислитель за счет протона водорода |
Окислитель за счет серы |
|
Активные металлы |
2Na + H2SO4 = Na2SO4 + H2 |
8Na + 5H2SO4 = 4Na2SO4 + 4H2O + H2S↑ |
|
Металлы средней активности |
Zn + H2SO4 = ZnSO4 + H2 |
3Zn + 4H2SO4 = 3ZnSO4 + 4H2O + S↓ (в зависимости от концентрации кислоты может выделиться SO2 или H2S) |
|
Al, Cr, Fe |
Как с другими металлами до водорода: Fe + H2SO4 = FeSO4 + H2 |
На холоде реакция не идет (пассивация), при нагревании: 2Fe + 6H2SO4 = Fe2(SO4)3 + 6H2O + 3SO2 |
|
Металлы средней активности |
Реакция не идет, так как эти металлы не могут вытеснить водород |
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 |
- Обменная реакция с концентрированной серной кислотой:
NaCl + H2SO4 конц. = NaHSO4 + HCl↑ (при сильном нагревании)
Остальные обменные реакции стандартны и в этом материале рассмотрены не будут.
- Сероводород:
SO2 + 2H2S = 3S↓ + 2H2O
2H2S + 3O2 = 2H2O + 2SO2 (кислород в избытке)
2H2S + O2 = 2H2O + 2S↓ (кислород в недостатке)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KCl тв. + H2SO4 конц. →
- KI + H2SO4 конц. →
- Fe + H2SO4 конц. tºC →
- FeO + H2SO4 конц. →
- Cl2 + K2SO4 + H2O
- KHSO4 + HI
- KHSO4 + HCl
- I2 + K2SO4 + H2S
- Fe2 (SO4)2 + H2O + SO2
- FeSO4 + H2O
11) Замещение неметаллов
Часто в задании 8 ЕГЭ по химии встречается замещение брома на хлор, или йода на хлор или бром. Галогены могут вытеснять друг друга и другие неметаллы из соединений. Чтобы понимать, какие неметаллы могут вытеснить другие неметаллы, нужно помнить о том, что в ПС Д.И. Менделеева элементы стоят таким образом, что чем правее и выше стоит элемент, тем сильнее проявляются его неметаллические свойства, и тем выше его электроотрицательность. Более электроотрицательные неметаллы могут вытеснять менее электроотрицательные. Так, хлор и бром стоят выше в таблице Менделеева, чем йод, поэтому могут вытеснить его из соединений:
2NaI + Br2 = 2NaBr + I2
2KI + Cl2 = 2KCl + I2
Хлор может вытеснить бром:
2NaBr + Cl2 = 2NaCl + Br2
Йод не может вытеснить другие галогены, так как расположен в ПС ниже хлора, брома и фтора, но йод может вытеснить те элементы-неметаллы, что стоят левее в Периодической системе, например, серу:
H2S + I2 = 2HI + S
Можно использовать ряд электроотрицательности неметаллов, на реальном ЕГЭ его не будет, легче запомнить Периодический закон, тем более что эти знания также нужны для выполнения задания 2 ЕГЭ по химии.
12) Взаимодействие неметаллов с другими неметаллами
Более электроотрицательные неметаллы могут окислить менее электроотрицательные неметаллы. То есть те элементы, которые стоят в ПС выше и правее отнимают электроны у тех неметаллов, которые стоят ниже и левее.
Например, хлор, бром и фтор могут окислить йод, серу, фосфор (наиболее популярные на ЕГЭ реакции). В таблице представлены наиболее популярные продукты:
Таблица – взаимодействие неметаллов
|
Восстановители |
Окислители |
|||||
|
F2 |
Cl2 |
Br2 |
I2 |
O2 |
S |
|
|
I2 |
IF7 IF5 |
ICl5 ICl3 ICl |
IBr5 IBr3 IBr |
‒ |
‒ |
‒ |
|
S |
SF6 |
SCl4 |
SBr4 |
‒ |
SO2 |
‒ |
|
P |
PF5 |
PCl5 PCl3 |
PBr5 PBr3 |
PI3 |
P2O3 P2O5 |
P2S3 P2S5 |
|
Si |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiO2 |
SiS2 |
|
H2 |
HF |
HCl |
HBr |
HI |
H2O |
H2S |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + O2 →
- SO2 + O2 →
- H2S + SO2 →
- S + P →
- S + H2O
- SO2
- P2S3
- SO3
- S3P2
13) Медь и её соединения
2CuCl2 + 4KI = 2CuI↓ + I2 + 4KCl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 – темно-синий комплекс
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH – прозрачный раствор
3CuO + 2NH3 = 3Cu + N2 + 3H2O
14) Серебро и его соединения
AgCl + 2NH3 = [Ag(NH3)2]Cl
8AgNO3 + PH3 + 4H2O = H3PO4 + 8Ag + 8HNO3
15) Хром и его соединения
- Соединения хрома II – хорошие восстановители, при взаимодействии с окислителями превращаются в соединения хрома III
4CrO + O2 = 2Cr2O3
CrO + 4HNO3 = Cr(NO3)3 + 2H2O + NO2
- соединения хрома III проявляют как окислительные, так и восстановительные свойства:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 6NaBr + 8H2O + 2Na2CrO4 (хром в степени окисления +3 является восстановителем)
2CrCl3 + H2 = 2CrCl2 + 2HCl (хром в степени окисления +3 является восстановителем)
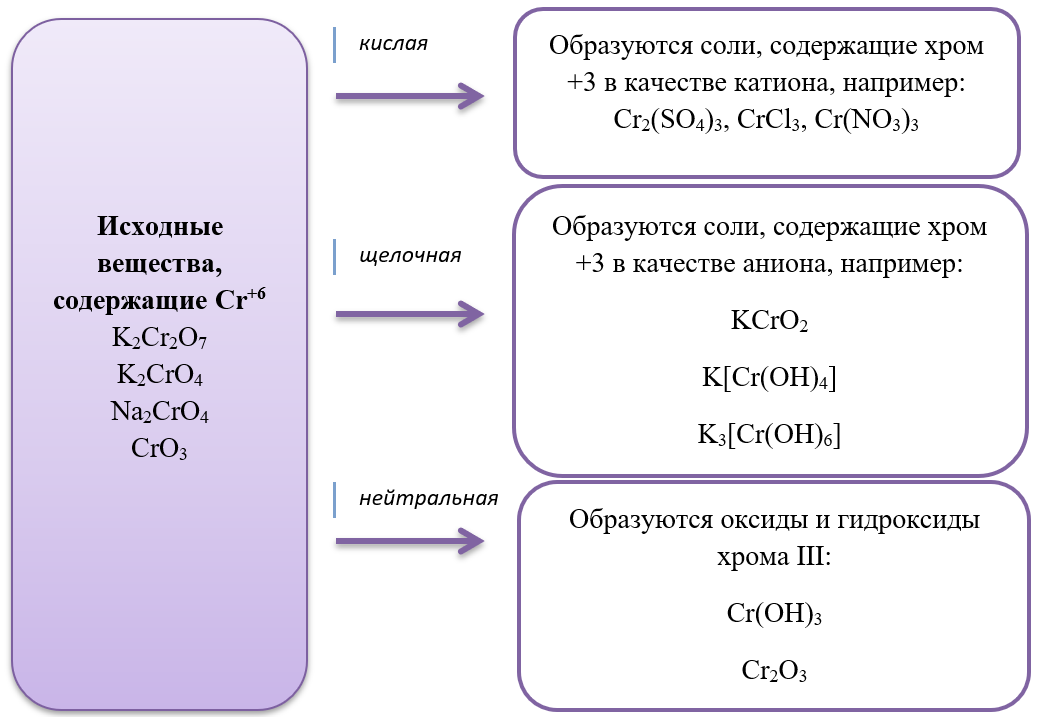
- Дихроматы – соли, окрашивающие растворы в оранжевый цвет и хроматы – соли желтого цвета устойчивы в разных средах: в кислой среде устойчивы оранжевые дихроматы, а в щелочной – желтые хроматы. В зависимости от среды, они могут взаимно превращаться:
Хромат превращается в дихромат в кислой среде, раствор меняет цвет с желтого на оранжевый.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Дихромат превращается в хромат в щелочной среде, раствор меняет цвет с оранжевого на желтый.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
В ЕГЭ по химии стали уже традиционными задания с соединениями хрома, особенно с дихроматами, в основном встречается их окислительно-восстановительные свойства:
16) Железо и его соединения
- Железо реагирует с концентрированной азотной и серной кислотой только при нагревании, с разбавленными кислотами реагирует при нормальных условиях, например:
Fe + 6HNO3 конц = Fe(NO3)3 + 3NO2 + 3H2O (при нагревании)
- Взаимодействие железа с галогенами и галогенводородами:
Таблица – Железо с галогенами и галогеноводородами
|
С галогенами |
С галогенводородом |
|
2Fe + 3Cl2 = 2FeCl3 |
Fe + 2HCl = FeCl2 + H2 |
|
2Fe + 3Br2 = 2FeBr3 |
Fe + 2HBr = FeBr2 + H2 |
|
Fe + I2 = FeI2 |
Fe + 2HI = FeI2 + H2 |
- Соединения двухвалентного железа – хорошие восстановители, с окислителями превращаются в соединения трехвалентного железа:
FeO + 4HNO3 конц = Fe(NO3)3 + NO2 + 2H2O
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- Железная окалина – двойной оксид Fe3O4 или FeO·Fe2O3, проявляет как окислительные (за счет оксида железа III), так и восстановительные (за счет железа II) свойства, а также растворяется в кислотах, образуя две соли (железа II и железа III)
Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O (оксиды железа растворились в разбавленной серной кислоте без изменения степени окисления)
Fe3O4 + 8KI + 4H2SO4 = 3FeI2 + 4K2SO4 + I2 + 4H2O (железная окалина проявляет окислительные свойства за счет наличия железа III)
Fe3O4 + 10HNO3конц = 3Fe(NO3)3 + NO2 + 5H2O (железная окалина проявляет восстановительные свойства за счет железа II)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + I2 →
- Fe + Cl2 →
- Fe + HCl →
- Fe + O2 →
- FeI3
- FeCl2
- FeI2
- FeCl3
- FeO
- Fe3O4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + CuSO4 →
- Fe + H2SO4 р-р →
- Fe + H2SO4 конц. tºC →
- Fe + H2O + O2 →
- FeSO4 + Cu
- FeSO4 + H2
- Fe2(SO4)3 + Cu
- Fe2 (SO4)3 + H2
- Fe2(SO4)3 + SO2 + H2O
- Fe(OH) 3
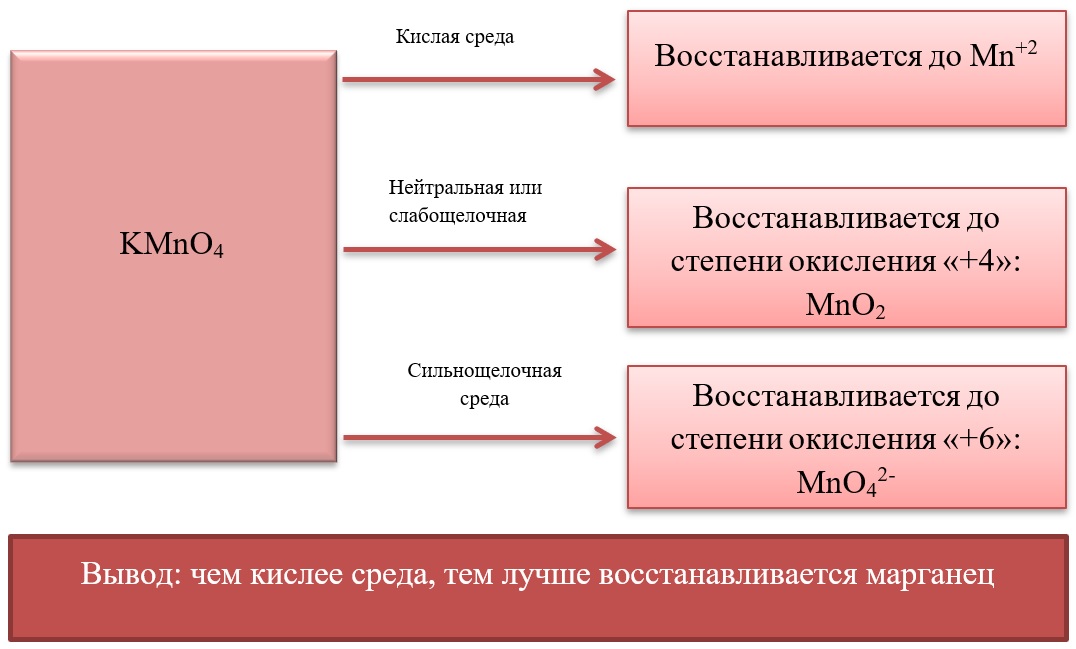
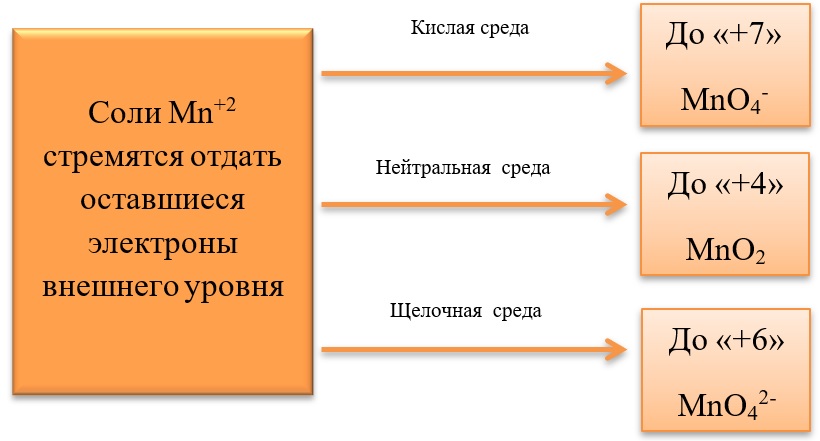
17) Соединения марганца
- Марганец в степени окисления +7 проявляет окислительные свойства. Продукты его восстановления зависят от среды:
Примеры реакция перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2KMnO4 + SO2 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
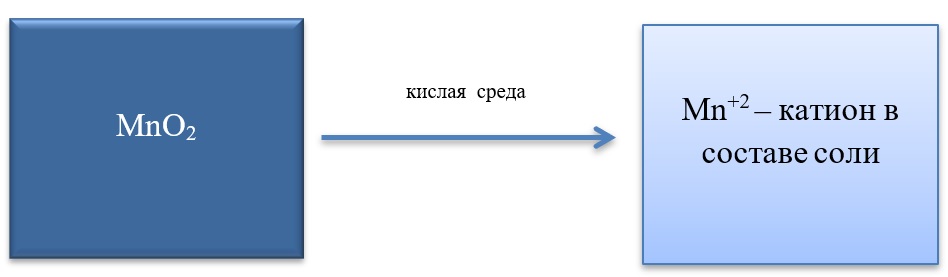
- Марганец в степени окисления +4 проявляет как окислительные. Так и восстановительные свойства.
Окислительные свойства чаще проявляет в кислой среде, восстанавливаясь до катиона +2.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + H2O2 + H2SO4 → O2 + MnSO4 + 2H2O
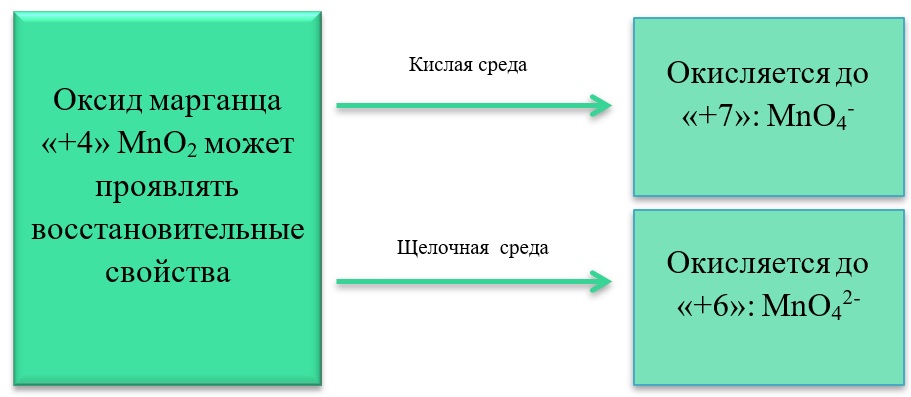
В) Марганец в степени окисления +4 проявляет и восстановительные свойства, окисляясь до +6 в щелочной среде, и до +7 в кислой:
MnO2 + Br2 + 4KOH = K2MnO4 + 2KBr + 2H2O
- Соединения марганца II, например, MnSO4 проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства проявляет в реакциях с более активными металлами, например, с алюминием:
3MnSO4 + 2Al = 3Mn + Al2(SO4)3
Восстановительные свойства проявляет при взаимодействии с типичными окислителями.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
18) Неметаллы с щелочами
- Галогены с щелочами:
Хлор, бром и йод реагируют с щелочами при разных условиях. На холоде окисления галогена происходит чаще до степени окисления +1 (восстановление в любых условиях происходит до степени окисления ‒1). Описать данную реакцию можно уравнением:
Г2 + 2NaOH = NaГ + NaГO + H2O (вместо гидроксида натрия можно взять любую щелочь, содержащую одновалентный металл: K, Cs, Rb)
2Г2 + 2Ca(OH)2 = CaГ2 + Ca(ГO)2 + 2H2O (вместо гидроксида кальция можно брать гидроксид бария и стронция).
Где Г = I, Cl, Br
Например:
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
При нагревании окисление галогена часто проходит до степени окисления +5:
3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O
6Г2 + 6Ca(OH)2 = 5CaГ2 + Ca(ГO3)2 + 6H2O
Например:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
6Cl2 + 6Ca(OH)2 = 5CaCl2 + Ca(ClO3)2 + 6H2O
Обращайте внимание на температуру, от Вашей внимательности зависят Ваши баллы на ЕГЭ по химии!
- Сера, селен и теллур тоже реагируют с щелочами по одной схеме:
3Э + 6NaOH = 2Na2Э + Na2ЭO3 + 3H2O
3Э + 3Ca(OH)2 = 2CaЭ + CaЭO3 + 3H2O
Например:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O
- Фосфор с щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Кремний с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + NaOH →
- SO2 + NaOH →
- SO3 + NaOH →
- H2S + NaOH →
- NaHS + S + H2O
- Na2SO4 + H2O
- Na2S + Na2SO3 + H2O
- Na2SO3 + H2O
- Na2S + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P + NaOH →
- P2O3 + NaOH →
- P2O5 + NaOH изб. →
- P2O5 + NaOH нед. →
- NaH2PO2
- NaH2PO3
- Na3P
- Na3PO4
- NaH2PO4
19) Кислотные оксиды с щелочами
Кислотные оксиды реагируют с щелочами, образуя соль и воду, к нестандартным реакциям относят взаимодействие диоксида азота с щелочами, продукты которого зависят от наличия в среде кислорода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + Cl2O →
- NaOH + NO2 + O2 →
- NaOH + Cl2O3 →
- NaOH + HNO3 →
- NaClO + H2O
- NaCl + HCl
- NaClO2 + H2O
- NaNO3 + H2O
- NaNO2 + NaNO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + SO2 →
- NaOH + SO3 →
- NaOH + NO2 →
- NaOH + P2O5 →
- NaNO3 + NaNO2 + H2O
- Na2SO4 + H2O
- NaNO2 + H2O
- NaH2PO4
- NaH2PO3
- Na2SO3 + H2O
20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
Многие неметаллы реагируют с активными металлами, образуя соли или солеподобные вещества, легко гидролизующиеся в воде или кислотах.
Для начала рассмотрим схемы образования этих веществ. В них неметалл часто проявляет низшую степень окисления (значение низшей степени окисления легко определяется по номеру группы: для этого от номера группы нужно отнять 8, например, для азота это будет 5 ‒ 8 = ‒3)
Таблица – Степени окисления, которые принимают неметаллы при взаимодействии с активными металлами:
|
С |
Si |
N и P |
S, Se, Te |
F, Cl, Br, I |
|
‒4 (с Na, K, Al) ‒1 (с Ca, Mg) |
‒4 |
‒3 |
‒2 |
‒1 |
|
Карбиды |
Силициды |
Нитриды и фосфиды |
Сульфиды, селениды, теллуриды |
Фториды, хлориды, бромиды, йодиды |
Степени окисления активных металлов равны номеру группы, в которой они стоят в ПС.
4Na + C = Na4C
4Al + 3C = Al4C3
Ca + 2C = CaC2
4K + Si = K4Si
3Ca + N2 = Ca3N2
3K + P = K3P
2Al + 3S = Al2S3
Ba + Cl2 = BaCl2
Практически все эти вещества, за исключением некоторых сульфидов и галогенидов (хлоридов, бромидов, йодидов, фторидов) неустойчивы в растворах и подвергаются мгновенному гидролизу, который стоит рассматривать как обычную обменную реакцию с водой:
K3P + 3HOH = 3KOH + PH3↑
Na4Si + 4HOH = 4NaOH + SiH4↑
Ca3N2 + 6HOH = 3Ca(OH)2 + 2NH3↑
Продукт гидролиза карбидов зависит от степени окисления углерода в исходном веществе: если она равна ‒1, то образуется ацетилен (C2H2), а если ‒4, то метан (CH4).
Al4C3 + 12HOH = 4Al(OH)3 + 3CH4↑
CaC2 + 2HOH = Ca(OH)2 + C2H2↑
Так же происходит их кислотный гидролиз:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Ba3P2 + 3H2SO4 = 3BaSO4 + 2PH3↑
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- MgC2 + H2O →
- Na4C + H2O →
- Mg3P2 + H2O →
- Na3P + H2O →
- NaOH + C2H2
- Mg(OH) 2 + CH4
- Mg(OH) 2 + PH3
- NaOH + CH4
- Mg(OH) 2 + C2H2
- NaOH + PH3
21) Гидролиз бинарных соединений с ковалентной полярной связью
При гидролизе бинарных соединений неметаллов важно помнить, что степень окисления неметаллов не изменяется, из неметалла с положительной степенью окисления образуется кислотный гидроксид (кислородсодержащая кислота), из отрицательно заряженного неметалла образуется бескислородная кислота:
PCl5 + 4H2O = H3PO4 + 5HCl
SF6 + 4H2O = H2SO4 + 6HF
ICl3 + 2H2O = HIO2 + 3HCl
Для образования гидроксидов неметаллов можно воспользоваться следующей таблицей:
|
Степень окисления неметалла |
Э+1 |
Э+3 |
Э+4 |
Э+5 |
Э+6 |
Э+7 |
|
Соответствующая кислота (кислотный гидроксид) |
НЭО |
HЭO2 Или H3ЭO3 |
H2ЭO3 |
HЭO3 Или H3ЭO4 |
H2ЭO4 |
HЭO4 |
|
Примеры |
HClO |
HClO2 H3PO3 |
H2SO3 |
HIO3 H3PO4 |
H2SO4 |
HClO4 |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- ICl + H2O →
- ICl3 + H2O →
- ICl5 + H2O →
- ICl7 + H2O →
- HClO3 + HI
- HIO + HCl
- HIO4 + HCl
- HIO2 + HCl
- HIO3 + HCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- PCl3 + H2O →
- SCl4 + H2O →
- SiCl4 + H2O →
- PCl5 + H2O →
- H2SO4 + HCl
- H2SiO3 + HCl
- H3PO3 + HCl
- SO2 + HCl
- HPO3 + HCl
22) Взаимный гидролиз
При взаимодействии некоторых солей могут образоваться новые соли, неустойчивые в растворах, в таких случаях в таблице растворимости на пересечении катиона и аниона мы видим прочерк (не существует или необратимо разлагается водой), например, сульфид алюминия:
Сульфид алюминия образуется в реакциях между растворимыми сульфидами и солями алюминия:
3Na2S + 2AlCl3 = 6NaCl + Al2S3
Но данная запись неверна, так как сульфида алюминия не существует в растворах, записываем уравнение гидролиза этой соли:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Объединим первое уравнение со вторым(левую часть первого уравнение соединяем с левой частью второго уравнения, а правую с правой, все коэффициенты сохраняем):
3Na2S + 2AlCl3 + Al2S3 + 6H2O = 6NaCl + Al2S3 + 2Al(OH)3↓ + 3H2S↑
Сокращаем сульфид алюминия, так как он есть и в правой части реакции, и в левой:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3H2S↑ — так выглядит реакция взаимодействия растворов сульфида натрия и хлорида алюминия.
Рассмотрим еще один пример — взаимодействие карбоната калия и нитрата железа III:
3K2CO3 + 2Fe(NO3)3 = Fe2(CO3)3 + 6KNO3
Образовавшийся карбонат железа III разлагается в воде:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Соединяем два уравнения:
3K2CO3 + 2Fe(NO3)3 + Fe2(CO3)3 + 3H2O = Fe2(CO3)3 + 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Сокращаем карбонат железа III с обеих сторон:
3K2CO3 + 2Fe(NO3)3 + 3H2O = 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Взаимный гидролиз попался мне на реальном досрочном ЕГЭ по химии 2022 во второй части!
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CrCl3 + NaOH изб. →
- CrCl3 + NaOH нед. →
- CrCl3 + Na2S р-р →
- Cr2O3 + Na2SO3 →
- Cr(OH) 3 + NaCl + SO2
- NaCl + Cr(OH) 3
- Cr(OH) 3 + NaCl + H2S
- NaCrO2 + SO2
- Na3 [Cr(OH) 6] + NaCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH изб. →
- AlCl3 + KOH нед. →
- Al2O3 + K2CO3 →
- KCl + K[Al(OH) 4]
- Al(OH) 3 + KCl + CO2
- Al2 (CO3)3 + KCl
- KAlO2 + CO2
- Al(OH) 3 + KCl
100 ОВР, котрые помогут учащимся при сдаче ЕГЭ по химии.
1) 2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
2) 2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 8H2O + 2KCl
3) 5NaNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
4) 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
5) 2KMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
6) 2KMnO4 + 5Na2SO3 + 3H2SO4 = MnSO4 + K2SO4 + 5Na2SO4 + 3H2O
7)SO2 + 2KMnO4 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O

9) K2Cr2O7 + 3NaNO2 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
10) K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
11) 4Mg + 10HNO3(оч.разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
12) Cr2(SO4)3 + 3Br2 + 16NaOH = 6NaBr + 2Na2CrO4 + 3Na2SO4 + 8H2O
13)Al2S3 + 30HNO3(конц.) = 2Al(NO3)3 + 3H2SO4 + 24NO2 + 12H2O
14) 6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O
15) FeCl2 + 4HNO3(конц.) = Fe(NO3)3 + 2HCl + NO2 + H2O
16) AlP + 11HNO3(конц.) = H3PO4 + 8NO2 + Al(NO3)3 + 4H2O
17) 6FeSO4 + KClO3 + 3H2SO4 = 3Fe2(SO4)3 + KCl + 3H2O
18) 3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
19) 2Al + K2Cr2O7 + 7H2SO4 = Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
20) 3P2O3 + 2HClO3 + 9H2O = 6H3PO4 + 2HCl
21) Cr2(SO4)3 + 6KMnO4 + 16KOH = 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O
22) Cr2O3 + 3KNO3 + 4KOH = 2K2CrO4 + 3KNO2 + 2H2O
23) 2NaNO2 + 2NaI + 2H2SO4 = 2NO + I2 + 2Na2SO4 + 2H2O
24) 8KI + 9H2SO4(конц.) = 4I2 + H2S + 8KHSO4 + 4H2O
25) Cu + 2FeCl3 = CuCl2 + 2FeCl2
26) 3PH3 + 4HClO3 = 3H3PO4 + 4HCl
27) 3NO2 + H2O = NO + 2HNO3
28) I2 + K2SO3 + 2KOH = 2KI + K2SO4 + H2O
29) 2NH3 + 3KClO = N2 + 3KCl + 3H2O
30) 6P + 5HClO3 + 9H2O = 5HCl + 6H3PO4
31) 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
32) Ca(ClO)2 + 4HCl = CaCl2 + 2Cl2 + 2H2O
33) 3H2S + HClO3 = 3S + HCl + 3H2O
34) Fe2(SO4)3 + 2KI = 2FeSO4 + I2 + K2SO4
35) 2KMnO4 + KI + H2O = 2MnO2 + KIO3 + 2KOH
36) I2 + 10HNO3(конц.) = 2HIO3 + 10NO2 + 4H2O
37) 3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 28NO + 9H2SO4
38) 4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S + 4H2O
39) MnO2 + 2KBr + 2H2SO4 = MnSO4 + Br2 + K2SO4 + 2H2O
40) 5HCOH + 4KMnO4 + 6H2SO4 = 5CO2 + 2K2SO4 + 4MnSO4 + 11H2O
41) 3KNO2 + 2KMnO4 + H2O = 3KNO3 + 2MnO2 + 2KOH
42) NaClO + 2KI + H2SO4 = I2 + NaCl + K2SO4 + H2O
43) 2KNO3 + 6KI + 4H2SO4 = 2NO + 3I2 + 4K2SO4 + 4H2O
44) 14HCl + K2Cr2O7 = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
45) 2Cr(OH)3 + 3Cl2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O
46) K2MnO4 + 8HCl = MnCl2 + 2Cl2 + 2KCl + 4H2O
47) K2Cr2O7 + 3Na2SO3 + 4H2O = 2Cr(OH)3 + 3Na2SO4 + 2KOH
48) 2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
49) 4Zn + KNO3 + 7KOH = NH3 + 4K2ZnO2 + 2H2O
50) 2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O
51) P2O3 + 6KOH + 2NO2 = 2NO + 2K3PO4 + 3H2O
52) 2KMnO4 + 2NH3 = 2MnO2 + N2 + 2KOH + 2H2O
53) 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
54) 3NaNO2 + Na2Cr2O7 + 8HNO3 = 5NaNO3 + 2Cr(NO3)3 + 4H2O
55) B + HNO3(конц.) + 4HF = NO + HBF4 + 2H2O
56) 2CuCl2 + SO2 + 2H2O = 2CuCl + 2HCl + H2SO4
57) PH3 + 8AgNO3 + 4H2O = 8Ag + H3PO4 + 8HNO3
58) 2NH3 + 6KMnO4 + 6KOH = N2 + 6K2MnO4 + 6H2O
59) 5Zn + 2KMnO4 + 8H2SO4 = 5ZnSO4 + 2MnSO4 + K2SO4 + 8H2O
60) 3KNO2 + K2Cr2O7 + 8HNO3 = 5KNO3 + 2Cr(NO3)3 + 4H2O
61) FeS + 12HNO3(конц.) = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O
62) KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
63) 2NaCrO2 + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 4H2O
64) Fe2(SO4)3 + Na2SO3 + H2O = 2FeSO4 + Na2SO4 + H2SO4
65) 3P2O3+ 2H2Cr2O7 + H2O = 2H3PO4 + 4CrPO4
66) 3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O
67) 5Na2SO3(нед.) + 2KIO3 + H2SO4 = I2 + K2SO4 + 5Na2SO4 + H2O
68) 2CrBr3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaBr + 8H2O
69) 8 KMnO4 + 5 PH3 + 12H2SO4 = 5H3PO4 + 8MnSO4 + 4K2SO4 + 12H2O
70) 3SO2 + K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O
71) 3P2O3 + 4HNO3 + 7H2O = 6H3PO4 + 4NO
72) 2NO + 3KClO + 2KOH = 2KNO3 + 3KCl + H2O
73) 5PH3 + 8KMnO4 + 12H2SO4 = 5H3PO4 + 4K2SO4 + 8MnSO4 + 12H2O
74) 5AsH3 + 8KMnO4 + 12H2SO4 = 5H3AsO4 + 4K2SO4 + 8MnSO4 + 12H2O
75) 2CuI + 4H2SO4(конц.) = 2CuSO4 + I2 + 4H2O + 2SO2
76) Si + 2KOH + H2O = K2SiO3 + 2H2 (to)
77) B + 3HNO3 = H3BO3 + 3NO2
78) 8NH3 + 3Br2 = N2 + 6NH4Br
79) P4 + 3KOH + 3H2O = PH3 + 3KH2PO2
80) Al2O3 + 3C + 3Cl2 = 2AlCl3 + 3CO(to)
81) H2S + HClO = S + HCl + H2O
82) 5KNO3(расплав) + 2P = 5KNO2 + P2O5
83) I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
84) H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
85) 8Zn + 5H2S2O7 = 8ZnSO4 + 2H2S + 3H2O
86) 2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
87) Na2S + 8NaNO3 + 9H2SO4 = 10NaHSO4 + 8NO2 + 4H2O
88) Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
89) 5C + Ca3(PO4)2 + 3SiO2 = 2P + 5CO + 3CaSiO3 (to)
90) 2NaI + H2O2 + H2SO4 = Na2SO4 + I2 + 2H2O
91) 14HBr + K2Cr2O7 = 2CrBr3 + 3Br2 + 7H2O + 2KBr
92) 2NH3 + 2KMnO4(тв.) = N2 + 2MnO2 + 2KOH + 2H2O (to)
93) 2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl
94) 2HMnO4 + 5H2S + 2H2SO4 = 5S + 2MnSO4 + 8H2O
95) 3KNO3 + 8Al + 5KOH + 18H2O = 3NH3 + 8K[Al(OH)4]
96) 5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
97) P4 + 20HNO3 = 4H3PO4 + 20NO2 + 4H2O
98) 3NaClO + 4NaOH + Cr2O3 = 2Na2CrO4 + 3NaCl + 2H2O
99) Na2SO3 + 2KMnO4 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
100) Cr2(SO4)3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4 +8H2O
Полный курс подготовки к ЕГЭ по химии-2023. Здесь приведена теория по каждому заданию в соответствии с спецификацией и кодификатором ЕГЭ по химии. Учебные материалы и теория, необходимые для подготовки к ЕГЭ по химии.
Вы можете поддержать работу сайта, разработку новых материалов и тестов. Донаты принимаются через форму:
Обратите внимание! Форма выше — это не оплата курса по химии, это форма для сбора донатов на работу сайта)
Кодификатор ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| |
1.1. | Современные представления о строении атома |
| 1.1.1. | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
|
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1. | Закономерности изменения свойств элементов и их соединений по периодам и группам
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами) |
|
| 1.2.2. | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3. | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | |
| 1.2.4. | Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | |
| 1.3. | Химическая связь и строение вещества |
|
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.3.2. | Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| 1.3.3. | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. | Химическая реакция | |
| 1.4.1. | Классификация химических реакций в неорганической и органической химии
Тренировочные тесты в формате ЕГЭ по теме «Классификация реакций» ( с ответами) |
|
| 1.4.2. | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3. | Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» ( с ответами) |
|
| 1.4.4. | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» ( с ответами) |
|
| 1.4.5. |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | |
| 1.4.6. | Реакции ионного обмена | |
| 1.4.7. |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (с ответами) |
|
| 1.4.8. |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 19 ЕГЭ по химии) ( с ответами) |
|
| 1.4.9. |
Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами) |
|
| 1.4.10. |
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1. | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2.2. | Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | |
| 2.3. | Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 2.4. | Характерные химические свойства оксидов: основных, амфотерных, кислотных | |
| 2.5. | Характерные химические свойства оснований и амфотерных гидроксидов | |
| 2.6. | Характерные химические свойства кислот | |
| 2.7. | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | |
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1. | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тренировочные тесты в формате ЕГЭ по теме «Теория строения орг. соединений» ( с ответами) |
|
| 3.2. | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3. | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация орг. соединений» ( с ответами) |
|
| 3.4. | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | |
| 3.5. | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6. | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | |
| 3.7. | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Тренировочные тесты в формате ЕГЭ по теме «Свойства азотсодержащих соединений» ( с ответами) |
|
| 3.8. | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | |
| 3.9. | Взаимосвязь органических соединений | |
| 4. | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1. | Экспериментальные основы химии | |
| 4.1.1. | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2. | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | |
| 4.1.3. | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4. | Качественные реакции на неорганические вещества и ионы | |
| 4.1.5. | Качественные реакции органических соединений | |
| 4.1.6. | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | |
| 4.1.7. | Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов | |
| 4.1.8. | Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот | |
| 4.2.1. | Понятие о металлургии: общие способы получения металлов | |
| 4.2.2. | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | |
| 4.2.3. | Природные источники углеводородов, их переработка | |
| 4.2.4. | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | |
| 4.3. | Расчеты по химическим формулам и уравнениям реакций | |
| 4.3.1. | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2. | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3. | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4. | Расчеты теплового эффекта реакции | |
| 4.3.5. | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | |
| 4.3.6. | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества | |
| 4.3.7. | Установление молекулярной и структурной формулы вещества | |
| 4.3.8. | Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9. | Расчеты массовой доли (массы) химического соединения в смеси |
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами)
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.3. Химическая связь и строение вещества
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами)
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами)
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.4. Химическая реакция
1.4.1. Классификация химических реакций в неорганической и органической химии
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения
1.4.3. Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» (задание 20 ЕГЭ по химии) ( с ответами)
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
1.4.6. Реакции ионного обмена
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 21 ЕГЭ по химии) ( с ответами)
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 22 ЕГЭ по химии) ( с ответами)
1.4.10. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
2.8. Взаимосвязь различных классов неорганических веществ
3. ОРГАНИЧЕСКАЯ ХИМИЯ
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
3.6. Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
3.8. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
3.9. Взаимосвязь органических соединений
4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1. Экспериментальные основы химии
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
4.1.4. Качественные реакции на неорганические вещества и ионы
4.1.5. Качественные реакции органических соединений
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
4.1.7. Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов
4.1.8. Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот
4.2.1. Понятие о металлургии: общие способы получения металлов
4.2.2. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
4.2.3. Природные источники углеводородов, их переработка
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
4.3. Расчеты по химическим формулам и уравнениям реакций
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе»
4.3.2. Расчеты объемных отношений газов при химических реакциях
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
4.3.4. Расчеты теплового эффекта реакции
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
4.3.7. Установление молекулярной и структурной формулы вещества
4.3.8. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчеты массовой доли (массы) химического соединения в смеси
Курс подготовки к ЕГЭ или ОГЭ (ГИА) по химии:
Общая химия
Часть 1. Строение вещества
1. Строение атома. Электронные формулы атомов
2. Периодический закон
3. Строение молекул. Типы химических связей. Основные характеристики ковалентной связи. Межмолекулярные связи
4. Строение вещества (кристаллические решетки). Основные физические свойства различных кристаллов
5. Степень окисления и валентность химических элементов.
Часть 2. Основы неорганической химии
1. Классификация неорганических веществ
2. Номенклатура неорганических веществ
3. Способы получения оксидов
4. Химические свойства основных оксидов
5. Химические свойства кислотных оксидов
6. Химические свойства амфотерных оксидов
7. Химические свойства и способы получения кислот
8. Химические свойства и способы получения солей
9. Химические свойства и способы получения оснований
10. Взаимосвязь основных классов неорганических веществ
11. Бинарные соединения — гидриды.
12. Реакции разложения в неорганической химии
Часть 3. Физико-химия растворов:
1. Понятие о растворах, растворимость
2. Теория электролитической диссоциации
3. Реакции ионного обмена
4. Гидролиз.
Часть 4. Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции.
2. Электролиз солей. Электролиз солей карбоновых кислот. Коррозия.
Часть 5. Особенности работы в лаборатории
Часть 6. Химические реакции. Закономерности их протекания
1. Классификация химических реакций.
2. Кинетика (скорость) химических реакций и ее зависимость от разных факторов.
3. Термодинамика химических реакций: химическое равновесие и его смещение.
Органическая химия
1. Теория строения органических веществ. Классификация органических веществ. Гомологи и изомеры. Виды изомерии.
2. Алканы: химические и физические свойства, строение, получение, изомерия.
3. Алкены: химические и физические свойства, строение, получение, изомерия.
4. Алкины: химические и физические свойства, строение, получение, изомерия.
5. Алкадиены: химические и физические свойства, строение, получение, изомерия.
6. Арены: химические и физические свойства, строение, получение, изомерия.
7. Циклоалканы: химические и физические свойства, строение, получение, изомерия.
8. Спирты: химические и физические свойства, строение, изомерия и способы получения. Фенолы: химические свойства, способы получения, строение и изомерия.
9. Альдегиды и кетоны: химические и физические свойства, строение и изомерия, получение.
10. Карбоновые кислоты: химические и физические свойства, строение, номенклатура и изомерия, способы получения.
11. Сложные эфиры: химические и физические свойства, строение, получение, изомерия.
12. Жиры: химические и физические свойства, строение, получение.
13. Углеводы: химические и физические свойства, строение, получение.
14. Амины: химические и физические свойства, строение, получение, изомерия.
15. Аминокислоты: химические и физические свойства, строение, получение, изомерия.
16. Белки: химические и физические свойства, строение и получение.
17. Взаимосвязь разных классов органических веществ.
18. Качественные реакции в органической химии.
Характерные реакции в органической химии:
Реакция Дюма Электролиз солей карбоновых кислот Пиролиз метана Реакция Вагнера
Химия элементов
Часть 1. Химия щелочных металлов и их соединений. Пероксиды щелочных металлов. Гидроксиды щелочных металлов.
Часть 2. Химия щелочноземельных металлов. Оксиды щелочноземельных металлов. Гидроксиды щелочноземельных металлов.
Часть 3. Химия алюминия и его соединений. Оксид алюминия. Гидроксид алюминия. Соли алюминия.
Часть 4. Химия углерода. Оксид углерода (II) и оксид углерода (IV). Угольная кислота и ее соли (карбонаты и гидрокарбонаты).
Часть 5. Химия кремния. Оксид кремния (IV). Кремниевая кислота. Силан. Силикаты.
Часть 6. Химия азота и его соединений. Оксиды азота. Аммиак. Нитриды. Азотная кислота и азотистая кислота. Нитраты.
Часть 7. Химия фосфора и его соединений. Фосфин. Фосфиды металлов. Оксиды фосфора III и V. Фосфорные кислоты и их соли (фосфаты, гидрофосфаты и дигидрофосфаты, пирофосфаты и метафосфаты). Фосфористая кислота.
Часть 8. Химия кислорода и его соединений.
Часть 9. Химия серы и ее соединений. Сероводород и сульфиды. Оксиды серы – сернистый газ и серный ангидрид. Серная кислота и ее свойства. Сернистая кислота. Особенности химии сульфатов и сульфитов.
Часть 10. Химия галогенов и их соединений.
Часть 11. Химия d-элементов: железа, хрома, цинка, меди.
Часть 12. Химия водорода и его соединений.
Задачи: базовый блок
1. Атомно -молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Диагностические и тренировочные работы
Все реальные варианты КИМ ЕГЭ по химии
Тренировочная работа по химии в формате ЕГЭ 26 октября 2017 года
Тренировочная работа по химии для 11 классов 30 ноября 2017 года
Досрочный ЕГЭ по химии 25.03.2019
Видеоопыты
Видеоопыты по общей и неорганической химии
Видеоопыты по органической химии