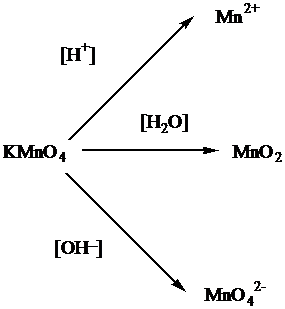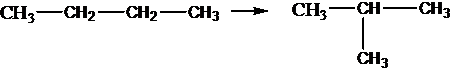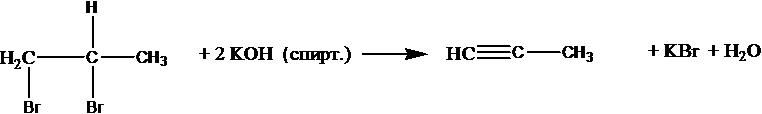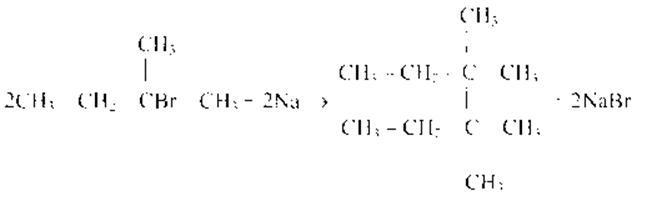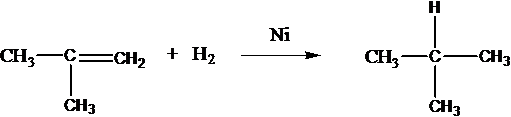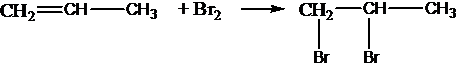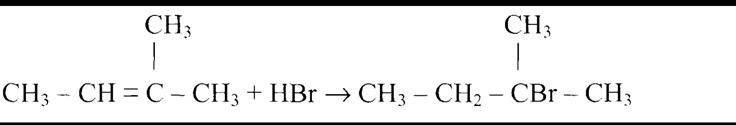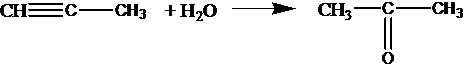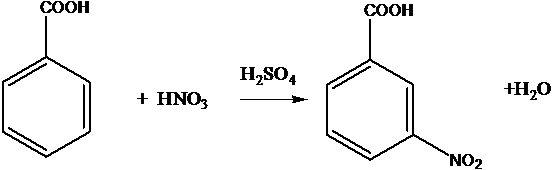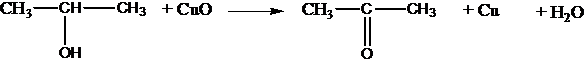2 октября 2017
В закладки
Обсудить
Жалоба
Несуществующие вещества
Что делать, если в правой части уравнения получается вещество с прочерком в таблице растворимости? Идет ли реакция или не идет, и если идет, то как?
В прикрепленном файле разобраны наиболее часто встречающиеся случаи: полный гидролиз, разложение иодидов и некоторые другие реакции. А также несколько заданий 32 из ЕГЭ, в которых встречаются подобные реакции.
Источник: vk.com/chem4you
ne-v.pdf
Список несуществующих неорганических соединений — информационный список формул и названий неорганических соединений, встречающихся в литературе, существование которых теоретически возможно, но которые не обнаружены в природе и не синтезированы в лабораторных условиях.
| № | Формула | Название | Комментарий |
|---|---|---|---|
| 2. |  |
гидроксид серебра | при попытке получения выпадает осадок оксида серебра Ag2O |
| 3. |  |
карбонат алюминия | не получен |
| 4. |  |
ортоалюминаты | не получены в водном растворе, получены сплавлением |
| 5. |  |
метамышьяковая кислота | не получена |
| 6. |  |
ортобораты | при реакции борной кислоты со щелочами в одном растворе образуются тетрабораты или соли других полиборных кислот, некоторые получены сухим сплавлением. |
| 7. |  |
бромистая кислота | не получена |
| 8. |  |
карбонат хрома (III) | не получен |
| 9. |  |
хлорид хрома (VI) | не получен |
| 10. |  |
иодид меди (II) | при попытке получения образуется CuI — иодид меди (I) |
| 11. |  |
карбонат железа (III) | не получен |
| 12. |  |
хлорид железа (VI) | не получен |
| 12. |  |
оксид железа (VIII) | не получен |
| 14. |  |
гидроксид железа (III) | при попытке получения образуется Fe2O3•nH2O или FeO(OH) |
| 15. |  |
сульфид железа (III) | не получен |
| 16. |  |
карбонат ртути (II) | не получен |
| 17. |  |
оксид ртути (I) | не получен |
| 18. |  |
сульфид ртути (I) | не получен; при действии раствора, содержащего сульфид-анион, на соли одновалентной ртути, выпадает осадок HgS и металлической ртути. |
| 26. |  |
фторид криптона (IV) | не получен |
| 26. |  |
криптонат бария | не получен |
| 19. |  |
хлорид марганца (VII) | не получен |
| 21. |  |
ортофосфат аммония | не получен, в отличие от гидрофосфата (NH4)2HPO4 и дигидрофосфата NH4H2PO4 |
| 12. |  |
фторид осмия (VIII) | не получен |
| 23. |  |
хлорид серы (VI) | не получен |
| 25. |  |
сернистая кислота | не получена, существует в форме гидрата SO2•nH2O |
| 26. |  |
хлорид селена (VI) | не получен |
| 27. |  |
карбонат олова (II) | не получен |
| 28. |  |
хлорид ванадия (V) | не получен |
| 29. |  |
триоксид тетраазота | не получен |
Вещества с некорректными формулами:
| № | Формула | Название | Комментарий |
|---|---|---|---|
| 1. |  |
оксид серебра(II) | формула некорректна, правильный состав: AgIIIAgIO2 — оксид серебра(III)-серебра(I) |
| 13. |  |
тетраоксид трижелеза | формула некорректна, правильный состав: FeIIFeIII2O4 — оксид дижелеза(II)-железа(III), магнетит |
 |
оксид железа (II, III) | ||
 |
феррат (III) железа (II) | ||
| 20. |  |
гидроксид аммония | правильно: гидрат аммиака NH3•H2O |
| 22. |  |
тетраоксид трисвинца | формула некорректна, правильный состав: Pb2IIPbIVO4 — оксид свинца(IV)-дисвинца(II) |
 |
оксид свинца(II, IV) | ||
 |
ортоплюмбат (IV) свинца (II) | ||
| 12. |  |
оксид серы (III) | формула не корректна, оказался смесью пиросульфатов катионов серы |
| 24. |  |
надсерная кислота, персульфаты | формула некорректна, правильно H2S2O6(O2) и S2O6(O2)2− — пероксодисерная кислота и пероксодисульфаты |
Литература
- Лидин Р.А., Андреева Л.Л., Молочко В.А. Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 22—24. — ISBN 5-7107-8085-5
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| 1.1 | Современные представления о строении атома | |
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов. | |
| 1.2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | |
| 1.2.1 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической таблицы химических элементов. | |
| 1.2.2 | Общая характеристика металлов IА–IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И.Менделеева и особенностям строения их атомов. | |
| 1.3 | Химическая связь и строение вещества | |
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов. | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения. | |
| 1.4 | Химическая реакция | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии. | |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения. | |
| 1.4.3 | Скорость реакции, ее зависимость от различных факторов. | |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | |
| 1.4.6 | Реакции ионного обмена. | |
| Особенности взаимодействия кислых солей со щелочами. | ||
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. | |
| Необратимый гидролиз бинарных соединений. | ||
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. | |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей,кислот). | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). | |
| 2.2 | Химические свойства простых веществ — металлов | |
| 2.2.1 | Характерные химические свойства щелочных металлов. | |
| 2.2.2 | Характерные химические свойства бериллия, магния и щелочноземельных металлов. | |
| 2.2.3 | Характерные химические свойства алюминия. | |
| 2.2.4 | Химические свойства переходных металлов (меди, цинка, хрома, железа). | |
| 2.3 | Химические свойства простых веществ — неметаллов | |
| 2.3.1 | Химические свойства водорода и галогенов. | |
| 2.3.2 | Химические свойства кислорода и серы. | |
| 2.3.3 | Химические свойства азота и фосфора. | |
| 2.3.4 | Химические свойства углерода и кремния. | |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных. | |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов. | |
| 2.6 | Характерные химические свойства кислот. | |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка). | |
| 3 | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная). | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). | |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6 | Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. | |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. | |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахарады, дисахариды, полисахариды) | |
| 3.8.1 | Жиры. | |
| 3.8.2 | Белки. | |
| 3.8.3 | Углеводы (моносахариды, дисахариды, полисахариды). | |
| 3.9 | Взаимосвязь органических соединений. | |
| 4 | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1 | Экспериментальные основы химии | |
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. | |
| 4.1.2 | Методы разделения смесей и очистки веществ. | |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы. | |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы. | |
| 4.1.5 | Качественные реакции органических соединений. | |
| 4.1.7 | Основные способы получения углеводородов. | |
| 4.1.8 | Основные способы получения кислородсодержащих соединений. | |
| 4.2 | Общие представления о промышленных способах получения важнейших веществ | |
| 4.2.1 | Понятие о металлургии: общие способы получения металлов. | |
| 4.2.2.1 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). | |
| 4.2.3 | Природные источники углеводородов, их переработка. | |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. | |
| 4.3 | Рачеты по химическим формулам и уравнениям реакций | |
| 4.3.1 | Расчеты с использованием понятия «массовая доля вещества в растворе». | |
| 4.3.2 | Расчеты объемных отношений газов при химических реакциях. | |
| 4.3.3 | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. | |
| 4.3.4 | Расчеты теплового эффекта реакции. | |
| 4.3.5 | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). | |
| 4.3.6 | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. |
Общая и неорганическая химия
По итогам прошлого года можно выделить задания, в которых большинство выпускников допустили ошибки. Из блока «Общая и неорганическая химия» это задания 19, 20, 24, 30, 31, 32 (соответственно, № 17, 18, 22, 29, 30, 31 в нумерации 2022 года).
Задание «Классификация химических реакций в неорганической и органической химии»
Большие трудности вызвало выполнение задания «Классификация химических реакций в неорганической и органической химии». Вероятная причина снижения результативности — изменение формы ответа: вместо фиксированных двух ответов необходимо выбрать все правильные (а их число может быть от двух до четырех).
При выполнении этого задания нужно внимательно анализировать каждое предложенное утверждение, а иногда подбираться к ответу от обратного: «это утверждение точно неверно».
Обратите внимание, что в ЕГЭ 2022 года таких заданий с открытым ответом стало три: №12, №17, №18.
Задание «Скорость химической реакции, ее зависимость от различных факторов»
По-видимому, та же причина привела и к низкой результативности выполнения задания «Скорость химической реакции, ее зависимость от различных факторов» (№18 в новом формате ЕГЭ). При выполнении нужно помнить, что все факторы, влияющие на скорость реакции, условно можно отнести к левой части уравнения. То есть продукты реакции на скорость не влияют никак. Важно не путать скорость реакции и смещение равновесия, помнить, что слово «катализатор» относится к скорости, но никак не к равновесию. А при повышении температуры реакция всегда идет с большей скоростью.
Павел Лисицын/РИА Новости
Задание «Обратимые и необратимые химические реакции. Химическое равновесие и его смещение под действием различных факторов»
Задание №22 — это задание на соответствие, то есть к каждому фактору нужно подобрать направление смещения равновесия.
Особые сложности вызывает анализ ответной реакции равновесной системы на внешнее воздействие, если это воздействие вызвано добавлением твердых веществ в растворы. В этом случае в растворе появляются дополнительные ионы, способные влиять на состояние химического равновесия. Здесь речь идет о факторе «концентрация». Но важно понять, будет ли менять концентрацию добавленное вещество.
Если в систему вносят нерастворимое вещество, то оно никак не смещает равновесие. Точно так же не смещает равновесие и растворимое вещество, если оно не принимает участия в реакции.
Но если растворимое вещество в своем составе содержит те же ионы, какие есть в уравнении, то нужно смотреть, с какой стороны увеличивается их концентрация, а равновесие, соответственно, смещается в другую сторону.
И еще один случай, когда добавленное растворимое вещество смещает равновесие — если оно реагирует с ионами, которые находятся в обратимой реакции, и уменьшает их концентрацию.
Задание «Реакции окислительно-восстановительные»
В задании №29 нужно продемонстрировать умение составлять уравнение окислительно-восстановительной реакции с учетом коэффициентов и электронный баланс к этой реакции. Но часто участники экзамена баланс не засчитывают, так как он составлен к уравнению, не отвечающему условиям задания.
Также выпускники допускают традиционные ошибки:
• неверно выбирают окислитель и восстановитель для реакции;
• записывают уравнения несуществующих химических реакций, которые теоретически не противоречат окислительно-восстановительным превращениям, но практически не осуществимы;
• записывают уравнения реакций, которые не отвечают условиям задания;
• не учитывают характер среды и возможные взаимодействия между продуктами (например, кислота+щелочь) или продуктов с исходными веществами.
При выполнении этого задания нужно учитывать, что не допускается использовать воду в качестве реагента, так как это оговорено в условии задания.
Баллы снимаются, если в балансе неверно определены или записаны степени окисления (сначала пишется знак, а потом цифра).
Также частая ошибка — это неверно записанные процессы окисления и восстановления и, соответственно, неверно определенные окислитель и восстановитель.
Помните: окислитель-грабитель окисляет, забирает электроны, понижает свою степень окисления. Досадной ошибкой, лишающей балла, становится отсутствие множителей в балансе, без которых не будет и самого баланса. Ведь баланс — это равенство, которое должно заключаться в том, что число отданных электронов равно числу принятых. Без множителей запись будет неверной.
Aleksander Polyakov/Global Look Press
Задание «Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена»
В задании №30 сразу снижает результативность, если в списке веществ для проведения реакции ионного обмена появляются кислые соли.
Следует придерживаться такого принципа: если для реакции взяли кислую соль, в продуктах никогда не получится основание, так как любая кислая соль будет сразу реагировать с основанием.
Если вы будете контролировать себя таким образом, это поможет вам избежать ошибок.
Выпускники часто допускают следующие типичные ошибки:
• неверно выбирают реагенты, например, выбирают вещества, взаимодействие которых не удовлетворяет условиям протекания реакций ионного обмена до конца;
• не сокращают коэффициенты в сокращенном ионном уравнении;
• неверно записывают формулы ионов;
• неправильно определяют и записывают заряды ионов (записывать нужно так, как в таблице растворимости: сначала цифру, потом знак).
Задание «Реакции, подтверждающие взаимосвязь классов неорганических веществ»
При выполнении задания №31 школьники часто невнимательно читают описание конкретного химического эксперимента. Следовательно, неверно записывают продукты реакции, что приводит к нарушению отражения генетической связи, идея которой заложена в задании.
Например, при смешивании твердых гидроксида натрия и иодида аммония и дальнейшем нагревании образуется только газообразный аммиак (гидрат не образуется!)
Часто не учитываются специфические свойства представителей различных классов неорганических веществ, например, соединений хрома, алюминия. Уравнение считается записанным неверно, если в нем пропущен даже один коэффициент, или ошибочно записан хотя бы один индекс в формуле. К сожалению, типичной является ошибка, когда вместо формулы сульфита пишут сульфид. Учите номенклатуру!
Комбинированная расчетная задача
Традиционно самым сложным заданием с самым низким процентом выполнения является комбинированная расчетная задача (№33).
Она сложная, ее выполнение требует целого комплекса знаний и умений, в том числе:
• умения анализировать условия;
• понимать суть химических процессов, отраженных в условии;
• составлять уравнения химических реакций (согласно данным условия задачи), необходимых для выполнения стехиометрических расчетов;
• выстраивать алгоритм решения веществ, выполнять расчеты, необходимые для нахождения ответа;
• логически обосновывать все этапы решения.
Кроме того, участники экзамена часто допускают арифметические ошибки, не указывают размерности физических величин, путаются в обозначениях.
Немаловажное значение имеет грамотная запись данных, извлеченных из условия задания, которая отражает обоснованный логический подход к решению задачи. Но многие выпускники этого не делают.
Если во время подготовки к экзамену вы чувствуете, что не можете решить ни одну из задач подобного типа, может быть, лучше уделить больше внимания другим заданиям?
Органическая химия
В блоке «Органическая химия» наибольшее число ошибок было допущено в заданиях №11 (Гомология и изомерия. Гибридизация), №13 (Свойства азотсодержащих органических веществ), №32 (Взаимосвязь органических веществ), №34 (Установление молекулярной и структурной формулы вещества).
Aleksander Polyakov/Global Look Press
Гомология и изомерия. Гибридизация
При выполнении задания №11 помните: гомологи — это всегда представители одного класса с разным числом атомов, а изомеры могут принадлежать и к одному классу, и к разным, но общая формула, то есть число атомов, у них всегда одинаковое.
Задание, проверяющее знание свойств азотсодержащих органических веществ, часто вызывает проблемы при выполнении. Возможно, это связано с тем, что, изучая свойства кислородсодержащих веществ, школьники обращают внимание на их кислотные свойства. А с азотом все наоборот: аминогруппа проявляет основные свойства за счет не поделенной электронной пары на атоме азота. И чем больше смещена электронная плотность к азоту, тем сильнее основные свойства.
Выполняя задания, относящиеся к органической химии, следует иметь в виду, что химические свойства веществ одного класса являются способами получения веществ другого класса.
И если вы вдруг забыли, с чем реагируют спирты, то, возможно, вспомните, из чего могут быть получены альдегиды.
Внимательно читайте текст задания! Не исключено, что вы найдете в нем подсказки для себя.
Цепочка превращений органических веществ
Задание №32 из года в год вызывает типичные ошибки. Выпускники неверно записывают формулы органических веществ:
• вместо структурной появляется молекулярная формула,
• добавление лишней черточки к азоту образует несуществующий пятивалентный азот,
• бензольное кольцо отображают с указанными сверху атомами углерода.
Помимо ошибочно написанных продуктов реакции, пропускаются коэффициенты, теряются побочные продукты. А еще иногда вместо уравнения реакции бывает записана схема, а это неправильно, потому что в схеме реагенты, а иногда и побочные продукты, записаны не в строке, а над стрелочкой.
Установление молекулярной и структурной формулы вещества
При выполнении задания №34 нужно:
• установить молекулярную формулу органического вещества на основании вычислений с использованием физических величин;
• установить структурную формулу по указанным свойствам или способам получения;
• составить уравнение реакции.
Типичные ошибки здесь такие:
1. вместо молекулярной формулы выводится простейшее соотношение, не позволяющее составить правильную структурную формулу органического вещества;
2. неполный анализ условия задачи приводит к составлению не существующей, придуманной формулы без ориентации на указанные в задании свойства или способы получения вещества.
Для выполнения этой задачи необходимо знать свойства органических веществ.
При повторении органики начните с углеводородов, усвойте для себя, как особенности строения влияют на свойства веществ. Далее — кислородсодержащие. Как их можно получить из углеводородов? В чем проявляется окисление кислородсодержащих веществ по ряду спирт-альдегид-кислота?
Окисление в органике — это появление в молекуле атомов кислорода и двойной связи перед ним.
Свойства азотсодержащих органических веществ
Повторяя свойства азотсодержащих, помните, что аминогруппа — основание. А если в аминокислотах присутствует и аминогруппа, и карбоксильная группа, значит, они являются амфотерными соединениями и реагируют как с кислотами, так и с основаниями.
Поскольку самое главное, что определяет свойства органических веществ, — это их строение, запомните, что реакции идут по функциональным группам или по особенностям связи (одинарные связи алканов позволяют протекать только реакциям замещения, а кратными связями обусловлены реакции присоединения).
Таким образом, при подготовке к экзамену по химии важно уметь выделять нужную информацию, анализировать ее и фиксировать этапы решения задачи.
Полезные ссылки для подготовки к ЕГЭ по химии
• Чтобы хорошо сдать экзамен по химии нужно готовиться, повторять теорию и выполнять практические задания. Найти их можно в открытом банке заданий на сайте Федерального института педагогических измерений.
• Полезными будут и записи вебинаров по разбору заданий ЕГЭ на сайте РЦОИ города Москвы.
• Другой вид подготовки — диагностика в формате ЕГЭ. Проверить свои знания и потренироваться в заполнении экзаменационных бланков школьники могут в Центре независимой диагностики Московского центра качества образования. Записаться на них можно в разделе Центра на сайте МЦКО.
• Кроме того, в Библиотеке «Московской электронной школы» есть виртуальная лаборатория по химии, в которой учащиеся могут проводить безопасные научные опыты с помощью компьютера или планшета, а затем использовать полученные знания на практике. Также выпускники могут проходить неограниченное количество раз самодиагностику.
Как показали результаты репетиционного экзамена по химии, наиболее трудными оказались задания, направленные на проверку знаний химических свойств веществ. К числу таких заданий можно отнести задание С3 – «Цепочка органических веществ», С2 – «Реакции между неорганическими веществами и их растворами».
При решении задания С3 «Цепочка органических веществ» учащийся должен написать пять уравнений химических реакций, среди которых одно является окислительно-восстановительным.
Рассмотрим составление одного из таких окислительно-восстановительных уравнений:
СН3СНО X1
Чтобы составить уравнение окислительно-восстановительной реакции с участием органических веществ, нужно научиться определять степень окисления в органическом веществе по его структурной формуле. Для этого нужно иметь знания о химической связи, знать, что такое электроотрицательность.
Структурная формула помогает оценить смещение электронов по каждой из связей. Так атом углерода метильной группы (–СН3) сместит электрон по каждой из связей к себе. Таким образом, степень окисления углерода метильной группы будет равна (-3). Атом углерода карбонильной группы (СО) отдаст 2 электрона атому кислорода, но частично компенсирует недостачу, приняв 1 электрон от атома водорода. Следовательно, его степень окисления будет равна +1:
В продукте реакции степень окисления углерода метильной группы не изменится. Карбонильная группа атомов превратится в карбоксильную с замещенным водородом на натрий, вследствие щелочной среды (-СООNa). Атом углерода карбоксильной группы сместит два электрона в сторону карбонильного кислорода и один электрон в сторону кислорода замещенной гидроксильной группы. Таким образом, степень окисления атома углерода карбоксильной группы будет равна (+3):
Следовательно, одна молекула этаналя отдает 2 электрона:
С+1-2е=С+3
Рассмотрим теперь процессы, происходящие с перманганатом натрия. Обращает внимание, что в схеме дан перманганат натрия, а не калия. Свойства перманганата натрия должны быть аналогичны свойствам перманганта калия, который в зависимости от кислотности среды способен давать различные продукты:
Так как в нашем случае перманганат натрия используется в щелочной среде, то продуктом реакции будет манганат ион – MnO42-.
Определим степень окисления иона марганца в перманганате калия NaMnO4 пользуясь правилом равенства числа положительных и отрицательных зарядов в нейтральной структурной единице вещества. Четыре кислорода каждый по (-2) дадут восемь отрицательных зарядов, так как степень окисления у калия +1, то у марганца будет +7:
Na+1Mn+7O4-2
Записав формулу манганата натрия Na2MnO4, определим степень окисления марганца:
Na2+1Mn+6O4-2
Таким образом, марганец принял один электрон:
Mn+7+1e=Mn+6
Полученные уравнения позволяют определить множители перед формулами в уравнении химической реакции, которые называют коэффициентами:
С+1-2е=С+3 ·1
Mn+7+1e=Mn+6 ·2
Уравнение реакции приобретет следующий вид:
2NaMnO4+CH3CHO+3NaOH=CH3COONa+2Na2MnO4+2H2O
Задание С2 требует от участника ЕГЭ знание свойств разнообразных свойств неорганических веществ, связанных с протеканием как окислительно-восстановительных реакций между веществами, находящимися как в одном, так и в различных агрегатных состояниях, так и обменных реакций протекающих в растворах. Такими свойствами могут быть некоторые индивидуальный свойства простых веществ и их соединений, например, реакция лития или магния с азотом:
2Li+3N2=2Li3N
2Mg+N2=Mg2N2
горение магния в углекислом газе:
Mg+CO2=MgO+CO
2Mg+CO2=2MgO+C
Особую трудность у учащихся вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов:
MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3¯+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2¯+2Na2SO4+2CO2
Традиционно трудны для написания уравнения с участием комплексных соединений. Так растворы амфотерных гидроксидов в избытке щелочи обладают всеми свойствами щелочей. Они способны вступать в реакции с кислотами и кислотными оксидами:
Na[Al(OH)4]+HCl=NaCl+Al(OH)3¯+H2O
Na[Al(OH)4]+2HCl=NaCl+Al(OH)2Cl+2H2O
Na[Al(OH)4]+3HCl=NaCl+Al(OH)Cl2+3H2O
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
Na[Al(OH)4]+CO2=NaHCO3+Al(OH)3¯
2Na[Al(OH)4]+CO2=Na2CO3+2Al(OH)3¯+H2O
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
На экзамене желательно помнить об окислительных свойствах солей трехвалентного железа:
2FeCl3+Cu=CuCl2+2FeCl2
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Традиционно вызывают затруднения, связанные с проявлением основных свойств раствором аммиака. В результате чего могут протекать обменные реакции в водных растворах:
MgCl2+2NH3+2H2O=Mg(OH)2+2NH4Cl
В заключение приведем серию уравнений химических реакций, которые нужно знать участникам ЕГЭ по химии:
ОБЩАЯ ХИМИЯ
Кислоты. Основания. Соли. Оксиды.
Кислотные оксиды (кроме SiO2) реагируют с водой, как амфотерным оксидом с образованием кислот:
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Для получения азотной кислоты азот оксид азота (IV) должен быть доокислен, например кислородом воздуха:
4NO2 + O2 + 2H2О = 4HNO3
Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту:
NaCl + H2SO4 = NaHSO4 + HCl
Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту:
NaBr+ H3PO4 = NaH2PO4 + HBr
Кислоты реагируют с металлами, стоящими в ряду напряжений до водорода:
Fe + 2 HCl = FeCl2 + H2
И их оксидами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Обратите внимание на валентность переходных элементов в солях.
Щелочные и щелочноземельные металлы взаимодействуют с водой:
K + H2O = KOH + ½ H2
В условиях избытка кислоты могут образовываться и кислые соли:
2Н3РО4 + 2Na = 2NaH2PO4 + Н2
Органические кислоты также проявляют кислотные свойства:
2СН3СООН + 2Na = 2CH3COONa + Н2
СНзСООН + NaOH = CH3COONa + Н2О
Комплексные гидроксиды реагируют с кислотами с образованием солей и воды:
Na[Al(OH)4] + HCl = AlCl3 + 4H2O + NaCl
LiOH + HNO3 = LiNO3 + H2O
Многоосновные кислоты в реакции с гидроксидами могут образовывать кислые соли:
Н3РО4 + КОН = КН2РО4 + Н2О
Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль:
NH3 + H3PO4 = NH4H2PO4
Обратим внимание на свойства оснований, их взаимодействие с кислотами:
2Н3РО4 + ЗСа(ОН)2 = Са3(РО4)2¯ + 6Н2О
с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3¯ + H2O
2Ca(OH)2 + CO2=(СaOH)2CO3+H2O
Реакция гидроксидов с кислотными оксидами может приводить и к кислым солям:
KOH + CO2 = KHCO3
Основные оксиды реагируют с амфотерными оксидами:
CaO + H2O = Ca(OH)2
Средние соли в воде реагируют с кислотными оксидами с образованием кислых солей:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Более сильные кислоты вытесняют более слабые из их солей:
CH3COONH4 + HCl = CH3COOH + NH4Cl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2
Кислоты в присутствии серной кислоты реагируют со спиртами с образованием сложных эфиров:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Более сильное основание вытесняет более слабое из его солей:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
MgCl2 + KOH = MgOHCl + KCl
NH4С1 + NaOH = NaCl + NH3 + H2O
Чтобы получить из основной соли получить среднюю соль нужно подействовать кислотой:
MgOHCl + HCl = MgCl2 + H2O
Гидроксиды металлов (кроме щелочных металлов) разлагаются при нагревании в твердом виде до оксидов:
2Al(OH)3 = Al2O3 + 3H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Гидрокарбонаты при нагревании разлагаются до карбонатов:
2KHCO3 = K2CO3 + H2O + CO2
Нитраты обычно разлагаются до оксидов (обратите внимание на повышение степени окисления переходного элемента находящегося в промежуточной степени окисления):
2Fe(NO3)2 = Fe2O3 + 4NO2 + 0,5O2
2Fe(NO3)3 ® Fe2O3 + 6NO2 + 1,5 O2
2Cu(NO3)2 = 2CuO + 4NO2 + О2
Нитраты щелочных металлов разлагаются до нитритов:
NaNO3 = NaNO2 + ½ O2
Карбонаты металлов (кроме щелочных) разлагаются до оксидов:
CaCO3 = CaO + CO2
При составлении уравнений реакций ионного обмена пользуйтесь таблицей растворимости:
K2SO4 + BaCl2 = BaSO4¯ + 2KCl
[C6H5-NH3]C1 + AgNО3 = [C6H5NH3]NO3 + AgCl¯
Электролиз
Электролиз расплавов солей:
2KCl = 2K + Cl2
Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода:
2HgSO4 + 2H2O = 2Hg + О2 + 2H2SO4
1) на катоде: Hg2+ + 2e = Hg°
2) на аноде: 2Н2О – 4е = О2 + 4Н+
Электролиз раствора сульфата натрия
1) на катоде: 2H2O + 2e = H2 + 2OH–
2) на аноде: 2H2O – 4e = O2 + 4H+
3) Составлено общее уравнение электролиза:
2H2O = 2H2 + O2
до водорода:
СаI2 + 2Н2О = Н2 + I2 + Са(ОН)2
1) на катоде: 2Н2О + 2e = 2ОН + Н2
2) на аноде: 2I— — 2e = I2
Сравните свойства одноэлементных и кислородсодержащих анионов.
Химические реакции, возможные при электролизе сульфата хрома (III):
1)Сг3+ + e = Сг2+
2) Cr2+ + 2e = Сг°
3) Сг3+ + 3 e= Сг°
4) 2Н+ + 2e = Н2
Электролиз водных растворов солей карбоновых кислот:
2CH3COONa + 2H2O = CH3CH3 + 2CO2 + H2 + 2NaOH
Гидролиз
Пример взаимного гидролиза солей:
A12(SO4)3 + 3K2CO3 + 3H2O = 2A1(OH)3 + 3CO2 + 3K2SO4
Амфотерность
Амфотерные гидроксиды растворяются в водных растворах щелочей:
A1(OH)3 + 3KOH = K3[A1(OH)6]
A1(OH)3 + KOH = K[Al(OH)4]
реагируют с твердыми щелочами при сплавлении:
Al(OH)3 + KOH KAlO2 + 2H2O
Амфотерные металлы реагируют с водными растворами щелочей:
Al + NaOH + 3H2O = Na[Al(OH)4] + 3/2 H2
Продукт сплавления амфотерного гидроксида со щелочью легко разлагается водой:
KAlO2 + 2H2O = KOH + Al(OH)3¯
Комплексные гидроксиды реагируют с кислотами:
K[Al(OH)4] + HCl =KCl + Al(OH)3¯ + H2O
Бинарные соединения
Способ получения:
СаО + 3С = СаС2 + СО
Бинарные соединения реагируют с кислотами:
Al2S3 + 3H2SO4 := Al2(SO4)3 + 3H2S
Mg3N2 + 8HNO3 = Mg(NO3)2 + 2NH4NO3
и водой:
A14C3 + 12Н2О = 4А1(ОН)3 + ЗСН4
PCl3 + H2O = 3H3PO3 + 3HCl
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Азот
Азотная кислота является сильным окислителем:
окисляют неметаллы:
ЗР + 5HNO3 + 2Н2О = Н3РО4 + 5NO
P + 5HNO3 = H3PO4 + 5NO2 + H2O
металлы:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 = 4Mg(NO3)2 + N2O + 5H2O
оксиды переходных металлов в промежуточных степенях окисления:
3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO+ 7H2O (возможно выделение NО2)
оксиды азота также проявляют окислительные свойства:
5N2O + 2P = 5N, + P2O
но по отношению к кислороду являются восстановителями:
2NO + O2 = 2NO2
Азот реагирует с некоторыми простыми веществами:
N2+3H2= 2NH3
N2 + O2 = 2NO
3Mg + N2 = Mg3N2
Галогены
обычно проявляют окислительные свойства:
PH3 + 4Br2 + 4Н2О = Н3РО4 + 8НВг
2P + 5Cl2 = 2PCl5
2P + 3PCl5 = 5PCl3
PH3 + 4Br2 + 4H2O = H3PO4 + 8HBr
Cl2 + H2 = 2HCl
2HCl + F2 = 2HF + Cl2
2NH3 + 3Br2 = N2 + 6HBr
Галогены в растворах щелочей диспропорционируют при комнатной температуре:
Cl2 + 2KOH = KCl + H2O + KClO
и при нагревании:
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Окислительные свойства перманганата калия:
5Н3РО3 + 2КМnО4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5Н3РО4 + ЗН2О
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
Сера
реагирует с простыми веществами:
S + O2 = SO2
3S + 2А1 = A12S3
оксид серы (IV) может быть доокислен кислородом:
2SO2 + O2 = 2SO3
2SO2 + O2 + 2H2O = 2H2SO4
и выступать в роли окислителя:
SO2 + 2H2S = 3S + 2H2O
Концентрированная серная кислота проявляет окислительные свойства:
Cu + H2SO4 = CuSO4 + SO2 +2H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Фосфор
получение фосфора:
Са3(Р04)2 + 5С + 3SiO2 = 3CaSiO3 + 5СО + 2Р
Металлы
реагируют с галогенами:
2Fe + 3Cl2 = 2FeCl3
Алюминий без оксидной пленки растворяется в воде:
Al (без оксидной пленки) + Н2О = Al(OH)3 + 3/2 H2
методы получения металлов:
Fe2O3 + CO = 2FeO + CO2
FeO + CO = Fe + CO2
CuO + H2 = Cu + H2O
Гидроксид железа (II) может быть легко доокислен пероксидом водорода:
2Fe(OH)2 + H2O2 = 2Fe(OH)3
обжиг пирита:
2FeS2 + O2 = Fe2O3 + 4SO2
ОРГАНИЧЕСКАЯ ХИМИЯ
Горение органических веществ
2С10Н22 + 31O2 = 20CО2 + 22H2О
Алканы
Методы получения алканов из простых веществ:
С + 2H2 = CH4
сплавлением солей щелочных металлов с щелочами:
СН3СООК + КОН ® СН4 + К2СО3
Химические свойства алканов — промышленное окисление метана:
CH4 + O2 = CH2O + H2O
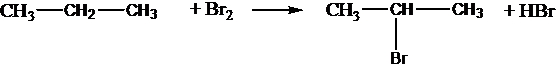
Взаимодействие алканов с галогенами:
С2Н6 + Сl2 С2Н5Сl + НСl
Изомеризация алканов:
Галогеналканы
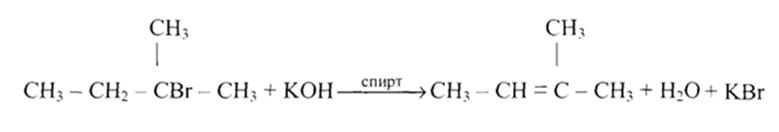
Реакция со спиртовыми растворами щелочей:
С6Н5-СНВг-СН3 + КОН  С6Н5СН=СН2 + КВг + Н2О
С6Н5СН=СН2 + КВг + Н2О
с водными растворами щелочей:
С6Н5-СНВг-СН3 + КОН (водн.) ® С6Н5-СНОН-СН3 + KBr
C6H5Br + KOH ® C6H5OH + KBr
По правилу Зайцева водород отщепляется от наименее гидрированного атома
Из дигалогеналканов можно получить алкины:
Реакция Вюрца:
Алкены
Присоединяют водород:
присоединяют галогены:
присоединяют галогенводороды:
присоединят воду:
СН2=СН2 + Н2О ® СН3СН2ОН
С водным раствором перманганата калия без нагревания образуют гликоли (двухатомные спирты)
ЗС6Н5СН=СН2 + 2КМnО4 + 4Н2О ® ЗС6Н5СН(ОН)-СН2ОН + MnO2¯ + 2KOH
Алкины
промышленный способ получения ацетилена
2СН4 ® С2Н2 + ЗН2
карбидный способ получения ацетилена:
CaC2 + 2H2O = Ca(OH)2 + C2H2
реакция Кучерова — альдегид можно получить только из ацетилена:
С2Н2 + Н2О СН3СНО
Реакция алкинов с концевой тройной связью с аммиачным раствором оксида серебра:
2CH3-CH2-CºCH + Ag2O 2CH3-CH2-CºCAg +H2O
использование полученных продуктов в органическом синтезе:
CH3-CH2-CºCAg + C2H5Br ® CH3-CH2-CºC-C2H5 + AgBr
Бензол и его производные
Получение бензола из алкенов:
из ацетилена:
3C2H2 C6H6
Нитрование бензола и его производных в присутствие серной кислоты
C6H6 + HNO3 ® C6H5-NO2 + H2O
карбоксильная группа является ориентантом второго рода
реакция бензола и его производных с галогенами:
C6H6 + Cl2 C6H5Cl + HCl
С6Н5С2Н5 + Вг2 С6Н5-СНВг-СН3 + НВг
галогеналканами:
C6H6 + С2Н5С1 C6H5C2H5 + НС1
алкенами:
C6H6 + CH2=CH-CH3 ® C6H5-CH(CH3)2
Окисление бензола перманганатом калия в присутствии серной кислоты при нагревании:
5C6H5-CH3 + 6KMnO4 + 9H2SO4 = 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O
Спирты
Промышленный способ получения метанола:
CO + 2H2 = CH3OH
при нагревании с серной кислотой в зависимости от условий могут образовываться простые эфиры:
2С2Н5OH C2Н5ОС2Н5 + Н2О
или алкены:
2С2Н5OH CH2=CH2 + H2O
спирты реагируют с щелочными металлами:
С2Н5OH + Na ® C2H5ONa + ½ H2
с галогенводородами:
СН3СН2ОН + НСl ® CH3CH2Cl + H2O
с оксидом меди (II):
СН3СН2ОН + СuO ® CH3CHO + Cu + H2O
более сильная кислота вытесняет более слабые из их солей:
C2H5ONa + HCl ® C2H5OH + NaCl
при нагревании смеси спиртов с серной кислотой образуются несимметричные простые эфиры:
Альдегиды
Образуют с аммиачным раствором оксида серебра серебряное зеркало:
CH3CHO + Ag2O CH3COONH4 + 2Ag
реагируют со свежеосажденным гидроксидом меди (II):
CH3CHO + 2Cu(OH)2 ® CH3COOH + 2CuOH + H2O
могут быть восстановлены до спиртов:
CH3CHO + H2 ® CH3CH2OH
окисляются перманганатом калия:
ЗСН3СНО + 2КМnО4® 2СН3СООК + СН3СООН + 2МnО2 + Н2О
Амины
можно получить восстановлением нитросоединений в присутствии катализатора:
C6H5-NO2 + 3H2 = C6H5-NH2 + 2H2O
реагируют с кислотами:
C6H5-NH2 + HC1 =[C6H5-NH3]C1
Углеводы
Глюкозу можно получить гидролизом крахмала или целлюлозы:
(С6Н10О5)n + n H2O = nC6H12O6
Для глюкозы характерно спиртовое брожение:
C6H12O6 ® 2C2H5OH + 2CO2
молочнокислое брожение:
C6H12O6 ® 2СН3СН(ОН)СООН
реакция серебряного зеркала:
C6H12O6+Ag2O 2Ag¯+C6H12O7
Аминокислоты
Аминокислоты реагируют как с кислотами:
H2N-CH-COOH+HCl ® Cl— H3N+-CH-COOH
так и c щелочами:
H2N-CH-COOH+NaOH ® H2N-CH-COONa+H2O
соли аминокислот также способны участвовать в реакциях обмена в водном растворе:
Cl— H3N+-CH-COOH+NaOH ® H2N-CH-COOH +NaCl + H2O
Cl— H3N+-CH-COOH+2NaOH ® H2N-CH-COONa +NaCl + 2H2O
H2N-CH-COONa+HCl ® H2N-CH-COOH +NaCl
H2N-CH-COONa+2HCl ® Cl— H3N+-CH-COOH +NaCl