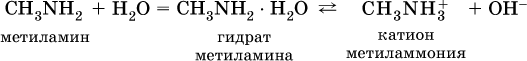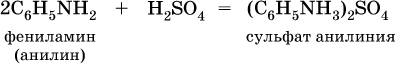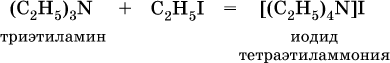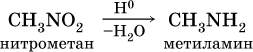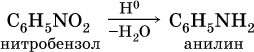Нитросоединения – это вещества, в которых алкильный или ароматический радикал связан с нитрогруппой —NO2.
В зависимости от типа углеводородного радикала, связанного с группой NO2, нитросоединения подразделяются на алифатические (жирные) и ароматические.
Простейший представитель алифатических нитросоединений – нитрометан:
CH3 –NO2
Ароматическое нитросоединение – нитробензол С6Н5–NO2:
Свойства нитросоединений
Восстановление нитросоединений
При восстановлении нитросоединений образуются первичные амины.
- Нитросоединения восстанавливаются водородом:
- Восстановление сульфидом аммония (реакция Зинина):
- Восстановление алюминием и цинком в щелочной среде.
Алюминий и цинк в щелочной среде образуют гидроксокомплексы.
В щелочной и нейтральной среде получаются амины. Восстановлением нитробензола получают анилин.
- Восстановление металлами в кислой среде.
Железо, олово и цинк в соляной кислоте реагируют с нитросоединениями с образованием солей аминов:
Амины из раствора соли выделяют с помощью щелочи:
Реакции замещения нитробензола
Нитробензол вступает в реакции замещения с образованием мета-замещенных продуктов в бензольном кольце.
Например, при хлорировании нитробензола образуется мета-хлорнитробензол:
Получение нитросоединений
Нитрование алканов и ароматических углеводородов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает избирательно.
Стретичный–Н > Свторичный–Н > Спервичный–Н
Например, при нитровании пропана образуется преимущественно 2-нитропропан
Ароматические углеводороды нитруются концентрированной азотной кислотой. Реакция катализируется концентрированной серной кислотой:
При нитровании толуола может получиться трёхзамещённая молекула (2,4,6-тринитротолуол, тротил):
Замещение галогена на нитрогруппу
При взаимодействии нитрита серебра с галогеналканами образуются амины:
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
это вещества, в которых алкильный или ароматический радикал связан с нитрогруппой -NO2.
Нитросоединения подразделяются на алифатические (жирные) и ароматические.
Простейший представитель алифатических нитросоединений – нитрометан CH3-NO2:
Простейшее ароматическое нитросоединение – нитробензол С6Н5-NO2:
ФИЗИЧЕСКИЕ СВОЙСТВА НИТРОСОЕДИНЕНИЙ
Низшие нитроалканы являются бесцветными жидкостями,
ароматические нитроалканы — бесцветными или желтоватыми легкоплавкими твёрдыми веществами со специфическим запахом, в воде практически нерастворимыми.
ХИМИЧЕСКИЕ СВОЙСТВА НИТРОСОЕДИНЕНИЙ.
1. Гидрирование водородом — образуются амины
органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы:
R-NH2, R2NH, R3N
Простейший представитель – метиламин:
Важнейший ароматический амин — анилин (аминобензол): С6H5-NH2 — ядовит.
Получают красители, взрывчатые вещества и лекарственные средства (сульфаниламидные препараты).
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Первые представители ряда аминов – метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N и этиламин C2H5NH2 – при комнатной температуре газообразные,
далее при увеличении числа атомов в радикале амины становятся жидкостями, а при увеличении длины цепи радикала до 10 атомов С – кристаллическими веществами.
Растворимость аминов в воде убывает по мере увеличения длины цепи радикала и при возрастании числа органических групп, связанных с азотом (переход к вторичным и третичным аминам).
Запах аминов напоминает запах аммиака, высшие (с большими радикалами) амины практически лишены запаха.
Анилин — бесцветная маслянистая жидкость, легко буреет на воздухе вследствие окисления; т. кип. 184° Анилин плохо растворим в воде, смешивается со спиртом, эфиром, бензолом
Водородные связи в аминах:
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства.
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
Поэтому амины и аммиак обладают свойствами оснований.
РЕАКЦИИ ПО АМИНОГРУППЕ (ОСНОВНЫЕ СВОЙСТВА).
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми.
1. В водном растворе образуют гидраты аминов — среда слабощелочная. Реакция обратима.
2. Взаимодействие с карбоновыми кислотами — образуются амиды кислот
3. С минеральными сильными кислотами образую соли
4. Реагируют с галогеналканами, образуя соли карбоновых кислот.
5. С солями тяжелых металлов в водных растворах образуют соли и основания.
ГОРЕНИЕ.
Амины сгорают в кислороде, образуя азот, углекислый газ и воду:
ОСОБЕННОСТИ СВОЙСТВ АНИЛИНА:
Реакции по аминогруппе и по бензольному кольцу.
Особенности этих реакций обусловлены взаимным влиянием атомов.
— бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
— бензольное кольцо становится более активным в реакциях замещения, чем бензол.
1. Бромирование анилина (качественная реакция на анилин) — образуется белый осадок.
Основные свойства у анилина проявляются слабее, чем у аммиака и аминов предельного ряда. Анилин не изменяет окраски лакмуса.
2. Взаимодействие с кислотами — образуются соли.
Взаимодействуют с карбоновыми кислотами, ангидридами карбоновых кислот, серной и азотной кислотами.
АМИНОКИСЛОТЫ — органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы -NH2.
Простейший представитель — аминоуксусная кислота H2N-CH2-COOH (глицин)
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ.
Твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы электропроводны.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H2N-CH2-COOH ⇄ +H3N-CH2-COO-
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА:
Аминокислоты — амфотерны, поэтому реагируют и с кислотами, и с основаниями
2. Как кислоты, реагируют с металлами до водорода, оксидами металлов, солями летучих кислот.
3. Реагируют со спиртами с образование сложных эфиров (в присутствии хлороводорода)
4. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ Α-АМИНОКИСЛОТ ПРИВОДИТ К ОБРАЗОВАНИЮ ПЕПТИДОВ.
При взаимодействии двух α-аминокислот образуется дипептид.
Фрагменты молекул аминокислот, образующие пептидную цепь, называются АМИНОКИСЛОТНЫМИ ОСТАТКАМИ, а связь CO–NH — ПЕПТИДНОЙ СВЯЗЬЮ.
Из трех молекул α-аминокислот (глицин+аланин+глицин) можно получить трипептид:
H2N-CH2CO-NH-CH(CH3)-CO-NH-CH2COOHглицилаланилглицин
- Информация о материале
- Автор: Super User
Смотреть видео:
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Алкены. Химические свойства. Все 18 реакций ЕГЭ.
Вурдихан Вурдиханов

Алкадиены. Химические свойства. Все 12 реакций ЕГЭ.
Вурдихан Вурдиханов

Алкины. Химические свойства. Все 20 реакций ЕГЭ.
Вурдихан Вурдиханов

Алкены. Химические свойства. Все 18 реакций ЕГЭ.
Вурдихан Вурдиханов
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
13.12.2019
- Комментарии
RSS
Написать комментарий
Нет комментариев. Ваш будет первым!
Ваше имя:
Загрузка…
Глава 7. НИТРОСОЕДИНЕНИЯ
=============================================================
Нитросоединения – это производные углеводородов, содержащие в своѐм составе одну или несколько нитрогрупп – NО2.
В зависимости от строения углеводородного радикала, с которым связана нитрогруппа, различают алифатические и ароматические нитросоединения. Алифатические могут быть насыщенными (нитроалканы) и ненасыщенными (нитроалкены, нитроалкины). Ароматические нитросоединения могут содержать нитрогруппу, непосредственно связанную с ароматическим ядром (нитроарены), и нитрогруппу в боковой цепи (нитроалкиларены). По расположению нитрогруппы в углеродной цепи нитросоединения подразделяют на первичные, вторичные и третичные:
|
R |
||||||||||||||||
|
R |
R |
|||||||||||||||
|
R |
CH2 |
NO2 |
CH |
NO2 |
C |
NO2 |
||||||||||
|
R |
R |
|||||||||||||||
|
первичное нитросоединение |
вторичное нитросоединение |
третичное нитросоединение |
По правилам заместительной номенклатуры ИЮПAK названия нитросоединений образуют от названия родоначальных углеводородов, прибавляя префикс нитро– и указывая положение нитрогруппы в углеродной цепи:
|
1 |
2 |
3 |
4 |
4 |
3 |
2 |
1 |
NO2 |
||||||||||||
|
CH2 |
CH2 |
CH2 |
CH3 |
CH3 |
CH2 |
CH |
CH3 |
CH3 |
C |
CH3 |
||||||||||
|
NO2 |
NO2 |
CH3 |
||||||||||||||||||
|
1-нитробутан |
2-нитробутан |
2-метил-2-нитропропан |
|
CН3 |
CН3 |
CН3 |
||||||||||
|
NO2 |
NO2 |
|||||||||||
|
NO2 |
||||||||||||
|
2-нитротолуол |
3-нитротолуол |
4-нитротолуол |
||||||||||
|
(орто-нитротолуол) |
(мета-нитротолуол) |
(пара-нитротолуол) |
Изомерия нитросоединений может быть обусловлена разной структурой углеродного скелета (изомерия цепи) как в 2-нитробутане и 2-метил-2- нитропропане или разным положением нитрогруппы в углеродной цепи (изомерия положения) как в 1-нитробутане и 2-нитробутане, а также в 2- нитротолуоле, 3-нитротолуоле, 4-нитротолуоле.
Электронное строение нитрогруппы можно представить с помощью двух граничных структур, в которых один из атомов кислорода образует с атомом азота двойную, а другой – семиполярную связь. Однако в реальной молекуле химические связи обоих атомов кислорода с атомом азота равноценны и
184

отрицательный заряд равномерно распределѐн между двумя атомами кислорода:
|
+ |
O |
+ |
O |
|
|
R |
N O |
R N |
O |
|
|
.O |
||||
|
+. |
||||
|
. |
||||
|
. |
||||
|
R |
. |
|||
|
N . |
||||
|
O |
============================================================
7.1. НИТРОАЛКАНЫ
============================================================
7.1.1. СПОСОБЫ ПОЛУЧЕНИЯ НИТРОАЛКАНОВ
Нитрование алканов (реакция Коновалова). При нагревании алканов с
разбавленной азотной кислотой (10–25%) при температуре около 140 0С и повышенном давлении происходит замещение одного из атомов водорода нитрогруппой (см. раздел «Алканы»):
|
CH3 + HNO 3(разб.) |
t, p |
CH3 |
+ H2O |
||||||||
|
CH3 |
CH2 |
CH3 |
CH |
||||||||
|
NO2 |
|||||||||||
|
пропан |
2-нитропропан |
Реакция протекает по свободнорадикальному механизму:
|
t, p |
|||||
|
HONO 2 |
HO. + NO.2 |
||||
|
R |
H + HO. |
R. + H2O |
|||
|
R. + HONO 2 |
R |
NO2 + HO. |
|||
|
и т. д. |
Наиболее легко нитрогруппой замещается водород у третичного атома углерода, затем у вторичного и, наконец, у первичного.
Взаимодействие галогеналканов с солями азотистой кислоты.
Первичные и вторичные галогеналканы под действием нитритов натрия, калия, серебра в среде апротонного растворителя образуют преимущественно нитроалканы:
|
C2H5 |
Cl + NaNO2 |
C2H5 |
NO2 + NaCl |
|||
|
хлорэтан |
нитроэтан |
Взаимодействие алифатических –галогенокарбоновых кислот с солями азотистой кислоты. Алифатические –галогенокарбоновые кислоты под действием растворов нитрита натрия или калия превращаются в –
185

нитрокарбоновые кислоты, при декарбоксилировании которых получаются нитроалканы:
|
CH2 |
COOH |
+ |
NaNO2 |
CH2 |
COOH |
NaОН |
||||||||||||
|
— NaCl |
— Н2О |
|||||||||||||||||
|
Cl |
NO2 |
|||||||||||||||||
|
хлоруксусная кислота |
нитроуксусная кислота |
|||||||||||||||||
|
CH2 |
COONa |
NaОН |
CH3 |
NO2 + Na2CО3 |
||||||||||||||
|
NO2 |
||||||||||||||||||
|
натриевая соль |
нитрометан |
нитроуксусной кислоты
7.1.2. ХИМИЧЕСКИЕ СВОЙСТВА НИТРОАЛКАНОВ
Химические свойства нитроалканов определяются в основном наличием в их молекуле нитрогруппы. Будучи сильным акцептором электронной плотности нитрогруппа повышает кислотность атомов водорода при α- углеродном атоме. Реакции нитроалканов происходят с участием нитрогруппы и α-углеродного атома.
Аци-нитро-таутомерия, образование солей. Нитроалканы (первичные и вторичные) способны переходить в таутомерные им аци-нитроформы, обладающие кислыми свойствами:
|
R |
+ |
O |
+ OН |
|||||||||||||||||
|
СН |
N O |
R |
СН |
N O |
||||||||||||||||
|
Н |
||||||||||||||||||||
|
нитроформа |
аци-нитроформа |
Такая таутомерия называется аци-нитро-таутомерия. В нейтральной среде равновесие почти полностью смещено в сторону нитро-формы. В щелочной – в сторону аци-нитроформы. Так, первичные и вторичные нитроалканы растворяются в водном растворе щѐлочи, превращаясь в соли:
|
O |
+ OН |
Na+ |
|||||||||||||||||||||||||||||
|
R |
СН |
+ |
NaOH |
+ |
O |
||||||||||||||||||||||||||
|
N O |
R |
СН |
N O |
R |
СН |
N |
O |
||||||||||||||||||||||||
|
— H2O |
|||||||||||||||||||||||||||||||
|
Н |
|||||||||||||||||||||||||||||||
|
нитроформа |
аци-нитроформа |
Первичные и вторичные нитроалканы и им подобные соединения, которые в свободном состоянии не обладают кислыми свойствами, но могут под влиянием щелочей переходить в таутомерные аци-формы, обладающие кислотными свойствами и способные давать солеобразные соединения,
называются псевдокислотами.
Наиболее устойчивой является аци-форма жирно-ароматических нитросоединений, в которой двойная азот-углеродная связь сопряжена с бензольным кольцом. Это стабилизирует структуру аци-формы. Например, достаточно устойчивой является аци-форма фенилнитрометана:
186

|
+ O |
+ OН |
||||||||||||||||||||||||||
|
СН |
N O |
СН |
N O |
||||||||||||||||||||||||
|
Н |
аци-нитроформа фенилнитрометана |
||||||||||||||||||||||||||
|
нитроформа фенилнитрометана |
Восстановление нитроалканов. Нитроалканы под действием восстановителей (водород над никелем Ренея, железо в присутствии соляной кислоты, алюмогидрид лития и др.) превращаются в алифатические амины:
|
CH3 |
CH2 |
NО2 + 6 H |
CH3 |
CH2 |
NH2 + 2 H2O |
|||||
|
нитроэтан |
этиламин |
Взаимодействие нитроалканов с альдегидами и кетонами. Первичные и вторичные нитроалканы в слабощелочной среде конденсируются с альдегидами и кетонами за счѐт атомов водорода, находящихся при α- углеродном атоме по отношению к нитрогруппе. Причѐм с формальдегидом реагируют все имеющиеся в нитроалкане α-водородные атомы (в нитроэтане – два, в нитрометане – три):
|
H |
СН2OH |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
O |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CH3COOK |
NО2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CH3 |
CH |
NО2 + H |
C |
CH3 |
CH |
||||||||||||||||||||||||||||||||||||||||||||||||
|
H |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
нитроэтан |
формальдегид |
2-нитропропанол-1 |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
O |
СН2OH |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
H |
C |
H |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
CH3 |
C |
NО2 |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
СН2OH |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2-метил-2-нитропропандиол-1,3 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
H |
СН2OH |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
O |
CH3COOK |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CH2 |
NО2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CH2 |
NО2 |
+ H |
C H |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
нитрометан |
формальдегид |
2-нитроэтанол-1 |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
O |
СН2OH |
O |
СН2OH |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
H |
C |
H |
H |
C |
H |
||||||||||||||||||||||||||||||||||||||||||||||||
|
NО2 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CН |
О2N |
C |
СН2OH |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
СН2OH |
СН2OH |
2-нитропропандиол-1,3 2-метилол-2-нитропропандиол-1,3 (триметилолнитрометан)
С другими альдегидами реагирует только один α-водородный атом первичного нитроалкана. Образующийся при этом нитроалканол, как правило, отщепляет молекулу воды с образованием непредельного нитросоединения:
187

|
H |
CH3 |
СН |
OH |
|||||||||||||||||||||||
|
O |
||||||||||||||||||||||||||
|
CH3COOK |
||||||||||||||||||||||||||
|
NО2 |
||||||||||||||||||||||||||
|
R |
CH |
NО2 + CH3 |
C H |
R |
CH |
|||||||||||||||||||||
|
R |
C |
СН |
CH3 |
|||||||||||||||||||||||
|
— H2O |
||||||||||||||||||||||||||
|
NО2 |
Вторичные нитроалканы содержат всего углеродном атоме, поэтому конденсируются с давая разветвлѐнные нитроалканолы:
|
H |
|||||||||
|
O |
CH3COOK |
||||||||
|
R |
C |
NО2 + CH3 |
C |
H |
|||||
|
R |
один атом водорода при α- одной молекулой альдегида,
NО2 OH
R C СН CH3
R
Реакции с кетонами протекают подобным образом и всегда приводят к образованию разветвлѐнных соединений.
=============================================================
7.2.АРОМАТИЧЕСКИЕ НИТРОСОЕДИНЕНИЯ
=============================================================
7.2.1. МЕТОДЫ ПОЛУЧЕНИЯ АРОМАТИЧЕСКИХ НИТРОСОЕДИНЕНИЙ
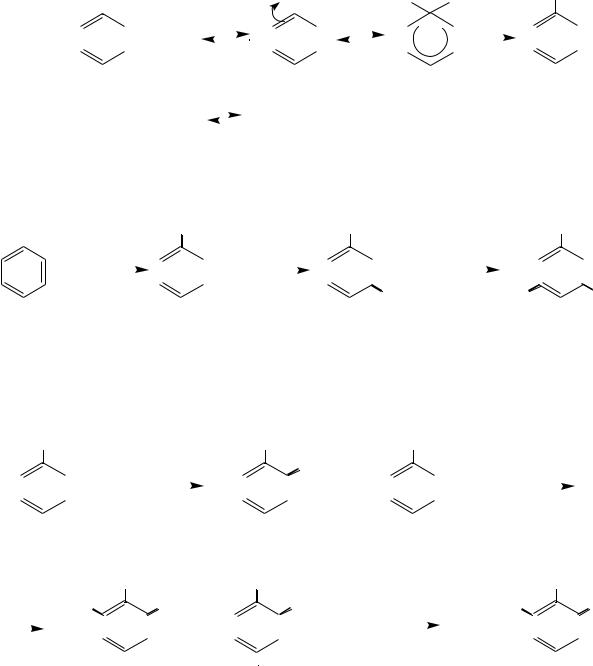
Нитрование аренов. Нитросоединения, содержащие нитрогруппу в ароматическом ядре, получают по реакции электрофильного замещения атома водорода в ароматическом ядре на нитрогруппу NO2 под действием смеси концентрированных азотной и серной кислот (нитрующей смеси) (см. раздел «Одноядерные арены»):
|
H2SO4; 600C |
NO2 |
|||||||
|
+ HNO 3 |
+ H2O |
|||||||
нитробензол
Атакующей электрофильной частицей в этой реакции является ион нитрония NO2+, который образуется в результате кислотно-основной реакции между азотной и серной кислотами, где азотная кислота играет роль основания:
|
1. |
H SO |
H + + |
HSO — |
|||||||||||||||||||||
|
2 |
4 |
4 |
||||||||||||||||||||||
|
2. |
.. |
NO |
+ H + |
+ |
NO |
+ |
||||||||||||||||||
|
H |
O |
H |
O |
H O |
+ |
NO |
||||||||||||||||||
|
.. |
2 |
2 |
2 |
2 |
||||||||||||||||||||
|
H |
||||||||||||||||||||||||
|
188 |
|
H |
+ |
H |
NO2 |
|||||||||||||||||||||||||||
|
+ |
+ |
O2N |
O2N |
H |
||||||||||||||||||||||||||
|
3. |
NO2 |
+ |
||||||||||||||||||||||||||||
|
+ |
||||||||||||||||||||||||||||||
|
— H |
||||||||||||||||||||||||||||||
|
бензол |
комплекс |
комплекс |
нитробензол |
|||||||||||||||||||||||||||
|
4. |
H + + |
HSO — |
H SO |
|||||||||||||||||||||||||||
|
4 |
2 |
4 |
Для введения второй нитрогруппы требуются более жесткие условия, а введение третьей нитрогруппы происходит с большим трудом:
|
NO2 |
NO2 |
NO2 |
||||||||||||
|
HNO3; H2SO4 |
HNO3; H2SO4 |
HNO3; H2SO4 |
||||||||||||
|
— H2O |
— H2O |
— H2O |
О2N |
NO2 |
||||||||||
|
NO2 |
||||||||||||||
|
нитробензол |
1,3-динитробензол |
1,3,5-тринитробензол |
При наличии в ядре арена электронодонорных заместителей реакция нитрования значительно облегчается и в обычных условиях удаѐтся ввести в
молекулу три нитрогруппы:
|
CH3 |
CH3 |
CH3 |
|||||||||||||||||||||||||||||||||
|
2HNO ; H SO |
NO2 |
2HNO ; H SO |
|||||||||||||||||||||||||||||||||
|
2 |
3 |
2 |
4 |
+ |
3 |
2 |
4 |
||||||||||||||||||||||||||||
|
— 2H2O |
— 2H2O |
||||||||||||||||||||||||||||||||||
|
метилбензол |
NO2 |
||||||||||||||||||||||||||||||||||
|
(толуол) |
2-нитротолуол |
4-нитротолуол |
|||||||||||||||||||||||||||||||||
|
CH3 |
CH3 |
CH3 |
|||||||||||||||||||||||||||||||||
|
О2N |
NO2 |
NO2 |
2HNO ; H SO |
О2N |
NO2 |
||||||||||||||||||||||||||||||
|
+ |
3 |
2 |
4 |
2 |
|||||||||||||||||||||||||||||||
|
— 2H2O |
|||||||||||||||||||||||||||||||||||
|
NO2 |
NO2 |
||||||||||||||||||||||||||||||||||
|
2,6-динитротолуол |
2,4-динитротолуол |
2,4,6-тринитротолуол |
|||||||||||||||||||||||||||||||||
|
(тол, тротил) |
1,3,5-Тринитробензол и 2,4,6-тринитротолуол – взрывчатые вещества, использующиеся в военных целях. В частности, тол плавится при температуре 81 оС, а взрывается при 280 оС. Это позволяет его плавить и в жидком состоянии разливать в формы.
7.2.2. ХИМИЧЕСКИЕ СВОЙСТВА АРОМАТИЧЕСКИХ НИТРОСОЕДИНЕНИЙ
Реакционная способность нитроаренов обусловлена наличием в их структуре нитрогруппы и ароматического ядра и их взаимным влиянием друг на друга.
189
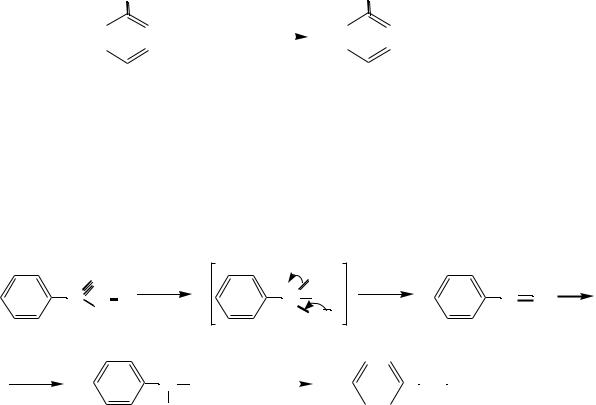
Восстановление ароматических нитросоединений (реакция Зинина).
Одно из наиболее важных свойств нитрогруппы – еѐ способность восстанавливаться в аминогруппу. Впервые нитробензол был восстановлен в анилин в 1842 году Н.Н. Зининым. В качестве восстановителей наиболее часто используют железо, олово или цинк в соляной кислоте, сульфид аммония, гидросульфид натрия и др. Ароматические амины являются конечными продуктами восстановления нитроаренов.
|
NО2 |
NH2 |
|||||||
|
+ 6 H |
+ 2 H2O |
|||||||
|
нитробензол |
анилин |
Реакция протекает в несколько стадий. В зависимости от условий восстановления можно выделить различные промежуточные продукты. В нейтральной и кислой среде в качестве промежуточных образуются ароматические нитрозосоединения и арилгидроксиламины. Причѐм в нейтральной среде восстановление можно остановить на любой стадии. В кислой среде выделить промежуточные продукты невозможно:
|
+ O |
2 Н |
+ |
Н |
.. |
|
|
N O |
N |
OН |
— Н2О |
N O |
|
|
O |
|||||
нитрозобензол
|
2 Н |
.. |
||||||||
|
N |
Н |
||||||||
|
— Н2О |
|||||||||
|
Н |
|||||||||
|
фенилгидроксиламин |
анилин |
В щелочной среде промежуточные нитрозосоединения конденсируются с арилгидроксиламинами, давая азоксисоединения, которые последовательно восстанавливаются до азосоединений, гидразосоединений и, наконец, до ариламинов.
Реакции по ароматическому кольцу. Являясь ориентантом II рода,
нитрогруппа дезактивирует ароматическое кольцо по отношению к электрофильным реагентам, поэтому ароматические нитросоединения вступают в реакции электрофильного замещения (нитрование, сульфирование, галогенирование) в более жѐстких условиях, чем незамещѐнные ароматические углеводороды. Алкилирование нитробензола по Фриделю-Крафтсу вообще не происходит. Входящие электрофильные реагенты нитрогруппа направляет в мета-положение:
190
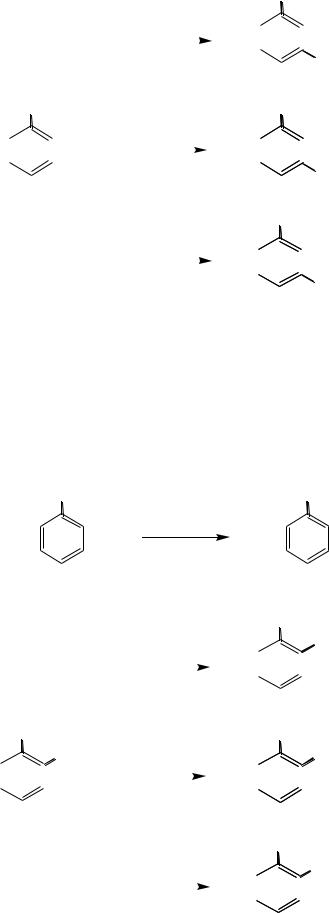
|
NO2 |
|||||||||||
|
HNO3 |
+ |
H2O |
|||||||||
|
H2SO4 |
|||||||||||
|
NO2 |
|||||||||||
|
1,3-динитробензол |
|||||||||||
|
NO2 |
NO2 |
||||||||||
|
H2SO4 |
+ |
H2O |
|||||||||
|
SO3H |
|||||||||||
|
нитробензол |
3—нитробензолсульфокислота |
||||||||||
|
NO2 |
|||||||||||
|
Br2 |
+ |
HBr |
|||||||||
|
AlBr3 |
|||||||||||
|
Br |
|||||||||||
|
1—бром-3-нитробензол |
Благодаря сильно выраженному электроноакцепторному характеру нитрогруппа оказывает значительное влияние на атомы и группы атомов, находящиеся по отношению к ней в орто- и пара-положениях. Например, если для гидролиза хлорбензола нужны очень жѐсткие условия, то хлор в орто- (или пара-) нитрохлорбензоле под влиянием нитрогруппы приобретает высокую подвижность и легко замещается:
|
Cl |
OH |
||
|
KOH |
+ |
KCl |
|
|
500 oC; 500 атм. |
|||
|
хлорбензол |
фенол |
|
OH |
||||||||||||
|
NaOН; H2O |
NO2 |
|||||||||||
|
+ |
NaCl |
|||||||||||
|
130 оС |
||||||||||||
|
орто-нитрофенол |
||||||||||||
|
Cl |
NH2 |
|||||||||||
|
NO2 |
2 NH3 |
NO2 |
||||||||||
|
+ |
NH4Cl |
|||||||||||
|
о |
||||||||||||
|
орто-нитрохлорбензол |
160 С |
орто-нитроанилин |
||||||||||
|
OCH3 |
||||||||||||
|
CH OH |
NO2 |
|||||||||||
|
3 |
+ |
KCl + H2O |
||||||||||
|
KOH |
||||||||||||
|
1—метокси-2-нитробензол |
||||||||||||
191
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Очень важны в народном хозяйстве азотсодержащие органические вещества. Азот может входить в органические соединения в виде нитрогруппы NO2, аминогруппы NH2 и амидогруппы (пептидной группы) – C(O)NH, причем всегда атом азота будет непосредственно связан с атомом углерода.
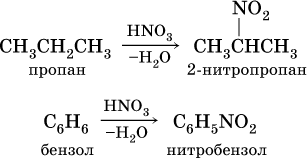
Нитросоединения получают при прямом нитровании предельных углеводородов азотной кислотой (давление, температура) или при нитровании ароматических углеводородов азотной кислотой в присутствии серной кислоты, например:
Низшие нитроалканы (бесцветные жидкости) используются как растворители пластмасс, целлюлозного волокна, многих лаков, низшие нитроарены (желтые жидкости) – как полупродукты для синтеза аминосоединений.
Амины (или аминосоединения) можно рассматривать как органические производные аммиака. Амины могут быть первичными R – NH2, вторичными RR’NH и третичными RR’R» N, в зависимости от числа атомов водорода, которые замещены на радикалы R, R’, R». Например, первичный амин — этиламин C2H5NH2, вторичный амин — дижетиламин (CH3)2NH, третичный амин – триэтиламин (C2H5)3N.
Амины, как и аммиак, проявляют основные свойства, они в водном растворе гидратируются и диссоциируют как слабые основания:
а с кислотами образуют соли:
Третичные амины присоединяют галогенпроизводные с образованием солей четырехзамещенного аммония:
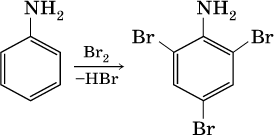
Ароматические ажины (в которых аминогруппа связана непосредственно с бензольным кольцом) являются более слабыми основаниями, чем алкиламины, из-за взаимодействия неподеленной пары электронов атома азота с ?-электронами бензольного кольца. Аминогруппа облегчает замещение водорода в бензольном кольце, например на бром; из анилина образуется 2,4,6-триброманилин:
Получение: восстановление нитросоединений с помощью атомарного водорода (получают либо непосредственно в сосуде по реакции Fe + 2НCl = FeCl2 + 2Н0, либо при пропускании водорода Н2 над никелевым катализатором Н2 = 2Н0) приводит к синтезу первичных аминов:
a)
б) реакция Зинина
Амины используются в производстве растворителей для полимеров, лекарственных препаратов, кормовых добавок, удобрений, красителей. Очень ядовиты, особенно анилин (желто-коричневая жидкость, всасывается в организм даже через кожу).
Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная
группой аминов является аминогруппа — NH2.

Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.

Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом,
у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин,
пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.

Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.

Получение
- Нагревание галогеналканов с аммиаком
- Восстановление нитросоединений
- Восстановление амидов
- Восстановление нитрилов
- Реакция аммиака со спиртами
- Реакция галогеналканов с аминами
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.

При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина
и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.

Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.

Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.

В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.


Химические свойства аминов
- Основные свойства
- Реакция с азотистой кислотой
- Конденсация аминов с альдегидами и кетонами
- Разложение солей аминов
- Горение аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.

Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.

При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.

При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая
температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.






![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)