Александр Есманский,
преподаватель Олимпиадных школ МФТИ по химии, репетитор ЕГЭ и ОГЭ,
автор и составитель методических разработок
Задание № 30
Что требуется
Из предложенного перечня веществ необходимо выбрать те, между которыми возможно протекание окислительно-восстановительной реакции (ОВР), записать уравнение этой реакции и подобрать в ней коэффициенты методом электронного баланса, а также указать окислитель и восстановитель.
Особенности
Это одно из самых сложных заданий ЕГЭ по предмету, поскольку оно проверяет знание всей химии элементов, а также умение определять степени окисления элементов. По этим данным нужно определить вещества, которые могут быть только окислителями (элементы в составе этих веществ могут только понижать степень окисления), только восстановителями (элементы в составе этих веществ могут только повышать степень окисления) или же проявлять окислительно-восстановительную двойственность (элементы в составе этих веществ могут и понижать, и повышать степень окисления).
Также в задании необходимо уметь самостоятельно (без каких-либо указаний или подсказок) записывать продукты широкого круга окислительно-восстановительных реакций. Кроме того, нужно уметь грамотно оформить электронный баланс, после чего перенести полученные в балансе коэффициенты в уравнение реакции и дополнить его коэффициентами перед веществами, в которых элементы не изменяли степеней окисления.
Советы
Окислительно-восстановительные реакции основаны на принципе взаимодействия веществ противоположной окислительно-восстановительной природы. Согласно этому принципу любой восстановитель может взаимодействовать практически с любым окислителем. В задаче № 30 окислители и восстановители часто подобраны таким образом, что между ними точно будет протекать реакция.
Для нахождения пары окислитель/восстановитель нужно, прежде всего, обращать внимание на вещества, содержащие элементы в минимальной и максимальной степени окисления. Тогда вещество с минимальной степенью окисления будет являться типичным восстановителем, а вещество с максимальной степенью окисления с большой долей вероятности окажется сильным окислителем.
Если в списке только одно вещество (вещество 1) содержит элемент в максимальной или минимальной степени окисления, нужно найти ему в пару вещество, в котором элемент находится в промежуточной степени окисления и может проявлять свойства и окислителя, и восстановителя (вещество 2). Тогда вещество 1 определит окислительно-восстановительную активность вещества 2.
Когда пара окислитель/восстановитель определена, нужно обязательно проверить, в какой среде (кислой, нейтральной или щелочной) может протекать эта реакция. Если нет особенных правил, связанных со средой протекания выбранной реакции, то в качестве среды следует выбрать водный раствор того вещества (кислоты или щелочи), которое есть в предложенном списке реагентов.
Чтобы верно записать продукты окислительно-восстановительной реакции, нужно знать теоретические сведения о химии того или иного вещества и специфику его свойств. Однако запоминать все реакции наизусть — дело утомительное, да и не очень полезное. Для того чтобы упростить задачу, можно выявить некоторые общие закономерности в протекании ОВР и научиться предсказывать продукты реакций. Для этого нужно следовать трем простым правилам:
- Процессы окисления и восстановления — это две стороны единого процесса: процесса передачи электрона. Если какой-либо элемент (восстановитель) отдает электроны, то в этой же реакции обязательно должен быть какой-то элемент (окислитель), который принимает эти электроны.
- Если в реакции участвует простое вещество, эта реакция — всегда окислительно-восстановительная.
- При взаимодействии сильных окислителей с различными восстановителями обычно образуется один и тот же основной продукт окисления. Многие окислители при взаимодействии с различными восстановителями также часто восстанавливаются до какого-то одного продукта, соответствующего их наиболее устойчивой степени окисления.
Задание № 31
Что требуется
Из предложенного перечня веществ (того же, что и в задании № 30) необходимо выбрать такие вещества, между которыми возможна реакция ионного обмена. Необходимо записать уравнение реакции в молекулярной форме и привести сокращенную ионную форму.
Особенности
Это задание значительно легче предыдущего, поскольку круг возможных реакций ограничен и определен условиями протекания реакций ионного обмена, которые школьники изучают еще в 8-9 классах.
Советы
Нужно помнить, что любая реакция ионного обмена — это обязательно реакция, протекающая в растворе. Все реакции ионного обмена являются неокислительно-восстановительными!
В реакциях ионного обмена могут участвовать:
- солеобразующие оксиды;
- основания и амфотерные гидроксиды;
- кислоты;
- соли (средние, кислые, основные). Теоретически можно составить реакцию ионного обмена с участием смешанных, двойных или комплексных солей, но это для задания № 31 — экзотика.
Чаще всего в этой задаче встречаются реакции ионного обмена с участием оснований, амфотерных гидроксидов, кислот и средних солей. Однако обмен ионами может осуществляться далеко не с любыми парами веществ. Для того чтобы протекала реакция ионного обмена, необходимо выполнение некоторых ограничительных условий, которые связаны с реагентами и продуктами реакции.
Для написания ионных форм уравнений нужно следовать правилам, согласно которым одни вещества представляются в диссоциированной форме (в виде ионов), а другие — в недиссоциированной (в виде молекул).
Расписываем на ионы в реакциях ионного обмена:
- растворимые сильные электролиты;
- малорастворимые сильные электролиты, если они являются реагентами.
Не расписываем на ионы в реакциях ионного обмена:
- неэлектролиты;
- нерастворимые в воде вещества;
- слабые электролиты;
- малорастворимые сильные электролиты, если они являются продуктами реакции.
Когда уже сокращенная форма реакции ионного обмена записана, будет нелишним проверить для нее выполнение материального и электрического баланса. Другими словами, верно ли расставлены в сокращенной форме коэффициенты и сохраняется ли общий электрический заряд в левой и правой частях уравнения. Это позволит избежать потерянных коэффициентов или зарядов ионов на пути от молекулярной формы через полную ионную — к сокращенной.
Задание № 32
Что требуется
По приведенному текстовому описанию необходимо записать уравнения четырех реакций.
Особенности
Это задание так же, как и задание № 30, проверяет знание всей химии элементов, которая содержится в спецификации ЕГЭ. Однако часто составление четырех уравнений, описанных в задании № 32, является более простой задачей, чем составление одного уравнения в вопросе № 30. Во-первых, здесь не нужно самостоятельно выбирать реагенты, поскольку они уже даны в условии, а продукты часто можно угадать, используя данные условия, которые, по сути, являются подсказками. Во-вторых, из четырех описанных в задании уравнений, как правило, два можно записать, используя знания 8-9 классов. Например, это могут быть реакции ионного обмена. Два других уравнения — посложнее, подобные тем, которые предлагаются в задании № 30.
Советы
Конечно, можно просто выучить всю химию элементов наизусть и с ходу записать все уравнения. Это самый верный способ. Если же возникают трудности с определением продуктов, то нужно по максимуму использовать подсказки, приведенные в условии. Чаще всего в задании указываются наблюдаемые химические явления: выпадение или растворение осадков, выделение газов, изменение цвета твердых веществ или растворов. А если еще и указан конкретный цвет осадка, газа или раствора, можно с высокой точностью определить, о каком веществе идет речь. Для этого необходимо всего лишь знать цвета наиболее часто использующихся в задачах школьной программы осадков и газов, а также цвета растворов солей. Это сильно облегчит написание проблемного уравнения реакции, и задание № 32 покажется очень даже простым.
Задание № 33
Что требуется
Необходимо записать уравнение пяти реакций с участием органических веществ по приведенной схеме (цепочке превращений).
Особенности
В этом задании предлагается классическая цепочка превращений, какие школьники учатся решать с первого года изучения химии, только здесь в каждом уравнении участвует хотя бы одно органическое вещество. Задача на каждой стадии цепочки может быть сформулирована в двух вариантах. В первом варианте даются один из реагентов и продукт реакции. В этом случае необходимо подобрать второй реагент, а также указать все условия осуществления реакций (наличие катализаторов, нагревание, соотношение реагентов). Во втором варианте известны все реагенты, а часто и условия реакции. Необходимо только записать продукты.
Советы
Лучший способ успешно выполнить цепочку по органике — это знать наизусть все типы реакций каждого класса соединений и специфические свойства органических веществ, содержащиеся в школьном курсе органической химии.
Главное правило задания № 33 — использование графических (структурных) формул органических веществ в уравнениях реакций. Это указание обязательно прописано в каждом варианте тренировочных работ и пробных вариантов ЕГЭ по химии, поэтому известно всем выпускникам. Однако некоторые школьники все равно иногда пренебрегают этим правилом и часть органических веществ записывают в молекулярном виде. Будьте внимательны! Уравнения реакций с молекулярными формулами органических веществ в этом задании не засчитываются.
В задачах № 32 и № 33 уравнение считается написанным верно, если в нем расставлены все коэффициенты и при необходимости указаны условия протекания реакции. Уравнения реакций, в которых хотя бы один коэффициент неверен или не указаны важные условия, не засчитываются.
Задание № 34
Что требуется
Решить расчетную задачу, тематика которой меняется от года к году и от варианта к варианту.
Особенности
В спецификации ЕГЭ под номером 34 заявлены задачи с использованием понятия доли (массовой, объемной, мольной) вещества в смеси. Частным случаем таких задач являются задачи «на массовую долю вещества в растворе», задачи «на примеси», то есть с использованием понятия доли чистого вещества в составе технического. Сюда же относятся расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного, а также расчеты по уравнению реакции, если один из реагентов дан в избытке.
Предсказать, какие задачи будут отобраны для ЕГЭ именно в этом году, практически невозможно. Единственное, что можно ожидать по опыту прошлых лет, — это то, что задача не окажется сложной и будет полностью соответствовать профильной школьной программе (не олимпиадной). Это значит, что такая задача по зубам любому школьнику, освоившему курс химии на профильном школьном уровне и обладающему обыкновенной математической и химической логикой.
Советы
Для того чтобы решить эту задачу, прежде всего, нужно знать базовые формулы и определения основных физических величин. Необходимо осознать понятие «математической доли» как отношения части к целому. И тогда все типы долей в химии принимают одинаковый внешний вид.
| Массовая доля вещества в смеси | ({omega_{1}} = {{m_{в-ва}} over m_{смеси}}) |
| Массовая доля вещества растворе | ({omega_{1}} = {{m_{в-ва}} over m_{р-ра}}) |
| Мольная доля вещества в смеси (растворе) | ({chi} = {{nu_{в-ва}} over nu_{смеси}}) |
| Объемная доля вещества в смеси (растворе) | ({varphi} = {{V_{в-ва}} over V_{смеси}}) |
| Доля чистого вещества в составе технического (степень чистоты) | ({omega_{чист}} = {{m_{чист}} over m_{техн}}) |
| Доля выхода продукта от теоретически возможного (выход продукта) |
({eta} = {{upsilon_{практ}} over upsilon_{теор}} = {{m_{практ}} over m_{теор}} )
(m_{практ}) — масса продукта, которая получилась в результате химической реакции (m_{теор}) — масса продукта, которая могла образоваться в соответствии с теоретическим расчетом по уравнению реакции |
| Количество вещества |
({v} = {m over M} )
([{v}] = моль ) ({nu} = {{V} over V_{m}}) Молярный объем, т.е. объем одного моля газа, одинаков для всех газов при одинаковых условиях |
| Молярная концентрация (молярность) вещества в растворе |
({C} = {{v_{в-ва}} over V_{р-ра}} )
([{C}] = {моль over л} = М) |
| Плотность раствора |
({rho} = {{m_{р-ра}} over V_{р-ра}} )
([{rho}] = {г over мл} = {г over см^3} ) |
Задание № 35
Что требуется
Решить расчетную задачу на установление молекулярной и структурной формулы вещества, записать предложенное уравнение реакции с данным веществом.
Особенности
Идеологическая часть задач на вывод формулы изучается школьниками еще в 8-9 классах, поэтому это наиболее простая задача части 2 ЕГЭ. Хотя в спецификации не указано, формулу какого вещества необходимо установить. Опыт показывает, что из года в год здесь традиционно участвуют органические вещества.
Советы
Все задачи на вывод формулы, встречающиеся в ЕГЭ, можно условно разделить на три типа. Первый тип — это установление формулы по массовым долям элементов в веществе. Здесь работает формула для массовой доли элемента в сложном веществе:
({omega} = {n times {A_{r}(элемента)} over {M_{r}(вещества)}} times 100 %)
где n — число атомов элемента в молекуле, то есть индекс элемента.
Иногда в этом типе задач нужно знать еще и общую формулу класса, к которому относится неизвестное органическое вещество. Затем следует выразить относительную молекулярную массу вещества через n и подставить в уравнение для массовой доли. Решением уравнения будет искомое значение n, а следовательно, и молекулярная формула вещества. Дополнительные сведений о веществе, указанные в условии задачи, позволяют установить структурную формулу вещества, с которой далее требуется записать уравнение реакции.
Второй тип задач — это установление формулы через расчеты по уравнению химической реакции. Здесь нужно обязательно знать еще общую формулу класса, к которому относится неизвестное органическое вещество, и записать с ним уравнение реакции. Иногда приходится расставлять коэффициенты в общем виде через n. Тем не менее это наиболее понятный тип задач на вывод формулы, поскольку он чаще всего сводится к одному уравнению с одним неизвестным n, решение которого дает нам искомую молекулярную формулу. Дополнительные сведения о веществе, указанные в условии задачи, позволяют установить структурную формулу вещества, с которой далее требуется записать уравнение реакции.
И, наконец, третий тип задач — это установление формулы по продуктам сгорания вещества. Этот вариант наиболее часто встречается на ЕГЭ в этом задании. Выглядит он чуть более громоздко, чем два предыдущих, однако решается также очень просто. План решения заключается в нахождении простейшей формулы вещества и переходе к истинной (то есть молекулярной) формуле через известную молярную массу вещества. Простейшая формула находится из закона, согласно которому индексы элементов относятся так же, как их количества вещества в молях. Если молярная масса вещества не дана в условии, то можно попробовать доказать единственность решения через соответствие формулы правилам валентности. Но такой подход часто бывает трудоемок, и его можно легко обойти, если использовать дополнительные сведения об искомом веществе, указанные в условии задачи. Это может быть класс соединения, наличие или отсутствие каких-либо типов изомерии и, наконец, химическая реакция, в которую это вещество способно вступать или с помощью которой оно может быть получено. Помимо молекулярной формулы, эти же дополнительные сведения позволяют однозначно определить и структурную формулу вещества, с которой далее требуется записать уравнение реакции.
22 апреля 2022
В закладки
Обсудить
Жалоба
Консультация по химии
Онлайн-трансляция по вопросам подготовки к ЕГЭ по химии в рамках марафона «ЕГЭ – это про 100!».
В вариантах ЕГЭ задачу №26 можно решать разными способами – через вычисление массовой доли вещества и с использованием растворимости. Однако, округляя величины до указанного знака, в соответствии с условием задачи, в ответе получаются разные значения. Как быть в этой ситуации?
Задачу на растворимость можно решить только тогда, когда эта растворимость будет дана. В КИМ этого года – задач на растворимость в 26 номере нет, поэтому все задачи решаются с использованием массовой доли. Задания ЕГЭ построены так, чтобы ваш ответ не зависел от округления. Внимательно читайте условия задачи и смотрите, с какой точностью ожидается получить ответ.
На какие теоретические пособия должен ориентироваться выпускник при подготовке к ЕГЭ по химии?
Есть пособия, которые рекомендованы ФИПИ, Навигатор ЕГЭ, открытый банк заданий ФИПИ, учебники для профильного изучения химии с грифом «Рекомендовано»
При решении 32 задания (органическая цепочка) можно не указывать условия протекания реакций, распространяется ли это на 31 задание? Будет ли реакция считаться правильной, если не указать катализатор в условии?
Требований к тому, чтобы вы указывали условия протекания реакций, нет. Если вы убеждены в своем ответе, то записывайте его. Если у вас есть сомнения, вы можете в общем виде указать катализатор, можете не указывать ничего. Но если вы решили указать условия протекания реакции, а они будут противоречить продуктам, которые получились, ответ может быть не засчитан. С указанием условий будьте аккуратны.
Обязательно ли указывать орто-изомер в реакциях замещения гомологов бензола? (задание 32)
Если речь идет о заместителях первого рода, смотрите на контекст задания и записывайте в уравнении тот продукт, который заложен последующими веществами в контексте данной конкретной цепочки.
Лучше всего написать тот изомер, который заложен в дальнейших превращениях.
При выполнении цепочки превращения, по органической химии, необходимо ли указывать условия химических реакции?
Необходимости в этом нет.
Какие темы, по вашим наблюдениям, хуже всего даются школьникам? Какие вопросы традиционно считаются самыми сложными?
Тема является сложной тогда, когда ты ее недостаточно понимаешь. А понимание темы зависит от подготовки к экзамену. Надо повторять с самого начала, чтобы понимать, почему происходит тот или иной процесс. Традиционно сложными считаются вопросы второй части – это высокий уровень сложности.
Будут ли на ЕГЭ органические ангидриды?
Органических ангидридов в ЕГЭ не будет. Изучайте кодификатор на сайте ФИПИ.
Будет ли в 21 задании указываться концентрация веществ в скобках, и если будет, то, как она влияет?
Все вещества будут одинаковой концентрации.
В теме 17 сообщений
Общие вопросы, касающиеся ЕГЭ по химии (процедура проведения экзамена, оформление работы).
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
Здравствуйте, какой вариант записи приемлим?
Снизят ли баллы, если не поставить скобки?
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
Оба варианта годятся. Единственное, если писать со скобками, то плюс надо выносить за скобку
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
Здравствуйте, вопрос по оформлению баланса
Почему в одном случае В САМОМ БАЛАНСЕ перед хромом ставится 2, а в другом нет?
Вроде бы, это число смотрится по индексу в левой части уравнения ( если это не простое вещество)
Снизят ли балл за баланс, если я не поставлю эту 2?
Спасибо за ответ))
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
3 часа назад, Ульяна сказал:
Здравствуйте, вопрос по оформлению баланса
Почему в одном случае В САМОМ БАЛАНСЕ перед хромом ставится 2, а в другом нет?
Вроде бы, это число смотрится по индексу в левой части уравнения ( если это не простое вещество)
Снизят ли балл за баланс, если я не поставлю эту 2?
Спасибо за ответ))
__________________________________
Однозначно правильно как в первом варианте, так точно будет засчитано. По поводу второго варианта он скорее всего тоже будет засчитан, среди скринов работ есть и так и так записанные и засчитанные.
Но, я думаю, что никому не нужен вариант «скорее всего будет засчитано», поэтому писать надо так, как в первом варианте, тем более, что он более корректен. У нас не может быть меньше двух атомов хрома с каждой стороны уже сразу, поэтому двойку надо вносить тоже сразу.
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
Здравствуйте! а подскажите пожалуйста можно ли в 16 задачи и в 14 находить массу раствора по-другому ,вот так: m(Zno)+m(co)-m(со)2+m(р-ра KOH)-m(h2). Если посчитать в обеих задачах масса раствора сходиться с вашим ответом. Засчитают ли такое нахождение правильным и поставят максимум баллов или нет? Спасибо заранее!
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
26 минут назад, kristinamakhiboroda сказал:
Здравствуйте! а подскажите пожалуйста можно ли в 16 задачи и в 14 находить массу раствора по-другому ,вот так: m(Zno)+m(co)-m(со)2+m(р-ра KOH)-m(h2). Если посчитать в обеих задачах масса раствора сходиться с вашим ответом. Засчитают ли такое нахождение правильным и поставят максимум баллов или нет? Спасибо заранее!
Я с трудом понял логику расчета, но все таки понял. Действительно, масса раствора будет такая же.
Я думаю, что такой вариант расчетов теоретически может быть засчитан, но очень велика вероятность того, что свою правоту придется доказывать уже на апелляции и изначально баллы снимут. Апелляция вещь хорошая, но дополнительный стресс ни к чему, + примерно 2/3 работ на апелляции не повышают баллы, а понижают, так как работу смотрят тщательнее и находят еще не замеченные ошибки.
На ЕГЭ помимо того, чтобы решать правильно, лучше работу оформлять в том виде, в котором она с большей вероятностью будет засчитана сразу.
По-хорошему, расчет должен отражать процессы в задаче, т.е. должен быть проведен таким образом, чтобы эксперту было понятно, что человек понимает, какие процессы происходят, в частности, что в состав раствора вошло и что из его состава вышло. По твоим расчетам выглядит так, что в раствор когда-то зашел СО, а затем вылетел CO2. Во всяком случае так выглядит. Лучше этого избежать, чем потом доказывать, что ты не верблюд.
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
1 минуту назад, Сергей Иванович сказал:
Я с трудом понял логику расчета, но все таки понял. Действительно, масса раствора будет такая же.
Я думаю, что такой вариант расчетов теоретически может быть засчитан, но очень велика вероятность того, что свою правоту придется доказывать уже на апелляции и изначально баллы снимут. Апелляция вещь хорошая, но дополнительный стресс ни к чему, + примерно 2/3 работ на апелляции не повышают баллы, а понижают, так как работу смотрят тщательнее и находят еще не замеченные ошибки.
На ЕГЭ помимо того, чтобы решать правильно, лучше работу оформлять в том виде, в котором она с большей вероятностью будет засчитана сразу.По-хорошему, расчет должен отражать процессы в задаче, т.е. должен быть проведен таким образом, чтобы было эксперту было понятно, что человек понимает, какие процессы происходят, в частности, что в состав раствора вошло и что из его состава вышло. По твоим расчетам выглядит так, что в раствор когда-то зашел СО, а затем вылетел CO2. Во всяком случае так выглядит. Лучше этого избежать, чем потом доказывать, что ты не верблюд.
Спасибо большое)
1 пользователю понравился пост
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
Только что, kristinamakhiboroda сказал:
Спасибо большое)
не за что!
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
В 20.07.2017 в 15:01, Сергей Иванович сказал:
Общие вопросы, касающиеся ЕГЭ по химии (процедура проведения экзамена, оформление работы).
Добрый вечер! подскажите пожалуйста почему в задачи 17 образуется комплексная соль, а не обычное уравнение обмена. ZnSO4 + 4NaOH → Na2[Zn(OH)4] + Na2SO4 и как определить что получиться в продуктах?
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
24 минуты назад, kristinamakhiboroda сказал:
Добрый вечер! подскажите пожалуйста почему в задачи 17 образуется комплексная соль, а не обычное уравнение обмена. ZnSO4 + 4NaOH → Na2[Zn(OH)4] + Na2SO4 и как определить что получиться в продуктах?
Создал тему по задачам на расчет массовой доли соединения в смеси. Просьба продублировать вопрос туда, т.к. здесь он не совсем по теме.
p.s. в задаче 17 вроде нет такой реакции.
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
Здравствуйте,подскажите, пожалуйста, хорошие решебники для подготовки к экзамену. Может быть, есть такие, которые помогут войти в тонус в домашних условиях? Моя дочь пока в 10 классе и время терпит. Но хотелось бы начать заранее готовиться. Думаем пойти на курсы «название удалено удалено администратором», но не знаю, насколько это эффективно. И тем более стоит бОльших денег, чем книги. Может, Вы могли бы посоветовать?
Заранее большое Вам спасибо за ответ!
Изменено 27 декабря, 2017 пользователем Сергей Иванович
Реклама сторонних ресурсов
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
В 24.12.2017 в 23:25, Karepina сказал:
Здравствуйте,подскажите, пожалуйста, хорошие решебники для подготовки к экзамену. Может быть, есть такие, которые помогут войти в тонус в домашних условиях? Моя дочь пока в 10 классе и время терпит. Но хотелось бы начать заранее готовиться. Думаем пойти на курсы «название удалено удалено администратором», но не знаю, насколько это эффективно. И тем более стоит бОльших денег, чем книги. Может, Вы могли бы посоветовать?
Заранее большое Вам спасибо за ответ!
По поводу названных Вами курсов я ничего подсказать по поводу их эффективности,, ксожалению, не смогу.
Лично на мой взгляд, неплохая книжка от разработчиков ЕГЭ. Точнее две книжки.
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
Добрый день)) скажите, пожалуйста, правильно ли записана реакция :
1)2KMnO4+Na2SO3+2NaOH=2Na2MnO4+K2SO4+H2O? Или же верна эта : 2KMnO4+Na2SO3+2NaOH=K2MnO4+Na2MnO4+Na2SO4+H2O?
2) PH3+ HBrO3= Br2+H2O+H3PO4, но в книге я посмотрела, что кислоты, кроме HIO3, восстанавливаются так : HHalO3 и их соли => Hal-, значит реакция вроде должна пойти так : PH3+ HBrO3= HBr+H2O+H3PO4
3) из предложенного перечня веществ нужно составить ОВР : P2O3, CO, HNO3, LiOH (можно при участии H2O) . Из предложенного выбрала P2O3+HNO3 +H2O = H3PO4+NO подскажите, пожалуйста, верно?
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
посоветуйте, пожалуйста, хороший справочник. Чтобы теорию выучить.
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
Подскажите, в подобных случаях можно писать, что образуется кислая соль (в данном случае гидросульфат калия)? Засчитывают такое на экзамене?
А анионы кислых солей в ионном уравнении никогда не расписываются на протон и кислотный остаток в ЕГЭ? или есть случаи, когда расписываются?
Спасибо!
Из предложенного перечня веществ выберите среднюю соль и вещество, реакция ионного обмена между которыми протекает с образованием слабой кислоты. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ.
- Гидрокарбонат аммония
- Оксид марганца (IV)
- Разбавленная серная кислота
- Оксид магния
- Нитрит калия
- Хлорид натрия
H2SO4 + 2KNO2 = K2SO4 + 2HNO2
2K+ + 2NO2– + 2H+ + SO42– = 2K+ + SO42– + 2HNO2
NO2– + H+ = HNO2
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
Вопрос не по варианту)
А насколько уровень сложности ваших кимов выше, чем реального егэ?
Просто я решаю кимы с егэ на 89+, а в ваших мой максимум был 80, и я вот думаю, нормальный ли это результат?)
Поделиться сообщением
Ссылка на сообщение
Поделиться на другие сайты
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
Фотографии: АГН «Москва» / Pixabay. Иллюстрация: Юлия Замжицкая
О нововведениях и нюансах подготовки рассказывает руководитель комиссии по разработке контрольно-измерительных материалов ЕГЭ по химии, кандидат педагогических наук Дмитрий Добротин.
Основные изменения
В этом году изменения минимальные. В целом структура работы осталась практически без корректировок.
Изменилось условие задания 23
Скриншот задания 23 из демоверсии ЕГЭ-2023 по химии
Из условия убрали таблицу, в которые были представлены концентрации, характерные для веществ, находящихся в данном состоянии равновесия.
Эксперты предполагают, что такую таблицу экзаменуемый может составить сам. Для этого не требуется каких-то специальных навыков: это классическая таблица, где заложены и концентрации исходных вещественных продуктов реакции, и, соответственно, их значения.
Изменения в задании 32 на «цепочки превращений»
Скриншот задания 32 из демоверсии ЕГЭ-2023 по химии
Если традиционная цепочка предполагает, что превращения идут слева направо, то в этом году появилось новшество, которое предполагает, что стрелочки к веществу или обозначению, который заменяет вещество (имеется в виду x1, x2 и т. д.) могут стоять как в направлении к веществу, так и от вещества.
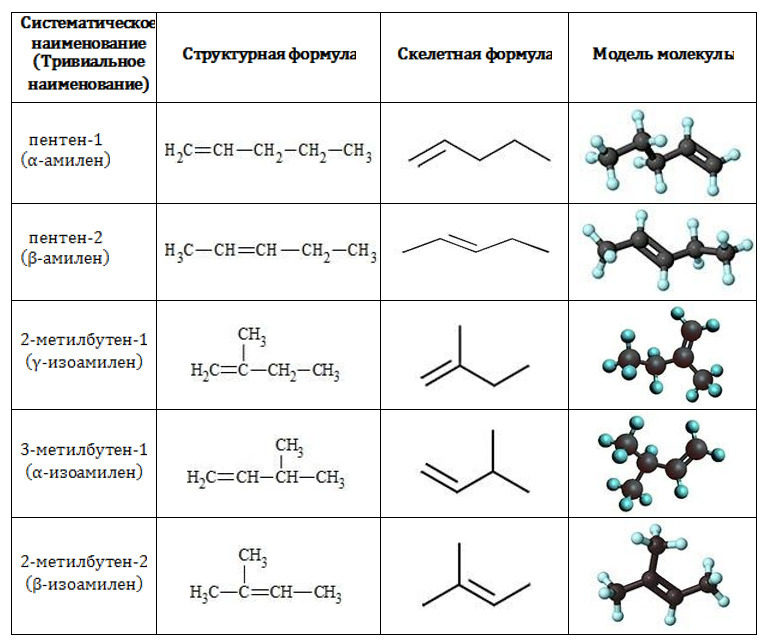
Появились «скелетные формулы»
«Скелетная формула» — это когда отдельные атомы обозначаются только в виде ломанной линии.
Примеры «скелетных формул»
К такой форме записи органических веществ многие уже привыкли, но для некоторых это может стать неожиданностью. Но такие формулы записи молекул могут быть. На это обращает внимание и примечание, которое идет после критериев оценивания.
Кому-то такая форма записи органических веществ будет удобна, и это можно использовать и в рамках записи своих уравнений, реакций. Но и в целом можно переводить и в привычный формат так называемых свернутых формул — в этом тоже нет никаких нарушений.
Задания 33 и 34 поменяли местами
Это сделали, чтобы после того, как учащиеся выполнят цепочку превращений с использованием знания в органических веществах, им будет удобнее сразу перейти именно к расчетной задаче, в которой нужно вывести молекулярную формулу органического вещества.
Завершающая задача 34 действительно самая сложная. На последнем месте ее разместили затем, чтобы экзаменуемый мог спокойно сосредоточиться на ней и уделить ей столько времени, сколько потребуется.
На что обратить внимание и как готовиться
-
Внимательно читать задание и инструкции
Например, в расчетных задачах 27 и 28 в качестве относительной атомной массы хлора используют значение 35,5. Это принципиальный момент, потому что в этих задачах нужно записать ответ с конкретной точностью, тоже указанной в условии задания.
Совет от эксперта:
«Машина не распознает никакое другое значение, кроме того, которое было заложено. Поэтому в данном случае очень важно следовать инструкциям и округлять с той заданной точностью, которая указана в условии задания».
Бывают случаи, когда экзаменуемый прорешал много вариантов и у него сложился стереотип, что значения PH, как правило, выстраиваются в порядке возрастания. Однако встречаются и задания, в которых их надо выстроить в порядке убывания.
-
Выделить достаточно времени на проверку работы
За 20 минут до окончания экзамена стоит начать проверку: все ли решено, все ли инструкции учтены. В тех заданиях, где это играет принципиальную роль, стоит быть максимально внимательным к деталям, которые могут привести к серьезной потере баллов.
-
При подготовке обратить особое внимание на самые сложные задания
Как показывает практика, это задания 33, 34, а также 24 и 25, которое связано с промышленным производством, способами получения веществ и их применением.
Совет от эксперта:
«Для того, чтобы лучше справиться с заданиями 24 и 25, ведите таблицы, которые помогают фиксировать внешние наблюдения за химическим экспериментом. Стоит вести их в течение всего периода обучения химии, а уж когда выпускник определился с выбором предметов, это точно пригодится».
Отдельное внимание стоит обратить на задание 25, которое предполагает проверку знаний и умения определять, какой аппарат требуется для получения того или иного вещества, в какой области его применяют. Нередко в школе педагоги отдают этот вопрос на самостоятельное изучение. Поэтому полезно до экзамена собрать и систематизировать эту информацию, как по органической химии, так и по неорганической.
-
Не ограничиваться подготовкой только по моделям ЕГЭ
Практика показывает, что если старшеклассник идет по пути подготовки к конкретным моделям экзамена, то как только встречаются нюансы в условии, отличные от того, к чему он готовился, он испытывает стресс. А если экзаменуемый в целом владеет необходимым теоретическим материалом, то не будет принципиальным, как его о нем спрашивают.
Самый оптимальный вариант — интенсифицировать процесс подготовки с опорой на классические учебники, либо пособия для подготовки абитуриентов, либо школьные учебники углубленного уровня, либо на материалы, которые размещены на сайте ФИПИ. В навигаторе ФИПИ приведены задания, которые соответствуют тем позициям, которые встречаются в экзаменационном варианте. Кроме того, там есть ссылки учебники, которые могут выступать в качестве помощников при подготовке.
Посмотреть полную версию консультации Дмитрия Добротина в эфире Рособрнадзора можно здесь.
Материалы по теме:
- Что изменится в ЕГЭ по русскому языку в 2023 году
- Что изменится в ЕГЭ по английскому языку в 2023 году
- Что изменится в ЕГЭ по истории в 2023 году
Если вам нравятся материалы на Педсовете, подпишитесь на наш канал в Телеграме, чтобы быть в курсе событий раньше всех.
Подписаться
Сдать ЕГЭ по химии на высокий балл — настоящий подвиг. Количество стобалльников в 2021 году — 543 человека из 93 000 участников. Как приблизиться к максимальному баллу и не допустить типичных ошибок, расскажем в этой статье.
Какие типичные ошибки совершают выпускники на ЕГЭ по химии
Спросили у Таисии Фламель, преподавательницы химии в Вебиуме, в каких заданиях ошибаются ученики и почему.
Какого цвета железо?
У железа три соединения:
FeO — основный оксид чёрного цвета
Fe2O3 — амфотерный оксид красно-коричневого цвета
Fe3O4 (FeO*Fe2O3) — смешанный оксид чёрного цвета
Задание, в котором можно совершить такую ошибку:
Запишем реакцию электролиза:
Вторая реакция: O2 + Fe. Здесь может образоваться как Fe2O3 ,так и Fe3O4. Чтобы сделать правильный выбор, вспоминаем, какое из этих веществ чёрного цвета. Это Fe3O4.
Верная реакция: 2O2 + 3Fe = Fe3O4
Перекиси. Пероксиды
Пероксиды — соединения, в которых степень окисления кислорода -1.
Пероксиды отлично реагируют с водой, но в зависимости от условий реакции, получаются разные продукты.
Если раствор холодный:
Na2O2 + H2O (хол.) = NaOH + H2O2
Если раствор горячий:
Na2O2 + H2O (гор.) = NaOH + H2O + O2
Задание 30. Реакция с гидроксидом бария
В задании необходимо написать реакцию ионного обмена, в которую вступает кислая соль. Должен образоваться белый осадок.
Кислая соль здесь одна — дигидрофосфат калия — KH2PO4.
К образованию белого осадка приведёт реакция с гидроксидом бария. Ошибка — писать обычную реакцию обмена:
KH2PO4 + Ba(OH)2 = BaHPO4 + KOH + H2O
Такую реакцию на ЕГЭ не засчитают, так как в растворе остались вещества, которые могут реагировать между собой — BaHPO4 и KOH.
Верный вариант реакции:
3KH2PO4 + 3Ba(OH)2 = Ba3(PO4)2 + K3PO4 + 6H2O
Таким образом, в продуктах реакции не может быть веществ, которые реагируют между собой.
Разложение нитратов
Эти реакции встречаются как в первой, так и во второй части ЕГЭ по химии. Важно внимательно выполнять такие задания и помнить про исключения.
Степень окисления и валентность азота
Вспомним строение атома азота:
Эти знания пригодятся при выполнении заданий первой части:
Что делает катализатор?
Катализатор — это вещество, которое ускоряет скорость реакции, но непосредственно не расходуется. Обычно катализатор пишется над стрелочкой в реакции.
Главные факты про катализатор:
- Не расходуется в процессе реакции;
- В обратимой реакции ускоряет процессы в обе стороны;
- Катализатор не изменяет равновесия в реакции;
- Катализатор не меняет концентрацию продуктов и реагентов.
Эти знания помогут при выполнении заданий первой части:
Запись циклических углеводородов
При записи циклических углеводородов нужно понимать, что главный элемент здесь — углерод. Квадрат — это вещество с 4-мя углеродами в составе, треугольник — с 3-мя углеродами. Каждый угол = углерод.
Можно не писать символ углерода, так как он и так подразумевается. Такая запись будет верной.
Если же вы пишете углерод, то связи должны обязательно отходить именно от этого элемента (ни в коем случае не от водорода, и не от пустого места на бланке).
Степени окисления и заряды — одно и то же?
В окислительно-восстановительной реакции (ОВР) нужно записывать степени окисления. Степень окисления пишется так: сначала знак, потом число.
Если же в задании необходимо написать реакцию ионного обмена (РИО), то здесь речь пойдёт о зарядах, которые можно посмотреть в таблице растворимости. Заряды записываются так: сначала число, потом знак.
Эта разница очень важна, по-другому задание будет оценено на 0 баллов.
Бензол обесцвечивает бромную воду?
Бензол не обесцвечивает бромную воду и раствор перманганата калия за счёт особенностей своего строения.
А вот гомологи бензола будут обесцвечивать бромную воду и раствор перманганата калия.
Здесь же можно вспомнить о том, что обесцвечивание перманганата калия — качественная реакция на алкены — реакция Вагнера.
Формула раствора аммиака
Аммиак — бесцветный газ с резким характерным запахом. Раствор аммиака — это аммиак в воде — соединение NH4OH.
Но такой молекулы не существует, так как она сразу распадается на NH3 и H2O.
«Поступить на химфак сложнее, чем его окончить», — правда ли это? Тася Фламель поделилась историей выбора института и поступления на химфак МГУ в нашей статье.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!





.jpg)
.jpg)