Похожие вопросы:
Химия, 27.02.2019 04:30
До розчину сульфатної кислоти масою 98г з масовою часткою кислоти 10% додали натрій гідроксид масою 10г. обчисліть масу солі.
Ответов: 2
Химия, 27.02.2019 11:40
.(рассчитайте объем(н. у) кислорода, который можно получить при разложении 237г перманганата калия kmno4).
Ответов: 2
Химия, 28.02.2019 10:10
Обчисліть масу магнію кількістю 0,25 моль.
Ответов: 3
Химия, 01.03.2019 06:20
Расписать цепочку превращения: mg(oh)₂ -> mgso₄ -> mgcl₂ -> mg (no₃)₂ -> mg(oh)₂
Ответов: 4
У тебя есть свой ответ?
Однажды студентам очень серьезно готовиться к экзаменам Он пытался только бутербродами и вскоре почу…
Вопросы по другим предметам:
Обществознание, 03.09.2019 21:40
Литература, 03.09.2019 21:40
Математика, 03.09.2019 21:40
Математика, 03.09.2019 21:40
Математика, 03.09.2019 21:40
История, 03.09.2019 21:40
Русский язык, 03.09.2019 21:40
Русский язык, 03.09.2019 21:40
Математика, 03.09.2019 21:40
Математика, 03.09.2019 21:40
Математика, 03.09.2019 21:40
Русский язык, 03.09.2019 21:40
Литература, 03.09.2019 21:40
Русский язык, 03.09.2019 21:40
Английский язык, 03.09.2019 21:40
Математика, 03.09.2019 21:40
Математика, 03.09.2019 21:40
Русский язык, 03.09.2019 21:40
Однажды студент Том очень серьёзно готовился к экзаменам, он питался только бутербродами и вскоре почувствовал приступы изжоги. В аптеке ему
предложили на выбор несколько вариантов лекарств с разными названиями,
сказав, что уних один и тот же активный компонент. Действительно, прочитав
внимательно инструкции, Том заметил одно и то же вещество. Оказалось, что
это вещество также применяется как слабительное средство. Попробуй
угадать, что это было за вещество, рассчитай его относительную
молекулярную массу (а. е. м).
В ответе введи численное значение, округлив до целых.
Показать ответы
Чтобы сделать синтаксический разбор предложений в тексте, введите текст в текстовое поле и
нажмите кнопку разобрать.
Как программа делает разбор предложений?
Программа разбивает весь текст по словам и предложениям, далее разбирает каждое слово по
отдельности, выделяет морфологические признаки и начальную форму слова.
Оцените нашу программу ниже, оставляйте комментарии, мы обязательно ответим.
Морфологический
разбор
Настройки разбора
Указывать часть речи
сверху слова?
Об инструменте
После того как вы нажмете кнопку «Разобрать», вы получите результат синтаксического разбора
предложения.
Сверху результата будет указано количество символов в тексте и количество слов.
Каждая часть речи подсвечивается отдельным цветом, если вы хотите отображать только
определенные части речи в предложении, выберите в панели инструментов нужную вам часть.
Приложение доступно в Google Play
Какой вариант разбора выбрать?
Омонимы — это слова одинаковые по написанию, но разные по значению, такие слова могут
попасться в предложении и программа не может определить какой смысл несет слово.
Здесь нужно выбрать подходящей разбор слова в предложение, смотрите по контексту.
Для этого вам помогут морфологические признаки слова, чтобы их увидеть наведите на слово и в
раскрывающемся меню выберите «Все характеристики».
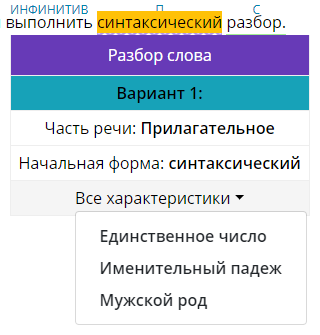
Часть речи сверху слова
Чтобы показывать часть речи сверху слова, включите соответствующею функцию в настройке
разбора.
Если у вас есть вопросы или пожелания, можете обратиться к нам по электронной почте
admin@rustxt.ru
ответ:
объяснение:
характеристика магния:
1) название элемента -магний,
символ — mg, порядковый номер — № 12 ,
атомная масса ar=24 группа — 2, подгруппа- главная , 3-й период
заряд ядра атома магния z=+12 (в ядре 12 протона-p⁺ и 12 нейтрона — n⁰)
вокруг ядра атома 3 энергетических уровня, на которых располагаются 12 электрона.
3) исходя из вышеизложенного напишем модели строение атома магния:
а). модель атома магния при дуг:
₊₁₂mg)₂)₈)₂
б). модель атома -электронная формула алюминия
₊₁₂mg1s²2s²2p⁶3s²
в).электронно-графическая модель атома:
3уровень ⇵
⇅ ⇅ ⇅
2уровень ⇅
1уровень ⇅
₊₁₂mg
4. простое вещество магний металл, состоит из одного атома.
как простое вещество магний взаимодействует:
с кислородом, образуя оксид магния;
с водородом, образуя гидрид магния;
с кислотами, образуя соли магния, с солями, образованными металлами, стоящими в ряду активности после него (он вытесняет ионы металла из соли).
его сложные вещества: оксид магния основной оксид, гидроксид магния-основание, нерастворимое в воде, соли магния растворимы в воде, за исключением фторида магния, фосфата магния, карбоната магния и силиката магния.
5. молекулы атомов в 2 группе, главной подгруппе одноатомные. с увеличением заряда ядра от бериллия до радия неметаллические свойства уменьшаются, а металлические усиливаются.
6. молекулы атомов простых веществ в периоде: натрий, магний, алюминий, кремний — одноатомные; фосфора четырехтомные p₄, серы многоатомные (s)n,хлора двухатомные ci₂. от натрия к хлору меняются свойства веществ: натрий, магний — металлы, алюминий -амфотерный металл, кремний полуметалл, фосфор, сера, хлор — неметаллы. также слева направо в периоде меняются окислительно-восстановительные свойства. натрий, магний, алюминий — восстановители. кремний, фосфор, сера, хлор — могут быть как восстановителями, так окислителями.
7. формула высшего оксида: mgo – основной оксид
8. формула гидроксида: mg(oh)₂- основание нерастворимое в воде.
9. летучего соединения с водородом не образует, а соединение магния с водородом — это гидрид алюминия mgh₂ -представляет собой твёрдое белое нелетучее
10. валентность магния в соединениях равна 2, степень
окисления+2 . магний –восстановитель.
характеристика углерода:
1) название элемента -углерода,
символ -c , порядковый номер — № 6 ,
атомная масса ar=12 группа — 4, подгруппа- главная , 2-й период
заряд ядра атома углерода z=+6 (в ядре 6 протонов-
p⁺ и 6 нейтронов — n⁰)
вокруг ядра атома 2 энергетических уровня, на которых располагаются 6 электронов.
3) исходя из вышеизложенного напишем строение атома магния и его электронную формулу:
а). модель атома углерода при
дуг: ₊₆c)₂)₄
б). модель атома, через электронную формулу (электронная конфигурация):
электронная формула углерода ₊₆c 1s²2s²2p²
в).электронно-графическая модель атома углерода:
↑ ↑
2уровень ⇅
1уровень ⇅
₊₆c
4. простое вещество углерод неметалл, состоит из
одного атома. углерод имеет три аллотропные видоизменения: углерод, алмаз, гафит. сложные соединения углерода: с кислородом образует два оксида co-несолеобразующий оксид и co₂ солеобразующий оксид и кислоту. с металлами образует соединения карбиды. h₂co₃ -угольная кислота летучая кислота ее соли лития, калия, натрия, аммония -растворимы в воде, соли образованные с другими металлами нерастворимы, легко разлагаются при нагревании.
5. молекулы атомов в 4 группе, главной подгруппе
одноатомные. с увеличением заряда ядра от углерода до свинца неметаллические свойства уменьшаются, а металлические усиливаются. свинец типичный металл.
6. молекулы атомов простых веществ в периоде: литий, бериллий, бор, углерод — одноатомные; азот, кислород, фтор двухатомные ci₂, неон одноатомный от лития к фтору меняются свойства веществ: литий- металл, бериллий- металл с амфотерными свойствами, углерод, азот, кислород, фтор- неметаллы. также слева направо в периоде меняются окислительно-восстановительные свойства..
7. формула высшего оксида: co₂ – основной оксид
8. формула гидроксида h₂co₃: летучая угольная кислота .
9.летучего соединения с водородом образует, моносилан — бинарное неорганическое соединение кремния и водорода с формулой sih₄, бесцветный газ с неприятным запахом, самовоспламеняется на воздухе, реагирует с водой, ядовит.
10. валентность углерода в соединениях равна 4, степень окисления+4, -4 . углерод–может быть, как восстановителем, так и окислителем









