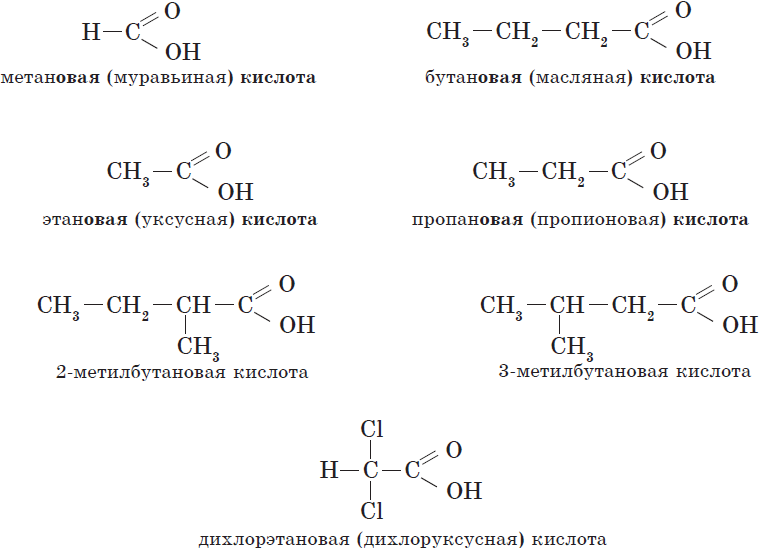
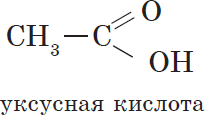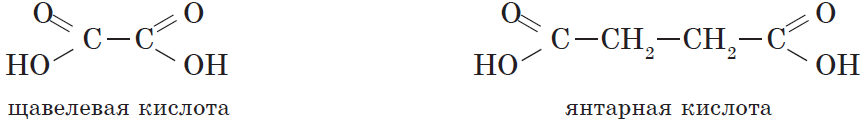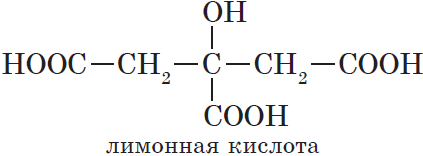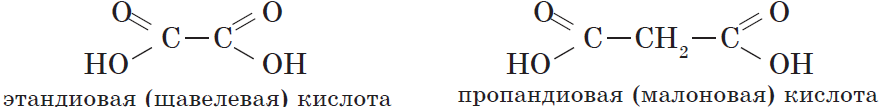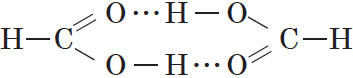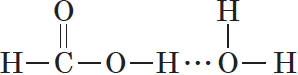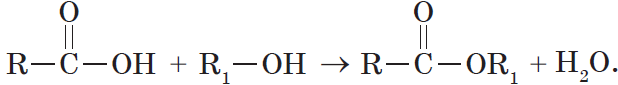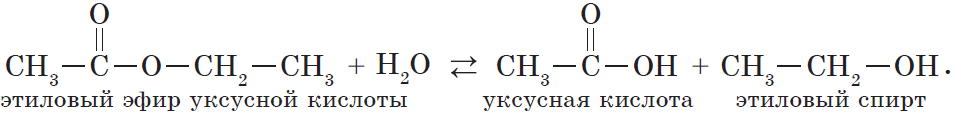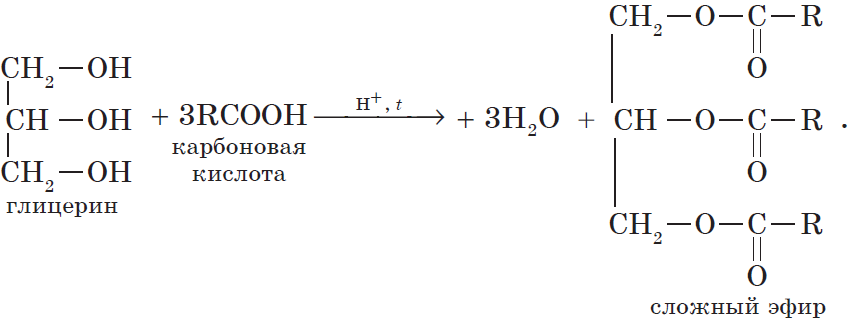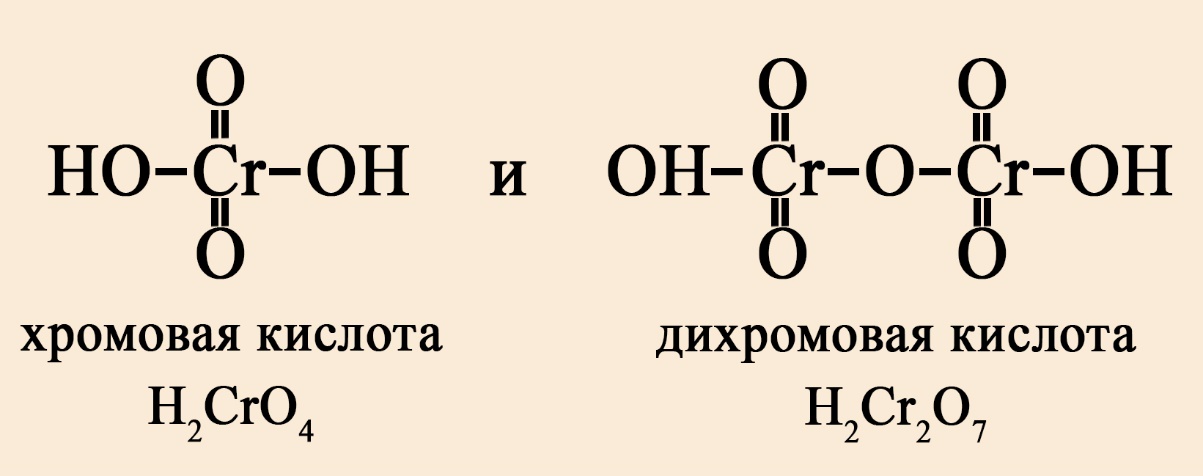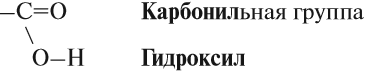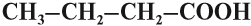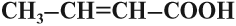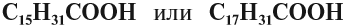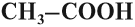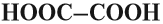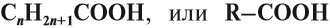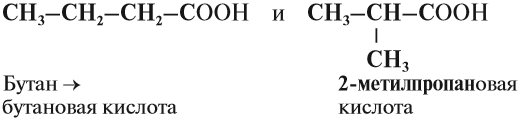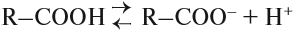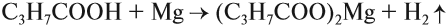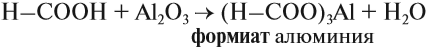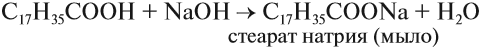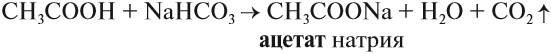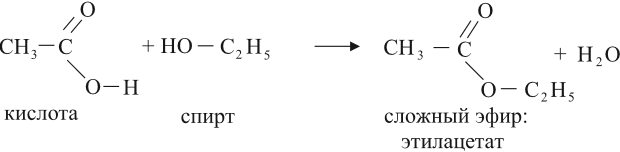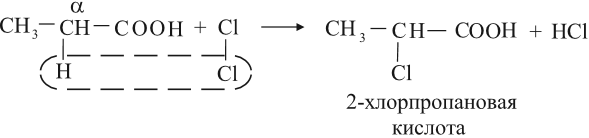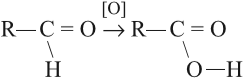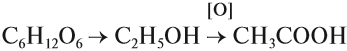Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН.
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Строение, изомерия и гомологический ряд карбоновых кислот
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
Классификация карбоновых кислот
По числу карбоксильных групп:
- одноосновные карбоновые кислоты — содержат одну карбоксильную группу -СООН. Общая формула CnH2n+1COOH или CnH2nO2.
Например, уксусная кислота
- многоосновные карбоновые кислоты — содержат две и более карбоксильные группы СООН. Например, общая формула двухосновных карбоновых кислот CnH2n(СОOH)2 или CnH2n-2O4.
Например, щавелевая кислота
Классификация по строению углеводородного радикала
- Предельные карбоновые кислоты – карбоксильная группа СООН соединена с предельным радикалом. Например, этановая кислота СН3–СООН.
- Непредельные карбоновые кислоты – карбоксильная группа СООН соединена с непредельным радикалом. Например, акриловая кислота: СН2=СН–СООН.
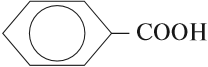
- Ароматические кислоты — карбоксильная группа СООН соединена с непредельным радикалом. Например, бензойная кислота: С6Н5СООН.
- Циклические кислоты — карбоксильная группа СООН соединена с углеводородным циклом. Например, циклопропанкарбоновая кислота: С3Н5СООН.
Строение карбоновых кислот
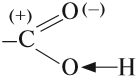
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность смещена к более электроотрицательному атому кислорода.
Атом углерода карбоксильной группы находится в состоянии sp2-гибридизации, образует три σ-связи и одну π-связь.
Водородные связи и физические свойства карбоновых кислот
В жидком состоянии и в растворах молекулы карбоновых кислот образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул карбоновых кислот.
Молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Номенклатура карбоновых кислот
Предельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Муравьиная | Метановая | Формиат (метаноат) | HCOOH |
| Уксусная | Этановая | Ацетат (этаноат) | CH3COOH |
| Пропионовая | Пропановая | Пропионат (пропаноат) | CH3CH2COOH |
| Масляная | Бутановая | Бутират (бутаноат) | CH3(CH2)2COOH |
| Валериановая | Пентановая | Пентаноат | CH3(CH2)3COOH |
| Капроновая | Гексановая | Гексаноат | CH3(CH2)4COOH |
| Пальмитиновая | Гексадекановая | Пальмитат | С15Н31СООН |
| Стеариновая | Октадекановая | Стеарат | С17Н35СООН |
Таблица. Непредельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Акриловая | Пропеновая | Акрилат | CH2=CH–COOH |
| Метакриловая | 2-Метилпропеновая | Метакрилат | CH2=C(СH3)–COOH |
| Кротоновая | транс-2-Бутеновая | Кротонат | СН3 -CH=CH–COOH |
| Олеиновая | 9- цис-Октадеценовая | Олеат | СН3(СН2)7СН=СН(СН2)7СООН |
| Линолевая | 9,12-цис-Октадекадиеновая | Линолеат | СН3(СН2)4(СН=СНСН2)2(СН2)6СООН |
| Линоленовая | 9,12,15-цис-Октадекатриеновая | Линоленоат | СН3СН2(СН=СНСН2)3(СН2)6СООН |
Таблица. Двухосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Щавелевая | Этандиовая | Оксалат | НООС – COOH |
| Малоновая | Пропандиовая | Малонат | НООС-СН2-СООН |
| Янтарная | Бутандиовая | Сукцинат | НООС-(СН2)2-СООН |
| Глутаровая | Пентандиовая | Глутарат | НООС-(СН2)3-СООН |
| Адипиновая | Гександиовая | Адипинат | НООС-(СН2)4-СООН |
| Малеиновая | цис-Бутендиовая | Малеинат | цис-НООССН=СНСООН |
| Фумаровая | транс-Бутендиовая | Фумарат | транс-НООССН=СНСООН |
Таблица. Ароматические карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Бензойная | Фенилкарбоновая | Бензоат |  |
| Фталевая | Бензол-1,2-дикарбоновая кислота | Фталат |  |
| Изофталевая | Бензол-1,3-дикарбоновая кислота | Изофталат |  |
| Терефталевая | Бензол-1,4-дикарбоновая кислота | Терефталат |  |
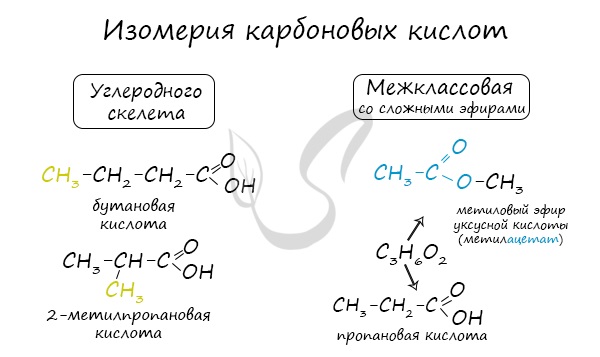
Изомерия предельных карбоновых кислот
Структурная изомерия
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для карбоновых кислот, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н8О2 соответствуют бутановая и 2-метилпропановая кислота
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Карбоновые кислоты изомерны сложным эфирам. Общая формула и предельных одноосновных карбоновых кислот, и сложных эфиров — CnH2nО2.
Например. Межклассовые изомеры с общей формулой С2Н4О2: уксусная кислота СН3–CОOH и метилформиат H–COOCH3
| Уксусная кислота | Метиловый эфир муравьиной кислоты |
| СН3–CОOH | HCOOCH3 |
Общую формулу СnH2nO2 могут также иметь многие другие полифункциональные соединения, например: альдегидоспирты, непредельные диолы, циклические простые диэфиры и т.п.
Химические свойства карбоновых кислот
.
- кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- замещение атома водорода в алкильном радикале
- образование сложных эфиров — этерификация
1. Кислотные свойства
Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н.
В водном растворе карбоновые кислоты частично диссоциируют на ионы:
R–COOH ⇆ R-COO– + H+
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
Например, уксусная кислота растворяет осадок гидроксида меди (II)
Видеоопыт взаимодействия уксусной кислоты с гидроксидом натрия можно посмотреть здесь.
Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода.
Видеоопыт взаимодействия уксусной кислоты с магнием и цинком можно посмотреть здесь.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды.
Например, уксусная кислота реагирует с оксидом меди (II)
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Видеоопыт взаимодействия уксусной кислоты с оксидом меди (II) можно посмотреть здесь.
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
Например, уксусная кислота растворяет карбонат кальция
Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа
2. Реакции замещения группы ОН
Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов.
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты
2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:
При нагревании карбоновые соли аммония разлагаются на амид и воду:
2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
При этом фенол не вступает в реакцию этерификации с карбоновыми кислотами. Сложные эфиры фенола получают косвенными способами.
2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты
3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу.
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
Например, уксусная кислота реагирует с бромом в присутствии красного фосфора
4. Свойства муравьиной кислоты
Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов.
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
Видеоопыт взаимодействия муравьиной кислоты с перманганатом калия можно посмотреть здесь.
4.4. Разложение при нагревании
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:
Видеоопыт разложения муравьиной кислоты можно посмотреть здесь
5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:
5.2. Реакции замещения в бензольном кольце
Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом.
6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:
6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:
7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
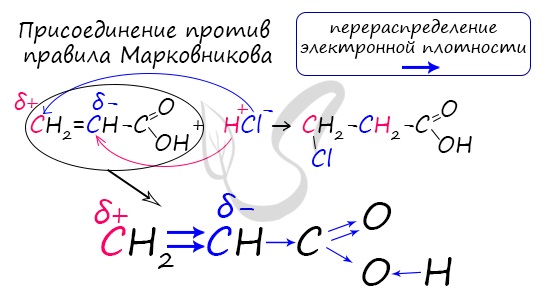
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:
К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:
7.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:
Получение карбоновых кислот
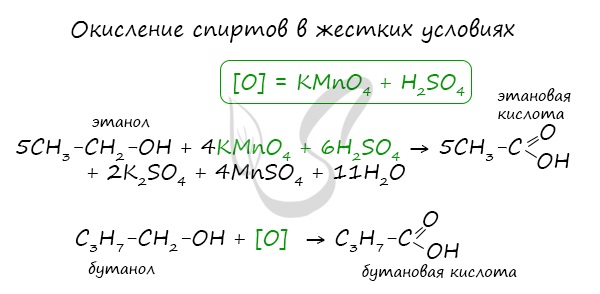
1. Окисление спиртов, алкенов и алкинов
При окислении спиртов, алкенов, алкинов и некоторых других соединений подкисленным раствором перманганата калия образуются карбоновые кислоты.
Например, при окислении этанола в жестких условиях образуется уксусная кислота
2. Окисление альдегидов
Альдегиды реагируют с раствором перманганата или дихромата калия в кислой среде при нагревании, а также с гидроксидом меди при нагревании.
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота.
Например, при окислении альдегидов гидроксидом меди (II) также образуются карбоновые кислоты
3. Щелочной гидролиз тригалогенидов
Тригалогеналканы, в которых три атома галогена расположены у одного атома углерода, с избытком щелочи образуется соль кислоты. При этом сначала происходит замещение галогенов на группы ОН.
Образуется неустойчивое вещество, которое распадается с отщеплением воды:
Так как щелочь в избытке, то образуется не сама кислота, а её соль:
4. Получение карбоновых кислот из солей
Карбоновые кислоты можно получить из солей действием минеральной кислоты на раствор соли:
Например, муравьиную кислоту можно получить, подействовав на формиат натрия раствором серной кислоты:
5. Гидролиз сложных эфиров
Сложные эфиры подвергаются гидролизу в кислой среде при нагревании:
Например, метилацетат гидролизуется в кислой среде:
6. Кислотный гидролиз жиров
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин
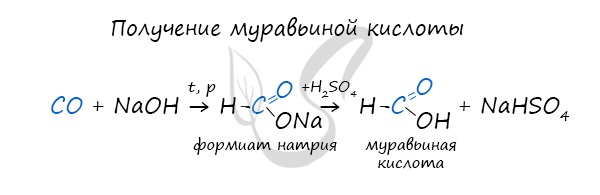
7. Получение муравьиной кислоты из угарного газа
Соль муравьиной кислоты получают нагреванием оксида углерода (II) с твёрдым гидроксидом натрия под давлением:
8. Каталитическое окисление бутана
Уксусную кислоту в промышленности получают каталитическим окислением бутана:
9. Получение бензойной кислоты
Бензойную кислоту получают окислением гомологов бензола раствором перманганата калия в кислой среде.
Например, при окислении толуола образуется бензойная кислота:
10. Взаимодействие реактива Гриньяра с углекислым газом
При взаимодействии реактивов Гриньяра (алкилгалогенидов магния) с углекислым газом и последующем гидролизе образовавшегося промежуточного продукта образуется карбоновая кислота.
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп
COOH.
Имеют разнообразное промышленное применение и большое биологическое значение.
Общая формула одноосновных карбоновых кислот CnH2nO2 .
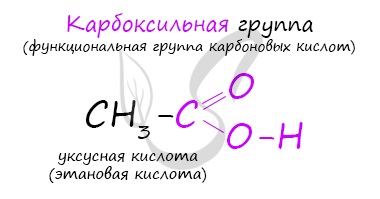
Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав
которых они входят.
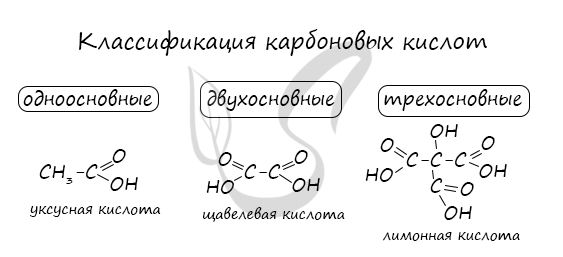
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода
и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота
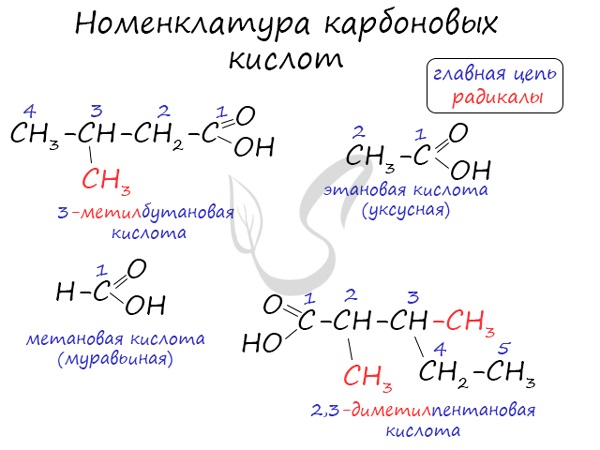
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными
эфирами.
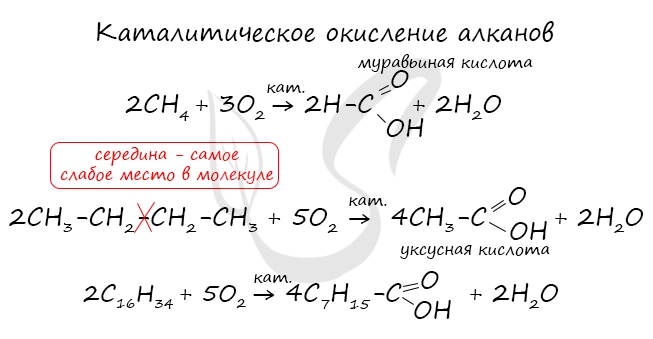
Получение карбоновых кислот
- Окисление алканов
- Окисление спиртов
- Окисление альдегидов
- Синтез муравьиной кислоты
- Синтез уксусной кислоты
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого
образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются
до соответствующих кислот.
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией
на альдегиды — реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II.
В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
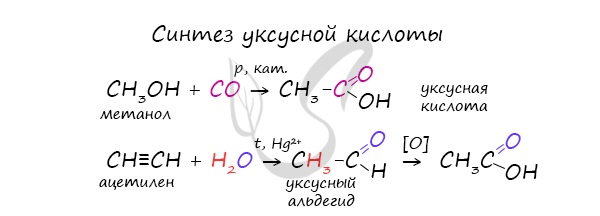
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид.
Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем
спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений
металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко
замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе.
Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная —
трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это
перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот,
способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
HCOOH → (t, H2SO4) CO↑ + H2O
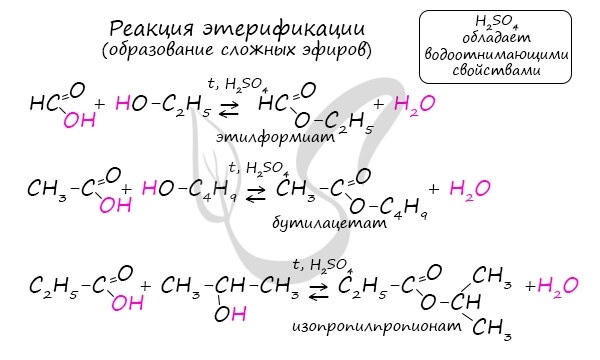
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты
и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
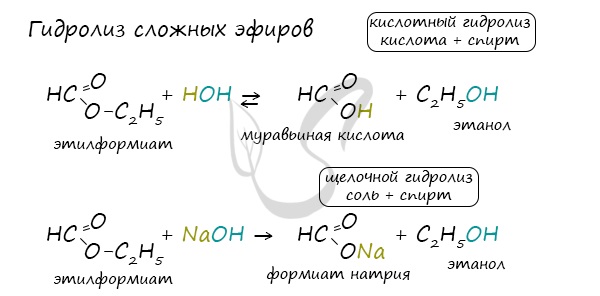
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль
кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо.
Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
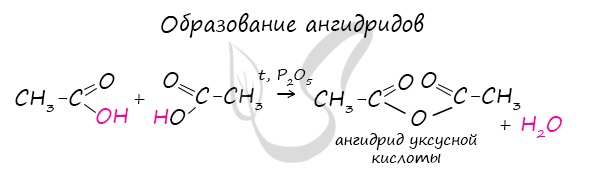
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.

Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания.
Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
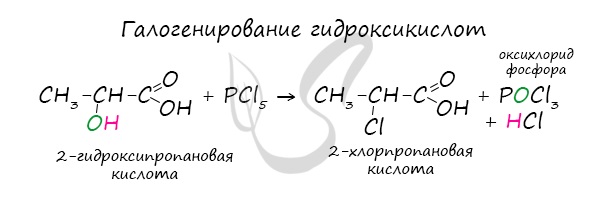
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит
в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Вещества, содержащие в молекуле одну или несколько карбоксильных групп, называются карбоновыми кислотами.
Группа атомов 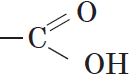
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными.
Общая формула этих кислот $RCOOH$, например:
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты:
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические.
Предельными, или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:
или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат $π$-связей в углеводородном радикале. В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой) $СН_2=СН—СООН$ или олеиновой $СН_3—(СН_2)7—СН=СН—(СН_2)7—СООН$ и других кислот.
Как видно из формулы бензойной кислоты, она является ароматической, так как содержит в молекуле ароматическое (бензольное) кольцо:
Номенклатура и изомерия
Общие принципы образования названий карбоновых кислот, как и других органических соединений, уже рассматривались. Остановимся подробнее на номенклатуре одно- и двухосновных карбоновых кислот. Название карбоновой кислоты образуется от названия соответствующего алкана (алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов-, окончания -ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например:
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
Многие кислоты имеют и исторически сложившиеся, или тривиальные, названия.
Названия карбоновых кислот.
| Химическая формула | Систематическое название кислоты | Тривиальное название кислоты |
| $Н—СООН$ | Метановая | Муравьиная |
| $СН_3—СООН$ | Этановая | Уксусная |
| $СН_3—СН_2—СООН$ | Пропановая | Пропионовая |
| $СН_3—СН_2—СН_2—СООН$ | Бутановая | Масляная |
| $СН_3—СН_2—СН_2—СН_2—СООН$ | Пентановая | Валериановая |
| $СН_3—(СН_2)4—СООН$ | Гексановая | Капроновая |
| $СН_3—(СН_2)5—СООН$ | Гептановая | Энантовая |
| $НООС—СООН$ | Этандиовая | Щавелевая |
| $НООС—СН_2—СООН$ | Пропандиовая | Малоновая |
| $НООС—СН_2—СН_2—СООН$ | Бутандиовая | Янтарная |
После знакомства с многообразным и интересным миром органических кислот рассмотрим более подробно предельные одноосновные карбоновые кислоты.
Понятно, что состав этих кислот выражается общей формулой $С_nН{2n}О_2$, или $С_nН{2n+1}СООН$, или $RCOOH$.
Физические и химические свойства
Физические свойства.
Низшие кислоты, т.е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырех атомов углерода, — жидкости с характерным резким запахом (вспомните запах уксусной кислоты). Кислоты, содержащие от $4$ до $9$ атомов углерода, — вязкие маслянистые жидкости с неприятным запахом; содержащие более $9$ атомов углерода в молекуле — твердые вещества, не растворяющиеся в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, например, температура кипения муравьиной кислоты равна $100,8°С$, уксусной — $118°С$, пропионовой — $141°С$.
Простейшая карбоновая кислота — муравьиная $НСООН$, имея небольшую относительную молекулярную массу $(M_r(HCOOH)=46)$, при обычных условиях является жидкостью с температурой кипения $100,8°С$. В то же время бутан $(M_r(C_4H{10})=58)$ в тех же условиях газообразен и имеет температуру кипения $–0,5°С$. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями:
Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил 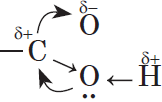
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Химические свойства.
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильную полярную связь между атомами водорода и кислорода. Рассмотрим эти свойства на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
$CH_3-COOH⇄CH_3-COO^{-}+H^+$
Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды:
$CH_3-COOH+H_2O⇄CH_3COO^{-}+H_3O^+$
Равновесие диссоциации карбоновых кислот смещено влево; подавляющее большинство их — слабые электролиты. Тем не менее, кислый вкус, например, уксусной и муравьиной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т.е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода: $nR-COOH+M→(RCOO){n}M+{n}/{2}H_2↑$
Так, железо восстанавливает водород из уксусной кислоты:
$2CH_3-COOH+Fe→(CH_3COO){2}Fe+H_2↑$
3. Взаимодействие с основными оксидами с образованием соли и воды:
$2R-COOH+CaO→(R-COO){2}Ca+H_2O$
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
$R—COOH+NaOH→R—COONa+H_2O$,
$2R—COOH+Ca(OH)2→(R—COO){2}Ca+2H_2O$.
5. Взаимодействие с солями более слабых кислот с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия:
$CH_3COOH+C_{17}H_{35}COONa→CH_3COONa+C_{17}H_{35}COOH↓$,
$2CH_3COOH+K_2CO_3→2CH_3COOK+H_2O+CO_2↑$.
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт:
Очевидно, что реагировать с карбоновыми кислотами, т.е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин:
Все карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты. Например, реакция присоединения водорода — гидрирование. Для кислоты, содержащей в радикале одну $π$-связь, можно записать уравнение в общем виде:
$C_{n}H_{2n-1}COOH+H_2{→}↖{катализатор}C_{n}H_{2n+1}COOH.$
Так, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
${C_{17}H_{33}COOH+H_2}↙{text»олеиновая кислота»}{→}↖{катализатор}{C_{17}H_{35}COOH}↙{text»стеариновая кислота»}$
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:
${CH_2=CH—COOH+Br_2}↙{text»акриловая(пропеновая)кислота»}→{CH_2Br—CHBr—COOH}↙{text»2,3-дибромпропановая кислота»}.$
8. Реакции замещения (с галогенами) — в них способны вступать предельные карбоновые кислоты. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
$CH_3COOH+Cl_2{→}↖{Р(красный)}{CH_2Cl-COOH+HCl}↙{text»хлоруксусная кислота»}$,
$CH_2Cl-COOH+Cl_2{→}↖{Р(красный)}{CHCl_2-COOH+HCl}↙{text»дихлоруксусная кислота»}$,
$CHCl_2-COOH+Cl_2{→}↖{Р(красный)}{CCl_3-COOH+HCl}↙{text»трихлоруксусная кислота»}$
Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота ХЦООХ — жидкость с резким запахом и температурой кипения $100.8°С$, хорошо растворима в воде. Муравьиная кислота ядовита, при попадании на кожу вызывает ожоги! Жалящая жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленности, медицине. Она используется при крашении тканей и бумаги.
Уксусная (этановая) кислота $CH_3COOH$ — бесцветная жидкость с характерным резким запахом, смешивается с водой в любых cоотношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса ($3–5%$-ный раствор) и уксусной эссенции ($70–80%$-ный раствор) и широко используются в пищевой промышленности. Уксусная кислота — хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества, используемые для борьбы с сорняками, — гербициды.
Уксусная кислота является основным компонентом винного уксуса, характерный запах которого обусловлен именно ею. Она — продукт окисления этанола и образуется из него при хранении вина на воздухе.
Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая $C_{15}H_{31}COOH$ и стеариновая $C_{17}H_{35}COOH$ кислоты. В отличие от низших кислот, эти вещества твердые, плохо растворимы в воде.
Однако их соли — стеараты и пальмитаты — хорошо растворимы и обладают моющим действием, поэтому их еще называют мылами. Понятно, что эти вещества производят в больших масштабах. Из непредельных высших карбоновых кислот наибольшее значение имеет олеиновая кислота $C_{17}H_{33}COOH$, или $CH_3 — (CH_2)_7 — CH=CH —(CH_2)_7COOH$. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят ее соли.
Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота $HOOC—COOH$, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота — это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
Классификация кислот
Материал по химии
- Определение кислот
- Классификация кислот по составу
- Классификация кислот по основности
- Сильные и слабые кислоты
- Тривиальные названия некоторых кислот
- «Протон» или «катион»?
- Кислоты и индикаторы
Определение кислот
Кислоты ‒ это вещества, способные в растворах отдавать катион (протон) водорода.
Примеры диссоциации кислот:
HCl ↔ H+ + Cl‒
H2SO4 ↔ 2H+ + SO42‒
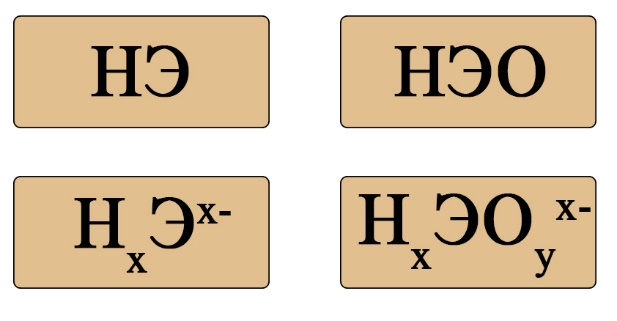
Если пока понятие диссоциации неизвестно, легче ориентироваться по общим формулам кислот:
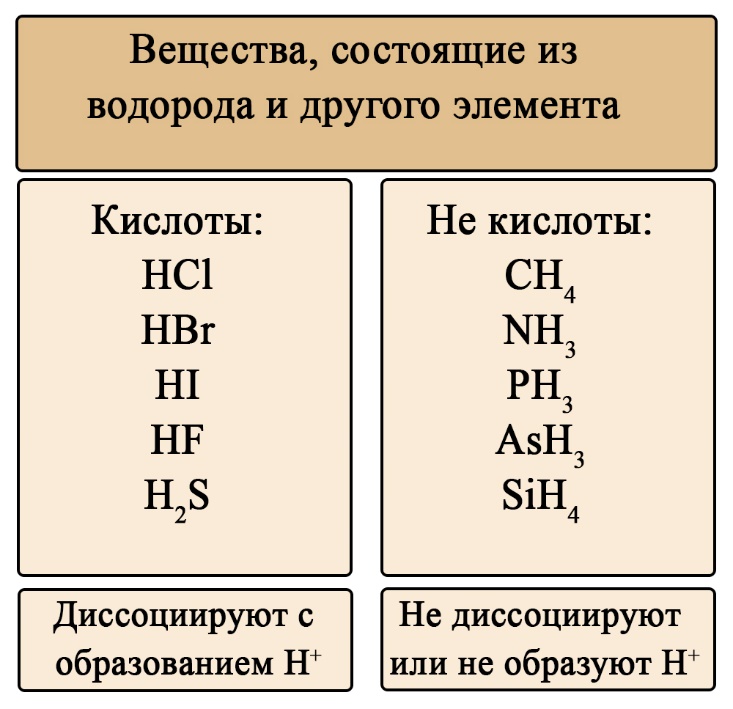
Важен не только состав, но и последовательность. На первом месте должен стоять водород, за ним – элемент, если в составе есть кислород, то он должен стоять последним. Например, HCl – кислота (соответствует формуле HЭ), H2S – тоже кислота (на первом месте водород, на втором — сера), а вот NH3 несмотря на то, что состоит из водорода и элемента, не является кислотой, это легко определить по последовательности: в этой формуле сначала стоит элемент, а за ним – водород (иногда, чтобы запутать сдающего, составитель может написать не NH3, а H3N, Вы должны помнить, что NH3 (аммиак), PH3(фосфин), AsH3 (арсин), CH4 (метан) – не являются кислотами, так как в воде либо не диссоциируют, либо диссоциируют без образования протона водорода. H2SO4 – является кислотой, так как формула имеет порядок элементов «водород → элемент → кислород», а NaOH, тоже состоящая из элемента, кислорода и водорода – кислотой не является, так как тут последовательность будет такова: «элемент → кислород → водород».
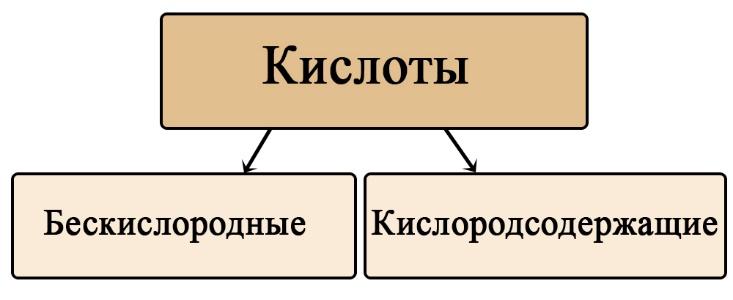
Классификация кислот по составу
Кислоты можно разделить на кислородсодержащие и бескислородные. Не трудно догадаться, что бескислородные не содержат атомов кислорода, а кислородсодержащие — содержат. Кислородсодержащие кислоты образованы соответствующими оксидами, а бескислородные образованы прямым взаимодействием простых веществ.
Таб. Примеры бескислородных и кислородсодержащих кислот, образованных одним и тем же неметаллом
|
Бескислородные |
Кислородсодержащие |
|
HCl |
HClO4 |
|
H2S |
H2SO3 |
|
HBr |
HBrO |
|
HI |
HIO2 |
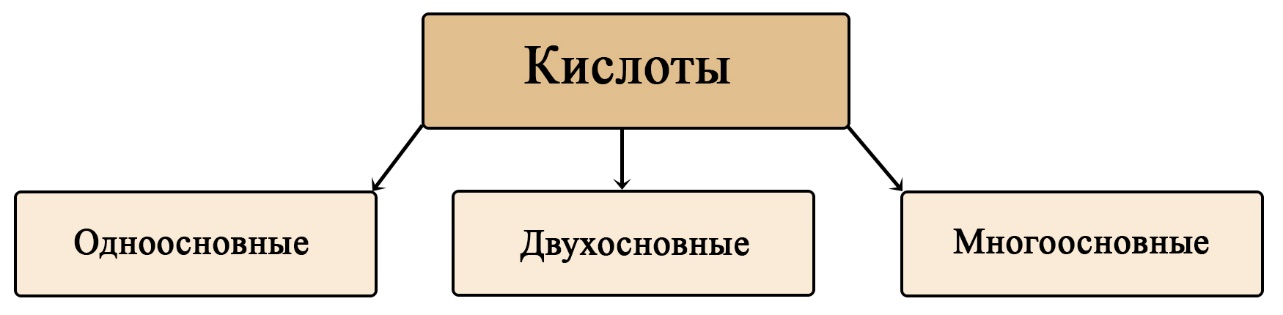
Классификация кислот по основности
Кислоты могут отдать столько водорода, сколько имеется в их составе (в большинстве случаев, есть исключения). Если может отдать максимум один водород – то кислота относится к одноосновным, если может отдать максимум два протона водорода – то двухосновная и так далее.
Например:
HCl ↔ H+ + Cl‒ (одноосновная)
H2SO4 ↔ 2H+ + SO42‒ (двухосновная)
H3PO4 ↔ 3H+ + PO43- (трехосновная/многоосновная)
Таб. Примеры кислот с разной основностью
|
Одноосновные (один водород) |
Двухосновные (два водорода) |
Многоосновные (три и более протона водорода) |
|
HNO3 |
H2S |
H3PO4 |
|
HF |
H2SiO3 |
H3BO3 |
|
HBrO |
H2CO3 |
H4P2O7 |
Сильные и слабые кислоты
От чего зависит сила кислот? В первую очередь от скорости отдачи протона водорода при диссоциации (чем быстрее кислота отдает протон водорода, тем она считается сильнее). Как определить скорость «на глаз», не имея под рукой никаких справочных материалов, кроме таблицы Менделеева?
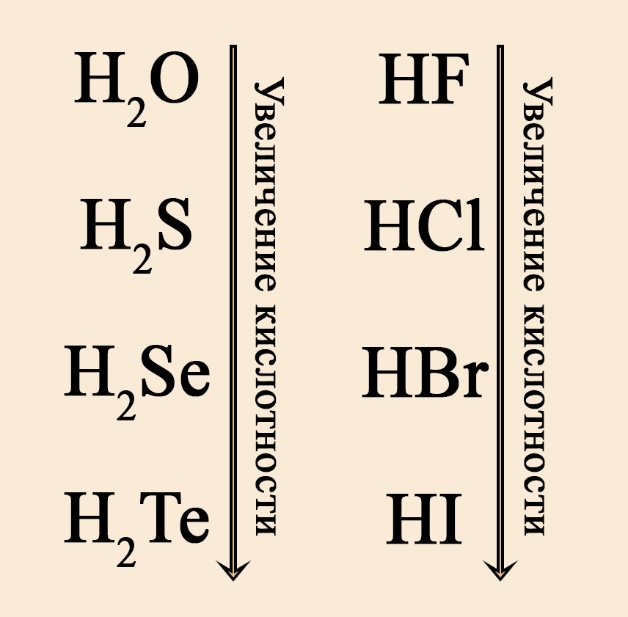
- Если кислота бескислородная, то скорость диссоциации можно определить по радиусу атома, образующего эту кислоту элемента. Напомним, что радиус увеличивается в ПС (периодической системе) сверху-вниз и справа-налево. Так, в ряду кислот HF → HCl → HBr → HI радиус увеличивается от фтора к йоду, так как йод стоит в ПС значительно ниже, чем фтор. Радиус фтора небольшой, поэтому протон водорода прочно связан со фтором, скорость диссоциации будет низкой, значит, кислота слабая. У йода пять электронных оболочек, между йодом и водородом большее расстояние, чем между фтором и водородом, поэтому молекула йодоводорода будет диссоциировать значительно быстрее, значит, кислота сильная. Аналогичную закономерность можно наблюдать в ряду кислот, образованных халькогенами (неметаллами VIА-группы): чем ниже халькоген, тем сильнее образуемая им кислота, поэтому H2S слабее H2Se, а H2Se слабее, чем H2Te.
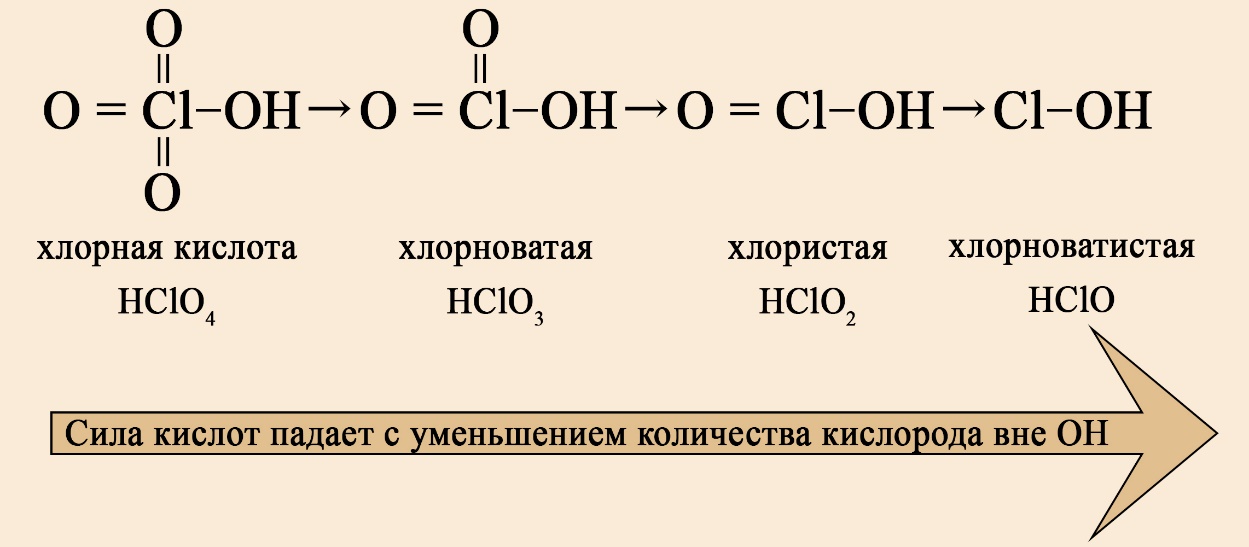
- Если кислота кислородсодержащая, то её сила зависит от количества кислорода, не входящего в гидроксо-группы. Чем больше кислорода вне -OH группы, тем сильнее кислота. Так, дихромовая кислота сильнее хромовой, потому как дихромовая кислота имеет четыре кислорода вне гидроксо-группы, а хромовая – два кислорода вне гидроксогруппы.
В ряду хлорсодержащих кислот наблюдается такая же закономерность:
Список сильных кислот: HI, HCl, HBr, HNO3, HClO4, HClO3, HBrO3, H2SO4, HMnO4, H2Cr2O7.
Список слабых кислот: H2S, HF, HNO2, H2SO3, H2CO3, HClO, карбоновые кислоты.
В действительности классификация кислот по их силе несколько богаче, и те кислоты, которые в школе записывают в слабые (например, ортофосфорную и фтороводородную) на самом деле относят к кислотам средней силы. Помимо классификации важно знать и названия кислот, а также их остатки. Остатками кислот называют отрицательно-заряженные ионы (анионы), которые образуются при диссоциации кислоты в воде. То есть остаток кислоты – это частица, которая остаётся, если отнять у кислоты весь водород. Вот несколько таблиц, в которых кислоты сгруппированы по силе, с указанием соответствующих кислотных остатков и примерами солей:
Таб. Самые сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HI |
йодоводородная |
I‒ |
NaI -йодид натрия |
|
HBr |
Бромоводородная |
Br‒ |
KBr – бромид калия |
|
HCl |
Хлороводородная, соляная |
Cl‒ |
CaCl2 – хлорид кальция |
|
HClO4 |
Хлорная |
ClO4‒ |
NaClO4 – перхлорат натрия |
|
H2SO4 |
Серная |
SO42‒ |
K2SO4 – сульфат калия |
|
HMnO4 |
Марганцовая |
MnO4‒ |
NaMnO4 – перманганат натрия |
Таб. Сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HClO3 |
Хлорноватая |
ClO3‒ |
KClO3 – хлорат калия |
|
HBrO3 |
Бромноватая |
BrO3‒ |
Ba(BrO3)2 – бромат бария |
|
H2Cr2O7 |
Дихромовая |
Cr2O72‒ |
(NH4)2Cr2O7 – дихромат аммония |
Таб. Кислоты средней силы и их остатки (в ОГЭ и ЕГЭ считаем слабыми)
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HNO2 |
Азотистая |
NO2‒ |
NaNO2 – нитрит натрия |
|
H3PO4 |
Фосфорная (ортофосфорная) |
PO43‒ |
(NH4)3PO4 – фосфат аммония |
|
HF |
Фтороводородная (плавиковая) |
F‒ |
CaF2 – фторид кальция |
|
HClO2 |
Хлористая |
ClO2‒ |
KClO2 – хлорит калия |
Таб. Слабые кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
H2S |
Сероводородная |
S2‒ |
MgS – сульфид магния |
|
HCN |
Циановодородная |
CN‒ |
KCN – цианид калия |
|
H2CO3 |
Угольная |
CO32‒ |
CaCO3 – карбонат кальция |
|
H2SO3 |
Сернистая |
SO32‒ |
BaSO3 – сульфит бария |
|
HClO |
Хлорноватистая |
ClO‒ |
NaClO – гипохлорит натрия |
|
H2SiO3 |
Кремниевая |
SiO32‒ |
K2SiO3 – силикат калия |
|
CH3COOH |
Уксусная |
CH3COO‒* |
CH3COONa – ацетат натрия |
*В органических кислотах водород пишется не в начале молекулы, а в конце, например:
CH3COOH – уксусная кислота, диссоциирует следующим образом:
CH3COOH ↔ CH3COO‒ + H+
C2H5COOH – пропионовая кислота
CH3CH2COOH ↔ CH3CH2COO‒ + H+
C3H7COOH – масляная кислота.
C3H7COOH ↔ C3H7COO‒ + H+
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- H2SO2
- HCl
- HNO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородная слабая
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HNO2
- HBr
- H3PO4
- одноосновная сильная
- одноосновная слабая
- многоосновная сильная
- многоосновная слабая
Задание по образцу ФИПИ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HF
- H2CO3
- H2SiO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородна слабая
Тривиальные названия некоторых кислот
Многие кислоты имеют альтернативное историческое название, например, хлороводородную кислоту еще называют соляной кислотой, потому что она образует самую популярную соль – NaCl (поваренная соль, используемая в быту). Фтороводородную кислоту называют плавиковой, так как она плавит стекло (поэтому данную кислоту не хранят в стеклянной таре). Муравьиную и щавелевую кислоты назвали так по источнику получения.
«Протон» или «катион»?
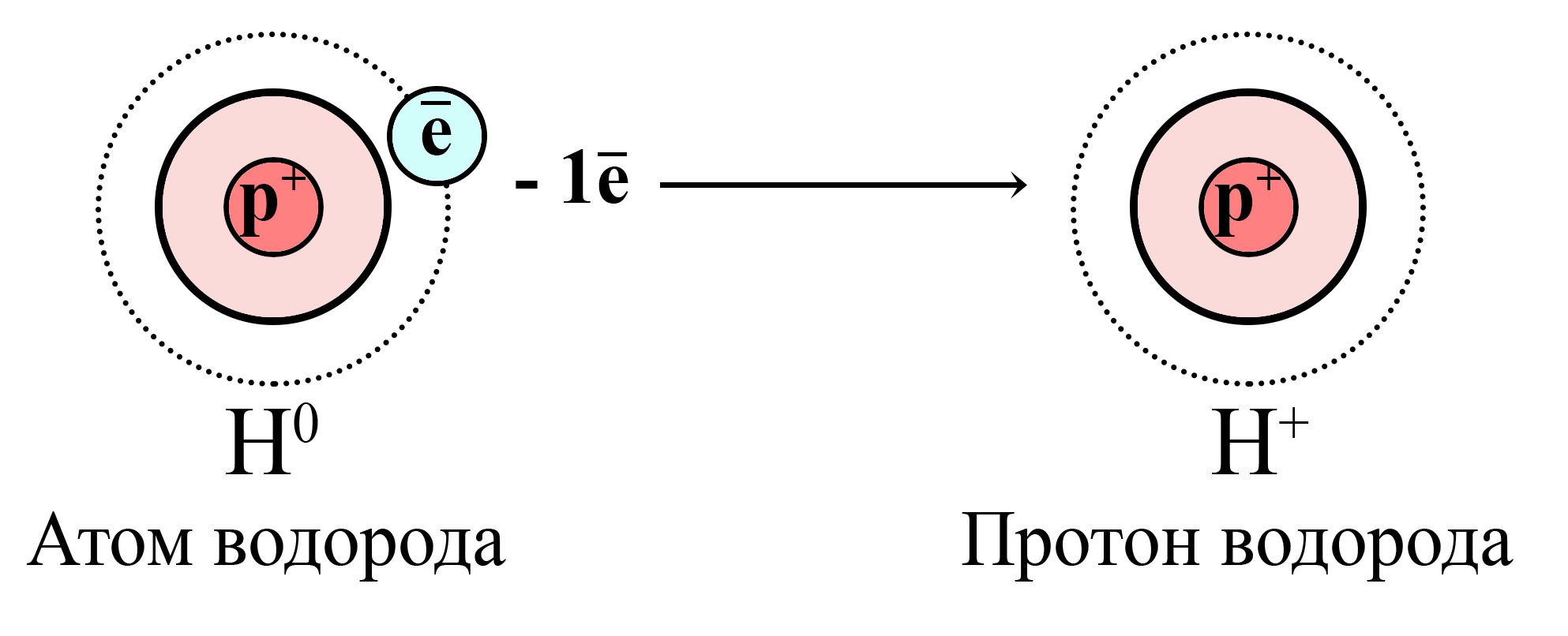
Для всех положительно заряженных частиц характерен термин «катион», однако, по отношению к водороду принято говорить «протон». А дело всё в том, что другие элементы при потере внешних электронов, все равно обладают электронами внутренних слоёв, тогда как водород, содержащий всего один электрон, потеряв его, становится протоном (нейтронов в ядре тоже нет).
Поэтому принято говорить, что кислота отдает не катион водорода, а протон водорода.
Кислоты и индикаторы
Для определения кислот в растворах можно использовать стандартные индикаторы (вещества, меняющие цвет в определенной среде): лакмус и метиловый оранжевый, фенолфталеин кислотами не окрашивается. Лакмус в кислых растворах (рН < 7) становится красным, а метиловый оранжевый – красным или розовым.
2.6. Характерные химические свойства кислот.
Классификация кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные |
двухосновные |
трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH |
H2SO4, H2SO3, H2CO3, H2SiO3 |
H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
|
H2S, HCl, CH3COOH, HCOOH |
H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
|
хорошо диссоциирующие (сильные) |
малодиссоциирующие (слабые) |
|
H2SO4, HCl, HBr, HI, HNO3, HClO4 |
H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
|
слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) |
сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
|
практически все кислоты кроме HNO3 и H2SO4 (конц.) |
HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка (), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H+ + Cl—
либо в таком: HCl → H+ + Cl—
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки
. Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
H3PO4 H+ + H2PO4—
H2PO4— H+ + HPO42-
HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
H2SO4 + ZnO ZnSO4 + H2O
6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
2H2S + SO2 3S↓+ 2H2O
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 454 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Верны ли следующие утверждения о свойствах карбоновых кислот?
А. Карбоновые кислоты образуются при окислении первичных спиртов и альдегидов.
Б. Для карбоновых кислот характерна реакция гидролиза.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Верны ли следующие суждения о свойствах альдегидов и карбоновых кислот?
А. Альдегиды вступают как в реакции окисления, так и в реакции восстановления.
Б. При взаимодействии карбоновых кислот со спиртами образуются сложные эфиры.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1
Из предложенного перечня выберите все органические соединения, свойства которых способна проявлять муравьиная кислота.
1) алкан
2) спирт
3) карбоновая кислота
4) альдегид
5) алкен
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Задания Д19 № 566
Для насыщенных карбоновых кислот характерна (ы):
1) реакции со спиртами
2) реакции с металлами, стоящими левее водорода в ряду напряжений металлов
3) реакция с перманганатом натрия
4) реакция с гидроксидом калия
5) реакции с металлами, стоящими правее водорода в ряду напряжений металлов
6) реакция с бромной водой
Верны ли следующие суждения о свойствах альдегидов?
А. При окислении альдегиды превращаются в карбоновые кислоты.
Б. Альдегиды вступают в реакции с водородом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4
Из предложенного перечня выберите все вещества, при взаимодействии которых с раствором перманганата калия в кислой среде образуется карбоновая кислота.
1) гексен-1
2) бензол
3) метилбензол
4) метилэтиловый эфир
5) уксусный альдегид
Запишите номера выбранных ответов.
Источник: Демонстрационная версия ЕГЭ—2022 по химии, Демонстрационная версия ЕГЭ—2023 по химии
Верны ли следующие суждения о свойствах предельных карбоновых кислот.
А. Все кислоты являются жидкостями при нормальных условиях.
Б. При взаимодействии со спиртами образуют сложные эфиры.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Для пропаналя характерна(-о):
1) sр-гибридизация атомов углерода
2) изменение окраски индикатора
3) восстановительные свойства
4) взаимодействие с гидроксидом меди (II)
5) взаимодействие с аммиачным раствором оксида серебра (I)
6) взаимодействие с карбоновыми кислотами
Задания Д19 № 738
Муравьиная кислота взаимодействует с
1) оксидом кремния (IV)
2) углеродом
3) карбонатом натрия
4) хлороводородом
5) этанолом
6) оксидом серебра (аммиачный раствор)
Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) бензойная кислота и раствор гидроксида натрия
Б) бензойная кислота и избыток твёрдого гидроксида натрия (при нагревании)
В) бензойная кислота и этанол (в присутствии серной кислоты)
Г) бензойная кислота и азотная кислота (в присутствии серной кислоты)
ОРГАНИЧЕСКИЙ ПРОДУКТ
РЕАКЦИИ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этилат натрия и вода
Б) этанол и бромоводород
В) уксусная кислота и натрий
Г) уксусная кислота и бром
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) бромуксусная кислота
2) формиат натрия
3) этанол
4) бромэтан
5) бромацетат
6) ацетат натрия
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) уксусная кислота и этанол
Б) уксусная кислота и гидроксид меди (II)
В) уксусная кислота и карбонат натрия
Г) уксусная кислота и хлорангидрид уксусной кислоты
ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ
1) уксусный ангидрид
2) этилат натрия
3) ацетат натрия
4) ацетат меди (II)
5) этилацетат
6) этаналь
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Задания Д19 № 437
Муравьиная кислота взаимодействует с
1) оксидом углерода (IV)
2) азотом
3) карбонатом кальция
4) хлороводородом
5) пропанолом-1
6) оксидом серебра (аммиачный раствор)
Задания Д19 № 867
Муравьиная кислота взаимодействует с
1) оксидом кремния (IV)
2) углеродом
3) карбонатом натрия
4) хлороводородом
5) этанолом
6) оксидом серебра (аммиачный раствор)
Муравьиная кислота взаимодействует с
1) оксидом азота (II)
2) серой
3) аммиаком
4) хлоридом алюминия
5) водородом
6) гидроксидом меди (II)
Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) ацетат меди
2) гликолят меди
3) формиат меди
4) фенолформальдегидная смола
5) муравьиная кислота
6) фенол
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Из предложенного перечня выберите все вещества, которые образуются при окислении ацетальдегида в кислой среде.
1) этилен
2) ацетат натрия
3) уксусная кислота
4) вода
5) этиловый спирт
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, с которыми взаимодействует муравьиная кислота.
1) хлорид натрия
2) карбонат калия
3) гидросульфат натрия
4) аммиачный раствор оксида серебра
5) оксид азота (II)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Установите соответствие между схемой реакции и продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ РЕАКЦИИ
1) 3,5-динитрофенол
2) 2,4,6-тринитрофенол
3) метилацетат
4) 2,2,2-трибромэтаналь
5) 1-метоксиэтанол
6) уксусная кислота
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Из предложенного перечня выберите все вещества, которые реагируют с бромной водой.
1) пропанол-1
2) ацетон
3) этаналь
4) диметиловый эфир
5) пропионовая кислота
Запишите номера выбранных ответов в порядке возрастания.
Всего: 454 1–20 | 21–40 | 41–60 | 61–80 …
Содержание
- Определение
- Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства кислот
- Физические свойства
- Химические свойства
- Получение и применение кислот
- Выводы
Определение
Карбоновые кислоты — это производные углеводородов, в молекулах которых содержится одна или несколько карбоксильных групп:
Карбоксильная группа имеет сложный состав. Она состоит из карбонильной и гидроксильной (гидроксо) групп:
Карбоновые кислоты часто встречаются в природе, придавая ягодам и фруктам, а также некоторым другим продуктам питания кислый вкус. Их делят на различные группы (классы) по некоторым признакам:
- По строению (составу) углеводородного радикала кислоты делят на:
– Предельные
в углеводородном радикале только простые связи;
– Непредельные (в углеводородном радикале есть кратная связь);
в углеводородном радикале есть кратная связь;
– Ароматические
имеется бензольное кольцо.
Задание 24.1. Определите состав этих кислот.
Для того чтобы различить по составу предельные и непредельные кислоты, нужно умножить на два число атомов углерода в углеводородном радикале и сравнить полученную величину (С) с числом атомов водорода (В) в углеводородном радикале:
- у предельных кислот В > C, например для С3Н7СООН: В = 7, а С = 3 · 2 = 6;
- у непредельных кислот B < C, например для С3Н5СООН: В = 5, а С = 3 · 2 = 6.
Задание 24.2. Какая из следующих кислот является предельной:
- По числу карбоксильных групп кислоты делят на:
– Одноосновные
есть одна карбоксильная группа;
– Двухосновные
есть две карбоксильные группы.
Бывают кислоты, содержащие и большее число карбоксильных групп. Рассмотрим строение молекул и свойства карбоновых кислот на примере предельных одноосновных кислот.
Гомологический ряд, номенклатура, изомерия
Предельные одноосновные карбоновые кислоты образуют гомологический ряд с общей формулой:
Если
- n = 0, то Н–СООН метановая кислота (муравьиная)
- n = 1, то СН3–СООН этановая кислота (уксусная).
Вопрос. По какому принципу составляются названия кислот?
Для того чтобы составить название кислоты, нужно:
- подсчитать все атомы углерода (считая и атом углерода карбоксильной группы);
- назвать алкан, который имеет такое же число атомов углерода и то же строение;
- дописать к этому названию «овая» и слово «кислота».
Кроме того, для кислот чаще всего используют тривиальные названия (муравьиная, уксусная), которые указывают на происхождение кислоты или её отличительные признаки. Например, название муравьиная указывает, что эта кислота входит в состав жгучего сока муравьёв. А слово «уксусная» происходит от греческого слова «оксос», что означает «кислый». Запомните некоторые из этих названий:
- n = 2 CH3–СН2–СOОH С2Н5СООН пропионовая кислота,
- n = 3 СН3–СН2–CH2–СООН С3Н7СООН масляная кислота,
- ………….
- n = 17 C17H35COOH стеариновая кислота.
Задание 24.3. Назовите по ИЮПАК пропионовую и масляную кислоты.
Если вы выполнили вышеизложенные правила, у вас получилось: пропановая кислота, бутановая кислота.
Начиная с n = 3, у кислот появляются изомеры. Изомерия предельных кислот связана со строением углеводородного радикала:
Задание 24.4. Составьте молекулярные формулы этих кислот и убедитесь, что это изомеры.
Строение молекул
В состав карбоксильной группы входит гидроксогруппа ОН.
Вопрос. В каких соединениях встречается функциональная группа ОН?
Такая же группа входит в состав молекул спиртов. Спирты проявляют очень слабые кислотные свойства, могут вступать в реакции только с очень активными, щелочными металлами, не изменяют окраску индикатора, не реагируют с растворами щелочей.
Если в раствор карбоновой кислоты добавить индикатор (лакмус), то раствор окрасится в красный цвет. Это означает, что кислоты проявляют более кислые свойства, чем спирты. Почему? Потому что карбонильная группа, которая расположена рядом с гидроксогруппой, влияет на неё.
Карбонильная группа, которая входит в состав карбоксильной группы, имеет (+) на атоме углерода. За счёт этого небольшого положительного заряда происходит смещение общих электронных пар связей «С–О» и «О–Н», поэтому эти связи становятся более полярными:
Таким образом, карбонильная группа увеличивает полярность связи О–Н, делая её более полярной. Поэтому атом водорода карбоксильной группы становится очень подвижным. Он легко замещается на атом металла, способен отщепляться в растворах: кислоты диссоциируют:
Гидроксогруппа тоже влияет на карбонильную группу, делая ее неактивной, поэтому кислоты не участвуют в реакциях с разрывом π-связи карбонильной группы.
Карбоксильная группа влияет на углеводородный радикал, делая некоторые связи С–Н в нём более полярными, и кислоты могут участвовать в реакциях замещения атомов водорода радикала.
Свойства кислот
Физические свойства
Кислоты с небольшим числом атомов углерода (1–10) — жидкости с резким запахом. Вкус у них разный — уксусная кислота — кислая, а масляная — горькая. Низшие кислоты растворимы в воде, причём с увеличением длины радикала их растворимость ухудшается.
Например, уксусная кислота — бесцветная жидкость с резким запахом. Смешивается с водой в любых соотношениях. 60…90 %-ные растворы уксусной кислоты (уксусная эссенция) опасны для жизни, в то время как 6…8 %-ные растворы столового уксуса широко применяются при приготовлении пищи.
Высшие кислоты, например стеариновая кислота, твёрдые, нерастворимые в воде вещества, лишённые запаха. Смесь таких кислот называется «стеарин». Из стеарина делают свечи.
Химические свойства
Кислоты проявляют все свойства неорганических кислот.
Вопрос. Какие свойства кислот вам известны?
Кислоты реагируют с металлами, которые стоят в ряду напряжений до водорода:
При составлении таких реакций следует помнить, что
- кислотный остаток — это часть молекулы кислоты без подвижного атома водорода; в данном случае это: С3Н7СОО;
- валентность кислотного остатка равна числу замещённых атомов водорода, в данном случае замещается один атом водорода и валентность равна I;
- исходя из этого, нужно переписать после реакции кислотный остаток, взять его в скобки и за скобками поставить цифру, равную валентности металла, а затем записать символ самого металла.
В результате такой реакции образуется соль и выделяется водород.
Кислоты реагируют с основными и амфотерными оксидами:
В этом случае образуется соль и вода. Такие же продукты реакции образуются при взаимодействии кислоты и основания:
Большинство карбоновых кислот — слабые кислоты. Тем не менее они могут вытеснять более слабые кислоты из их солей:
Итак, во всех этих реакциях образуются соли. Названия солей происходят от латинских названий кислот. Запомните эти названия!
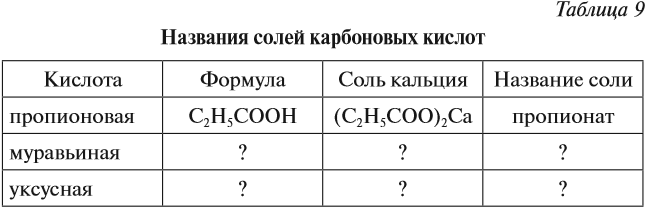
Задание 24.5. Составьте для известных Вам карбоновых кислот таблицу по схеме:
Названия солей см. выше (в уравнениях химических реакций).
Кислоты могут реагировать со спиртами, в результате получаются сложные эфиры:
Это реакция этерификации. Она происходит в присутствии концентрированной серной кислоты. (Подробнее о названиях и свойствах сложных эфиров см. урок 25.)
Кислоты могут реагировать с галогенами за счёт углеводородного радикала, при этом на атом галогена замещается атом водорода у ближайшего к карбоксильной группе атома углерода (это α-углеродный атом):
Получение и применение кислот
Кислоты можно получить при помощи окисления соответствующего альдегида:
Задание 24.6. Какой альдегид нужно взять для получения уксусной кислоты? 2-метилпропановой кислоты? Составьте уравнения реакций.
Вопрос. В каких условиях происходят процессы окисления альдегидов? Являются ли эти реакции качественными на альдегидную группу?
Кислоты применяются для получения душистых веществ, растворителей, входят в состав лекарств. Наибольшее применение получила ледяная (безводная) уксусная кислота, которая используется в технических целях (для получения лекарств, ацетатного шёлка, растворителей). В магазине можно купить и пищевую уксусную кислоту (70 %-ный раствор), и уксус (6 %-ный раствор). Концентрированная уксусная кислота — яд! Она вызывает тяжёлые ожоги внутренних органов, разрушает кровь. Её следует разбавлять водой до безопасных 5–7 % (примерно 1:10). Столовый уксус используют при приготовлении пищи. Его получают из глюкозы по схеме:
Некоторые (жирные) кислоты входят в состав жиров (см. урок 25).
Выводы
Кислоты — это производные углеводородов, содержащие карбоксильную группу. Для них характерны реакции:
- замещения атома Н карбоксильной группы (с металлами);
- обмена (с оксидами, гидроксидами, солями);
- этерификации (со спиртами);
- замещения атома Н радикала (с галогенами).
Кислоты входят в состав различных овощей, фруктов и других пищевых продуктов. Используются при приготовлении пищи, например уксус.