Навигация
|
Справочные материалы
|
Химия
В помощь сдающим ОГЭ
методическое пособие по химии
для учащихся 9-х классов,
Тема №1: «Строение атомов первых 20 химических элементов
ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
Строение атома: ядро (протоны и нейтроны) + электроны.
Число протонов (p+) – равно порядковому номеру химического элемента (Z).
Число нейтронов (n0) – равно A-Z, где А – массовое число.
Число электронов (е—) — равно порядковому номеру химического элемента (Z).
Заряд ядра = число протонов = число электронов (+Z = p+ = е—).
Номер периода показывает – число электронных слоев в электронной оболочке атома.
Номер группы показывает – число электронов на внешнем электронном слое атома + число валентных электронов.
Валентные электроны – электроны, участвующие в образовании химической связи.
Распределение электронов по энергетическим уровням: на 1-м максимум 2 электрона, на 2-м – 8 электронов, на 3-м – 18 электронов (если уровень последний – то число электронов на нём равно номеру группы или высчитывается как разница общего числа электронов и электронов на предыдущих уровнях). Если последний (внешний) уровень атома имеет максимальное число электронов, то такой электронный слой называется завершенным (его имеют атомы благородных газов – элементы 8 группы).
Тема №2: «Периодический закон и ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
Закономерности изменения свойств элементов и их соединений.
В периоде слева направо:
-
Радиус атома уменьшается;
-
Металлические свойства ослабевают;
-
Неметаллические свойства возрастают;
-
Восстановительные свойства ослабевают;
-
Окислительные свойства возрастают;
-
Электроотрицательность возрастает;
-
Число валентных электронов возрастает;
-
Основные оксиды через амфотерные сменяются кислотными.
В группе сверху вниз:
-
Радиус атома возрастает;
-
Металлические свойства возрастают;
-
Неметаллические свойства ослабевают;
-
Восстановительные свойства возрастают;
-
Окислительные свойства ослабевают;
-
Электроотрицательность уменьшается;
-
Число валентных электронов постоянно и равно номеру группы.
Тема №3: «Химическая связь».
Обязательный минимум знаний.
Типы химических связей:
-
Ковалентная полярная химическая связь (образуется между атомами неметаллов с разным значением электроотрицательности или между атомами металла и неметалла с небольшой разностью в значении электроотрицательности). Например: H2S, NH3.
-
Ковалентная неполярная химическая связь (образуется между атомами неметаллов с одинаковым значением электроотрицательности). Например: H2, O2, P4, S8.
-
Ионная химическая связь (образуется между атомами неметалла и металла). Например: NaCl, CaO, K2S.
-
Металлическая химическая связь – характерна для металлов и сплавов. Например: Al, Cu, бронза, чугун, латунь.
Тема №4: «Степень окисления химических элементов».
Обязательный минимум знаний.
Правила расчета степени окисления:
-
С.о. водорода = +1 в соединениях с неметаллами и = -1 в соединениях с металлами (гидриды металлов);
-
С.о. кислорода = -2, кроме пероксидов (-1) и фторидов (+2);
-
С.о. металла = заряду его иона (в таблице растворимости);
-
С.о. простого вещества = 0;
-
Сумма с.о. всех элементов в сложном веществе = 0;
-
С.о. иона = заряду иона (в таблице растворимости).
Алгоритм определения степени окисления элементов в бинарных соединениях:
-
Выбрать более электроотрицательный элемент и найти его степень окисления, как № группы – 8. Написать над ним степень окисления.
-
Умножить степень окисления на индекс у этого элемента. Полученное число со знаком «минус» подписать под другим элементом.
-
Такое же число со знаком «плюс» подписать под другим элементом.
-
Разделить это число на индекс другого элемента. Полученную степень окисления написать над элементом.
Алгоритм определения степени окисления неметалла в кислотах и солях:
-
Отделить кислород вертикальной чертой, записать сверху его степень окисления – 2 и умножить на индекс. Полученное число написать под кислородом.
-
Такое же число с противоположным знаком записать под левой частью формулы.
-
Вычесть из него число атомов водорода (для кислот) или заряд металла*индекс металла (для солей). Полученное число написать над знаком центрального элемента.
Тема №5: «Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура органических соединений».
Обязательный минимум знаний.
Классификация веществ
Металлы Неметаллы Оксиды Основания Кислоты Соли
Оксиды – бинарные соединения кислорода, в котором он проявляет степень окисления –2 (CaO, Al2O3).
Классификация оксидов.
Оксиды
несолеобразующие солеобразующие
основные амфотерные кислотные
Несолеобразующие оксиды – не взаимодействуют с кислотами и щелочами и, как следствие, не образуют солей. Основные оксиды – образованы металлом в с.о.+1 и +2 (Na2O, MgO). Амфотерные оксиды – образованы металлами в с.о. +3 и +4 (Al2O3, PbO2). Исключения: ZnO, PbO, SnO, BeO (у них с.о. металла равна +2). Кислотные оксиды – образованы металлом в с.о.+5,+6,+7 или неметаллов, исключая несолеобразующие (SO3, CO2).
Основания – сложные соединения, в составе которых катион металла соединен с гидроксид-анионами: Me(OH)n. Например: NaOH, Ca(OH)2. Основания могут быть растворимыми и нерастворимыми. Растворимые в воде основания – щелочи (они окрашивают индикаторы).
Кислоты – сложные соединения, в составе которых атом водорода соединен с кислотным остатком (HCl, H2SO4). Кислотный остаток может состоять из одного элемента (Cl—) и быть сложным (SO4—).
Соли – сложные вещества, в составе которых катион металла соединен с кислотным остатком (NaCl, CaSO4).
Формулы и названия кислот и солей.
|
Формула кислоты |
Название кислоты |
Название соли |
Пример соли |
|
HF |
Фтороводородная (плавиковая) |
Фторид |
FeF3, фторид железа (III) |
|
HCl |
Хлороводородная (соляная) |
Хлорид |
CuCl2, хлорид меди (II) |
|
HBr |
Бромоводородная |
Бромид |
MgBr2, бромид магния |
|
HI |
Йодоводородная |
Йодид |
NaI, йодид натрия |
|
H2S |
Сероводородная |
Сульфид |
FeS, сульфид железа (II) |
|
H2SO3 |
Сернистая |
Сульфит |
Na2SO3, сульфит натрия |
|
H2SO4 |
Серная |
Сульфат |
BaSO4, сульфат бария |
|
HNO2 |
Азотистая |
Нитрит |
KNO2, нитрит калия |
|
HNO3 |
Азотная |
Нитрат |
Cu(NO3)2, нитрат меди (II) |
|
H2CO3 |
Угольная |
Карбонат |
CaCO3, карбонат кальция |
|
H2SiO3 |
Кремниевая |
Силикат |
Na2SiO3, силикат натрия |
|
H3PO4 |
Фосфорная |
Фосфат |
Ca3(PO4)2, фосфат кальция |
Тема №6: «Условия и признаки протекания химических реакций. Химические уравнения».
Обязательный минимум знаний.
Физические явления – явления, при которых состав вещества остается постоянным, а изменяется лишь его агрегатное состояние или форма и размеры тел. Примеры: плавление парафина, таяние льда, испарение воды.
Химические явления (химические реакции)– явления, при которых одни химические вещества превращаются в другие. Примеры: горение древесины, ржавление металлов, скисание молока.
Химическое уравнение – это условная запись химической реакции с помощью химических формул и коэффициентов.
Признаки химических реакций:
-
Изменение цвета;
-
Выделение тепла и света;
-
Выделение газа;
-
Растворение осадка;
-
Изменение запаха;
-
Выпадение осадка.
.
Тема №7: «Классификация химических реакций».
Обязательный минимум знаний.
Типы химических реакций по числу и составу исходных и полученных веществ:
-
Реакция разложения – это реакции, при которых из одного вещества образуется несколько других. Например: Cu(OH)2 → CuO + H2O
-
Реакция соединения – это реакции, при которых из нескольких веществ образуется одно. Например: S + O2 → SO2
-
Реакция обмена – это реакции, при которых два сложных вещества обмениваются своими составными частями. Например:
CuSO4 + BaCl2 → BaSO4 + CuCl2
-
Реакция замещения – это реакция между простым и сложным веществом, при которой атомы простого вещества, замещают атомы одного из элементов в сложном веществе. Например:
Zn + 2HCl → ZnCl2 + H2
Типы химических реакций по тепловому эффекту:
-
Экзотермические – протекают с выделением теплоты;
-
Эндотермические – протекают с поглощением теплоты.
По изменению степени окисления исходных веществ и продуктов реакции:
-
Окислительно-восстановительные реакции (ОВР) – реакции, протекающие с изменением степени окисления;
-
Не окислительно-восстановительные реакции – реакции, протекающие без изменением степени окисления;
По участию катализатора:
-
Каталитические – протекают с участием катализатора;
-
Некаталитические – протекают без участия катализатора.
По обратимости:
-
Обратимые – протекают в двух противоположных направлениях;
NaCl + HNO3 ↔ HCl +NaNO3
-
Необратимые – протекают только в одном направлении.
NaCl + AgNO3 → AgCl↓ + NaNO3
Тема №8: «Электролиты и неэлектролиты. Катионы и анионы».
Обязательный минимум знаний.
Электролиты – вещества, растворы которых проводят электрический ток. К электролитам относятся – растворимые кислоты, щелочи, соли.
Неэлектролиты – вещества, растворы которых не проводят электрический ток. К неэлектролитам относятся – нерастворимые кислоты, основания, соли; оксиды; органические вещества: раствор сахарозы, метанол, этанол, глюкоза.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 35.
Тема №9: «Электролитическая диссоциация кислот, щелочей и солей».
Обязательный минимум знаний.
Положения ТЭД:
-
При растворении в воде электролиты диссоциируют на положительные ионы (катионы) и отрицательные ионы (анионы).
-
Под действие электрического тока катионы движутся к катоду (-), анионы – к аноду (+).
-
Диссоциация – обратимый процесс.
-
Не все электролиты диссоциируют в равной мере.
-
Химические свойства электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Кислоты – электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Например: HCl → H+ + Cl—
Основания – электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. Например: NaOH → Na+ + OH—
Соли — электролиты, которые при диссоциации образуют катионы металла и анионы кислотного остатка. Например: NaCl → Na+ + Cl—
Это важно! При диссоциации индексы выносятся вперед ионов. Например: Al2(SO4)3 → 2Al3+ + 3SO42-
Тема №10: «Реакции ионного обмена и условия их осуществления».
Обязательный минимум знаний.
Взаимодействие кислот, оснований и солей

1р р
р
Алгоритм составления реакций ионного обмена:
-
Записать исходные вещества. Подписать классы веществ.
-
Проверить, являются ли они электролитами (по таблице растворимости). По схеме определить, возможна ли такая реакция.
-
Если возможно, над ионами в исходных веществах проставить заряды (по таблице растворимости).
-
Поменять правые части формул местами и записать, таким образом продукты реакции.
-
Правильно составить формулы продуктов. Для этого поставить заряды ионов, снести их крест-накрест и сократить, если нужно.
-
Расставить коэффициенты в уравнении
-
Под формулами продуктов реакции подписать, являются ли они электролитами или неэлектролитами.
-
Записать электролиты в виде ионов с учетом индексов и коэффициентов; неэлектролиты оставить в молекулярном виде.
-
В левой и правой части сократить одинаковые частицы.
-
Записать оставшиеся после сокращения ионы и молекулы.
Условия протекания реакций ионного обмена до конца (необратимо):
-
Образуется осадок.
-
Образуется газ.
-
Образуется малодиссоциируемое вещество, например вода.
Тема №11: «Химические свойства простых веществ: металлов и неметаллов».
Обязательный минимум знаний.
+ неметалл → соль или оксид (1)
+ Н2О → Ме(ОН)n+H2 (если Ме от Li-Al) (2)
+ Н2О → Ме2Оn+H2 (если Ме от Mn-Cd) (3)
Металл + кислота → соль (растворимая) + Н2 (Ме левее Н) (4)
+ соль → соль’ (растворимая)+ Ме (5)
+ Ме2Оn → Ме’ + Ме2Om (6)
-
. Образуется бинарное соединение. Металл пишется слева, неметалл справа. У металла с.о. равна +№ группы (есть исключения), у неметалла с.о. равна № группы — 8.Например: 2Са + О2 → 2Са+2О-2.
-
. Металлы от лития до натрия реагируют с водой при комнатной температуре, остальные – при нагревании. 2Na + 2H2O → 2NaOH + H2.
-
. Данная реакция протекает при нагревании. Zn + H2O → ZnO + H2.
-
.Данная реакция характерна только для разбавленных кислот. Металлы, стоящие в ряду напряжений после водорода, с разбавленными кислотами не взаимодействуют. Ещё одно условие данной реакции: в результате неё должна быть образована растворимая соль. Mg + 2HCl → MgCl2 + H2. Это важно!: азотная кислота по особому взаимодейстует с металлами (см. А.14).
-
. Zn + CuCl2 → ZnCl2 +Cu.
-
. 2Al + Cr2O3 → Al2O3 + 2Cr
Это важно! Особенности химических свойств некоторых металлов:
1. Особенности щелочных металлов (Li, Na, K):
-
При взаимодействии с кислородом литий образует оксид Li2O, натрий образует пероксид Na2O2: 2Na + O2 → Na2O2.
-
С растворами кислот и солей не взаимодействуют, т.к. в первую очередь будут вступать в реакцию с водой.
2. Особенности алюминия:
-
При обычных условиях малоактивен, т.к. покрыт прочной оксидной пленкой Al2O3 (большинство реакций идут при нагревании);
-
Является амфотерным металлом, поэтому взаимодействует не только с растворами кислот, но и с щелочами, образуя соль — алюминат:
2Al+2NaOH+2H2O→2NaAlO2+3H2↑
-
На холоду не взаимодействует с концентрированными серной и азотной кислотами (пассивируется).
3. Особенности железа:
-
Для железа характерно образование двух соединений: Fe2+ и Fe3+;
-
Образование соединений железа:
|
+2 |
+3 |
|
1). С неметаллами |
|
|
Fe + S → FeS |
2Fe + 3Cl2 → 2FeCl3 |
|
3Fe + 2O2 → Fe3O4 |
|
|
2). C водой: |
|
|
3Fe + 4H2O → Fe3O4 + 4H2↑ |
|
|
3). С кислотами |
|
|
Fe + 2HCl → FeCl2 + H2↑ |
|
|
4). С солями: |
|
|
Fe + СuSO4 → FeSO4 + Cu |
Тема №12: «Химические свойства оксидов: основных, амфотерных, кислотных».
Обязательный минимум знаний.





Это важно! Амфотерные оксиды будут сочетать свойства основных и кислотных оксидов, т.е. будут вступать в реакции с щелочами и кислотами.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 40.
Тема №13: «Химические свойства оснований».
Обязательный минимум знаний.
+ кислотный оксид → соль + H2O
Щелочи + кислота → соль + H2O
Основания + соль → соль + основание (↑,↓)
Нерастворимые + кислота → соль + H2O
нагревание → МеО + H2O
Тема №14: «Химические свойства кислот».
Обязательный минимум знаний.
+ Ме (до Н) → соль + Н2
+ основный/амфотерный оксид → соль + Н2О
Кислота + основание/амфотерный гидроксид → соль + Н2О
+ соль → соль + кислота (↓,↑)
!Особенности взаимодействия азотной кислоты с металлами:
-
Водород никогда не выделяется;
-
Металл в полученном нитрате имеет максимальную степень окисления;
-
На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni.
-
Продукты реакции зависят от двух факторов:
-
Активность металла;
-
Концентрация кислоты.
HNO3 (к) + Ме (I, II группа, гл.подгр.) → нитрат + N2O + H2O
HNO3 (к) + Ме (остальные) → нитрат + NO2 +H2O
HNO3 (р) + Ме (I, II группа, гл.подгр.) → нитрат + NH3 (или NH4NO3) + H2O
HNO3 (р) + Ме (остальные) → нитрат + NO + H2O
Например:
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 38.
Ag + 2HNO3 (к) → AgNO3 + NO2 + H2O.
!Особенности химических свойств концентрированной серной кислоты:
-
С металлами:
-
Может взаимодействовать с металлами, стоящими в ряду напряжений после водорода;
-
Металл в полученном сульфате имеет максимальную с.о.
-
Водород никогда не выделяется;
-
На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni.
H2SO4 (к) + Me (I, II группа, гл.подгр, Zn) → сульфат + H2S/S/SO2 +H2O
H2SO4 (к) + Me (остальные) → сульфат + SO2 + H2O.
-
С неметаллами:
2H2SO4 (к) + C → CO2 + 2SO2 + 2H2O
2H2SO4 (к) + S → 3SO2 + 2H2O
-
С органическими веществами: обугливает бумагу, ткань, древесину, сахарозу.
Тема №15: «Химические свойства солей».
Обязательный минимум знаний.
+ кислота → соль + кислота’
Соли + щелочь → соль + основание’ (↑,↓).
+ соль → соль + соль’
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 41.
Тема №16: «Первоначальные представления об органических веществах».
Обязательный минимум знаний.
Общие признаки органических веществ:
-
Наличие углерода;
-
Наличие в молекулах только ковалентных связей;
-
Валентность углерода всегда равна четырем.
Основные классы органических веществ.
-
Предельные углеводороды (алканы). Общая формула CnH2n+2. Важнейшие представители алканов:
|
Формула |
Название |
|
CH4 |
Метан |
|
C2H6 |
Этан |
|
C3H8 |
Пропан |
|
C4H10 |
Бутан |
|
C5H12 |
Пентан |
Характерные реакции: замещение и окисление.
-
Непредельные углеводороды (алкены). Общая формула CnH2n. Важнейшие представители:
|
Формула |
Название |
|
C2H4 |
Этен (этилен) |
|
C3H6 |
Пропен (пропилен) |
|
C4H8 |
Бутен |
|
C5H10 |
Пентен |
Особенность строения: наличие двойной С-С связи. Характерные реакции: присоединения и окисления.
-
Непредельные углеводороды (алкины). Общая формула CnH2n-2. Важнейшие представители:
|
Формула |
Название |
|
C2H2 |
Этин (ацетилен) |
|
C3H4 |
Пропин |
|
C4H6 |
Бутин |
|
C5H8 |
Пентин |
Особенность строения: наличие тройной С-С связи. Характерные реакции: присоединения и окисления.
-
Спирты. Общая формула CnH2n+1ОН. Важнейшие представители:
|
Формула |
Название |
|
CH3ОН |
Метанол (метиловый спирт) |
|
C2H5ОН |
Этанол (этиловый спирт) |
|
C3H5(ОН)3 |
Глицерин |
-
Карбоновые кислоты. Общая формула CnH2n+1СООН. Важнейшие представители:
|
Формула |
Название |
|
НСООН |
Муравьиная кислота |
|
CH3СООН |
Уксусная кислота |
|
C17H35СООН |
Стеариновая кислота |
Характерны все свойства кислот (взаимодействие с металлами, оксидами металлов, основаниями, солями).
Тема №17: «Чистые вещества и смеси. Правила безопасной работы в школьной лаборатории. Разделение смесей и очистка веществ».
Обязательный минимум знаний.
Химические формулы соответствуют чистым веществам. Все изучаемы в школьном курсе способы разделения смесей относятся к физическим.
Смесь – многокомпонентная система (воздух, нефть, морская вода, стекло, бронза, молоко, лимонад).
Смеси бывают однородными (нельзя увидеть границу раздела между веществами): раствор сахара в воде и неоднородными (видна граница раздела между веществами): взвесь мела в воде.
Способы разделения неоднородных смесей:
-
Отстаивание (этим же методом можно разделить две несмешивающиеся жидкости с помощью делительной воронки). Ускоряют отстаивание центрифугированием;
-
Фильтрование;
-
Некоторые твердые смеси можно разделить при помощи магнита (смесь железных и медных опилок, смесь железных опилок и серы).
Способы разделения однородных смесей:
-
Выпаривание;
-
Перегонка (дистилляция).
Некоторые правила безопасной работы в химической лаборатории:
-
При растворении серной кислоты нужно вливать её тонкой струей в воду и перемешивать;
-
При работе с растворами едких веществ необходимо надевать защитные перчатки и очки;
-
Воспламенившиеся ЛВЖ (нефть, спирт, ацетон) необходимо тушить песком;
-
Опыты с получением токсичных газообразных веществ (SO2, H2S, NO2) необходимо проводить в вытяжном шкафу.
Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008 г., § 23.
Тема №18: «Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе и на газообразные вещества».
Обязательный минимум знаний.
Индикаторы
|
Кислая |
Нейтральная |
Щелочная |
|
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
Лакмус |
красный |
фиолетовый |
синий |
|
Метилоранж |
розовый |
оранжевый |
желтый |
Качественные реакции
|
Хлорид-ион Cl— |
+ Ag+ → AgCl↓ белый творожистый осадок |
|
Сульфат-ион SO42- |
+ Ba2+ → BaSO4↓ белый осадок |
|
Карбонат-ион CO32- |
+ H+ → CO2↑+H2O выделение газа + Ca2+ → CaCO3↓ белый осадок |
|
Ион аммония NH4+ |
+ OH— → NH4OH при нагревании запах аммиака |
|
Кислород O2 |
Загорание тлеющей лучины |
|
Водород H2 |
Хлопок при поднесении горящей лучины |
|
Углекислый газ CO2 |
Горящая лучина гаснет |
|
Аммиак NH3 |
По запаху; посинение влажной лакмусовой бумаги; появление белого дыма при внесении палочки, смоченной соляной кислотой («дым без огня»). |
Тема №19: «Вычисление массовой доли химического элемента в веществе».
Обязательный минимум знаний.
Вычисления производятся по следующей формуле:
ω = Ar∙n/Mr ∙ 100%, где Ar – атомная масса химического элемента; n – число атомов того элемента, массовая доля которого находится; Mr – молярная масса молекулы. Например: вычислите массовую долю кислорода в карбиде натрия. Решение:
1. Составляем формулу карбида натрия: Na4C.
2. Ar(Na)=23 г/моль; n(Na)=4; Mr(Na4C)=104г/моль.
3. Подставляем в формулу и вычисляем: ω(Na)=23∙4/104 ∙100% = 88,5%
4. Ответ: 88,5%.
Задания части В.
Тема №1: «Периодический закон Д. И. Менделеева».
Обязательный минимум знаний.
См. тема №2 части А.
Тема №2: «Химические свойства простых веществ и оксидов».
Обязательный минимум знаний.
Химические свойства неметаллов.
|
Как окислитель |
Как восстановитель |
|
|
H2 |
Щелочные металлы |
НеМе и МеО |
|
O2 |
Ме, неМе (большинство), неМеО (в которых степень окисления неМе не max) |
F2 |
|
Галогены (F2, Cl2, Br2) |
Ме, H2 |
— |
|
S |
Ме, H2 |
O2, галогены, H2SO4 (к), HNO3(к) |
|
N2 |
Ме (в обычных условиях только с литией, с остальными – при нагревании), H2(при нагревании и давлении) |
O2 (при температуре электрической дуги), галогены. |
|
P |
Ме, H2 |
O2, галогены, HNO3(к) |
|
C |
Ме, H2 |
O2, галогены, МеО, H2SO4(к), HNO3(к) |
|
Si |
Ме, H2 |
O2, галогены, щелочи |
+ см. тема № 12 части А.
Тема №3: «Окислительно-восстановительные реакции».
Обязательный минимум знаний.
Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых атомы меняют степени окисления.
Восстановитель – элемент, отдающий электроны (в ОВР его степень окисления повышается). Им может быть атом, ион, имеющий минимальную или промежуточную степень окисления. Например: Zn0 – 2e— = Zn+2.
Окислитель – элемент, принимающий электроны (в ОВР его степень окисления понижается). Им может быть атом, ион, максимальную или промежуточную степень окисления. Например: S0 + 4e— = S+4.
Атом или ион, имеющий промежуточную степень окисления, может проявлять как восстановительные, так и окислительные свойства, т.е. проявлять окислительно-восстановительную двойственность. Для элементов главных подгрупп максимальная степень окисления = +№ группы; минимальная № группы – 8.
Восстановление – процесс принятия электронов.
Окисление – процесс отдачи электронов.
+ см. тема №4 части А.
Тема №4: «Химические свойства кислот, оснований и солей».
Обязательный минимум знаний.
см. тема №13, 14, 15 части А.
Задания части С.
Тема №1: «Взаимосвязь различных классов неорганических веществ».
Обязательный минимум знаний.
Схема генетической связи веществ.
+O2 +H2O
металл основной оксид основание соль
неметалл кислотный оксид кислота соль
+O2 +H2O
Дополнительная информация: Габриэлян О. С., Химия 8 кл., 2008г., § 42.
Тема №2: «Вычисление массовой доли растворенного вещества в растворе».
Обязательный минимум знаний.
Алгоритм решения расчетных задач на нахождение массы выпавшего осадка по уравнению реакции:
-
Составить уравнение реакции, уравнять его.
-
По таблице растворимости определить в правой части реакции осадок, обозначить его ↓.
-
Рассчитать массу вещества в растворе по формуле:
m(вещества) = m(раствора)∙ω.
-
Рассчитать количество вещества по формуле: n = m/M.
-
По уравнению реакции определить количество вещества того вещества, которое выпало в осадок.
-
Рассчитать массу осадка по формуле: m = M·n.
Пример. К 80 г раствора с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди (II). Определите массу выпавшего осадка.
Решение.
-
Составляем уравнение реакции: NaOH + CuSO4 → Na2SO4 + Cu(OH)2.
-
По таблице растворимости определяем, что в осадок выпадает гидроксид меди(II), тогда уравнение реакции принимает вид: NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓.
-
Рассчитаем массу NaOH по формуле m(вещества) = m(раствора)∙ω:
m(NaOH)=80г · 0,05= 4г.
-
Рассчитаем количество вещества NaOH по формуле m = M·n:
n(NaOH)= 4г/40г/моль=0,1моль.
-
По уравнению реакции определяем (по коэффициентам перед веществами), что n(Cu(OH)2)=1/2n(NaOH)→n(Cu(OH)2)=0,05моль.
-
Рассчитаем массу Cu(OH)2 (осадок) по формуле m = M·n:
m(Cu(OH)2)= 98г/моль∙0,05моль = 4,9г.
Ответ: 4,9 г.
Необходимые формулы:
-
m = M·n; n = m/M.
-
m(в-ва)=m(р-ра)·ω; m(р-ра)=m(в-ва)/ω.
-
V=Vm·n; n=V/Vm.
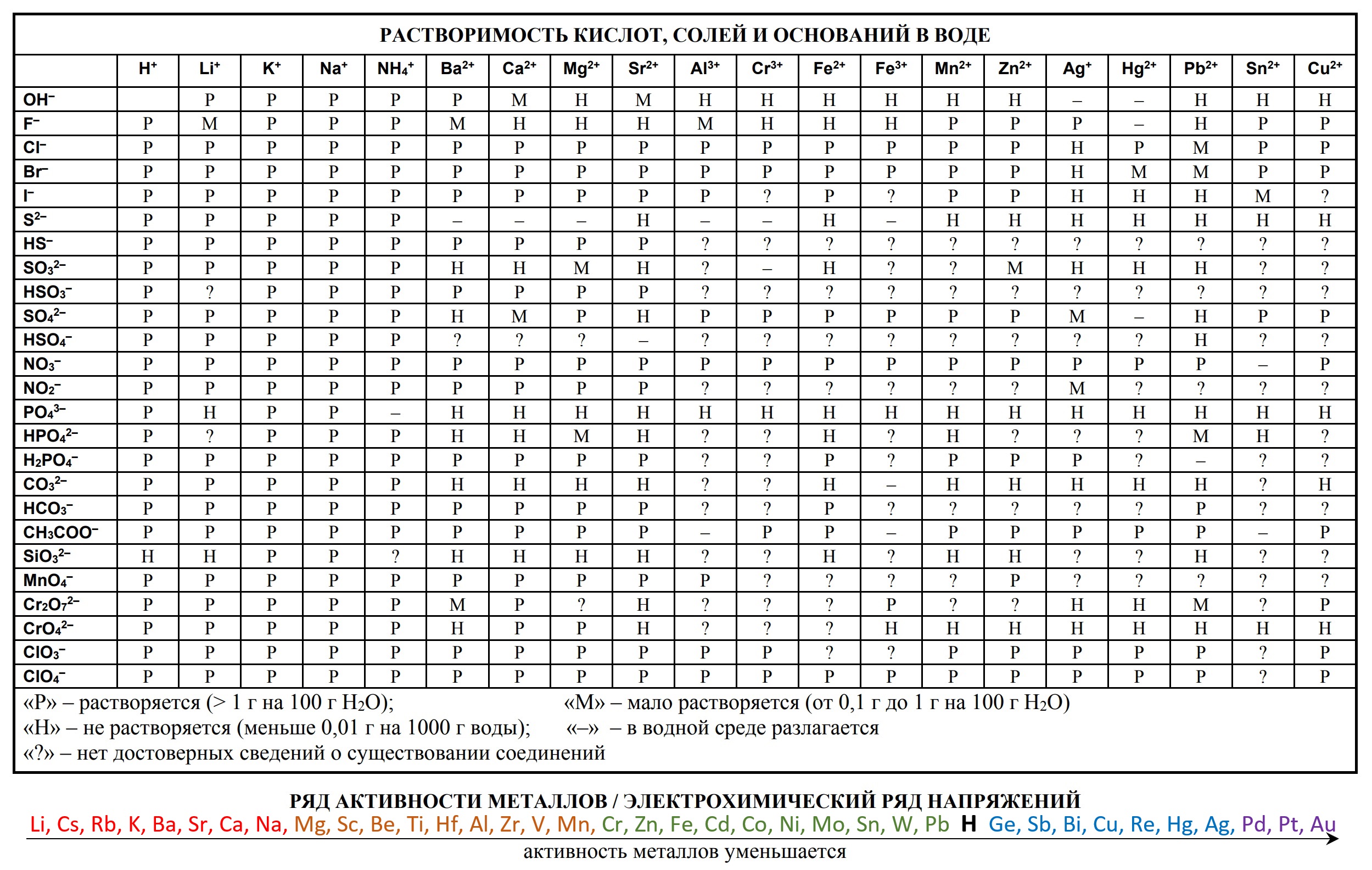
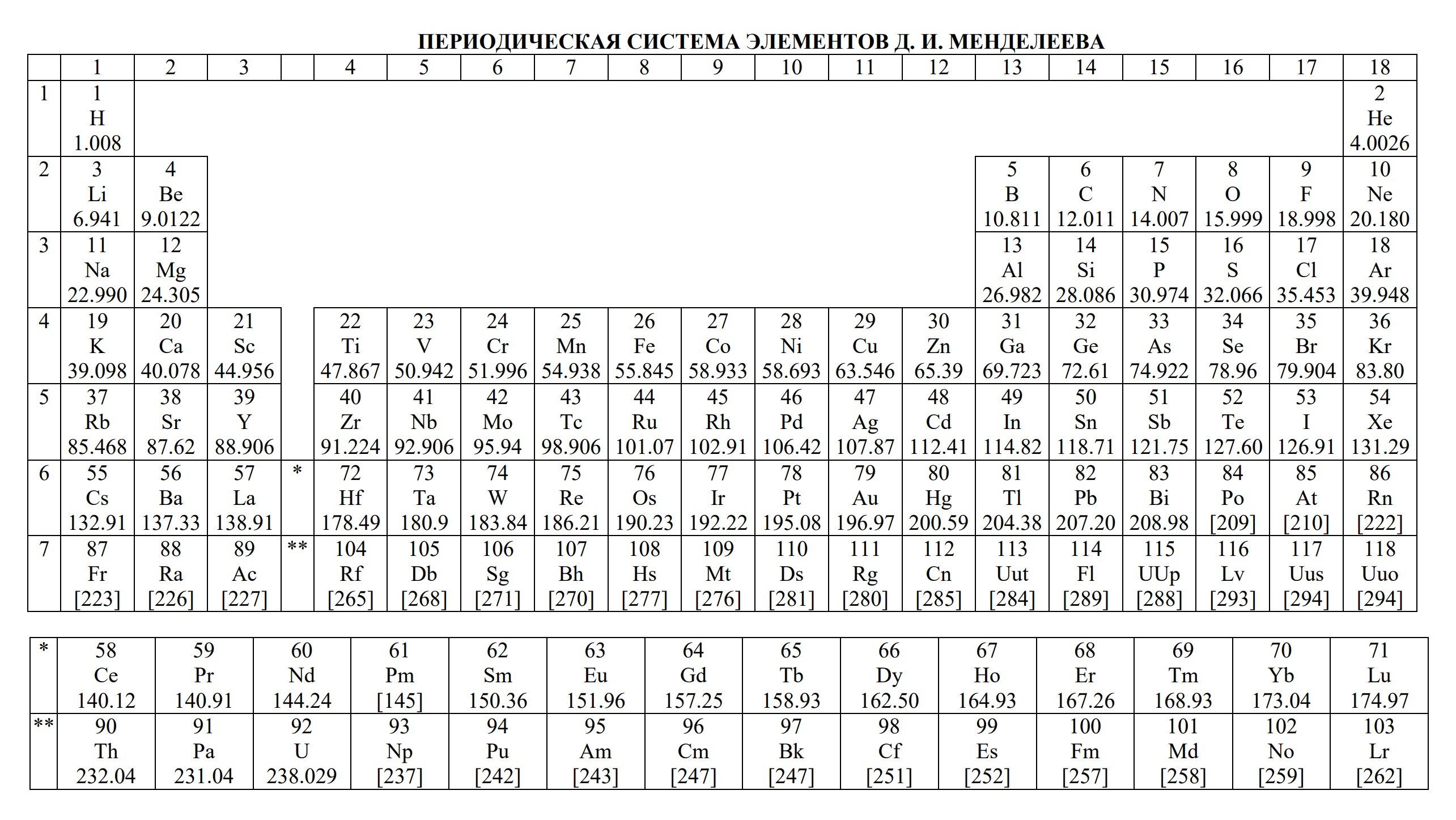
Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
- периодическая система химических элементов Д.И. Менделеева
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
Степень окисления. Окислительно-восстановительные реакции
- Степень окисления
Степень окисления СО — условный заряд элемента, вычисленный в предположении, что все связи в соединении ионные.
Правила, используемые при вычислении СО
- Алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю, а в сложном ионе (например, анионе кислотного остатка) — заряду иона.
0 0 0 0
- СО атомов в простых веществах равна нулю (H2, N2, Cu, C…)
- Постоянную СО в соединениях имеют: щелочные металлы Na, K, Li… (+1); почти все металлы II группы, в том числе щелочноземельные Ca и Ba.. (+2); алюминий (+3); фтор (-1).
- CО водорода в соединениях (+1), кроме гидридов — NaH, KH, CaH2… -(-1)
- СО кислорода (-2), кроме ОF2 (+2) и пероксидов – Na2O2, H2O2 – (-1).
- Высшая (наибольшая положительная) степень окисления элемента равна номеру его группы (№группы) в периодической системе, низшая —(8 — №группы)
- СО элемента в простом ионе равна заряду этого иона: FeCl3-соль, по таблице растворимости можно узнать заряды ионов, а значит и степени окисления
+3 -1
Заряд иона Fe3+ → степень окисления Fe Заряд иона Cl— → степень окисления Cl
Примеры расчетов:
1. Находим в формуле элементы с известной СО и записываем их над знаками
элементов
- «Неизвестную» СО х рассчитываем по правилу 1
+1 x -2 +1 x -2 +2 x -2
KMnO4 HNO3 CaSO4
1 + X +4(-2) =0 1+x+3(-2)=0 2+x+4(-2)=0
x=7 → CO(Mn)=+7 x=5→CO(N)=+5 x=+6→CO(S)=+6
Fe2(SO4)3 заряд иона SO42-, значит заряд железа Fe3+,тогда
+3 х -2
Fe2S3О12 2(+3) + 3х+12(-2) = 0 х=6 → СО(S)=+6
- Окислительно-восстановительные реакции ОВР
ОВР — такие реакции, в ходе которых электроны от одних атомов переходят к другим (меняется степень окисления элементов).
Окислитель – вещество, атомы или ионы которого, присоединяют электроны.
Восстановитель – вещество, атомы или ионы которого отдают электроны.
Повышение степени окисления СО, связано с отдачей
атомом или ионом электронов, называют процессом окисления
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 +8 СО
Понижение степени окисления СО, связано с присоединением (приобретением)
атомом или ионом электронов, называется процессом восстановления
Составление уравнений ОВР.
Расстановка коэффициентов методом электронного баланса. При использовании метода постулируют: число электронов, отданным восстановителем равно числу электронов, присоединенных окислителем.
Последовательность действий.
- Записывают схему реакции (формулы исходных веществ и продуктов реакции без коэффициентов)
Cl2 + H2S + H2O → HCl + H2SO4
- Определяют элементы, которые поменяли степень окисления
0 -2 -1 +6
Cl2 + H2S + H2O → HCl + H2SO4
- Записывают эти элементы в две строки и определяют число электронов, приобретенных окислителем и отданных восстановителем (число атомов обычно берут из левой части схемы реакции). Дополнительные уравнения называют уравнениями электронного баланса, иногда полуреакциями окисления и восстановления
-2 +6
S — 8ē → S
0 -1
Cl2 + 2ē → 2Cl
4. Уравнивают число приобретаемых и отдаваемых электронов
-2 +6
S — 8ē → S 1 (надо взять один атом серы, он отдаст 8ē)
0 -1 8
Cl2 + 2ē → 2Cl 4 (надо взять четыре молекулы хлора, они приобретут 8ē)
Оформление полуреакций:
-2 +6
восстановитель S — 8ē → S 1 окисление
0 -1 8
окислитель Cl2 + 2ē → 2Cl 4 восстановление
Полученные числа 1 и 4 представляют соотношение исходных атомов серы (в составе H2S)
и молекул хлора и являются коэффициентами для левой части уравнения.
- Запишем полученные коэффициенты перед формулами двух веществ (окислителя Cl2 и
восстановителя H2S) в левую часть уравнения
4Cl2 + H2S + H2O → HCl + H2SO4
- Правую часть уравниваем по левой
4Cl2 + H2S + 4H2O = 8HCl + H2SO4
В тетради результаты вашей работы выглядят так:
0 -2 -1 +6
4Cl2 + H2S + 4H2O = 8HCl + H2SO4
-2 +6
восстановитель S — 8ē → S 1 окисление
0 -1 8
окислитель Cl2 + 2ē → 2Cl 4 восстановление
Никакие другие записи не нужны
Пример 1.
0 0 +3 -1
1,2 Al + Cl2 → AlCl3
0 +3
3,4 восстановитель Al — 3ē → Al 2 окисление
0 -1 6
окислитель Сl2 + 2ē → 2Cl 3 восстановление
5,6 2Al + 3Cl2 = 2AlCl3
Пример 2.
0 +1 +3 0
1,2 Al + HCl → AlCl3 + H2
0 +3
3,4 восстановитель Al — 3ē → Al 1 окисление
+1 0 3
окислитель H + 1ē → H 3 восстановление
5,6 Al + 3HCl → AlCl3 + 3/2H2 — промежуточные коэффициенты. После умножения всех коэффициентов на 2 получим:
2Al + 6HCl = 2AlCl3 + 3H2
- ОГЭ по химии
Перечень дополнительных материалов и оборудования, использование которых разрешено на ОГЭ-2020 по химии, утверждается приказом Минпросвещения России и Рособрнадзора.
Участникам экзамена разрешается использовать следующие материалы и оборудование:
– Периодическая система химических элементов Д.И. Менделеева;
– таблица растворимости солей, кислот и оснований в воде;
– электрохимический ряд напряжений металлов;
– непрограммируемый калькулятор;
– лабораторное оборудование для проведения химических опытов, предусмотренных заданиями (Приложение 2);
– комплект химических реактивов (Приложение 2).
Проведение лабораторных опытов при выполнении задания 24 осуществляется в условиях химической лаборатории, оборудование которой должно отвечать требованиям СанПиН к кабинетам химии.
Связанные страницы:

Автор
Материал ЕГЭ 2022 по химии содержит справочные таблицы, тривиальные названия неорганических и органических соединений, краткие теоретические сведения о гидролизе, электролизе, тренажёр для повторения большого количества неорганических реакций.
Ссылка для скачивания материала: скачать в PDF / скачать в WORD
Новые тренировочные варианты ЕГЭ 2022 по химии:
Тренировочные варианты ЕГЭ по химии 11 класс задания с ответами