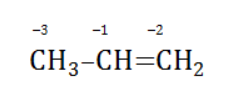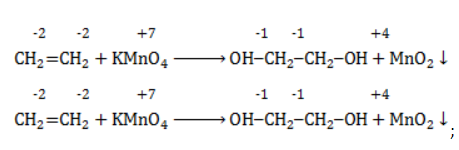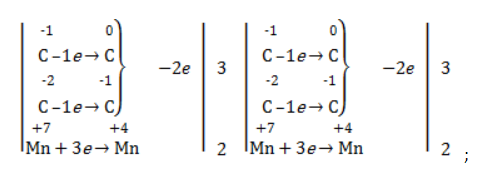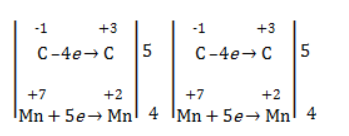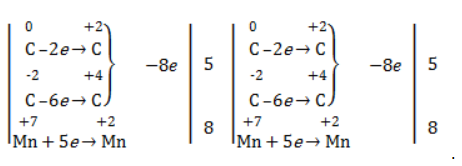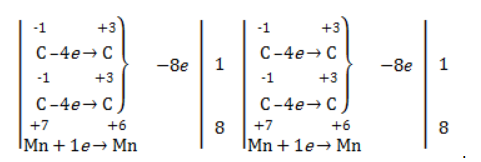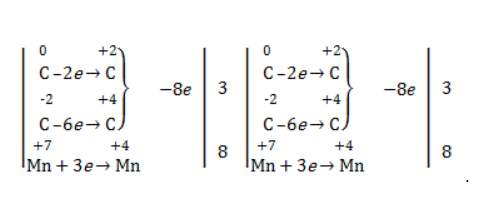Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Еπ = Е(С=С) — Е(С-С) = 620 — 348 = 272 кДж/моль
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
Например, при гидрировании бутена-2 образуется бутан.
Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление.
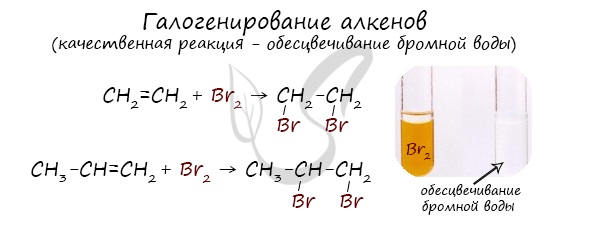
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан.
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
Например, при взаимодействии этилена с бромоводородом образуется бромэтан.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан.
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
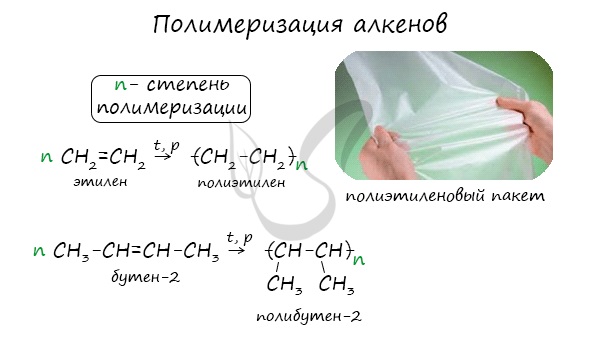
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен.
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида)
Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида
2.2. Мягкое окисление
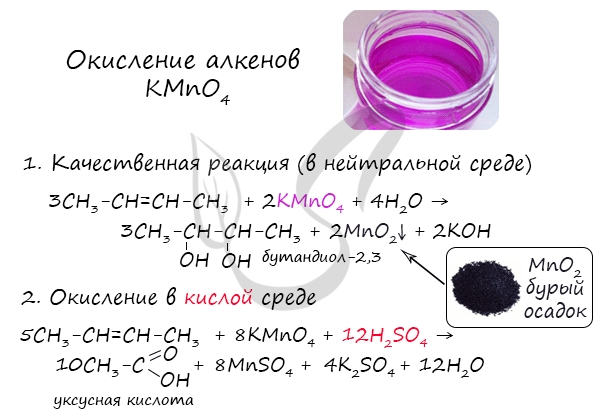
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
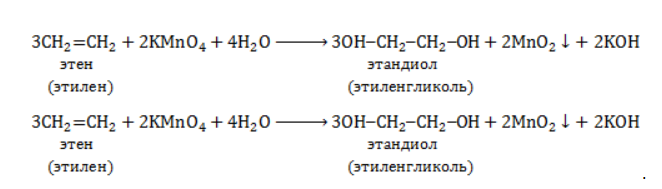
Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2)
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
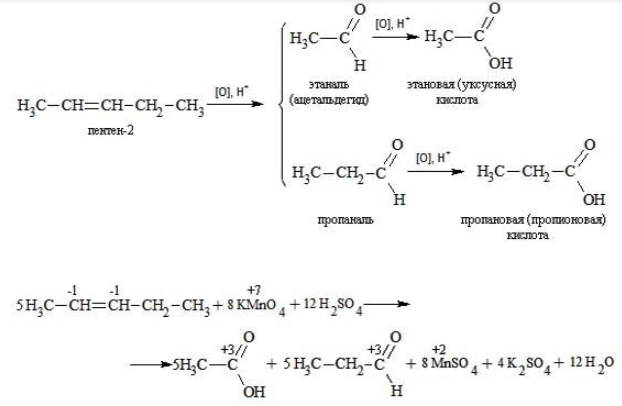
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
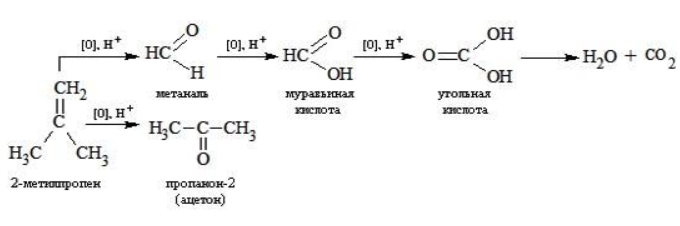
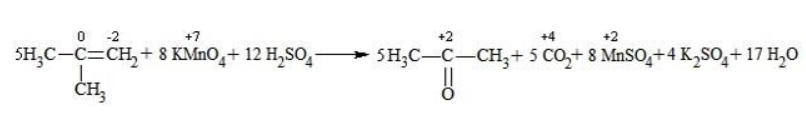
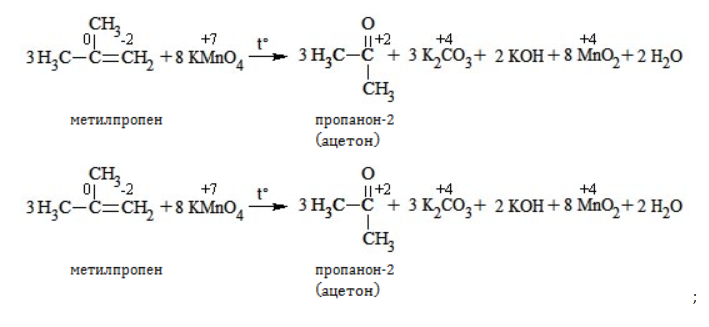
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия:
Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон:
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания пропилена:
2C3H6 + 9O2 → 6CO2 + 6H2O
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500оС или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Например, при изомеризации бутена-1 может образоваться бутен-2 или 2-метилпропен
CH2=CH-CH2-CH3 → CH3-CH=CH-CH3
Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит
одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2.
Общая формула их гомологического ряда — CnH2n.
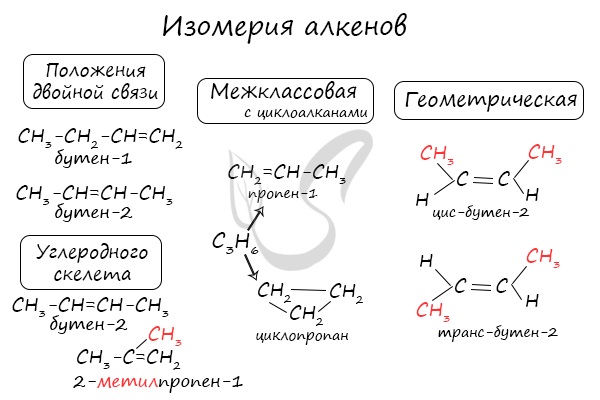
Номенклатура и изомерия алкенов
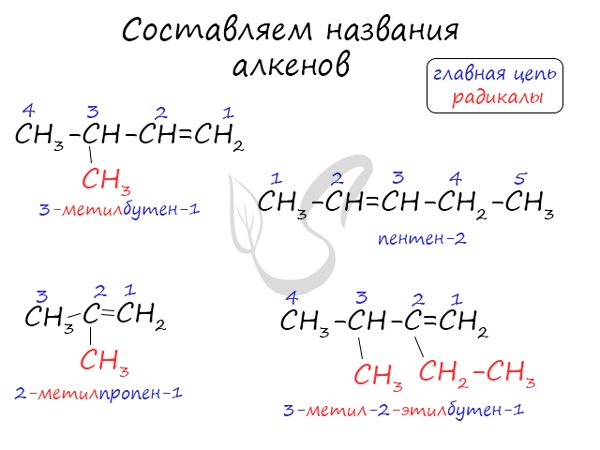
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом:
этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию
атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого
начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая
изомерия в виде существования цис- и транс-изомеров.
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
- Дегидрирование алканов
- Дегидрогалогенирование галогеналканов
- Дегалогенирование дигалогеналканов
- Внутримолекулярная дегидратация спиртов
В результате крекинга нефти образуется один алкан и один алкен.
C12H26 → C6H12 + C6H14
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко
водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный.
CH3-CH3 → (t, кат) CH2=CH2 + H2

В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород
отщепляется от соседнего наименее гидрированного атома углерода.

В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные
рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими
свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Гидратация
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная
вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а
атом галогена — к наименее гидрированному атому углерода.

Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода,
гидроксогруппа — к наименее гидрированному.

При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном
окислении образуются окиси.

Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные
углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2.
В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной
связи.
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения
молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Мягкое окисление алкенов. Пошаговый алгоритм составления уравнений.
Под мягким окислением алкенов подразумевают действие на них нейтрального холодного водного раствора перманганата калия. В результате такого окисления образуются, так называемые вицинальные диолы – двухатомные спирты с двумя ОН-группами при соседних атомах углерода в молекуле.
Поскольку среда нейтральная, в качестве продуктов восстановления перманганата калия образуются диоксид марганца — MnO2 и щелочь.
Вывод о том, что вода также является реагентом (будет входить в левую часть уравнения реакции), можно легко сделать хотя бы по тому, что в молекуле органического вещества появляются дополнительные атомы водорода, которых в перманганате нет.
Таким образом, схема реакции будет выглядеть так:
Расставим коэффициенты в этой схеме методом электронного баланса. Для этого сначала нужно определить степени окисления у тех атомов углерода, при которых изменилось окружение (в нашем случае у тех атомов углерода, к которым прикрепятся ОН группы). Отметим, что при окислении органических веществ степень окисления водорода не меняется и равна +1.
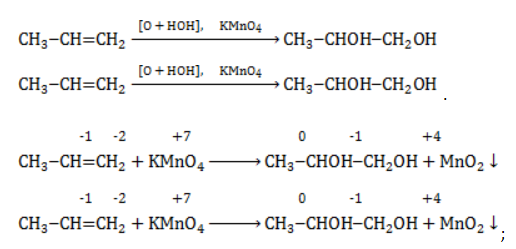
Для расстановки степеней окисления атомов углерода в органических веществах можно использовать так называемый метод блоков. В данном методе мы должны мысленно «изолировать» друг от друга фрагменты молекулы органического вещества по углерод-углеродным связям и рассматривать такие фрагменты условно как нейтральные молекулы. В частности, формулу пропена можно разбить на условно нейтральные блоки таким образом:
Далее, приняв заряд каждого блока за 0 и помня, что водород в органических веществах всегда имеет степень окисления, равную +1, несложно посчитать степени окисления всех атомов углерода.
Обозначим степени окисления первого, второго и третьего атомов С как х, у, и z соответственно. Тогда, подписав степени окисления для каждого элемента в формуле, мы получим:
Таким образом, составив уравнения и решив их, получаем:
x+3·1 = 0, x = -3,
y + 1 = 0, y = -1,
z+2·1=0, z = -2.
Проведем аналогичную манипуляцию с формулой органического продукта окисления. Разбиваем мысленно его молекулу на нейтральные блоки по углерод-углеродным связям. Пусть степени окисления первого, второго и третьего атома С также будут равны x, y и z соответственно. Атомы водорода в органике всегда имеют степень окисления +1, а кислорода практически всегда -2 (за исключением редких случаев — органических пероксидов, которые в ЕГЭ не рассматриваются). Поэтому, подписав степени окисления для каждого элемента, получим:
Далее, составим уравнения, помня, что условно заряд каждого блока равен нулю, и решим их:
x + 3·1 = 0 => x = -3
y + 1 −2 +1 = 0 => y = 0
z + 2·1 − 2 +1 = 0 => z = −1
Таким образом, мы видим, что степень окисления первого атома углерода не изменилась, что и логично, ведь не изменилось его окружение.
Степень окисления второго атома С была равна -1, стала равна 0.
Степень окисления третьего атома С была равна -2, стала равна -1.
Также в этой окислительно-восстановительной реакции изменяется степень окисления марганца. Изначально она была равна +7 (в перманганате калия), после реакции стала равна +4 (в диоксиде марганца).
Запишем еще раз схему реакции и составим для нее электронный баланс, используя в балансе только те атомы С, степень окисления которых изменилась:
3·| С−1С−2 − 2е− → С0С−1
2·| Mn+7 + 3e− → Mn+4
(вывод о том, что от двух атомов С слева нужно отнять 2 электрона делаем на основании того, что суммарный заряд двух «атомов» С слева равен -3, а справа -1)
Перенесем коэффициенты из электронного баланса в схему:
Далее, мы видим, что в левой части схемы уже точно известно количество атомов калия, поскольку перед единственным калийсодержащим веществом левой части известен коэффициент. Таким образом, очевидно, что перед KOH в правой части схемы нужно поставить коэффициент 2. Получаем:
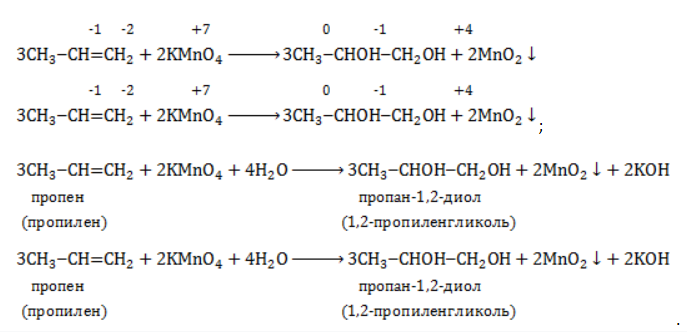
Далее, мы видим, что в левой части уравнения уже известно точное количество атомов кислорода, поскольку перед всеми кислородсодержащими веществами правой части коэффициенты известны. Всего в правой части уравнения 12 атомов кислорода. В левой части (не считая воды) – 8 атомов кислорода. Таким образом, чтобы в левой части тоже было 12 атомов кислорода, перед водой нужно поставить коэффициент 4. Таким образом, конечное уравнение окисления пропилена нейтральным холодным раствором перманганата будет иметь вид:
Следует отметить, что абсолютно такие же коэффициенты в уравнении реакции будут при мягком окислении любого другого органического вещества с одной двойной связью (при условии, что в молекуле будут отсутствовать другие фрагменты, способные к окислению).
Для демонстрации того, что коэффициенты будут идентичными, давайте рассмотрим мягкое окисление 2-фенилпропена
Схема окисления 2-фенилпропена будет выглядеть следующим образом:
Учитывая опыт примера с мягким окислением пропена, мы будем определять степени окисления не всех атомов углерода, а только тех, у которых изменилось окружение. Поэтому в молекуле 2-фенилпропена мы выделим только два условно нейтральных блока. Обозначив степени окисления атомов углерода как x и y, а также не забывая, что степень окисления водорода в органических веществах равна +1, подпишем степени окисления для каждого элемента в выделенных блоках:
Таким образом, составив и решив уравнения получаем:
x = 0
y + 2·1 = 0 => y = -2
Аналогично поступим с продуктом окисления:
Таким образом:
x −2 + 1 = 0 => x = 1
y +2·1 −2 + 1 = 0 => y = −1
Запишем повторно схему окисления 2-фенилпропена нейтральным раствором перманганата и составим электронный баланс:
3|С0С−2 − 2е− → С+1С−1
2|Mn+7 + 3e− → Mn+4
Перенесем коэффициенты из электронного баланса в схему реакции:
Далее мы видим, что калия в левой части схемы 2, значит коэффициент 2 нужно поставить перед KOH. Получаем:
В правой части мы видим 12 атомов кислорода, в связи с чем для получения такого же количества атомов кислорода в левой части перед водой необходимо поставить коэффициент 4. Таким образом, конечное уравнение мягкого окисления 2-фенилпропена холодным нейтральным раствором перманганата калия будет иметь вид:
Как можно видеть, коэффициенты в этом уравнении полностью совпали с коэффициентами уравнения реакции мягкого окисления пропилена.
В окислительно-восстановительных реакциях органические вещества
чаще проявляют свойства восстановителей, а сами окисляются. Легкость окисления органических соединений зависит от доступности электронов при взаимодействии с окислителем. Все известные факторы, вызывающие увеличение электронной плотности в молекулах органических соединений (например, положительные индуктивный и мезомерные эффекты), будут повышать их способность к окислению и наоборот.
Склонность органических соединений к окислению возрастает с ростом их
нуклеофильности
, что соответствует следующим рядам:

Рост нуклеофильности в ряду
Рассмотрим
окислительно-восстановительные реакции
представителей важнейших классов
органических веществ
с некоторыми неорганическими окислителями.
Окисление алкенов
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
3C
2
H
4
+ 2KMnO
4
+ 4H
2
O → 3CH
2
OH–CH
2
OH + 2MnO
2
+ 2KOH
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH
3
CH=CHCH
2
CH
3
+ 8KMnO
4
+ 12H
2
SO
4
→ 5CH
3
COOH + 5C
2
H
5
COOH + 8MnSO
4
+ 4K
2
SO
4
+ 17H
2
O
2) 5CH
3
CH=CH
2
+ 10KMnO
4
+ 15H
2
SO
4
→ 5CH
3
COOH + 5CO
2
+ 10MnSO
4
+ 5K
2
SO
4
+ 20H
2
O
3) CH
3
CH=CHCH
2
CH
3
+ 8KMnO
4
+ 10KOH → CH
3
COOK + C
2
H
5
COOK + 6H
2
O + 8K
2
MnO
4
4) CH
3
CH=CH
2
+ 10KMnO
4
+ 13KOH → CH
3
COOK + K
2
CO
3
+ 8H
2
O + 10K
2
MnO
4
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
При окислении алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, происходит образование двух кетонов:
Окисление алкинов
Алкины окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алкенов, атомы-восстановители здесь – атомы углерода, связанные кратной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH
3
C≡CH + 8KMnO
4
+ 12H
2
SO
4
→ 5CH
3
COOH + 5CO
2
+ 8MnSO
4
+ 4K
2
SO
4
+ 12H
2
O
Ацетилен может быть окислен перманганатом калия в нейтральной среде до оксалата калия:
3CH≡CH +8KMnO
4
→ 3KOOC –COOK +8MnO
2
+2КОН +2Н
2
О
В кислотной среде окисление идет до щавелевой кислоты или углекислого газа:
5CH≡CH +8KMnO
4
+12H
2
SO
4
→ 5HOOC –COOH +8MnSO
4
+4К
2
SO
4
+12Н
2
О
CH≡CH + 2KMnO
4
+3H
2
SO
4
→ 2CO
2
+ 2MnSO
4
+ 4H
2
O + K
2
SO
4
Окисление гомологов бензола
Бензол не окисляется даже в довольно жестких условиях. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C
6
H
5
CH
3
+2KMnO
4
→ C
6
H
5
COOK + 2MnO
2
+ KOH + H
2
O
C
6
H
5
CH
2
CH
3
+ 4KMnO
4
→ C
6
H
5
COOK + K
2
CO
3
+ 2H
2
O + 4MnO
2
+ KOH
Окисление гомологов бензола дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
5С
6
Н
5
СН
3
+6КMnO
4
+9 H
2
SO
4
→ 5С
6
Н
5
СООН+6MnSO
4
+3K
2
SO
4
+ 14H
2
O
5C
6
H
5
–C
2
H
5
+ 12KMnO
4
+ 18H
2
SO
4
→ 5C
6
H
5
COOH + 5CO
2
+ 12MnSO
4
+ 6K
2
SO
4
+ 28H
2
O
Окисление спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C
2
H
5
OH + K
2
Cr
2
O
7
+ 4H
2
SO
4
→ 3CH
3
CHO + K
2
SO
4
+ Cr
2
(SO
4
)
3
+ 7H
2
O
С избытком окислителя (KMnO
4
, K
2
Cr
2
O
7
) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
5C
2
H
5
OH + 4KMnO
4
+ 6H
2
SO
4
→ 5CH
3
COOH + 4MnSO
4
+ 2K
2
SO
4
+ 11H
2
O
3CH
3
–CH
2
OH + 2K
2
Cr
2
O
7
+ 8H
2
SO
4
→ 3CH
3
–COOH + 2K
2
SO
4
+ 2Cr
2
(SO
4
)
3
+ 11H
2
O
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.
Двухатомный спирт, этиленгликоль HOCH
2
–CH
2
OH, при нагревании в кислой среде с раствором KMnO
4
или K
2
Cr
2
O
7
легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
5СН
2
(ОН) – СН
2
(ОН) + 8КMnO
4
+12H
2
SO
4
→ 5HOOC –COOH +8MnSO
4
+4К
2
SO
4
+22Н
2
О
3СН
2
(ОН) – СН
2
(ОН) + 8КMnO
4
→ 3KOOC –COOK +8MnO
2
+2КОН +8Н
2
О
Окисление альдегидов и кетонов
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO
4
, K
2
Cr
2
O
7
, [Ag(NH
3
)
2
]OH, Cu(OH)
2
. Все реакции идут при нагревании:
3CH
3
CHO + 2KMnO
4
→ CH
3
COOH + 2CH
3
COOK + 2MnO
2
+ H
2
O
3CH
3
CHO + K
2
Cr
2
O
7
+ 4H
2
SO
4
→ 3CH
3
COOH + Cr
2
(SO
4
)
3
+ 7H
2
O
CH
3
CHO + 2KMnO
4
+ 3KOH → CH
3
COOK + 2K
2
MnO
4
+ 2H
2
O
5CH
3
CHO + 2KMnO
4
+ 3H
2
SO
4
→ 5CH
3
COOH + 2MnSO
4
+ K
2
SO
4
+ 3H
2
O
CH
3
CHO + Br
2
+ 3NaOH → CH
3
COONa + 2NaBr + 2H
2
O

реакция «серебряного зеркала»
C аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот которые в аммиачном растворе дают соли аммония (реакция «серебрянного зеркала»):
CH
3
CH=O + 2[Ag(NH
3
)
2
]OH → CH
3
COONH
4
+ 2Ag + H
2
O + 3NH
3
CH
3
–CH=O + 2Cu(OH)
2
→ CH
3
COOH + Cu
2
O + 2H
2
O
Муравьиный альдегид (формальдегид) окисляется, как правило, до углекислого газа:
5HCOH + 4KMnO
4
(
изб
)
+ 6H
2
SO
4
→ 4MnSO
4
+ 2K
2
SO
4
+ 5CO
2
+ 11H
2
O
3СН
2
О + 2K
2
Cr
2
O
7
+ 8H
2
SO
4
→ 3CO
2
+2K
2
SO
4
+ 2Cr
2
(SO
4
)
3
+ 11H
2
O
HCHO + 4[Ag(NH
3
)
2
]OH → (NH
4
)
2
CO
3
+ 4Ag↓ + 2H
2
O + 6NH
3
HCOH + 4Cu(OH)
2
→ CO
2
+ 2Cu
2
O↓+ 5H
2
O
Кетоны окисляются в жестких условия сильными окислителями с разрывом связей С-С и дают смеси кислот:
Карбоновые кислоты.
Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl
2
=CO
2
+ Hg + 2HCl
HCOOH+ Cl
2
= CO
2
+2HCl
HOOC-COOH+ Cl
2
=2CO
2
+2HCl
Муравьиная кислота
, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2↑ + 8H2O
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается:
HCOOH →(t) CO↑ + H2O
Каталитическое окисление алканов:
Каталитическое окисление алкенов:
Окисление фенолов:
Содержание
- 1 Понятие о неполном окислении
- 1.1 Определение степеней окисления
- 2 Влияние среды на окислитель
- 3 Мягкое окисление
- 4 Жесткое окисление
- 4.1 Окисление перманганатом калия в кислой среде
- 4.2 Окисление алкенов в щелочной среде
- 4.3 Окисление в нейтральном растворе
- 5 Заключение
В отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия.
Понятие о неполном окислении
В химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением.
Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества.
Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая -связь – легко разрушается с образованием у углеродных атомов свободной валентности (неспаренного электрона). За счет оттягивания или отрыва освободившихся электронов и происходит окислительно-восстановительный процесс.
Определение степеней окисления
Для того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов.
Например, при окислении пропена перманганатом калия вступающий в реакцию пропен
характеризуется следующими степенями окисления углеродных атомов:
В общем виде результат можно записать следующим образом:
Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода.
Влияние среды на окислитель
Состав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково.
Неорганическая соль в водном растворе диссоциирует на катион металла
и собственно окислитель – перманганат-анион
. В ходе реакции марганец восстанавливается от степени окисления +7 +7 до той или иной величины в зависимости от среды.
В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4:
Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи.
Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2:
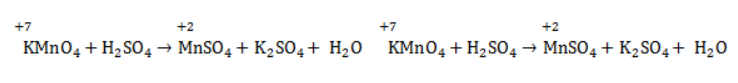
При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6:
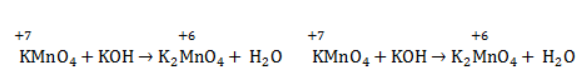
Мягкое окисление
Процесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается -связь, и к освободившимся валентностям двух углеродных атомов присоединяются две гидроксогруппы
. Источниками их формирования служат:
- кислород из перманганат-иона;
- вода.
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля:
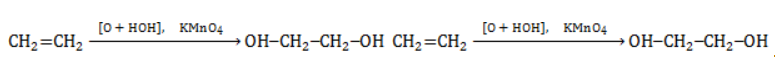
Для составления полного уравнения нужно:
- определить степени окисления реагентов:
- рассчитать электронный баланс:
- расставить коэффициенты:
- ввести в уравнение недостающие реагенты и продукты, исходя из равенства состава в левой и правой частях уравнения, и определить окончательные коэффициенты:
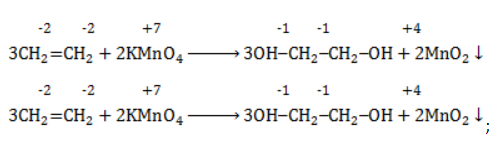
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично:
Дальше мягкое окисление не идет, так как -связи в молекуле в мягких условиях сохраняются. Раствор перманганата теряет окраску, а оксид марганца выпадает в виде бурого осадка. Гидроксилирование, известное также как реакция Вагнера, служит для выявления в молекулах двойной связи.
Это интересно:
Химические свойства алкадиенов
Применение алканов
Жесткое окисление
Жесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли.
Окисление перманганатом калия в кислой среде
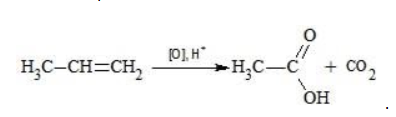
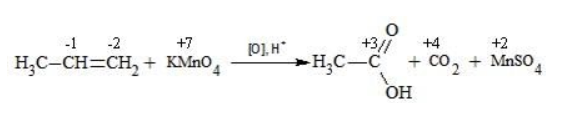
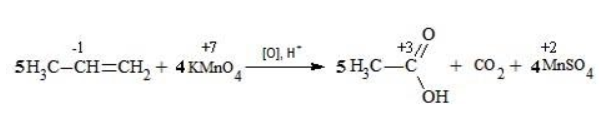
Пропен в содержащем кислоту растворе реагирует до образования уксусной кислоты и углекислого газа:
Степени окисления участвующих в реакции углеродных атомов и марганца составят:
Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты:
Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления:
Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты:
Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот:
Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями.
Правило, по которому осуществляется окисление углерода, отражено в таблице:
Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона:
Полное уравнение:
Электронный баланс:
Окисление алкенов в щелочной среде
При нагревании с концентрированной щелочью алкены окисляются до солей:
Если один из углеродных атомов – первичный, он окисляется до углекислого газа:
Окисление в нейтральном растворе
В условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат
и неорганические соли калия – карбонат
и манганат
.
Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон:
Заключение
Взаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов.
29 ноября 2021
В закладки
Обсудить
Жалоба
Жёсткое окисление алкенов в кислой среде
Пошаговый алгоритм составления уравнений реакций жёсткого окисления алкенов.
Источник: vk.com/naukadljatebja