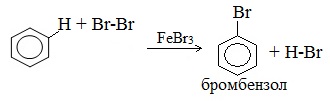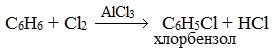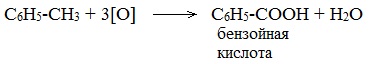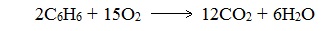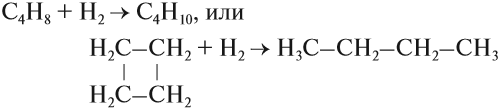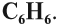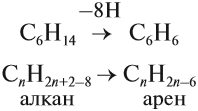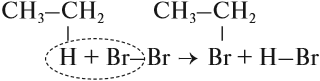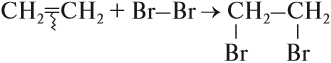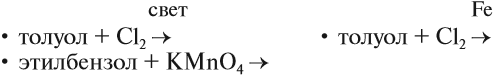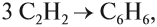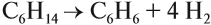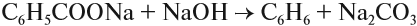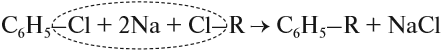Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму
Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца.
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
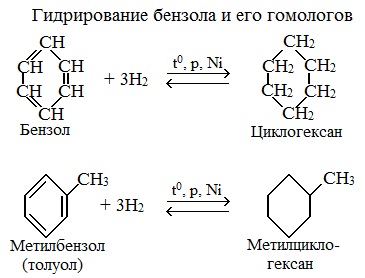
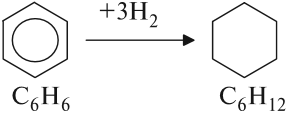
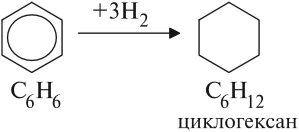
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
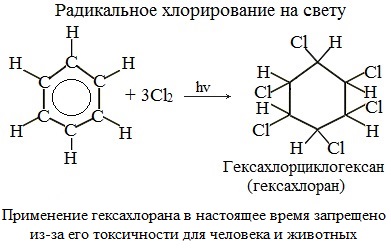
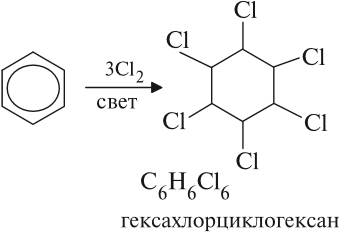
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
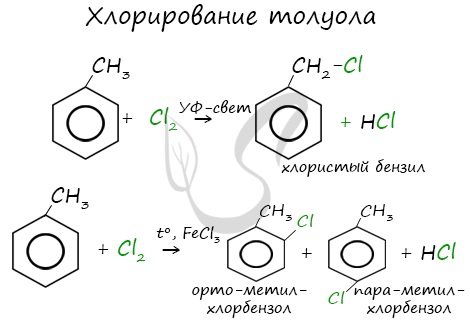
Например, при хлорировании толуола на свету образуется бензилхлорид
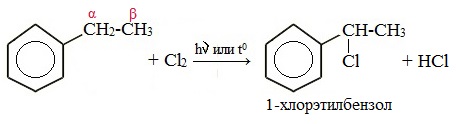
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, этилбензол реагирует с хлором на свету
2. Реакции замещения
Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.).
2.1. Галогенирование
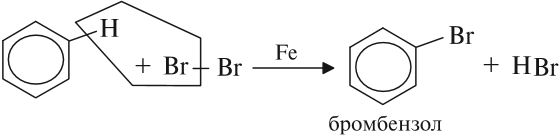
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
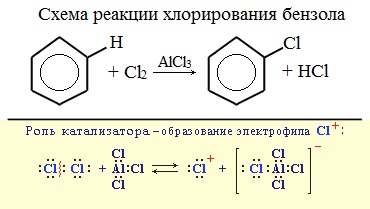
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо.
Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения
Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, при хлорировании этилбензола:
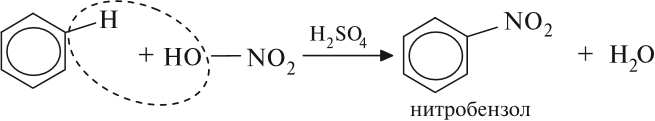
2.2. Нитрование
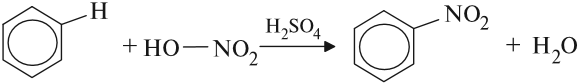
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
Серная кислота способствует образованию электрофила NO2+:
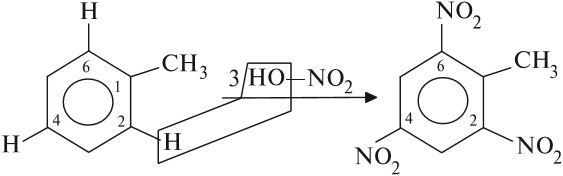
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
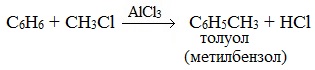
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
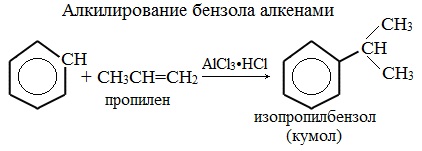
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
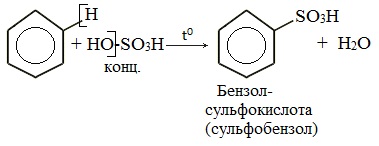
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
2C6H6 + 15O2 → 12CO2 + 6H2O + Q
Уравнение сгорания аренов в общем виде:
CnH2n–6 + (3n – 3)/2 O2 → nCO2 + (n – 3)H2O + Q
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. Окисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
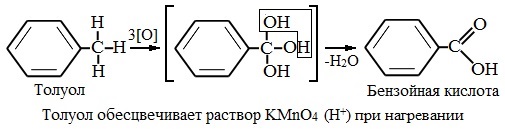
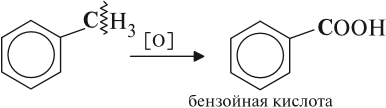
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
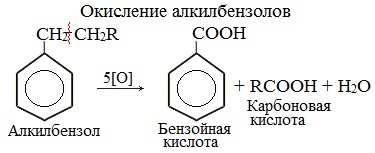
При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты.
Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ
Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат
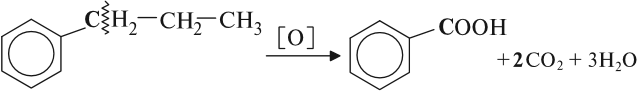
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода).
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода.
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода
5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации.
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
Например, при гидратации стирола образуется спирт:
Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Варнакова И.В.
Организация подготовки к ЕГЭ по химии:
окислительно-восстановительные реакции с участием аренов
В статье рассмотрено окисление аренов перманганатом калия и дихроматом калия, показана зависимость получения продуктов реакции от среды раствора и строения исходных веществ.
Ключевые слова: ОВР, окисление, перманганат калия, восстановители, арены.
В окислительно-восстановительных реакциях (ОВР) органические вещества чаще всего проявляют свойства восстановителей, при этом сами окисляются. Легкость окисления зависит от доступности электронов при взаимодействии с окислителем. Все факторы, приводящие к увеличению электронной плотности (например, положительный индуктивный эффект, мезомерный эффект) повышают способность вещества к окислению. Помимо полного окисления (горения), для некоторых классов органических соединений характерны реакции неполного окисления, при этом они превращаются в другие классы.
Существуют специфические окислители для каждых классов. Но есть два классических окислителя, которые, универсальные для многих классов. Это перманганат калия – KMnO4 бихромат (дихромат) калия – K2Cr2O7. Эти вещества являются сильными окислителями за счет марганца в степени окисления +7, и хрома в степени окисления +6, соответственно.
Реакции с этими окислителями встречаются довольно часто, однако нигде нет целостного руководства, по какому принципу выбирать продукты таких реакций.
На практике действует очень много факторов, влияющих на ход реакции (температура, среда, концентрация реагентов и т.д.). Часто получается смесь продуктов. Поэтому предугадать продукт, который образуется практически невозможно.
Бензол не окисляется даже под действием сильных окислителей
(KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений. В отличие от бензола его гомологи окисляются довольно легко.
Окисление аренов в кислой среде
При действии раствора KMnO4 и нагревании в гомологах бензола окислению подвергаются только боковые цепи:

Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.
Алкильные группы в алкилбензолах окисляются легче, чем алканы. Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
5С6Н5-CH2-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH +6СО2 + 6MnSO4 +3 K2SO4 + 14H2O
бензойная кислота
5C6H5-CH(CH3)2+18KMnO4+27H2SO4 →5C6H5-СООН +10CO2+18MnSO4+ 9K2SO4+ 42H2O
бензойная кислота
2. Если в молекуле арена несколько боковых цепей, то в кислой среде каждая из них окисляется по a-углеродному атому до карбоксильной группы, в результате чего образуются многоосновные ароматические кислоты:
С6Н5С2Н5 + 2K2Сr2O7 + 8H2SO4
→ C6H5COOH + СО2↑ + 2Cr (SO4)3 + 2K2SO4 + 10H2O
бензойная кислота
5С6Н5СН(СН3)2 +18KMnO4 +27H2SO4→ 5C6H5COOH +10СО2 +18MnSO4 + 9K2SO4 +42H2O
бензойная кислота
5С6 Н4 (СН3)2 + 12KMnO4 + 18 H2SO4→ 5C6H4(COOH)2 + 12MnSO4 + 6К2SO4 + 28H2O
фталевая кислота
Окисление аренов в щелочной и нейтральной средах
1. Гомологи бензола при нагревании окисляются перманганатом калия в нейтральной среде с образованием калиевых солей ароматических кислот.
С6Н5-CH3 + 2KMnO4 → C6H5COOК + 2MnO2 + KOН + H2O
бензоат калия
С6Н5- CH2-CH3 + 4KMnO4 → C6H5COOК + К2СО3 + 4MnO2 + KOН + 2H2O
3С6Н5-CH2-CH2-CH3 + 10KMnO4 →3C6H5COOК + 3CH3COOК + 10MnO2 + 4KOН + 4H2O
С6Н4(СН3)2 + 4KMnO4 → C6H4(COOК)2 + 4MnO2↓ + 2KOН + 2H2O
фталат калия
2.Следует обратить внимание на то, что при мягком окислении стирола перманганатом калия КMnO4 в нейтральной или слабощелочной среде происходит разрыв π –связи, образуется гликоль (двухатомный спирт). В результате реакции окрашенный раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV).
3C6H5−CH═CH2 + 2KMnO4 + 4H2O → 3C6H5−CH(OH)-CH2(OH) + 2MnO2↓ + 2KOH
1-фенилэтиленгликоль
Окисление же сильным окислителем — перманганатом калия в кислой среде — приводит к полному разрыву двойной связи и образованию углекислого газа и бензойной кислоты, раствор при этом обесцвечивается.
С6Н5-CH=CH2 + 2KMnO4 + 3H2SO4 → C6H5COOH + СО2↑+ 2MnSO4 + K2SO4 + 4H2O
Таблица 1.
Продукты окисления аренов в кислой и нейтральной/щелочной среде
|
Арен |
Продукты окисления в кислой среде |
Продукты окисления в щелочной среде |
|
C6H5-CH3 |
C6H5-COOH |
C6H5-COOК |
|
C6H5-C2H5 |
C6H5-COOH+CO2 |
C6H5-COOК+ K2CO3 |
|
C6H5-CH(CH3)2 кумол |
C6H5COOH+2CO2 бензойная кислота |
C6H5COOК+2K2CO3 бензоат калия |
|
C6H5-CH2СН2CH3 |
C6H5COOH+ CH3-COOH |
C6H5COOК+ CH3-COOК |
|
CH3-C6H4-CH3 |
HOOC-C6H4-COOH бензолдикарбоновая кислота |
КOOC-C6H4-COOК |
|
C6H5-CH=CH2 |
C6H5COOH+CO2 |
(н.у.) C6H5-CH(ОН)CH2ОН (t°) C6H5-COOК+ K2CO3 |
|
|
терефталевая кислота |
КООС-C6H4-COOК+ +2K2CO3 |
|
|
|
КООС-C6H4-COOК+ CH3COOК |
|
|
изофталевая кислота |
КООС-C6H4-COOК+ CH3COOК+К2СО3 |
Поэтому при изучении окисления аренов в различных средах обучающиеся могут самостоятельно высказать предположения, что в кислой среде следует ожидать образования кислот, а в щелочной – солей. Как показывает многолетний опыт, предложенная методика обучения старшеклассников составлению уравнений ОВР с участием органических веществ повышает их итоговый результат ЕГЭ по химии на несколько баллов.
Список используемой литературы:
Куцапкина Л. В. Окислительно-восстановительные реакции в органической химии : Подготовка к ЕГЭ. — [б. м.] : [б. и.], 2016. — 26 с. — [б. н.]
https://acetyl.ru/f/r600.php
https://docplayer.com/52144692-Organizaciya-podgotovki-k-ege-po-himii-okislitelno-vosstanovitelnye-reakcii-s-uchastiem-organicheskih-veshchestv.html
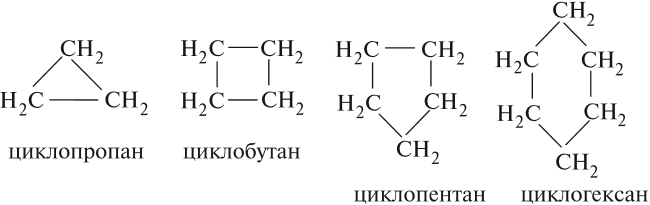
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец.
Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6.
Общая формула их гомологического ряда — CnH2n-6.
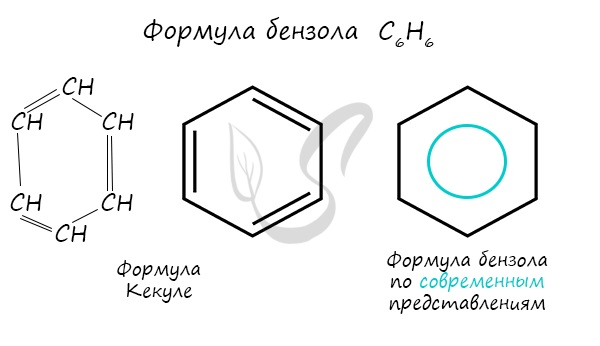
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла
объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям
двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2
гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
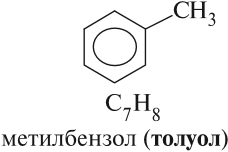
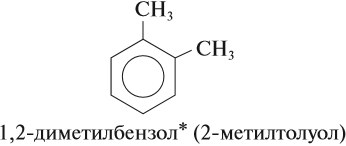
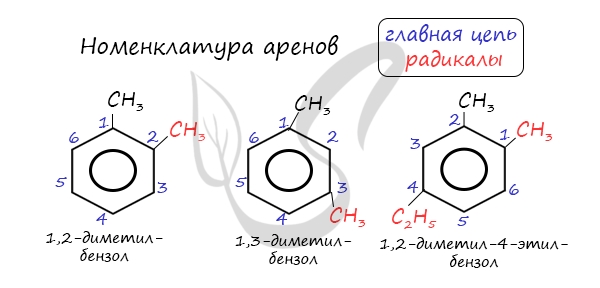
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол),
этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей,
то выбирают кратчайший путь между ними.
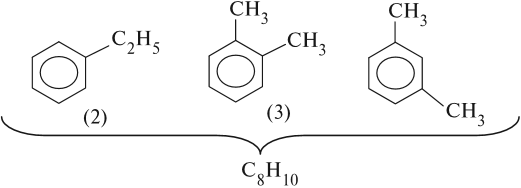
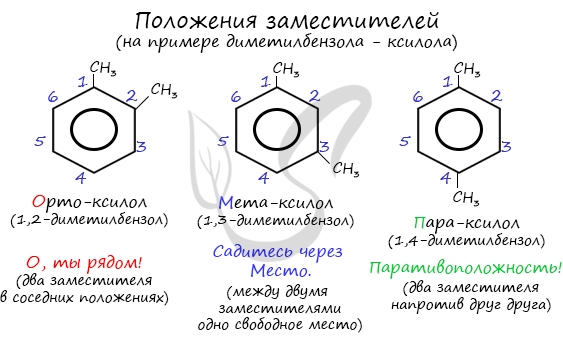
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном
кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается
приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 
Получение аренов
Арены получают несколькими способами:
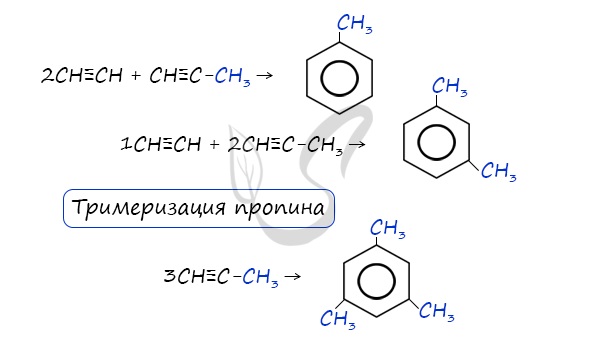
- Реакция Зелинского (тримеризация ацетилена)
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический
углеводород — бензол.

В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге
можно добиться образования 1,3,5-триметилбензола.
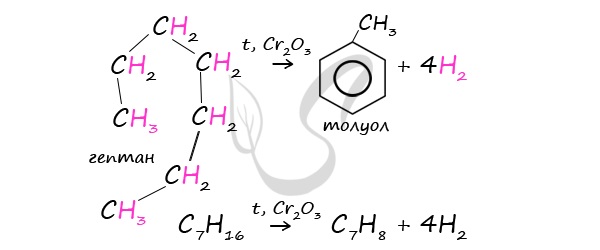
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная
структура алкана замыкается в цикл, отщепляется водород.
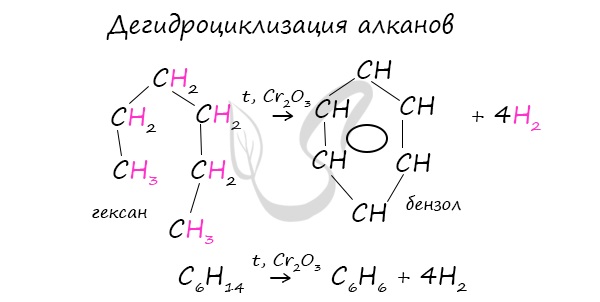
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен,
с теми же заместителями, которые были у циклоалкана.

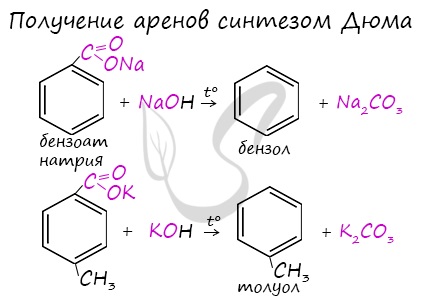
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность
делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и
раствор перманганата калия.
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце
и превратить арен в циклоалкан.

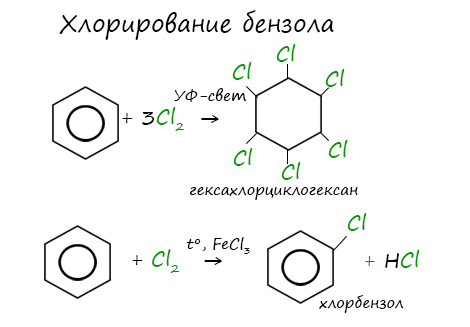
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор,
то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время
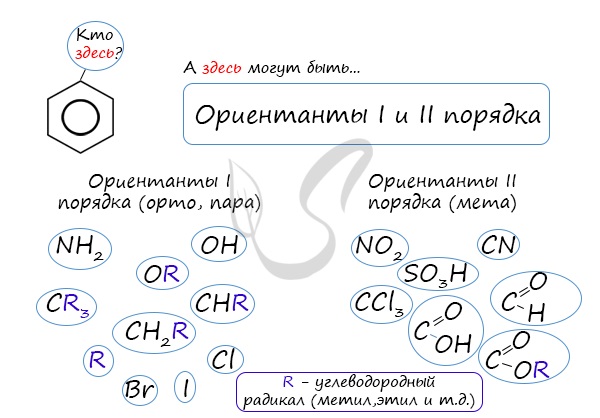
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2,
CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3,
CHO, COOH, COOR.
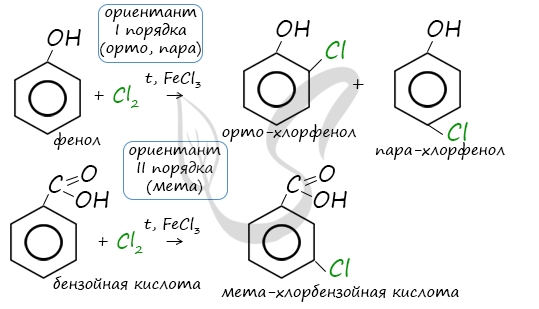
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях.
А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
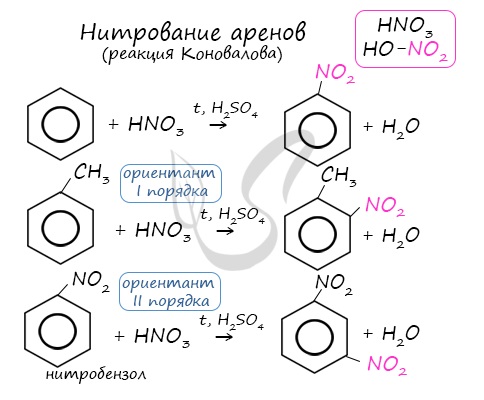
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты,
обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще
всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом
углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
2C6H6 + 15O2 → 12CO2 + 6H2O
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной
кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Подготовка к ЕГЭ по химии
Окислительно-восстановительные реакции
с участием органических веществ.
Алкены. Алкины. Арены.
Кислородсодержащие вещества
(для педагогов и учащихся)
Составила: Борисова Снежана Петровна, учитель химии МАОУ СОШ №4
г.Новый Уренгой
2020
Окислительно-восстановительные реакции (ОВР) (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении — понижается.
Первоначально окислением называли только реакции веществ с кислородом, восстановлением — отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует.
В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого (окислителя), например:
При этом окислитель восстанавливается, а восстановитель — окисляется. При протекании реакций в гальваническом элементе переход электронов осуществляется по проводнику, соединяющему электроды элемента, и изменение энергии Гиббса ΔG в данной реакции может быть превращено в полезную работу. В отличие от реакций ионного обмена окислительно-восстановительные реакции (ОВР) в водных растворах протекают, как правило, не мгновенно.
При окислительно-восстановительных реакциях атомы в высшей степени окисления являются только окислителями, в низшей — только восстановителями; атомы в промежуточной степени окисления в зависимости от типа реакции и условий ее протекания могут быть окислителями или восстановителями. Многие окислительно-восстановительные реакции (ОВР) – каталитические.
По формальным признакам окислительно-восстановительные реакции (ОВР) разделяют на межмолекулярные (например, 2SO2 + O2 → 2SO3) и внутримолекулярные, например:
Последняя реакция представляет собой самоокисление-самовосстановление.
В случае окислительно-восстановительных реакций в органической химии использование обобщенной концепции окисления-восстановления и понятия о степени окисления часто малопродуктивно, особенно при незначительно полярности связей между атомами, участвующими в реакции. В органической химии окисление рассматривают обычно как процесс, при котором в результате перехода электронов от органического соединения к окислителю возрастает число (или кратность) кислородсодержащих связей (С-О, N — О, S — О и т.п.) либо уменьшается число водородсодержащих связей (С — Н, N — Н, S — Н и т.п.), например: RCHO → RCOOH; R2CHCHR2 → R2C=CR2. При восстановлении органических соединений в результате приобретения электронов происходят обратные процессы, например: R2CO → R2CH2; RSO2Cl → RSO2H.
Используют также подход, при котором атомам С в молекуле приписывают различные степени окисления в зависимости от числа связей, образованных с элементом более электроотрицательным, чем водород. В этом случае функциональные производные можно расположить в порядке возрастания их степени окисления. Так, насыщенные углеводороды относят к нулевой группе (приблизительная степень окисления — 4), R2C=CR2, ROH, RCl и RNH2 — к первой (- 2), RCCR, R2CO и R2CCl2 — ко второй (0), RCOOH, RC
CCl, RCONH2 и RССl3 — к третьей (+2), RCN, CCl4 и СО2 — к четвертой (+4). Тогда окисление — процесс, при котором соединение переходит в более высокую категорию, а восстановление — обратный процесс.
В органической химии используют широкий ряд восстановителей и окислителей, что позволяет выбрать реагент, обладающий селективностью (т.е. способностью действовать избирательно на определенные функциональные группы), а также получать продукты в требуемой степени окисления. Например, борогид Na восстанавливает кетоны или альдегиды до спиртов, не реагируя с амидами и сложными эфирами; LiAlH4 восстанавливает все эти соединения до спиртов. Среди окислителей высокой селективностью обладают, например, комплекс CrО3 с пиридином, с высоким выходом окисляющий спирты в кетоны, не затрагивая кратные связи С-С, а также SeO2, окисляющий кетоны и альдегиды до α-дикарбонильных соединений.
Селективность окислительно-восстановительных реакций может быть обеспечена и в каталитических процессах; например, в зависимости от катализатора и условий реакций ацетиленовые углеводороды можно селективно гидрировать до этиленовых или насыщенных углеводородов.
Каталитические окислительно-восстановительные реакции (ОВР) играют важную роль в промышленности, например:
Окислительно-восстановительные реакции (ОВР) широко распространены в природе и используются в технике.
Органическая химия – это химия соединений углерода, поэтому важно уметь вычислять степени окисления атомов углерода в них.
Для определения степени окисления (СО) атомов в молекулах органических веществ существуют разные приёмы, вот один из способов. Он означает, что более электроотрицательный атом, смещая к себе одну электронную пару, приобретает заряд -1, две электронных пары — заряд -2. Связь между одинаковыми атомами не дает вклада в степень окисления. Таким образом, связь между атомами С-С соответствует нулевой степени их окисления. В связи C-H углероду как более электроотрицательному атому соответствует заряд -1, а в связи C-O заряд углерода (менее электроотрицательного) равен +1. Степень окисления атома в молекуле подсчитывается как алгебраическая сумма зарядов, которые дают все связи данного атома.
Пример №1.
Так, в молекуле CH3Cl три связи C-H дают суммарный заряд на атоме C, равный -3, а связь C-Cl — заряд +1. Следовательно, степень окисления атома углерода в этом соединении равна:
— 3+1=-2.
Пример №2.
Определим степени окисления (СО) атомов углерода в молекуле этанола:
C-3H3 – C-1H2 – OH
Три связи C−H дают суммарный заряд на атоме C, равный (С0+3е—→С-3) -3.
Две связи С−Н дают заряд на атоме С, равный -2,а связь С→О заряд +1, следовательно, суммарный заряд на атоме С, равен (-2+1=-1) -1.
Пример №3.
Определим СО атомов углерода в молекуле уксусной кислоты:
С-3Н3 – С+3О – ОН
Три связи C−H дают суммарный заряд на атоме C, равный (С0+3е—→С-3) -3.
Двойная связь С=О (кислород как более электроотрицательный, забирает электроны у атома углерода) даёт заряд на атоме С, равный +2 (С0-2е—→С+2),а связь С→О заряд +1, следовательно, суммарный заряд на атоме С, равен (+2+1=+3) +3.
Пример №4.
Определим СО атомов углерода в молекуле уксусного альдегида:
С-3Н3 – С+1О – Н
Три связи C−H дают суммарный заряд на атоме C, равный (С0+3е—→С-3) -3.
Двойная связь С=О (кислород как более электроотрицательный, забирает электроны у атома углерода) даёт заряд на атоме С, равный +2 (С0-2е—→С+2),а связь С−H заряд -1, следовательно, суммарный заряд на атоме С, равен (+2-1=+1) +1.
К окислителям органических соединений относятся в первую очередь вещества неорганической природы. По агрегатному состоянию их можно разделить на:
— газообразные (О2 воздуха без нагревания и при нагревании, О3);
— жидкие ( [Ag (NH3)2]OH (водные растворы), Cu(OH)2, H2O2, KMnO4/ H2O, KMnO4/ H2SO4, K2Cr2O7/ H2SO4)/
У ряда веществ окислительная активность изменятся в зависимости от условий проведения процесса окисления.
Перманганат калия является очень сильным окислителем, в зависимости от рН среды разные продукты его восстановления.
|
Среда |
Полуреакция |
Пример |
|
Сильно щелочная |
Мn+7 +1е → Мn+6 |
МnО42- (например К2МnО4) (раствор зеленого цвета) |
|
Нейтральная |
Мn+7+3е → Мn+4 |
МnО2 (бурый осадок) |
|
Сильно кислая |
Мn+7+5е → Мn+2 |
Мn2+ (например МnSО4 или МnСl2) (бесцветный раствор) |
Сильными окислителями являются дихроматы в кислой среде.
|
Среда |
Полуреакция |
Пример |
|
Сильно щелочная |
2Cr+6 +6е → 2Cr+3 |
[Cr(OH)6]3- (например К3[Cr(OH)6]) (светло-зеленый раствор) |
|
Нейтральная |
2Cr+6 +6е → 2Cr+3 |
Cr(OH)3 (серо-зеленый осадок) |
|
Сильно кислая |
2Cr+6 +6е → 2Cr+3 |
Cr+3 (например Cr2(SО4)3 или CrСl3) (сине-зелёный раствор) |
Подобрать и расставить коэффициенты в уравнениях окислительно-восстановительных реакций, протекающих с участием органических веществ, можно осуществить тремя способами.
1.Метод электронного баланса
Уравнения электронного баланса описывают процессы окисления и восстановления атомов. Кроме этого, специальные множители указывают на коэффициенты перед формулами веществ, содержащих атомы, которые участвовали в процессах окисления и восстановления. Это, в свою очередь, позволяет находить остальные коэффициенты.
Пример. Окисление толуола перманганатом калия в кислой среде.
C6H5-CH3 + KMnO4 + H2SO4 → …
Известно, что боковые метильные радикалы аренов обычно окисляются до карбоксила, поэтому в данном случае образуется бензойная кислота. Перманганат калия в кислой среде восстанавливается до двузарядных катионов марганца. Учитывая наличие сернокислотной среды, продуктами будут сульфат марганца (II) и сульфат калия. Кроме того, при окислении в кислой среде образуется вода. Теперь схема реакции выглядит так:
C6H5-CH3 + KMnO4 + H2SO4 → C6H5COOH + MnSO4 + K2SO4 + H2O
Из схемы видно, что изменяется состояние атома углерода в метильном радикале, а также атома марганца. Степени окисления марганца определяются по общим правилам подсчета: в перманганате калия +7, в сульфате марганца +2. Степени окисления атома углерода можно легко определить исходя из структурных формул метильного радикала и карбоксила. Для этого нужно рассмотреть смещение электронной плотности исходя из того, что по электроотрицательности углерод занимает промежуточное положение между водородом и кислородом, а связь С-С формально считается неполярной. В метильном радикале атом углерода притягивает три электрона от трех атомов водорода, поэтому его степень окисления равна -3. В карбоксиле атом углерода отдает два электрона карбонильному атому кислорода и один электрон атому кислорода гидроксильной группы, поэтому степень окисления атома углерода +3.
C6H5-C-3H3 + KMn+7O4 + H2SO4 → C6H5C+3OOH + Mn+2SO4 + K2SO4 + H2O
Уравнение электронного баланса:
|
Mn+7 + 5e → Mn+2 |
30 |
6 |
|
C-3 – 6e → C+3 |
5 |
Перед формулами веществ, содержащих марганец необходим коэффициент 6, а перед формулами толуола и бензойной кислоты – 5.
5C6H5-CH3 +6 KMnO4 + H2SO4 → 5C6H5COOH + 6MnSO4 + K2SO4 + H2O
Далее уравниваем число атомов калия:
5C6H5-CH3 +6 KMnO4 + H2SO4 → 5C6H5COOH + 6MnSO4 + 3K2SO4 + H2O
И число атомов серы:
5C6H5-CH3 +6 KMnO4 +9H2SO4→5C6H5COOH + 6MnSO4 +3K2SO4 + H2O
На заключительном этапе необходим коэффициент перед формулой воды, который можно вывести подбором по числу атомов водорода или кислорода:
5C6H5-CH3 +6 KMnO4 +9H2SO4 → 5C6H5COOH + 6MnSO4 +3K2SO4 + 14H2O
2.Метод полуреакций
Пример. Окисление толуола перманганатом калия в кислой среде.
C6H5 CH3 + KMnO4 + H2SO4 → C6H5COOH + MnSO4 + K2SO4 + H2O
Выписываем молекулы органических веществ:
C7H8 → C7H6O2
Выравниваем атомы O молекулой H2O:
(Добавляем слева 2 молекулы воды, т.к. справа 2 атома кислорода)
C7H8 + 2H2O → C7H6O2.
Уравниваем атомы H катионами H+ :
(Cлева 12 атомов водорода, поэтому справа нужно добавить 6 катионов водорода)
C7H8 + 2H2O → C7H6O2 + 6H+
Определяем заряды и переход электронов:
C7H8 + 2H2O — 6 e → C7H6O2 + 6H+
Выписываем ионы марганца
MnO4 — → Mn2+
Выравниваем атомы O молекулой H2O:
(Добавляем справа 4 молекулы воды, т.к. слева 4 атома кислорода)
MnO4 — → Mn2+ + 4 H2O
Уравниваем атомы H катионами H+ :
(Добавляем слева 8 катионов водорода, т.к справа 8 атомов водорода)
MnO4 — + 8Н+ → Mn2+ + 4 H2O
Определяем заряды и переход электронов:
MnO4 — + 8Н+ +5 e → Mn2+ + 4 H2O
Записываем электронно-ионный баланс
|
C7H8 + 2H2O — 6 e → C7H6O2 + 6H+ |
30 |
5 |
|
MnO4 — + 8Н+ +5 е → Mn2+ + 4 H2O |
6 |
Вносим числа в уравнение, расставляя коэффициенты
5C6H5CH3 + 6KMnO4 + H2SO4 → 5C6H5COOH + 6MnSO4 + K2SO4 + H2O
Уравниваем калий, серу, водород и проверяем количество кислорода.
5C6H5CH3 + 6KMnO4 + 9H2SO4 → C6H5COOH + 6MnSO4 + 3K2SO4 +18 H2O
3.Метод электронного баланса и полуреакций
Пример. Окисление толуола перманганатом калия в кислой среде.
C6H5 CH3 + KMnO4 + H2SO4 → C6H5COOH + MnSO4 + K2SO4 + H2O
Определяем степени окисления марганца по общим правилам подсчета: в перманганате калия +7, в сульфате марганца +2.
C6H5-CH3 + KMn+7O4 + H2SO4 = C6H5COOH + Mn+2SO4 + K2SO4 + H2O
Для неорганических веществ используем метод электронного баланса:
Mn+7 + 5e → Mn+2
Для органических веществ используем метод полуреакций (см. метод полуреакций).
Записываем электронно-ионный баланс
|
Mn+7 + 5e → Mn+2 |
30 |
6 |
|
C7H8 + 2H2O — 6 e → C7H6O2 + 6H+ |
5 |
Вносим числа в уравнение, расставляя коэффициенты
5C6H5CH3 + 6KMnO4 + H2SO4 → 5C6H5COOH + 6MnSO4 + K2SO4 + H2O
Уравниваем калий, серу, водород и проверяем количество кислорода.
5C6H5CH3 + 6KMnO4 + 9H2SO4 → C6H5COOH + 6MnSO4 + 3K2SO4 +18 H2O
Реакции окисления алкенов
Реакции окисления алкенов дают возможность превращать их в многоатомные спирты, альдегиды, кетоны, карбоновые кислоты, оксиды. Глубину определяют условия протекания реакций.
Окисление алкенов водным раствором KMnO4
(реакция Вагнера)
При мягком окислении алкены превращаются в гликоли (многоатомные спирты).
Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью. Разрывается только π связь, при этом ơ связь сохраняется. По месту разрыва π связи присоединяются гидроксильные группы, т.е. к тем атомам углерода, между которыми до окисления существовала двойная связь, вне зависимости от места расположения двойной связи (на краю или в центре молекулы).
Реакция с раствором перманганата калия протекает в нейтральной или слабо-щелочной среде следующим образом:
R-CH=CH-R’ + KMnO4 + H2O → R—CH2OH-CH2OH-R’ + MnO2 + KOH
(охлаждение)
Пример 1.
CH2=CH2 + KMnO4 + H2O → CH2OH-CH2OH + MnO2 + KOH
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
6 |
2 |
|
C2H4+ 2H2O — 2 e → C2H6O2 + 2H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3CH2=CH2 + 2KMnO4 + H2O → 3CH2OH-CH2OH + 2MnO2 + KOH
Уравниваем калий, водород и проверяем количество кислорода.
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2MnO2 + 2KOH
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены.
При наличии в молекуле 2-х двойных связей образуются тетраолы:
R-CH=CH-CH=CH-R’ + KMnO4 + H2O → R—CHOH-CHOH-CHOH-CHOH -R’ + MnO2 + KOH
Пример 2.
СН3-CH=CH-CH=CH-СН2-СН3 + KMnO4 + H2O → MnO2 + KOH +
СН3—CHOH-CHOH-CHOH-CHOH — СН2-СН3
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
12 |
4 |
|
C7H12+ 4H2O — 4 e → C7H16O4 + 4H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3СН3-CH=CH-CH=CH-СН2-СН3 + 4KMnO4 + H2O → 4MnO2 + KOH + С3Н3—CHOH-CHOH-CHOH-CHOH — СН2-СН3
Уравниваем калий, водород и проверяем количество кислорода.
3СН3-CH=CH-CH=CH-СН2-СН3 + 4KMnO4 + 8H2O → 4MnO2 + 4KOH + 3СН3—CHOH-CHOH-CHOH-CHOH — СН2-СН3
Окисление алкенов раствором KMnO4 и дихроматом калия
в кислой среде
В кислой среде (подкисленный серной кислотой раствор) при нагревании происходит полное разрушение двойной связи и превращение атомов углерода, между которыми существовала двойная связь, в атомы углерода карбоксильной группы.
1. Если двойная связь находится не на краю, то образуется смесь кислот.
а) если радикалы одинаковые:
R-CH=CH-R + KMnO4 + H2SO4 → 2R-CООН + MnSO4 + K2SO4 + H2O
R-CH=CH-R + K2Cr2O7 + H2SO4 → 2R-CООН + Cr2(SО4)3 + K2SO4 + H2O
Пример 3.
СН3-CH=CH- СН3 + KMnO4 + H2SO4 → 2СН3-CООН + MnSO4 + K2SO4 + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 5e → Mn+2 |
40 |
8 |
|
C4H8+ 4H2O — 8 e → C4H8O4 + 8H+ |
5 |
Вносим числа в уравнение, расставляя коэффициенты
5СН3-CH=CH- СН3 + 8KMnO4 + H2SO4 → 10СН3-CООН + 8MnSO4 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
5СН3-CH=CH- СН3 + 8KMnO4 + 12H2SO4 → 10СН3-CООН + 8MnSO4 + 4K2SO4 + 12H2O
Пример 4.
СН3-CH=CH- СН3 + K2Cr2O7 + H2SO4 → 2СН3-CООН + Cr2(SО4)3 + K2SO4 + H2O
Записываем электронно-ионный баланс
|
2Cr+6 + 6e → 2Cr+3 |
24 |
4 |
|
C4H8+ 4H2O — 8e → C4H8O4 + 8H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3СН3-CH=CH- СН3 + 4 K2Cr2O7+ H2SO4 → 6СН3-CООН + 4 Cr2(SО4)3 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
3СН3-CH=CH- СН3 + 4 K2Cr2O7 + 16H2SO4 → 6СН3-CООН + 4Cr2(SО4)3 + 4K2SO4 + 16H2O
б) если радикалы разные:
R-CH=CH-R’ + KMnO4 + H2SO4 → R-CООН + R’-CООН + MnSO4 + K2SO4 + H2O
R-CH=CH-R’ + K2Cr2O7+ H2SO4 → R-CООН + R’-CООН + Cr2(SО4)3 + K2SO4 + H2O
Пример 5.
СН3-CH=CH- СН2-СН3 + KMnO4 + H2SO4 → MnSO4 + K2SO4 + H2O + СН3-CООН + СН3-СН2 -CООН
Записываем электронно-ионный баланс
|
Mn+7 + 5e → Mn+2 |
40 |
8 |
|
C5H10 + 4H2O — 8 e → C2H4O2 + C3H6O2 + 8H+ |
5 |
Вносим числа в уравнение, расставляя коэффициенты
5СН3-CH=CH- СН2-СН3 + 8KMnO4 + H2SO4 → 8MnSO4 + K2SO4 + H2O + 5СН3-CООН + 5СН3-СН2 -CООН
Уравниваем калий, водород и проверяем количество кислорода.
5СН3-CH=CH- СН2-СН3 + 8KMnO4 + 16H2SO4 → 8MnSO4 + 4K2SO4 + 16H2O + 5СН3-CООН + 5СН3-СН2 -CООН
Пример 6.
СН3-CH=CH- СН2-СН3 + K2Cr2O7 + H2SO4 → + Cr2(SО4)3 + K2SO4 + H2O + СН3-CООН + СН3-СН2 -CООН
Записываем электронно-ионный баланс
|
2Cr+6 + 6e → 2Cr+3 |
24 |
4 |
|
C5H10 + 4H2O — 8 e → C2H4O2 + C3H6O2 + 8H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3СН3-CH=CH- СН2-СН3 + 4K2Cr2O7 + H2SO4 → 4Cr2(SО4)3 + K2SO4 + H2O + 3СН3-CООН + 3СН3-СН2 -CООН
Уравниваем калий, водород и проверяем количество кислорода.
3СН3-CH=CH- СН2-СН3 + 4K2Cr2O4 + 16H2SO4 → 4Cr2(SО4)3 + 4K2SO4 + 16H2O + 3СН3-CООН + 3СН3-СН2 -CООН
2. Если двойная связь находится у конца молекулы (например, в случае бутена-1), то одним из продуктов должна оказаться муравьиная кислота – вещество, которое легко окисляется до углекислого газа:
R-CH=CH2 + KMnO4 + H2SO4 → R-CООН + СО2 + MnSO4 + K2SO4 + H2O
R-CH=CH2 + K2Cr2O7 + H2SO4 → R-CООН + СО2 + Cr2(SО4)3 + K2SO4 + H2O
Пример 7.
СН3-CH=CH2 + KMnO4 + H2SO4 → СН3-CООН + СО2 + MnSO4 + K2SO4 + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 5e → Mn+2 |
10 |
2 |
|
C3H6 + 4H2O — 10 e → C2H4O2 + CO2 + 10H+ |
1 |
Вносим числа в уравнение, расставляя коэффициенты
СН3-CH=CH2 + 2KMnO4 + H2SO4 → СН3-CООН + СО2 + 2MnSO4 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
СН3-CH=CH2 + 2KMnO4 + 3H2SO4 → СН3-CООН + СО2 + 2MnSO4 + K2SO4 + 4H2O
Пример 7.
СН3-CH2 -CH=CH2 + K2Cr2O7 + H2SO4 → СН3-CH2 -CООН + СО2 + Cr2(SО4)3 + K2SO4 + H2O
Записываем электронно-ионный баланс
|
2Cr+6 + 6e → 2Cr+3 |
30 |
5 |
|
C4H8+ 4H2O — 10 e → C3H6O2 + CO2 + 10H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3СН3-CH2 -CH=CH2 + 5K2Cr2O4 + H2SO4 → 3СН3-CH2 -CООН + 3СО2 + 5Cr2(SО4)3 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
3СН3-CH2 -CH=CH2 + 5K2Cr2O7 +20H2SO4 → 3СН3-CH2 -CООН + 3СО2 + 5Cr2(SО4)3 + 5K2SO4 + 23H2O
3. Если в молекуле алкена атом углерода при двойной связи содержит два углеводородных заместителя (например, 2-метилбутен-2), то при его окислении происходит образование кетона:
Пример 8.
Записываем электронно-ионный баланс
|
Mn+7 + 5e → Mn+2 |
30 |
6 |
|
C5H10 + 3H2O — 6 e → C3H6O + C2H4O2 + 6H+ |
5 |
Вносим числа в уравнение, расставляя коэффициенты
5(СН3)2С-CH=CH2 + 6KMnO4 + H2SO4 → 6MnSO4 + K2SO4 + H2O + 5СН3-СО- СН3 + 5СН3-CООН
Уравниваем калий, водород и проверяем количество кислорода.
4. Если в молекуле атом углерода при двойной связи содержит два углеводородных заместителя и 2 двойных связи, то при равных условиях они обе будут подвержены разрыву с образованием смеси веществ одно- и двухосновной кислот, углекислого газа или кетона:
Окисление алкенов раствором KMnO4
в сильнощелочной среде
1. В молекуле двойная связь располагается с краю: связь полностью разрушается, крайний атом превращается в среднюю соль (карбонат), оставшаяся часть — также в соответствующую соль.
R -CH=CH2 + KMnO4 + KOH → R-COOK + K2CO3 + H2O + K2MnO4 (нагревание)
Пример 9.
CH3 -CH=CH2 + KMnO4 + KOH → CH3COOK + K2CO3 + H2O + K2MnO4
Записываем электронно-ионный баланс
|
Mn+7 + 1e → Mn+6 |
10 |
10 |
|
C3H6 + 5H2O — 10e → CH3 COO— + CO32- + 13H+ |
1 |
Вносим числа в уравнение, расставляя коэффициенты
СН3-CH=CH2 + 10KMnO4 + КОН → СН3-CООК + K2CO3 + H2O + 10K2MnO4
Уравниваем калий, водород и проверяем количество кислорода.
СН3-CH=CH2 + 10KMnO4 + 13КОН → СН3-CООК + K2CO3 + 8H2O + 10K2MnO4
2. В молекуле двойная связь располагается в середине молекулы: связь полностью разрушается, образуются 2 соли карбоновых кислот.
R -CH=CH-R’ + KMnO4 + KOH → R-COOK + R’-COOK + H2O + K2MnO4 (нагревание)
Пример 10.
CH3 -CH=CH-CH2 -CH3 + KMnO4 + KOH → CH3COOK + C2H5COOK + H2O + K2MnO4
Записываем электронно-ионный баланс
|
Mn+7 + 1e → Mn+6 |
8 |
8 |
|
C5H10 + 4H2O — 8e → CH3 COO— + C2H5CОO— + 10H+ |
1 |
Вносим числа в уравнение, расставляя коэффициенты
CH3-CH=CH-CH2 -CH3 + 8KMnO4 + КОН → CH3COOK + C2H5COOK + H2O + 8K2MnO4
Уравниваем калий, водород и проверяем количество кислорода.
CH3-CH=CH-CH2-CH3+8KMnO4 +10КОН → CH3COOK + C2H5COOK + 6H2O + 8K2MnO4
Задания для самостоятельной работы
- Составьте уравнение окисления пентена-1 раствором перманганата калия в нейтральной среде.
- Составьте уравнение окисления пентена-1 раствором перманганата калия в кислой среде.
- Составьте уравнение окисления пентена-1 раствором перманганата калия в сильнощелочной среде.
- Составьте уравнение окисления пентена-2 раствором дихромата калия в кислой среде.
- Составьте уравнение окисления пентена-2 раствором перманганата калия в сильнощелочной среде.
- Составьте уравнение окисления 3-метилпентен-2 раствором перманганата калия в кислой среде.
- Составьте уравнение окисления 2,3-диметилпентен-2 раствором перманганата калия в кислой среде.
- Составьте уравнение окисления 2-метилпропена раствором перманганата калия в кислой среде.
- Составьте уравнение окисления гексена-3 раствором дихромата калия в кислой среде.
- Составить и уравнять методом электронно-ионного баланса схемы реакций взаимодействия алкена с водным и сернокислым (при t°C) раствором перманганата калия:
|
Вариант |
Название алкена (исходного вещества) |
|
I |
2-метилбутен-1 |
|
II |
2-метилпентен-1 |
|
III |
бутен-1 |
|
IV |
пентен-1 |
|
V |
3-метилпентен-1 |
|
VI |
3-метилпентен-2 |
Реакции окисления алкинов
Алкины окисляются значительно труднее алкенов. Сильные окислители окисляют алкины с разрывом тройной связи до карбоновых кислот. Эта реакция используется как качественная на наличие тройной связи (как и двойной) в органических соединениях
Окисление алкинов водным раствором KMnO4
Окисление алкинов перманганатом калия в нейтральной среде на холоду (00С) приводит к образованию 1,2-дикетона.
R-C C-R’ + KMnO4 + H2O → R—CO-CO-R’ + MnO2 + KOH
(охлаждение)
Пример 1.
СН3-CC- СН3 + KMnO4 + H2O →
Записываем электронно-ионный баланс
Пример 2.
+ KMnO4
КООС-СООК +
Записываем электронно-ионный баланс
Пример 3.
СН3-CCН + KMnO4 + H2O
СН3-СООК + КНСО3 +
Записываем электронно-ионный баланс
Окисление алкинов в кислой среде
Окисление ацетилена подкисленным раствором перманганата калия на холоду приводит к образованию щавелевой кислоты:
+ KMnO4 + H2SO4 → КООС-СООК +
При нагревании в присутствии перманганата калия в кислотной среде происходит расщепление кратной связи.
1.Если тройная связь находится у конца молекулы (например, в случае бутина-1), то одним из продуктов должна оказаться муравьиная кислота – вещество, которое легко окисляется до углекислого газа:
R-C CН + KMnO4 + H2SO4 → R-CООН + СО2 +
Пример 4.
СН3-CCН + KMnO4 + H2SO4 → СН3-СООН + СО2 +
Записываем электронно-ионный баланс
2. Если тройная связь находится не на краю, то образуется смесь кислот.
Пример 5.
СН3-CC- СН3 + K2Cr2O7 + H2SO4 → 2СН3-CООН +
Записываем электронно-ионный баланс
СН3-CC- СН2-СН3 + KMnO4 + H2SO4 →
Записываем электронно-ионный баланс
Пример 6.
СН3-CC- СН2-СН3 + K2Cr2O7 + H2SO4 →
Записываем электронно-ионный баланс
Пример 7.
СН3-CH2 -CC- СН2-CH2-СН3 + K2Cr2O7 + H2SO4 →
Записываем электронно-ионный баланс
Реакции окисления аренов
1.Бензол не окисляется даже под действием сильных окислителей
(KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
В отличие от бензола его гомологи окисляются довольно легко.
Окисление аренов раствором KMnO4
в щелочной среде
1. В молекуле тройная связь располагается с краю: связь полностью разрушается, крайний атом превращается в среднюю соль (карбонат), оставшаяся часть — также в соответствующую соль.
R -CCH + KMnO4 + KOH → R-COOK + K2CO3 + H2O + K2MnO4 (нагревание)
Пример 9.
CH3 -CCH + KMnO4 + KOH →
Записываем электронно-ионный баланс
Вносим числа в уравнение, расставляя коэффициенты
2. В молекуле тройная связь располагается в середине молекулы: связь полностью разрушается, образуются 2 соли карбоновых кислот.
R -CC-R’ + KMnO4 + KOH → R-COOK + R’-COOK + H2O + K2MnO4 (нагревание)
Пример 10.
CH3 -CC-CH2 -CH3 + KMnO4 + KOH →
Записываем электронно-ионный баланс
Пример 11.
CH3 -CCН + K2Cr2O7 + H2SO4 →
Записываем электронно-ионный баланс
Пример 12.
CH3 -CCН + KMnO4 + H2O →
Записываем электронно-ионный баланс
Пример 13.
CH3 -CC-СН2-СН2-СН3 + KMnO4 + H2O →
Записываем электронно-ионный баланс
Окисление аренов в кислой среде
При действии раствора KMnO4 и нагревании в гомологах бензола окислению подвергаются только боковые цепи:
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.
Алкильные группы в алкилбензолах окисляются легче, чем алканы. Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
Пример 1.
С6Н5-CH2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Записываем электронно-ионный баланс
Вносим числа в уравнение, расставляя коэффициенты
С6Н5-CH2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5-CH2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены.
С6Н5-CH2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Пример 2.
С6Н5-CH2-СН2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СН3-CООН + MnSO4 + K2SO4 + H2O
Записываем электронно-ионный баланс
Вносим числа в уравнение, расставляя коэффициенты
С6Н5-CH2-СН2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СН3-CООН + MnSO4 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5-CH2-СН2-CH3 + KMnO4 + H2SO4 → C6H5COOH + СН3-CООН + MnSO4 + K2SO4 + H2O
Пример 3.
С6Н5-CH2-(CH3)2 + K2Cr2O7 + H2SO4 → СН3-CООН + 2СО2 + Cr2(SО4)3 + K2SO4 + H2O
Записываем электронно-ионный баланс
Вносим числа в уравнение, расставляя коэффициенты
С6Н5-CH2-(CH3)2 + K2Cr2O7 + H2SO4 → СН3-CООН + 2СО2 + Cr2(SО4)3 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5-CH2-(CH3)2 + K2Cr2O7 + H2SO4 → СН3-CООН + 2СО2 + Cr2(SО4)3 + K2SO4 + H2O
2.Если в молекуле арена несколько боковых цепей, то в кислой среде каждая из них окисляется по a-углеродному атому до карбоксильной группы, в результате чего образуются многоосновные ароматические кислоты:
Пример 5.
С6Н5-CH=CH2 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Записываем электронно-ионный баланс
Вносим числа в уравнение, расставляя коэффициенты
С6Н5-CH=CH2 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5-CH=CH2 + KMnO4 + H2SO4 → C6H5COOH + СО2 + MnSO4 + K2SO4 + H2O
Окисление аренов в щелочной и нейтральной средах
1. Гомологи бензола при нагревании окисляются перманганатом калия в нейтральной среде с образованием калиевых солей ароматических кислот.
Пример 6.
С6Н5-CH3 + KMnO4 → C6H5COOК + MnO2 + KOН + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
6 |
2 |
|
C7H8 + 2H2O — 6 e → C7H5O2— + 7H+ |
1 |
Вносим числа в уравнение, расставляя коэффициенты
С6Н5-CH3 + 2KMnO4 → C6H5COOК + 2MnO2 + KOН + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5-CH3 + 2KMnO4 → C6H5COOК + 2MnO2 + KOН + H2O
Пример 6.
С6Н5— CH2-CH3 + KMnO4 → C6H5COOК + К2СО3 + MnO2 + KOН + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
12 |
4 |
|
C8H10 + 5H2O — 12 e → C7H5O2— + СО32- + 15H+ |
1 |
Вносим числа в уравнение, расставляя коэффициенты
С6Н5— CH2-CH3 + 4KMnO4 → C6H5COOК + К2СО3 + 4MnO2 + KOН + H2O
Уравниваем калий, водород и проверяем количество кислорода.
С6Н5— CH2-CH3 + 4KMnO4 → C6H5COOК + К2СО3 + 4MnO2 + KOН + 2H2O
Пример 6.
С6Н5— CH2-CH2-CH3 + KMnO4 → C6H5COOК + CH3COOК + MnO2 + KOН + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
30 |
10 |
|
C9H12 + 4H2O — 10 e → C7H5O2— + CH3COО— + 12H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3С6Н5-CH2-CH2-CH3 + 10KMnO4 → 3C6H5COOК + 3CH3COOК + 10MnO2 + KOН + H2O
Уравниваем калий, водород и проверяем количество кислорода.
3С6Н5— CH2-CH2-CH3 + 10KMnO4 → 3C6H5COOК + 3CH3COOК + 10MnO2 + 4KOН + 4H2O
2.Следует обратить внимание на то, что при мягком окислении стирола перманганатом калия КMnO4 в нейтральной или слабощелочной среде происходит разрыв π -связи ,образуется гликоль (двухатомный спирт). В результате реакции окрашенный раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV).
Пример 7.
С6Н5-CH=CH2 + KMnO4 + H2O → С6Н5-CH(ОН)-CH2(ОН) + MnO2 + KOН + H2O
Записываем электронно-ионный баланс
|
Mn+7 + 3e → Mn+4 |
6 |
2 |
|
C8H8 + 2H2O — 2 e → C8H10O2 + 2H+ |
3 |
Вносим числа в уравнение, расставляя коэффициенты
3С6Н5-CH=CH2 + 2KMnO4 + H2O → 3С6Н5-CH(ОН)-CH2(ОН) + 2MnO2 + KOН + H2O
Уравниваем калий, водород и проверяем количество кислорода.
3С6Н5-CH=CH2 + 2KMnO4 + 4H2O → 3С6Н5-CH(ОН)-CH2(ОН) + 2MnO2 + 2KOН
Задания для самостоятельной работы
- Составьте уравнение окисления изопропилбензола раствором перманганата калия в кислой среде.
- Составьте уравнение окисления толуола раствором перманганата калия в нейтральной среде.
- Составьте уравнение окисления бутилбензола раствором дихромата калия в кислой среде.
- Составьте уравнение окисления пентина-2 раствором дихромата калия в кислой среде.
- Составьте уравнение окисления пентина-1 раствором перманганата калия в кислой среде.
- Составьте уравнение пропина раствором перманганата калия в кислой среде.
- Составьте уравнение окисления гексина-3 раствором дихромата калия в кислой среде.
Окисление кислородсодержащих органических соединений
1. (CH3)2C6H3C(H)O + KMnO4 + H2SO4 → (HOOC)2C6H3COOH + MnSO4 + K2SO4 + H2O
2. CH3OH + K2Cr2O7 + HCI → HCOOH + CrCI3 + KCI + H2O
3. CH3OH + KMnO4 + H2SO4 → HCOOH + MnSO4 + K2SO4 + H2O
4. C2H5OH + KMnO4 → CH3COOK + MnO2↓ + KOH + H2O
5. C2H5OH + KMnO4 + H2SO4 → CH3COOH + K2SO4 + MnSO4 + H2O
6. C2H5OH + KMnO4 → MnO2↓ + CH3C(H)O + KOH + H2O
7. C2H5OH + K2FeO4 → Fe2O3↓ + CH3C(H)O + KOH + H2O
8. C2H5OH + K2MnO4 → CH3C(H)O + MnO2↓ + KOH
9. C2H5OH + CrO3 + H2SO4 → CH3COOH + Cr2(SO4)3 + H2O
10. C2H5OH + CrO3 → CO2↑ + Cr2O3↓ + H2O
11. C2H5OH + CI2 + NaOH → CH3COONa + NaCI + H2O
12. C2H5OH + K2Cr2O7 + H2SO4 → CH3C(H)O + Cr2(SO4)3 + K2SO4 + H2O
13. CH3CH(OH)CH2─CH3 + KMnO4 → CH3C(O) ─CH2CH3 + MnO2↓ + KOH + H2O
14. HOOC─CH(CH3)CH2OH + KMnO4 + H2SO4 →
→ HOOC─CH(CH3)COOH + K2SO4 + MnSO4 + H2O
15. HOCH2CH2OH + KMnO4 → K2C2O4 + MnO2↓ + KOH + H2O
16. HC(H)O + KMnO4 + H2SO4 → HCOOH + MnSO4 + K2SO4 + H2O
17. CH3C(H)O + Cu(OH)2 + NaOH CH3COONa + Cu2O↓ + H2O
18. CH3C(H)O + KMnO4 + H2SO4 → CH3COOH + K2SO4 + MnSO4 + H2O
19. RCOCH3 + I2 + KOH → RCOOK + CH3I + KI + H2O
20. CH3COOH + KMnO4 → K2CO3 + MnO2↓ + H2O + CO2↑
21. H2C2O4 + K2Cr2O7 + H2SO4 → Cr2(SO4)3 + CO2↑ + K2SO4 + H2O
22. C6H12O6 + KMnO4 + H2SO4 → CO2↑ + MnSO4 + K2SO4 + H2O
23. C12H22O11 + KMnO4 + H2SO4 → CO2↑ + K2SO4 + MnSO4 + H2O
Смотреть видео:
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Алкены.Окисление алкенов с KMnO4 и K2Cr2O7. Все 14 реакций ЕГЭ.
Вурдихан Вурдиханов

Алкины. Окисление с KMnO4 и K2Cr2O7. Все 9 реакций ЕГЭ.
Вурдихан Вурдиханов

Алкины.Окисление алкинов с KMnO4 и K2Cr2O7. Все 9 реакций ЕГЭ
Вурдихан Вурдиханов

Спирты. Окисление с KMnO4 и K2Cr2O7. Все 12 реакций ЕГЭ.
Вурдихан Вурдиханов
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
15.11.2019
- Комментарии
RSS
Написать комментарий
Нет комментариев. Ваш будет первым!
Ваше имя:
Загрузка…
Химические свойства аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму
Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца.
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
Например, при хлорировании толуола на свету образуется бензилхлорид
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, этилбензол реагирует с хлором на свету
2. Реакции замещения
Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.).
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо.
Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения
Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, при хлорировании этилбензола:
2.2. Нитрование
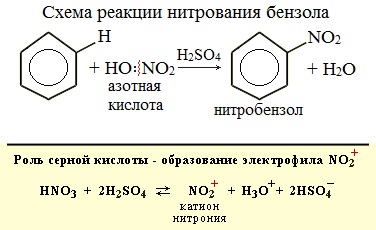
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
Серная кислота способствует образованию электрофила NO2 + :
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
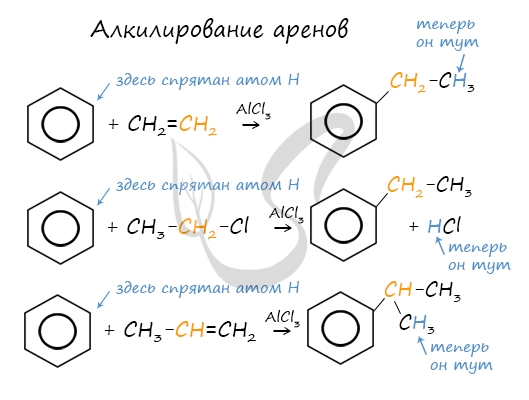
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
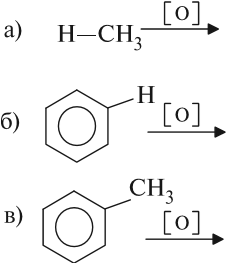
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
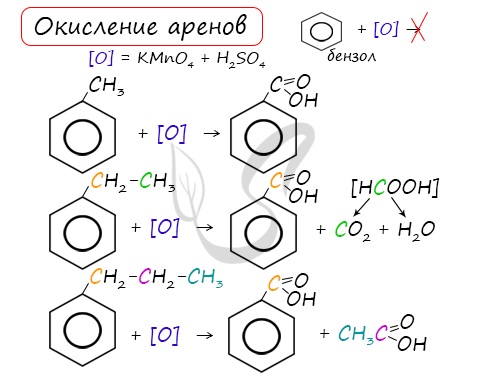
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты.
Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ
Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода).
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода.
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
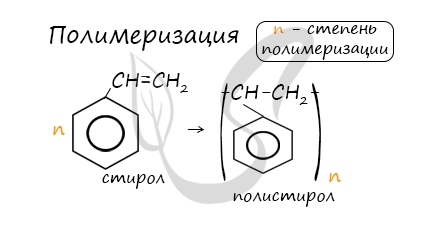
Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации.
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
Например, при гидратации стирола образуется спирт:
Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Бензол и его гомологи
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
- Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства аренов с уравнениями
По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Это объясняется особенностями строения бензольного кольца. Шестиэлектронная π-система является более устойчивой, чем обычные двухэлектронные π-связи. Делокализация шести π-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов.
Поэтому арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности.
Видеоопыт «Изучение отношения бензола к бромной воде и раствору перманганата калия»
Для аренов наиболее характерны реакции, идущие с сохранением ароматической системы- реакции замещения атомов водорода, связанных с циклом.
Ароматическое ядро, обладающее подвижной системой π-электронов, является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение π-электронного облака с двух сторон плоского σ-скелета молекулы.
Для аренов наиболее характерны реакции, протекающие по механизму электрофильного замещения, обозначаемого символом SЕ (анг. substitution electrophilic). В них участвует как само бензольное ядро, так и связанная с ним боковая цепь. Реакции замещения у аренов протекают легче, чем у предельных углеводородов.
Другие реакции (присоединение, окисление), в которых участвуют делокализованные углерод-углеродные связи бензольного кольца и нарушается его ароматичность идут с трудом.
Реакции замещения в бензольном кольце
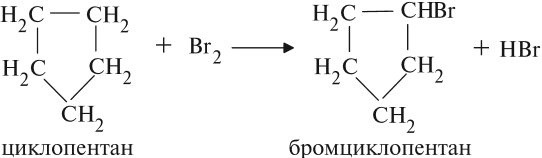
1. Галогенирование
Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, FeCl3 (с хлором), AlBr3, Fe Br3 (с бромом) при нагревании. Так, при взаимодействии бензола с бромом атом водорода замещается атомом брома.
Важно! Реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует. Бензол не обесцвечивает бромную воду!
Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы. Положительно заряженный ион хлора вступает в реакцию с бензолом.
2. Нитрование
Если на бензол действовать смесью концентрированных азотной и серной кислот (нитрующей смесью), то атом водорода замещается на нитрогруппу. Реакция проводится при нагревании.
Образуется тяжелая желтоватая жидкость с запахом горького миндаля — нитробензол, поэтому данная реакция может быть качественной на бензол.
3. Алкилирование галогеналканами
Замещение атома водорода в бензольном кольце на алкильную группу (алкилирование) происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) или алкенов в присутствии катализаторов AlBr3, FeBr3, AlCl3, FeCl3 (кислот Льюиса) при нагревании.
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола.
Алкилирование бензола алкенами
4. Сульфирование
Реакция легко проходит под действием «дымящей» серной кислоты (олеума).
Реакции присоединения
Эти реакции характеризуют арены как непредельные соединения. В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, они вступают с большим трудом. Для их протекания необходимы жесткие условия: высокая температура, наличие катализатора, световое облучение и др.
1.Гидрирование
Присоединение водорода к бензолу идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан.
Эта реакция является обратной образованию бензола при дегидрировании циклогексана.
Гомологи бензола при гидрировании дают производные циклогексана.
2.Радикальное хлорирование
Галогенирование бензола происходит при взаимодействии его паров с хлором под воздействием ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт – гексахлорциклогексан или гексахлоран (сильное средство для уничтожения насекомых).
Видеоопыт «Хлорирование бензола (получение гексахлорана)»
Бензол не присоединяет галогеноводороды и воду.
Замещение в боковой цепи
Галогенирование по α-атому углерода в боковой цепи
Реакция идет при нагревании или облучении и всегда по α-углероду. При продолжении галогенирования второй атом галогена снова встанет в α-положение.
Замещение в алкилбензолах
Гомологи бензола (алкилбензолы) С6Н5–R более активно вступают в реакции замещения по сравнению с бензолом.
Реакции окисления
Бензол очень устойчив к окислителям. Он не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
Однако алкильные группы в алкилбензолах окисляются легче предельных углеводородов. Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
1. При действии раствора KMnO4 и нагревании в гомологах бензола окислению подвергаются только боковые цепи.
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.
Видеоопыт «Окисление бензола и толуола»
2. Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах.
Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
источники:
http://studarium.ru/article/186
http://himija-online.ru/organicheskaya-ximiya/areny/ximicheskie-svojstva-arenov.html
Содержание
- Понятие о циклических углеводородах. Циклоалканы
- Понятие об ароматических углеводородах
- История открытия бензола. Строение молекулы
- Гомологический ряд, номенклатура, изомерия
- Свойства бензола
- Физические свойства
- Химические свойства
- Свойства гомологов бензола
- Влияние боковой цепи на бензольное кольцо
- Влияние бензольного кольца на CH3-группу боковой цепи
- Получение бензола и его гомологов
- Выводы
Понятие о циклических углеводородах. Циклоалканы
Циклические углеводороды — это вещества, в молекулах которых имеется замкнутая цепь атомов углерода.
Циклоалканы (циклопарафины) — это углеводороды замкнутого (циклического) строения, в молекулах которых атомы углерода соединены только простыми связями.
Общая формула циклоалканов СnH2n, поэтому эти углеводороды нельзя отнести к предельным углеводородам. Атомы углерода, образующие цикл, соединены между собой простыми σ-связями, как в алканах. В зависимости от величины цикла, т. е. числа сторон в этом углеродном многоугольнике, различают циклоалканы:
- трёхчленные (правильные треугольники);
- четырёхчленные (правильные четырёхугольники);
- пятичленные (правильные пятиугольники) и т. д.
По номенклатуре ИЮПАК названия циклопарафинов образуют, прибавляя приставку цикло- — к названию алкана.
Например:
Первые два представителя — циклопропан и циклобутан (при н. у.) — газы, следующие три — жидкости, высшие — твёрдые вещества.
Циклопентан, циклогексан и их гомологи — наиболее устойчивые циклоалканы, поэтому они с трудом вступают в реакции гидрирования, галогенирования и т. д. Если реакция галогенирования происходит, то это реакция замещения, цикл при этом не разрушается:
Трёхчленные и четырёхчленные циклы, имея менее устойчивый цикл, способны присоединять одну молекулу водорода, превращаясь в предельный углеводород:
При этом происходит размыкание цикла. Галогенирование циклобутана идёт так же, как и его гидрирование:
Обратите внимание. Атомы хлора становятся в 1,4-положение: по концам разорванной цепи. Это реакции присоединения. С бОльшим трудом вступают в реакции присоединения и устойчивые пяти— и шестичленные циклоалканы.
Поэтому циклопарафины нельзя отнести к насыщенным углеводородам.
Циклопарафины входят в состав нефти, составляя до 25– 75 % её. Поэтому их называют нафтенами.
Понятие об ароматических углеводородах
К ароматическим углеводородам относятся углеводороды, в молекулах которых содержится одно или несколько бензольных ядер (колец)*.
* Существуют и другие ароматические углеводороды и органические соединения. В данном пособии они не рассматриваются.
Бензольное ядро — это остаток типичного представителя ароматических углеводородов — бензола.
История открытия бензола. Строение молекулы
Бензол был открыт в начале прошлого века. Это было загадочное вещество. Многие учёные пытались разгадать его строение, объяснить его свойства, но не могли. Почему?
Дело в том, что было установлено: состав молекулы бензола выражается формулой
Задание 21.1. По составу молекулы определите, является ли это вещество предельным или непредельным углеводородом.
Если сравнить состав бензола с соответствующим алканом, легко видеть, что бензол — сильно ненасыщенное соединение. Для того чтобы превратиться в алкан, бензол должен присоединить 8 атомов (4 молекулы) водорода. Но оказалось, что бензол, присоединяя 3 молекулы водорода, превращается в вещество циклического строения:
Значит, и бензол имеет циклическое строение!
Теперь возникает вопрос: какие связи соединяют атомы углерода в молекуле бензола? В 1865 году немецкий химик Кекуле* предложил такую модель молекулы бензола:
* Кекуле Фридрих Август (07.09.1829–13.07.1896) — немецкий химик-органик. В 1858 г. выдвинул положение о том, что «конституция» вещества обусловлена «валентностью» элементов, предложил (1865) циклическую структурную формулу бензола, доказал равноценность всех связей внутри бензольного кольца.
Эта модель объясняла многие свойства бензола, но не объясняла особенности химических свойств этого соединения. Ведь если углеводород имеет три двойные связи, то он должен давать качественные реакции на двойную (кратную) связь.
Вопрос. Какие вы знаете качественные реакции на кратную связь?
Но оказалось, что бензол эти качественные реакции не даёт, т. е.
- не обесцвечивает бромную воду (при нормальных условиях);
- не обесцвечивает раствор перманганата калия.
Значит, двойных связей в молекуле бензола НЕТ!
Дальнейшие исследования показали, что в молекуле бензола существует особая, очень прочная ароматическая связь. Рассмотрим её образование на примере бензола.
Как уже было сказано, бензол имеет циклическое строение, причём атомы углерода соединены в правильный шестиугольник при помощи простых σ-связей. Такие σ-связи соединяют атомы углерода и водорода:
Вопрос. Сколько связей образовал каждый атом углерода? Сколько электронов участвует в образовании этих связей?
Поскольку каждый атом углерода имеет по четыре валентных электрона, а в образовании трёх простых σ-связей участвовало по три электрона каждого атома, — у каждого атома углерода осталось по одному «лишнему» электрону (•). Эти электроны объединяются и образуют единую электронную систему — ароматическую связь:
Задание. Соедините точки линией, не отрывая карандаш от бумаги. Что у Вас получилось? Окружность.
Ароматическая связь в молекулах обозначается кружочком:
Формулы (1) и (1а) отражают строение одного и того же вещества бензола, состава С6Н6. Записывая формулу бензола (1а), следует помнить, что:
- в вершинах этого правильного шестиугольника находится атом углерода;
- каждый атом углерода соединён с одним атомом водорода.
Гомологический ряд, номенклатура, изомерия
Для того чтобы вывести общую формулу гомологического ряда бензола, сравним, как всегда, состав алкана и бензола, у которых число атомов углерода одинаково:
Гомологи бензола (арены) должны отвечать формуле СnН2n–6 и содержать одно бензольное кольцо (остаток бензола). Так как у бензола состав C6H6, то ближайший гомолог бензола имеет семь атомов углерода в молекуле:
Вопрос. Существуют ли ароматические изомеры толуола, т. е. можно ли получить новое соединение, «перемещая» метильную группу (СН3) по кольцу?
Поскольку все атомы углерода равноценны, — изомеров ароматического строения у толуола нет и обозначать цифрой положение метильной группы не имеет смысла.
Если n = 8, то составу С8Н10 отвечают несколько формул:
В местах соединения атомов углерода бензольного кольца и радикалов атомов водорода нет!
Вопрос. От чего будет зависеть изомерия таких ароматических соединений?
Очевидно, что для вещества (3) возможны ещё два изомера, которые отличаются взаимным расположением метильных групп. В этом случае положение метильной группы нужно показывать цифрой. Цифрой 1 нумеруют любую метильную группу и, двигаясь по кольцу в сторону ближайшей группы, расставляют остальные номера:
* Ароматические изомеры диметилбензола называются ксилол.
Задание 21.2. Составьте формулы остальных гомологов бензола с n = 8. Назовите полученные изомеры. Назовите также соединение (2).
Свойства бензола
Физические свойства
Бензол — это бесцветная жидкость с характерным запахом. Приятный запах некоторых ароматических соединений (аромат) дал название целому классу соединений. Бензол легче воды и не смешивается с нею. Являясь неполярным соединением, бензол хорошо растворяет неполярные соединения: жиры и масла.
Химические свойства
В молекуле бензола имеется очень прочная ароматическая связь. Поэтому в химических реакциях бензол стремится сохранить ароматическую связь. Для того чтобы понять, какие химические реакции более характерны для бензола, вспомним, как протекают реакции основных типов: замещения и присоединения.
Задание 21.3. Составьте уравнения реакций с бромом для этана и этилена. Укажите тип этих реакций.
Обратите внимание: реакции замещения происходят без изменения структуры молекулы (тип химической связи остался прежним):
А в реакциях присоединения изменяется структура молекулы, изменяется тип химической связи:
Вопрос. Какой тип химической реакции предпочтительнее для бензола: замещения или присоединения? Почему?
Поскольку в реакциях замещения тип химической связи не изменяется, то бензол и другие ароматические углеводороды преимущественно вступают в реакции замещения, так как в этих реакциях ароматическая связь (она наиболее прочная) не разрушается. Следует помнить, что при обычных условиях бензол в химические реакции не вступает.
Вопрос. Почему?
Так, реакция бромирования бензола происходит в присутствии катализатора железа:
Реакция нитрования (с HNO3) происходит при нагревании в присутствии концентрированной серной кислоты:
В особых условиях возможно разрушение ароматической связи, и тогда бензол вступает в реакции присоединения:
На ярком солнечном свету происходит взаимодействие бензола с хлором или бромом:
Бензол при обычных условиях не окисляется, например не обесцвечивает раствор перманганата калия. Окисление идет в особых условиях и сопровождается разрушением бензольного кольца. Бензол легко воспламеняется и горит коптящим пламенем. Пары бензола взрывоопасны. Бензол ядовит!
Задание 21.4. Составьте уравнение реакции горения бензола.
Свойства гомологов бензола
Свойства толуола и других гомологов бензола очень похожи на свойства самого бензола, но всё же имеют определённые особенности.
В теории Бутлерова сказано: атомы в молекуле взаимно влияют друг на друга. Поэтому появление в молекуле любой новой группы оказывает влияние на остальные атомы, т. е. изменяет свойства прежнего вещества.
Рассмотрим взаимное влияние атомов в молекуле на примере толуола.
Влияние боковой цепи на бензольное кольцо
Сравним две реакции: нитрование бензола и толуола. Исходные вещества отличаются друг от друга на группу СН3 (метил).
Отличается ли их поведение в этих реакциях? Да. Бензол вступает в реакцию медленнее, и в его молекуле может быть замещён любой атом водорода:
Толуол реагирует с азотной кислотой в 24 раза быстрее. В его молекуле могут быть замещены только те атомы водорода, которые связаны со вторым, четвёртым или шестым атомом углерода по отношению к CH3 группе:
Вывод. Влияние СН3-группы, а также любых других углеводородных радикалов, заключается в том, что они (эти группы) облегчают реакции замещения и направляют их в 2, 4, 6-положения по отношению к себе.
Влияние бензольного кольца на CH3-группу боковой цепи
Сравним три реакции окисления (знак [O] означает мягкое окисление в водном растворе окислителя):
Первые две реакции при обычных условиях не происходят, т. е. бензол и метан не окисляются в растворах и не обесцвечивают розовый раствор перманганата калия (КМnО4). Толуол вступает в такую реакцию:
Таким образом, ни СН3-группа, ни бензол по отдельности не окисляются при нормальных условиях. Но влияние бензольного кольца на СН3-группу приводит к тому, что связи в ней становятся более полярными и разрушаются под действием перманганата калия. Такая реакция характерна и для других гомологов бензола:
Под действием бензольного кольца становятся более полярными ближайшие к кольцу С–Н связи. Поэтому при окислении раствором перманганата калия любого гомолога бензола на месте боковой цепи образуется карбоксильная группа СООН.
Задание 21.5. Составьте уравнения реакций:
Укажите тип этих реакций.
Получение бензола и его гомологов
Бензол можно получить из ацетилена:
а также дегидроциклизацией алканов (дегидрирование — отщепление водорода, циклизация — образование замкнутого кольца из атомов углерода):
Бензол и другие ароматические углеводороды, как и алканы, можно получать из солей соответствующих кислот:
Гомологи бензола можно получить, как и алканы, из галогенпроизводных углеводородов:
Выводы
Арены — это непредельные циклические углеводороды, содержащие прочную ароматическую связь. Для таких веществ характерны реакции замещения атома водорода. Возможны также реакции присоединения.