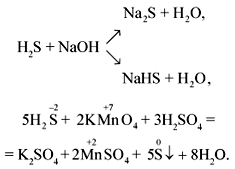Решение задач на олеум в рамках ЕГЭ
В блоке материалов по неорганической химии к ЕГЭ есть достаточно интересный объект под названием олеум. Например, он фигурировал в одной из задач 33 на прошедшем в 2022 году ЕГЭ. Что это такое? Давайте разберемся и решим несколько примеров заданий.
Олеум представляет собой раствор оксида серы (VI) (серного ангидрида) в безводной серной кислоте. Уже здесь остановимся и отметим два важных факта:
1) олеум – это смесь веществ, а не индивидуальное соединение;
2) олеум вообще не содержит воды, хотя и является раствором.
Иногда олеуму приписывают формулу пиросерной кислоты H2S2O7. Это в общем случае не будет верным, поскольку массовая доля SO3 в олеуме может быть ниже или выше, чем 44,9%, которые соответствуют формуле H2S2O7. Проще рассматривать отдельно оксид и серную кислоту в составе смеси.
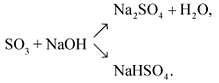
Как писать реакции и решать задачи, в которых фигурирует олеум? Первое, что следует понимать, это то, что оксид серы (VI) очень активно реагирует с водой. Именно по этой причине олеум дымит на воздухе. Над его поверхностью образуется туман из мелких капель серной кислоты. Поскольку реакция с водой идет настолько активно, при смешении олеума с любым водным раствором первой будет протекать реакция оксида с водой:
SO3 + H2O = H2SO4
Далее уже образовавшая серная кислота реагирует с компонентами раствора, если это возможно. Вторым важным свойством олеума являются сильные окислительные свойства. В этом он схож с концентрированной серной кислотой. Так, олеум очень легко обугливает бумагу, вату, х/б ткань, окисляет многие другие органические и неорганические вещества. Если его растворить в небольшом количестве воды, то получим концентрированный раствор серной кислоты. Она вполне может участвовать в ОВР.
Давайте решим несколько задач с участием олеума.
№1
Навеску 10%-ного олеума растворили в 100 мл холодной воды и получили 10%-ный раствор серной кислоты. Определите массу исходной навески.
Решение:
Поскольку олеум содержит SO3, запишем уравнение его реакции с водой:
SO3 + H2O = H2SO4
Пусть масса олеума была х г, тогда масса SO3 была равна 0,1х г, а серной кислоты в олеуме было 0,9х г. Тогда запишем массу конечного раствора:
m(Н2О исх.) = ρ·V = 1·100 = 100 г
m(р-ра конечн.) = m(Н2О исх.) + m(олеума) = 100 + х г
Сразу можно выразить массу серной кислоты в конечном растворе:
m(H2SO4 конечн.) = m(р-ра конечн.)·ω(H2SO4)/100% = (100 + х)·10%/100% = 10 + 0,1х г
Выразим массу серной кислоты, которая образовалась из SO3:
n(SO3) = m(SO3)/M(SO3) = 0,1х/80 моль
n(H2SO4 из SO3) = n(SO3) = 0,1х/80 моль
m(H2SO4 из SO3) = n·M= 0,1х/80·98 = 0,1225x г
Запишем итоговое выражение для массы серной кислоты в конечном растворе:
m(H2SO4 конечн.) = m(H2SO4 из SO3) + m(H2SO4 из олеума) = 0,1225х + 0,9х = 10 + 0,1х
Решим уравнение и найдем массу олеума:
0,1225х + 0,9х = 10 + 0,1х
0,9225х = 10
х = 10,84 г
Ответ: 10,84 г
№2
Навеску олеума массой 10,6 г полностью нейтрализовали 5% раствором гидроксида натрия. Определите массовую долю оксида серы (VI) в исходной навеске, если известно, что массовая доля соли в конечном растворе равна 8,37%.
Решение:
Помним, что если олеум смешивают с водным раствором, то первой пишем реакцию SO3 с водой:
SO3 + H2O = H2SO4
Далее нужно записать реакцию нейтрализации всей серной кислоты:
2NaOH + H2SO4 = Na2SO4 + 2H2O
Пусть в составе исходной навески было х моль оксида серы и у моль кислоты. Тогда выразим массу исходной навески через введенные переменные:
m(SO3) = n·M = 80x г
m(H2SO4 из олеума) = n·M = 98у г
m(навески) = m(SO3) + m(H2SO4 из олеума) = 80х + 98у г
Выразим общее количество серной кислоты, которую нейтрализовали:
n(H2SO4 из SO3) = n(SO3) = х моль
n(H2SO4 общ.) = n(H2SO4 из SO3) + n(H2SO4 из олеума)= х + у моль
Тогда можно записать количество и массу сульфата натрия:
n(Na2SO4) = n(H2SO4 общ.) = x + y моль
m(Na2SO4) = n·M = 142(х + у) г
Далее найдем количество и массу гидроксида натрия:
n(NaOH) = 2n(Na2SO4) = 2(x + y) моль
m(NaOH) = n·M = 80(х + у) г
Выразим массу исходного раствора щелочи:
m(р-ра NaOH) = m(NaOH)/ω(NaOH)·100% =1600(х + у) г
Тогда масса конечного раствора равна:
m(р-ра конечн.) = m(р-ра NaOH) + m(олеума) = 1600(х + у) + 10,6 г
Выразим массовую долю сульфата натрия в конечном растворе:
ω(Na2SO4) = m(Na2SO4)/m(р-ра конечн.)·100% = 142(х + у)/(1600(х + у) + 10,6)·100% = 8,37%
Составим и решим систему уравнений:
80х + 98у = 10,6
142(х + у)/(1600(х + у) + 10,6)·100% = 8,37%
80х + 98у = 10,6
142(х + у)/(1600(х + у) + 10,6) = 0,0837
80х + 98у = 10,6
142(х + у) = 133,92(х + у) + 0,887
80х + 98у = 10,6
8,08(х + у) = 0,887
80х + 98у = 10,6
х + у = 0,11
х = 0,11 – у
8,8 – 80у + 98у = 10,6
х = 0,11 – у
18у = 1,8
х = 0,01 моль
у = 0,1 моль
m(SO3) = n·M = 0,8 г
m(H2SO4 из олеума) = n·M = 9,8 г
m(навески) = m(SO3) + m(H2SO4 из олеума) = 0,8 + 9,8 = 10,6 г
Вычислим массовую долю оксида серы (VI) в олеуме:
ω(SO3) = m(SO3)/m(навески)·100% = 0,8/10,6·100% = 7,55%
Ответ: 7,55% .
№3
Навеску олеума, в котором содержалось 18 моль электронов, растворили в 10 мл воды. К полученному горячему раствору добавили порошок железной окалины массой 1,74 г, который полностью прореагировал. Определите массовую долю воды в конечном растворе, если известно, что массовая доля оксида серы (VI) в олеуме равна 16,95%.
Решение:
Помним, что если олеум смешивают с водным раствором, то первой пишем реакцию SO3 с водой:
SO3 + H2O = H2SO4
Пусть в составе исходной навески было х моль серной кислоты и у моль оксида серы (VI). Тогда в составе навески было 50х + 40у моль электронов. Выразим массы компонентов смеси:
m(H2SO4 исх.) = 98x г
m(SO3) = 80y г
Массовую долю оксида можно выразить следующим образом:
ω(SO3) = m(SO3)/m(олеума) = m(SO3)/(m(SO3) + m(H2SO4 исх.)·100% = 80y/(98x + 80y)·100%
Составим систему уравнений:
50х + 40у = 18
80y/(98x + 80y)·100% = 16,95%
80у = 36 – 100х
(36 – 100х)/(36 – 2х) = 0,1695
80у = 36 – 100х
36 – 100х = 6,102 – 0,339х
80у = 36 – 100х
х = 0,3
у = 0,075
Далее нам нужно понять, что получилось после добавления олеума к воде. Вычислим количество воды и сравним с количеством оксида серы (VI):
m(H2O исх.) = ρ·V = 1·10 = 10 г
n(H2O исх.) = m/M = 10/18 = 0,5556 моль
n(H2O исх.) > n(SO3), следовательно, получим раствор серной кислоты, а весь оксид прореагирует.
Для дальнейшего расчета нужно рассмотреть реакцию железной окалины и серной кислоты. Принципиально она может протекать в двух вариантах:
1)Fe3O4 + 4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O (разбавленная кислота)
2)2Fe3O4 + 10H2SO4 = 3Fe2(SO4)3 + SO2 + 10H2O (концентрированная кислота)
Вычислим массовую долю кислоты в растворе:
n(H2SO4) = n(H2SO4 исх.) + n(SO3) = 0,3 + 0,075 = 0,375 моль
m(H2SO4) = n·M = 0,375·98 = 36,75 г
m(H2SO4 исх.) = n·M = 0,3·98 = 29,4 г
m(SO3) = n·M = 0,075·80 = 6 г
m(р-ра H2SO4) = m(H2SO4 исх.) + m(SO3) + m(H2O исх.) = 29,4 + 6 + 10 = 45,4 г
ω(H2SO4) = m(H2SO4)/m(р-ра H2SO4)·100% = 36,75/45,4·100% = 80,95%
Поскольку кислоту вполне можно считать концентрированной, реакция с железной окалиной пойдет по типу ОВР:
2Fe3O4 + 10H2SO4 = 3Fe2(SO4)3 + SO2 + 10H2O
Вычислим количество и массу образовавшихся сернистого газа и воды:
n(Fe3O4) = m/M = 1,74/232 = 0,0075 моль
n(SO2) = 0,5n(Fe3O4) = 0,00375 моль
n(Н2О обр.) = 10n(SO2) = 0,00375·10 = 0,0375 моль
m(SO2) = n·M = 0,00375·64 = 0,24 г
m(Н2О обр.) = n·M = 0,0375·18 = 0,675 г
Вычислим массу воды, оставшейся после реакции с олеумом:
n(Н2О расх.) = n(SO3) = 0,075 моль
m(Н2О расх.) = n·M = 0,075·18 = 1,35 г
m(Н2О ост.) = m(H2O исх.) – m(Н2О расх.) = 10 – 1,35 = 8,65 г
Тогда суммарно в конечном растворе будет:
m(Н2О конечн.) = m(Н2О ост.) + m(Н2О обр.) = 8,65 + 0,675 = 9,325 г
Вычислим массу конечного раствора и массовую долю воды в нем:
m(р-ра конечн.) = m(р-ра H2SO4) + m(Fe3O4) — m(SO2) = 45,4 + 1,74 – 0,24 = 46,9 г
ω(Н2О) = m(Н2О конечн.)/m(р-ра конечн.)·100% = 9,325/46,9·100% = 19,88%
Ответ: 19,88%
Чтобы поделиться, нажимайте
Задачи на тему Реакции в растворах. Олеум.
Предлагаем вашему вниманию задачи по теме Реакции в растворах. Олеум с подробными видео-объяснениями (даны сразу после условий задания) и ответами (приведены в конце страницы).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
-
Рассчитайте массу (г) 8%-го раствора гидроксида натрия, который потребуется для нейтрализации раствора серной кислоты массой 300 г с массовой долей растворённого вещества 4,9%.
-
Сколько сульфида меди (в г) образуется, если к 200 г 4%-го раствора сульфата меди (II) добавить 150 г 1,3%-го раствора сульфида натрия?
-
Для определения хлорида натрия в технической поваренной соли навеску массой 10 г растворили в 40 г воды. К пробе полученного раствора массой 2 г добавили избыток раствора нитрата серебра (I). Масса выпавшего осадка 0,861 г. Каково содержание хлорида натрия в технической поваренной соли (в массовых долях -%)?
-
К воде объёмом 50 см3 добавили раствор серной кислоты объёмом 100 см3 с плотностью 1,4 г/см3. Плотность полученного раствора понизилась до 1,2 г/см3. К пробе полученного раствора объёмом 2 см3 добавили избыток раствора хлорида бария. Масса выпавшего осадка составила 2,097 г. Определите массовую долю (%) серной кислоты в исходном растворе.
-
После упаривания раствора гидроксида калия объёмом 560 мл с массовой долей KOH 10% и плотностью 1,1 г/см3, получили раствор объёмом 200 см3. Рассчитайте объём (см3) этого раствора, который необходим для нейтрализации раствора серной кислоты массой 49 г с массовой долей H2SO4 8%.
-
Рассчитайте массу (г) раствора с массовой долей гидроксида калия 14%, который нужно добавить к раствору массой 35 г с массовой долей азотной кислоты 10%, чтобы получить раствор с массовой долей азотной кислоты, равной 6%.
-
Смешали раствор соляной кислоты объёмом 400 см3 и молярной концентрацией 0,175 моль/дм3 и раствор гидроксида натрия объёмом 300 см3 с молярной концентрацией 0,2 моль/дм3. Найти рН полученного раствора (изменением объёма при смешивании растворов пренебречь).
-
Какую массу (г) оксида серы (VI) необходимо растворить в воде массой 306 г, чтобы получить 24% олеум?
-
Рассчитайте объём (см3) 70%-й серной кислоты (плотность 1,615 г/мл), получаемой смешением раствора объёмом 1 дм3 (плотность 1,265 г/мл) с массовой долей серной кислоты 35% с 32%-м олеумом.
-
Рассчитайте, какой объём (см3) 80%-го олеума (плотность 2 г/см3) надо прибавить к раствору объёмом 4 дм3 (плотность 1,8 г/см3) с массовой долей серной кислоты 96%, чтобы получить 100%-ную кислоту.
Ответы:
- 150
- 2
- 88
- 50
- 15
- 6
- 2
- 1886
- 1520
- 800
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет, а также получить условия всех пробных, тренеровочных и реальных вариантов ЕГЭ, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
А также:
- Посмотреть видео-объяснения решений всех типов задач по химии
- Просмотреть все тесты по органической химии с видео-объяснениями
- Просмотреть все тесты по неорганической химии с видео-объяснениями
- Посмотреть пробные варианты ЦТ вы можете здесь,
- Посмотреть пробные и реальные варианты ЕГЭ
- Посмотреть все видео-уроки по различным разделам школьного курса
- Больше заданий РТ с видео-объяснениями
- Больше заданий ЦТ с видео-объяснениями
- Больше заданий ЕГЭ с ответами и видео-объяснениями
- Все видео-объяснения вы можете найти на YouTube канале
Материалы сайта (тесты, задания, задачи, видео) разработаны автором самостоятельно и не являются копией каких-либо других заданий, в том числе заданий, разработанных РИКЗом (Республиканским институтом контроля знаний). При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.
В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:
Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.
Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.
Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Пункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
Решение задач по химии
Категория: Химия.
Решение задач по химии
Получение олеума.
О́леум (лат. Oleum) – раствор серного ангидрида SO3 в 100%-й серной кислоте H2SO4.
xSO3·H2O или H2SO4·xSO3 или H2S2O7;
Олеум представляет собой вязкую маслянистую бесцветную жидкость или легкоплавкие кристаллы, которые, однако, могут приобретать самые различные оттенки вследствие наличия примесей. На воздухе «дымит», реагирует с водой с выделением очень большого количества тепла. Концентрация серного ангидрида может варьировать в очень широких пределах: от единиц до десятков процентов. Олеум по сравнению с концентрированной серной кислотой обладает ещё большим водоотнимающим и окислительным действием. Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
Физические свойства
Температура кипения водных растворов серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % H2SO4.
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме, общее давление пара над ним повышается.
Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
Применение
Применяется в промышленности при производстве серной кислоты, капролактама и многих других веществ. В органической химии применяется как сульфирующий, водоотнимающий или окисляющий реагент.
Особенности экспериментальной работы
Олеум – крайне едкое вещество: оставляет сильные ожоги на коже, быстро разъедает многие материалы, за исключением наименее реакционноспособных. Тем не менее, вследствие эффекта пассивации может храниться в стальных ёмкостях. Олеум нельзя разбавлять водой или выливать его в воду, из-за сильно экзотермической реакции. Разбавление олеума производится прибавлением его к серной кислоте. При приливании в воду жидкость закипает, образуя туман из серной кислоты.
Задача 1.
К 75 %-му раствору серной кислоты массой 288 г добавили оксид серы (VI) массой 400 г. Вычислите массовую долю оксида серы (VI) в образовавшемся олеуме.
Решение:
т (Н2О)= 288 – 216 = 72 г.
Часть оксида серы (VI) вступит в реакцию с водой. Всего оксида серы (VI) 5 моль. На реакцию с водой потратится 4 моль оксида серы (VI). Останется 1 моль оксида серы (VI).
SO3 + H2O = H2SO4. По уравнению химической реакции все вещества находятся в равных количественных соотношениях.
n (SO3) =
n (H2O) =72 г/18 г/моль = 4 моль.
n (SO3) = 5 моль-4 моль = 1 моль.
m (SO3)ост. = 80г/моль * 1 моль = 80 г.
m (H2SO4) = 4моль*98 г/моль = 392 г.
mp-pa = 288+400 = 688 г.
= 11,6 %. Ответ: 11,6 %.
Задача 2.
К 92 %-му раствору серной кислоты массой 562,5 г. добавили оксид серы (VI) массой 240 г. Вычислите массовую долю оксида серы (VI) в образовавшемся олеуме.
Решение:
т (Н2О)= 562,5 – 517,5 = 45 г.
Часть оксида серы (VI) вступит в реакцию с водой. Всего оксида серы (VI) 3 моль. На реакцию с водой потратится 2,5 моль оксида серы (VI). Останется 0,5 моль оксида серы (VI).
SO3 + H2O = H2SO4. По уравнению химической реакции все вещества находятся в равных количественных соотношениях.
n (SO3) =
n (H2O) =45 г/18 г/моль = 2,5 моль.
n (SO3) = 3 моль-2,5 моль = 0,5 моль.
m (SO3)ост. = 80г/моль * 0,5 моль = 40 г.
mp-pa = 562,5+240 =802,5 г.
= 4,98 %. Ответ: 4,98 %.
Задача 3.
Вычислите массу оксида серы (VI), который необходимо добавить к 20 %-му раствору серной кислоты массой 200 г, чтобы получить 10 %-ный олеум.
Решение:
т (Н2О)= 200 – 40 = 160 г. n (H2O) =160 г/18 г/моль = 8,89 моль.
SO3 + H2O = H2SO4. n (SO3) = 8,89 моль. m (SO3)вступ. в р-ю с Н2О= 80г/моль * 8,89 моль = 711,2 г.
Пусть масса оставшегося непрореагировавшим оксида серы (VI) – х, тогда
Х= 20 + 71,12 + 0,1х
0,9х = 91,12
х = 101,2 г.
масса всего оксида серы (VI)
m (SO3) = 711,2 + 101,2 = 812,4 г. Ответ: 812,4 г.
Задача 4.
Вычислите массу оксида серы (VI), который необходимо добавить к 90 %-му раствору серной кислоты массой 250 г, чтобы получить 20 %-ный олеум.
Решение:
т (Н2О)= 250 – 225 = 25 г. n (H2O) =25 г/18 г/моль = 1,39моль.
SO3 + H2O = H2SO4. n (SO3) = 1,39 моль. m (SO3)вступ. в р-ю с Н2О= 80г/моль * 1,39 моль = 111,1 г.
Пусть масса оставшегося непрореагировавшим оксида серы (VI) – х, тогда
Х= 50 + 22,22 + 0,2х
0,8 х = 72,22
х = 90,3 г.
масса всего оксида серы (VI)
m (SO3) = 90,3 + 111,1 = 201,3 г. Ответ: 201,3 г.
Задача 5.
Вычислите массу 50 %-ной серной кислоты и массу оксида серы (VI), которые необходимо взять, чтобы получить 200 г 20 %-ого олеума.
Решение:
Можно определить сколько осталось оксида серы (VI) в олеуме.
, m (SO3) = 40 г.
Пусть масса вступившего в реакцию с водой оксида серы (VI) – х, тогда всего m (SO3) = х + 40
Поуравнению: SO3 + H2O = H2SO4
n (SO3) = = 0,225 х ;
Пусть mp. в. Н2SO4 – y, тогда:
Масса олеума 200 г, тогда:
200 = х + 40 + y + 0. 225 x ; 160 = 1. 225 x + y ;
160 = 1. 225 x + 0. 225 x
160 = 1. 45 x ; x = 110. 3 ; y = 24. 8
т (Н2О)= 24. 8 г.
m (SO3) = 110,3 + 40 = 150,3 г.
mp-paH2SO4 = 24,8 + 24,8 = 49,6 г. Ответ: 49,6 г и 150,3 г.
Задача 6.
Вычислите массу оксида серы (VI) и массу 25 %-ого раствора серной кислоты, необходимых для приготовления 20 % -ого олеума массой 400 г.
Решение:
Можно определить сколько осталось оксида серы (VI) в олеуме.
, m (SO3) = 80 г.
Пусть масса вступившего в реакцию с водой оксида серы (VI) – х, тогда всего m (SO3) = х + 80
По уравнению: SO3 + H2O = H2SO4
n (SO3) = = 0,225 х ;
Пусть mp. в. Н2SO4 – y, тогда:
Масса олеума 400 г, тогда:
400 = х + 80 + y + 0,225 x ; 320 = 1,225 x + y ;
320 = 1,225 x + 0,075 x
320 = 1,3 x ; x = 246,2 ; y = 18,5
т (Н2О)= 55. 4 г.
m (SO3) = 80 + 246,2 = 326,2 г.
m p-pa H2SO4 = 18,5 + 55,4 = 73,9 г. Ответ: 326,2 г. и 73,9 г.
Задача 7.
Вычислите массу серного ангидрида и массу 40 %-ого раствора серной кислоты, необходимых для приготовления 200 г 16 %-ого олеума.
Можно определить сколько осталось оксида серы (VI) в олеуме.
, m (SO3) = 32 г.
Пусть mp. в. Н2SO4 – х, тогда: mp-paH2SO4 = 100х/40 = 2,5 х
200 = 2,5 х + 32 + m (SO3)прор.
т (Н2О) в р-ре H2SO4 =2,5 х – х = 1,5 х
n (H2O) =
n (SO3) =
m (SO3)прор. = 80г/моль * = г.
200 = 2,5 х + 32 + ; 27,5 х = 504 ; х = 18,3
Следовательно: mp-paH2SO4 = 45,8 г.
m (SO3)прор. = 122,2г. m (SO3)ост. = 32 г. m (SO3) = 154,2 г.
Ответ: 154,2 г. и 45,8 г.
Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется
при изготовлении красителей, органическом синтезе и в производстве серной кислот.
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении
образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
SO2 + O2 ⇄ (кат. — V2O5) SO3
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
1. NO + O2 → NO2
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием
нитрозилсерной кислоты:
2. NO + NO2 + 2H2SO4 = 2NO(HSO4) + H2O
3. NO(HSO4) + H2O = H2SO4 + HNO2
В водном растворе диссоциирует ступенчато.
H2SO4 ⇄ H+ + HSO4—
HSO4— ⇄ H+ + SO42-
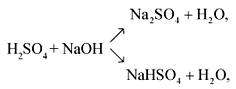
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.
MgO + H2SO4 → MgSO4 + H2O
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)

С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие
другие кислоты, способна растворять осадки.
BaBr2 + H2SO4 → BaSO4↓ + 2HBr
MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O

Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
S + H2SO4 → SO2 + H2O
C + H2SO4 → CO2 + SO2 + H2O
Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl.
Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления.
Они окисляются до +2.
Fe + H2SO4(разб.) → FeSO4 + H2↑
Zn + H2SO4(разб.) → ZnSO4 + H2↑
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)

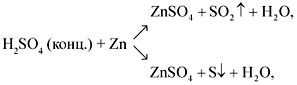
Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами
выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.

Na + H2SO4(конц.) → Na2SO4 + H2S + H2O
Zn + H2SO4(конц.) → ZnSO4 + S + H2O
Cu + H2SO4(конц.) → CuSO4 + SO2 + H2O

Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании
данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3.
В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
Fe + H2SO4(конц.) → (t) Fe2(SO4)3 + SO2 + H2O
Cr + H2SO4(конц.) → (t) Cr2(SO4)3 + SO2 + H2O

Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет
об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
1. Положение серы в периодической системе химических элементов
2. Электронное строение атома серы
3. Физические свойства и нахождение в природе
4. Соединения серы
5. Способы получения
6. Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с галогенами
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6.1.5. Взаимодействие с водородом
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с окислителями
6.2.2. Взаимодействие с щелочами
Сероводород
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.2. Взаимодействие с кислородом
3.3. Восстановительные свойства
3.4. Взаимодействие с солями тяжелых металлов
Сульфиды
Способы получения сульфидов
Химические свойства сульфидов
Оксиды серы
1. Оксид серы (IV)
2. Оксид серы (VI)
Серная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация серной кислоты
3.2. Основные свойства серной кислоты
3.3. Взаимодействие с солями более слабых кислот
3.4. Разложение при нагревании
3.5. Взаимодействие с солями
3.6. Качественная реакция на сульфат-ионы
3.7. Окислительные свойства серной кислоты
Сернистая кислота
Соли серной кислоты – сульфаты
Сера
Положение в периодической системе химических элементов
Сера расположена в главной подгруппе VI группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение серы
Электронная конфигурация серы в основном состоянии:
Атом серы содержит на внешнем энергетическом уровне 2 неспаренных электрона и две неподеленные электронные пары в основном энергетическом состоянии. Следовательно, атом серы может образовывать 2 связи по обменному механизму, как и кислород. Однако, в отличие от кислорода, за счет вакантной 3d орбитали атом серы может переходить в возбужденные энергетические состояния. Электронная конфигурация серы в первом возбужденном состоянии:
Электронная конфигурация серы во втором возбужденном состоянии:
Таким образом, максимальная валентность серы в соединениях равна VI (в отличие от кислорода). Также для серы характерна валентность — IV.
Степени окисления атома серы – от -2 до +4. Характерные степени окисления -2, 0, +4, +6.
Физические свойства и нахождение в природе
Сера образует различные простые вещества (аллотропные модификации).
Наиболее устойчивая модификация серы – ромбическая сера S8. Это хрупкое вещество желтого цвета.
Моноклинная сера – это аллотропная модификация серы, в которой атомы соединены в циклы в виде «короны». Это твердое вещество, состоящее из темно-желтых игл, устойчивое при температуре более 96оС, а при обычной температуре превращающееся в ромбическую серу.
Пластическая сера – это вещество, состоящее из длинных полимерных цепей. Коричневая резиноподобная аморфная масса, нерастворимая в воде.
В природе сера встречается:
- в самородном виде;
- в составе сульфидов (сульфид цинка ZnS, пирит FeS2, сульфид ртути HgS — киноварь и др.)
- в составе сульфатов (CaSO4·2H2O гипс, Na2SO4·10H2O — глауберова соль)
Соединения серы
Типичные соединения серы:
| Степень окисления | Типичные соединения |
| +6 | Оксид серы(VI) SO3
Серная кислота H2SO4 Сульфаты MeSO4 Галогенангидриды: SО2Cl2 |
| +4 | Оксид серы (IV) SO2
Сернистая кислота H2SO3 Сульфиты MeSO3 Гидросульфиты MeHSO3 Галогенангидриды: SOCl2 |
| –2 | Сероводород H2S
Сульфиды металлов MeS |
Способы получения серы
1. В промышленных масштабах серу получают открытым способом на месторождениях самородной серы, либо из вулканов. Из серной руды серу получают также пароводяными, фильтрационными, термическими, центрифугальными и экстракционными методами. Пароводяной метод — это выплавление из руды с помощью водяного пара.
2. Способ получения серы в лаборатории – неполное окисление сероводорода.
2H2S + O2 → 2S + 2H2O
3. Еще один способ получения серы – взаимодействие сероводорода с оксидом серы (IV):
2H2S + SO2 → 3S + 2H2O
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1. Сера проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами.
1.1. При горении серы на воздухе образуется оксид серы (IV):
S + O2 → SO2
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2P + 3S → P2S3
2P + 5S → P2S5
2S + C → CS2
1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
Например, железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S + Fe → FeS
S + Hg → HgS
Еще пример: алюминий взаимодействует с серой с образованием сульфида алюминия:
3S + 2Al → Al2S3
1.5. С водородом сера взаимодействует при нагревании с образованием сероводорода:
S + H2 → H2S
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Например, азотная кислота окисляет серу до серной кислоты:
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
Серная кислота также окисляет серу. Но, поскольку S+6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
S + 2H2SO4 → 3SO2 + 2H2O
Соединения хлора, например, бертолетова соль, также окисляют серу до +4:
3S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
S + Na2SO3 → Na2S2O3
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например, сера реагирует с гидроксидом натрия:
S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
При взаимодействии с перегретым паром сера диспропорционирует:
3S + 2H2O (пар) → 2H2S + SO2
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1о.
Способы получения сероводорода
В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
Химические свойства сероводорода
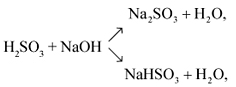
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Сульфиды
Сульфиды – это бинарные соединения серы и металлов или некоторых неметаллов, соли сероводородной кислоты.
По растворимости в воде и кислотах сульфиды разделяют на растворимые в воде, нерастворимые в воде, но растворимые в минеральных кислотах, нерастворимые ни в воде, ни в минеральных кислотах, гидролизуемые водой.
| Растворимые в воде | Нерастворимые в воде, но растворимые в минеральных кислотах | Нерастворимые ни в воде, ни в минеральных кислотах (только в азотной и серной конц.) | Разлагаемые водой, в растворе не существуют |
| Сульфиды щелочных металлов и аммония | Сульфиды прочих металлов, расположенных до железа в ряду активности. Белые и цветные сульфиды (ZnS, MnS, FeS, CdS) | Черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS) | Сульфиды трехвалентных металлов (алюминия и хрома (III)) |
| Реагируют с минеральными кислотами с образованием сероводорода | Не реагируют с минеральными кислотами, сероводород получить напрямую нельзя |
Разлагаются водой |
|
| ZnS + 2HCl → ZnCl2 + H2S |
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S |
Способы получения сульфидов
1. Сульфиды получают при взаимодействии серы с металлами. При этом сера проявляет свойства окислителя.
Например, сера взаимодействует с магнием и кальцием:
S + Mg → MgS
S + Ca → CaS
Сера взаимодействует с натрием:
S + 2Na → Na2S
2. Растворимые сульфиды можно получить при взаимодействии сероводорода и щелочей.
Например, гидроксида калия с сероводородом:
H2S + 2KOH → K2S + 2H2O
3. Нерастворимые сульфиды получают взаимодействием растворимых сульфидов с солями (любые сульфиды) или взаимодействием сероводорода с солями (только черные сульфиды).
Например, при взаимодействии нитрата меди и сероводорода:
Pb(NO3)2 + Н2S → 2НNO3 + PbS
Еще пример: взаимодействие сульфата цинка с сульфидом натрия:
ZnSO4 + Na2S → Na2SO4 + ZnS
Химические свойства сульфидов
1. Растворимые сульфиды гидролизуются по аниону, среда водных растворов сульфидов щелочная:
K2S + H2O ⇄ KHS + KOH
S2– + H2O ⇄ HS– + OH–
2. Сульфиды металлов, расположенных в ряду напряжений левее железа (включительно), растворяются в сильных минеральных кислотах.
Например, сульфид кальция растворяется в соляной кислоте:
CaS + 2HCl → CaCl2 + H2S
А сульфид никеля, например, не растворяется:
NiS + HСl ≠
3. Нерастворимые сульфиды растворяются в концентрированной азотной кислоте или концентрированной серной кислоте. При этом сера окисляется либо до простого вещества, либо до сульфата.
Например, сульфид меди (II) растворяется в горячей концентрированной азотной кислоте:
CuS + 8HNO3 → CuSO4 + 8NO2 + 4H2O
или горячей концентрированной серной кислоте:
CuS + 4H2SO4(конц. гор.) → CuSO4 + 4SO2 + 4H2O
4. Сульфиды проявляют восстановительные свойства и окисляются пероксидом водорода, хлором и другими окислителями.
Например, сульфид свинца (II) окисляется пероксидом водорода до сульфата свинца (II):
PbS + 4H2O2 → PbSO4 + 4H2O
Еще пример: сульфид меди (II) окисляется хлором:
СuS + Cl2 → CuCl2 + S
5. Сульфиды горят (обжиг сульфидов). При этом образуются оксиды металла и серы (IV).
Например, сульфид меди (II) окисляется кислородом до оксида меди (II) и оксида серы (IV):
2CuS + 3O2 → 2CuO + 2SO2
Аналогично сульфид хрома (III) и сульфид цинка:
2Cr2S3 + 9O2 → 2Cr2O3 + 6SO2
2ZnS + 3O2 → 2SO2 + ZnO
6. Реакции сульфидов с растворимыми солями свинца, серебра, меди используют как качественные на ион S2−.
Сульфиды свинца, серебра и меди — черные осадки, нерастворимые в воде и минеральных кислотах:
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Na2S + 2AgNO3 → Ag2S↓ + 2NaNO3
Na2S + Cu(NO3)2 → CuS↓ + 2NaNO3
7. Сульфиды трехвалентных металлов (алюминия и хрома) разлагаются водой (необратимый гидролиз).
Например, сульфид алюминия разлагается до гидроксида алюминия и сероводорода:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
Разложение происходит и взаимодействии солей трехвалентных металлов с сульфидами щелочных металлов.
Например, сульфид натрия реагирует с хлоридом алюминия в растворе. Но сульфид алюминия не образуется, а сразу же необратимо гидролизуется (разлагается) водой:
3Na2S + 2AlCl3 + 6H2O → 2Al(OH)3 + 3H2S + 6NaCl
Оксиды серы
| Оксиды серы | Цвет | Фаза | Характер оксида |
| SO2 Оксид сера (IV), сернистый газ | бесцветный | газ | кислотный |
| SO3 Оксид серы (VI), серный ангидрид | бесцветный | жидкость | кислотный |
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид. Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV):
1. Сжигание серы на воздухе:
S + O2 → SO2
2. Горение сульфидов и сероводорода:
2H2S + 3O2 → 2SO2 + 2H2O
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например, сульфит натрия взаимодействует с серной кислотой:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
4. Обработка концентрированной серной кислотой неактивных металлов.
Например, взаимодействие меди с концентрированной серной кислотой:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Химические свойства оксида серы (IV):
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя.
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов.
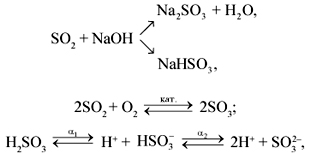
Например, оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2 + 2NaOH(изб) → Na2SO3 + H2O
SO2(изб) + NaOH → NaHSO3
Еще пример: оксид серы (IV) реагирует с основным оксидом натрия:
SO2 + Na2O → Na2SO3
2. При взаимодействии с водой SO2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
SO2 + H2O ↔ H2SO3
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например, оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
2SO2 + O2 ↔ 2SO3
Сернистый ангидрид обесцвечивает бромную воду:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Азотная кислота очень легко окисляет сернистый газ:
SO2 + 2HNO3 → H2SO4 + 2NO2
Озон также окисляет оксид серы (IV):
SO2 + O3 → SO3 + O2
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
5SO2 + 2H2O + 2KMnO4 → 2H2SO4 + 2MnSO4 + K2SO4
Оксид свинца (IV) также окисляет сернистый газ:
SO2 + PbO2 → PbSO4
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например, при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
SO2 + 2Н2S → 3S + 2H2O
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
SO2 + С → S + СO2
Оксид серы (VI)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость. На воздухе «дымит», сильно поглощает влагу.
Способы получения. Оксид серы (VI) получают каталитическим окислением оксида серы (IV) кислородом.
2SO2 + O2 ↔ 2SO3
Сернистый газ окисляют и другие окислители, например, озон или оксид азота (IV):
SO2 + O3 → SO3 + O2
SO2 + NO2 → SO3 + NO
Еще один способ получения оксида серы (VI) – разложение сульфата железа (III):
Fe2(SO4)3 → Fe2O3 + 3SO3
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4
2. Серный ангидрид является типичным кислотным оксидом, взаимодействует с щелочами и основными оксидами.
Например, оксид серы (VI) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
SO3 + 2NaOH(избыток) → Na2SO4 + H2O
SO3(избыток) + NaOH → NaHSO4
Еще пример: оксид серы (VI) взаимодействует с оксидом оксидом (при сплавлении):
SO3 + MgO → MgSO4
3. Серный ангидрид – очень сильный окислитель, так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как иодид калия, сероводород или фосфор:
SO3 + 2KI → I2 + K2SO3
3SO3 + H2S → 4SO2 + H2O
5SO3 + 2P → P2O5 + 5SO2
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO3 в H2SO4.
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества теплоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравненяи реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q
Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q
В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне.
Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. nSO3 + H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота.
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
H2SO4 ⇄ H+ + HSO4–
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4– ⇄ H+ + SO42–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, серная кислота взаимодействует с оксидом магния:
H2SO4 + MgO → MgSO4 + H2O
Еще пример: при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например, серная кислота взаимодействует с гидрокарбонатом натрия:
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
Или с силикатом натрия:
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
NaNO3 (тв.) + H2SO4 → NaHSO4 + HNO3
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например, хлорида натрия:
NaCl(тв.) + H2SO4 → NaHSO4 + HCl
4. Также серная кислота вступает в обменные реакции с солями.
Например, серная кислота взаимодействует с хлоридом бария:
H2SO4 + BaCl2 → BaSO4 + 2HCl
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется сульфат железа (II):
H2SO4(разб.) + Fe → FeSO4 + H2
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
H2SO4 + NH3 → NH4HSO4
Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
6H2SO4(конц.) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2Al → Al2(SO4)3 + 3SO2 + 6H2O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например, концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц.) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O
Сернистая кислота
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.
Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
H2SO3 ↔ HSO3– + H+
HSO3– ↔ SO32– + H+
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
H2SO3 ↔ SO2 + H2O
Соли серной кислоты – сульфаты
Серная кислота образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
1. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
2. Сульфаты таких металлов, как медь Cu, алюминий Al, цинк Zn, хром Cr, железо (II) Fe подвергаются термическому разложению на оксид металла, диоксид серы SO2 и кислород O2;
2CuSO4 → 2CuO + SO2 + O2 (SO3)
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2ZnSO4 → 2ZnO + SO2 + O2
2Cr2(SO4)3 → 2Cr2O3 + 6SO2 + 3O2
При разложении сульфата железа (II) в FeSO4 Fe (II) окисляется до Fe (III)
4FeSO4 → 2Fe2O3 + 4SO2 + O2
Сульфаты самых тяжелых металлов разлагаются до металла.
3. За счет серы со степенью окисления +6 сульфаты проявляют окислительные свойства и могут взаимодействовать с восстановителями.
Например, сульфат кальция при сплавлении реагирует с углеродом с образованием сульфида кальция и угарного газа:
CaSO4 + 4C → CaS + 4CO
4. Многие средние сульфаты образуют устойчивые кристаллогидраты:
Na2SO4 ∙ 10H2O − глауберова соль
CaSO4 ∙ 2H2O − гипс
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Пособие-репетитор по химии
Продолжение. Cм. в № 22/2005;
1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19, 21/2008;
1, 3, 10/2009
ЗАНЯТИЕ 30
10-й класс (первый год обучения)
Сера и ее соединения
П л а н

таблице Д.И.Менделеева, строение атома.
2. Происхождение названия.
3. Физические свойства.
4. Химические свойства.
5. Нахождение в природе.
6. Основные методы получения.
7. Важнейшие соединения серы (сероводород,
сероводородная кислота и ее соли; сернистый газ,
сернистая кислота и ее соли; триоксид серы,
серная кислота и ее соли).
В периодической системе сера находится в
главной подгруппе VI группы (подгруппа
халькогенов). Электронная формула серы 1s22s2p63s2p4,
это р-элемент. В зависимости от состояния
сера может проявлять валентность II, IV или VI:
S: 1s22s22p63s23p43d0
(валентность II),
S*: 1s22s22p63s23p33d1
(валентность IV),
S**: 1s22s22p63s13p33d2
(валентность VI).
Характерные степени окисления серы –2, +2, +4, +6
(в дисульфидах, содержащих мостиковую
связь –S–S– (например, FeS2), степень
окисления серы равна –1); в соединениях входит
в состав анионов, с более электроотрицательными
элементами – в состав катионов, например:
Сера – элемент с высокой
электроотрицательностью, проявляет
неметаллические (кислотные) свойства. Имеет
четыре стабильных изотопа с массовыми числами 32,
33, 34 и 36. Природная сера на 95 % состоит из
изотопа 32S.
Русское название серы произошло от
санскритского слова cira – светло-желтый, по
цвету природной серы. Латинское название sulfur
переводится как «горючий порошок».1
Ф и з и ч е с к и е с в о й с т в а
Сера образует три аллотропные модификации: ромбическая
(-сера), моноклинная
(-сера) и пластическая,
или каучукоподобная. Наиболее устойчива при
обычных условиях ромбическая сера, а выше
95,5 °С стабильна моноклинная сера. Обе эти
аллотропные модификации имеют молекулярную
кристаллическую решетку, построенную из молекул
состава S8, расположенных в пространстве в
виде короны; атомы соединены одинарными
ковалентными связями. Различие ромбической и
моноклинной серы состоит в том, что в
кристаллической решетке молекулы упакованы
по-разному.
Если ромбическую или моноклинную серу нагреть
до точки кипения (444,6 °С) и полученную жидкость
вылить в холодную воду, то образуется
пластическая сера, по свойствам напоминающая
резину. Пластическая сера состоит из длинных
зигзагообразных цепей. Эта аллотропная
модификация неустойчива и самопроизвольно
превращается в одну из кристаллических форм.
Ромбическая сера – твердое кристаллическое
вещество желтого цвета; в воде не растворяется (и
не смачивается), но хорошо растворяется во многих
органических растворителях (сероуглерод, бензол
и т.д.). Сера обладает очень плохой электро- и
теплопроводностью. Температура плавления
ромбической серы +112,8 °С, при температуре
95,5 °С ромбическая сера переходит в
моноклинную:
Х и м и ч е с к и е с в о й с т в а
По своим химическим свойствам сера является
типичным активным неметаллом. В реакциях может
быть как окислителем, так и восстановителем.
Н2 (+):
О2 (+):
S + O2 SO2.
Металлы (+):
2Na + S = Na2S,
2Al + 3S Al2S3,
Fe + S FeS,
Hg + S = HgS.
Неметаллы (+/–)*:
С + 2S CS2,
2P + 3S P2S3,
S + Cl2 = SCl2,
S + 3F2 = SF6,
S + N2
реакция не идет.
Н2О (–). сера не смачивается водой.
Основные оксиды (–).
Кислотные оксиды (–).
Основания (+/–):
S + Cu(OH)2
реакция не идет.
Кислоты (не окислители) (–).
Кислоты-окислители (+):
S + 2H2SO4 (конц.) = 3SO2 + 2H2O,
S + 2HNO3 (разб.) = H2SO4 + 2NO,
S + 6HNO3 (конц.) = H2SO4 + 6NO2 + 2H2O.
Соли (–).
В п р и р о д е сера встречается как в самородном
состоянии, так и в виде соединений, важнейшими из
которых являются пирит, он же железный, или
серный, колчедан (FeS2), цинковая обманка (ZnS),
свинцовый блеск (PbS), гипс (CaSO4•2H2O),
глауберова соль (Na2SO4•10H2O),
горькая соль (MgSO4•7H2O). Кроме того,
сера входит в состав каменного угля, нефти, а
также в различные живые организмы (в составе
аминокислот). В организме человека сера
концентрируется в волосах.
Серу, содержащуюся в свободном состоянии в
горных породах, выплавляют из них в автоклавах с
помощью водяного пара.
В л а б о р а т о р н ы х у с л о в и я х серу
можно получить, используя
окислительно-восстановительные реакции (ОВР),
например:
H2SO3 + 2H2S = 3S + 3H2O,
2H2S + O2 2S + 2H2O.
В а ж н е й ш и е с о е д и н е н и я с
е р ы
Сероводород (H2S) – бесцветный
газ с удушающим неприятным запахом тухлых яиц,
ядовит (соединяется с гемоглобином крови,
образуя сульфид железа). Тяжелее воздуха,
малорастворим в воде (2,5 объема сероводорода в 1
объеме воды). Связи в молекуле ковалентные
полярные, sp3-гибридизация, молекула
имеет угловое строение:
В химическом отношении сероводород достаточно
активен. Он термически неустойчив; легко сгорает
в атмосфере кислорода или на воздухе; легко
окисляется галогенами, диоксидом серы или
хлоридом железа(III); при нагревании
взаимодействует с некоторыми металлами и их
оксидами, образуя сульфиды:
2H2S + O2 2S
+ 2H2O,
2H2S + 3O2 2SO2
+ 2H2O,
H2S + Br2 = 2HBr + S,
2H2S + SO2 3S
+ 2H2O,
2FeCl3 + H2S = 2FeCl2 + S + 2HCl,
H2S + Zn ZnS + H2
,
H2S + CaO CaS + H2O.
В лабораторных условиях сероводород получают
действием на сульфиды железа или цинка сильных
минеральных кислот или необратимым гидролизом
сульфида алюминия:
ZnS + 2HCl = ZnCl2 + H2S,
Аl2SO3 + 6HOH 2Al(OH)3
+
3H2S.
Раствор сероводорода в воде – сероводородная
вода, или сероводородная кислота.
Слабый электролит, по второй ступени практически
не диссоциирует. Как двухосновная кислота
образует два типа солей – сульфиды и
гидросульфиды:
например, Na2S – сульфид натрия, NaHS –
гидросульфид натрия.
Сероводородная кислота проявляет все общие
свойства кислот. Кроме того, сероводород,
сероводородная кислота и ее соли проявляют
сильную восстановительную способность.
Например:
H2S + Zn = ZnS + H2,
H2S + CuO = CuS +
H2O,
Качественной реакцией на сульфид-ион
является взаимодействие с растворимыми солями
свинца; при этом выпадает осадок сульфида свинца
черного цвета:
Pb2+ + S2– —> PbS,
Pb(NO3)2 + Na2S = PbS + 2NaNO3.
Оксид серы(IV) SO2 – сернистый
газ, сернистый ангидрид – бесцветный газ
с резким запахом, ядовит. Кислотный оксид. Связи в
молекуле ковалентные полярные, sp2-гибридизация.
Тяжелее воздуха, хорошо растворим в воде (в одном
объеме воды – до 80 объемов SO2), образует
при растворении сернистую кислоту,
существующую только в растворе:
H2O + SO2 H2SO3.
По кислотно-основным свойствам сернистый газ
проявляет свойства типичного кислотного оксида,
сернистая кислота также проявляет все типичные
свойства кислот:
SO2 + CaO CaSO3,
H2SO3 + Zn = ZnSO3 + H2,
H2SO3 + CaO = CaSO3 + H2O.
По окислительно-восстановительным свойствам
сернистый газ, сернистая кислота и сульфиты
могут проявлять окислительно-восстановительную
двойственность (с преобладанием
восстановительных свойств). С более сильными
восстановителями соединения серы(IV) ведут себя
как окислители:
С более сильными окислителями они проявляют
восстановительные свойства:
В промышленности диоксид серы получают:
• при горении серы:
S + O2 SO2;
• обжигом пирита и других сульфидов:
4FeS2 + 11O2 2Fe2O3 + 8SO2
,
2ZnS + 3O2 2ZnO +
2SO2.
К лабораторным методам получения
относятся:
• действие сильных кислот на сульфиты:
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O;
• взаимодействие концентрированной серной
кислоты с тяжелыми металлами:
Cu + 2H2SO4 (конц.) = СuSO4 + SO2 + 2H2O.
Качественные реакции на сульфит-ион –
обесцвечивание «йодной воды» или действие
сильных минеральных кислот:
Na2SO3 + I2 + 2NaOH = 2NaI + Na2SO4
+ H2O,
Ca2SO3 + 2HCl = CaCl2 + H2O
+ SO2.
Оксид серы(VI) SO3 – триоксид
серы, или серный ангидрид, – это
бесцветная жидкость, которая при температуре
ниже 17 °С превращается в белую
кристаллическую массу. Ядовит. Существует в виде
полимеров (мономерные молекулы существуют
только в газовой фазе), связи в молекуле
ковалентные полярные, sp2-гибридизация.
Гигроскопичен, термически неустойчив. С водой
реагирует с сильным экзо-эффектом. Реагирует с
безводной серной кислотой, образуя олеум.
Образуется при окислении сернистого газа:
SO3 + H2O = H2SO4 + Q,
nSO3 + H2SO4 (конц.) = H2SO4•nSO3.
По кислотно-основным свойствам является
типичным кислотным оксидом:
SO3 + H2O = H2SO4,
SO3 + CaO = CaSO4,
По окислительно-восстановительным свойствам
выступает сильным окислителем, обычно
восстанавливаясь до SO2 или сульфитов:
В чистом виде практического значения не имеет,
является промежуточным продуктом при
производстве серной кислоты.
Серная кислота – тяжелая
маслянистая жидкость без цвета и запаха. Хорошо
растворима в воде (с большим экзо-эффектом).
Гигроскопична, ядовита, вызывает сильные ожоги
кожи. Является сильным электролитом. Серная
кислота образует два типа солей: сульфаты и гидросульфаты,
которые проявляют все общие свойства солей.
Сульфаты активных металлов термически
устойчивы, а сульфаты других металлов
разлагаются даже при небольшом нагревании:
Na2SO4
не разлагается,
ZnSO4 ZnO + SO3,
4FeSO4 2Fe2O3
+ 4SO2 + O2
,
Ag2SO4
2Ag + SO2
+ O2
,
HgSO4 Hg + SO2
+ O2
.
Раствор с массовой долей серной кислоты ниже
70 % обычно считается разбавленным; выше
70 % – концентрированным; раствор SO3 в
безводной серной кислоте называется олеум
(концентрация триоксида серы в олеуме может
достигать 65 %).
Разбавленная серная кислота проявляет все
свойства, характерные для сильных кислот:
Н2SO4 2H+ + SO42–,
Н2SO4 + Zn = ZnSO4 + Н2,
Н2SO4 (разб.) + Cu реакция не идет,
Н2SO4 + CaO = CaSO4 + H2O,
CaCO3 + Н2SO4 = CaSO4 + H2O
+ CO2.
Концентрированная серная кислота является
сильным окислителем, особенно при нагревании.
Она окисляет многие металлы, неметаллы, а также
некоторые органические вещества. Не окисляются
под действием концентрированной серной кислоты
железо, золото и металлы платиновой группы
(правда, железо хорошо растворяется при
нагревании в умеренно концентрированной серной
кислоте с массовой долей 70 %). При
взаимодействии концентрированной серной
кислоты с другими металлами образуются сульфаты
и продукты восстановления серной кислоты.
2Н2SO4 (конц.) + Cu = CuSO4 + SO2 + 2H2O,
5Н2SO4 (конц.) + 8Na = 4Na2SO4
+ H2S + 4H2O,
Н2SO4 (конц.) пассивирует Fe, Al.
При взаимодействии с неметаллами
концентрированная серная кислота
восстанавливается до SO2:
5Н2SO4 (конц.) + 2Р = 2H3PO4
+ 5SO2 + 2H2O,
2Н2SO4 (конц.) + C = 2H2O + CO2 + 2SO2
.
Контактный метод получения серной кислоты
состоит из трех стадий:
1) обжиг пирита:
4FeS2 + 11O2 2Fe2O3 + 8SO2
;
2) окисление SO2 в SO3 в присутствии
катализатора – оксида ванадия:
3) растворение SO3 в серной кислоте с
получением олеума:
SO3 + H2O = H2SO4 + Q,
nSO3 + H2SO4 (конц.) = H2SO4•nSO3.
Качественная реакция на сульфат-ион –
взаимодействие с катионом бария, в результате
чего выпадает белый осадок BaSO4.
Ba2+ + SO42– —> BaSO4,
BaCl2 + Na2SO4 = BaSO4 + 2NaCl.
Тест по теме «Сера и ее соединения»

и кислород – это:
а) хорошие проводники электричества;
б) относятся к подгруппе халькогенов;
в) хорошо растворимы в воде;
г) имеют аллотропные модификации.
2. В результате реакции серной кислоты с
медью можно получить:
а) водород; б) серу;
в) сернистый газ; г) сероводород.
3. Сероводород – это:
а) ядовитый газ;
б) сильный окислитель;
в) типичный восстановитель;
г) один из аллотропов серы.
4. Массовая доля (в %) кислорода в серном
ангидриде равна:
а) 50; б) 60; в) 40; г) 94.
5. Оксид серы(IV) является ангидридом:
а) серной кислоты;
б) сернистой кислоты;
в) сероводородной кислоты;
г) тиосерной кислоты.
6. На сколько процентов уменьшится масса
гидросульфита калия после прокаливания?
а) на 22,6;
б) на 41,1;
в) гидросульфит калия термически устойчив;
г) на 34,2.
7. Сместить равновесие в сторону прямой
реакции окисления сернистого газа в серный
ангидрид можно:
а) используя катализатор;
б) увеличивая давление;
в) уменьшая давление;
г) понижая концентрацию оксида серы(VI).
8. При приготовлении раствора серной
кислоты необходимо:
а) наливать кислоту в воду;
б) наливать воду в кислоту;
в) порядок приливания не имеет значения;
г) серная кислота не растворяется в воде.
9. Какую массу (в г) декагидрата сульфата
натрия необходимо добавить к 100 мл 8%-го раствора
сульфата натрия (плотность равна 1,07 г/мл), чтобы
удвоить массовую долю соли в растворе?
а) 100; б) 1,07; в) 30,5; г) 22,4.
10. Для определения сульфит-иона в
качественном анализе можно использовать:
а) катионы свинца;
б) «йодную воду»;
в) раствор марганцовки;
г) сильные минеральные кислоты.
Ключ к тесту
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| б, г | в | а, в | б | б | г | б, г | а | в | б, г |
Задачи и упражнения на серу и ее
соединения
Ц е п о ч к и п р е в р а щ е н и й

Сера —> сульфид железа(II) —> сероводород —>
сернистый газ —> триоксид серы > серная
кислота > оксид серы(IV).
2.
3. Серная кислота —> сернистый газ —>
сера —> диоксид серы —> триоксид серы —>
серная кислота.
4. Сернистый ангидрид —> сульфит натрия
—> гидросульфит натрия —> сульфит натрия —>
сульфат натрия.
5. Пирит —> сернистый газ —> серный
ангидрид —> серная кислота —> оксид серы(IV)
—> сульфит калия —> сернистый ангидрид.
6. Пирит > сернистый газ —> сульфит натрия
—> сульфат натрия —> сульфат бария —>
сульфид бария.
7. Сульфид натрия —> А —> В —> С —> D
—> сульфат бария (все вещества содержат серу;
первая, вторая и четвертая реакции – ОВР).
1. Через раствор, содержащий 5 г
едкого натра, пропустили 6,5 л сероводорода.
Определите состав полученного раствора.
Ответ. 7 г NaHS, 5,61 г H2S.
2. Какую массу глауберовой соли необходимо
добавить к 100 мл 8%-го раствора сульфата натрия
(плотность раствора равна 1,07 г/мл), чтобы удвоить
массовую долю вещества в растворе?
Ответ. 30,5 г Na2SO4•10H2O.
3. К 40 г 12%-го раствора серной кислоты
добавили 4 г серного ангидрида. Вычислите
массовую долю вещества в образовавшемся
растворе.
Ответ. 22 % H2SO4.
4. Смесь сульфида железа(II) и пирита, массой
20,8 г, подвергли длительному обжигу, при этом
образовалось 6,72 л газообразного продукта (н.у.).
Определите массу твердого остатка,
образовавшегося при обжиге.
Ответ. 16 г Fe2O3.
5. Имеется смесь меди, углерода и оксида
железа(III) с молярным соотношением компонентов
4:2:1 (в порядке перечисления). Какой объем 96%-й
серной кислоты (плотность равна 1,84 г/мл) нужен для
полного растворения при нагревании 2,2 г такой
смеси?
Ответ. 4,16 мл раствора H2SO4.
6. Для окисления 3,12 г гидросульфита
щелочного металла потребовалось добавить 50 мл
раствора, в котором молярные концентрации
дихромата натрия и серной кислоты равны 0,2 моль/л
и 0,5 моль/л соответственно. Установите состав и
массу остатка, который получится при выпаривании
раствора после реакции.
Ответ. 7,47 г смеси сульфатов хрома (3,92
г) и натрия (3,55 г).
(задачи на олеум)
1. Какую массу триоксида серы надо
растворить в 100 г 91%-го раствора серной кислоты,
чтобы получить 30%-й олеум?
Решение
По условию задачи:
m(H2SO4) = 100•0,91 = 91 г,
m(H2O) = 100•0,09 = 9 г,
(H2O)
= 9/18 = 0,5 моль.
Часть добавленного SO3 (m1) пойдет
на реакцию с H2O:
H2O + SO3 = H2SO4.
По уравнению реакции:
(SO3)
= (H2O) = 0,5
моль.
Тогда:
m1(SO3) = 0,5•80 = 40 г.
Вторая часть SO3 (m2) пойдет на
создание концентрации олеума. Выразим массовую
долю олеума:
m2(SO3) = 60 г.
Суммарная масса триоксида серы:
m(SO3) = m1(SO3) + m2(SO3)
= 40 + 60 = 100 г.
Ответ. 100 г SO3.
2. Какую массу пирита необходимо взять для
получения такого количества оксида серы(VI),
чтобы, растворив его в 54,95 мл 91%-го раствора серной
кислоты (плотность равна 1,82 г/см3), получить
12,5%-й олеум? Выход серного ангидрида считать за
75 %.
Ответ. 60 г FeS2.
3. На нейтрализацию 34,5 г олеума расходуется
74,5 мл 40%-го раствора гидроксида калия (плотность
равна 1,41 г/мл). Сколько молей серного ангидрида
приходится на 1 моль серной кислоты в этом олеуме?
Ответ. 0,5 моль SO3.
4. При добавлении оксида серы(VI) к 300 г 82%-го
раствора серной кислоты получен олеум с массовой
долей триоксида серы 10%. Найдите массу
использованного серного ангидрида.
Ответ. 300 г SO3.
5. При добавлении 400 г триоксида серы к 720 г
водного раствора серной кислоты получен олеум с
массовой долей 7,14 %. Найдите массовую долю
серной кислоты в исходном растворе.
Ответ. 90 % H2SO4.
6. Найдите массу 64%-го раствора серной
кислоты, если при добавлении к этому раствору
100 г триоксида серы получается олеум,
содержащий 20 % триоксида серы.
Ответ. 44,4 г раствора H2SO4.
7. Какие массы триоксида серы и 91%-го
раствора серной кислоты необходимо смешать для
получения 1 кг 20%-го олеума?
Ответ. 428,6 г SO3 и 571,4 г раствора H2SO4.
8. К 400 г олеума, содержащего 20 % триоксида
серы, добавили 100 г 91%-го раствора серной кислоты.
Найдите массовую долю серной кислоты в
полученном растворе.
Ответ. 92 % H2SO4 в олеуме.
9. Найдите массовую долю серной кислоты в
растворе, полученном при смешивании 200 г 20%-го
олеума и 200 г 10%-го раствора серной кислоты.
Ответ. 57,25 % H2SO4.
10. Какую массу 50%-го раствора серной кислоты
необходимо добавить к 400 г 10%-го олеума для
получения 80%-го раствора серной кислоты?
Ответ. 296,67 г 50%-го раствора H2SO4.
11. К 10%-му олеуму добавили 200 г 20%-го раствора
серной кислоты и получили 50%-й раствор серной
кислоты. Найдите массу использованного олеума.
Ответ. 114,83 г олеума.
К а ч е с т в е н н ы е з а д а ч и
1. Бесцветный газ А с резким характерным
запахом окисляется кислородом в присутствии
катализатора в соединение В, представляющее
собой летучую жидкость. Вещество В, соединяясь с
негашеной известью, образует соль С.
Идентифицируйте вещества, напишите уравнения
реакций.
Ответ. Вещества: А – SO2,
B – SO3, C – CaSO4.
2. При нагревании раствора соли А образуется
осадок В. Этот же осадок образуется при действии
щелочи на раствор соли А. При действии кислоты на
соль А выделяется газ С, обесцвечивающий раствор
перманганата калия. Идентифицируйте вещества,
напишите уравнения реакций.
Ответ. Вещества: А – Ca(HSO3)2,
B – CaSO3, C – SO2.
3. При окислении газа А концентрированной
серной кислотой образуется простое вещество В,
сложное вещество С и вода. Растворы веществ
А и С реагируют между собой с образованием
осадка вещества В. Идентифицируйте вещества,
напишите уравнения реакций.
Ответ. Вещества: А – H2S,
B – S, C – SO2.
4. В реакции соединения двух жидких при
обычной температуре оксидов А и В образуется
вещество С, концентрированный раствор которого
обугливает сахарозу. Идентифицируйте вещества,
напишите уравнения реакций.
Ответ. Вещества: А – SO3,
B – H2O, C – H2SO4.
5. В вашем распоряжении имеются сульфид
железа(II), сульфид алюминия и водные растворы
гидроксида бария и хлороводорода. Получите из
этих веществ семь различных солей (без
использования ОВР).
Ответ. Соли: AlCl3, BaS, FeCl2,
BaCl2, Ba(OH)Cl, Al(OH)Cl2, Al(OH)2Cl.
6. При действии концентрированной серной
кислоты на бромиды выделяется сернистый газ, а на
йодиды – сероводород. Напишите уравнения
реакций. Объясните разницу в характере продуктов
в этих случаях.
Ответ. Уравнения реакций:
2H2SO4 (конц.) + 2NaBr = SO2 + Br2
+ Na2SO4 + 2H2O,
5H2SO4 (конц.) + 8NaI = H2S + 4I2 + 4Na2SO4 +
4H2O.
1 См.: Лидин
Р.А. «Справочник по общей и неорганической
химии». М.: Просвещение, 1997.
* Знак +/– означает,
что данная реакция протекает не со всеми
реагентами или в специфических условиях.
Продолжение следует