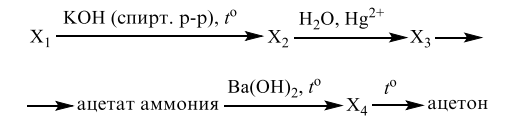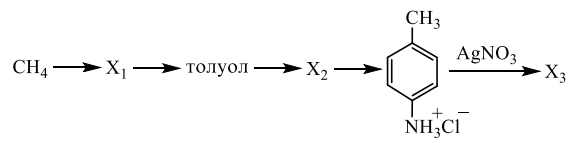Пройти тестирование по 10 заданиям
Пройти тестирование по всем заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
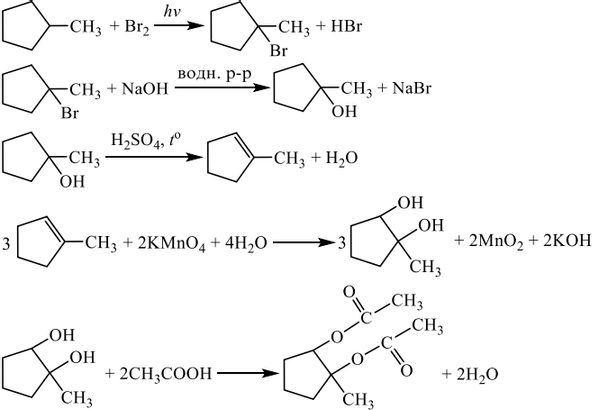
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) метилбензол
Б) анилин
В) 3-метилбутаналь
КЛАСС/ГРУППА
1) альдегиды
2) амины
3) аминокислоты
4) углеводороды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2017 по химии, Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ−2019 по химии
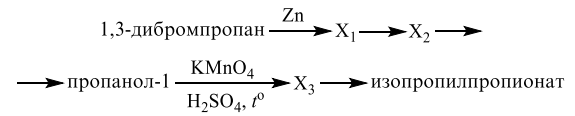
2
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутен-1
Б) циклопропан
В) бутадиен-1,3
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
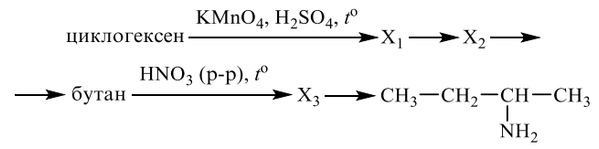
3
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутин
Б) циклогексен
В) бутадиен-1,2
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
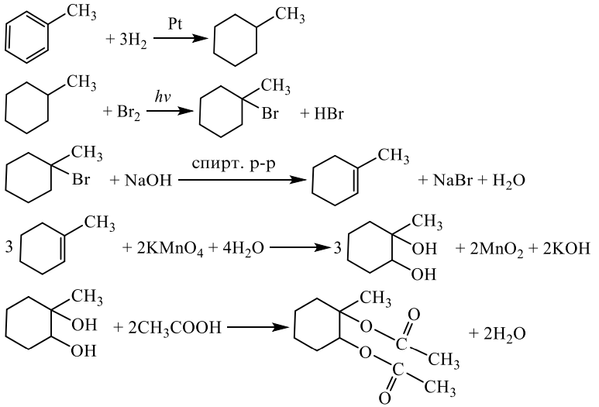
4
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутан
Б) бутин-1
В) циклогексан
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
5
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутадиен-1,3
Б) 2-метилпропанол-1
В) этилформиат
КЛАСС (ГРУППА) ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) простые эфиры
2) сложные эфиры
3) спирты
4) углеводороды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Пройти тестирование по этим заданиям
1 лист.
Реакции к основным темам курса 10 класса (для запоминания), проф. класс.
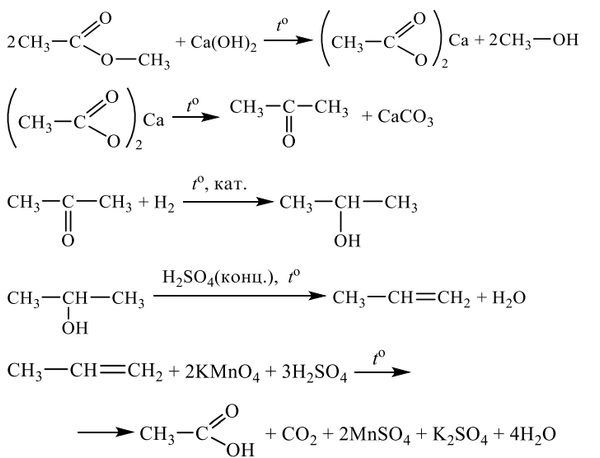
1. Алканы (предельные, насыщенные). Общая формула – СпН2п+2.
М (СпН2п+2)=(14п+2)г/моль, σ-связи, SP3-гибридизация, <109’28», тетраэдр.
1. р.галогенирования (р. замещения по радикальному механизму) проходит на свету: R-Н + Вr2 →R-Вr + НВr (галогены только в газообразном состоянии);
2. р. нитрования – р. Коновалова (р. замещения, радик. мех-зм):
R-Н + НО – NО2(разб) −→ R-NО2 + Н2О │
внимание: замещение атомов водорода у третичного атома (—с—) проходит легче, чем у вторичного атома(—с—) и тем более первичного атома (с—).
3. р. изомеризации (у С4Н10 и следующих) в присутствии катализатора – AlCl3:
СН3-СН2-СН2-СН3 —→ СН3-СН (СН3)-CН3
4.крекинг (разрыв связей между атомами углеродов, радик. мех-зм) под действием температуры и катализатора:
С8Н18→С4Н10+С4Н8
5. р. элиминирования – образование веществ с кратными связями за счет отрыва атомов или групп атомов: 2СН4→С2Н4↑+2Н2↑ при t=5000С-10000С
2СН4→С2Н2↑+3Н2↑ при t=10000С-15000С
2СН4→2С+4Н2↑ при t>15000С (пиролиз)
6. р. ароматизации – получение ароматических углеводородов за счёт отрыва атомов водородов в присутствии катализаторов: С6Н12 → С6Н6 + 3Н2↑
7. р. горения — ( + О2) СпН2п+2 + (3п+1)/2О2 → пСО2↑ + (п+1) Н2О + Q (экзотерм.)
. р. окисления метана ( +[О]) даёт продукты, в зависимости от условий:
СН4 из воздуха→ СН3ОН
→НСНО
→НСООН
8. р. Вюрца («удвоение») 2СН3Cl + 2Na → 2NaCl + C2H6, в кислой среде.
9. получение алканов: а) С+2Н2 → СН4↑ под действием эл. разряда;
б) СН3-СООNa + NaOH → CH4↑ + Na2CO3 при спекании сухих веществ
в) Al4C3 + 12НОН → 3СН4↑ + 4Al(ОН)3↓; г) Al4C3 + 12НСl→ 3СН4↑ + 4AlСl3.
2. Циклоалканы (предельные). Общая формула – СпН2п.
М (СпН2п)= 14п г/моль, σ-связи, SP3-гибридизация, <от 60′ до 109′, цикл.
1. р. присоединения (+Н2, +Вr2,+НI) у циклов с 3,4 5 атомами углерода
C3H6 + Br2 = Br-CH2-CH2-CH2Br;
2. р. замещения – аналогично алканам (циклы с 6 и > атомами углерода);
3. р. элиминирования (дегидрирования) С6Н12 → С6Н6 + 3Н2↑(катализ: Ni, t)
4. р. окисления – на примере циклогексана сильным окислителем:
С6Н12 + 4[О] → СН2-СН2-СООН
│
СН2-СН2-СООН (адипиновая кислота)
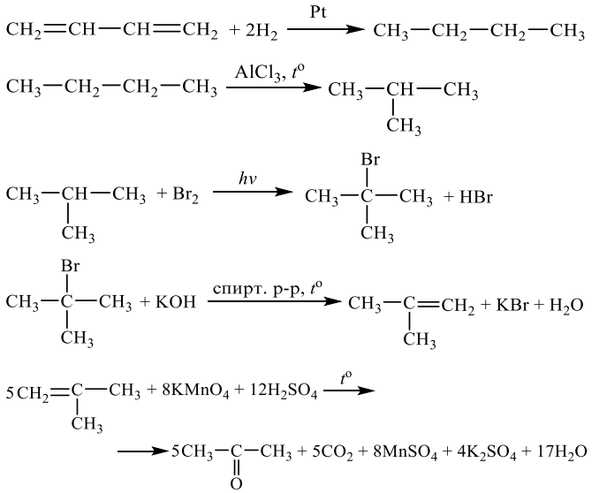
3. Алкены (непредельные). Общая формула – СпН2п.
М (СпН2п)= 14п г/моль, σ- и π-связи, SP2-гибридизация, < 120′, треугольник.
1.р. присоединение Н2, НГ, Г2 и Н2О (разрыв С=С связи, электрофильный мех-зм)
а) гидрогалогенирование:СН2=СН2 + НBr → СН3-СН2Br
в случае несимметричной π-связи по правилу Марковникова (Н к СН2):
2 лист
СН3-СН=СН2 + НBr → СН3-СНBr-СН3; продолжение см. дальше.
б) гидратация:СН3-С=СН2 + НОН → СН3-С(ОН)-СН3 (в присутствии минерал кислот)
│ │
СН3 СН3
в) галогенирование (обесцвечивание раствора бромной воды – Br2) – качественная реакция на кратную связь, как и реакция с раствором КМпО4:
СН2 = СН2 + Br2 → BrСН2-СН2Br
г)гидрирование: СН3-СН=СН2 + Н2 → СН3-СН2-СН3 (катализатор – Ni, t)
2.р. замещения (радикальный мех-зм) – замещение атома Н на соседнем с двойной связью атоме углерода, при t=5000С: СН3-СН=СН2 + Cl2 → ClСН2-СН=СН3 + НCl
3.р. окисления:а) мягкое – холодным раствором КМпО4(р. Вагнера)
СН2 = СН2 + [О] + Н2О → СН2ОН-СН2ОН (упрощенная запись)
или 3СН2 = СН2 + 2КМпО4 + 4Н2О → 3СН2ОН-СН2ОН + 2МпО2↓ + 2КОН
б)жесткое – кипящим раствором КМпО4 в кислой среде
СН3-СН=СН-СН3 + 4[О] → 2 СН3-СООН
4.р. полимеризации: пСН2=СН2 → ( — СН2-СН2 — ) в кислой среде.
5.получение алкенов: а) С7Н16 —→ C4Н10 + CН3-CН=CН2 (t,Kat);
б) СН3-СН2-СНBr-СН3 + КОН (спирт)→СН3-СН=СН-СН3 + КBr + Н2О
в) СН3-СН-СН3 → СН3-СН=СН2 + Н2О (t=1500С, в кислой среде) по правилу Зайцева
│
ОН
г) СН2Br- СНBr-СН3 + 2К → СН2=СН-СН3 + 2КBr – синтез Вюрца—Крафтса
д) СН3-СН2-СН3 → СН3-СН=СН2 + Н2↑ в присутствии Kat – Cr2O3
4. Алкадиены (непредельные). Общая формула – СпН2п-2.
М (СпН2п-2)= (14п-2) г/моль, σ- и 2π-связи, SP2-гибридизация.
1. р. присоединения: →СН2Br-СНBr-СН=СН2 (присоединение по 1,2)
СН2=СН-СН=СН2 + Br2 →[
→ СН2Br-СН=СН=СН2Br (присоединение по 1,4)
2. р. полимеризации: пСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-) в кислоте
3. диеновый синтез – р. Дильса-Альдера- р.циклизации
СН2-СН=СН-СН2 + СН2=СН2 → С6Н10 при нагревании, под давлением.
4. получение алкадиенов:
а) СН3-СН2-СН2-СН3 → СН2=СН-СН=СН2 + 2Н2↑ при t, Kat – Cr2O3;
б) 2С2Н5ОН → СН2=СН-СН=СН2 + Н2↑ + 2Н2О при t, Kat – Al2O3, ZnO р. Лебедева.
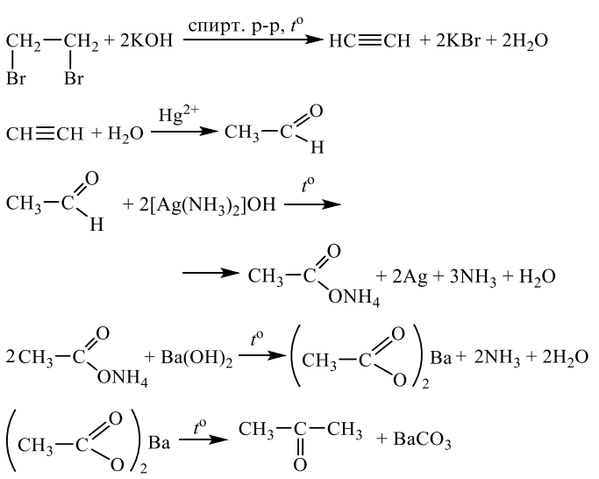
5. Алкины (непредельные). Общая формула – СпН2п-2.
М (СпН2п-2)= (14п-2) г/моль, σ- и 2π-связи, SP-гибридизация, линейное строение
обладают слабыми кислотными свойствами
1.р. электрофильного присоединения (медленнее, чем у алкенов) — Br2, Н2 и НСl
СН≡СН + Br2 → СНBr=СНBr, далее СНBr=СНBr+ Br2 → СНBr2-СНBr2
2.р. гидратации – р. Кучерова, в кислой среде, Kat – Hg2+
любой алкин образует кетон СН3-С≡СН + НОН →СН3-С (СН3)=О,
только ацетилен СН≡СН + НОН →СН3-СНО — альдегид
3. р. окисления раствором КМпО4: R-C≡C-R’ + 3[О] + HOH → R-COOH + R’-COOH
4.р. гидрирования СН3-С≡СН + Н2 → СН3-СН=СН2, далее СН3-СН=СН2 +Н2 →С3Н8
3 лист
при нагревании, в присутствии катализатора – Pt, Pd
продолжение см дальше
5.слабые кислотные свойства у алкинов с «концевой» кратной связью:
2СН≡СН + 2Na → 2NaC≡CNa + H2, с аммиачным раствором оксида серебра
СН≡СН + [Ag(NH3)2]OH → AgC≡CAg + 4NH3 + 2H2O
6. р. полимеризации: СН≡СН + СН≡СН → СН2=СН-СН=СН2, катализатор –NH4CL
или р. Зелинского 3СН≡СН → С6Н6, условия – активир-ый уголь (Сакт, t=6000С)
7. а): СаС2 + 2НОН → С2Н2↑ + Са(ОН)2↓; б) СаС2 + 2НCL → С2Н2↑ + СаCL2;
в) 2СН4 → С2Н2↑ + 3H2 при t=15000С
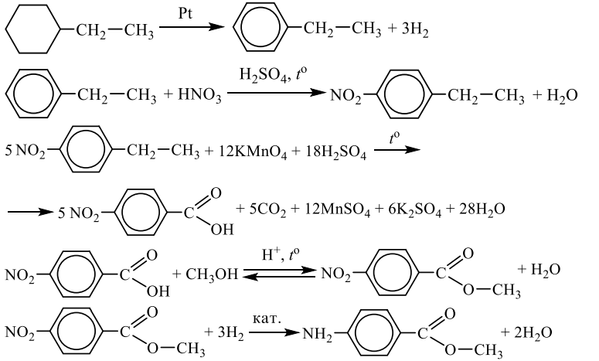
6. Арены (непредельные, циклические, ароматические).
Общая формула – СпН2п-6, М (СпН2п-6)= (14п-6) г/моль,
локализованное π-облако, SP2-гибридизация, циклическое строение
1. Р. электрофильного замещения:
а) галогенирование: С6Н6 + CL2 → С6Н5CL + НCL , катализатор – АLCL3
б) нитрование: С6Н6 + НО – NО2 → С6Н5-NО2 + Н2О, в присутствии H2SO4
в) алкилирование — р. Фриделя-Крафтса – удлинение цепи атомов углерода
С6Н6 + RCl → C6H5-R + HCl, где R – CnH2n+1 (радикалы), катализатор — АLCL3
2. р. присоединения в жёстких условиях – свет, катализатор— Ni (присоединение Н2) а) С6Н6 + 3Н2 → С6Н12
б) С6Н6 + 3CL2 → С6Н6CL6 на свету
3. для гомологов бензола:
а) замещение атомов водорода в цикле (катализаторы FeBr3 и H2SO4)
С6Н5-СН3 + Br2 → о—С6Н4(Br)СН3 +НBr в ортоположении, т.е. 1-бром-2-метилбензол
а также →п—С6Н4(Br)СН3 +НBr в параположении, т.е. 1-бром-4-метилбензол
помнить: у гомологов бензола замещение в цикле атомов водорода
происходит с равной вероятностью в положении 2, 4, 6 относительно имеющегося радикала в присутствии катализаторов FeBr3 и H2SO4.
б) С6Н5-СН3 + 3НО – NО2 → С6Н2(NО2)3 + 3Н2О 1-метил-2,4,6,-тринитробензол.
в) присоединение 2 С6Н5-СН3+ 5Н2 → 2 С6Н11-СН3 или −СН3, метилциклогексан.
г) радикальное замещение в боковую цепь на свету:
С6Н5-СН3 + Br2 → С6Н5-СН2Br + НBr
д) окисление кислым раствором КМпО4
С6Н5-СН3 + 2[О] → С6Н-СООН — упрощенная запись, полная запись:
5С6Н5-СН3 + 6КМпО4 + 9H2SO4 → 5С6Н5-СООН + 3К2SO4 + 6МпSO4 + 14Н2О
электронно-ионный баланс:
С6Н5-СН30 + 2Н2О0 −6е —_→ С6Н5-СООН0 + 6Н+ │5
МпО4— + 8Н+ +5е—→ Мп2+ + 4Н2О │6
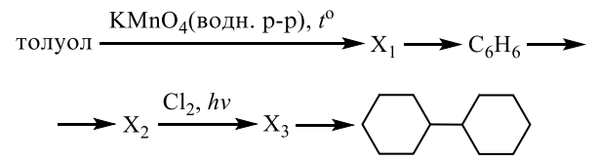
4. получение аренов: а) С6Н14 → С6Н6 + 4Н2↑, условия: t, Р, катализатор – Сr2O3
б) С6Н12→ С6Н6 + 3Н2↑, условия: t, катализатор – Pd
в) 3СН≡СН→ С6Н6, условия – активир-ый уголь (Сакт, t=6000С)
г) С6Н5-СООNa + NaOH → C6H6 + Na2CO3 при спекании сухих веществ.
4 лист
Кислородсодержащие соединения.
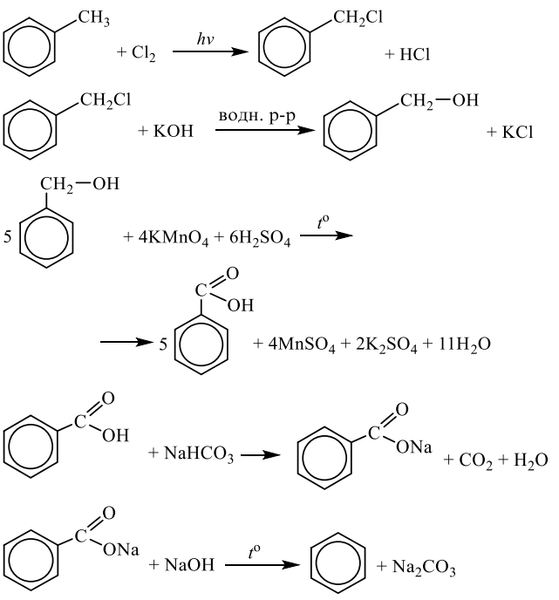
1. Одноатомные спирты — алканолы (предельные).
Общая формула – R-ОН или СпН2п+2О, М (СпН2п+2О)= (14п+18) г/моль,
Наличие гидроксогруппы — ОН в молекулах спиртов проявляется в слабых кислотных и основных свойств.
1. проявляют кислотные свойства (только реакции с щелочными Ме), убывающие от первичных к третичным спиртам: 2 С2Н5ОН + 2К → 2 С2Н5ОК + Н2↑;
2. слабые основные свойства, возрастающие от первичных к третичным спиртам:
R – ОН + НBr → R – Br + H2O
3. р. этерификации – взаимодействие с кислотами и образование сложных эфиров:
Н+
RСООН + НОR’ ↔ RСООR’ + Н2О (в кислой среде);
4. р. окисления подкисленными растворами КМпО4 или К2Сr2О7: а) первичные окисляются в 2 стадии до кислот т.к. имеют 2 атома [Н] на углероде при ОН-группе: 1стад. 2 стад.
R — СН2 – ОН + [О] → R — СН2 = О (альдегид); …+ [О] → R – СООН (кислота);
б) вторичные окисляются до кетонов т.к. имеют1 атом [Н] на углероде при ОН-группе: 1стад.
R — СН – ОН + [О] → R — С = О
│ │
R’ R’
5. р. дегидратации в присутствии раствора Н2SO4 (Al2O3, H3PO4 конц) зависит от температуры:
а) при t > 1500С – внутримолекулярная (Н2О отрывается от 1 молекулы):
СН3 – СН2 – СН2 – ОН (+Н2SO4) → СН3 – СН = СН2 + Н2О, продукт — алкен
б) при t < 1500С – межмолекулярная (Н2О отрывается от 2 молекул):
СН3 – СН2 –– ОН + СН3 – СН2 –– ОН (+Н2SO4) → СН3 –СН2 — О – СН2 – СН3+ Н2О,
продукт – простой эфир.
Различные классы спиртов дегидратируются при различных условиях:
первичные: СН2 – СН2 (конц. Н2SO4 при нагревании) → СН2 = СН2
│ │
Н ОН
вторичные: СН2 – СН – СН3 (конц. Н2SO4 при подогреве) → СН2 = СН
│ │ │
Н ОН СН3
СН3 СН3
│ │
третичные: СН2 – С – СН3 (конц. Н2SO4 на холоде) → СН2 = С
│ │ │
Н ОН СН3
6.Галогенирование: в присутствии PCl5, SOCl2 или HCL
СН3 – СН2 – ОН + SOCl2 → СН3 – СН2 – Cl + SO2 + HCL
6. Получение: а) СН3 – СН=СН2 + НОН → СН3 – С (СН3)Н — ОН (из алкенов);
5 лист
б) R – Br + NaOH (раствор) → R – ОН + NaBr (щелочной гидролиз галогеналканов); в) R – СНО + 2[Н] → R — СН2 – ОН (из альдегидов);
г) С≡О + 2Н2 (t, p, ZnO) → СН3ОН (из синтез-газа);
д) С6Н12О6 (брожение) → С2Н5ОН + 2СО2↑. см. продолжение.
7. качественные реакции на: а) предельные одноатомные спирты – CuO, t
С2Н5ОН + CuO → СН3 – СНО + Cu + Н2О
б) предельные многоатомные спирты – Cu (ОН)2, свежеприготовленный раствор
2 СН2 – ОН + Cu (OН)2 → (СН2 – О)2Cu + 2 Н2О
│ │
СН2 – ОН СН2 – ОН – ярко-синий раствор.
2. Ароматические спирты – фенолы (циклические, непредельные).
Общая формула – R-(ОН)m или СпН2п-6-m(ОH)m,
М (СпН2п-6-m(ОН)m)= (14п-6 +16m) г/моль,
SP2 – гибридизация
1. подвижность атома водорода и выраженные кислотные свойства –
а) реакции с Ме: С6Н5ОН + К → С6Н5ОК + 0,5Н2 ↑;
б) реакции со щелочами: С6Н5ОН + КОН → С6Н5ОК + НОН;
в) реакция с р-ром карбоната натрия (фенол в нём растворяется, но в отличие от обычных кислот не образует диоксида углерода):
С6Н5ОН(aq) + CO32-(aq) −→ C6H5O—(aq) + HCO3—(aq)
2. реакции с хлор-альдегидом: С6Н5ОН + СН3ССlO → С6Н5 – О – C(CH3)O + HCl;
3. р. электрофильного замещения протекают легче, чем у аренов:
С6Н5ОН + СН3 – С = О −→С6Н5 – О – С = О + НСl
│ │
Cl СН3
а) реакция с раствором бромной воды – 1-я качественная реакция на фенолы
С6Н5ОН + 3 Br2 → С6Н2(ОН)Br3↓ + 3НBr – 2,4,6 – трибромфенол (белая эмульсия)
б) реакция нитрования — С6Н5ОН + 3 НО – NO2 → С6Н2(ОН)(NO2)3 + 3 НОН
в присутствии Н2SO4 получается 2,4,6 – тринитрофенол,
в) получение фенолформальдегидной смолы – р. поликонденсации
С6Н5ОН (фенол) + НСНО (формальдегид) →С6Н4(ОН) – СН2ОН — 1-я стадия;
n С6Н4(ОН) – СН2ОН + n С6Н5ОН →( С6Н4(ОН) – СН2 – С6Н4(ОН))n + n НОН.
4. реакция с раствором FeCl3 – 2-я качественная реакция на фенолы
3 C6Н5ОН + FeCl3 → (С6Н5О-)3Fe + 3НCl (ярко-фиолетовый раствор).
4. Получение: а) из каменноугольной смолы;
б) С6Н5 Br + КОН → С6Н5ОН + КBr
в) С6Н5 – СН (СН3)2 + 2 [О] → С6Н5 – ОН + (СН3)2СО.
3. Альдегиды. Общая формула – R-С = О или СпН2п О.Мr (СпН2пО) =(14п+16)
│
Н
SP2 – гибридизация
1.Реакции нуклеофильного присоединения:
6 лист
а) R – СНО + НСN −KCN→ R – CH(OH) – C ≡ N;
б) R – СНО + R’OH −H+→ R – CH – OH −R’OH→ R – CH — OR’ + H2O
│ │
OR’ (полуацеталь) OR’ (ацеталь);
см. дальше
╔O ╔O
в) R – СНО + NaHSO3 (:S – ONa) → R – CH – S — ONa
│ │ O╝
OH OH
г) р. восстановления R – СНО + H2 −LiAlH4→ R – CH2 – OH
Внимание: водород легко присоединяется по связи С=С и очень трудно – по связи С=О. LiAlH4 восстанавливает связи С=О до С – ОН, не затрагивая связь С=С.
О ← ОН
║ │ │
СН3 – С – Н + Н – О – СН3 → СН3 – СН – О – СН3, LiAlH4 — алюмогидрид лития.
2. Окисление: легко окисляются в кислоты – качественные реакции на альдегиды – реакции «серебряного» и «медного» зеркала
а) R – CHO + 2 [Aq(NH3)2]OH → R – COO – NH4 + 2Aq↓ + 2NH3↑ + H2O:
реактив [Aq(NH3)2]OH – реактив Толленса
б) R – CHO + 2 Cu(OH)2 → R – COOH + Cu2O↓ + 2H2O:
реактив Cu(OH)2 – реактив Фелинга
или упрощённо — R – CHO + [О] → R – CОOН
3. Получение: а) из спиртов R–СН2-ОН + CuО −t→ R–СНО + Н2О + Cu
б) из дигалогензамещённых алканов:
R – CHCl2 + 2 NaОН → R – CHO + 2 NaCl + Н2О
4. Кетоны. Общая формула – R-С = О или СпН2п О. Мr (СпН2пО) =(14п+16)
│
R
SP2 – гибридизация
1. Химические свойства отличаются от свойств альдегидов:
а) менее активны в реакциях нуклеофильного присоединения, чем альдегиды (с цианидом водорода в присутствии цианида калия)
R – С=О + НСN −KCN→ R – C (OH) – C ≡ N;
│ │
R R
б) присоединение реактива Гриньяра – R – MqBr с образованием третичного спирта
R – С=О + R – MqBr −2HCl→ R – C (OH) – R + MqCl2 + HBr
│ │
R R
в) гидрирование кетонов с образованием вторичных спиртов
7 лист
R – С=О + Н2− → R – CН (OH)
│ │
R R
г) окисление с трудом, не взаимодействуют с соединениями серебра и меди
2. Иодоформный тест – если карбонильная группа связана со 2-ым атомом углерода от конца углеродной цепи (со щелочным раствором иода)
СН3 – СО – R + I2 −OH-→ R – COO—(aq) + CHI3(тв), жёлтый осадок, такой же, как и для CH3 – CH (OH)R.
5. Карбоновые кислоты. Общая формула – R-С = О или СпН2пО.
│
Мr (СпН2пО) =(14п+16) ОН
SP2 – гибридизация
1. Диссоциируют, т.е. являются донором катиона водорода – слабые электролиты, самая сильная из них – муравьиная НСООН
R – СООН ↔ R – СОО— + Н+, сл-но, характерны свойства, типичные для кислот – взаимодействие с Ме, основными оксидами, основаниями и солями слабых кислот.
2. р.замещения группы ОН на хлор, взаимодействие с хлоридом Р(V)
R – СООН + РСl5 → R – С = О + POCl3 + HCl
│
Сl
3.межмолекулярная дегидратация в присутствии Р2О5 или НРО3
R – СООН + Н – О – СО – R — Р2О5→ R – СО – О – СО — R + Н2О (ангидрид к-ты),
4. р. этерификации – образование сложных эфиров в присутствии Н2SO4
R – СООН + Н — О R′ − Н2SO4→ R – СО — О R′ + Н2О
остаток кислоты ↓ остаток спирта
5. получение амидов в реакциях с раствором аммиака, при нагревании
R – С = О + NH3 −t→ R – С = О + H2O
│ │
ОН NH2
6. р. замещения атома водорода у α–атома (С) на атом брома, в присутствии Ркр
СН3 – СН2 – СООН + Br2 − Ркр→ CH3 – CHBr – COOH + HBr;
7. р. дегидратации и гидрирование, в присутствии LiAlH4 (см. «альдегиды»)
R – С = О + 2 Н2 −LiAlH4→ R – СН2ОН + Н2О т.е. восстановление до спиртов.
│
ОН
8.Внимание: муравьиная кислота – самая сильная из органических кислот и
сильный восстановитель,
отсюда следует:
а) НСООН − Н2SO4→ СО2↑ + Н2О;
б) р. «зеркала» НСООН + 2 [Ag(NH3)2]OH −t→ 2 Ag↓ + (NH4)2CO3 + 2NH3 + H2O
или упрощенно НСООН + Ag2О −t→ 2Ag↓ + СО2↑ + Н2О;
в) НСООН + Cl2 → CO2↑ + 2HCl
9. Получение: а) из спиртов (окисление, т.е. + [О])
R – СН2 – ОН + [О] → R – СНО (альдегид) и дальше + [О] → R – СООН (кислота);
б) из альдегидов – р. «серебряного и медного зеркала»
8 лист.
R – СНО + [Ag(NH3)2]OH −t→ Ag↓ + R – СООNН4 + Н2О + NH3
б) из реактива Гриньяра (R – MgBr) – р. элиминирования и гидратации (последовательное взаимодействие с СО2 и Н2О):
R – MgBr + CO2 → R – COO – MgBr…….. + H2O → R – COOH + Mg (OH) Br
в) из трихлорзамещенного алкана (последовательное замещение атомов хлора на группы ОН из щелочей и дегидратация)
R – С (Cl)3 + 2 NaOH → 3NaCl + R – C(OH)3….→ R – COOH + H2O
R – C (OH)3 – трёхатомный спирт – вещество очень слабое и нестабильное.
продолжение см. дальше
6. Сложные эфиры карбоновых кислот. Общая формула – R-С = О
│
О R′
Мr (СпН2п+1СОО)(СпН2п+1)′ = (14п+46)
1. р. гидролиза: а) кислотного СН3СООСН3 + НОН −H+→ СН3СООН + НОСН3
(кислота) (спирт)
б) щелочного СН3СООСН3 + NaOH → СН3СООNa + СН3ОН
р. гидролиза с Н2О идёт медленно, её катализируют (ускоряют) кислоты и щёлочи
2. р. восстановления, в присутствии LiAlH4 с образованием 2-х спиртов:
R – СОО — R′ + 4 [Н+] −LiAlH4→ R – CH2 – OH + R′ОН (аналогично альдегидам);
3. Получение: а) р. этерификации R – СООН + НО R′ − Н2SO4↔ R – СОО — R′ + Н2О
особенность: медленная реакция, обратимая, с низким выходом.
б) р. ацилирования спирта хлоридом кислоты
СН3СОCl + НОСН2СН3 → СН3СООСН2СН3 + HCl (р. быстрая, хороший выход).
Хлорангидриды и ангидриды кислот
Эти два вида производных карбоновых кислот химически очень активны. Хлорангидриды даже более активны, чем ангидриды, и более летучи, что делает обращение с ними очень трудным. Они вступают в быструю реакцию на холоде с водой, аммиаком и с их производными, спиртами и аминами. В каждом случае атом водорода реагирующей молекулы замещается ацильной группой – это реакции ацилирования, а хлорангидриды и ангидриды кислот-ацилирующие агенты.
С хлорангидридами:
а) вода: СН3СОCl + НОН → СН3СО – ОН (кислота) + HCl;
б) спирт: СН3СОCl + НОСН2СН3 → СН3СО – ОСН2СН3 (эфир) + HCl;
в) аммиак: СН3СОCl + 2Н−NH2 → СН3СО – NH2 (амид) + NH4Cl;
г) амин: СН3СОCl + НNHСН3 → СН3СО – NHСН3 (замещ. амид) + HCl;
↑
этот атом водорода замещается на ацильную группу.
С ангидридами кислот:
а) вода: СН3СОООССН3 + НОН → СН3СО – ОН + СН3СООН;
б) спирт: СН3СОООССН3 + НОСН2СН3 → СН3СО – ОСН2СН3 + СН3СООН;
в) аммиак: СН3СОООCСН3 + Н−NH2 → СН3СО – NH2 + СН3СООН;
г) амин: СН3СОООCН3 + НNHСН3 → СН3СО – NHСН3 + СН3СООН.
7. Углеводы. Общая формула – Сn (Н2О)m. Mr = 12n + 18m.
9 лист
1. Глюкоза – альдегидоспирт СН2ОН – (СНОН)4 — СНО, т.е. имеет р. «зеркала»
СН2ОН – (СНОН)4 – СНО + 2 [Ag(NH3)2]OH −t→ СН2ОН – (СНОН)4 – СОО — NH4 + 3NH3 + H2O + 2 Ag↓
2. р. восстановления до многоатомных спиртов:
СН2ОН – (СНОН)4 – СНО + 2[Н] → СН2ОН – (СНОН)4 – СН2ОН (сорбит);
3. синее окрашивание с Си(ОН)2, как у многоатомных спиртов;
4. р. межмолекулярной дегидратации со спиртами: → простые эфиры;
5. р. этерификации с альдегидами → сложные эфиры;
6. брожение: С6Н12О6 −дрожжи→ 2 С2Н5ОН + 2 СО2↑ — спиртовое брожение;
С6Н12О6 −→ 2 СН3 – СН (ОН) – СООН — молочнокислое брожение.
8. Азотсодержащие соединения – амины. Общая формула – R- NH2,
R – NH – R или N(R)3. Мr (R- NH2) = (14п+17)
1. Амины обладают основными свойствами, поэтому, как основания,
а) реагируют с водой: R- N:H2 + Н2О ↔ [R- NH3]+ ОН−
б) реагируют с кислотами: R- N:H2 + Нδ+Cl δ- ↔ [R- NH3]+ Cl−
2. Реакция горения: 4 С2Н5 + N:H2 + 15О2 → 8СО2↑ + 2N2↑ + 14Н2О.
3. Р. нитрирования (с НО – NО) проходит по-разному:
а) у первичных аминов:
R- NH2 + НО – NО (NaNO2 + HCl) → R – OH + N2↑ + NaCl + H2O;
б) у вторичных аминов:
R2 – NH + НО – NО (NaNO2 + HCl) → R2N – N=O + NaCl + H2O.
4. Анилин – ароматический амин с формулой С6Н5 — NH2
в реакции нитрирования:
С6Н5 — NH2 + НО – NО (NaNO2 + HCl) → [С6Н5 — N≡N]+Cl− + NaCl + 2H2O;
5. Качественная реакция на анилин – реакция с раствором брома:
С6Н5 — NH2 + 3Br2 → C6H2Br3NH2↓ + 3 HBr
6. Получение аминов:
а) NH3 + CH3Cl −t→ CH3 – NH2 + HCl;
б) R – NO2 + 4 [H] −LiAlH4→ R – NH2 + 2H2O
7. Получение анилина:
) C6H5 – NO2 + 6 [H] −Fe + HCl→ C6H5 – NH2 + 2H2O
9. Азотсодержащие соединения – аминокислоты
…β α
Общая формула – R – СН — СООН
│
NH2 Мr (к-ты) = (14п+75)
1.Аминокислоты обладают амфотерными свойствами, поэтому реагируют:
а) с кислотами H2N – CH2 – COOH + HCl → Cl [NH3 – CH2 — COOH];
б) c щелочами H2N – CH2 – COOH + NaOH → NH2 – CH2 – COONa + H2O.
2. Р. этерификации – взаимодействие со спиртами:
H2N – CH2 – COOH + С2Н5OH −H+→ H2N – CH2 – COO – С2Н5 + Н2О
3. Р. поликонденсации — взаимодействие кислот между собой с образованием пептидов: пептидная связь
H2N – CH2 – COOH + H—N – CH2 – COOH → H2N – CH2 – CO—N – CH2 – COOH
│ Дипептид │
Н Н
4. Получение: α- аминокислоты из α-хлорзамещенных карбоновых кислот
R – СН – СООН + 2 H3N → R – СН – СООН + NH4 Cl
│ │
Cl NH2
Окислительно – восстановительные реакции в органической химии.
А. Углеводороды.
1. СН2 = СН – СН2 – СН3 + КМпО4 + Н2О → СН2 – СН – СН2 – СН3 + МпО2 + КОН
│ │
ОН ОН
2. С6Н5 – СН2 – СН3 + КМпО4 + Н2SО4 → С6Н5СOOН + MnSO4 + K2SO4 + CO2 + H2O
3. СН2 = СН – СН2 – СН3 + КМпО4+ Н2SО4 → HCOOH + CH3COOH + MnSO4 + K2SO4 + H2O
4. CH ≡ CH + КМпО4 + Н2О → H2C2O4 + MnO2 + KOH
5. С6Н5 – СН3 + КМпО4 + Н2SО4 → С6Н5СOOН + MnSO4 + K2SO4 + H2O
6.
Строение алкенов. Уместно начинать с него, так как все свойства алкенов тесно связаны с особенностями их строения. У алкенов в составе электронных орбиталей находится одно негибридное облако, которое образует пи-связь с атомом углерода. Для молекул алкенов характерна геометрическая структурная изометрия: из-за того, что P-орбитали перекрываются в двух местах, затруднено вращение относительно углерод-углеродной связи. А если так, значит, есть возможность различного взаиморасположения групп (пример: цис-бутен-2, транс-бутен-2).
Химические свойства алкенов и алканов: сравнение. Наиболее характерный механизм реакции у алканов — радикальный цепной механизм, и реакция начинается с образования свободного радикала. Для алкенов же характерен ионный механизм взаимодействия. Далее, поскольку активная форма молекулы у алкена — двойная углерод-углеродная, то, в отличие от алканов, алкены относятся к ненасыщенным углеводородам и им характерна реакция присоединения. Для алканов характерна реакция замещения. Благодаря высокой химической активности, алкены вступают в реакцию при обычных условиях, а алканам нужны дополнительные факторы — свет, тепло, искра или какой-то другой внешний фактор. И алкены, и алканы реагируют с галогенами (хлор и бром), но для алкенов это реакция присоединения (радикального характера), а для алканов — замещения. Водород присоединяется к алкенам при отсутствии катализатора; алкены могут также присоединять воду и взаимодействовать с кислотами (при этом характер реакций будет ионный). Алканы ни с водой, ни с водородом не реагируют.
Правило Марковникова гласит, что при присоединении протонных кислот или воды к несимметричным алкенам атом водорода будет присоединяться к тому атому углерода, который наиболее гидрогенизирован. Удобно, что все реакции с участием алкинов типовые и запоминаются относительно легко. Научите учеников моделировать реакцию: одни и те же связи разрываются и возникают, например, при взаимодействии алкина с водородом и с бромовой водой.
Из правила Марковникова есть исключения:
1. Когда двойная связь в молекуле алкена соседствует с электронно-акцепторной группой (например, трифторметил). Электронная плотность изменяется, и продукты реакции получаются иные, чем по правилу Марковникова. Атомы фтора сильно электроотрицательны и смещают двойную P-связь.
2. Строго для гидробромирования: взаимодействие несимметричного алкена с бромоводородом при участии органической перекиси. Тогда реакция протекает по радикальному механизму.
3. Сопряженные системы: двойная углерод-углеродная связь сопряжена с двойной углерод-водородной или углерод-азотной связью. Здесь также происходит смещение электронной плотности по P-связи. На атоме углерода возникает избыточный отрицательный заряд, в результате происходит «антимарковниковский» эффект.
Всегда ли для алкенов возможны только реакции присоединения? Согласно теории Бутлерова, достаточно знать строение молекулы, чтобы предсказать свойства вещества. Рассмотрим молекулу алкена пропена. В ней отчетливо выделяются две части: первая от этилена, где атомы углерода в sp2 гибридном состоянии, вторая — от алкана (метана), в которой находится sp3 гибридный атом углерода. Следовательно, пропен сочетает в себе свойства этилена и метана; а для метана характерна реакция замещения под воздействием внешних факторов (например, внешнего облучения). Реакция замещения у пропена возможна благодаря устойчивости аллельного радикала. Для всех алкенов, начиная от пропена, возможны аналогичные реакции, хотя это и не самое характерное свойство данной группы.
Реакция полимеризации. Эта реакция имеет огромное практическое значение, потому что с ее помощью возникает целый ряд углеводородов и их производных — полимеров. Чтобы реакция началась, нужен инициатор — радикал. Он взаимодействует с молекулой, например, этилена; двойная связь в этилене распадается, образовавшаяся частица взаимодействует с другой CH-группой, затем с ещё одной, и так процесс полимеризации идет до тех пор, пока связь не оборвется (это произойдет тогда, когда встретятся два радикала).

Органическая химия в тестовых заданиях. Профильный уровень. 10–11 классы. Учебное пособие
Учебное пособие предназначено для учащихся 10-11 классов общеобразовательных учреждений. Оно окажет помощь в закреплении и углублении знаний по органической химии. В пособии предлагаются задания различной степени сложности, представленные в тестовой форме.
Купить
У учеников часто возникают трудности, когда в задании требуется написать уравнение подобной реакции. Есть простой прием: объемные заместители пишем внизу. Так формула становится нагляднее.
Окисление алкенов. С одной стороны, двойная связь всегда энергетически обязательно сильнее, чем одинарная. С другой стороны, двойная связь — это наиболее активная часть молекулы, поэтому именно двойная связь подвержена окислению. При мягком окислении разрывается двойная связь, образуются двухатомные спирты. Эта реакция проходит в нейтральной среде без нагревания.
Что ещё почитать?
- Демоверсия ЕГЭ-2019 по химии
- Методические подходы к изучению ОВР в основной школе
- Методическая помощь учителю химии
- Изучение сероорганических соединений
- К методике изучения классов неорганических соединений
Если в реакции присутствует серная кислота, происходит жесткое окисление: атом углерода максимально окружает себя атомами кислорода, но одинарные связи по-прежнему не разрушаются. Здесь основная сложность — правильно определить степени окисления и расставить коэффициенты (см. видео).
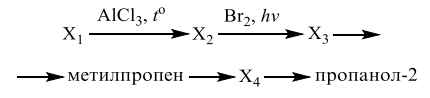
Получение алкенов. Опорой для изучения этой темы должна быть хорошо усвоенная информация о химических свойствах алканов. Дегидрирование алканов по сути и является процессом получения алкенов. Другой способ — крекинг алканов: при этой реакции всегда образуется два углеводорода, алкен и алкан; интуитивно это ясно, так как на два алкена просто не хватит атомов водорода. Другие способы получения алкенов можно изучить через повторение химических свойств самих алкенов. Например: гидратация алкенов дает спирты, а если от спирта отщепить воду, нагревая его с серной кислотой, получим алкен.
Правило Зайцева. При отщеплении воды от спирта, водород преимущественно отделяется от того атома углерода, у которого водородов меньше (то есть, от вторичного). Примерно та же ситуация наблюдается при дегидрохлорировании, однако, если хлороводород присоединяется к алкену легко, то отщепить его можно только при воздействии щелочи, растворенной в спирте.
Можно присоединить галоген к алкену, получается дигалогеналкан. Отщепить галогены тоже можно, под действием активного двухвалентного металла. Часто у учеников возникает вопрос, можно ли использовать одновалентный металл? Отвечаем: можно, но это нетипичная реакция.
Циклоалканы. Снова начнем со строения. Перед нами цикличные молекулы, изомерные алкенам, не содержащие двойных углерод-углеродных связей. Здесь возможна геометрическая изомерия. Ученикам, сдающим ЕГЭ по химии, полезно знать устойчивые конформации, свойственные тем или иным циклоалканам. Еще запомним правило: малые циклы (трехчлены и четырехчлены) — напряженные, как сжатые пружины, а большие циклы (пяти- и шестичлены) менее напряжены. Для первых характерны реакции присоединения, для вторых — замещения.
Химические свойства циклоалканов. Что могут присоединить малые циклы? Водород, галоген, галогеноводород, при определенных условиях — воду. Большие циклы реагируют примерно так же, как и большие алканы: с бромом, азотной кислотой, возможны реакции дегидрирования.
Получение циклоалканов. Здесь нужно повторить уравнения реакций при взаимодействии дигалогеналканов с активными двухвалентными металлами. Эти уравнения будут очень нужны при выполнении заданий на восстановление цепочки превращений и при решении задач на нахождение формулы вещества.
#ADVERTISING_INSERT#
Вебинар по теме
|
Тест «Алканы 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 |
|
|
Цепочки «Алканы» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Алкены 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 |
|
|
Цепочки «Алкены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Циклы и алкадиены» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 |
|
|
Цепочки «Циклы и алкадиены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Алкины» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 |
|
|
Сложные эфиры |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Цепочки «Сложные эфиры» |
|
|
1 2 3 4 5 |
|
|
Цепочки «Алкины» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Арены 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 |
|
|
Цепочки «Арены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Спирты и фенолы» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 |
|
|
Цепочки «Спирты и фенолы» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Цепочки «Альдегиды и кетоны» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Цепочки «Карбоновые кислоты» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 |
|
|
Карточки с похожими реакциями |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 |
|
|
Задание №10 ЕГЭ. Номенклатура и классификация органических веществ. |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 |
|
|
Задание №11 ЕГЭ. Строение органических веществ. Изомеры и гомологи. |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Задание №12. Свойства углеводородов и кислородсодержащих веществ |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Задание №13 ЕГЭ. Азотсодержащие вещества, углеводы, жиры |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 |
|
|
Задание №14 ЕГЭ. Свойства углеводородов |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 |
|
|
Задание №33 ЕГЭ. Вывод формулы органического вещества |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 |
|
|
Свойства и способы получения углеводородов |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 |
|
|
Свойства и способы получения кислородсодержащих органических веществ |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
Типовые (тематические) тесты в формате ЕГЭ по химии по каждому заданию. Тренировочные тесты, которые соответствуют заданиям ЕГЭ-2023 по химии по темам КИМ ЕГЭ по химии.
Хотите видеть больше интересных материалов? Вы можете поддержать работу сайта:
Обратите внимание! Форма выше — это форма для сбора донатов на работу сайта.
Полные тренировочные варианты ЕГЭ по химии с автопроверкой первой части
Спецификация ЕГЭ по химии-2023
| Номер задания | Тематические тесты по теме |
| 1 | Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояния атомов |
| 2 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов |
| 3 | Электроотрицательность. Степень окисления и валентность химических элементов |
| 4 | Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения |
| 5 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) |
| 6 | Характерные химические свойства простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка). Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена |
| 7 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). Характерные химические свойства неорганических веществ: – простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) |
| 8 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная); Характерные химические свойства неорганических веществ: – простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) |
| 9 | Взаимосвязь неорганических веществ |
| 10 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) |
| 11 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа |
| 12 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории). Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории) |
| 13 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки |
| 14 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Важнейшие способы получения углеводородов. Ионный (правило В.В. Марковникова) и радикальные механизмы реакций в органической химии |
| 15 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих органических соединений |
| 16 | Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений |
| 17 | Классификация химических реакций в неорганической и органической химии |
| 18 | Скорость реакции, её зависимость от различных факторов |
| 19 | Реакции окислительно-восстановительные |
| 20 | Электролиз расплавов и растворов (солей, щелочей, кислот) |
| 21 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная |
| 22 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов |
| 23 | Обратимые и необратимые химические реакции. Химическое равновесие. Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ |
| 24 | Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений |
| 25 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки |
| 26 | Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе» |
| 27 | Расчёты теплового эффекта (по термохимическим уравнениям) |
| 28 | Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси |
| 29 | Окислитель и восстановитель. Реакции окислительно-восстановительные
Задания 29 (ранее 30) из реального ЕГЭ по химии 2021 Задания 29 (ранее 30) из реального ЕГЭ по химии 2020 |
| 30 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена
Задания 30 (ранее 31) из реального ЕГЭ по химии 2021 Задания 30 (ранее 31) из реального ЕГЭ по химии 2020 |
| 31 | Тренажер задания 31 по химии железа
Тренажер задания 31 ЕГЭ по химии щелочных металлов Тренажер задания 31 ЕГЭ по химии щелочноземельных металлов Тренажер задания 31 по химии азота Тренажер задания 31 по химии алюминия Тренажер задания 31 по химии галогенов Тренажер задания 31 по химии марганца Тренажер задания 31 по химии меди Тренажер задания 31 по химии серы Тренажер задания 31 по химии углерода и кремния Тренажер задания 31 по химии цинка Тренажер задания 31 по химии хрома Задания 31 (ранее 32) из реального ЕГЭ по химии 2021 Задания 31 (ранее 32) из реального ЕГЭ по химии 2020 |
| 32 | Реакции, подтверждающие взаимосвязь органических соединений
Органические цепочки (задания 32, ранее 33) из реального ЕГЭ по химии 2021 Органические цепочки (задания 32, ранее 33) из реального ЕГЭ по химии 2020 |
| 33 | Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества.Расчёты массовой доли (массы) химического соединения в смесиРасчетные задачи по неорганике (задания 33, ранее 34) из реального ЕГЭ по химии 2021Расчетные задачи по неорганике (задания 33, ранее 34) из реального ЕГЭ по химии 2020 |
| 34 | Установление молекулярной и структурной формул вещества
Расчетные задачи, органическая химия (задания 34, ранее 35) из реального ЕГЭ по химии 2021 Расчетные задачи, органическая химия (задания 34, ранее 35) из реального ЕГЭ по химии 2020 |
Основные
положения теории А,М, Бутлерова. Гомологический ряд углеводородов. Изомеры
углеводородов. Структурная и пространственная изомерия.
1.
А14 Для вещества, формула которого
СН3 – СОО – С2Н5,
изомером является
1) СН3 – (СН2)2 – СООН 2) СН3
– СН2 – СООН
3) СН3 – О – С3Н7 4)
СН3 – (СН2)3 – ОН
2.
А14 Цис-транс- изомерия характерна для
1)
бутена-1 2) бутена-2 3) бутина-1 4) бутина-2
3.
А14 Изомером диэтилового эфира является
1) пропанол-2 2) бутанол-1 3) пентанол-2 4) гексанол-3
4.
А14 Этиловый эфир уксусной кислоты и метилпропионат являются
1) гомологами 2) структурными
изомерами
3) геометрическими изомерами 4) одним и тем же веществом
5.
А14 Этиловый эфир уксусной кислоты и метилпропионат являются
1) гомологами 2) структурными изомерами
3) геометрическими изомерами 4) одним и тем же веществом
6.
А14 Бутен-1 является структурным изомером
1) бутана 2) циклобутана 3) бутина 4) бутадиена
7.
А14 Структурным изомером гексина-2 является
1) гексен-2 2) гексадиен-2,4
3) 2-метилбутен-2 4) 3-метилбутин-1
8.
А14 Изомером диметилового эфира является
1) метаналь 2) метан 3) этанол 4) этилен
9.
А14 Структурным изомером пентина-2 является
1) 3-метилпентен-1 2) 2-метилбутадиен-1,3
3) метилциклопентан 4) гексадиен-1,3
10.
А14 Изомером этилацетата является
1) бутаналь 2) бутанол-2
3) бутановая кислота 4) диэтиловый эфир
11.
А14 Изомером 2-метилбутана является
1) бутан 2) 2,2-диметилпропан
3) 2-метилпропан 4) 2,2-диметилбутан
12.
А14 Изомером 2-метилбутана является
1) бутан 2) 2,2-диметилпропан
3) 2-метилпропан 4) 2,2-диметилбутан
13.
А14 Гомологом ацетальдегида является
1) пропаналь 2) этилацетат 3) пропанол 4) этанол
14.
А14 Диены являются структурными изомерами
1) алканов 2) циклоалканов 3) алкинов 4) аренов
15. А14 (Дем.
вар.) Изомером 2-метилпропанола-1 является
1)
метилизопропиловый эфир 2) пропанол-1
3) 2-метилбутанол-1 4) пропандиол-1,2
Типы
связей в молекулах органических веществ. Радикал. Функциональная группа.
Особенности химического и электронного строения алканов, алкенов, алкинов, их
свойства. Бензол — ароматический углеводород. Гомологи бензола.
1.
А15 И бутан, и бутен реагируют с
1) аммиачным раствором Ag2O 2) раствором KMnO4
3) бромной водой 4) хлором
2.
А15 В молекуле какого вещества все атомы углерода находятся в
состоянии sp-гибридизации?
1)
этана 2) этилена 3) ацетилена 4) бензола
3.
А15 Атом кислорода в молекуле фенола образует
1) две σ-связи 2) одну σ-связь
3) одну σ- и одну π-связи 4) две π-связи
4.
А15 В молекуле какого вещества все атомы углерода находятся в
состоянии sp2-гибридизации?
1)
гексан 2) гексен 3) бензол 4) толуол
5.
А15 Этин – углеводород, для которого характерно(а):
1) наличие двух π-связей между атомами углерода
2) двойная связь между атомами углерода
3) sp2-гибридизация орбиталей атомов углерода
4)
тетраэдрическое строение молекулы
6.
А15 Верны ли следующие суждения об ацетилене?
А. В молекуле ацетилена между атомами углерода присутствуют
только π-связи.
Б. При взаимодействии ацетилена с бромной водой разрывается π-
связь между атомами углерода.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
7.
А15 Число σ-связей в молекуле тетрахлорметана равно
1)
1 2) 2 3)3 4) 4
18.
А15 При взаимодействии 1 моль пропина с 1 моль бромоводорода
преимущественно образуется
1) 2-бромбутен-1 2) 1-бромпропен
3) 1,2-дибромпропан 4) 2-бромпропен
12.
А15 Верны ли следующие суждения о метане?
А. В молекуле метана атом углерода находится в состоянии
sp3-гибридизации.
Б. Метан вступает в реакцию замещения с бромом.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
13.
А15 И пентан, и пентен реагируют с
1) аммиачным раствором Ag2O 2) раствором KMnO4
3) бромоводородом 4) бромом
14.
А15 Число р-электронов, принимающих участие в образовании единой
π-электронной системы в молекуле бензола, равно
1)
1 2) 2 3) 6
4) 4
15. А15 (Дем.
вар.) Только σ-связи присутствуют в молекуле
1)
бензола 2) толуола 3) бутена-2 4) изобутана
Характерные
химические свойства кислородсодержащих органических соединений: предельных
одноатомных и многоатомных спиртов, фенола.
1.
А16 Многоатомные спирты, в отличие от одноатомных спиртов, могут
реагировать с
1) гидроксидом меди (II) 2) щелочными металлами
3) карбоновыми кислотами 4) кислородом
2.
А16 Одноатомные предельные спирты не вступают в реакцию
1) этерификации 2) гидрирования
3) дегидратации 4) замещения
3.
А16 Этилат натрия образуется при взаимодействии
1) натрия и этана 2) натрия и этанола
3) гидроксида натрия и хлорэтана 4) натрия и хлорэтана
4.
А16 Метанол может вступать в реакцию
1) с раствором гидроксида натрия 2) с бромной водой
3) с уксусной кислотой 4) «серебряного зеркала»
5.
А16 Этанол образует алкоголят при взаимодействии с
1) натрием 2) карбонатом натрия
3) гидроксидом меди (II) 4) хлоридом кальция
6.
А16 Какое органическое соединение реагирует с натрием, гидроксидом
калия и бромной водой?
1) анилин 2) глицерин 3) фенол 4) этанол
7.
А16 Реакция возможна между
1) глицерином и метаном 2) фенолом и бензолом
3) пропанолом и оксидом меди (II) 4) метанолом и медью
8.
А16 Алкоголят образуется при взаимодействии этанола с
1) перманганатом калия 2) хлороводородом
3) метиламином 4) натрием
9.
А16 Свежеосажденный гидроксид меди (II) взаимодействует с
1) бензолом 2) этанолом 3) стиролом 4) глицерином
10.
А16 Фенол не взаимодействует с
1)
Br2 2) HNO3 3) Na 4)
HCl
11.
А16 В отличие от этанола, глицерин взаимодействует с
1) натрием 2) уксусной кислотой
3) гидроксидом меди (II) 4) хлороводородом
12.
А16 Тринитрофенол образуется при взаимодействии фенола и
1) оксида азота (IV) 2) азотной кислоты
3) оксида азота (III) 4) нитрата калия
13.
А16 При нагревании этанола с концентрированной серной кислотой
выше 170°С образуется
1)
ацетилен 2) этан 3) этилен 4) этиленгликоль
14.
А16 И фенол, и глицерин реагируют с
1) натрием 2) сульфатом натрия 3) водой 4) медью
15. А16 (Дем.
вар.) Фенол не взаимодействует с
1)
метаналем 2) метаном 3) азотной кислотой 4) бромной водой
Характерные
химические свойства кислородсодержащих органических соединений.
1.
А17 При взаимодействии пропановой кислоты с раствором гидроксида
кальция образуются
1) (CH3COO)2Ca и H2O
2) (CH3CH2COO)2Ca и H2O
3) C3H8 и CaCO3 4)
C2H5CHO и CaO
2.
А17 Для муравьиной кислоты, в отличие от уксусной, возможна реакция
1) этерификации 2) нейтрализации
3) образования солей 4) «серебряного зеркала»
3.
А17 Муравьиная кислота взаимодействует с
1) хлоридом натрия 2) гидросульфатом натрия
3) аммиачным раствором оксида серебра 4) оксидом азота (II)
4.
А17 В результате брожения глюкозы образуется
1) метанол 2) этилен 3) этанол 4) кислород
5.
А17 Крахмал является биополимером, состоящим из остатков молекул
1) глюкозы 2) аминокислот 3) углеводородов
4)
глицерина и высших карбоновых кислот
6.
А17 При окислении ацетальдегида в кислой среде образуется
1) этилен 2) ацетат натрия 3) уксусная кислота 4) этиловый спирт
7.
А17 Уксусная кислота будет взаимодействовать с каждым из двух
веществ:
1) Na2CO3 (р-р) и CH4
2)
NaOH (р-р) и C2H5OH
3) O2 и NaCl (р-р) 4)
AlCl3 (р-р) и CH3OH
8.
А17 С каждым из веществ: магний, гидроксид натрия, этанол –
будет реагировать
1) пропановая кислота 2) пропиловый спирт
3) пропаналь 4) метилпропионат
9.
А17 Этилацетат образуется при взаимодействии уксусной кислоты и
1) этилена 2) этанола 3) этаналя 4) этана
10.
А17 Как муравьиная, так и пропионовая кислота реагируют с
1) фенолом 2) этаналем 3) этанолом 4) этилацетатом
11.
А17 При взаимодействии уксусной кислоты с гидрокарбонатом калия
образуются
1) ацетат калия, углекислый газ и вода 2) ацетат калия и водород
3) карбонат калия, углекислый газ и вода 4) метан и гидроксид калия
12.
А17 При взаимодействии муравьиной кислоты с гидроксидом кальция
образуются
1) формиат кальция и вода 2) ацетат кальция и вода
3) формиат кальция и водород 4) карбонат кальция и вода
13.
А17 Какое из указанных соединений реагирует с аммиачным раствором
оксида серебра?
1)
этаналь 2) этанол 3) ацетон 4) бензол
14.
А17 При взаимодействии уксусной кислоты с этанолом образуется
1) метиловый эфир уксусной кислоты
2) этиловый
эфир уксусной кислоты
3) метилэтиловый эфир 4) диэтиловый эфир
15. А17 (Дем.
вар.) При восстановлении глюкозы образуется
1) кислота
2) сложный эфир 3) соль 4) спирт
Взаимосвязь
органических веществ
1.
А18 В схеме превращений
+X
+Y
C2H4 C2H5OH
C2H5ONa
веществами «X» и «Y» являются соответственно
1) КОН и NaCl 2) H2O и Na 3) H2O и Na2CO3
4) KOH и Na
2.
А18 В схеме превращений C6H12O6 →X →C2H4
веществом «Х» является
1) C2H5OH
2) C6H10O5 3) CH3COOH 4) C6H12
3.
А18 Муравьиная кислота взаимодействует с
1) хлоридом натрия 2) гидросульфатом натрия
3) аммиачным раствором оксида серебра 4) оксидом азота (II)
4.
А18 В схеме превращений: C2H2 →X → C6H5Cl
веществом «Х» является
1) этилен 2) бромэтан 3) этаналь 4) бензол
5.
А18 В схеме превращений C2H5OH→ X → CH3COOH веществом
«X» является
1) C2H5Cl
2) CH3 –СО–CH3
3) CH3
– CОН 4) Cl –CH2
–COOH
6. А18 В
схеме превращений СН4 →X →CH3NH2 веществом
«Х» является
1) CH3NO2
2) CH3ONO2 3) CH3OH 4) CH3COOH
7.
А18 В схеме превращений CH ≡ СH→ X → CH3– CH2Br
веществом «Х» является
1) этаналь 2) оксид углерода (II) 3)
этанол 4) этан
8.
А18 С каждым из веществ: магний, гидроксид натрия, этанол – будет реагировать
1) пропановая кислота 2) пропиловый спирт
3) пропаналь 4) метилпропионат
9.
А18В цепочке превращений
Cl2
C2H4 → X C2H5Cl
веществом «X» является
1)
ацетилен 2) этанол 3) этан 4)
бензол
10.
А18 В схеме превращений CH3 – CH3 →X → CH3 ®CH2OH веществом
«Х» является
1) 1,2-дибромэтан 2) бромэтан 3) 1,1-дибромэтан 4) ацетилен
11.
А18 В схеме превращений C12H22O11→ X → C2Н5OH
веществом «Х» является
1) C12H22
2) C6H12O6 3) CH3COOH
4) C6H10O5
12.
А18 В схеме превращений C2H4 → X → CH3CНO веществом
«Х» является
1)
этаналь 2) этен 3) этан 4) этанол
13.
А18 В схеме превращений CH2=CH2 → X → CH3 – COOH веществом
«Х» является
1) бромэтан 2) 1,2-дибромэтан 3) этанол 4) 1,2-этандиол
14.
А18В схеме превращений CH4 →X →CH3 – COH веществом
«Х» является
1)
этан 2) метанол 3) этанол 4) ацетилен
15. А18 (Дем. вар.) В схеме превращений этаналь → X
→ этилацетат веществом «Х» является
1) этановая кислота 2) ацетат натрия 3) ацетилен 4) ацетон
Реакции,
характеризующие основные свойства и способы получения углеводородов
1.
А26 Алкены превращаются в алканы в ходе реакции
1) гидратации 2) изомеризации
3) гидрирования 4) дегидрирования
2.
А26 В отличие от бутана, для циклобутана возможно взаимодействие с
1) бромом 2) хлором 3) кислородом 4) водородом
3.
А26 При полном гидрировании ацетилена образуется
1) этанол 2) этиленгликоль 3) этен 4) этан
4.
А26 В результате реакции 1 моль ацетилена с 2 моль хлора образуется
1) 1,2-дихлорэтен 2) 1,1,2,2-тетрахлорэтан
3) 1,2-дихлорэтан 4) тетрахлорметан
5.
А26 В результате реакции 1 моль этина с 2 моль брома образуется
1) 1,2-дибромэтан 2) бромэтан
3) 1,1,2,2-тетрабромэтан 4) 1,2-дибромэтен
6.
А26 Ацетат натрия при нагревании с твердым гидроксидом натрия
образует
1) этан 2) пропан 3) ацетон 4) метан
7.
А26 Наибольшее количество водорода присоединяет 1 моль
1) пропина 2) бензола 3) пропена 4) бутадиена-1,3
8.
А26 Ацетилен в одну стадию можно получить из
1) циклопропана 2) бензола 3) бутадиена-1,3 4) метана
9.
А26 С образованием 2-бромпропена реагируют
1) пропин и бромоводород 2) пропин и бромная вода
3) пропан и бром 4) пропен и бром
10.
А26 Пропан реагирует с веществом, формула которого
1) Н2О
2) HCl 3) Cl2 4) Н2
11.
А26 Тримеризацией этина получают
1) гексан 2) циклогексан 3) гексадиен-1,3 4) бензол
12.
А26 При бромировании пропана (на свету, при умеренном нагревании) в
наибольшем количестве образуется
1) 1-бромпропан 2) 2-бромпропан
3) 1,1-дибромпропан 4) 1,2-дибромпропан
13.
А26 2-бромпропан можно получить взаимодействием
1) пропена с бромом 2) пропена с бромоводородом
3) пропина с бромоводородом 4) пропанола-1 с бромоводородом
14.
А26 При взаимодействии пропина с избытком брома преимущественно
образуется
1) 1,3-дибромпропан 2) 1,1,2,2-тетрабромпропан
3) 1,1-дибромпропан 4) 2,2-дибромпропан
15. А26 (Дем. вар)
С бромной водой взаимодействует каждое из двух
веществ:
1)
этилен и бензол 2) бутадиен-1,3 и бутан
3) этан и этен 4) бутин-1 и пентадиен-1,3
А27
Реакции, характеризующие основные свойства и способы получения
кислородосодержащих соединений
1.
А27 Этановую кислоту в одну стадию можно получить окислением
1)
этана 2) этиламина 3) этина 4)
этаналя
2.
А27 Диэтиловый эфир в одну стадию получают из
1) этилового спирта 2) 1,2-дихлорэтана
3) этаналя 4) этановой кислоты
3.
А27 При полном гидрировании ацетилена образуется
1) этанол 2) этиленгликоль 3) этен 4) этан
4.
А27 При окислении первичных спиртов оксидом меди (II) образуются
1) простые эфиры 2) альдегиды
3) карбоновые кислоты 4) сложные эфиры
5.
А27 При окислении первичных спиртов оксидом меди (II) образуются
1) простые эфиры 2) альдегиды
3) карбоновые кислоты 4) сложные эфиры
6.
А27 При окислении первичных спиртов оксидом меди (II) образуются
1) простые эфиры 2) альдегиды
3) карбоновые кислоты 4) сложные эфиры
7.
А27 Пропанол-1 образуется в результате взаимодействия
1) 1-хлорпропана со щелочью (водный р-р)
2) пропена со щелочью (водный р-р)
3) пропаналя с водой 4) дихлорпропана с водой
8.
А27 Пропановая кислота образуется в результате взаимодействия
1) пропана с серной кислотой 2) пропена с водой
3) пропаналя с гидроксидом меди (II)
4)
пропанола-1 с азотной кислотой
9.
А27 Шестиатомный спирт образуется при восстановлении водородом
1) гексановой кислоты 2) рибозы 3) гексаналя 4) глюкозы
10.
А27 Практически осуществима реакция между
1) этанолом и уксусной кислотой
2) этаналем и диметиловым эфиром
3) этилацетатом и оксидом меди (II)
4)
этиленгликолем и метаном
11.
А27 Какие два вещества вступили в реакцию, если в результате
образовался бутанол-2?
1) бутин-1 и вода 2) бутин-2 и вода
3) бутен-1 и вода 4) бутен-2 и раствор KMnO4
12.
А27 Глицерин можно получить взаимодействием
1) нитроглицерина и водорода 2) пропина и воды
3) 1,2,3-трихлорпропана и раствора щелочи
4)
пропаналя и водорода
13.
А27 Уксусная кислота образуется при взаимодействии этаналя с
1) этанолом 2) водой 3) водородом 4) гидроксидом меди (II)
14.
А27 Как уксусная кислота, так и фенол реагируют с
1) гидроксидом натрия 2) бромной водой
3) метаналем 4) гидроксидом меди (II)
15. А27 (Дем. вар)
Альдегид получается при гидратации
1)
этина 2) пропина 3)бутина-1 4) пентина-1
1.
А28 Верны ли следующие суждения о правилах безопасности при работе
с горючими веществами?
А. При возгорании веществ, не смешивающихся с водой, тушить их
можно сухим песком.
Б. Загоревшийся натрий нельзя тушить водой.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
2.
А28 Карбонат натрия можно отличить от силиката натрия с помощью
1) фенолфталеина 2) хлорида бария
3) гидроксида кальция 4) соляной кислоты
3.
А28 Качественной реакцией на многоатомные спирты является реакция с
1) кислородом 2) хлороводородом
3) гидроксидом калия 4) гидроксидом меди (II)
4.
А28 Раствор перманганата калия можно использовать для обнаружения
1) циклогексана 2) дихлорэтана 3) гексана 4) этилена
5.
А28 Cильным ядом является
1) сера пластическая 2) сера кристаллическая
3) фосфор красный 4) фосфор белый
6.
А28 Реакция «серебряного зеркала» характерна для каждого из двух
веществ:
1) муравьиной кислоты и уксусной кислоты
2) муравьиной кислоты и формальдегида
3) пропионового альдегида и пропионовой кислоты
4)
уксусного альдегида и уксусной кислоты
7.
А28 Углекислый газ в сосуде можно обнаружить с помощью
1) палочки, смоченной соляной кислотой 2) горящей лучинки
3) влажной фенолфталеиновой бумажки
4)
сухой фенолфталеиновой бумажки
8.
А28 Чтобы отличить муравьиную кислоту от уксусной, используют
1) NaOH (р-р) 2) FeO 3) Ag2O(NH3 р-р) 4) C2H5OH
9.
А28 Реактивом для обнаружения крахмала является
1) гидроксид натрия 2) раствор иода
3) соляная кислота 4) аммиачный раствор оксида серебра
10.
А28 Углекислый газ в сосуде можно обнаружить с помощью
1) палочки, смоченной соляной кислотой 2) бромной воды
3) влажной фенолфталеиновой бумажки
4)
известковой воды
11.
А28 Качественной реакцией на многоатомные спирты является реакция с
1) кислородом 2) хлороводородом
3) гидроксидом калия 4) гидроксидом меди (II)
12.
А28 Качественной реакцией на многоатомные спирты является реакция с
1) кислородом 2) хлороводородом
3) гидроксидом калия 4) гидроксидом меди (II)
13.
А28 Отличить глицерин от этанола можно с помощью
1)
HCl 2) Na 3) NaOH 4) Cu(OH)2
14. А28 (Дем. вар)
Реактивом на многоатомные спирты является
1)
KCl (р-р) 2) Cu(OH)2 (в изб. KOH)
3) Ca(NO3)2 (р-р) 4) Ag2O (в р-ре NH3)
А29
Общие способы получения металлов. Общие научные принципы производства. Основные
методы синтеза ВМС.
1.
Каучук в промышленности получают реакцией полимеризации
1) бутена-2 2) бутадиена-1,3 3) 2-метилпропена 4) бутена-1
2.
Верны ли следующие суждения о получении серной кислоты в
промышленности?
А. Для поглощения SO2 используют
концентрированную H2 SO4
Б. Для осушения оксида серы (IV) используют гидроксид калия.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
3.
Основным компонентом природного газа является
1) этилен 2) ацетилен 3) бензол 4) метан
4.
К реакциям синтеза высокомолекулярных веществ относится
1) гидратация 2) полимеризация 3) гидрогенизация 4) пиролиз
5.
Высокотемпературная переработка нефтепродуктов с образованием
более низкомолекулярных углеводородов имеет название
1) ароматизация 2) крекинг 3) риформинг 4) изомеризация
6.
Крекинг нефтепродуктов осуществляется с целью получения
1) бензина 2) сложных эфиров 3) метана 4) мазута
7.
В качестве сырья для промышленного производства H2 SO4 используют
1) гипс 2) пирит 3) оксид серы (VI) 4) сульфат железа (III)
8.
Только электролизом расплава соли в промышленности можно получить
1)
натрий 2) цинк 3) хром 4) серебро
9.
Для получения аммиака в промышленности в качестве сырья используют
1) Ca и HNO3 2) N2 и H2 3)
NH4Cl и Ca(OH)2 4) CH3NH2 и
HCl
10.
В реакцию полимеризации вступает
1) пропан 2) бутадиен-1,3 3) аминокапроновая кислота 4) метиламин
11.
В промышленности для получения серной кислоты используют
1) пирит 2) поташ 3) селитру 4) соду
12.
Для получения аммиака в промышленности используют
1) хлорид аммония и гидроксид калия 2) нитрат магния и воду
3) карбонат аммония 4) азот и водород
13.
Метанол в промышленности получают
1) взаимодействием оксида углерода (II) и водорода
2) брожением глюкозы 3) пиролизом метана
4) взаимодействием оксида углерода (IV) и водорода
14.
Гидроксид натрия в промышленности получают электролизом
водного раствора: 1) карбоната натрия 2) гидрокарбоната натрия
3) хлорида натрия 4) сульфата натрия
15. (Дем. вар.)
Верны ли следующие суждения о промышленных способах получения металлов?
А. В основе
пирометаллургии лежит процесс восстановления металлов из руд при высоких
температурах.
Б. В промышленности в качестве восстановителей используют оксид
углерода (II) и кокс.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
1. В1 (Дем. вар.)
Установите соответствие между названием вещества и
классом (группой) органических соединений, к которому(-ой) оно
принадлежит.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС (ГРУППА)
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
А) глицерин 1) альдегиды
Б) глицин 2) аминокислоты
В) бутанол-1 3) простые эфиры
Г) толуол 4) спирты
5) углеводороды
6) углеводы
2.
В1 Установите соответствие между названием вещества и классом
(группой) органических соединений, к которому(-ой) оно относится.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС (ГРУППА)
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
А) декан 1)сложные эфиры
Б) метилпропионат 2)углеводороды
В) глицерин 3)спирты
Г) стирол 4)карбоновые кислоты
5) аминокислоты
6) простые эфиры
3.
В1 Установите соответствие между формулой вещества и классом
(группой) рганических соединений, к которому(-ой) оно принадлежит.
ФОРМУЛА ВЕЩЕСТВА КЛАСС (ГРУППА)
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
А) СH3NH2 1)
алкины
Б) C6H6
2) алканы
В) C4H10 3)
альдегиды
Г) C2H5OС2H5
4) амины
5) арены
6) простые эфиры
4.
В1 Установите соответствие между названием органического соединения
и классом, к которому оно относится.
НАЗВАНИЕ СОЕДИНЕНИЯ КЛАСС СОЕДИНЕНИЙ
А) лейцин 1) амины
Б) сорбит 2) аминокислоты
В) бутин 3) углеводороды
Г) циклобутан 4) спирты
5) альдегиды
5.
В1 Установите соответствие между формулой вещества и классом
соединений, к которому оно принадлежит.
ФОРМУЛА ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) C6H5 – CH(NH2) – COOH 1)
нитросоединение
Б) C6H5 – NH – CH3
2) сложный эфир
В) C6H5
– NO2 3) амин
Г) CH2
–– CH –– CH2
| | |
ONO2 ONO2 ONO2
4)
аминокислота
6.
В1 Установите соответствие между названием вещества и классом
(группой) органических соединений, к которому(-ой) оно
принадлежит.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС (ГРУППА) ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
А) толуол 1) спирты
Б) глицерин 2) фенолы
В) этиленгликоль 3) углеводороды
Г) анилин 4) карбоновые кислоты
5) амины
6) простые эфиры
7.
В1 Установите соответствие между названием вещества и классом
(группой) органич. соединений, к которому(-ой) оно принадлежит.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС (ГРУППА)
ОРГАНИЧЕСКИХ ОЕДИНЕНИЙ
А) дифенилметан 1) карбоновые кислоты
Б) рибоза 2) аминокислоты
В) стирол 3) углеводороды
Г) фенилаланин 4) углеводы
5) фенолы
8. В1 Установите
соответствие между названием органического соединения
и классом, к которому оно относится.
НАЗВАНИЕ СОЕДИНЕНИЯ КЛАСС СОЕДИНЕНИЯ
А) бутадиен-1,3 1)
сложные эфиры
Б) гексанол-1 2)
углеводороды
В) фенилаланин 3) спирты
Г) метилформиат 4) карбоновые
кислоты
5) аминокислоты
6) простые эфиры
В6.
Реакции, характеризующие основные свойства и способы получения углеводородов.
Механизмы реакций замещения и присоединения в органической химии. Правило
Марковникова
1.
В6 И для этана, и для этилена возможны реакции
1) с хлором 2) с водой 3) изомеризации
4) разложения 5) горения 6) полимеризации
2.
В6 С толуолом могут реагировать
1) перманганат калия 2) иодоводород 3) хлорметан
4) азотная кислота 5) гидроксид натрия 6) вода
3.
В6 Толуол реагирует с
1) водородом 2) водой 3) цинком
4) азотной кислотой 5) хлороводородом 6) хлором
4.
В6 Для этена характерна(-о):
1) sp-гибридизация атомов углерода
2) наличие двойной связи в молекуле
3) реакция гидрогалогенирования
4) взаимодействие с аммиачным раствором Ag2O
5) реакция изомеризации
6)
взаимодействие с раствором KMnO4
5.
В6 Промежуточное образование карбокатиона CH3 –CH2+
происходит при взаимодействии
1) этена и хлора 2) этена и хлороводорода
3) этилена и водорода 4) этена и брома
5) этилена и бромоводорода
6) этилена и воды в присутствии катализатора
6.
В6 Этан может вступать в реакции
1) замещения 2) присоединения 3) изомеризации
4) разложения 5) горения 6) полимеризации
7.
В6 Для бутадиена-1,3 характерна(-о):
1) sp3-гибридизация атомов углерода
2) твердое состояние (при обычных условиях)
3) взаимодействие с хлором 4) реакция полимеризации
5) взаимодействие с азотом 6) реакция окисления
8.
В6 И для этилена, и для толуола характерно(-а):
1) наличие σ- и π- связей в молекулах
2) sp3-гибридизация атомов углерода в молекуле
3) окисление раствором перманганата калия
4) взаимодействие с аммиачным раствором оксида серебра
5) реакция галогенирования 6) хорошая растворимость в воде
9.
В6 Для пропана характерна(-о):
1) sp3-гибридизация атомов углерода
2) хорошая растворимость в воде
3) реакция нитрования 4) взаимодействие с водородом
5) реакция гидратации 6) взаимодействие с бромом
10.
В6 В отличие от этана, этин вступает в реакции
1) с хлором 2) с хлороводородом 3) с гидроксидом меди (II)
4) с раствором перманганата калия 5) гидратации 6) изомеризации
11.
В6 В соответствии с правилом В.В. Марковникова происходят реакции,
уравнения которых:
1) CH3 –CH ¾CH2
+ HBr→CH3 – CHBr – CH3
R O O R
2)CH3 – CH = CH2 + HBr → CH3– CH2
–CH2Br
H+
3) CH3– CH = CH2 + HOH → CH3 – CH(OH) – CH3
4) CF3 –CH =CH2 +HBr → CF3 –CH2 –CH2Br
Hg2+
5) CH3 –C ≡ CH + HOH → CH3 –CO– CH3
6) CCl3
–CH =CH2 +HBr → CCl3 –CH2 –CH2Br
12.
В6 Реакциями, описывающими механизм хлорирования метана, являются:
1) CH4 →C∙ + 4H∙
2) Cl2 →2Cl ∙
3) CH4 →CH3 + H∙
4) CH4 + Cl∙ →CH3∙ + HCl
5) ∙CH3 + Cl2 →CH3Cl + Cl
∙ 6) CH4 + 4Cl2 →CCl4 + 4HCl
13.
В6 Для пропина характерна(-о):
1) sp2-гибридизация атомов углерода 2) наличие двойной
связи
3) обесцвечивание бромной воды 4) реакция гидратации
5) взаимодействие с Ag2O (NH3 р-р) 6)
реакция изомеризации
14.
В6 Реакция бромирования пропана протекает
1) по радикальному механизму 2) в несколько стадий
3) с разрывом связи в молекуле брома в начале реакции
4) в соответствии с правилом В.В. Марковникова
5) в присутствии катализатора
6) с
преимущественным образованием 1-бромпропана
15. В6 (Дем. вар.)
Реакция бромирования метана протекает
1) по радикальному механизму 2) с образованием H+
3) с образованием различных бромпроизводных
4) в темноте и без нагревания 5) с выделением теплоты
6) в соответствии с правилом В.В. Марковникова
В7.
Реакции, характеризующие основные свойства и способы получения
кислородсодержащих соединений
1.
В7 Сложный эфир может образоваться при взаимодействии
1) метанола с пропанолом-1 2) метанола с метановой кислотой
3) пропионовой кислоты с этанолом 4) ацетальдегида с пропанолом-1
5) формальдегида с фенолом 6) уксусной кислоты с этанолом
2.
В7 При гидролизе сложных эфиров состава С8Н16О2 могут образоваться
1) метановая кислота и пентаналь 2) этановая кислота и гексанол
3) бутаналь и метилацетат 4) пентановая кислота и пропанол
5) этандиол и метанол 6) метановая кислота и гептанол
3.
В7 Для фенола характерна(-о):
1) sp2-гибридизация атомов углерода
2) жидкое агрегатное состояние (н.у.)
3) реакция с бромом 4) реакция гидрогалогенирования
5) взаимодействие с формальдегидом
6)
взаимодействие с углекислым газом
4.
В7 И для этиленгликоля, и для глицерина характерна(-о):
1) sp-гибридизация атомов углерода
2) хорошая растворимость в воде
3) наличие водородных связей между молекулами
4) взаимодействие с натрием
5) взаимодействие с бромной водой
6)
взаимодействие с водородом
5.
В7 Для пропанола характерна(-о):
1) sp2-гибридизация атомов углерода
2) твердое агрегатное состояние (н.у.)
3) существование изомеров 4) взаимодействие с натрием
5) реакция полимеризации 6) реакция этерификации
6.
В7 Для метилового спирта характерна(-о):
1) sp3-гибридизация атома углерода 2) плохая растворимость в воде
3) взаимодействие с медью 4) взаимодействие с водородом
5) реакция этерификации 6) реакция с оксидом меди (II)
7.
В7 Муравьиная кислота реагирует с
1) C2H5OH
2) Ag2O (NH3 (р-р))
3) ртутью
4) Cu(OH)2 5) C6H5СН3
6) NaCl
8.
В7 Метанол реагирует с
1) оксидом меди (II) 2) натрием 3) гидроксидом меди (II)
4) уксусной кислотой 5) водородом 6) диэтиловым эфиром
9.
В7 Ацетальдегид реагирует с
1) водородом 2) гидроксидом меди (II) 3) нитробензолом
4) хлоридом железа (III) 5) этаном 6) кислородом
10.
В7 Этиленгликоль реагирует с
1)
Na 2) CH4 3) Cu(OH)2 4) HBr 5)
NaCl 6) CH3 – O – CH3
11.
В7 С пропановой кислотой может взаимодействовать
1) ацетальдегид 2) глицерин 3) пропаналь
4) пропанол-2 5) пропанол-1 6) диэтиловый эфир
12.
В7 Метанол может взаимодействовать с
1) бромоводородом 2) гидроксидом цинка 3) этанолом
4) бромной водой 5) железом 6) масляной кислотой
13.
В7 Муравьиная кислота реагирует с
1) C2H5OH
2) [Ag(NH3)2]OН 3) HBr 4) Cu(OH)2
5)
C6H5OH 6) NaCl
14.
В7 Фенол реагирует с
1)
HCOH 2) CH3COONa 3) Cu 4) NaOH 5) Br2
6) KBr
15. В7 (Дем. вар.)
В отличие от фенола метанол
1)
взаимодействует с растворами щелочей
2) вступает в реакции поликонденсации
3) взаимодействует с бромоводородом
4) при окислении образует формальдегид
5) вступает в реакции этерификации
6) реагирует с хлоридом железа (III)
В8.Реакции, характеризующие основные свойства и способы получения
азотсодержащих соединений. Амины. Аминокислоты как амфотерные органические
соединения. Биологически важные вещества: жиры, углеводы (моносахариды,
дисахариды), жиры
1.
В8 Аланин может реагировать с
1) этаном 2) гидроксидом калия 3) хлоридом калия
4) серной кислотой 5) диметиловым эфиром 6) аммиаком
2.
В8 Аминоуксусная кислота взаимодействует с
1) этиленом 2) гидроксидом кальция 3) водородом
4) азотной кислотой 5) аминопропионовой кислотой
6) оксидом кремния (IV)
3.
В8 Аминобутановая кислота может взаимодействовать с
1) оксидом кремния 2) бутадиеном-1,3 3) соляной кислотой
4) гидроксидом калия 5) сульфатом натрия 6) пропанолом
4.
В8 Какие утверждения справедливы для пропиламина?
1) растворяется в воде
2) водный раствор пропиламина имеет слабокислую среду
3) реагирует с бромоводородной кислотой
4) при нагревании реагирует с С2H4
5) пары пропиламина тяжелее воздуха
6) как и другие амины, не имеет запаха
5.
В8 И метиламин, и фениламин
1) хорошо растворяются в воде
2) имеют сильно щелочную среду водного раствора
3) реагируют с азотной кислотой
4) взаимодействуют с Ca(OH)2
5) горят в атмосфере кислорода
6) относятся к первичным аминам
6.
В8 Вещество состава: NH2CH2CH(CH3)COOH
взаимодействует с
1) соляной кислотой 2) хлоридом калия
3) гидроксидом калия 4) этиловым спиртом
5) изобутаном 6) оксидом углерода (II)
7.
В8 Глицин взаимодействует с
1) гидроксидом калия 2) водородом 3) бензолом
4) метанолом 5) серной кислотой 6) метаном
8.
В8 Аминопропионовая кислота, в отличие от диэтиламина, реагирует с
1) гидроксидом калия 2) кислородом 3) фтором
4) гидроксидом бария 5) водородом 6) магнием
9.
В8 Аминомасляная кислота, в отличие от пропиламина, реагирует с
1) этанолом 2) кислородом 3) кальцием
4) гидроксидом натрия 5) азотной кислотой 6) хлороводородом
10.
В8 И пропиламин, и метиламин
1) растворяются в воде 2) имеют изомеры
3) при взаимодействии с серной кислотой образуют соли
4) не проявляют восстановительных свойств
5) относятся к вторичным аминам
6) при горении на воздухе образуют азот
11.
В8 Первичные амины взаимодействуют с
1) водородом 2) хлороводородом 3) серой
4) хлорметаном 5) этиленом 6) серной кислотой
12.
В8 И метиламин, и фениламин реагируют с
1) гидроксидом калия 2) водородом 3) азотной кислотой
4) кислородом 5) бромной водой 6) хлороводородом
13.
В8 Этиламин взаимодействует с
1) уксусной кислотой 2) бензолом 3) водой
4) кислородом 5) метаном 6) гидроксидом лития
14.
В8 И аминопропионовая кислота, и диметиламин
1) вещества кристаллические
2) реагируют с гидроксидом алюминия
3) реагируют как с азотной, так и с серной кислотами
4) окрашивают лакмус в красный цвет
5) могут проявлять оснóвные свойства за счет NH2-группы
6) могут окисляться кислородом
15. В8 (Дем. вар.) Диметиламин
1) твердое
вещество
2) плохо растворим в воде
3) взаимодействует с серной кислотой
4) образуется при восстановлении нитросоединений
5) реагирует с бромметаном
6) горит на воздухе
.
08
32. Цепочки реакций по органической химии
Вспоминай формулы по каждой теме
Решай новые задачи каждый день
Вдумчиво разбирай решения
ШКОЛКОВО.
Готовиться с нами — ЛЕГКО!
Подтемы раздела
органическая химия
.0110. Классификация и номенклатура органических веществ
.0211. Строение органических веществ
.0312. Химические свойства углеводородов и кислородсодержащих органических соединений
.0413. Химические свойства азотсодержащих органических соединений (амины, аминокислоты)
.0514. Химические свойства углеводородов
.0615. Химические свойства кислородсодержащих органических соединений
.0716. Взаимосвязь классов органических соединений
.0832. Цепочки реакций по органической химии
.0934. Установление молекулярной и структурной формулы вещества
Решаем задачи
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Показать ответ и решение

Показать ответ и решение