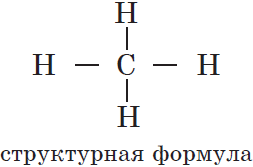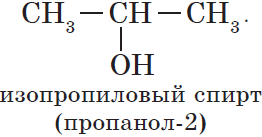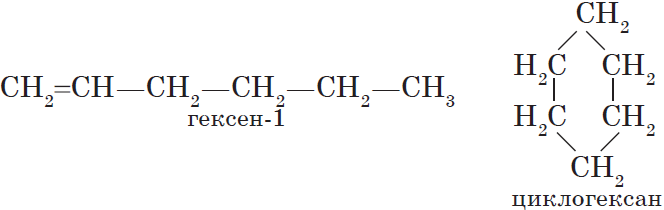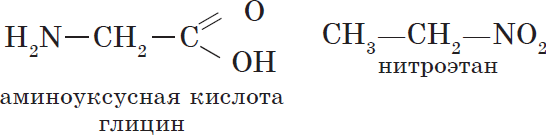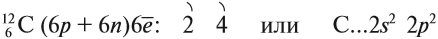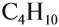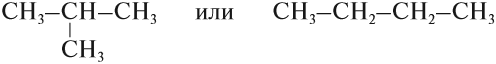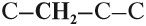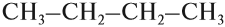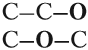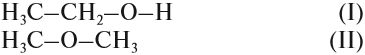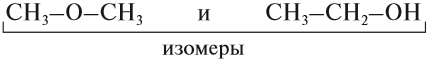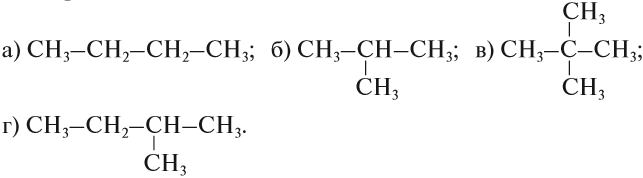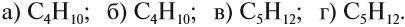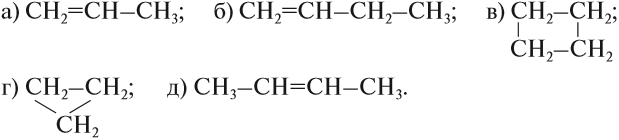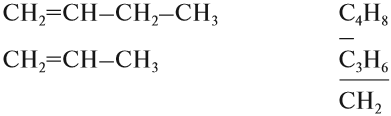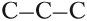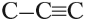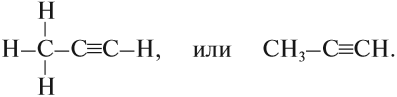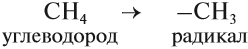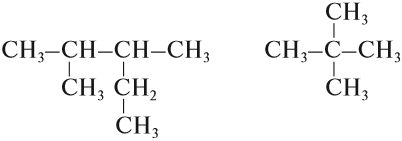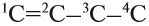| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| 1.1 | Современные представления о строении атома | |
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов. | |
| 1.2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | |
| 1.2.1 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической таблицы химических элементов. | |
| 1.2.2 | Общая характеристика металлов IА–IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И.Менделеева и особенностям строения их атомов. | |
| 1.3 | Химическая связь и строение вещества | |
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов. | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения. | |
| 1.4 | Химическая реакция | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии. | |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения. | |
| 1.4.3 | Скорость реакции, ее зависимость от различных факторов. | |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | |
| 1.4.6 | Реакции ионного обмена. | |
| Особенности взаимодействия кислых солей со щелочами. | ||
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. | |
| Необратимый гидролиз бинарных соединений. | ||
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. | |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей,кислот). | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). | |
| 2.2 | Химические свойства простых веществ — металлов | |
| 2.2.1 | Характерные химические свойства щелочных металлов. | |
| 2.2.2 | Характерные химические свойства бериллия, магния и щелочноземельных металлов. | |
| 2.2.3 | Характерные химические свойства алюминия. | |
| 2.2.4 | Химические свойства переходных металлов (меди, цинка, хрома, железа). | |
| 2.3 | Химические свойства простых веществ — неметаллов | |
| 2.3.1 | Химические свойства водорода и галогенов. | |
| 2.3.2 | Химические свойства кислорода и серы. | |
| 2.3.3 | Химические свойства азота и фосфора. | |
| 2.3.4 | Химические свойства углерода и кремния. | |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных. | |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов. | |
| 2.6 | Характерные химические свойства кислот. | |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка). | |
| 3 | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная). | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). | |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6 | Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. | |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. | |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахарады, дисахариды, полисахариды) | |
| 3.8.1 | Жиры. | |
| 3.8.2 | Белки. | |
| 3.8.3 | Углеводы (моносахариды, дисахариды, полисахариды). | |
| 3.9 | Взаимосвязь органических соединений. | |
| 4 | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1 | Экспериментальные основы химии | |
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. | |
| 4.1.2 | Методы разделения смесей и очистки веществ. | |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы. | |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы. | |
| 4.1.5 | Качественные реакции органических соединений. | |
| 4.1.7 | Основные способы получения углеводородов. | |
| 4.1.8 | Основные способы получения кислородсодержащих соединений. | |
| 4.2 | Общие представления о промышленных способах получения важнейших веществ | |
| 4.2.1 | Понятие о металлургии: общие способы получения металлов. | |
| 4.2.2.1 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). | |
| 4.2.3 | Природные источники углеводородов, их переработка. | |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. | |
| 4.3 | Рачеты по химическим формулам и уравнениям реакций | |
| 4.3.1 | Расчеты с использованием понятия «массовая доля вещества в растворе». | |
| 4.3.2 | Расчеты объемных отношений газов при химических реакциях. | |
| 4.3.3 | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. | |
| 4.3.4 | Расчеты теплового эффекта реакции. | |
| 4.3.5 | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). | |
| 4.3.6 | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. |
МАОУ многопрофильный лицей №20
г. Ульяновск
Краткая памятка—шпаргалка по органической химии
(для подготовки к ЕГЭ)
Составитель Селезнева Ольга Николаевна
учитель химии
высшей категории
Алканы: 1) замещение (R
0
, + Q, в 3 стадии) + галоген(не бромная вода); + азотная кислота
2) разложение
—крекинг (+ термический крекинг метана до ацетилена)
—дегидрирование
3) изомеризация (AlCl
3
) – c бутана
4) окисление на кат—ре (метан + О
2
до формальдегида, бутан до уксусной кислоты)
Алкены: 1) присоединение (по ионному механизму с образованием карбокатиона)
+ галоген, + галогеноводород, + вода (по правилу Марковникова для несимметричных алкенов)
2) полимеризация –R
3) окисление с KMnO
4
—в нейтральной среде при комнатной t до двухатомных спиртов
—при повышенной t и в кислой среде до карбоновых кислот (кетонов) или СО
2
(с разрывом цепи по двойной связи)
—в щелочной среде до солей
4) замещение по R при 500ºС
Алкины: 1) присоединение
+галоген, + галогеноводород, + вода (до этаналя и кетонов!)
димеризация до винилацетилена
тримеризация до бензола и его гомологов
2) окисление – ацетилен до щавелевой кислоты или её соли, остальные до карбоновых кислот и СО
2
(или солей)
3) замещение для НС≡СR + Na, + [Ag(NH
3
)
2
]OH , +[Cu(NH
3
)
2
]Cl
Арены: 1) замещение
+ галоген – в присутствии kat в кольце (монохлорбензол или 2,4,6—для гомологов); на свету для гомологов – в боковой
цепи (но не с бромной водой!)
+ азотная кислота
+ монохлоралкан (алкилирование)
2) р—ии присоединения
+ водород, + хлор на свету для бензола, + алкен (алкилирование в кислой среде)
3) р—ии окисления только для гомологов бензола до бензойной кислоты или солей.
Спирты: 1) + акт. Ме до алкоголятов (метилат,этилат) (О – Н)
2) + галогеноводород (С – О)
3) дегидратация до алкена (С – О) или до простого эфира (С – О и О – Н)
4) этерификация с карбоновыми кислотами и HNO
3
, H
2
SO
4
(О – Н)
5) окисление оксидом меди (II) до альдегида (первичный спирт) или кетона (вторичный спирт)
6) для многоатомных спиртов + Cu(OH)
2
Фенол: 1) + акт. Ме 2) + щёлочь в отличие от спиртов! 3) + бромная вода 4) + HNO
3
5) FeCl
3
6) + формальдегид;
легко окисляется.
Альдегиды: 1) окисление + Cu(OH)
2
;
+ [Ag(NH
3
)
2
]OH; + KMnO
4
2) присоединение + Н
2
; + спирт; + вода; + гидросульфит натрия
3) замещение по R
4) поликонденсация – формальдегид + фенол; 5) полимеризация для метаналя и этаналя
Карбоновые кислоты: 1) общие свойства кислот + Ме до Н; + МеО; + МеОН; + аммиак; + соли более слабых кислот (карб, силик,
фенолят)
2) + спирт (этерификация)
3) замещение по R с галогенами (не с бромной водой) 4) – Н
2
О → ангидрид
Муравьиная кислота + окисление + Cu(OH)
2
;
+ [Ag(NH
3
)
2
]OH; + KMnO
4
+ разложение до СО и Н
2
О в присутствии конц. серной кислоты
+Сl
2
→ HCl + CO
Олеиновая кислота +H
2
; +Br
2
; + KMnO
4
Щавелевая кислота под действием H
2
SO
4
разлагается до СО, СО
2
, Н
2
О
Амины (основные свойства): 1) + вода для низших аминов
2) + кислота, ZnCl
2
(кислая среда)
3) + монохлоралкан
4) + HNO
2
→ спирт + азот + вода (для низших аминов)
Анилин (очень слабое основание—нейтральная среда) + бромная вода, HNO
3
; легко окисляется
Аминокислоты (амфотерные свойства): 1) + кислота 2) + щёлочь +Ме до Н; + МеОН; + соль более слабых кислот; + аммиак
3) + спирт
4) + аминокислота → пептиды (поликонденсация)
Глюкоза (свойства альдегидов и многоатомных спиртов): 1) окисление + Cu(OH)
2
при нагревании
;
+[Ag(NH
3
)
2
]OH;
2) присоединение + водород
→ сорбит
3) + кислота карбоновая, ангидрид уксусной кислоты, серная; азотная 4) + спирт
5) брожение – спиртовое, молочнокислое, маслянокислое
6) качественная реакция на многоатомные спирты с Cu(OH)
2
без нагревания!
Сахароза: 1) + Н
2
О (гидролиз)
2) + Cu(OH)
2
как многоатомный спирт без нагревания! 3) + Cа(OH)
2
4) + кислота карбоновая, серная, азотная
Целлюлоза и крахмал: 1) + вода (гидролиз)
2) + карбоновая кислота или ангидрид, + серная кислота, + азотная кислота
3) крахмал + йод → синее окрашивание
Белки: 1) гидролиз; 2) ксантопротеиновая реакция с HNO
3
– жёлтое окрашивание; 3) биуретовая реакция с CuSO
4
и NaOH –
фиолетовое окрашивание
Список литературы:
1. Д.Д. Дзудцова, Л.Б. Бестаева «Окислительно—восстановительные реакции» — Москва,
«Дрофа», 2005
2. Н. Кузьменко, В. Еремин, В. Попков «Химия для школьников старших классов и
поступающих в вузы» — Москва, «Дрофа», 1999
3. Р.А. Лидин, Л. Ю. Аликберова «Справочник для старшеклассников и поступающих в вузы»
— Москва, «Аст—пресс»,2012
4. В.М. Потапов «Органическая химия» — Москва, «Просвещение», 1983
5. «Органическая химия» под редакцией Тюкавкиной – Москва, «Медицина». 1989
12 сентября 2022
В закладки
Обсудить
Жалоба
Памятка по органической химии
Таблица.
pm-h.doc
pm-h.pdf
Класс | Химические свойства | Способы получения
Алканы
Алкены
Алкины
Алкадиены
Арены
Предельные одноатомные спирты
Многоатомные спирты
Альдегиды
Предельные одноосновные карбоновые кислоты
Моносахариды
Дисахариды
Полисахариды
Амины
Аминокислоты
Белки
Автор: Столярова В.А.
Органическая химия – это химия углерода и его соединений с другими элементами.
В молекулах органических веществ могут присутствовать также атомы: водорода Н, кислорода О, азота N, серы S, фосфора P, галогенов, металлов и других элементов.
Количество известных органических соединений в настоящее время превышает 20 миллионов.
Углерод в органических веществах
Атомы углерода могут соединяться друг с другом с образованием цепей различного строения (разветвленные, неразветвленные, замкнутые) и длины (от двух до сотен тысяч атомов углерода).
В органических веществах углерод имеет валентность IV (образует 4 связи).
- Атом углерода может образовывать одинарные, двойные и тройные связи.
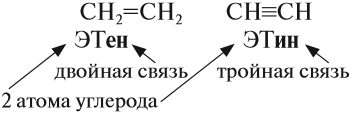
CH3-CH3 CH2=CH2 CH≡CH
В основе современной органической химии лежит теория строения органических соединений.
Основные положения теории строения органических соединений
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения).
- Свойства веществ зависят не только от вида и числа атомов в молекуле, но и от их взаимного расположения – т.е. от строения молекулы.
Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т. е. к появлению изомерии.
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
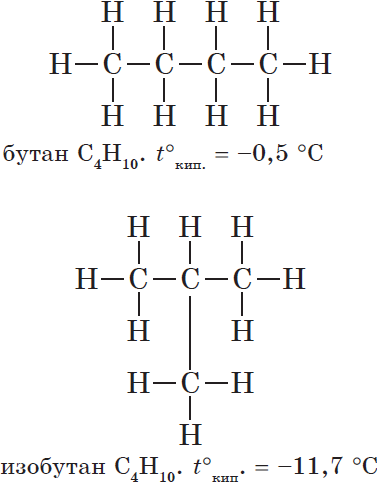
| Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилпропан) с разветвленным скелетом | |
|
н-Бутан CH3-CH2-CH2-CH3 |
Изобутан CH3-CH(CH3)-CH3 |
При этом температура кипения н-бутана -0,5оС, а изобутана -11,4оС.
- По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы – определить свойства.
- Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Это отражается на химических и физических свойствах вещества.
Формулы строения органических веществ
Состав органического вещества можно описать химическими формулами.
Химические формулы органических веществ бывают следующих типов:
Простейшая формула – может быть получена опытным путем через определение соотношения количества атомов химических элементов в веществе.
Например, простейшая формула метана CH4, а вот бензола – СН.
Истинная формула (брутто-формула) – показывает истинный состав молекулы, но не показывает ее структуру. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле.
Например, истинная формула бензола C6H6.
Полная (развернутая) структурная формула однозначно описывает порядок соединения атомов в молекуле.
Например, полная структурная формула бутана:
Сокращенная структурная формула – это структурная формула, в которой не указываются связи между углеродом и водородом.
Например, сокращенная структурная формула бутана:
CH3-CH2-CH2-CH3
Типы углеродных атомов в составе органических молекул
Типы углеродных атомов в составе органических молекул
|
Атомы углерода |
|||
| Первичные | Вторичные | Третичные | Четвертичные |
| Атомы углерода, которые в углеродной цепи соединены с одним атомом углерода | Атомы углерода, которые в углеродной цепи соединены с двумя атомами углерода | Атомы углерода, которые в углеродной цепи соединены с тремя атомами углерода | Атомы углерода, которые в углеродной цепи соединены с четырьмя атомами углерода |
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов.
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
Виды σ-связей
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь
С–С, С–Н, С–О |
Двойная связь
С=С, С=О |
Тройная связь
С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s22s22p2
+6С 1s 2s
2p
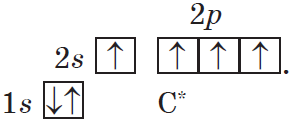
В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С* 1s22s12p3
+6С* 1s2 2s1
2p3
Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы.
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp3, sp2 и sp-гибридизация.
sp3-Гибридизация
В sp3-гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp3-гибридные орбитали:
Изображение с портала orgchem.ru
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
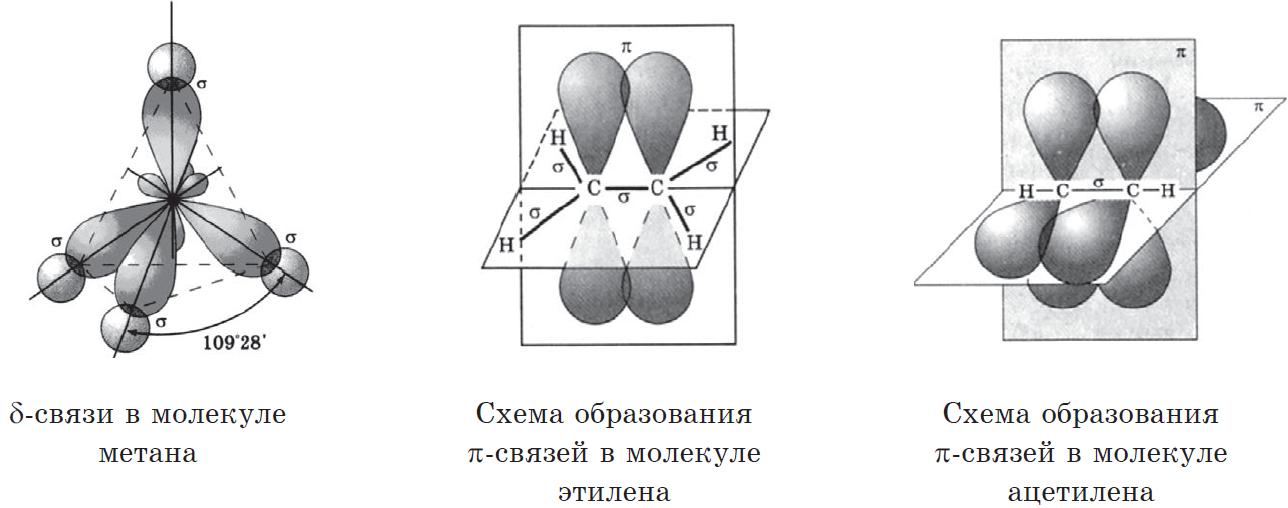
Поэтому четыре гибридные орбитали углерода в состоянии sp3-гибридизации направлены в пространстве под углом 109о 28’ друг к другу, что соответствует тетраэдрическому строению.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109о 28’
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Например, пространственное строение н-бутана
sp2-Гибридизация
В sp2-гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три sp2-гибридные орбитали атома углерода направлены в пространстве под углом 120о друг к другу, что соответствует плоскому строению (треугольник).
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp2— орбитали.
Изображение с портала orgchem.ru
Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp2-гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей.
Модель молекулы этилена:
sp-Гибридизация
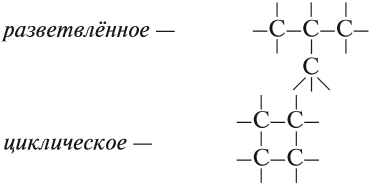
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180о друг к другу, что соответствует линейному строению.
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
Например, молекула ацетилена имеет линейное строение.
Изомерия
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
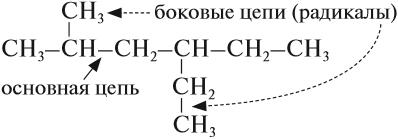
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
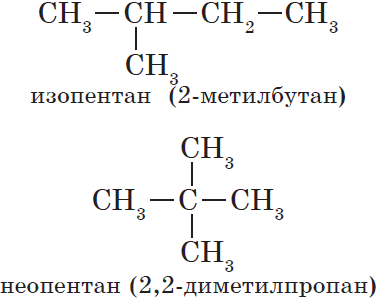
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия)
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
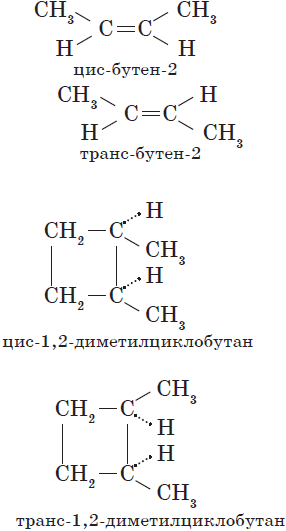
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле.
Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ.
|
Классификация органических веществ по составу |
||
| Углеводороды | Кислородсодержащие вещества | Азотсодержащие вещества |
| Состоят из атомов углерода и водорода | Содержат также атомы кислорода | Содержат также атомы азота |
Углеводороды
Углеводороды– это вещества, состав которых отражается формулой СхНу, то есть в их составе только атомы углерода и водорода.
В зависимости от типа связей между атомами С, они делятся на предельные или насыщенные (все связи одинарные) и непредельные (ненасыщенные) — в молекуле присутствуют двойные и тройные связи.
Кроме того, углеводороды делятся на циклические (углеродная цепь образует кольцо) и ациклические или алифатические (углеродная цепь не замкнута в кольцо).
| Углеводороды | |||||
| Предельные (содержат только одинарные связи) | Непредельные (содержат двойные или тройные связи между атомами углерода) | ||||
| Алканы | Циклоалканы | Алкены | Алкадиены | Алкины | Ароматические углеводороды |
| Углеводороды с открытой (незамкнутой) углеродной цепью | Атомы углерода соединены в замкнутый цикл | Одна двойная связь | Две двойные связи | Одна тройная связь | Циклические углеводороды с тремя двойными связями (бензольное кольцо) |
| CnH2n+2 | CnH2n | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n-6 |
| Этан
CH3-CH3 |
Циклобутан
|
Этилен
CH2=CH2 |
Дивинил
CH2=CН-СН=СH2 |
Ацетилен
СН≡СН |
Бензол
|
| Ациклические углеводороды | |
| С неразветвленной цепью | С разветвленной углеродной цепью |
| н-Бутан
CH3-CH2-CH2-CH3 |
Изобутан
|
Кислородсодержащие органические вещества
Так как кислород имеет валентность II, он может образовать либо 2 одинарные связи, либо одну двойную. Соответственно, в органической молекуле он соединяется с водородом и углеродом.
- группа –О-Н (гидроксильная)
- группа >С=О (карбонильная)
- группа –СОО- (карбоксильная)
|
Кислородсодержащие органические вещества |
|||||
| Группа ОН | Группа С=О | Группа -СОО- | |||
| Гидроксил | Карбонил | Карбоксил | |||
| Спирт | Фенол | Альдегид | Кетон | Карбоновая кислота | Сложный эфир |
| R-OH |  |
 |
 |
 |
|
| Метанол
CH3-OH |
Фенол
|
Ацетальдегид
|
Пропанон
|
Уксусная кислота
|
Метилацетат
|
Азотсодержащие органические вещества
Азотсодержащие вещества можно также разделить на классы по наличию определенных функциональных групп.
- амины – содержат группы –NН2, –NH–, либо -N< ,
- нитрилы (группа –СºN),
- азотистые гетероциклы.
Некоторые органические вещества содержат и азот, и кислород.
К ним относятся:
- нитросоединения –NO2
- амиды –CONH2,
- аминокислоты – полифункциональные соединения, которые содержат и карбоксильную группу –COOH, и аминогруппу –NH2
| Азотсодержащие вещества | |||||
| Амины | Нитрилы | Нитросоединения | Амиды | Аминокислоты | Гетероциклы |
| -NH2
-NH- -N< |
-C≡N | R-NO2 | R-C(NH2)=O | -NH2, -COOH | |
| Метиламин
CH3-NH2 |
Нитрил уксусной кислоты
CH3-C≡N |
Нитрометан
CH3-NO2 |
Амид уксусной кислоты
CH3-C(NH2)=O |
Аминоуксусная кислота
CH2(NH2)-COOH |
Пиррол
|
Другие органические вещества
Органические соединения очень многочисленны и разнообразны.
К важным классам органических соединений также относятся галогенопроизводные органические вещества R–Hal ,которые содержат также атомы галогенов (хлора, фтора, брома и др.).
В состав органических соединений также могут входить несколько одинаковых или различных функциональных групп.
Гомологи. Гомологический ряд
Органические вещества разных классов тесно взаимосвязаны.
Соединения, содержащие одинаковые функциональные свойства, проявляют схожие химические и физические свойства.
Вещества, которые содержат одинаковые функциональные группы, имеют сходное строение, но отличаются друг от друга на одну или несколько групп –СH2–, образуют гомологический ряд.
Гомологи – это вещества, которые входят в один и тот же гомологический ряд.
Группу –СH2– называют гомологической разностью.
Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Теория химического строения органических соединений А. М. Бутлерова
Подобно тому, как для неорганической химии основой развития являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, для органической химии основополагающей стала теория строения органических соединений А. М. Бутлерова.
Основным постулатом теории Бутлерова является положение о химическом строении вещества, под которым понимается порядок, последовательность взаимного соединения атомов в молекулы, т.е. химическая связь.
Под химическим строением понимают порядок соединения атомов химических элементов в молекуле согласно их валентности.
Этот порядок может быть отображен при помощи структурных формул, в которых валентности атомов обозначаются черточками: одна черточка соответствует единице валентности атома химического элемента. Например, для органического вещества метана, имеющего молекулярную формулу $СН_4$, структурная формула выглядит так:
Основные положения теории А. М. Бутлерова
- Атомы в молекулах органических веществ связаны друг с другом согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи.
- Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т. е. химическим строением вещества.
- Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
Теория строения органических соединений является динамичным и развивающимся учением. По мере развития знаний о природе химической связи, о влиянии электронного строения молекул органических веществ стали пользоваться, кроме эмпирических и структурных, электронными формулами. В таких формулах указывают направление смещения электронных пар в молекуле.
Квантовая химия и химия строения органических соединений подтвердили учение о пространственном направлении химических связей (цис- и трансизомерия), изучили энергетические характеристики взаимных переходов у изомеров, позволили судить о взаимном влиянии атомов в молекулах различных веществ, создали предпосылки для прогнозирования видов изомерии и направления и механизма протекания химических реакций.
Органические вещества имеют ряд особенностей:
- В состав всех органических веществ входят углерод и водород, поэтому при горении они образуют углекислый газ и воду.
- Органические вещества построены сложно и могут иметь огромную молекулярную массу (белки, жиры, углеводы).
- Органические вещества можно расположить в ряды сходных по составу, строению и свойствам гомологов.
- Для органических веществ характерной является изомерия.
Изомерия и гомология органических веществ
Свойства органических веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле.
Изомерия — это явление существования разных веществ — изомеров с одинаковым качественным и количественным составом, т.е. с одинаковой молекулярной формулой.
Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Структурная изомерия
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Как уже было показано, молекулярной формуле $С_4Н_{10}$ соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода $С_5Н_{12}$ возможны три изомера: пентан, изопентан и неопентан:
$СН_3—СН_2—{СН_2}↙{пентан}—СН_2—СН_3$
С увеличением числа атомов углерода в молекуле число изомеров быстро растет. Для углеводорода $С_{10}Н_{22}$ их уже $75$, а для углеводорода $С_{20}Н_{44}$ — $366 319$.
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы:
$CH_2={CH-CH_2}↙{бутен-1}-CH_3$ $CH_3-{CH=CH}↙{бутен-2}-CH_3$
${CH_3-CH_2-CH_2-OH}↙{н-пропиловый спирт(пропанол-1)}$
Изомерия различных классов органических соединений (межклассовая изомерия) обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих к разным классам. Так, молекулярной формуле $С_6Н_{12}$ соответствует ненасыщенный углеводород гексен-1 и циклический углеводород циклогексан:
Изомерами являются углеводород, относящийся к алкинам, — бутин-1 и углеводород с двумя двойными связями в цепи бутадиен-1,3:
$CH≡C-{CH_2}↙{бутин-1}-CH_2$ $CH_2={CH-CH}↙{бутадиен-1,3}=CH_2$
Диэтиловый эфир и бутиловый спирт имеют одинаковую молекулярную формулу $С_4Н_{10}О$:
${CH_3CH_2OCH_2CH_3}↙{text»диэтиловый эфир»}$ ${CH_3CH_2CH_2CH_2OH}↙{text»н-бутиловый спирт (бутанол-1)»}$
Структурными изомерами являются аминоуксусная кислота и нитроэтан, отвечающие молекулярной формуле $С_2Н_5NO_2$:
Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
Пространственная изомерия
Пространственная изомерия подразделяется на два вида: геометрическую и оптическую. Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Обозначения цис- и транс- обычно относят к паре одинаковых заместителей:
Геометрические изомеры различаются по физическим и химическим свойствам.
Оптическая изомерия возникает, если молекула несовместима со своим изображением в зеркале. Это возможно, когда у атома углерода в молекуле четыре различных заместителя. Этот атом называют асимметрическим. Примером такой молекулы является молекула $α$-аминопропионовой кислоты ($α$-аланина) $СН_3СН(NH_2)COOH$.
Молекула $α$-аланина ни при каком перемещении не может совпасть со своим зеркальным отражением. Такие пространственные изомеры называются зеркальными, оптическими антиподами, или энантиомерами. Все физические и практически все химические свойства таких изомеров идентичны.
Изучение оптической изомерии необходимо при рассмотрении многих реакций, протекающих в организме. Большинство этих реакций идет под действием ферментов — биологических катализаторов. Молекулы этих веществ должны подходить к молекулам соединений, на которые они действуют, как ключ к замку, следовательно, пространственное строение, взаимное расположение участков молекул и другие пространственные факторы имеют для течения этих реакций большое значение. Такие реакции называются стереоселективными.
Большинство природных соединений являются индивидуальными энантиомерами, и их биологическое действие резко отличается от свойств их оптических антиподов, полученных в лаборатории. Подобное различие в биологической активности имеет огромное значение, так как лежит в основе важнейшего свойства всех живых организмов — обмена веществ.
Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению и химическим свойствам, где каждый член отличается от предыдущего на гомологическую разность $CH_2$. Например: $CH_4$ — метан, $C_2H_6$ — этан, $C_3H_8$ — пропан, $C_4H_{10}$ — бутан и т. д.
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ.
В органических соединениях углерод всегда четырехвалентен. В возбужденном состоянии в его атоме происходит разрыв пары $2s^3$-электронов и переход одного из них на р-орбиталь:
Такой атом имеет четыре неспаренных электрона и может принимать участие в образовании четырех ковалентных связей.
На основании приведенной электронной формулы валентного уровня атома углерода можно было бы ожидать, что на нем находится один $s$-электрон (сферическая симметричная орбиталь) и три $р$-электрона, имеющих взаимно перпендикулярные орбитали ($2р_х, 2р_у, 2p_z$-орбиталь). В действительности же все четыре валентных электрона атома углерода полностью эквивалентны и углы между их орбиталями равны $109°28’$. Кроме того, расчеты показывают, что каждая из четырех химических связей углерода в молекуле метана ($СН_4$) на $25%$ является $s-$ и на $75%$ — $p$-связью, т.е. происходит смешивание $s-$ и $р-$состояний электронов. Это явление называют гибридизацией, а смешанные орбитали — гибридными.
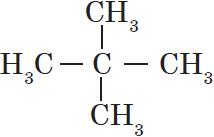
Атом углерода в $sp^3$-валентном состоянии имеет четыре орбитали, на каждой из которых находится по одному электрону. В соответствии с теорией ковалентной связи он имеет возможность образовывать четыре ковалентные связи с атомами любых одновалентных элементов ($СН_4, CHCl_3, CCl_4$) или с другими атомами углерода. Такие связи называются $σ$-связями. Если атом углерода имеет одну $С—С$ связь, то он называется первичным ($Н_3С—СН_3$), если две — вторичным ($Н_3С—СН_2—СН_3$), если три — третичным (
Одной из характерных особенностей атомов углерода является их способность образовывать химические связи за счет обобщения только $р$-электронов. Такие связи называются $π$-связями. $π$-связи в молекулах органических соединений образуются только в присутствии $σ$-связей между атомами. Так, в молекуле этилена $Н_2С=СН_2$ атомы углерода связаны $σ-$ и одной $π$-связью, в молекуле ацетилена $НС=СН$ — одной $σ-$ и двумя $π$-связями. Химические связи, образовавшиеся с участием $π$-связей, называются кратными (в молекуле этилена — двойная, в молекуле ацетилена — тройная), а соединения с кратными связями — ненасыщенными.
Явление $sp^3$-, $sp^2$- и $sp$ — гибридизации атома углерода.
При образовании $π$-связей изменяется гибридное состояние атомных орбиталей атома углерода. Так как образование $π$-связей происходит за счет р-электронов, то в молекулах с двойной связью электроны будут иметь $sp^2$-гибридизацию (была $sp^3$, но один р-электрон отходит на $π$-орбиталь), а с тройной — $sp$-гибридизацию (два р-электрона отошли на $π$-орбиталь). Характер гибридизации изменяет направленность $σ$-связей. Если при $sp^3$-гибридизации они образовывают пространственно разветвленные структуры ($а$), то при $sp^2$-гибридизации все атомы лежат в одной плоскости и углы между $σ$-связями равны $120°$(б), а при $sp$-гибридизации молекула линейна (в):
При этом оси $π$-орбиталей перпендикулярны оси $σ$-связи.
Как $σ$-, так и $π$-связи являются ковалентными, значит, должны характеризоваться длиной, энергией, пространственной направленностью и полярностью.
Характеристики одинарных и кратных связей между атомами С.
| Молекула | Тип гибридизации | Валентный угол | Длина связи, нм | Энергия связи, кДж/моль |
| $CH_3-CH_3$ | $sp^3$ | $109°5’$ | $0.154$ | $369$ |
| $CH_2=CH_2$ | $sp^2$ | $120°$ | $0.134$ | $712$ |
| $CH≡CH$ | $sp^3$ | $180°$ | $0.120$ | $962$ |
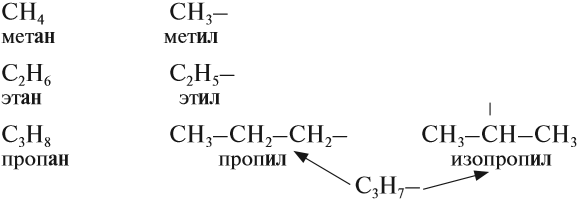
Радикал. Функциональная группа.
Одной из особенностей органических соединений является то, что в химических реакциях их молекулы обмениваются не отдельными атомами, а группами атомов. Если эта группа атомов состоит только из атомов углерода и водорода, то она называется углеводородным радикалом, если же она имеет атомы других элементов, то она называется функциональной группой. Так, например, метил ($СН_3$—) и этил ($С_2Н_5$—) являются углеводородными радикалами, а оксигруппа (—$ОН$), альдегидная группа (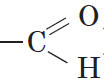
Как правило, функциональная группа определяет химические свойства органического соединения и поэтому является основой их классификации.
1 лист.
Реакции к основным темам курса 10 класса (для запоминания), проф. класс.
1. Алканы (предельные, насыщенные). Общая формула – СпН2п+2.
М (СпН2п+2)=(14п+2)г/моль, σ-связи, SP3-гибридизация, <109’28», тетраэдр.
1. р.галогенирования (р. замещения по радикальному механизму) проходит на свету: R-Н + Вr2 →R-Вr + НВr (галогены только в газообразном состоянии);
2. р. нитрования – р. Коновалова (р. замещения, радик. мех-зм):
R-Н + НО – NО2(разб) −→ R-NО2 + Н2О │
внимание: замещение атомов водорода у третичного атома (—с—) проходит легче, чем у вторичного атома(—с—) и тем более первичного атома (с—).
3. р. изомеризации (у С4Н10 и следующих) в присутствии катализатора – AlCl3:
СН3-СН2-СН2-СН3 —→ СН3-СН (СН3)-CН3
4.крекинг (разрыв связей между атомами углеродов, радик. мех-зм) под действием температуры и катализатора:
С8Н18→С4Н10+С4Н8
5. р. элиминирования – образование веществ с кратными связями за счет отрыва атомов или групп атомов: 2СН4→С2Н4↑+2Н2↑ при t=5000С-10000С
2СН4→С2Н2↑+3Н2↑ при t=10000С-15000С
2СН4→2С+4Н2↑ при t>15000С (пиролиз)
6. р. ароматизации – получение ароматических углеводородов за счёт отрыва атомов водородов в присутствии катализаторов: С6Н12 → С6Н6 + 3Н2↑
7. р. горения — ( + О2) СпН2п+2 + (3п+1)/2О2 → пСО2↑ + (п+1) Н2О + Q (экзотерм.)
. р. окисления метана ( +[О]) даёт продукты, в зависимости от условий:
СН4 из воздуха→ СН3ОН
→НСНО
→НСООН
8. р. Вюрца («удвоение») 2СН3Cl + 2Na → 2NaCl + C2H6, в кислой среде.
9. получение алканов: а) С+2Н2 → СН4↑ под действием эл. разряда;
б) СН3-СООNa + NaOH → CH4↑ + Na2CO3 при спекании сухих веществ
в) Al4C3 + 12НОН → 3СН4↑ + 4Al(ОН)3↓; г) Al4C3 + 12НСl→ 3СН4↑ + 4AlСl3.
2. Циклоалканы (предельные). Общая формула – СпН2п.
М (СпН2п)= 14п г/моль, σ-связи, SP3-гибридизация, <от 60′ до 109′, цикл.
1. р. присоединения (+Н2, +Вr2,+НI) у циклов с 3,4 5 атомами углерода
C3H6 + Br2 = Br-CH2-CH2-CH2Br;
2. р. замещения – аналогично алканам (циклы с 6 и > атомами углерода);
3. р. элиминирования (дегидрирования) С6Н12 → С6Н6 + 3Н2↑(катализ: Ni, t)
4. р. окисления – на примере циклогексана сильным окислителем:
С6Н12 + 4[О] → СН2-СН2-СООН
│
СН2-СН2-СООН (адипиновая кислота)
3. Алкены (непредельные). Общая формула – СпН2п.
М (СпН2п)= 14п г/моль, σ- и π-связи, SP2-гибридизация, < 120′, треугольник.
1.р. присоединение Н2, НГ, Г2 и Н2О (разрыв С=С связи, электрофильный мех-зм)
а) гидрогалогенирование:СН2=СН2 + НBr → СН3-СН2Br
в случае несимметричной π-связи по правилу Марковникова (Н к СН2):
2 лист
СН3-СН=СН2 + НBr → СН3-СНBr-СН3; продолжение см. дальше.
б) гидратация:СН3-С=СН2 + НОН → СН3-С(ОН)-СН3 (в присутствии минерал кислот)
│ │
СН3 СН3
в) галогенирование (обесцвечивание раствора бромной воды – Br2) – качественная реакция на кратную связь, как и реакция с раствором КМпО4:
СН2 = СН2 + Br2 → BrСН2-СН2Br
г)гидрирование: СН3-СН=СН2 + Н2 → СН3-СН2-СН3 (катализатор – Ni, t)
2.р. замещения (радикальный мех-зм) – замещение атома Н на соседнем с двойной связью атоме углерода, при t=5000С: СН3-СН=СН2 + Cl2 → ClСН2-СН=СН3 + НCl
3.р. окисления:а) мягкое – холодным раствором КМпО4(р. Вагнера)
СН2 = СН2 + [О] + Н2О → СН2ОН-СН2ОН (упрощенная запись)
или 3СН2 = СН2 + 2КМпО4 + 4Н2О → 3СН2ОН-СН2ОН + 2МпО2↓ + 2КОН
б)жесткое – кипящим раствором КМпО4 в кислой среде
СН3-СН=СН-СН3 + 4[О] → 2 СН3-СООН
4.р. полимеризации: пСН2=СН2 → ( — СН2-СН2 — ) в кислой среде.
5.получение алкенов: а) С7Н16 —→ C4Н10 + CН3-CН=CН2 (t,Kat);
б) СН3-СН2-СНBr-СН3 + КОН (спирт)→СН3-СН=СН-СН3 + КBr + Н2О
в) СН3-СН-СН3 → СН3-СН=СН2 + Н2О (t=1500С, в кислой среде) по правилу Зайцева
│
ОН
г) СН2Br- СНBr-СН3 + 2К → СН2=СН-СН3 + 2КBr – синтез Вюрца—Крафтса
д) СН3-СН2-СН3 → СН3-СН=СН2 + Н2↑ в присутствии Kat – Cr2O3
4. Алкадиены (непредельные). Общая формула – СпН2п-2.
М (СпН2п-2)= (14п-2) г/моль, σ- и 2π-связи, SP2-гибридизация.
1. р. присоединения: →СН2Br-СНBr-СН=СН2 (присоединение по 1,2)
СН2=СН-СН=СН2 + Br2 →[
→ СН2Br-СН=СН=СН2Br (присоединение по 1,4)
2. р. полимеризации: пСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-) в кислоте
3. диеновый синтез – р. Дильса-Альдера- р.циклизации
СН2-СН=СН-СН2 + СН2=СН2 → С6Н10 при нагревании, под давлением.
4. получение алкадиенов:
а) СН3-СН2-СН2-СН3 → СН2=СН-СН=СН2 + 2Н2↑ при t, Kat – Cr2O3;
б) 2С2Н5ОН → СН2=СН-СН=СН2 + Н2↑ + 2Н2О при t, Kat – Al2O3, ZnO р. Лебедева.
5. Алкины (непредельные). Общая формула – СпН2п-2.
М (СпН2п-2)= (14п-2) г/моль, σ- и 2π-связи, SP-гибридизация, линейное строение
обладают слабыми кислотными свойствами
1.р. электрофильного присоединения (медленнее, чем у алкенов) — Br2, Н2 и НСl
СН≡СН + Br2 → СНBr=СНBr, далее СНBr=СНBr+ Br2 → СНBr2-СНBr2
2.р. гидратации – р. Кучерова, в кислой среде, Kat – Hg2+
любой алкин образует кетон СН3-С≡СН + НОН →СН3-С (СН3)=О,
только ацетилен СН≡СН + НОН →СН3-СНО — альдегид
3. р. окисления раствором КМпО4: R-C≡C-R’ + 3[О] + HOH → R-COOH + R’-COOH
4.р. гидрирования СН3-С≡СН + Н2 → СН3-СН=СН2, далее СН3-СН=СН2 +Н2 →С3Н8
3 лист
при нагревании, в присутствии катализатора – Pt, Pd
продолжение см дальше
5.слабые кислотные свойства у алкинов с «концевой» кратной связью:
2СН≡СН + 2Na → 2NaC≡CNa + H2, с аммиачным раствором оксида серебра
СН≡СН + [Ag(NH3)2]OH → AgC≡CAg + 4NH3 + 2H2O
6. р. полимеризации: СН≡СН + СН≡СН → СН2=СН-СН=СН2, катализатор –NH4CL
или р. Зелинского 3СН≡СН → С6Н6, условия – активир-ый уголь (Сакт, t=6000С)
7. а): СаС2 + 2НОН → С2Н2↑ + Са(ОН)2↓; б) СаС2 + 2НCL → С2Н2↑ + СаCL2;
в) 2СН4 → С2Н2↑ + 3H2 при t=15000С
6. Арены (непредельные, циклические, ароматические).
Общая формула – СпН2п-6, М (СпН2п-6)= (14п-6) г/моль,
локализованное π-облако, SP2-гибридизация, циклическое строение
1. Р. электрофильного замещения:
а) галогенирование: С6Н6 + CL2 → С6Н5CL + НCL , катализатор – АLCL3
б) нитрование: С6Н6 + НО – NО2 → С6Н5-NО2 + Н2О, в присутствии H2SO4
в) алкилирование — р. Фриделя-Крафтса – удлинение цепи атомов углерода
С6Н6 + RCl → C6H5-R + HCl, где R – CnH2n+1 (радикалы), катализатор — АLCL3
2. р. присоединения в жёстких условиях – свет, катализатор— Ni (присоединение Н2) а) С6Н6 + 3Н2 → С6Н12
б) С6Н6 + 3CL2 → С6Н6CL6 на свету
3. для гомологов бензола:
а) замещение атомов водорода в цикле (катализаторы FeBr3 и H2SO4)
С6Н5-СН3 + Br2 → о—С6Н4(Br)СН3 +НBr в ортоположении, т.е. 1-бром-2-метилбензол
а также →п—С6Н4(Br)СН3 +НBr в параположении, т.е. 1-бром-4-метилбензол
помнить: у гомологов бензола замещение в цикле атомов водорода
происходит с равной вероятностью в положении 2, 4, 6 относительно имеющегося радикала в присутствии катализаторов FeBr3 и H2SO4.
б) С6Н5-СН3 + 3НО – NО2 → С6Н2(NО2)3 + 3Н2О 1-метил-2,4,6,-тринитробензол.
в) присоединение 2 С6Н5-СН3+ 5Н2 → 2 С6Н11-СН3 или −СН3, метилциклогексан.
г) радикальное замещение в боковую цепь на свету:
С6Н5-СН3 + Br2 → С6Н5-СН2Br + НBr
д) окисление кислым раствором КМпО4
С6Н5-СН3 + 2[О] → С6Н-СООН — упрощенная запись, полная запись:
5С6Н5-СН3 + 6КМпО4 + 9H2SO4 → 5С6Н5-СООН + 3К2SO4 + 6МпSO4 + 14Н2О
электронно-ионный баланс:
С6Н5-СН30 + 2Н2О0 −6е —_→ С6Н5-СООН0 + 6Н+ │5
МпО4— + 8Н+ +5е—→ Мп2+ + 4Н2О │6
4. получение аренов: а) С6Н14 → С6Н6 + 4Н2↑, условия: t, Р, катализатор – Сr2O3
б) С6Н12→ С6Н6 + 3Н2↑, условия: t, катализатор – Pd
в) 3СН≡СН→ С6Н6, условия – активир-ый уголь (Сакт, t=6000С)
г) С6Н5-СООNa + NaOH → C6H6 + Na2CO3 при спекании сухих веществ.
4 лист
Кислородсодержащие соединения.
1. Одноатомные спирты — алканолы (предельные).
Общая формула – R-ОН или СпН2п+2О, М (СпН2п+2О)= (14п+18) г/моль,
Наличие гидроксогруппы — ОН в молекулах спиртов проявляется в слабых кислотных и основных свойств.
1. проявляют кислотные свойства (только реакции с щелочными Ме), убывающие от первичных к третичным спиртам: 2 С2Н5ОН + 2К → 2 С2Н5ОК + Н2↑;
2. слабые основные свойства, возрастающие от первичных к третичным спиртам:
R – ОН + НBr → R – Br + H2O
3. р. этерификации – взаимодействие с кислотами и образование сложных эфиров:
Н+
RСООН + НОR’ ↔ RСООR’ + Н2О (в кислой среде);
4. р. окисления подкисленными растворами КМпО4 или К2Сr2О7: а) первичные окисляются в 2 стадии до кислот т.к. имеют 2 атома [Н] на углероде при ОН-группе: 1стад. 2 стад.
R — СН2 – ОН + [О] → R — СН2 = О (альдегид); …+ [О] → R – СООН (кислота);
б) вторичные окисляются до кетонов т.к. имеют1 атом [Н] на углероде при ОН-группе: 1стад.
R — СН – ОН + [О] → R — С = О
│ │
R’ R’
5. р. дегидратации в присутствии раствора Н2SO4 (Al2O3, H3PO4 конц) зависит от температуры:
а) при t > 1500С – внутримолекулярная (Н2О отрывается от 1 молекулы):
СН3 – СН2 – СН2 – ОН (+Н2SO4) → СН3 – СН = СН2 + Н2О, продукт — алкен
б) при t < 1500С – межмолекулярная (Н2О отрывается от 2 молекул):
СН3 – СН2 –– ОН + СН3 – СН2 –– ОН (+Н2SO4) → СН3 –СН2 — О – СН2 – СН3+ Н2О,
продукт – простой эфир.
Различные классы спиртов дегидратируются при различных условиях:
первичные: СН2 – СН2 (конц. Н2SO4 при нагревании) → СН2 = СН2
│ │
Н ОН
вторичные: СН2 – СН – СН3 (конц. Н2SO4 при подогреве) → СН2 = СН
│ │ │
Н ОН СН3
СН3 СН3
│ │
третичные: СН2 – С – СН3 (конц. Н2SO4 на холоде) → СН2 = С
│ │ │
Н ОН СН3
6.Галогенирование: в присутствии PCl5, SOCl2 или HCL
СН3 – СН2 – ОН + SOCl2 → СН3 – СН2 – Cl + SO2 + HCL
6. Получение: а) СН3 – СН=СН2 + НОН → СН3 – С (СН3)Н — ОН (из алкенов);
5 лист
б) R – Br + NaOH (раствор) → R – ОН + NaBr (щелочной гидролиз галогеналканов); в) R – СНО + 2[Н] → R — СН2 – ОН (из альдегидов);
г) С≡О + 2Н2 (t, p, ZnO) → СН3ОН (из синтез-газа);
д) С6Н12О6 (брожение) → С2Н5ОН + 2СО2↑. см. продолжение.
7. качественные реакции на: а) предельные одноатомные спирты – CuO, t
С2Н5ОН + CuO → СН3 – СНО + Cu + Н2О
б) предельные многоатомные спирты – Cu (ОН)2, свежеприготовленный раствор
2 СН2 – ОН + Cu (OН)2 → (СН2 – О)2Cu + 2 Н2О
│ │
СН2 – ОН СН2 – ОН – ярко-синий раствор.
2. Ароматические спирты – фенолы (циклические, непредельные).
Общая формула – R-(ОН)m или СпН2п-6-m(ОH)m,
М (СпН2п-6-m(ОН)m)= (14п-6 +16m) г/моль,
SP2 – гибридизация
1. подвижность атома водорода и выраженные кислотные свойства –
а) реакции с Ме: С6Н5ОН + К → С6Н5ОК + 0,5Н2 ↑;
б) реакции со щелочами: С6Н5ОН + КОН → С6Н5ОК + НОН;
в) реакция с р-ром карбоната натрия (фенол в нём растворяется, но в отличие от обычных кислот не образует диоксида углерода):
С6Н5ОН(aq) + CO32-(aq) −→ C6H5O—(aq) + HCO3—(aq)
2. реакции с хлор-альдегидом: С6Н5ОН + СН3ССlO → С6Н5 – О – C(CH3)O + HCl;
3. р. электрофильного замещения протекают легче, чем у аренов:
С6Н5ОН + СН3 – С = О −→С6Н5 – О – С = О + НСl
│ │
Cl СН3
а) реакция с раствором бромной воды – 1-я качественная реакция на фенолы
С6Н5ОН + 3 Br2 → С6Н2(ОН)Br3↓ + 3НBr – 2,4,6 – трибромфенол (белая эмульсия)
б) реакция нитрования — С6Н5ОН + 3 НО – NO2 → С6Н2(ОН)(NO2)3 + 3 НОН
в присутствии Н2SO4 получается 2,4,6 – тринитрофенол,
в) получение фенолформальдегидной смолы – р. поликонденсации
С6Н5ОН (фенол) + НСНО (формальдегид) →С6Н4(ОН) – СН2ОН — 1-я стадия;
n С6Н4(ОН) – СН2ОН + n С6Н5ОН →( С6Н4(ОН) – СН2 – С6Н4(ОН))n + n НОН.
4. реакция с раствором FeCl3 – 2-я качественная реакция на фенолы
3 C6Н5ОН + FeCl3 → (С6Н5О-)3Fe + 3НCl (ярко-фиолетовый раствор).
4. Получение: а) из каменноугольной смолы;
б) С6Н5 Br + КОН → С6Н5ОН + КBr
в) С6Н5 – СН (СН3)2 + 2 [О] → С6Н5 – ОН + (СН3)2СО.
3. Альдегиды. Общая формула – R-С = О или СпН2п О.Мr (СпН2пО) =(14п+16)
│
Н
SP2 – гибридизация
1.Реакции нуклеофильного присоединения:
6 лист
а) R – СНО + НСN −KCN→ R – CH(OH) – C ≡ N;
б) R – СНО + R’OH −H+→ R – CH – OH −R’OH→ R – CH — OR’ + H2O
│ │
OR’ (полуацеталь) OR’ (ацеталь);
см. дальше
╔O ╔O
в) R – СНО + NaHSO3 (:S – ONa) → R – CH – S — ONa
│ │ O╝
OH OH
г) р. восстановления R – СНО + H2 −LiAlH4→ R – CH2 – OH
Внимание: водород легко присоединяется по связи С=С и очень трудно – по связи С=О. LiAlH4 восстанавливает связи С=О до С – ОН, не затрагивая связь С=С.
О ← ОН
║ │ │
СН3 – С – Н + Н – О – СН3 → СН3 – СН – О – СН3, LiAlH4 — алюмогидрид лития.
2. Окисление: легко окисляются в кислоты – качественные реакции на альдегиды – реакции «серебряного» и «медного» зеркала
а) R – CHO + 2 [Aq(NH3)2]OH → R – COO – NH4 + 2Aq↓ + 2NH3↑ + H2O:
реактив [Aq(NH3)2]OH – реактив Толленса
б) R – CHO + 2 Cu(OH)2 → R – COOH + Cu2O↓ + 2H2O:
реактив Cu(OH)2 – реактив Фелинга
или упрощённо — R – CHO + [О] → R – CОOН
3. Получение: а) из спиртов R–СН2-ОН + CuО −t→ R–СНО + Н2О + Cu
б) из дигалогензамещённых алканов:
R – CHCl2 + 2 NaОН → R – CHO + 2 NaCl + Н2О
4. Кетоны. Общая формула – R-С = О или СпН2п О. Мr (СпН2пО) =(14п+16)
│
R
SP2 – гибридизация
1. Химические свойства отличаются от свойств альдегидов:
а) менее активны в реакциях нуклеофильного присоединения, чем альдегиды (с цианидом водорода в присутствии цианида калия)
R – С=О + НСN −KCN→ R – C (OH) – C ≡ N;
│ │
R R
б) присоединение реактива Гриньяра – R – MqBr с образованием третичного спирта
R – С=О + R – MqBr −2HCl→ R – C (OH) – R + MqCl2 + HBr
│ │
R R
в) гидрирование кетонов с образованием вторичных спиртов
7 лист
R – С=О + Н2− → R – CН (OH)
│ │
R R
г) окисление с трудом, не взаимодействуют с соединениями серебра и меди
2. Иодоформный тест – если карбонильная группа связана со 2-ым атомом углерода от конца углеродной цепи (со щелочным раствором иода)
СН3 – СО – R + I2 −OH-→ R – COO—(aq) + CHI3(тв), жёлтый осадок, такой же, как и для CH3 – CH (OH)R.
5. Карбоновые кислоты. Общая формула – R-С = О или СпН2пО.
│
Мr (СпН2пО) =(14п+16) ОН
SP2 – гибридизация
1. Диссоциируют, т.е. являются донором катиона водорода – слабые электролиты, самая сильная из них – муравьиная НСООН
R – СООН ↔ R – СОО— + Н+, сл-но, характерны свойства, типичные для кислот – взаимодействие с Ме, основными оксидами, основаниями и солями слабых кислот.
2. р.замещения группы ОН на хлор, взаимодействие с хлоридом Р(V)
R – СООН + РСl5 → R – С = О + POCl3 + HCl
│
Сl
3.межмолекулярная дегидратация в присутствии Р2О5 или НРО3
R – СООН + Н – О – СО – R — Р2О5→ R – СО – О – СО — R + Н2О (ангидрид к-ты),
4. р. этерификации – образование сложных эфиров в присутствии Н2SO4
R – СООН + Н — О R′ − Н2SO4→ R – СО — О R′ + Н2О
остаток кислоты ↓ остаток спирта
5. получение амидов в реакциях с раствором аммиака, при нагревании
R – С = О + NH3 −t→ R – С = О + H2O
│ │
ОН NH2
6. р. замещения атома водорода у α–атома (С) на атом брома, в присутствии Ркр
СН3 – СН2 – СООН + Br2 − Ркр→ CH3 – CHBr – COOH + HBr;
7. р. дегидратации и гидрирование, в присутствии LiAlH4 (см. «альдегиды»)
R – С = О + 2 Н2 −LiAlH4→ R – СН2ОН + Н2О т.е. восстановление до спиртов.
│
ОН
8.Внимание: муравьиная кислота – самая сильная из органических кислот и
сильный восстановитель,
отсюда следует:
а) НСООН − Н2SO4→ СО2↑ + Н2О;
б) р. «зеркала» НСООН + 2 [Ag(NH3)2]OH −t→ 2 Ag↓ + (NH4)2CO3 + 2NH3 + H2O
или упрощенно НСООН + Ag2О −t→ 2Ag↓ + СО2↑ + Н2О;
в) НСООН + Cl2 → CO2↑ + 2HCl
9. Получение: а) из спиртов (окисление, т.е. + [О])
R – СН2 – ОН + [О] → R – СНО (альдегид) и дальше + [О] → R – СООН (кислота);
б) из альдегидов – р. «серебряного и медного зеркала»
8 лист.
R – СНО + [Ag(NH3)2]OH −t→ Ag↓ + R – СООNН4 + Н2О + NH3
б) из реактива Гриньяра (R – MgBr) – р. элиминирования и гидратации (последовательное взаимодействие с СО2 и Н2О):
R – MgBr + CO2 → R – COO – MgBr…….. + H2O → R – COOH + Mg (OH) Br
в) из трихлорзамещенного алкана (последовательное замещение атомов хлора на группы ОН из щелочей и дегидратация)
R – С (Cl)3 + 2 NaOH → 3NaCl + R – C(OH)3….→ R – COOH + H2O
R – C (OH)3 – трёхатомный спирт – вещество очень слабое и нестабильное.
продолжение см. дальше
6. Сложные эфиры карбоновых кислот. Общая формула – R-С = О
│
О R′
Мr (СпН2п+1СОО)(СпН2п+1)′ = (14п+46)
1. р. гидролиза: а) кислотного СН3СООСН3 + НОН −H+→ СН3СООН + НОСН3
(кислота) (спирт)
б) щелочного СН3СООСН3 + NaOH → СН3СООNa + СН3ОН
р. гидролиза с Н2О идёт медленно, её катализируют (ускоряют) кислоты и щёлочи
2. р. восстановления, в присутствии LiAlH4 с образованием 2-х спиртов:
R – СОО — R′ + 4 [Н+] −LiAlH4→ R – CH2 – OH + R′ОН (аналогично альдегидам);
3. Получение: а) р. этерификации R – СООН + НО R′ − Н2SO4↔ R – СОО — R′ + Н2О
особенность: медленная реакция, обратимая, с низким выходом.
б) р. ацилирования спирта хлоридом кислоты
СН3СОCl + НОСН2СН3 → СН3СООСН2СН3 + HCl (р. быстрая, хороший выход).
Хлорангидриды и ангидриды кислот
Эти два вида производных карбоновых кислот химически очень активны. Хлорангидриды даже более активны, чем ангидриды, и более летучи, что делает обращение с ними очень трудным. Они вступают в быструю реакцию на холоде с водой, аммиаком и с их производными, спиртами и аминами. В каждом случае атом водорода реагирующей молекулы замещается ацильной группой – это реакции ацилирования, а хлорангидриды и ангидриды кислот-ацилирующие агенты.
С хлорангидридами:
а) вода: СН3СОCl + НОН → СН3СО – ОН (кислота) + HCl;
б) спирт: СН3СОCl + НОСН2СН3 → СН3СО – ОСН2СН3 (эфир) + HCl;
в) аммиак: СН3СОCl + 2Н−NH2 → СН3СО – NH2 (амид) + NH4Cl;
г) амин: СН3СОCl + НNHСН3 → СН3СО – NHСН3 (замещ. амид) + HCl;
↑
этот атом водорода замещается на ацильную группу.
С ангидридами кислот:
а) вода: СН3СОООССН3 + НОН → СН3СО – ОН + СН3СООН;
б) спирт: СН3СОООССН3 + НОСН2СН3 → СН3СО – ОСН2СН3 + СН3СООН;
в) аммиак: СН3СОООCСН3 + Н−NH2 → СН3СО – NH2 + СН3СООН;
г) амин: СН3СОООCН3 + НNHСН3 → СН3СО – NHСН3 + СН3СООН.
7. Углеводы. Общая формула – Сn (Н2О)m. Mr = 12n + 18m.
9 лист
1. Глюкоза – альдегидоспирт СН2ОН – (СНОН)4 — СНО, т.е. имеет р. «зеркала»
СН2ОН – (СНОН)4 – СНО + 2 [Ag(NH3)2]OH −t→ СН2ОН – (СНОН)4 – СОО — NH4 + 3NH3 + H2O + 2 Ag↓
2. р. восстановления до многоатомных спиртов:
СН2ОН – (СНОН)4 – СНО + 2[Н] → СН2ОН – (СНОН)4 – СН2ОН (сорбит);
3. синее окрашивание с Си(ОН)2, как у многоатомных спиртов;
4. р. межмолекулярной дегидратации со спиртами: → простые эфиры;
5. р. этерификации с альдегидами → сложные эфиры;
6. брожение: С6Н12О6 −дрожжи→ 2 С2Н5ОН + 2 СО2↑ — спиртовое брожение;
С6Н12О6 −→ 2 СН3 – СН (ОН) – СООН — молочнокислое брожение.
8. Азотсодержащие соединения – амины. Общая формула – R- NH2,
R – NH – R или N(R)3. Мr (R- NH2) = (14п+17)
1. Амины обладают основными свойствами, поэтому, как основания,
а) реагируют с водой: R- N:H2 + Н2О ↔ [R- NH3]+ ОН−
б) реагируют с кислотами: R- N:H2 + Нδ+Cl δ- ↔ [R- NH3]+ Cl−
2. Реакция горения: 4 С2Н5 + N:H2 + 15О2 → 8СО2↑ + 2N2↑ + 14Н2О.
3. Р. нитрирования (с НО – NО) проходит по-разному:
а) у первичных аминов:
R- NH2 + НО – NО (NaNO2 + HCl) → R – OH + N2↑ + NaCl + H2O;
б) у вторичных аминов:
R2 – NH + НО – NО (NaNO2 + HCl) → R2N – N=O + NaCl + H2O.
4. Анилин – ароматический амин с формулой С6Н5 — NH2
в реакции нитрирования:
С6Н5 — NH2 + НО – NО (NaNO2 + HCl) → [С6Н5 — N≡N]+Cl− + NaCl + 2H2O;
5. Качественная реакция на анилин – реакция с раствором брома:
С6Н5 — NH2 + 3Br2 → C6H2Br3NH2↓ + 3 HBr
6. Получение аминов:
а) NH3 + CH3Cl −t→ CH3 – NH2 + HCl;
б) R – NO2 + 4 [H] −LiAlH4→ R – NH2 + 2H2O
7. Получение анилина:
) C6H5 – NO2 + 6 [H] −Fe + HCl→ C6H5 – NH2 + 2H2O
9. Азотсодержащие соединения – аминокислоты
…β α
Общая формула – R – СН — СООН
│
NH2 Мr (к-ты) = (14п+75)
1.Аминокислоты обладают амфотерными свойствами, поэтому реагируют:
а) с кислотами H2N – CH2 – COOH + HCl → Cl [NH3 – CH2 — COOH];
б) c щелочами H2N – CH2 – COOH + NaOH → NH2 – CH2 – COONa + H2O.
2. Р. этерификации – взаимодействие со спиртами:
H2N – CH2 – COOH + С2Н5OH −H+→ H2N – CH2 – COO – С2Н5 + Н2О
3. Р. поликонденсации — взаимодействие кислот между собой с образованием пептидов: пептидная связь
H2N – CH2 – COOH + H—N – CH2 – COOH → H2N – CH2 – CO—N – CH2 – COOH
│ Дипептид │
Н Н
4. Получение: α- аминокислоты из α-хлорзамещенных карбоновых кислот
R – СН – СООН + 2 H3N → R – СН – СООН + NH4 Cl
│ │
Cl NH2
Окислительно – восстановительные реакции в органической химии.
А. Углеводороды.
1. СН2 = СН – СН2 – СН3 + КМпО4 + Н2О → СН2 – СН – СН2 – СН3 + МпО2 + КОН
│ │
ОН ОН
2. С6Н5 – СН2 – СН3 + КМпО4 + Н2SО4 → С6Н5СOOН + MnSO4 + K2SO4 + CO2 + H2O
3. СН2 = СН – СН2 – СН3 + КМпО4+ Н2SО4 → HCOOH + CH3COOH + MnSO4 + K2SO4 + H2O
4. CH ≡ CH + КМпО4 + Н2О → H2C2O4 + MnO2 + KOH
5. С6Н5 – СН3 + КМпО4 + Н2SО4 → С6Н5СOOН + MnSO4 + K2SO4 + H2O
6.
Известно, что все сложные вещества условно можно разделить на органические и неорганические.
В состав неорганических веществ может входить любой элемент периодической системы. Основными классами неорганических веществ являются оксиды, кислоты, основания и соли. Свойства этих веществ были рассмотрены в первых двух разделах.
В состав органических веществ обязательно входит атом углерода, который в подавляющем числе органических соединений образует цепи. Эти цепи имеют разную длину и разное строение, поэтому органических соединений теоретически может быть бесчисленное множество.
Основу любого органического соединения составляет углеводородная цепь, которая может соединяться с функциональными группами.
Свойства органического соединения описывают по схеме:
- определение;
- гомологический ряд;
- изомерия;
- номенклатура (названия);
- строение молекулы (углеводородной цепи и функциональных групп);
- свойства, связанные со строением
- функциональной группы;
- углеводородного радикала;
- особые свойства;
- получение и применение.
Прочитав очередной урок, попробуйте описать изучаемые соединения на любом примере, используя эту схему. И всё получится!
Содержание
- Предмет органической химии. Теория строения органических веществ
- Особенности строения органических соединений
- Выводы
- Классификация органических соединений
- Формулы органических соединений
- Изомерия
- Гомологи
- Выводы
- Названия углеводородов. Правила международной номенклатуры
Предмет органической химии. Теория строения органических веществ
Органические вещества известны людям с давних пор. Ещё в древности люди использовали сахар, животные и растительные жиры, красящие и душистые вещества. Все эти вещества выделялись из живых организмов. Поэтому такие соединения стали называться органическими, а раздел химии, который изучал вещества, образующиеся в результате жизнедеятельности живых организмов, получил название «органическая химия». Это определение было дано шведским учёным Берцелиусом* в 1827 году.
* Берцелиус Йенс Якоб (20.08.1779–7.08.1848) — шведский химик. Проверил и доказал ряд основных законов химии, определил атомные массы 45 химических элементов, ввёл современное обозначение химических элементов (1814) и первые химические формулы, разработал понятия «изомерия», «катализ» и «аллотропия».
Уже первые исследователи органических веществ отмечали особенности этих соединений. Во-первых, все они при сжигании образуют углекислый газ и воду, значит, все они содержат атомы углерода и водорода. Во-вторых, эти соединения имели более сложное строение, чем минеральные (неорганические) вещества. В-третьих, возникали серьёзные затруднения, связанные со способами получения и очистки этих соединений. Полагали даже, что органические соединения невозможно получить без участия «жизненной силы», которая присуща только живым организмам, то есть органические соединения нельзя, казалось, получить искусственно.
И, наконец, были обнаружены соединения одинакового молекулярного состава, но различные по свойствам. Такое явление не было характерно для неорганических веществ. Если для неорганического вещества известен состав, то известны и его свойства.
Вопрос. Какими свойствами обладают H2SO4; Ca(OH)2?
А химики-органики обнаружили, что вещество состава С2Н6О у одних исследователей является достаточно инертным газом, а у других — жидкостью, активно вступающей в разнообразные реакции. Как это объяснить?
К середине 19-го века было создано немало теорий, авторы которых пытались объяснить эти и другие особенности органических соединений. Одной из таких теорий стала теория химического строения Бутлерова*.
* Бутлеров Александр Михайлович (15.09.1928–17.08.1886) — русский химик. Создал теорию химического строения органических веществ, лежащей в основе современной химии. Предсказал изомерию многих органических соединений, заложил основы учения о таутомерии.
Некоторые её положения были изложены А. М. Бутлеровым в 1861 году на конференции в г. Шпейере, другие были сформулированы позже в научных работах А. М. Бутлерова. В целом, основные положения этой теории в современном изложении можно сформулировать так.
1. Атомы в молекулах располагаются в строгом порядке, согласно их валентности.
2. Атом углерода в органических молекулах всегда имеет валентность равную четырём.
3. Порядок соединений атомов в молекуле и характер химических связей между атомами называется химическим строением.
4. Свойства органических соединений зависят не только от того, какие атомы и в каких количествах входят в состав молекулы, но и от химического строения:
- вещества разного строения имеют разные свойства;
- вещества похожего строения имеют похожие свойства.
5. Изучая свойства органических соединений, можно сделать вывод о строении данного вещества и описать это строение одной-единственной химической формулой.
6. Атомы в молекуле влияют друг на друга, и это влияние сказывается на свойствах вещества.
При изучении органической химии нужно чаще вспоминать эти положения и, прежде чем описывать свойства какого-либо вещества, следует указать его строение при помощи химической формулы, в которой будет показан порядок соединения атомов в молекуле — графическая формула.
Особенности строения органических соединений
Органическая химия изучает строение молекул и свойства соединений углерода, кроме самых простых (угольная и синильная кислоты и их соли).
В состав неорганических соединений могут входить любые из 114 известных в настоящее время химических элементов. Сейчас известно более 0,5 млн неорганических веществ.
В состав органических молекул обычно входят атомы 6 химических элементов: C, H, O, N, P, S. И тем не менее в настоящее время известно более 20 миллионов органических соединений.
Почему органических веществ так много?
Поскольку в состав любого органического соединения входит атом углерода, попробуем найти ответ на этот вопрос, рассмотрев особенности строения атома углерода.
Углерод — химический элемент 2-го периода, IV группы Периодической системы химических элементов Менделеева, следовательно, строение его атома можно изобразить так:
Таким образом, на внешнем уровне атома углерода находится четыре электрона. Являясь неметаллом, атом углерода может и отдавать четыре электрона, и принимать до завершения внешнего уровня также четыре электрона. Поэтому:
- атом углерода в органических соединениях всегда четырёхвалентен;
- атомы углерода способны соединяться друг с другом, образуя цепи различной длины и строения;
- атомы углерода соединяются друг с другом и с другими атомами при помощи ковалентной связи, которую в формуле обозначают чёрточкой; так как валентность атома углерода равна четырём, — общее число чёрточек (химических связей) у одного атома углерода тоже равно четырём.
В состав углеродных цепочек может входить разное число атомов углерода: от одного до нескольких тысяч. Кроме того, цепочки могут иметь разное строение:
Между атомами углерода могут возникать химические связи разного типа:
Поэтому всего лишь четыре (!) атома углерода могут образовать более 10 соединений разного строения, даже если в состав таких соединений будут входить только атомы углерода и водорода. Эти соединения будут иметь, например, следующие «углеродные скелеты»:
и другие.
Задание 17.1. Попробуйте составить сами 2–3 цепочки атомов углерода иного строения из четырёх атомов углерода.
Выводы
Способность атомов углерода образовывать УГЛЕРОДНЫЕ ЦЕПИ разного состава и строения — главная причина многообразия органических соединений.
Классификация органических соединений
Поскольку органических соединений очень много, их классифицируют по разным признакам:
- по строению углеродной цепи — линейные, разветвлённые, циклические соединения;
- по типу химической связи — предельные, непредельные и ароматические соединения;
- по составу — углеводороды, кислородсодержащие соединения, азотсодержащие соединения и другие.
В данном пособии будут рассмотрены свойства соединений различных классов, поэтому определения и примеры будут даны позднее.
Формулы органических соединений
Формулы органических соединений можно изображать по-разному. Состав молекулы отражает молекулярная (эмпирическая) формула:
Но эта формула не показывает расположения атомов в молекуле, т. е. строения молекулы вещества. А в органической химии это понятие — химическое строение молекулы вещества — самое главное! Последовательность соединения атомов в молекуле показывает графическая (структурная) формула. Например, для вещества строения С4Н10 можно написать две такие формулы:
Можно показать все химические связи:
Такие развёрнутые графические формулы наглядно показывают, что атом углерода в органических молекулах четырёхвалентен. При составлении графических формул нужно сначала изобразить углеродную цепь, например:
Затем чёрточками обозначить валентность каждого атома углерода:
У каждого атома углерода должно быть четыре чёрточки!
Затем заполнить «свободные» валентности атомами водорода (или другими одновалентными атомами или группами).
Теперь можно переписать эту формулу в сокращённом виде:
Если вы хотите сразу написать такую формулу для бутана — ничего сложного нет, нужно только считать до четырёх. Изобразив углеродный «скелет», нужно задать себе вопрос: сколько валентностей (чёрточек) имеет данный конкретный атом углерода?
Две. Значит, нужно добавить 2 атома водорода:
Следует помнить, что графические формулы можно записывать по-разному. Например, графическую формулу бутана можно записать так:
или так:
и так далее.
Поскольку последовательность расположения атомов не нарушилась, то это формулы одного и того же соединения(!) Проверить себя можно, составив названия этих соединений (см урок 17.7). Если названия веществ совпадают, то это — формулы одного и того же вещества.
Изомерия
К середине 19-го века, когда было получено и изучено достаточно много органических соединений, химики-органики обнаружили непонятное явление: соединения, имеющие одинаковый состав, имели разные свойства! Например, газ, который с трудом вступает в реакции и не реагирует с Nа, имеет состав C2H6O. Но существует жидкость, имеющая тот же состав и очень активная в химическом отношении. В частности, эта жидкость состава C2H6O активно реагировала с Na, выделяя водород. Совершенно разные по физическим и химическим свойствам вещества имеют одинаковую молекулярную формулу! Почему? Ответ на этот вопрос можно получить при помощи теории строения органических соединений Бутлерова, одно из положений которой утверждает: «Свойства органических соединений зависят от химического строения их молекул».
Так как химические свойства рассматриваемых соединений различны, значит, их молекулы имеют разное строение. Попробуем составить графические формулы этих соединений. Для вещества состава C2H6O можно предложить только два вида цепочек:
Заполнив эти «скелеты» атомами водорода, получаем:
Вопрос. Какое из этих соединений способно реагировать с Nа, выделяя водород?
Очевидно, к такому взаимодействию способно только вещество (I), содержащее связь «О–Н», которой нет в молекуле (II). И газ Н2 выделяется потому, что разрушается связь «О–Н». Если бы для образования водорода нужно было бы разрушить связь «С–Н», то поскольку такие связи есть в обоих веществах, газ Н2 выделялся бы в обоих случаях. Таким образом, формула (I) отражает строение молекулы жидкости, а формула (II) — газа.
Существование соединений, которые имеют одинаковый состав, но разное химическое строение, называется изомерией.
ИЗОМЕРЫ — это соединения, которые имеют одинаковый состав, но разное химическое строение, а значит, и разные свойства.
Поэтому молекулы органических соединений следует изображать при помощи графических (структурных) формул, так как в этом случае будет видно строение изучаемого вещества, а значит, будет видно, как и за счёт чего происходит химическая реакция.
Упражнение 17.1. Среди следующих соединений найдите изомеры:
Решение. Поскольку изомеры имеют одинаковый состав, определим состав (молекулярные формулы) всех этих соединений, то есть пересчитаем число атомов углерода и водорода:
Ответ. Соединения а) и б) изомерны друг другу, так как имеют одинаковый состав C4H10, но различное химическое строение.
Соединения в) и г) изомерны друг другу, так как имеют одинаковый состав C5H12, но различное химическое строение.
Задание 17.2. Среди следующих соединений найдите изомеры:
Гомологи
Из того же положения теории строения органических соединений Бутлерова следует, что вещества, имеющие похожее (сходное) строение молекул, должны иметь и похожие (сходные) свойства. Органические соединения, которые имеют похожее строение, а, значит, и похожие свойства, образуют гомологические ряды.
Например, углеводороды, в составе молекул которых есть только одна двойная связь, образуют гомологический ряд алкенов:
и так далее.
Углеводороды, в молекулах которых имеются только простые связи, образуют гомологический ряд алканов:
и так далее.
Члены любого гомологического ряда называются ГОМОЛОГАМИ.
Гомологи — это органические соединения, которые похожи по химическому строению и, значит, по свойствам. Гомологи отличаются друг от друга по составу на группу СН2 или (СН2)n.
Убедимся в этом на примере гомологического ряда алкенов:
Задание 17.3. Сравните состав членов гомологического ряда алканов (гомологов алканов) и убедитесь, что по составу они отличаются на группу СН2 или (СН2)n.
Выводы
Гомологи похожи по строению, а значит, и по свойствам; гомологи отличаются по составу на группу СН2. Группа СН2 называется гомологической разностью.
Названия углеводородов. Правила международной номенклатуры
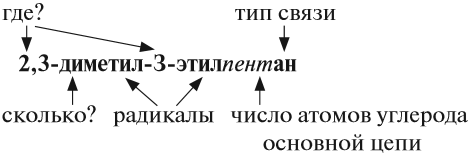
Для того чтобы понимать друг друга, нужен язык. Люди говорят на разных языках и не всегда понимают друг друга. Химики же, для того чтобы понимать друг друга, пользуются одним и тем же международным языком. Основу этого языка составляют названия соединений (номенклатура).
Правила номенклатуры (названий) органических соединений были приняты в 1965 году. Они называются правилами ИЮПАК (IUPAC)*.
* IUPAC — International Union of Pure and Applied Chemistry — Международный союз чистой и прикладной химии.
За основу названий органических соединений принимаются названия гомологов-алканов:
- СН4 — МЕТан,
- C2H6 — ЭТан,
- С3Н8 — ПРОПан,
- С4Н10 — БУТан**,
- С5Н12 — ПЕНТан**,
- C6H14 — ГЕКСан**,
- C7H16 — ГЕПТан**,
- C8H18 — ОКТан**.
** Для этих соединений имеется ввиду, что они имеют линейное строение.
В этих названиях КОРНИ слов (полужирный шрифт) — мет-, эт-, проп- и так далее — указывают на число атомов углерода в цепи:
- МЕТ — 1 атом углерода,
- ЭТ — 2 атома углерода,
- ПРОП — 3 атома углерода и так далее.
Задание 17.4. Сколько атомов углерода содержит углеродная цепь соединений:
- метаналь;
- этиловый спирт;
- пропанон;
- бутановая кислота?
Суффикс в названии указывает на характер (тип) связей. Так, суффикс -ан- показывает, что все связи между атомами углерода простые.
Задание 17.5. Вспомните, что такое гомологи, и установите, являются ли гомологами алканов следующие вещества:
- октан?
- пропен?
- 2-метилпропан?
В названиях могут быть и другие суффиксы:
- -ен-, если в цепи имеется одна двойная связь;
- -ин-, если в цепи имеется одна тройная связь.
Упражнение 17.2. Попробуйте составить графические формулы ЭТана, ЭТена и ЭТина.
Решение. Все эти вещества имеют корень -ЭТ-, то есть в состав этих веществ входит .?. атома углерода. В первом веществе имеется .?. связь, так как суффикс -ан-:
Рассуждая аналогично, Вы получите:
Предположим, нужно изобразить графическую формулу пропина.
1. Корень -проп- указывает, что в цепи 3 атома углерода:
2. Суффикс -ин- указывает, что имеется одна тройная связь:
3. Каждый атом углерода имеет валентность IV. Поэтому допишем недостающие атомы водорода:
Задание 17.6. Составить графическую формулу пропена.
Теперь, предположим, нужно составить графическую формулу бутена. Корень -бут- означает, что в цепи имеется 4 атома углерода, суффикс -ен- указывает, что имеется двойная связь. Но где расположена эта связь? Возможны варианты:
Значит, в этом случае необходимо обозначить место двойной связи. Для этого атомы углерода нумеруют. Нумерацию начинают с того конца углеродной цепи, к которому ближе кратная двойная связь:
Хотя двойная связь в каждом случае соединяет два атома углерода, после суффикса -ен- записывают меньший номер.
Задание 17.7. Составьте графические формулы соединений: а) пентен-2; б) бутин-1.
Ранее было сказано, что углеродные цепи могут быть линейными и разветвлёнными. Мы научились составлять названия линейных углеводородов. Теперь рассмотрим правила составления названий разветвлённых углеводородов. Для этого вспомним, что разветвлённые углеводороды имеют ответвления (боковые цепи, радикалы) от основной цепи:
Ответвления от основной (главной) цепи называются радикалами.
Радикалы по составу отличаются от соответствующего углеводорода на один атом водорода:
Названия радикалов предельных углеводородов имеют суффикс -ил-:
Правила составления названий углеводородов:
1) выбрать главную цепь: она должна быть самой длинной и самой разветвлённой (содержать максимальное число радикалов);
2) атомы углерода, которые не вошли в состав главной цепи, образуют боковые цепи (радикалы);
3) нумерацию атомов главной (основной) цепи начинают с того конца, от которого ближе кратная связь, а для предельных углеводородов — с того конца, к которому ближе радикал. В любом случае сумма номеров, которые появились в названии, должна быть наименьшей;
4) перед названием радикала ставят номер атома углерода (адрес), с которым он соединён;
5) если одинаковых радикалов несколько, то их число обозначают так:
- два радикала ди-,
- три радикала три-,
- четыре радикала тетра- и т. д.;
6) затем записывают названия соответствующих радикалов (начиная с самых простых) и в конце названия записывают название углеводорода — основной цепи, указывая тип связи и место положения этой связи.
Упражнение 17.3. Назвать углеводород:
Решение.
1. Выберем самую длинную цепь; в данном случае она содержит 5 атомов углерода: корень — пент.
2. Все связи простые: суффикс -ан-. Получается: пентан.
3. Нумеруем главную цепь слева направо, так как к левому концу ближе радикал «метил-»:
4. У второго атома углерода и у третьего атома углерода имеется по одному радикалу «метил-», то есть всего два радикала «метил-»; обозначим их «ди»; получаем: 2,3-диметил…
5. У третьего атома углерода есть ещё один радикал «этил-», поэтому получаем:
Упражнение 17.4. Назвать:
Пример. Составить графическую формулу углеводорода: 3,3-диметилбутен-1.
Решение.
1. Определим число атомов углерода в основной цепи:
2. Определим тип химической связи в основной цепи:
3. Составляем «углеродный скелет»:
4. У атома углерода № 3 имеется два (ДИ) радикала «метил», т. е. каждый радикал имеет один атом углерода:
5. Допишем атомы водорода согласно валентности:
Задание 17.8. Составьте структурные (графические) формулы:
- 3-метилбутин-1;
- 2,2-диметилбутан;
- 3-этилпентан.