|
Тест «Алканы 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 |
|
|
Цепочки «Алканы» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Алкены 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 |
|
|
Цепочки «Алкены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Циклы и алкадиены» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 |
|
|
Цепочки «Циклы и алкадиены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Алкины» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 |
|
|
Сложные эфиры |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Цепочки «Сложные эфиры» |
|
|
1 2 3 4 5 |
|
|
Цепочки «Алкины» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Арены 2.0» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 |
|
|
Цепочки «Арены» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Тест «Спирты и фенолы» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 |
|
|
Цепочки «Спирты и фенолы» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Цепочки «Альдегиды и кетоны» |
|
|
1 2 3 4 5 6 7 8 9 10 |
|
|
Цепочки «Карбоновые кислоты» |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 |
|
|
Карточки с похожими реакциями |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 |
|
|
Задание №10 ЕГЭ. Номенклатура и классификация органических веществ. |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 |
|
|
Задание №11 ЕГЭ. Строение органических веществ. Изомеры и гомологи. |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Задание №12. Свойства углеводородов и кислородсодержащих веществ |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
|
Задание №13 ЕГЭ. Азотсодержащие вещества, углеводы, жиры |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 |
|
|
Задание №14 ЕГЭ. Свойства углеводородов |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 |
|
|
Задание №33 ЕГЭ. Вывод формулы органического вещества |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 |
|
|
Свойства и способы получения углеводородов |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 |
|
|
Свойства и способы получения кислородсодержащих органических веществ |
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 |
|
Пройти тестирование по 10 заданиям
Пройти тестирование по всем заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) метилбензол
Б) анилин
В) 3-метилбутаналь
КЛАСС/ГРУППА
1) альдегиды
2) амины
3) аминокислоты
4) углеводороды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2017 по химии, Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ−2019 по химии
2
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутен-1
Б) циклопропан
В) бутадиен-1,3
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
3
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутин
Б) циклогексен
В) бутадиен-1,2
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
4
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутан
Б) бутин-1
В) циклогексан
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
5
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутадиен-1,3
Б) 2-метилпропанол-1
В) этилформиат
КЛАСС (ГРУППА) ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) простые эфиры
2) сложные эфиры
3) спирты
4) углеводороды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Пройти тестирование по этим заданиям
Типовые (тематические) тесты в формате ЕГЭ по химии по каждому заданию. Тренировочные тесты, которые соответствуют заданиям ЕГЭ-2023 по химии по темам КИМ ЕГЭ по химии.
Хотите видеть больше интересных материалов? Вы можете поддержать работу сайта:
Обратите внимание! Форма выше — это форма для сбора донатов на работу сайта.
Полные тренировочные варианты ЕГЭ по химии с автопроверкой первой части
Спецификация ЕГЭ по химии-2023
| Номер задания | Тематические тесты по теме |
| 1 | Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояния атомов |
| 2 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов |
| 3 | Электроотрицательность. Степень окисления и валентность химических элементов |
| 4 | Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения |
| 5 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) |
| 6 | Характерные химические свойства простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка). Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена |
| 7 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). Характерные химические свойства неорганических веществ: – простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) |
| 8 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная); Характерные химические свойства неорганических веществ: – простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) |
| 9 | Взаимосвязь неорганических веществ |
| 10 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) |
| 11 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа |
| 12 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории). Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории) |
| 13 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки |
| 14 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Важнейшие способы получения углеводородов. Ионный (правило В.В. Марковникова) и радикальные механизмы реакций в органической химии |
| 15 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих органических соединений |
| 16 | Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений |
| 17 | Классификация химических реакций в неорганической и органической химии |
| 18 | Скорость реакции, её зависимость от различных факторов |
| 19 | Реакции окислительно-восстановительные |
| 20 | Электролиз расплавов и растворов (солей, щелочей, кислот) |
| 21 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная |
| 22 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов |
| 23 | Обратимые и необратимые химические реакции. Химическое равновесие. Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ |
| 24 | Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений |
| 25 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки |
| 26 | Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе» |
| 27 | Расчёты теплового эффекта (по термохимическим уравнениям) |
| 28 | Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси |
| 29 | Окислитель и восстановитель. Реакции окислительно-восстановительные
Задания 29 (ранее 30) из реального ЕГЭ по химии 2021 Задания 29 (ранее 30) из реального ЕГЭ по химии 2020 |
| 30 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена
Задания 30 (ранее 31) из реального ЕГЭ по химии 2021 Задания 30 (ранее 31) из реального ЕГЭ по химии 2020 |
| 31 | Тренажер задания 31 по химии железа
Тренажер задания 31 ЕГЭ по химии щелочных металлов Тренажер задания 31 ЕГЭ по химии щелочноземельных металлов Тренажер задания 31 по химии азота Тренажер задания 31 по химии алюминия Тренажер задания 31 по химии галогенов Тренажер задания 31 по химии марганца Тренажер задания 31 по химии меди Тренажер задания 31 по химии серы Тренажер задания 31 по химии углерода и кремния Тренажер задания 31 по химии цинка Тренажер задания 31 по химии хрома Задания 31 (ранее 32) из реального ЕГЭ по химии 2021 Задания 31 (ранее 32) из реального ЕГЭ по химии 2020 |
| 32 | Реакции, подтверждающие взаимосвязь органических соединений
Органические цепочки (задания 32, ранее 33) из реального ЕГЭ по химии 2021 Органические цепочки (задания 32, ранее 33) из реального ЕГЭ по химии 2020 |
| 33 | Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества.Расчёты массовой доли (массы) химического соединения в смесиРасчетные задачи по неорганике (задания 33, ранее 34) из реального ЕГЭ по химии 2021Расчетные задачи по неорганике (задания 33, ранее 34) из реального ЕГЭ по химии 2020 |
| 34 | Установление молекулярной и структурной формул вещества
Расчетные задачи, органическая химия (задания 34, ранее 35) из реального ЕГЭ по химии 2021 Расчетные задачи, органическая химия (задания 34, ранее 35) из реального ЕГЭ по химии 2020 |
Органические цепочки из ЕГЭ с решениями.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) Уравнение спиртового брожения глюкозы под действием дрожжей:
2) Этиловый спирт сернокислым раствором перманганата калия может быть окислен до уксусной кислоты:
3) Уравнение нейтрализации уксусной кислоты гидроксидом натрия:
4) Взаимодействие солей карбоновых кислот со щелочами при сплавлении приводит к образованию углеводорода с меньшим числом атомов углерода
5) Алканы вступают в реакцию нитрования с разбавленной азотной кислотой при сильном нагревании:
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) При нагревании одноатомных спиртов с концентрированной серной кислотой выше 140 оС протекает внутримолекулярная дегидратация с образованием алкена:
2) Алкены вступают в реакцию соединения с бромом. При этом атомы брома присоединяются по месту двойной связи, сами двойная связь превращается в одинарную:
3) Вицинальные дигалогенпроизоводные углеводородов при нагревании с некоторыми металлами, например, цинком или магнием, образуют алкены:
4) Гидратация несимметричных алкенов протекает в соответствии с правилом Марковникова:
5) Вторичные спирты в ЕГЭ окисляем до соответствующих кетонов (углеродный скелет не рвем):
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) При бромировании бутана на свету образуется преимущественно 2-бромбутан:
2) При действии на галогенпроизводные алканов спиртового раствора щелочи при нагревании образуется алкен. Реакция протекает для 2-бромбутана в соответствии с правилом Зайцева:
3) Бутен-2, реагируя с бромом, образует 2,3-дибромбутан:
4) 2,3-дибромбутан при реакции с избытком спиртового раствора щелочи образует бутин-2:
5) Гидратация алкинов с числом углеродных атомов в молекуле больше 2-х приводит к образованию кетонов:
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
v1) Реакция алкенов с нейтральным холодным раствором перманганата калия приводит к образованию соответствующих вицинальных диолов:
2) Взаимодействие этиленгликоля с избытком бромоводорода приводит к образованию 1,2-дибромэтана:
3) Дегидрогалогенирование вицинальных дигалогеналканов действием спиртового раствора щелочи приводит к образованию соответствующих алкинов:
4) В результате гидратации ацетилена в присутствии солей ртути образуется ацетальдегид:
5) Совместное нагревание ацетальдегида с гидроксидом меди (II) приводит к его окислению до уксусной кислоты. Гидроксид меди (II) при этом восстанавливается до оксида меди (I) (кирпично-красный осадок):
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Задание №6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Задание №7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Задание №8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Задание №9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Задание №10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
[adsp-pro-3]
Задание №11
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №12
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №13
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №14
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №15
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №16
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №17
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №18
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №19
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №20
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
[adsp-pro-3]
Задание №21
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №22
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №23
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №24
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №25
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №26
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №27
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №28
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №29
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №30
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
[adsp-pro-3]
Задание №31
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: При написании уравнений реакций используйте структурные формулы органических веществ. Решение
Ответ:
Задание №32
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №33
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №34
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №35
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №36
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №37
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №38
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №39
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №40
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
[adsp-pro-3]
Задание №41
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №42
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №43
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №44
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №45
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №46
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №47
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №48
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №49
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
Задание №50
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Ответ:
[adsp-pro-10]
1 лист.
Реакции к основным темам курса 10 класса (для запоминания), проф. класс.
1. Алканы (предельные, насыщенные). Общая формула – СпН2п+2.
М (СпН2п+2)=(14п+2)г/моль, σ-связи, SP3-гибридизация, <109’28», тетраэдр.
1. р.галогенирования (р. замещения по радикальному механизму) проходит на свету: R-Н + Вr2 →R-Вr + НВr (галогены только в газообразном состоянии);
2. р. нитрования – р. Коновалова (р. замещения, радик. мех-зм):
R-Н + НО – NО2(разб) −→ R-NО2 + Н2О │
внимание: замещение атомов водорода у третичного атома (—с—) проходит легче, чем у вторичного атома(—с—) и тем более первичного атома (с—).
3. р. изомеризации (у С4Н10 и следующих) в присутствии катализатора – AlCl3:
СН3-СН2-СН2-СН3 —→ СН3-СН (СН3)-CН3
4.крекинг (разрыв связей между атомами углеродов, радик. мех-зм) под действием температуры и катализатора:
С8Н18→С4Н10+С4Н8
5. р. элиминирования – образование веществ с кратными связями за счет отрыва атомов или групп атомов: 2СН4→С2Н4↑+2Н2↑ при t=5000С-10000С
2СН4→С2Н2↑+3Н2↑ при t=10000С-15000С
2СН4→2С+4Н2↑ при t>15000С (пиролиз)
6. р. ароматизации – получение ароматических углеводородов за счёт отрыва атомов водородов в присутствии катализаторов: С6Н12 → С6Н6 + 3Н2↑
7. р. горения — ( + О2) СпН2п+2 + (3п+1)/2О2 → пСО2↑ + (п+1) Н2О + Q (экзотерм.)
. р. окисления метана ( +[О]) даёт продукты, в зависимости от условий:
СН4 из воздуха→ СН3ОН
→НСНО
→НСООН
8. р. Вюрца («удвоение») 2СН3Cl + 2Na → 2NaCl + C2H6, в кислой среде.
9. получение алканов: а) С+2Н2 → СН4↑ под действием эл. разряда;
б) СН3-СООNa + NaOH → CH4↑ + Na2CO3 при спекании сухих веществ
в) Al4C3 + 12НОН → 3СН4↑ + 4Al(ОН)3↓; г) Al4C3 + 12НСl→ 3СН4↑ + 4AlСl3.
2. Циклоалканы (предельные). Общая формула – СпН2п.
М (СпН2п)= 14п г/моль, σ-связи, SP3-гибридизация, <от 60′ до 109′, цикл.
1. р. присоединения (+Н2, +Вr2,+НI) у циклов с 3,4 5 атомами углерода
C3H6 + Br2 = Br-CH2-CH2-CH2Br;
2. р. замещения – аналогично алканам (циклы с 6 и > атомами углерода);
3. р. элиминирования (дегидрирования) С6Н12 → С6Н6 + 3Н2↑(катализ: Ni, t)
4. р. окисления – на примере циклогексана сильным окислителем:
С6Н12 + 4[О] → СН2-СН2-СООН
│
СН2-СН2-СООН (адипиновая кислота)
3. Алкены (непредельные). Общая формула – СпН2п.
М (СпН2п)= 14п г/моль, σ- и π-связи, SP2-гибридизация, < 120′, треугольник.
1.р. присоединение Н2, НГ, Г2 и Н2О (разрыв С=С связи, электрофильный мех-зм)
а) гидрогалогенирование:СН2=СН2 + НBr → СН3-СН2Br
в случае несимметричной π-связи по правилу Марковникова (Н к СН2):
2 лист
СН3-СН=СН2 + НBr → СН3-СНBr-СН3; продолжение см. дальше.
б) гидратация:СН3-С=СН2 + НОН → СН3-С(ОН)-СН3 (в присутствии минерал кислот)
│ │
СН3 СН3
в) галогенирование (обесцвечивание раствора бромной воды – Br2) – качественная реакция на кратную связь, как и реакция с раствором КМпО4:
СН2 = СН2 + Br2 → BrСН2-СН2Br
г)гидрирование: СН3-СН=СН2 + Н2 → СН3-СН2-СН3 (катализатор – Ni, t)
2.р. замещения (радикальный мех-зм) – замещение атома Н на соседнем с двойной связью атоме углерода, при t=5000С: СН3-СН=СН2 + Cl2 → ClСН2-СН=СН3 + НCl
3.р. окисления:а) мягкое – холодным раствором КМпО4(р. Вагнера)
СН2 = СН2 + [О] + Н2О → СН2ОН-СН2ОН (упрощенная запись)
или 3СН2 = СН2 + 2КМпО4 + 4Н2О → 3СН2ОН-СН2ОН + 2МпО2↓ + 2КОН
б)жесткое – кипящим раствором КМпО4 в кислой среде
СН3-СН=СН-СН3 + 4[О] → 2 СН3-СООН
4.р. полимеризации: пСН2=СН2 → ( — СН2-СН2 — ) в кислой среде.
5.получение алкенов: а) С7Н16 —→ C4Н10 + CН3-CН=CН2 (t,Kat);
б) СН3-СН2-СНBr-СН3 + КОН (спирт)→СН3-СН=СН-СН3 + КBr + Н2О
в) СН3-СН-СН3 → СН3-СН=СН2 + Н2О (t=1500С, в кислой среде) по правилу Зайцева
│
ОН
г) СН2Br- СНBr-СН3 + 2К → СН2=СН-СН3 + 2КBr – синтез Вюрца—Крафтса
д) СН3-СН2-СН3 → СН3-СН=СН2 + Н2↑ в присутствии Kat – Cr2O3
4. Алкадиены (непредельные). Общая формула – СпН2п-2.
М (СпН2п-2)= (14п-2) г/моль, σ- и 2π-связи, SP2-гибридизация.
1. р. присоединения: →СН2Br-СНBr-СН=СН2 (присоединение по 1,2)
СН2=СН-СН=СН2 + Br2 →[
→ СН2Br-СН=СН=СН2Br (присоединение по 1,4)
2. р. полимеризации: пСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-) в кислоте
3. диеновый синтез – р. Дильса-Альдера- р.циклизации
СН2-СН=СН-СН2 + СН2=СН2 → С6Н10 при нагревании, под давлением.
4. получение алкадиенов:
а) СН3-СН2-СН2-СН3 → СН2=СН-СН=СН2 + 2Н2↑ при t, Kat – Cr2O3;
б) 2С2Н5ОН → СН2=СН-СН=СН2 + Н2↑ + 2Н2О при t, Kat – Al2O3, ZnO р. Лебедева.
5. Алкины (непредельные). Общая формула – СпН2п-2.
М (СпН2п-2)= (14п-2) г/моль, σ- и 2π-связи, SP-гибридизация, линейное строение
обладают слабыми кислотными свойствами
1.р. электрофильного присоединения (медленнее, чем у алкенов) — Br2, Н2 и НСl
СН≡СН + Br2 → СНBr=СНBr, далее СНBr=СНBr+ Br2 → СНBr2-СНBr2
2.р. гидратации – р. Кучерова, в кислой среде, Kat – Hg2+
любой алкин образует кетон СН3-С≡СН + НОН →СН3-С (СН3)=О,
только ацетилен СН≡СН + НОН →СН3-СНО — альдегид
3. р. окисления раствором КМпО4: R-C≡C-R’ + 3[О] + HOH → R-COOH + R’-COOH
4.р. гидрирования СН3-С≡СН + Н2 → СН3-СН=СН2, далее СН3-СН=СН2 +Н2 →С3Н8
3 лист
при нагревании, в присутствии катализатора – Pt, Pd
продолжение см дальше
5.слабые кислотные свойства у алкинов с «концевой» кратной связью:
2СН≡СН + 2Na → 2NaC≡CNa + H2, с аммиачным раствором оксида серебра
СН≡СН + [Ag(NH3)2]OH → AgC≡CAg + 4NH3 + 2H2O
6. р. полимеризации: СН≡СН + СН≡СН → СН2=СН-СН=СН2, катализатор –NH4CL
или р. Зелинского 3СН≡СН → С6Н6, условия – активир-ый уголь (Сакт, t=6000С)
7. а): СаС2 + 2НОН → С2Н2↑ + Са(ОН)2↓; б) СаС2 + 2НCL → С2Н2↑ + СаCL2;
в) 2СН4 → С2Н2↑ + 3H2 при t=15000С
6. Арены (непредельные, циклические, ароматические).
Общая формула – СпН2п-6, М (СпН2п-6)= (14п-6) г/моль,
локализованное π-облако, SP2-гибридизация, циклическое строение
1. Р. электрофильного замещения:
а) галогенирование: С6Н6 + CL2 → С6Н5CL + НCL , катализатор – АLCL3
б) нитрование: С6Н6 + НО – NО2 → С6Н5-NО2 + Н2О, в присутствии H2SO4
в) алкилирование — р. Фриделя-Крафтса – удлинение цепи атомов углерода
С6Н6 + RCl → C6H5-R + HCl, где R – CnH2n+1 (радикалы), катализатор — АLCL3
2. р. присоединения в жёстких условиях – свет, катализатор— Ni (присоединение Н2) а) С6Н6 + 3Н2 → С6Н12
б) С6Н6 + 3CL2 → С6Н6CL6 на свету
3. для гомологов бензола:
а) замещение атомов водорода в цикле (катализаторы FeBr3 и H2SO4)
С6Н5-СН3 + Br2 → о—С6Н4(Br)СН3 +НBr в ортоположении, т.е. 1-бром-2-метилбензол
а также →п—С6Н4(Br)СН3 +НBr в параположении, т.е. 1-бром-4-метилбензол
помнить: у гомологов бензола замещение в цикле атомов водорода
происходит с равной вероятностью в положении 2, 4, 6 относительно имеющегося радикала в присутствии катализаторов FeBr3 и H2SO4.
б) С6Н5-СН3 + 3НО – NО2 → С6Н2(NО2)3 + 3Н2О 1-метил-2,4,6,-тринитробензол.
в) присоединение 2 С6Н5-СН3+ 5Н2 → 2 С6Н11-СН3 или −СН3, метилциклогексан.
г) радикальное замещение в боковую цепь на свету:
С6Н5-СН3 + Br2 → С6Н5-СН2Br + НBr
д) окисление кислым раствором КМпО4
С6Н5-СН3 + 2[О] → С6Н-СООН — упрощенная запись, полная запись:
5С6Н5-СН3 + 6КМпО4 + 9H2SO4 → 5С6Н5-СООН + 3К2SO4 + 6МпSO4 + 14Н2О
электронно-ионный баланс:
С6Н5-СН30 + 2Н2О0 −6е —_→ С6Н5-СООН0 + 6Н+ │5
МпО4— + 8Н+ +5е—→ Мп2+ + 4Н2О │6
4. получение аренов: а) С6Н14 → С6Н6 + 4Н2↑, условия: t, Р, катализатор – Сr2O3
б) С6Н12→ С6Н6 + 3Н2↑, условия: t, катализатор – Pd
в) 3СН≡СН→ С6Н6, условия – активир-ый уголь (Сакт, t=6000С)
г) С6Н5-СООNa + NaOH → C6H6 + Na2CO3 при спекании сухих веществ.
4 лист
Кислородсодержащие соединения.
1. Одноатомные спирты — алканолы (предельные).
Общая формула – R-ОН или СпН2п+2О, М (СпН2п+2О)= (14п+18) г/моль,
Наличие гидроксогруппы — ОН в молекулах спиртов проявляется в слабых кислотных и основных свойств.
1. проявляют кислотные свойства (только реакции с щелочными Ме), убывающие от первичных к третичным спиртам: 2 С2Н5ОН + 2К → 2 С2Н5ОК + Н2↑;
2. слабые основные свойства, возрастающие от первичных к третичным спиртам:
R – ОН + НBr → R – Br + H2O
3. р. этерификации – взаимодействие с кислотами и образование сложных эфиров:
Н+
RСООН + НОR’ ↔ RСООR’ + Н2О (в кислой среде);
4. р. окисления подкисленными растворами КМпО4 или К2Сr2О7: а) первичные окисляются в 2 стадии до кислот т.к. имеют 2 атома [Н] на углероде при ОН-группе: 1стад. 2 стад.
R — СН2 – ОН + [О] → R — СН2 = О (альдегид); …+ [О] → R – СООН (кислота);
б) вторичные окисляются до кетонов т.к. имеют1 атом [Н] на углероде при ОН-группе: 1стад.
R — СН – ОН + [О] → R — С = О
│ │
R’ R’
5. р. дегидратации в присутствии раствора Н2SO4 (Al2O3, H3PO4 конц) зависит от температуры:
а) при t > 1500С – внутримолекулярная (Н2О отрывается от 1 молекулы):
СН3 – СН2 – СН2 – ОН (+Н2SO4) → СН3 – СН = СН2 + Н2О, продукт — алкен
б) при t < 1500С – межмолекулярная (Н2О отрывается от 2 молекул):
СН3 – СН2 –– ОН + СН3 – СН2 –– ОН (+Н2SO4) → СН3 –СН2 — О – СН2 – СН3+ Н2О,
продукт – простой эфир.
Различные классы спиртов дегидратируются при различных условиях:
первичные: СН2 – СН2 (конц. Н2SO4 при нагревании) → СН2 = СН2
│ │
Н ОН
вторичные: СН2 – СН – СН3 (конц. Н2SO4 при подогреве) → СН2 = СН
│ │ │
Н ОН СН3
СН3 СН3
│ │
третичные: СН2 – С – СН3 (конц. Н2SO4 на холоде) → СН2 = С
│ │ │
Н ОН СН3
6.Галогенирование: в присутствии PCl5, SOCl2 или HCL
СН3 – СН2 – ОН + SOCl2 → СН3 – СН2 – Cl + SO2 + HCL
6. Получение: а) СН3 – СН=СН2 + НОН → СН3 – С (СН3)Н — ОН (из алкенов);
5 лист
б) R – Br + NaOH (раствор) → R – ОН + NaBr (щелочной гидролиз галогеналканов); в) R – СНО + 2[Н] → R — СН2 – ОН (из альдегидов);
г) С≡О + 2Н2 (t, p, ZnO) → СН3ОН (из синтез-газа);
д) С6Н12О6 (брожение) → С2Н5ОН + 2СО2↑. см. продолжение.
7. качественные реакции на: а) предельные одноатомные спирты – CuO, t
С2Н5ОН + CuO → СН3 – СНО + Cu + Н2О
б) предельные многоатомные спирты – Cu (ОН)2, свежеприготовленный раствор
2 СН2 – ОН + Cu (OН)2 → (СН2 – О)2Cu + 2 Н2О
│ │
СН2 – ОН СН2 – ОН – ярко-синий раствор.
2. Ароматические спирты – фенолы (циклические, непредельные).
Общая формула – R-(ОН)m или СпН2п-6-m(ОH)m,
М (СпН2п-6-m(ОН)m)= (14п-6 +16m) г/моль,
SP2 – гибридизация
1. подвижность атома водорода и выраженные кислотные свойства –
а) реакции с Ме: С6Н5ОН + К → С6Н5ОК + 0,5Н2 ↑;
б) реакции со щелочами: С6Н5ОН + КОН → С6Н5ОК + НОН;
в) реакция с р-ром карбоната натрия (фенол в нём растворяется, но в отличие от обычных кислот не образует диоксида углерода):
С6Н5ОН(aq) + CO32-(aq) −→ C6H5O—(aq) + HCO3—(aq)
2. реакции с хлор-альдегидом: С6Н5ОН + СН3ССlO → С6Н5 – О – C(CH3)O + HCl;
3. р. электрофильного замещения протекают легче, чем у аренов:
С6Н5ОН + СН3 – С = О −→С6Н5 – О – С = О + НСl
│ │
Cl СН3
а) реакция с раствором бромной воды – 1-я качественная реакция на фенолы
С6Н5ОН + 3 Br2 → С6Н2(ОН)Br3↓ + 3НBr – 2,4,6 – трибромфенол (белая эмульсия)
б) реакция нитрования — С6Н5ОН + 3 НО – NO2 → С6Н2(ОН)(NO2)3 + 3 НОН
в присутствии Н2SO4 получается 2,4,6 – тринитрофенол,
в) получение фенолформальдегидной смолы – р. поликонденсации
С6Н5ОН (фенол) + НСНО (формальдегид) →С6Н4(ОН) – СН2ОН — 1-я стадия;
n С6Н4(ОН) – СН2ОН + n С6Н5ОН →( С6Н4(ОН) – СН2 – С6Н4(ОН))n + n НОН.
4. реакция с раствором FeCl3 – 2-я качественная реакция на фенолы
3 C6Н5ОН + FeCl3 → (С6Н5О-)3Fe + 3НCl (ярко-фиолетовый раствор).
4. Получение: а) из каменноугольной смолы;
б) С6Н5 Br + КОН → С6Н5ОН + КBr
в) С6Н5 – СН (СН3)2 + 2 [О] → С6Н5 – ОН + (СН3)2СО.
3. Альдегиды. Общая формула – R-С = О или СпН2п О.Мr (СпН2пО) =(14п+16)
│
Н
SP2 – гибридизация
1.Реакции нуклеофильного присоединения:
6 лист
а) R – СНО + НСN −KCN→ R – CH(OH) – C ≡ N;
б) R – СНО + R’OH −H+→ R – CH – OH −R’OH→ R – CH — OR’ + H2O
│ │
OR’ (полуацеталь) OR’ (ацеталь);
см. дальше
╔O ╔O
в) R – СНО + NaHSO3 (:S – ONa) → R – CH – S — ONa
│ │ O╝
OH OH
г) р. восстановления R – СНО + H2 −LiAlH4→ R – CH2 – OH
Внимание: водород легко присоединяется по связи С=С и очень трудно – по связи С=О. LiAlH4 восстанавливает связи С=О до С – ОН, не затрагивая связь С=С.
О ← ОН
║ │ │
СН3 – С – Н + Н – О – СН3 → СН3 – СН – О – СН3, LiAlH4 — алюмогидрид лития.
2. Окисление: легко окисляются в кислоты – качественные реакции на альдегиды – реакции «серебряного» и «медного» зеркала
а) R – CHO + 2 [Aq(NH3)2]OH → R – COO – NH4 + 2Aq↓ + 2NH3↑ + H2O:
реактив [Aq(NH3)2]OH – реактив Толленса
б) R – CHO + 2 Cu(OH)2 → R – COOH + Cu2O↓ + 2H2O:
реактив Cu(OH)2 – реактив Фелинга
или упрощённо — R – CHO + [О] → R – CОOН
3. Получение: а) из спиртов R–СН2-ОН + CuО −t→ R–СНО + Н2О + Cu
б) из дигалогензамещённых алканов:
R – CHCl2 + 2 NaОН → R – CHO + 2 NaCl + Н2О
4. Кетоны. Общая формула – R-С = О или СпН2п О. Мr (СпН2пО) =(14п+16)
│
R
SP2 – гибридизация
1. Химические свойства отличаются от свойств альдегидов:
а) менее активны в реакциях нуклеофильного присоединения, чем альдегиды (с цианидом водорода в присутствии цианида калия)
R – С=О + НСN −KCN→ R – C (OH) – C ≡ N;
│ │
R R
б) присоединение реактива Гриньяра – R – MqBr с образованием третичного спирта
R – С=О + R – MqBr −2HCl→ R – C (OH) – R + MqCl2 + HBr
│ │
R R
в) гидрирование кетонов с образованием вторичных спиртов
7 лист
R – С=О + Н2− → R – CН (OH)
│ │
R R
г) окисление с трудом, не взаимодействуют с соединениями серебра и меди
2. Иодоформный тест – если карбонильная группа связана со 2-ым атомом углерода от конца углеродной цепи (со щелочным раствором иода)
СН3 – СО – R + I2 −OH-→ R – COO—(aq) + CHI3(тв), жёлтый осадок, такой же, как и для CH3 – CH (OH)R.
5. Карбоновые кислоты. Общая формула – R-С = О или СпН2пО.
│
Мr (СпН2пО) =(14п+16) ОН
SP2 – гибридизация
1. Диссоциируют, т.е. являются донором катиона водорода – слабые электролиты, самая сильная из них – муравьиная НСООН
R – СООН ↔ R – СОО— + Н+, сл-но, характерны свойства, типичные для кислот – взаимодействие с Ме, основными оксидами, основаниями и солями слабых кислот.
2. р.замещения группы ОН на хлор, взаимодействие с хлоридом Р(V)
R – СООН + РСl5 → R – С = О + POCl3 + HCl
│
Сl
3.межмолекулярная дегидратация в присутствии Р2О5 или НРО3
R – СООН + Н – О – СО – R — Р2О5→ R – СО – О – СО — R + Н2О (ангидрид к-ты),
4. р. этерификации – образование сложных эфиров в присутствии Н2SO4
R – СООН + Н — О R′ − Н2SO4→ R – СО — О R′ + Н2О
остаток кислоты ↓ остаток спирта
5. получение амидов в реакциях с раствором аммиака, при нагревании
R – С = О + NH3 −t→ R – С = О + H2O
│ │
ОН NH2
6. р. замещения атома водорода у α–атома (С) на атом брома, в присутствии Ркр
СН3 – СН2 – СООН + Br2 − Ркр→ CH3 – CHBr – COOH + HBr;
7. р. дегидратации и гидрирование, в присутствии LiAlH4 (см. «альдегиды»)
R – С = О + 2 Н2 −LiAlH4→ R – СН2ОН + Н2О т.е. восстановление до спиртов.
│
ОН
8.Внимание: муравьиная кислота – самая сильная из органических кислот и
сильный восстановитель,
отсюда следует:
а) НСООН − Н2SO4→ СО2↑ + Н2О;
б) р. «зеркала» НСООН + 2 [Ag(NH3)2]OH −t→ 2 Ag↓ + (NH4)2CO3 + 2NH3 + H2O
или упрощенно НСООН + Ag2О −t→ 2Ag↓ + СО2↑ + Н2О;
в) НСООН + Cl2 → CO2↑ + 2HCl
9. Получение: а) из спиртов (окисление, т.е. + [О])
R – СН2 – ОН + [О] → R – СНО (альдегид) и дальше + [О] → R – СООН (кислота);
б) из альдегидов – р. «серебряного и медного зеркала»
8 лист.
R – СНО + [Ag(NH3)2]OH −t→ Ag↓ + R – СООNН4 + Н2О + NH3
б) из реактива Гриньяра (R – MgBr) – р. элиминирования и гидратации (последовательное взаимодействие с СО2 и Н2О):
R – MgBr + CO2 → R – COO – MgBr…….. + H2O → R – COOH + Mg (OH) Br
в) из трихлорзамещенного алкана (последовательное замещение атомов хлора на группы ОН из щелочей и дегидратация)
R – С (Cl)3 + 2 NaOH → 3NaCl + R – C(OH)3….→ R – COOH + H2O
R – C (OH)3 – трёхатомный спирт – вещество очень слабое и нестабильное.
продолжение см. дальше
6. Сложные эфиры карбоновых кислот. Общая формула – R-С = О
│
О R′
Мr (СпН2п+1СОО)(СпН2п+1)′ = (14п+46)
1. р. гидролиза: а) кислотного СН3СООСН3 + НОН −H+→ СН3СООН + НОСН3
(кислота) (спирт)
б) щелочного СН3СООСН3 + NaOH → СН3СООNa + СН3ОН
р. гидролиза с Н2О идёт медленно, её катализируют (ускоряют) кислоты и щёлочи
2. р. восстановления, в присутствии LiAlH4 с образованием 2-х спиртов:
R – СОО — R′ + 4 [Н+] −LiAlH4→ R – CH2 – OH + R′ОН (аналогично альдегидам);
3. Получение: а) р. этерификации R – СООН + НО R′ − Н2SO4↔ R – СОО — R′ + Н2О
особенность: медленная реакция, обратимая, с низким выходом.
б) р. ацилирования спирта хлоридом кислоты
СН3СОCl + НОСН2СН3 → СН3СООСН2СН3 + HCl (р. быстрая, хороший выход).
Хлорангидриды и ангидриды кислот
Эти два вида производных карбоновых кислот химически очень активны. Хлорангидриды даже более активны, чем ангидриды, и более летучи, что делает обращение с ними очень трудным. Они вступают в быструю реакцию на холоде с водой, аммиаком и с их производными, спиртами и аминами. В каждом случае атом водорода реагирующей молекулы замещается ацильной группой – это реакции ацилирования, а хлорангидриды и ангидриды кислот-ацилирующие агенты.
С хлорангидридами:
а) вода: СН3СОCl + НОН → СН3СО – ОН (кислота) + HCl;
б) спирт: СН3СОCl + НОСН2СН3 → СН3СО – ОСН2СН3 (эфир) + HCl;
в) аммиак: СН3СОCl + 2Н−NH2 → СН3СО – NH2 (амид) + NH4Cl;
г) амин: СН3СОCl + НNHСН3 → СН3СО – NHСН3 (замещ. амид) + HCl;
↑
этот атом водорода замещается на ацильную группу.
С ангидридами кислот:
а) вода: СН3СОООССН3 + НОН → СН3СО – ОН + СН3СООН;
б) спирт: СН3СОООССН3 + НОСН2СН3 → СН3СО – ОСН2СН3 + СН3СООН;
в) аммиак: СН3СОООCСН3 + Н−NH2 → СН3СО – NH2 + СН3СООН;
г) амин: СН3СОООCН3 + НNHСН3 → СН3СО – NHСН3 + СН3СООН.
7. Углеводы. Общая формула – Сn (Н2О)m. Mr = 12n + 18m.
9 лист
1. Глюкоза – альдегидоспирт СН2ОН – (СНОН)4 — СНО, т.е. имеет р. «зеркала»
СН2ОН – (СНОН)4 – СНО + 2 [Ag(NH3)2]OH −t→ СН2ОН – (СНОН)4 – СОО — NH4 + 3NH3 + H2O + 2 Ag↓
2. р. восстановления до многоатомных спиртов:
СН2ОН – (СНОН)4 – СНО + 2[Н] → СН2ОН – (СНОН)4 – СН2ОН (сорбит);
3. синее окрашивание с Си(ОН)2, как у многоатомных спиртов;
4. р. межмолекулярной дегидратации со спиртами: → простые эфиры;
5. р. этерификации с альдегидами → сложные эфиры;
6. брожение: С6Н12О6 −дрожжи→ 2 С2Н5ОН + 2 СО2↑ — спиртовое брожение;
С6Н12О6 −→ 2 СН3 – СН (ОН) – СООН — молочнокислое брожение.
8. Азотсодержащие соединения – амины. Общая формула – R- NH2,
R – NH – R или N(R)3. Мr (R- NH2) = (14п+17)
1. Амины обладают основными свойствами, поэтому, как основания,
а) реагируют с водой: R- N:H2 + Н2О ↔ [R- NH3]+ ОН−
б) реагируют с кислотами: R- N:H2 + Нδ+Cl δ- ↔ [R- NH3]+ Cl−
2. Реакция горения: 4 С2Н5 + N:H2 + 15О2 → 8СО2↑ + 2N2↑ + 14Н2О.
3. Р. нитрирования (с НО – NО) проходит по-разному:
а) у первичных аминов:
R- NH2 + НО – NО (NaNO2 + HCl) → R – OH + N2↑ + NaCl + H2O;
б) у вторичных аминов:
R2 – NH + НО – NО (NaNO2 + HCl) → R2N – N=O + NaCl + H2O.
4. Анилин – ароматический амин с формулой С6Н5 — NH2
в реакции нитрирования:
С6Н5 — NH2 + НО – NО (NaNO2 + HCl) → [С6Н5 — N≡N]+Cl− + NaCl + 2H2O;
5. Качественная реакция на анилин – реакция с раствором брома:
С6Н5 — NH2 + 3Br2 → C6H2Br3NH2↓ + 3 HBr
6. Получение аминов:
а) NH3 + CH3Cl −t→ CH3 – NH2 + HCl;
б) R – NO2 + 4 [H] −LiAlH4→ R – NH2 + 2H2O
7. Получение анилина:
) C6H5 – NO2 + 6 [H] −Fe + HCl→ C6H5 – NH2 + 2H2O
9. Азотсодержащие соединения – аминокислоты
…β α
Общая формула – R – СН — СООН
│
NH2 Мr (к-ты) = (14п+75)
1.Аминокислоты обладают амфотерными свойствами, поэтому реагируют:
а) с кислотами H2N – CH2 – COOH + HCl → Cl [NH3 – CH2 — COOH];
б) c щелочами H2N – CH2 – COOH + NaOH → NH2 – CH2 – COONa + H2O.
2. Р. этерификации – взаимодействие со спиртами:
H2N – CH2 – COOH + С2Н5OH −H+→ H2N – CH2 – COO – С2Н5 + Н2О
3. Р. поликонденсации — взаимодействие кислот между собой с образованием пептидов: пептидная связь
H2N – CH2 – COOH + H—N – CH2 – COOH → H2N – CH2 – CO—N – CH2 – COOH
│ Дипептид │
Н Н
4. Получение: α- аминокислоты из α-хлорзамещенных карбоновых кислот
R – СН – СООН + 2 H3N → R – СН – СООН + NH4 Cl
│ │
Cl NH2
Окислительно – восстановительные реакции в органической химии.
А. Углеводороды.
1. СН2 = СН – СН2 – СН3 + КМпО4 + Н2О → СН2 – СН – СН2 – СН3 + МпО2 + КОН
│ │
ОН ОН
2. С6Н5 – СН2 – СН3 + КМпО4 + Н2SО4 → С6Н5СOOН + MnSO4 + K2SO4 + CO2 + H2O
3. СН2 = СН – СН2 – СН3 + КМпО4+ Н2SО4 → HCOOH + CH3COOH + MnSO4 + K2SO4 + H2O
4. CH ≡ CH + КМпО4 + Н2О → H2C2O4 + MnO2 + KOH
5. С6Н5 – СН3 + КМпО4 + Н2SО4 → С6Н5СOOН + MnSO4 + K2SO4 + H2O
6.
За это задание ты можешь получить 5 баллов. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 44.9%
Ответом к заданию 32 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$C_2H_4 →↖{KMnO_4, H_2O, 0 °C} X_1 →↖{HCl_{(изб.)}} X_2 → CH≡CH →↖{H_2O (Hg^{2+})} Х_3 →↖{[Ag(NH_3)_2]OH} Х_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $3CH_2=CH_2 + 2KMnO_4 + 4H_2O → 3CH_2(OH)–CH_2OH + 2MnO_2 + 2KOH$
2) $CH_2(OH)–CH_2OH + 2HCl → CH_2Cl–CH_2Cl + 2H_2O$
3) $CH_2Cl–CH_2Cl + 2KOH_{(спирт.)} → CH≡CH + 2KCl + 2H_2O$
4) $CH≡CH + H_2O →↖{Hg^{2+}}$
5) $CH_3CHO$ + $2[Ag(NH_3)_2]OH$ → 2Ag + $3NH_3$ + $H_2O$ + $CH_3COONH_4$
Ответ:
Задача 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$глюкоза → X_1 → X_2 {→}↙{AlCl_3}↖{C_6H_6} C_8H_{10} {→}↙{FeCl_3}↖{Cl_2} X_4 {→}↙{H_2SO_4}↖{KMnO_4} X_5$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $C_6H_{12}O_6 →↖{дрожжи} 2C_2H_5OH + 2CO_2$
2) $C_2H_5OH →↖{H_2SO_4, t > 140 °C} CH_2=CH_2 + H_2O$
3) $CH_2=CH_2 +$ 
4) $Cl_2 +$ 
5) $12KMnO_4 + 18H_2SO_4 +$ 
или
$12KMnO_4 + 18H_2SO_4 +$ 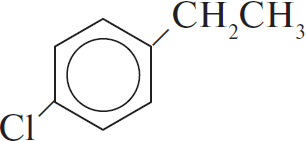
Ответ:
Задача 3
Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
$н-гептан →↖{Pt, t} Х_1 →↖{Cl_2, свет}$ 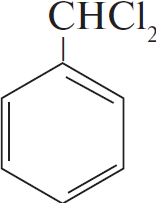
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3CH_2CH_2CH_2CH_2CH_2CH_3 →↖{Pt, t°} 4H_2 +$
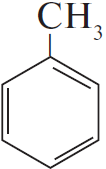
2) 
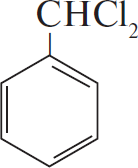
3) 
4) 5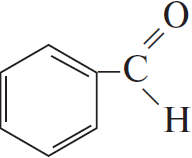
5) С6H5COOH $+ CH_3–CH(OH)–CH_3 → H_2O +$
Ответ:
Задача 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$ацетилен →↖{C_{(акт.)}, t°} Х_1 →↖{H_2, Pt} Х_2 →↖{Cl_2, hν}$ 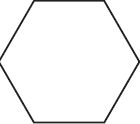
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $3CH≡CH →↖{C_{(акт.)}, t°}$
2) 
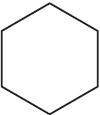
3) 
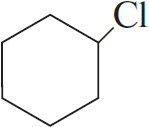
4) 
5) 3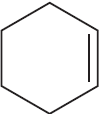
Ответ:
Задача 5
Приведите уравнения химических реакций, которые позволяют осуществить следующие превращения:
$C_2H_5OH → CH_2=CH_2 →↖{HCl} X_1 →$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $C_2H_5OH →↖{H_2SO_{4(конц.)}, t > 140 °C} CH_2=CH_2 + H_2O$
2) $CH_2=CH_2 + HCl → CH_3–CH_2Cl$
3) $CH_3–CH_2Cl +$ 
4) $5C_6H_5C_2H_5 + 12KMnO_4 + 18H_2SO_4 → 5C_6H_5COOH + 5CO_2 + 6K_2SO_4 + 12MnSO_4 + 28H_2O$
5) 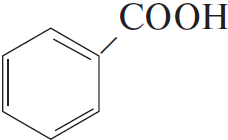
Ответ:
Задача 6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$CH≡CH →↖{H_2O (Hg^{2+})} X_1 →↙{H_2SO_4}↖{K_2Cr_2O_7} CH_3COOH →↖{NaHCO_3} X_2 →↖{CH_3I} Х_3 →↖{H_2O (H^{+})} уксусная кислота$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH≡CH + H_2O → CH_3–CHO$
2) $3CH_3CHO + K_2Cr_2O_7 + 4H_2SO_4 → 3CH_3COOH + K_2SO_4 + Cr_2(SO_4)_3 + 4H_2O$
3) $CH_3COOH + NaHCO_3 → CH_3COONa + H_2O + CO_2$
4) $CH_3COONa + CH_3I → CH_3COOCH_3 + NaI$
5) $CH_3COOCH_3 + H_2O ⇄ CH_3COOH + CH_3OH$
Ответ:
Задача 7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$C_3H_8 →↖{Cl_2, hν} X_1 → (CH_3)_2CHCH(CH_3)_2 → 2,3-диметил-2-хлорбутан →↖{NaOH_{(спирт.)}, t°} X_2 {→}↙{H_2O, 0 °C}↖{KMnO_4} X_3$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3–CH_2–CH_3 + Cl_2 →↖{hν}$ 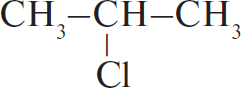
2) 2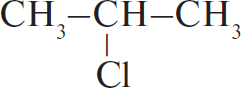
3) 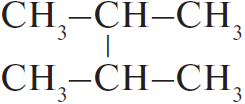
4) 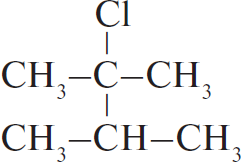
5) 3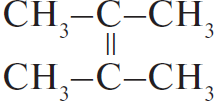
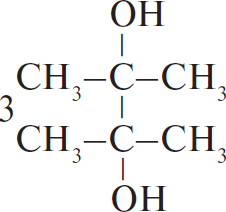
Ответ:
Задача 8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
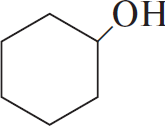
$бензол →↖{H_2, Pt, t°} X_1 →↖{Cl_2, hν} X_2 → циклогексанол {→}↙{180°С}↖{H_2SO_{4(конц.)}} Х_3 → HOOC–(CH_2)_4–COOH$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
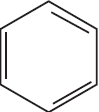
1) 
2) 
3) 
4) 
5) 
Ответ:
Задача 9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$CH_3CH_2CH_2CH_2OH {→}↙{180°C}↖{H_2SO_4} X_1 →↖{HBr} X_2 →↖{KOH, H_2O} X_3 {→}↙{180°C}↖{H_2SO_4} X_4 →↖{KMnO_4, H_2SO_4, t°} X_5$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3CH_2CH_2CH_2OH → CH_3CH_2–CH=CH_2 + H_2O$
2) $CH_3CH_2–CH=CH_2 + HBr → CH_3CH_2–CHBr–CH_3$
3) $CH_3CH_2–CHBr–CH_3 + KOH_{(водн.)} → CH_3CH_2–CH(OH)–CH_3 + KBr$
4) $CH_3CH_2–CH(OH)–CH_3 → CH_3–CH=CH–CH_3 + H_2O$
5) $5CH_3–CH=CH–CH_3 + 8KMnO_4 + 12H_2SO_4 → 10CH_3–COOH + 4K_2SO_4 + 8MnSO_4 + 12H_2O$
Ответ:
Задача 10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$пропан →↖{Pt, t°} Х_1 → 1.2-дибромпропан →↖{NaOH_{(спирт. р-р)}, t°} Х_2 →↖{t°, кат.} Х_3 →↖{KMnO_4, H_2SO_4, t°}$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3–CH_2–CH_3 → CH_3–CH=CH_2 + H_2$
2) $CH_3–CH=CH_2 + Br_2 → CH_3–CHBr–CH_2Br$
3) $CH_3–CHBr–CH_2Br + 2NaOH_{(спирт. р-р)} → CH_3–C≡CH + 2NaBr + 2H_2O$
4) $3CH_3–C≡CH →↖{C_{(акт.)}, t°}$
5) $18KMnO_4 + 27H_2SO_4 + 5$ 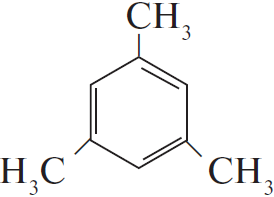
Ответ:
Задача 11
Напишите уравнения реакций, которые позволяют осуществить следующие превращения:
$Al_4C_3 → X_1 → нитрометан →↖{H_2, кат.} X_2 →↖{HI} X_3 →↖{NaOH, t°} X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $Al_4C_3 + 12H_2O → 4Al(OH)_3 + 3CH_4$
2) $CH_4 + HONO_2 → CH_3NO_2 + H_2O$
3) $CH_3NO_2 + 3H_2 → CH_3NH_2 + 2H_2O$
4) $CH_3NH_2 + HI → [CH_3NH_3]^{+}I^{–}$
5) $[CH_3NH_3]^{+}I^{–} + NaOH → CH_3NH_2 + NaI + H_2O$
Ответ:
Задача 12
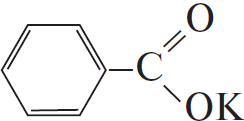
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$C_6H_5COOK →↖{KOH, t°} X_1 →↖{C_2H_4, H_3PO_4, t°} X_2 →↖{Cl_2, hν} X_3 →$ 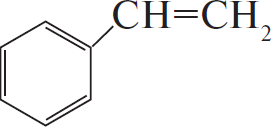
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Вариант ответа:
1) 
2) 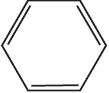

3) 
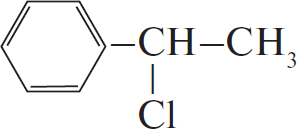
4) $C_6H_5–CH(Cl)–CH_3 + KOH_{(спирт.)} → C_6H_5–CH=CH_2 + KCl + H_2O$
5) $C_6H_5–CH=CH_2 + 2KMnO_4 + 3H_2SO_4 → K_2SO_4 + 2MnSO_4 + 4H_2O + CO_2 +$
Ответ: