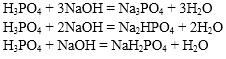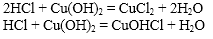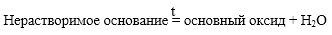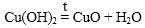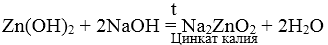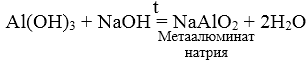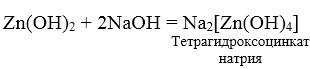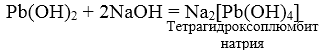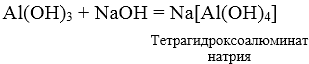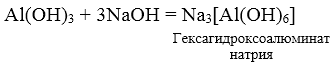Recommended textbook solutions
Ways of the World: A Global History
3rd Edition•ISBN: 9781319022723Robert W. Strayer
232 solutions
U.S. History
1st Edition•ISBN: 9781938168369John Lund, Paul S. Vickery, P. Scott Corbett, Todd Pfannestiel, Volker Janssen
567 solutions
America’s History for the AP Course
8th Edition•ISBN: 9781457628931 (2 more)Eric Hinderaker, James A. Henretta, Rebecca Edwards, Robert O. Self
470 solutions
Western Heritage Since 1300, AP Edition
12th Edition•ISBN: 9780135258514Donald Kagan, Frank M. Turner, Steven Ozment
531 solutions
Цвета соединений, знание которых необходимо для сдачи ЕГЭ
1. Медь – мягкий пластичный металл розового цвета. Степени окисления: +1, +2.
Cu2O – кристаллическое, нерастворимое в воде вещество кирпично-красного цвета.
CuO – кристаллы чёрного цвета, практически нерастворимые в воде.
CuS — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
Cu2S — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
CuOH — желтое вещество; не растворимо в воде; является неустойчивым и разлагается при нагревании на Cu2O и H2O.
Cu(OH)2 – голубое аморфное или кристаллическое вещество; практически не растворимо в воде.
CuSO4 – кристаллическое вещество белого цвета, хорошо растворяется в воде. Из водных растворов кристаллизуется пентагидрат CuSO4·5H2O – медный купоро́с, кристаллы голубого цвета (при нагревании снова теряет воду и становится белым). Водный раствор CuSO4 также голубого цвета.
2. Цинк – металл голубовато-белого цвета, мягкий, хрупкий. Степень окисления: +2.
ZnO, Zn(OH)2, ZnS – белые твердые вещества, нерастворимые в воде.
3. Алюминий – легкий металл серебристо-белого цвета. Степень окисления: +3.
Al2O3, Al(OH)3 – белые твердые вещества, нерастворимые в воде.
AlPO4 — твёрдое, белое кристаллическое вещество, нерастворимое в воде.
4. Серебро – блестящий белый мягкий пластичный металл. Степень окисления: +1.
AgCl – белое твердое нерастворимое в воде вещество.
AgBr – светло-желтое твердое нерастворимое в воде вещество.
AgI – твердое нерастворимое в воде вещество желтого цвета.
Ag2S — нерастворимое в воде и разбавленных растворах кислот вещество черного цвета.
Ag2O — твердое нерастворимое в воде вещество черного цвета.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
5. Железо – серебристо-серый мягкий ковкий металл. Степени окисления: +2, +3, +6.
FeO – твердое нерастворимое в воде вещество черного цвета.
Fe(OH)2 – серо-зеленый осадок, студенистый осадок зеленого цвета. Не растворяется в воде.
Fe2O3, Fe(OH)3 – твердые красно-коричневые (бурые), нерастворимые в воде соединения.
Fe3O4 – твердое черное вещество. Не растворяется в воде.
FeCl3 – раствор желтого цвета.
6. Сера – желтое нерастворимое в воде вещество. Степени окисления: -2, +4, +6.
SO2 – бесцветный газ с неприятным запахом; газ, образующийся в момент зажигания спички
H2SO4 – тяжелая бесцветная жидкость, растворяется в воде с сильным разогреванием раствора.
7. Хром — твёрдый металл голубовато-белого цвета.
CrO — твердое вещество ченого цвета.
Cr2O3 — твердое вещество темно-зеленого цвета.
CrO3 — твердое вещество красного цвета.
Na2Cr2O7 и другие дихроматы — соединения оранжевого цвета.
Na2CrO4 и другие хроматы — соединения желтого цвета.
Cr2(SO4)3 — в растворе сине-фиолетового цвета (кислотная среда).
K3[Cr(OH)6] — в растворе зеленого цвета (щелочная среда).
8. Марганец — металл серебристо-белого цвета.
MnO2 — твердое нерастворимое в воде вещество бурого цвета.
Mn(OH)2 — белый осадок.
KMnO4 — пурпурные кристаллы, растворяется в воде с образованием фиолетового раствора.
K2MnO4 — растворимая соль темно-зеленого цвета.
Mn(NO3)2, MnCl2, MnBr2 и некоторые другие соли Mn+2 — как правило, розовые растворимые в воде соединения.
9. Фосфор — неметалл. Основные модификации: белый, красный и черный фосфор.
Ag3PO4 — твердое нерастворимое в воде вещество желтого цвета.
AlPO4 — твердое нерастворимое в воде вещество белого цвета.
Li3PO4 — твердое нерастворимое в воде вещество белого цвета.
Ba3(PO4)2 — осадок белого цвета
10. Свинец — ковкий, тяжёлый металл серебристо-белого цвета.
PbS — осадок черного цвета.
PbSO4 — осадок белого цвета.
PbI2 – осадок ярко-желтого цвета.
11. Соединения бария:
BaSO4 – белый осадок нерастворимый в кислотах
BaSO3 – белый осадок растворимый в кислотах
Ba3(PO4)2 — осадок белого цвета
BaCrO4 — осадок желтого цвета
12. Другие соединения:
CaCO3 – осадок белого цвета
NH3 – аммиак, бесцветный газ с резким запахом
CO2 – газ тяжелее воздуха, без цвета и запаха, играющий важную роль в процессе фотосинтеза.
NO2 – газ бурого цвета (лисий хвост)
H2SiO3 – бесцветный студенистый осадок
Таблицы качественных реакций
21-Дек-2013 | комментариев 9 | Лолита Окольнова
Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
| Описание | Формула |
Реакции |
| Бурый газ |
NO2 |
1) N2 + 2O2 = 2NO2 2) взаимодействие металлов с азотной кислотой (концентрированной) 3) разложение нитратов |
| Запах тухлых яиц |
H2S |
Взаимодействие активных металлов с концентрированной серной кислотой: |
|
Газ с резким запахом. Растворимый в воде |
SO2 |
1) взаимодействие серасодежащих веществ с кислородом
2) взаимодействие некоторых металлов с концентрированной серной кислотой |
| Газ с резким характерным запахом, растворимый в воде |
NH3 |
1) N2 + 3H2 = 2NH3 2) обменные реакции солей аммония |
| Газ, не поддерживающий горение, малорастворимый в воде, не ядовитый |
N2 |
1) горение азотсодержащих веществ; NH4NO2 = N2 + 2H2O |
|
Газы, поддерживающие горение: (для NO2 – бурый цвет) |
O2 O3 NO2 |
3C + 2O3 = 3CO2 С + 2NO2 = CO2 + 2NO |
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
|
желто-зеленое |
фиолетовое |
кирпично-красное |
ярко-красное |
желтое |
карминово-красное |
|
Ba2+ |
K+ |
Са2+ |
Li+ |
Na+ |
Sr2+ |
Таблица качественных реакций
— цвета осадков
|
Осадки белого цвета |
Качественная реакция |
|
Белый творожистый нерастворимый в воде; нерастворимый в HNO3 |
Ag+ + Cl— → AgCl↓ качественная реакция на соли серебра; качественная реакция на хлорид-ионы; |
|
Белый осадок нерастворимый в кислотах |
Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария; качественная реакция на сульфат-ионы; |
|
Белый осадок образуется при пропускании газа без цвета с резким запахом через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + SO2 = CaSO3↓ + H2O
|
|
Белый осадок образуется при добавлении щелочи; растворяется в избытке щелочи |
Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓
|
|
Белый осадок образуется при пропускании газа без цвета и запаха через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2H+ → CO2↑ + H2O + Ca2+ |
|
Осадок светло-желтого цвета (осадок кремового цвета) образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + Br— → AgBr↓ качественная реакция на бромид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + I— → AgJ↓ качественная реакция на иодид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; растворим в кислотах; |
3Ag+ + PO43- → Ag3PO4↓ |
|
Осадки коричневых цветов |
Качественная реакция |
|
Осадок бурого цвета образуется при взаимодействии с растворами щелочей; |
Fe3+ +3OH— → Fe(OH)3↓ качественная реакция на соли железа |
|
Осадки синих и зеленых цветов |
Качественная реакция |
|
Осадки зеленого цвета |
Fe2+ +2OH— → Fe(OH)2↓ |
|
Осадок голубого цвета (осадок синего цвета) образуется при взаимодействии с растворами щелочей |
Cu2+ +2OH— → Cu(OH)2↓ качественная реакция на соли меди (II) |
|
Осадок синего цвета образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли |
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ качественная реакция на соли железа (II) — с красной кровяной солью; 4Fe3+ + 3[Fe(CN)6]-4 → Fe4[Fe(CN)6]3↓ качественная реакция на соли железа (III) — с желтой кровяной солью; |
|
Осадки черного цвета |
Качественная реакция |
|
Осадок черного цвета Образуется при взаимодействии с сульфидами или с H2S |
Fe2+ + S2- → FeS↓ Ni2+ + S2- → NiS↓ Cu2+ + S2- → CuS↓ Pb2+ + S2- → PbS↓ Hg2+ + S2- → HgS↓ Ag+ + S2- → Ag2S↓ качественная реакция на сульфид-ионы |
Обсуждение: «Таблицы качественных реакций»
(Правила комментирования)
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Осадки белого цвета образуют практически все нерастворимые соединения Ca, Ba,Mg, Al, Zn, Be, Pb. Ag.
Осадки белые, мелкокристаллические — CaCO3 , ВaCO3, MgCO3, PbCO3
Са3(РО4)2, Ва3(РО4)2, Mg 3(РО4)2., ВaSO4,, Li3РО4, Li2SiO3, Pb SO4, ZnS
Осадок белый, творожистый – AgCl (PbCl2 )
Осадки белые, объемные — Mg(OH)2, Zn(OH)2, Be(OH)2, Al(OH)3
Осадок светло — желтый, творожистый – AgBr (PbBr2 )
Осадок светло – желтый, мелкокристаллический — Ag2CO3
Осадок желтый, творожистый – AgI (PbI2)
Осадок желтый, мелкокристаллический – Ag3РО4
Осадок голубого цвета – Cu(OH)2
Осадки черного цвета – CuS, Ag2S, PbS
Осадок зеленого цвета, постепенно буреющий – Fe(OH)2
Осадки бурого цвета – Ag2О, Fe(OH) 3
Осадок студенистый, бесцветный — H2SiO3
Осадки, растворимые в кислотах с образованием прозрачных растворов —Mg(OH)2 ,,,Cu(OH)2, Fe(OH)2, Fe(OH)3 , Ag3РО4 , Li3РО4
Осадки, растворимые в кислотах с выделением газа — CaCO3 , ВaCO3, MgCO3,. PbCO3, Ag2CO3, CuS, Ag2S, PbS.
Осадки, растворимые в кислотах и щелочах с образованием прозрачных растворов — Zn(OH)2, Be(OH)2 , Al(OH)3.
Физические свойства кислот
Твердые кислоты: H3PO4 (ортофосфорная кислота), H3BO3 (борная кислота), HIO4 (йодная кислота).
Жидкие кислоты: H2SO4, HNO3.
Большинство кислот растворяются в воде. Некоторые кислоты являются растворами газов в воде, например, HCl и H2S).
Химические свойства кислот
1. Кислоты взаимодействуют с основаниями с образованием соли и воды (реакция нейтрализации).
Если в реакциях нейтрализации участвуют многоосновные кислоты или многокислотные основания, то продуктами реакции могут быть не только средние соли.
2. Кислоты взаимодействуют с основными оксидами с образованием соли и воды.
Кислота + Основный оксид = соль + H2O
2HCl + CaO = CaCl2 + H2O
3. Кислоты взаимодействуют с амфотерными оксидами с образованием соли и воды.
Кислота + амфотерный оксид = соль + H2O
2HNO3 + ZnO = Zn(NO3)2 + H2O
4. Кислоты взаимодействуют с амфотерными гидроксидами с образованием соли и воды.
Кислота + амфотерный гидроксид = соль + H2O
3HCl + Cr(OH)3 = CrCl3 + 3H2O
5. Кислоты взаимодействуют с некоторыми средними солями с образованием новой соли новой кислоты.
Эти реакции возможно в том случае если в результате их образуется слабая кислота (в виде газа) или выпадает осадок (нерастворимая соль)
Кислота + соль = соль1 + Кислота1
HCl + AgNO3 = AgCl ↓+ HNO3
2CH3COOH + Na2CO3 = 2CH3COONa + CO2 ↑ + H2O
6. Кислоты взаимодействуют с металлами. Характер продуктов этих реакций зависит от природы и концентрации кислоты и от активности металла.
Активность металла определяется его положением в электрохимическом ряду напряжений.
Взаимодействие металлов с серной концентрированной кислотой:
|
Металлы |
Активные |
Средней активности |
Неактивные |
|
H2SO4 (конц.) |
Соль + H2O + H2S 8Na + 5H2SO4 = 4Na2SO4 + H2S +4H2O |
Соль + H2O + S 4H2SO4 + 3Zn = 3ZnSO4+4H2O+S |
Cоль + H2O + SO2 2H2SO4 + 2Ag = Ag2SO4+2H2O+SO2 |
Получение кислот
1. Бескислородоные кислоты получают путем синтеза водородных соединений неметаллов из простых веществ и последующего растворения полученных продуктов в воде.
Неметалл + H2 = водородное соединение неметалла;
Неметаллы: F2, Cl2, Br2, I2, S, Se
2. Оксокислоты получают взаимодействием кислотных оксидов с водой.
Кислотный оксид + H2O = оксокислота
SO3 + H2O = H2SO4
3. Большинство кислот можно получить взаимодействием солей с кислотами.
Соль + кислота = Соль1 + кислота1
2NaCl(тв.) + H2SO4(конц.) = 2HCl + Na2SO4
Основания
Физические свойства оснований
Все неорганические основания —твердые вещества, кроме NH4OH
Основание имеют разный цвет: гидроксид калия (KOH) — белого цвета, гидроксид меди (II) (Cu(OH)2) — голубого цвета
Некоторые растворимые в воде основания называются едкими щелочами:
NaOH — едкий натр
KOH — едкий кали
Химические свойства оснований
1. Основания взаимодействуют с кислотами с образованием соли и воды – реакция нейтрализации.
Основание + кислота = соль + H2O
KOH + HCl = KCl + H2O
2. Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды.
Щелочь + кислотный оксид = Соль + H2O
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
3. Растворы щелочей взаимодействуют с растворами солей, если в результате образуется нерастворимое основание (или выделяется газ) или соль.
Раствор щелочи + раствор соли = основание2 + соль2
2NaOH + CuSO4 = Cu(OH)2 ↓ + Na2SO4
4. Нерастворимые в воде основание при нагревании разлагаются на основный оксид и воду.
5. Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды.
Zn + 2NaOH + 2 H2O = Na2[Zn(OH)4] + H2
Получение оснований
1. Взаимодействие щелочных и щелочноземельных металлов с водой.
2Na + 2H2O = 2NaOH + H2
2. Взаимодействие оксидов щелочных и щелочноземельных металлов с водой.
BaO + H2O = Ba(OH)2
3. Получение нерастворимых оснований действием щелочей на растворимые соли металлов
Раствор щелочи + раствор соли = нераствор. основание + соль1
2NaOH + FeSO4 = Fe(OH)2 ↓ + Na2SO4
Амфотерные гидроксиды
Физические свойства
Все амфотерные гидроксиды — твердые вещества, не растворимые в воды. Окраска амфотерных гидроксидов зависит от характера входящих в их состав катионов металлов.
Химические свойства
Амфотерные гидроксиды реагируют как с кислотами, так и со щелочами.
1. Взаимодействие амфотерных гидроксидов с кислотами.
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2 H2O
Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O
2. Сплавление твердых гидроксидов с твердыми щелочами.
3. При взаимодействии амфотерных гидроксидов с избытком растворов щелочей образуются комплексы.
4.1.4. Качественные реакции на неорганические вещества и ионы.
Представим себе такую ситуацию:
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:

Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
- Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2NaOH + MgCl2 = Mg(OH)2 ↓+ 2NaCl
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
а с нитратом серебра с образованием белого творожистого осадка AgCl
HCl + AgNO3 = HNO3 + AgCl↓
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
Качественные реакции на катионы
| Катион | Реактив | Признак реакции |
| Ba2+ | SO42- |
Выпадение белого осадка, не растворимого в кислотах: Ba2+ + SO42- = BaSO4↓ |
| Cu2+ |
1) OH− 2) S2- |
1) Выпадение осадка голубого цвета: Cu2+ + 2OH− = Cu(OH)2↓ 2) Выпадение осадка черного цвета: Cu2+ + S2- = CuS↓ |
| Pb2+ | S2- |
Выпадение осадка черного цвета: Pb2+ + S2- = PbS↓ |
| Ag+ | Cl− |
Выпадение белого осадка, не растворимого в HNO3, но растворимого в аммиаке NH3·H2O: Ag+ + Cl− → AgCl↓ |
| Fe2+ |
1) OH− 2) Гексацианоферрат (III) калия (красная кровяная соль) K3[Fe(CN)6] |
1) Выпадение белого осадка, зеленеющего на воздухе: Fe2+ + 2OH− = Fe(OH)2↓ 2) Выпадение синего осадка (турнбулева синь): K+ + Fe2+ + [Fe(CN)6]3- = KFe[Fe(CN)6]↓ |
| Fe3+ |
1) OH− 2) Гексацианоферрат (II) калия (желтая кровяная соль) K4[Fe(CN)6] 3) Роданид-ион SCN− |
1) Выпадение осадка бурого цвета: Fe3+ + 3OH− = Fe(OH)3↓ 2) Выпадение синего осадка (берлинская лазурь): K+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6]↓ 3) Появление интенсивно-красного (кроваво-красного) окрашивания: Fe3+ + 3SCN− = Fe(SCN)3 |
| Al3+ | Щелочь (амфотерные свойства гидроксида) |
Выпадение белого осадка гидроксида алюминия при приливании небольшого количества щелочи: OH− + Al3+ = Al(OH)3 и его растворение при дальнейшем приливании: Al(OH)3 + NaOH = Na[Al(OH)4] |
| NH4+ | OH−, нагрев |
Выделение газа с резким запахом: NH4+ + OH− = NH3↑ + H2O Посинение влажной лакмусовой бумажки |
| H+ (кислая среда) |
Индикаторы: − лакмус − метиловый оранжевый |
Красное окрашивание |
Качественные реакции на анионы
| Анион | Воздействие или реактив | Признак реакции. Уравнение реакции |
| SO42- | Ba2+ |
Выпадение белого осадка, не растворимого в кислотах: Ba2+ + SO42- = BaSO4↓ |
| NO3− |
1) Добавить H2SO4 (конц.) и Cu, нагреть 2) Смесь H2SO4 + FeSO4 |
1) Образование раствора синего цвета, содержащего ионы Cu2+, выделение газа бурого цвета (NO2) 2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(H2O)5NO]2+. Окраска от фиолетовой до коричневой (реакция «бурого кольца») |
| PO43- | Ag+ |
Выпадение светло-желтого осадка в нейтральной среде: 3Ag+ + PO43- = Ag3PO4↓ |
| CrO42- | Ba2+ |
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl: Ba2+ + CrO42- = BaCrO4↓ |
| S2- | Pb2+ |
Выпадение черного осадка: Pb2+ + S2- = PbS↓ |
| CO32- |
1) Ca2+ 2) H+ |
1) Выпадение белого осадка, растворимого в кислотах: Ca2+ + CO32- = CaCO3↓ 2) Выделение бесцветного газа («вскипание»), вызывающее помутнение известковой воды: CO32- + 2H+ = CO2↑ + H2O Ca(OH)2 + CO2 = CaCO3↓ + H2O |
| CO2 | Известковая вода Ca(OH)2 |
Выпадение белого осадка и его растворение при дальнейшем пропускании CO2: Ca(OH)2 + CO2 = CaCO3↓ + H2O CaCO3 + CO2 + H2O = Ca(HCO3)2 |
| SO32- | H+ |
Выделение газа SO2 с характерным резким запахом (SO2): 2H+ + SO32- = H2O + SO2↑ |
| F− | Ca2+ |
Выпадение белого осадка: Ca2+ + 2F− = CaF2↓ |
| Cl− | Ag+ |
Выпадение белого творожистого осадка, не растворимого в HNO3, но растворимого в NH3·H2O(конц.): Ag+ + Cl− = AgCl↓ AgCl + 2(NH3·H2O) = [Ag(NH3)+ + Cl− + 2H2O |
| Br− | Ag+ | Выпадение светло-желтого осадка, не растворимого в HNO3:
Ag+ + Br− = AgBr↓ (осадок темнеет на свету) |
| I− | Ag+ | Выпадение желтого осадка, не растворимого в HNO3 и NH3·H2O(конц.):
Ag+ + I− = AgI↓ (осадок темнеет на свету) |
| OH− (щелочная среда) |
Индикаторы: — лакмус — фенолфталеин |
— синее окрашивание — малиновое окрашивание |
Чтобы поделиться, нажимайте
В ЕГЭ и ЦТ по химии каждый год присутствуют задания на определения веществ в пронумерованных пробирках, задания с зашифрованными буквами веществами (А, Б, В и т.д.), задания на различение веществ и т.п. Для выполнения этих заданий вам необходимо знать качественные реакции на определение (распознавание) веществ. Предлагаю вам выборку качественных реакций с видео-опытами. Список реакций НЕ является полным, но этого достаточно для ЕГЭ и ЦТ по химии. Учтите, что качественные реакции, которые прведены первыми для каждого вещества (иона) являются наиболее используемыми на практике, а также в заданиях ЕГЭ и ЦТ.
Оглавление (кликайте, чтобы не листать):
Основные качественные реакции на катионы
Основные качественные реакции на анионы
Окраска (цвет) всех осадков и их особенности
Качественные реакции для индивидуальных веществ
Общие правила различения веществ друг от друга
Примеры задания из ЕГЭ и ЦТ на эту тему с видео-объяснениями
Для качественного анализа пригодны не все реакции, а лишь те, которые сопровождаются каким-либо внешним эффектом:
- Образование характерных осадков
- Растворение вещества
- Появление (изменение) окраски
- Выделение газов
- Изменение запаха
- Окрашивание пламени
ОСНОВНЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА КАТИОНЫ
| Катион | Реактив | Наблюдаемые признаки и ионное уравнение | Примеры уравнений реакций/примечания |
| Li+ | F— | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Li+ + F— = LiF↓ |
LiNO3 + AgF = LiF↓ + AgNO3
CH3COOLi + NH4F = LiF↓ +CH3COONH4 |
| PO43- | Помутнение раствора из-за образования малорастворимого вещества белого цвета
3Li+ + PO43-= Li3PO4↓ |
3LiOH + Na3PO4 = Li3PO4↓ + 3NaOH
3LiI + K3PO4 = Li3PO4↓ + 3KI |
|
| Пламя | Карминово-красное окрашивание (ближе к малиновому) | ||
| Видео-опыты по обнаружению ионов лития Li+ Развернуть/свернуть Изменение цвета пламени солями лития |
|||
| Na+, K+, Rb+, Cs+ | Не возможно обнаружить в растворе (нельзя обнаружить только для заданий ЕГЭ и ЦТ, но в реальности существуют качественные реакции). | ||
| Na+ | Пламя | Жёлтое окрашивание | |
| K+ | Пламя | Фиолетовое окрашивание | |
| Rb+ | Пламя | Красно-голубое окрашивание | |
| Cs+ | Пламя | Голубоватое окрашивание | |
| Видео-опыты по обнаружению ионов лития Na+, K+, Rb+, Cs+ Развернуть/свернуть Изменение цвета пламени солями натрия Изменение цвета пламени солями калия Изменение цвета пламени солями рубидия Изменение цвета пламени солями цезия |
|||
| Са2+ | СO32- | Появление белого осадка
Ca2+ + CO32- = CaCO3↓ |
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Ca(NO3)2 + K2CO3 = CaCO3↓ + 2KNO3 |
| F— | Появление белого осадка
Ca2+ + 2F— = CaF2↓ |
CaBr2 + 2NaF = CaF2↓ + 2NaBr
CaI2 + 2NH4F = CaF2↓ + 2NH4I |
|
| SO32- | Появление белого осадка
Ca2+ + SO32- = CaSO3↓ |
Ca(NO3)2 + Na2SO3 = CaSO3↓ + 2NaNO3
(CH3COO)2Ca + Li2SO3 = CaSO3↓ + 2CH3COOLi |
|
| SiO32- | Появление белого осадка
Ca2+ + SiO32- = CaSiO3↓ |
Ca(HS)2 + K2SiO3 = CaSiO3↓ + 2KHS
CaCl2 + Na2SiO3 = CaSiO3↓ + 2NaCl |
|
| PO43- | Появление белого осадка
3Ca2+ + 2PO43- = Ca3(PO4)2↓ |
3Ca(HCO3)2 + 2K3PO4 = Ca3(PO4)2↓ + 6KHCO3
3Ca(NO2)2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaNO2 |
|
| HPO42- | Появление белого осадка
Ca2+ + HPO42-= CaHPO4↓ |
CaCl2 + Na2HPO4 = CaHPO4↓ + 2NaCl
Ca(NO3)2 + K2HPO4 = CaHPO4↓ + 2KNO3 |
|
| SO42- | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Ca2+ + SO42- = CaSO4↓ |
Ca(NO3)2 + Na2SO4 = CaSO4↓ + 2NaNO3
CaCl2 + MgSO4 = CaSO4↓ + MgCl2 |
|
| Пламя | Кирпично-красное окрашивание | ||
| Видео-опыты по обнаружению ионов кальция Ca2+ Развернуть/свернуть Реакция между карбонатом натрия и хлоридом кальция Реакция между фторидом натрия и бромидом кальция Реакция между сульфатом магния и хлоридом кальция Изменение цвета пламени солями кальция |
|||
| Ba2+, Sr2+ | SO42- | Появление белого мелкодисперсного осадка (нерастворимого в килотах), напоминающего молоко
Ba2+ + SO42- = BaSO4↓ Sr2+ + SO42- = SrSO4↓ |
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Sr(NO3)2 + H2SO4 = SrSO4↓ + 2HNO3 |
| СO32- | Появление белого осадка
Ba2+ + CO32- = BaCO3↓ Sr2+ + CO32- = SrCO3↓ |
BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl
Sr(NO3)2 + K2CO3 = SrCO3↓ + 2KNO3 |
|
| F— | Помутнение раствора из-за образования малорастворимого вещества белого цвета для бария и появление белого осадка для стронция
Ba2+ + 2F— = BaF2↓ Sr2+ + 2F— = SrF2↓ |
BaBr2 + 2NaF = BaF2↓ + 2NaBr
SrI2 + 2NH4F = SrF2↓ + 2NH4I |
|
| SO32- | Появление белого осадка
Ba2+ + SO32- = BaSO3↓ Sr2+ + SO32- = SrSO3↓ |
Ba(NO3)2 + Na2SO3 = BaSO3↓ + 2NaNO3
(CH3COO)2Sr + Li2SO3 = SrSO3↓ + 2CH3COOLi |
|
| SiO32- | Появление белого осадка
Ba2+ + SiO32- = BaSiO3↓ Sr2+ + SiO32- = SrSiO3↓ |
Ba(HSO3)2 + K2SiO3 = BaSiO3↓ + 2KHSO3
SrCl2 + Na2SiO3 = SrSiO3↓ + 2NaCl |
|
| PO43- | Появление белого осадка
3Ba2+ + 2PO43- = Ba3(PO4)2↓ 3Sr2+ + 2PO43- = Sr3(PO4)2↓ |
3Ba(HCO3)2 + 2K3PO4 = Ba3(PO4)2↓ + 6KHCO3
3Sr(NO2)2 + 2Na3PO4 = Sr3(PO4)2↓ + 6NaNO2 |
|
| HPO42- | Появление белого осадка
Ba2+ + HPO42-= BaHPO4↓ Sr2+ + HPO42-= SrHPO4↓ |
BaCl2 + Na2HPO4 = BaHPO4↓ + 2NaCl
Sr(NO3)2 + K2HPO4 = SrHPO4↓ + 2KNO3 |
|
| CrO42- | Появление жёлтого осадка
Ba2+ + CrO42-= BaCrO4↓ Sr2+ + CrO42-= SrCrO4↓ |
Ba(NO3)2 + K2CrO4 = BaCrO4↓ + 2KNO3
SrCl2 + Na2CrO4 = SrCrO4↓ + 2NaCl |
|
| Пламя | Желто-зеленое окрашивание для ионов бария
Карминово-красное окрашивание для ионов стронция |
||
| Видео-опыты по обнаружению ионов бария Ba2+ и стронция Sr2+ Развернуть/свернуть Качественная реакция на сульфит- и сульфат-ион Реакция между нитратом стронция и сульфатом калия Реакция между хлоридом бария и карбонатом натрия Реакция между нитратом стронция и карбонатом натрия Реакция между нитратом стронция и фторидом натрия Реакция между нитратом бария и хроматом калия Реакция между хлоридом бария и хроматом калия Изменение окраски пламени солями стронция Изменение окраски пламени солями бария |
|||
| Mg2+ | OH— | Появление белого осадка (нерастворимого в избытке щёлочи)
Mg2+ + 2OH— = Mg(OH)2↓ |
MgCl2 +2NaOH = Mg(OH)2↓ + 2NaCl
Mg(NO3)2 +2KOH = Mg(OH)2↓ + 2KNO3 |
| СO32- | Появление белого осадка
Mg2+ + CO32- = MgCO3↓ А также может образоваться основная соль – гидроксокарбонат (MgOH)2CO3↓ из-за гидролиза |
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl
2MgCl2+2Na2CO3+H2O=(MgOH)2CO3↓ + 4NaCl + CO2↑ |
|
| F— | Появление белого осадка
Mg2+ + 2F— = MgF2↓ |
MgBr2 + 2NaF = MgF2↓ + 2NaBr
MgI2 + 2NH4F = MgF2↓ + 2NH4I |
|
| SO32- | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Mg2+ + SO32- = MgSO3↓ |
(CH3COO)2Mg + Li2SO3 = MgSO3↓ + 2CH3COOLi
Mg(NO3)2 + Na2SO3 = MgSO3↓ + 2NaNO3 |
|
| SiO32- | Появление белого осадка
Mg2+ + SiO32- = MgSiO3↓ |
MgSO4 + K2SiO3 = MgSiO3↓ + K2SO4
MgCl2 + Na2SiO3 = MgSiO3↓ + 2NaCl |
|
| PO43- | Появление белого осадка
3Mg2+ + 2PO43- = Mg3(PO4)2↓ |
3Mg(HCO3)2 + 2K3PO4 = Mg3(PO4)2↓ + 6KHCO3
3MgSO4 + 2Na3PO4 = Mg3(PO4)2↓ + 3Na2SO4 |
|
| HPO42- | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Mg2+ + HPO42-= MgHPO4↓ |
MgCl2 + Na2HPO4 = MgHPO4↓ + 2NaCl
Mg(NO3)2 + K2HPO4 = MgHPO4↓ + 2KNO3 |
|
| Видео-опыты по обнаружению ионов магния Mg2+ Развернуть/свернуть Реакция между хлоридом магния и гидроксидом калия Реакция между хлоридом магния и карбонатом натрия |
|||
| NH4+ | OH— при нагревании | Выделение газа с резким запахом, посинение влажной лакмусовой бумажки
NH4+ + OH— = NH3↑ + H2O |
NH4Cl + NaOH = NaCl + NH3↑ + H2O
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3↑ + 2H2O |
| Видео-опыты по обнаружению ионов аммония NH4+ Развернуть/свернуть Реакция между хлоридом аммония и гидроксидом натрия |
|||
| Zn2+ | OH— | Выпадение белого осадка гидроксида цинка при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Zn2+ + 2OH— = Zn(OH)2↓ 2) Zn(OH)2 + 2OH— = [Zn(OH)4]2- |
1) Zn(NO3)2 + 2NaOH = Zn(OH)2↓ + 2NaNO3
2) Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] Помните, что гидроксиды катионов Al3+, Cr3+ не переводятся в комплексное соединение гидратом аммиака. Zn2+ при добавлении конц. раствора аммиака сначала образуется Zn(OH)2, а при избытке аммиак способствует растворению осадка: Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2 |
| S2- | Появление белого осадка (легко растворимого в минеральных кислотах)
Zn2+ + S2- = ZnS↓ |
Zn(NO3)2 + Na2S = ZnS↓ + 2NaNO3
ZnSO4 + K2S = ZnS↓ + K2SO4 ZnS не выпадает в осадок при насыщении растворов солей цинка сероводородом |
|
| СO32- | Появление белого осадка
Zn2+ + CO32- = ZnCO3↓ А также может образоваться основная соль – гидроксокарбонат (ZnOH)2CO3↓ из-за гидролиза |
ZnCl2 + Na2CO3 = ZnCO3↓ + 2NaCl
2ZnCl2+2K2CO3+H2O=(ZnOH)2CO3↓ + 4KCl + CO2↑ |
|
| PO43- | Появление белого осадка
3Zn2+ + 2PO43- = Zn3(PO4)2↓ |
3ZnSO4 + 2Na3PO4 = Zn3(PO4)2↓ + 3Na2SO4
3Zn(NO3)2 + 2Na3PO4 = Zn3(PO4)2↓ + 6NaNO3 |
|
| CrO42- | Появление жёлтого осадка
Zn2+ + CrO42-= ZnCrO4↓ |
Zn(NO3)2 + K2CrO4 = ZnCrO4↓ + 2KNO3
ZnCl2 + Na2CrO4 = ZnCrO4↓ + 2NaCl |
|
| Видео-опыты по обнаружению ионов цинка Zn2+ Развернуть/свернуть Реакция между нитратом цинка и гидроксидом натрия Реакция между хлоридом цинка и карбонатом натрия |
|||
| Al3+ | OH— | Выпадение белого осадка гидроксида алюминия при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Al3+ + 3OH— = Al(OH)3↓ 2) Al(OH)3 + OH— = [Al(OH)4]— или Al(OH)3 + 3OH— = [Al(OH)6]3- |
1) AlCl3 + 3KOH = Al(OH)3↓ + 3KCl
2) Al(OH)3 + KOH = K[Al(OH)4] или Al(OH)3 + 3KOH = K3[Al(OH)6] Помните, что гидроксид катиона Al3+ не переводится в комплексное соединение гидратом аммиака. |
| PO43— | Появление белого осадка
Al3+ + PO43- = AlPO4↓ |
Al2(SO4)3 + 2K3PO4 = 2AlPO4↓ + 3K2SO4
AlCl3 + Na3PO4 = AlPO4↓ + 3NaCl |
|
| СO32- | Появление белого осадка и выделение бесцветного газа из-за полного гидролиза карбоната алюминия
2Al3+ + 3СO32-+ 3Н2О = 2Al(OH)3↓ + 6КCl + 3CO2↑ |
2AlCl3 + 3К2СO3+ 3Н2О = 2Al(OH)3↓ + 6КCl + 3CO2↑ | |
| Видео-опыты по обнаружению ионов алюминия Al3+ Развернуть/свернуть Амфотерность гидроксида алюминия |
|||
| Cr3+ | OH— | Выпадение серо-зелёного осадка гидроксида хрома (III) при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Cr3+ + 3OH— = Cr(OH)3↓ 2) Cr(OH)3 + OH— = [Cr(OH)4]— или Cr(OH)3 + 3OH— = [Cr(OH)6]3- |
1) CrBr3 + 3NaOH = Cr(OH)3↓ + 3NaBr
2) Cr(OH)3 + NaOH = Na[Cr(OH)4] или Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Помните, что гидроксид хрома (III) не переводятся в комплексное соединение гидратом аммиака. Раствор, содержащий [Cr(OH)6]3-, при добавлении хлорной или бромной воды в щелочной среде становится желтым из-за образования хромат-аниона CrO42-: 2[Cr(OH)6]3- + 3Br2 + 4OH— = 2CrO42- + 6Br— + 8H2O |
| PO43— | Появление чёрного (чёрно-зелёного) осадка
Cr3+ + PO43- = CrPO4↓ |
Cr2(SO4)3 + 2K3PO4 = 2CrPO4↓ + 3K2SO4
CrCl3 + Rb3PO4 = CrPO4↓ + 3RbCl |
|
| СO32- | Появление серо-зелёного осадка и выделение бесцветного газа из-за полного гидролиза карбоната хрома (III)
2Cr3+ + 3СO32-+ 3Н2О = 2Cr(OH)3↓ + 6КCl + 3CO2↑ |
Сr2(SO4)3 + 3К2CO3 + 3Н2О = 2Cr(OH)3↓ + 3К2SO4 + 3CO2↑ | |
| Видео-опыты по обнаружению ионов хрома Cr3+ Развернуть/свернуть Амфотерность гидроксида хрома |
|||
| Fe2+ | OH— | Появление грязно-зелёного осадка (хотя должен быть белый), буреющего со временем
Fe2+ + 2OH— = Fe(OH)2↓ |
FeCl2 +2NaOH = Fe(OH)2↓ + 2NaCl
Fe(NO3)2 +2KOH = Fe(OH)2↓ + 2KNO3 |
| Fe(CN)63− (Красная кровяная соль K3[Fe(CN)6]) | Синий осадок (турнбулева синь):
K+ + Fe2+ + [Fe(CN)6]3- = KFe[Fe(CN)6]↓ |
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓+ 2KCl | |
| СO32- | Появление белого осадка
Fe2+ + CO32- = FeCO3↓ |
(NH4)2Fe(SO4)2 + Na2CO3 = FeCO3↓ + Na2SO4 + (NH4)2SO4 | |
| S2- | Появление чёрного осадка (легко растворимого в минеральных кислотах)
Fe2+ + S2- = FeS↓ |
FeSO4 + (NH4)2S = FeS↓ + (NH4)2SO4
Сульфид железа (II) можно получить только при достаточно большой концентрации ионов S2- врастворе. FeS не выпадает в осадок при насыщении растворов солей железа(II) сероводородом |
|
| Видео-опыты по обнаружению ионов железа Fe2+ Развернуть/свернуть Реакция между хлоридом железа (II) и гидроксидом натрия Качественная реакция на ион железа Fe2+ |
|||
| Fe3+ | OH— | Появление бурого осадка
Fe3+ + 3OH— = Fe(OH)3↓ |
FeCl3+2CsOH = Fe(OH)3↓ + 2CsCl
Fe(NO3)3 +2NaOH = Fe(OH)3↓ + 2NaNO3 |
| Fe(CN)64− (желтая кровяная соль) K4[Fe(CN)6] | Синий осадок (берлинская лазурь):
K+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6]↓ |
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓+ 3KCl | |
| SCN— (роданид-ион) | Появление красно-кровавого окрашивания
Fe3+ + 3SCN— = Fe(SCN)3 |
FeCl3 + 3NH4SCN = Fe(SCN)3 + 3NH4Cl | |
| PO43- | Появление жёлтого осадка
Fe3+ + PO43- = FePO4↓ |
Fe2(SO4)3 + 2K3PO4 = 2FePO4↓ + 3K2SO4
FeCl3 + Na3PO4 = FePO4↓ + 3NaCl |
|
| Видео-опыты по обнаружению ионов железа Fe3+ Развернуть/свернуть Получение гидроксида железа (III) и исследование его свойств Качественная реакция на ион железа Fe3+ |
|||
| Mn2+ | OH— | Появление белого осадка, розовеющего (буреющего) на воздухе
Mn2+ + 2OH— = Mn(OH)2↓ |
MnBr2 +2NaOH = Mn(OH)2↓ + 2NaBr
Mn(NO3)2 +2KOH = Mn(OH)2↓ + 2KNO3 |
| S2- | Появление телесно-розового осадка
Mn2+ + S2- = MnS↓ |
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
MnCl2 + Na2S = MnS↓ + 2NaCl |
|
| СO32- | Появление белого осадка
Mn2+ + CO32- = MnCO3↓ |
MnCl2 + Na2CO3 = MnCO3↓ + 2NaCl
Mn(NO3)2 + K2CO3 = MnCO3↓ + 2KNO3 |
|
| HPO42- | Появление белого осадка
3Mn2+ + 4HPO42- = Mn3(PO4)2↓ + 2H2PO4— |
3MnCl2 + 4Na2HPO4 = Mn3(PO4)2↓ + 6NaCl + 2NaH2PO4 | |
| Видео-опыты по обнаружению ионов марганца Mn2+ Развернуть/свернуть Реакция между нитратом марганца (II) и гидроксидом натрия Реакция между нитратом марганца (II) и карбонатом натрия |
|||
| Pb2+ | S2- | Появление чёрного осадка
Pb2+ + S2- = PbS↓ |
(CH3COO)2Pb + K2S = PbS↓ + 2CH3COOK
Pb(NO3)2 + Na2S = PbS↓ + 2NaNO3 |
| I— | Появление жёлто-золотистого осадка
Pb2+ + 2I— = PbI2↓ |
(CH3COO)2Pb + 2NaI = PbI2↓ + 2CH3COONa
Pb(NO3)2 + CaI2 = PbI2↓ + Ca(NO3)2 |
|
| SO42- | Появление белого осадка
Pb2+ + SO42- = PbSO4↓ |
(CH3COO)2Pb + K2SO4 = PbSO4↓ + 2CH3COOK
Pb(NO3)2 + H2SO4 = PbSO4↓ + 2HNO3 |
|
| Cl— | Появление белого осадка, растворимого в горячей воде
Pb2+ + 2Cl— = PbCl2↓ |
(CH3COO)2Pb + 2NaCl = PbCl2↓ + 2CH3COONa
Pb(NO3)2 + BaCl2 = PbCl2↓ + Ba(NO3)2 |
|
| OH— | Выпадение белого осадка гидроксида свинца (II) при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Pb2+ + 2OH— = Pb(OH)2↓ 2) Pb(OH)2 + 2OH— = [Pb(OH)4]2- |
1) Pb(NO3)2 + 2NaOH = Pb(OH)2↓ + 2NaNO3
2) Pb(OH)2 + 2NaOH = Na2[Pb(OH)4] |
|
| HPO42- | Появление белого осадка
3Pb2+ + 4HPO42- = Pb3(PO4)2↓ + 2H2PO4— |
3Pb(NO3)2 + 4Na2HPO4 = Pb3(PO4)2↓ + 6NaNO3 + 2NaH2PO4 | |
| CrO42- | Появление жёлтого осадка
Pb2+ + CrO42-= PbCrO4↓ |
Pb(NO3)2 + K2CrO4 = PbCrO4↓ + 2KNO3 | |
| Видео-опыты по обнаружению ионов свинца Pb2+ Развернуть/свернуть Реакция между хлоридом свинца (II) и иодидом натрия Реакция между нитратом свинца (II) и сульфатом натрия Реакция между нитратом свинца (II) и хлоридом калия Сравнение осадков галогенидов свинца (II) Реакция между нитратом свинца (II) и хроматом калия |
|||
| Ag+ | Cl— | Появление белого творожистого осадка
Ag+ + Cl— = AgCl↓ |
AgF + NaCl = AgCl↓ + NaF
3AgNO3 + AlCl3 = 3AgCl↓ + Al(NO3)3 |
| Br— | Появление белого-жёлтого осадка
Ag+ + Br— = AgBr↓ |
AgF + KBr = AgBr↓ + KF
CH3COOAg + RbBr = AgBr↓ + CH3COORb |
|
| I— | Появление жёлтого осадка
Ag+ + I— = AgI↓ |
AgF + NaI = AgI↓ + NaF
2AgNO3 + ZnI2 = 2AgI↓ + Zn(NO3)2 |
|
| CrO42- | Появление кирпично-красного осадка
2Ag+ + CrO42-= Ag2CrO4↓ |
2AgNO3 + K2CrO4 = Ag2CrO4↓ + 2KNO3
2CH3COOAg + Na2CrO4 = Ag2CrO4↓+ 2CH3COONa |
|
| S2- | Появление чёрного-коричневого осадка
2Ag+ + S2- = Ag2S↓ |
2CH3COOAg + K2S = Ag2S↓ + 2CH3COOK
2AgNO3 + Na2S = Ag2S↓ + 2NaNO3 |
|
| OH— | Появление чёрного осадка
2Ag+ + 2OH— = Ag2O↓ + H2O |
2AgNO3 + 2KOH = Ag2O↓ + H2O + 2KNO3
2AgNO3 + Ba(OH)2 = Ag2O↓ + H2O + Ba(NO3)2 |
|
| PO43- | Появление жёлтого осадка
3Ag+ + PO43-= Ag3PO4↓ |
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
Rb3PO4 + 3AgNO3 = Ag3PO4↓ + 3RbNO3 |
|
| HPO42- | Появление жёлтого осадка
3Ag+ + 2HPO42- = Ag3PO4↓ + H2PO4— |
3AgNO3 + 2K2HPO4 = Ag3PO4↓ + 3KNO3 + KH2PO4 | |
| SO42- | Помутнение раствора из-за образования малорастворимого вещества белого цвета
2Ag+ + SO42- = Ag2SO4↓ |
2AgNO3 + K2SO4 = Ag2SO4↓ + 2KNO3
2CH3COOAg + Na2SO4 = Ag2SO4↓ + 2CH3COONa |
|
| Видео-опыты по обнаружению ионов серебра Ag+ Развернуть/свернуть Реакция между нитратом серебра (I) и хлоридом натрия Сравнение окраски осадков галогенидов серебра (I) Реакция между нитратом серебра (I) и сульфидом натрия Реакция между нитратом серебра (I) и хромата калия Реакция между нитратом серебра (I) и гидроксидом калия Реакция между нитратом серебра (I) и фосфорной кислотой |
|||
| Cu2+ | OH— | Появление голубого осадка Cu2+ + 2OH— = Cu(OH)2↓ | CuCl2 +2NaOH = Cu(OH)2↓ + 2NaCl
Cu(NO3)2 +2KOH = Cu(OH)2↓ + 2KNO3 |
| S2- | Появление чёрного осадка (нерастворимого в серной и соляной кислотах)
Cu2+ + S2- = CuS↓ |
(CH3COO)2Cu + K2S = CuS↓ + 2CH3COOK
Cu(NO3)2 + Na2S = CuS↓ + 2NaNO3 |
|
| I— | Образование осадка белого цвета, который выделяющимся при этом свободным йодом окрашивается в бурый цвет
2Cu2+ + 4I— = 2CuI + I2 |
2CuSO4 + 4KI = 2CuI↓ + I2 + 2K2SO4 | |
| Пламя | Ярко-синее окрашивание | ||
| Видео-опыты по обнаружению ионов меди Cu2+ Развернуть/свернуть Реакция между хлоридом меди (II) и гидроксидом натрия Реакция между сульфатом меди (II) и иодидом калия Реакция между сульфатом меди (II) и сульфидом натрия Изменение окраски пламени солями меди (II) |
|||
| H+ | Индикаторы: метилоранж и лакмус | Оранжевый метилоранж меняет свой цвет на красный.
Фиолетовый лакмус меняет свой цвет на красный. |
|
| CO32- | Выделение бесцветного газа без запаха
2H+ + CO32- = H2O + CO2↑ |
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
H2SO4 + K2CO3 = K2SO4 + H2O + CO2↑ |
|
| HCO3— | Выделение бесцветного газа без запаха
H+ + HCO3— = H2O + CO2↑ |
HNO3 + NaHCO3 = NaNO3+ H2O + CO2↑
2HBr + Ba(HCO3)2 = BaBr2 + 2H2O + 2CO2↑ |
|
| SO32- | Выделение бесцветного газа с резким запахом
2H+ + SO32- = H2O + SO2↑ |
2HBr + Rb2SO3 = 2RbBr + H2O + SO2↑
H2SO4 + Na2SO3 = Na2SO4 + H2O + SO2↑ |
|
| HSO3— | Выделение бесцветного газа с резким запахом
H+ + HSO3— = H2O + SO2↑ |
HCl + NaHSO3 = NaCl + H2O + SO2↑
2HBr + Ca(HCO3)2 = CaBr2 + 2H2O + 2SO2↑ |
|
| S2- | Выделение бесцветного газа с запахом тухлых яиц
2H+ + S2- = H2S↑ |
2HBr + K2S = 2KBr + H2S↑
H2SO4 + Na2S = Na2SO4 + H2S↑ |
|
| HS— | Выделение бесцветного газа с запахом тухлых яиц
H+ + HS— = H2S↑ |
HNO3 + NaHS = NaNO3 + H2S↑
2HBr + Sr(HS)2 = SrBr2 + 2H2S↑ |
|
| SiO32- | Образование белого студенистого осадка
2H+ + SiO32- = H2SiO3↓ |
2HBr + Na2SiO3 = 2NaBr + H2SiO3↓
H2SO4 + K2SiO3 = K2SO4 + H2SiO3↓ |
|
| Видео-опыты по обнаружению ионов водорода H+ Развернуть/свернуть Действие кислот на индикаторы Реакция между карбонатом натрия и серной кислотой Реакция между гидрокарбонатом натрия и соляной кислотой Реакция между сульфитом натрия и соляной кислотой Реакция между сульфидом калия и соляной кислотой Получение кремниевой кислоты |
ОСНОВНЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АНИОНЫ
| Анион | Реактив | Наблюдаемые признаки и ионное уравнение | Примеры уравнений реакций/примечания |
| SO42- | Ba2+ | Появление белого мелкодисперсного осадка (нерастворимого в килотах), напоминающего молоко
Ba2+ + SO42- = BaSO4↓ |
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
BaBr2 + K2SO4 = BaSO4↓ + 2KBr |
| Sr2+ | Появление белого осадка (нерастворимого в килотах)
Sr2+ + SO42- = SrSO4↓ |
SrCl2 + Na2SO4 = SrSO4↓ + 2NaCl
Sr(NO3)2 + H2SO4 = SrSO4↓ + 2HNO3 |
|
| Ca2+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Ca2+ + SO42- = CaSO4↓ |
Ca(NO3)2 + Na2SO4 = CaSO4↓ + 2NaNO3
CaCl2 + MgSO4 = CaSO4↓ + MgCl2 |
|
| Pb2+ | Появление белого осадка
Pb2+ + SO42- = PbSO4↓ |
(CH3COO)2Pb + K2SO4 = PbSO4↓ + 2CH3COOK
Pb(NO3)2 + H2SO4 = PbSO4↓ + 2HNO3 |
|
| Ag+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
2Ag+ + SO42- = Ag2SO4↓ |
2AgNO3 + K2SO4 = Ag2SO4↓ + 2KNO3
2CH3COOAg + Na2SO4 = Ag2SO4↓ + 2CH3COONa |
|
| Видео-опыты по обнаружению сульфат ионов SO42- Развернуть/свернуть Реакция между сульфатом магния и хлоридом кальция Качественная реакция на сульфит- и сульфат-ион Реакция между нитратом стронция и сульфатом калия Реакция между нитратом свинца (II) и сульфатом натрия |
|||
| PO43- | Ag+ | Появление жёлтого осадка
3Ag+ + PO43-= Ag3PO4↓ |
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
Rb3PO4 + 3AgNO3 = Ag3PO4↓ + 3RbNO3 |
| Li+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
3Li+ + PO43-= Li3PO4↓ |
3LiOH + Na3PO4 = Li3PO4↓ + 3NaOH
3LiI + K3PO4 = Li3PO4↓ + 3KI |
|
| Ca2+ | Появление белого осадка
3Ca2+ + 2PO43- = Ca3(PO4)2↓ |
3Ca(HCO3)2 + 2K3PO4 = Ca3(PO4)2↓ + 6KHCO3
3Ca(NO2)2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaNO2 |
|
| Ba2+ | Появление белого осадка
3Ba2+ + 2PO43- = Ba3(PO4)2↓ |
3Ba(HCO3)2 + 2K3PO4 = Ba3(PO4)2↓ + 6KHCO3
3Ba(NO2)2 + 2Na3PO4 = Ba3(PO4)2↓ + 6NaNO2 |
|
| Sr2+ | Появление белого осадка
3Sr2+ + 2PO43- = Sr3(PO4)2↓ |
3Sr(HSO3)2 + 2K3PO4 = Sr3(PO4)2↓ + 6KHSO3
3Sr(NO3)2 + 2Cs3PO4 = Sr3(PO4)2↓ + 6CsNO3 |
|
| Mg2+ | Появление белого осадка
3Mg2+ + 2PO43- = Mg3(PO4)2↓ |
3Mg(HCO3)2 + 2K3PO4 = Mg3(PO4)2↓ + 6KHCO3
3MgSO4 + 2Na3PO4 = Mg3(PO4)2↓ + 3Na2SO4 |
|
| Zn2+ | Появление белого осадка
3Zn2+ + 2PO43- = Zn3(PO4)2↓ |
3ZnSO4 + 2Na3PO4 = Zn3(PO4)2↓ + 3Na2SO4
3Zn(NO3)2 + 2Na3PO4 = Zn3(PO4)2↓ + 6NaNO3 |
|
| Al3+ | Появление белого осадка
Al3+ + PO43- = AlPO4↓ |
Al2(SO4)3 + 2K3PO4 = 2AlPO4↓ + 3K2SO4
AlCl3 + Na3PO4 = AlPO4↓ + 3NaCl |
|
| Cr3+ | Появление чёрного (чёрно-зелёного) осадка
Cr3+ + PO43- = CrPO4↓ |
Cr2(SO4)3 + 2K3PO4 = 2CrPO4↓ + 3K2SO4
CrCl3 + Rb3PO4 = CrPO4↓ + 3RbCl |
|
| Fe3+ | Появление жёлтого осадка
Fe3+ + PO43- = FePO4↓ |
Fe2(SO4)3 + 2K3PO4 = 2FePO4↓ + 3K2SO4
FeCl3 + Na3PO4 = FePO4↓ + 3NaCl |
|
| Видео-опыты по обнаружению фосфат ионов PO43- Развернуть/свернуть Реакция между нитратом серебра (I) и фосфорной кислотой |
|||
| HPO42- | Ca2+ | Появление белого осадка
Ca2+ + HPO42-= CaHPO4↓ |
CaCl2 + Na2HPO4 = CaHPO4↓ + 2NaCl
Ca(NO3)2 + K2HPO4 = CaHPO4↓ + 2KNO3 |
| Ba2+ | Появление белого осадка
Ba2+ + HPO42-= BaHPO4↓ |
BaCl2 + Na2HPO4 = BaHPO4↓ + 2NaCl
Ba(NO3)2 + K2HPO4 = BaHPO4↓ + 2KNO3 |
|
| Sr2+ | Появление белого осадка
Sr2+ + HPO42-= SrHPO4↓ |
SrCl2 + Rb2HPO4 = SrHPO4↓ + 2RbCl
Sr(NO3)2 + Cs2HPO4 = SrHPO4↓ + 2CsNO3 |
|
| Mg2+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Mg2+ + HPO42-= MgHPO4↓ |
MgCl2 + Na2HPO4 = MgHPO4↓ + 2NaCl
Mg(NO3)2 + K2HPO4 = MgHPO4↓ + 2KNO3 |
|
| Mn2+ | Появление белого осадка
3Mn2+ + 4HPO42- = Mn3(PO4)2↓ + 2H2PO4— |
3MnCl2 + 4Na2HPO4 = Mn3(PO4)2↓ + 6NaCl + 2NaH2PO4 | |
| Pb2+ | Появление белого осадка
3Pb2+ + 4HPO42- = Pb3(PO4)2↓ + 2H2PO4— |
3Pb(NO3)2 + 4Na2HPO4 = Pb3(PO4)2↓ + 6NaNO3 + 2NaH2PO4 | |
| Ag+ | Появление жёлтого осадка
3Ag+ + 2HPO42- = Ag3PO4↓ + H2PO4— |
3AgNO3 + 2K2HPO4 = Ag3PO4↓ + 3KNO3 + KH2PO4 | |
| Видео-опыты по обнаружению гидрофосфат ионов HPO42- Развернуть/свернуть |
|||
| CrO42- | Ba2+ | Появление жёлтого осадка
Ba2+ + CrO42-= BaCrO4↓ |
Ba(NO3)2 + Rb2CrO4 = BaCrO4↓ + 2RbNO3
BaCl2 + Cs2CrO4 = BaCrO4↓ + 2CsCl |
| Sr2+ | Появление жёлтого осадка
Sr2+ + CrO42-= SrCrO4↓ |
Sr(NO3)2 + K2CrO4 = SrCrO4↓ + 2KNO3
SrCl2 + Na2CrO4 = SrCrO4↓ + 2NaCl |
|
| Zn2+ | Появление жёлтого осадка
Zn2+ + CrO42-= ZnCrO4↓ |
Zn(NO3)2 + K2CrO4 = ZnCrO4↓ + 2KNO3
ZnCl2 + Na2CrO4 = ZnCrO4↓ + 2NaCl |
|
| Pb2+ | Появление жёлтого осадка
Pb2+ + CrO42-= PbCrO4↓ |
Pb(NO3)2 + K2CrO4 = PbCrO4↓ + 2KNO3 | |
| Ag+ | Появление кирпично-красного осадка
2Ag+ + CrO42-= Ag2CrO4↓ |
2AgNO3 + K2CrO4 = Ag2CrO4↓ + 2KNO3
2CH3COOAg + Na2CrO4 = Ag2CrO4↓+ 2CH3COONa |
|
| Видео-опыты по обнаружению хромат ионов CrO42- Развернуть/свернуть Реакция между нитратом бария и хроматом калия Реакция между хлоридом бария и хроматом калия Реакция между нитратом свинца (II) и хроматом калия Реакция между нитратом серебра (I) и хромата калия |
|||
| S2- | Pb2+ | Появление чёрного осадка
Pb2+ + S2- = PbS↓ |
(CH3COO)2Pb + K2S = PbS↓ + 2CH3COOK
Pb(NO3)2 + Na2S = PbS↓ + 2NaNO3 |
| Ag+ | Появление чёрного-коричневого осадка
2Ag+ + S2- = Ag2S↓ |
2CH3COOAg + K2S = Ag2S↓ + 2CH3COOK
2AgNO3 + Na2S = Ag2S↓ + 2NaNO3 |
|
| Cu2+ | Появление чёрного осадка (нерастворимого в серной и соляной кислотах)
Cu2+ + S2- = CuS↓ |
(CH3COO)2Cu + K2S = CuS↓ + 2CH3COOK
Cu(NO3)2 + Na2S = CuS↓ + 2NaNO3 |
|
| Zn2+ | Появление белого осадка (легко растворимого в минеральных кислотах)
Zn2+ + S2- = ZnS↓ |
Zn(NO3)2 + Na2S = ZnS↓ + 2NaNO3
ZnSO4 + K2S = ZnS↓ + K2SO4 ZnS не выпадает в осадок при насыщении растворов солей цинка сероводородом |
|
| Fe2+ | Появление чёрного осадка (легко растворимого в минеральных кислотах)
Fe2+ + S2- = FeS↓ |
FeSO4 + (NH4)2S = FeS↓ + (NH4)2SO4
Сульфид железа (II) можно получить только при достаточно большой концентрации ионов S2- врастворе. FeS не выпадает в осадок при насыщении растворов солей железа(II) сероводородом |
|
| Mn2+ | Появление телесно-розового осадка
Mn2+ + S2- = MnS↓ |
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
MnCl2 + Na2S = MnS↓ + 2NaCl |
|
| H+ | Выделение бесцветного газа с запахом тухлых яиц
2H+ + S2- = H2S↑ |
2HBr + K2S = 2KBr + H2S↑
H2SO4 + Na2S = Na2SO4 + H2S↑ |
|
| HS— | H+ | Выделение бесцветного газа с запахом тухлых яиц
H+ + HS— = H2S↑ |
HNO3 + NaHS = NaNO3 + H2S↑
2HBr + Sr(HS)2 = SrBr2 + 2H2S↑ |
| Видео-опыты по обнаружению сульфид ионов S2- Развернуть/свернуть Реакция между нитратом серебра (I) и сульфидом натрия Реакция между сульфатом меди (II) и сульфидом натрия Реакция между сульфидом калия и соляной кислотой |
|||
| CO32- | Ca2+ | Появление белого осадка
Ca2+ + CO32- = CaCO3↓ |
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Ca(NO3)2 + K2CO3 = CaCO3↓ + 2KNO3 |
| H+ | Выделение бесцветного газа без запаха
2H+ + CO32- = H2O + CO2↑ |
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
H2SO4 + K2CO3 = K2SO4 + H2O + CO2↑ |
|
| Ba2+ | Появление белого осадка
Ba2+ + CO32- = BaCO3↓ |
BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl
Ba(NO3)2 + K2CO3 = BaCO3↓ + 2KNO3 |
|
| Sr2+ | Появление белого осадка
Sr2+ + CO32- = SrCO3↓ |
SrCl2 + Cs2CO3 = SrCO3↓ + 2CsCl
Sr(NO3)2 + K2CO3 = SrCO3↓ + 2KNO3 |
|
| Mg2+ | Появление белого осадка
Mg2+ + CO32- = MgCO3↓ А также может образоваться основная соль – гидроксокарбонат (MgOH)2CO3↓ из-за гидролиза |
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl
2MgCl2+2Na2CO3+H2O=(MgOH)2CO3↓ + 4NaCl + CO2↑ |
|
| Zn2+ | Появление белого осадка
Zn2+ + CO32- = ZnCO3↓ А также может образоваться основная соль – гидроксокарбонат (ZnOH)2CO3↓ из-за гидролиза |
ZnCl2 + Na2CO3 = ZnCO3↓ + 2NaCl
2ZnCl2+2K2CO3+H2O=(ZnOH)2CO3↓ + 4KCl + CO2↑ |
|
| Al3+ | Появление белого осадка и выделение бесцветного газа из-за полного гидролиза карбоната алюминия
2Al3+ + 3СO32-+ 3Н2О = 2Al(OH)3↓ + 6КCl + 3CO2↑ |
2AlCl3 + 3К2СO3+ 3Н2О = 2Al(OH)3↓ + 6КCl + 3CO2↑ | |
| Cr3+ | Появление серо-зелёного осадка и выделение бесцветного газа из-за полного гидролиза карбоната хрома (III)
2Cr3+ + 3СO32-+ 3Н2О = 2Cr(OH)3↓ + 6КCl + 3CO2↑ |
Сr2(SO4)3 + 3К2CO3 + 3Н2О = 2Cr(OH)3↓ + 3К2SO4 + 3CO2↑ | |
| Fe2+ | Появление белого осадка
Fe2+ + CO32- = FeCO3↓ |
(NH4)2Fe(SO4)2 + Na2CO3 = FeCO3↓ + Na2SO4 + (NH4)2SO4 | |
| Mn2+ | Появление белого осадка
Mn2+ + CO32- = MnCO3↓ |
MnCl2 + Na2CO3 = MnCO3↓ + 2NaCl
Mn(NO3)2 + K2CO3 = MnCO3↓ + 2KNO3 |
|
| HCO3— | H+ | Выделение бесцветного газа без запаха
H+ + HCO3— = H2O + CO2↑ |
HNO3 + NaHCO3 = NaNO3+ H2O + CO2↑
2HBr + Ba(HCO3)2 = BaBr2 + 2H2O + 2CO2↑ |
| Видео-опыты по обнаружению карбонат ионов CO32- и гидрокарбонат ионов HCO3— Развернуть/свернуть Реакция между карбонатом натрия и хлоридом кальция Реакция между хлоридом бария и карбонатом натрия Реакция между нитратом стронция и карбонатом натрия Реакция между хлоридом магния и карбонатом натрия Реакция между хлоридом цинка и карбонатом натрия Реакция между нитратом марганца (II) и карбонатом натрия Реакция между карбонатом натрия и серной кислотой Реакция между гидрокарбонатом натрия и соляной кислотой |
|||
| SO32- | H+ | Выделение бесцветного газа с резким запахом
2H+ + SO32- = H2O + SO2↑ |
2HBr + Rb2SO3 = 2RbBr + H2O + SO2↑
H2SO4 + Na2SO3 = Na2SO4 + H2O + SO2↑ |
| Ca2+ | Появление белого осадка
Ca2+ + SO32- = CaSO3↓ |
Ca(NO3)2 + Na2SO3 = CaSO3↓ + 2NaNO3
(CH3COO)2Ca + Li2SO3 = CaSO3↓ + 2CH3COOLi |
|
| Ba2+ | Появление белого осадка
Ba2+ + SO32- = BaSO3↓ |
Ba(NO3)2 + Na2SO3 = BaSO3↓ + 2NaNO3
(CH3COO)2Ba+ Li2SO3 = BaSO3↓ + 2CH3COOLi |
|
| Sr2+ | Появление белого осадка
Sr2+ + SO32- = SrSO3↓ |
Sr(NO3)2 + K2SO3 = SrSO3↓ + 2KNO3
(CH3COO)2Sr + Rb2SO3 = SrSO3↓ + 2CH3COORb |
|
| Mg2+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Mg2+ + SO32- = MgSO3↓ |
(CH3COO)2Mg + Li2SO3 = MgSO3↓ + 2CH3COOLi
Mg(NO3)2 + Na2SO3 = MgSO3↓ + 2NaNO3 |
|
| HSO3— | H+ | Выделение бесцветного газа с резким запахом
H+ + HSO3— = H2O + SO2↑ |
HCl + NaHSO3 = NaCl + H2O + SO2↑
2HBr + Ca(HCO3)2 = CaBr2 + 2H2O + 2SO2↑ |
| Видео-опыты по обнаружению сульфит ионов SO32- Развернуть/свернуть Качественная реакция на сульфит- и сульфат-ион Реакция между сульфитом натрия и соляной кислотой |
|||
| SiO32- | H+ | Образование белого студенистого осадка
2H+ + SiO32- = H2SiO3↓ |
2HBr + Na2SiO3 = 2NaBr + H2SiO3↓
H2SO4 + K2SiO3 = K2SO4 + H2SiO3↓ |
| Li+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
2Li+ + SiO32- = Li2SiO3↓ |
2LiBr + Na2SiO3 = Li2SiO3↓ + 2NaBr
2LiCl + K2SiO3 = Li2SiO3↓ + 2KCl |
|
| Ca2+ | Появление белого осадка
Ca2+ + SiO32- = CaSiO3↓ |
Ca(HS)2 + K2SiO3 = CaSiO3↓ + 2KHS
CaCl2 + Na2SiO3 = CaSiO3↓ + 2NaCl |
|
| Ba2+ | Появление белого осадка
Ba2+ + SiO32- = BaSiO3↓ |
Ba(HSO3)2 + K2SiO3 = BaSiO3↓ + 2KHSO3
BaCl2 + Na2SiO3 = BaSiO3↓ + 2NaCl |
|
| Sr2+ | Появление белого осадка
Sr2+ + SiO32- = SrSiO3↓ |
Sr(HCO3)2 + K2SiO3 = SrSiO3↓ + 2KHCO3
SrCl2 + Na2SiO3 = SrSiO3↓ + 2NaCl |
|
| Mg2+ | Появление белого осадка
Mg2+ + SiO32- = MgSiO3↓ |
MgSO4 + K2SiO3 = MgSiO3↓ + K2SO4
MgCl2 + Na2SiO3 = MgSiO3↓ + 2NaCl |
|
| Видео-опыты по обнаружению силикат ионов SiO32- Развернуть/свернуть Получение кремниевой кислоты |
|||
| F— | Ca2+ | Появление белого осадка
Ca2+ + 2F— = CaF2↓ |
CaBr2 + 2NaF = CaF2↓ + 2NaBr
CaI2 + 2NH4F = CaF2↓ + 2NH4I |
| Li+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Li+ + F— = LiF↓ |
LiNO3 + AgF = LiF↓ + AgNO3
CH3COOLi + NH4F = LiF↓ +CH3COONH4 |
|
| Ba2+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета для бария и появление белого осадка для стронция
Ba2+ + 2F— = BaF2↓ |
BaBr2 + 2NaF = BaF2↓ + 2NaBr
BaI2 + 2NH4F = BaF2↓ + 2NH4I |
|
| Sr2+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета для бария и появление белого осадка для стронция
Sr2+ + 2F— = SrF2↓ |
SrCl2 + 2NaF = SrF2↓ + 2NaCl
SrI2 + 2NH4F = SrF2↓ + 2NH4I |
|
| Mg2+ | Появление белого осадка
Mg2+ + 2F— = MgF2↓ |
MgBr2 + 2NaF = MgF2↓ + 2NaBr
MgI2 + 2NH4F = MgF2↓ + 2NH4I |
|
| Видео-опыты по обнаружению фторид ионов F— Развернуть/свернуть Реакция между фторидом натрия и бромидом кальция Реакция между нитратом стронция и фторидом натрия |
|||
| Cl— | Ag+ | Появление белого творожистого осадка
Ag+ + Cl— = AgCl↓ |
AgF + NaCl = AgCl↓ + NaF
3AgNO3 + AlCl3 = 3AgCl↓ + Al(NO3)3 |
| Pb2+ | Появление белого осадка, растворимого в горячей воде
Pb2+ + 2Cl— = PbCl2↓ |
(CH3COO)2Pb + 2NaCl = PbCl2↓ + 2CH3COONa
Pb(NO3)2 + BaCl2 = PbCl2↓ + Ba(NO3)2 |
|
| Видео-опыты по обнаружению хлорид ионов Cl— Развернуть/свернуть Реакция между нитратом свинца (II) и хлоридом калия Реакция между нитратом серебра (I) и хлоридом натрия |
|||
| Br— | Ag+ | Появление белого-жёлтого осадка
Ag+ + Br— = AgBr↓ |
AgF + KBr = AgBr↓ + KF
CH3COOAg + RbBr = AgBr↓ + CH3COORb |
| Pb2+ | Появление белого малорастворимого вещеста
Pb2+ + 2Br— = PbBr2↓ |
(CH3COO)2Pb + 2NaBr= PbBr2↓ + 2CH3COONa
Pb(NO3)2 + CaBr2 = PbBr2↓ + Ca(NO3)2 |
|
| Видео-опыты по обнаружению бромид ионов Br— Развернуть/свернуть Сравнение осадков галогенидов серебра (I) Сравнение осадков галогенидов свинца (II) |
|||
| I— | Ag+ | Появление жёлтого осадка
Ag+ + I— = AgI↓ |
AgF + NaI = AgI↓ + NaF
2AgNO3 + ZnI2 = 2AgI↓ + Zn(NO3)2 |
| Pb2+ | Появление жёлто-золотистого осадка
Pb2+ + 2I— = PbI2↓ |
(CH3COO)2Pb + 2NaI = PbI2↓ + 2CH3COONa
Pb(NO3)2 + CaI2 = PbI2↓ + Ca(NO3)2 |
|
| Cu2+ | Образование осадка белого цвета, который выделяющимся при этом свободным йодом окрашивается в бурый цвет
2Cu2+ + 4I— = 2CuI + I2 |
2CuSO4 + 4KI = 2CuI↓ + I2 + 2K2SO4 | |
| Видео-опыты по обнаружению иодид ионов I— Развернуть/свернуть Реакция между хлоридом свинца (II) и иодидом натрия Реакция между сульфатом меди (II) и иодидом калия |
|||
| OH— | Индикаторы: фенолфталеин, метилоранж и лакмус | Бесцветный фенолфталеин меняет свой цвет на малиновый.
Оранжевый метилоранж меняет свой цвет на жёлтый. Фиолетовый лакмус меняет свой цвет на синий. |
|
| NH4+ (при нагревании) | Выделение газа с резким запахом, посинение влажной лакмусовой бумажки
NH4+ + OH— = NH3↑ + H2O |
NH4Cl + NaOH = NaCl + NH3↑ + H2O
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3↑ + 2H2O |
|
| Zn2+ | Выпадение белого осадка гидроксида цинка при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Zn2+ + 2OH— = Zn(OH)2↓ 2) Zn(OH)2 + 2OH— = [Zn(OH)4]2- |
1) Zn(NO3)2 + 2NaOH = Zn(OH)2↓ + 2NaNO3
2) Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] Помните, что гидроксиды катионов Al3+, Cr3+ не переводятся в комплексное соединение гидратом аммиака. Zn2+ при добавлении конц. раствора аммиака сначала образуется Zn(OH)2, а при избытке аммиак способствует растворению осадка: Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2 |
|
| Al3+ | Выпадение белого осадка гидроксида алюминия при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Al3+ + 3OH— = Al(OH)3↓ 2) Al(OH)3 + OH— = [Al(OH)4]— или Al(OH)3 + 3OH— = [Al(OH)6]3- |
1) AlCl3 + 3KOH = Al(OH)3↓ + 3KCl
2) Al(OH)3 + KOH = K[Al(OH)4] или Al(OH)3 + 3KOH = K3[Al(OH)6] Помните, что гидроксид катиона Al3+ не переводится в комплексное соединение гидратом аммиака. |
|
| Cr3+ | Выпадение серо-зелёного осадка гидроксида хрома (III) при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Cr3+ + 3OH— = Cr(OH)3↓ 2) Cr(OH)3 + OH— = [Cr(OH)4]— или Cr(OH)3 + 3OH— = [Cr(OH)6]3- |
1) CrBr3 + 3NaOH = Cr(OH)3↓ + 3NaBr
2) Cr(OH)3 + NaOH = Na[Cr(OH)4] или Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Помните, что гидроксид хрома (III) не переводятся в комплексное соединение гидратом аммиака. Раствор, содержащий [Cr(OH)6]3-, при добавлении хлорной или бромной воды в щелочной среде становится желтым из-за образования хромат-аниона CrO42-: 2[Cr(OH)6]3- + 3Br2 + 4OH— = 2CrO42- + 6Br— + 8H2O |
|
| Mg2+ | Появление белого осадка (нерастворимого в избытке щёлочи)
Mg2+ + 2OH— = Mg(OH)2↓ |
MgCl2 +2NaOH = Mg(OH)2↓ + 2NaCl
Mg(NO3)2 +2KOH = Mg(OH)2↓ + 2KNO3 |
|
| Fe2+ | Появление грязно-зелёного осадка (хотя должен быть белый), буреющего со временем
Fe2+ + 2OH— = Fe(OH)2↓ |
FeCl2 +2NaOH = Fe(OH)2↓ + 2NaCl
Fe(NO3)2 +2KOH = Fe(OH)2↓ + 2KNO3 |
|
| Fe3+ | Появление бурого осадка
Fe3+ + 3OH— = Fe(OH)3↓ |
FeCl3+2CsOH = Fe(OH)3↓ + 2CsCl
Fe(NO3)3 +2NaOH = Fe(OH)3↓ + 2NaNO3 |
|
| Mn2+ | Появление белого осадка, розовеющего (буреющего) на воздухе
Mn2+ + 2OH— = Mn(OH)2↓ |
MnBr2 +2NaOH = Mn(OH)2↓ + 2NaBr
Mn(NO3)2 +2KOH = Mn(OH)2↓ + 2KNO3 |
|
| Pb2+ | Выпадение белого осадка гидроксида свинца (II) при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Pb2+ + 2OH— = Pb(OH)2↓ 2) Pb(OH)2 + 2OH— = [Pb(OH)4]2- |
1) Pb(NO3)2 + 2NaOH = Pb(OH)2↓ + 2NaNO3
2) Pb(OH)2 + 2NaOH = Na2[Pb(OH)4] |
|
| Ag+ | Появление чёрного осадка
2Ag+ + 2OH— = Ag2O↓ + H2O |
2AgNO3 + 2KOH = Ag2O↓ + H2O + 2KNO3
2AgNO3 + Ba(OH)2 = Ag2O↓ + H2O + Ba(NO3)2 |
|
| Cu2+ | Появление голубого осадка Cu2+ + 2OH— = Cu(OH)2↓ | CuCl2 +2NaOH = Cu(OH)2↓ + 2NaCl
Cu(NO3)2 +2KOH = Cu(OH)2↓ + 2KNO3 |
|
| Видео-опыты по обнаружению гидроксид ионов OH— Развернуть/свернуть Действие щелочей на индикаторы Реакция между хлоридом магния и гидроксидом калия Реакция между хлоридом аммония и гидроксидом натрия Реакция между нитратом цинка и гидроксидом натрия Амфотерность гидроксида алюминия Амфотерность гидроксида хрома (III) Реакция между хлоридом железа (II) и гидроксидом натрия Получение гидроксида железа (III) и исследование его свойств Реакция между нитратом марганца (II) и гидроксидом натрия Реакция между нитратом серебра (I) и гидроксидом калия Реакция между хлоридом меди (II) и гидроксидом натрия |
ОКРАСКА (ЦВЕТ) ВСЕХ ОСАДКОВ И ИХ ОСОБЕННОСТИ
| Цвет | Формула | Ионное уравнение получения | Особенности |
| Белый | LiF | Li+ + F— = LiF↓ | Белый аморфный осадок. Растворимость фторида лития в воде уменьшается в присутствии аммиака |
| Белый | Li3PO4 | 3Li+ + PO43-= Li3PO4↓
3Li+ + HPО42– = Li3PO4↓ + H+ |
Фосфат лития растворим в растворах кислот и солей аммония |
| Белый | CaCO3 | Ca2+ + CO32- = CaCO3↓ | Карбонат кальция растворим в кислотах.
Также можно получить при пропускании углекислого газа через известковую воду: Сa(OH)2 + CO2 = CaCO3↓ + H2O. Образовавшийся осадок растворяется в избытке CO2: CaCO3↓ + H2O + CO2 = Ca(HCO3)2 |
| Белый | CaF2 | Ca2+ + 2F— = CaF2↓ | Белый студенистый осадок. Малорастворимый в кислотах и разлагающийся при нагревании с концентрированной серной кислотой |
| Белый | CaSO3 | Ca2+ + SO32- = CaSO3↓ | Сульфит кальция растворим в кислотах.
Также можно получить при пропускании сернистого газа через известковую воду: Сa(OH)2 + SO2 = CaSO3↓ + H2O. Образовавшийся осадок растворяется в избытке SO2: CaSO3↓ + H2O + SO2 = Ca(HSO3)2 |
| Белый | CaSiO3 | Ca2+ + SiO32- = CaSiO3↓ | Известно большое количество силикатов кальция:
CaSiO3 — метасиликат или просто силикат кальция Ca3Si2O7 — пиросиликат кальция Ca2SiO4 — ортосиликат кальция |
| Белый | Ca3(PO4)2 | 3Ca2+ + 2PO43- = Ca3(PO4)2↓ | При действии кислот ортофосфат кальция переходит в более растворимый дигидрофосфат |
| Белый | CaHPO4 | Ca2+ + HPO42-= CaHPO4↓ | При действии кислот гидрофосфат кальция переходит в более растворимый дигидрофосфат |
| Белый | CaSO4 | Ca2+ + SO42- = CaSO4↓ | Осадок сульфата кальция нерастворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония |
| Белый | BaSO4 | Ba2+ + SO42- = BaSO4↓ | Осадок нерастворим в щелочах и кислотах, за исключением концентрированной серной кислоты, в которой он заметно растворяется с образованием гидросульфата бария Ba(HSO4)2 |
| Белый | SrSO4 | Sr2+ + SO42- = SrSO4↓ | Осадок нерастворим в щелочах и кислотах, за исключением концентрированной серной кислоты, в которой он заметно растворяется с образованием гидросульфата стронция Sr(HSO4)2 |
| Белый | BaCO3 | Ba2+ + CO32- = BaCO3↓ | Карбонат бария растворим в кислотах. При действии избытка раствора углекислого газа переводится в растворимый гидрокарбонат |
| Белый | SrCO3 | Sr2+ + CO32- = SrCO3↓ | Карбонат стронция растворим в кислотах. При действии избытка раствора углекислого газа переводится в растворимый гидрокарбонат |
| Белый | BaF2 | Ba2+ + 2F— = BaF2↓ | Разлагается при нагревании с концентрированной серной кислотой |
| Белый | SrF2 | Sr2+ + 2F— = SrF2↓ | Разлагается при нагревании с концентрированной серной кислотой |
| Белый | BaSO3 | Ba2+ + SO32- = BaSO3↓ | Растворяется в кислотах |
| Белый | SrSO3 | Sr2+ + SO32- = SrSO3↓ | Растворяется в кислотах |
| Белый | BaSiO3 | Ba2+ + SiO32- = BaSiO3↓ | Растворяется в сильных кислотах |
| Белый | SrSiO3 | Sr2+ + SiO32- = SrSiO3↓ | Растворяется в сильных кислотах |
| Белый | Ba3(PO4)2 | 3Ba2+ + 2PO43- = Ba3(PO4)2↓ | С избытком фосфорной кислоты образует растворимый в воде дигидрофосфат.
Заметно растворим в присутствии NH4Cl, уксусной кислоте и хорошо растворим в сильных кислотах |
| Белый | Sr3(PO4)2 | 3Sr2+ + 2PO43- = Sr3(PO4)2↓ | С избытком фосфорной кислоты образует растворимый в воде дигидрофосфат.
Заметно растворим в присутствии NH4Cl, уксусной кислоте и хорошо растворим в сильных кислотах |
| Белый | BaHPO4 | Ba2+ + HPO42-= BaHPO4↓ | Растворяется в кислотах (не серной) |
| Белый | SrHPO4 | Sr2+ + HPO42-= SrHPO4↓ | Растворяется в кислотах (не серной) |
| Белый | Mg(OH)2 | Mg2+ + 2OH— = Mg(OH)2↓ | Не растворяется в щелочах, но в аммонийных солях легко растворяется |
| Белый | MgCO3 | Mg2+ + CO32- = MgCO3↓ | Растворим в кислотах. При действии избытка раствора углекислого газа переводится в растворимый гидрокарбонат |
| Белый | MgF2 | Mg2+ + 2F— = MgF2↓ | Хорошо растворяется в растворах фторидов и сульфатов щелочных металлов |
| Белый | MgSO3 | Mg2+ + SO32- = MgSO3↓ | Растворим в кислотах. При действии избытка раствора сернистого газа переводится в растворимый гидрокарбонат |
| Белый | MgSiO3 | Mg2+ + SiO32- = MgSiO3↓ | Растворяется в сильных кислотах |
| Белый | Mg3(PO4)2 | 3Mg2+ + 2PO43- = Mg3(PO4)2↓ | С избытком фосфорной кислоты образует растворимый в воде дигидрофосфат |
| Белый | MgHPO4 | Mg2+ + HPO42-= MgHPO4↓ | С избытком фосфорной кислоты образует растворимый в воде дигидрофосфат |
| Белый | Zn(OH)2 | Zn2+ + 2OH— = Zn(OH)2↓ | Растворяется в избытке растворов щелочей |
| Белый | ZnS | Zn2+ + S2- = ZnS↓ | Легко растворяется в минеральных кислотах |
| Белый | ZnCO3 | Zn2+ + CO32- = ZnCO3↓ | Растворим в кислотах. При действии избытка раствора углекислого газа переводится в растворимый гидрокарбонат |
| Белый | Zn3(PO4)2 | 3Zn2+ + 2PO43- = Zn3(PO4)2↓ | Растворяется в щелочах, аммиаке и кислотах |
| Белый | Al(OH)3 | Al3+ + 3OH— = Al(OH)3↓ | Растворяется в избытке растворов щелочей |
| Белый | AlPO4 | Al3+ + PO43- = AlPO4↓ | Растворяется в щелочах и кислотах |
| Белый | FeCO3 | Fe2+ + CO32- = FeCO3↓ | Во влажном воздухе легко окисляется до FeOHCO3, вследствие чего окраска его уже в момент образования приобретает бурый цвет.
Растворяется в избытке раствора углекислого газа. |
| Белый | Mn(OH)2 | Mn2+ + 2OH— = Mn(OH)2↓ | Розовеет (буреет) на воздухе. Не растворим в щелочах, но растворим в аммонийных солях и сильных кислотах |
| Белый | MnCO3 | Mn2+ + CO32- = MnCO3↓ | Растворяется в кислотах |
| Белый | Mn3(PO4)2 | 3Mn2+ + 4HPO42- = Mn3(PO4)2↓ + 2H2PO4—
3Mn2+ + 2PO43- = Mn3(PO4)2↓ |
Белый аморфный осадок |
| Белый | PbSO4 | Pb2+ + SO42— = PbSO4↓ | Растворяется при нагревании в щелочах, концентрированной серной кислоте и растворе ацетата аммония |
| Белый | PbCl2 | Pb2+ + 2Cl— = PbCl2↓ | Является малорастворимым веществом, растворяется в горячей воде, щелочах и концентрированной соляной кислоте |
| Белый | Pb(OH)2 | Pb2+ + 2OH— = Pb(OH)2↓ | Растворяется в кислотах и щелочах |
| Белый | Pb3(PO4)2 | 3Pb2+ + 4HPO42- = Pb3(PO4)2↓ + 2H2PO4—
3Pb2+ + 2PO43- = Pb3(PO4)2↓ |
Белый аморфный осадок |
| Белый | AgCl | Ag+ + Cl— = AgCl↓ | Осадок белый творожистый. Растворим в концентрированном растворе аммиака и концентрированной соляной кислоте |
| Белый | H2SiO3 | 2H+ + SiO32- = H2SiO3↓ | Осадок белый студенистый |
| Оранжевый | Ag2CrO4 | 2Ag+ + CrO42-= Ag2CrO4↓ | Осадок оранжевый (кирпично-красный). Растворим в кислотах и концентрированном растворе аммиака |
| Жёлтый | BaCrO4 | Ba2+ + CrO42-= BaCrO4↓ | В растворах сильных неорганических кислот растворяется с образованием дихромата. Плохо растворим в уксусной кислоте, что используется для отделения бария от ионов стронция |
| Жёлтый | SrCrO4 | Sr2+ + CrO42-= SrCrO4↓ | В растворах сильных неорганических кислот и уксусной кислоте растворяется с образованием дихромата |
| Жёлтый | ZnCrO4 | Zn2+ + CrO42-= ZnCrO4↓ | Растворим в кислотах и щелочах |
| Жёлтый | PbCrO4 | Pb2+ + CrO42-= PbCrO4↓ | Растворим в кислотах и щелочах |
| Жёлтый | AgBr | Ag+ + Br— = AgBr↓ | Осадок бело-жёлтый (светло-жёлтый). Частично растворим в концентрированном растворе аммиака |
| Жёлтый | Ag3PO4 | 3Ag+ + PO43- = Ag3PO4↓
3Ag+ + 2HPO42- = Ag3PO4↓ + H2PO4— |
Растворим в растворе аммиака |
| Жёлтый | CdS | Cd2+ + S2- = CdS↓ | Осадок имеет ярко-желтую окраску – «канареечный цвет». В разбавленных кислотах при кипячении легко растворим |
| Серо-зелёный | Cr(OH)3 | Cr3+ + 3OH— = Cr(OH)3↓ | Растворим в кислотах и щелочах |
| Чёрно-зелёный | CrPO4 | Cr3+ + PO43- = CrPO4↓ | Чёрно-зелёный (черный) осадок |
| Грязно-зелёный | Fe(OH)2 | Fe2+ + 2OH— = Fe(OH)2↓ | Должен быть белого цвета, но из-за окисления получается грязно-зелёный цвет. Растворим в кислотах |
| Чёрный | FeS | Fe2+ + S2- = FeS↓ | Не выпадает в осадок при насыщении растворов солей железа(II) сероводородом. Растворяется в кислотах |
| Чёрный | PbS | Pb2+ + S2- = PbS↓ | Растворим в азотной кислоте |
| Чёрный | Ag2S | 2Ag+ + S2- = Ag2S↓ | Осадок чёрный (чёрно-коричневый). Растворим в азотной кислоте |
| Чёрный | Ag2O | 2Ag+ + 2OH— = Ag2O↓ + H2O | Осадок чёрный (чёрно-коричневый). Растворяется в концентрированном растворе аммиака |
| Чёрный | CuS | Cu2+ + S2- = CuS↓ | Выпадает в осадок из солянокислых и сернокислых растворов ее солей, но в разбавленной HNО3 при нагревании легко растворяется |
| Чёрный | NiS | Ni2+ + S2- → NiS↓ | Растворим в азотной кислоте |
| Чёрный | HgS | Hg2+ + S2- → HgS↓ | В разбавленных кислотах нерастворим, растворяется только в концентрированной HNО3 и царской водке при нагревании |
| Бурый | Fe(OH)3 | Fe3+ + 3OH— = Fe(OH)3↓ | Растворим в кислотах, но не растворим в концентрированном растворе аммиака |
| Телесно-розовый | MnS | Mn2+ + S2- = MnS↓ | Не выпадает в осадок при насыщении растворов солей марганца(II) сероводородом. Растворим в кислотах |
| Голубой | Cu(OH)2 | Cu2+ + 2OH— = Cu(OH)2↓ | Растворим в кислотах и растворе аммиака |
КАЧЕСТВЕННЫЕ РЕАКЦИИ ДЛЯ ИНДИВИДУАЛЬНЫХ ВЕЩЕСТВ
| Вещество | Реактив | Реакция | Характерные признаки |
| Н2 | О2 (сжигание) | 2Н2 + О2 = 2Н2О | Запотевание холодного предмета |
| О2 | С (тлеющая лучинка) | С + О2 = СО2 | Вспышка |
| О3 | KI (p-p) | 2KI + O3 + H2O = 2KOH + I2↓ + O2↑ | Образование кристаллического иода тёмно-фиолетового цвета |
| Сl2 | Бумажка, пропитанная крахмальным клейстером и раствором иодида калия | 2KI + Cl2 = 2KCl + I2↓ | Посинение бумажки |
| I2 | Крахмальный клейстер | Синее окрашивание | |
| СО2 | Известковая вода | Са(ОН)2 + СО2 = СаСО3↓+ Н2О
CaCO3↓ + H2O + CO2 = Ca(HCO3)2 |
Помутнение раствора с последующим растворение осадка при пропускании избытка углекислого газа |
| С (тлеющая лучинка) | Гаснет в атмосфере углекислого газа | ||
| NH3 | Хлороводород | NH3 + HCl = NH4Cl | Белый дым. Специфический запах NH3, образование белого дыма (NH4Cl) |
| SO2 | Окрашенные растворы окислителей (KMnO4 и Br2) | SO2 + Br2 + 2H2O = H2SO4 + 2HBr
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4 |
Обесцвечивание растворов |
ОБЩИЕ ПРАВИЛА РАЗЛИЧЕНИЯ ВЕЩЕСТВ ДРУГ ОТ ДРУГА
- По разной среде раствора:
1) Изменение окраски индикаторов:
Фенолфталеин (бесцветный) применяется для определения щелочной реакции среды (присутствуют ионы OH—). Изменяет цвет на малиновый.
Лакмус (фиолетовый) в кислой среде (присутствуют ионы H+) становится красным, в щелочной — синим.
Метилоранж (оранжевый) в кислой среде (присутствуют ионы H+) становится красным, в щелочной — жёлтым.
2) Среда раствора аммиака NH3 является щелочной, так как протекает обратимое взаимодействие с водой: NH3 + H2O ↔ NH4+ + OH–.
3) H2SiO3 является очень слабой нерастворимой в воде кислотой, поэтому она не изменяет окраску индикаторов.
4) Некоторые соли подвергаются гидролизу и поэтому их растворы меняют окраску индикаторов:
СuSO4 гидролизуется по катиону, поэтому раствор этой соли имеет кислую реакцию среды.
Na2CO3 гидролизуется по аниону, поэтому раствор этой соли имеет щелочную реакцию среды.
- Как отличить металлы различной активности:
Например, щелочные и щелочноземельные металлы можно отличить от других металлов реакцией с водой. Первые реагируют быстро и очень бурно в обычных условиях:
2Na + 2H2O → 2NaOH + H2 (при обычных условиях)
Fe + H2O → без нагревания реакция НЕ идет (но идёт при нагревании: 3Fe + 4H2O → Fe3O4 + H2↑).
- Как отличить оксиды активных металлов (щелочных и щелочноземельных) от оксидов других металлов:
Оксиды активных металлов реагируют с водой в обычных условиях:
K2O + H2O → 2KOH
ZnO + H2O → реакция НЕ идет (ни при каких условиях)
- Как отличить кислоты-окислители от кислот-неокислителей:
В отличие от обычных кислот, кислоты-окислители реагируют с металлами, стоящими в ряду напряжений правее водорода:
HBr + Ag → реакция не идет
4HNO3 (конц.) + Cu → Cu(NO3)2 + 2NO2↑ + 2H2O (выделение бурого газа)
- Как отличить солислабой и сильной кислот:
В этом случае часто берут соль угольной, сернистой, сероводородной или кремниевой кислот. В реакциях этих солей с сильными кислотами выделяется газ или выпадает осадок:
K2CO3 + 2HCl → 2KCl + CO2↑ + H2O
K2S + 2HCl → 2KCl + H2S↑
K2SiO3 + 2HCl → 2KCl + H2SiO3↓
K2SO4 + HCl → реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются)
BaSO3 + 2HCl → BaCl2 + SO2↑ + H2O
BaSO4 + HCl → реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются)
- Как отличить соли слабого и сильного основания:
Соли слабых основания при взаимодействии со щелочами дают осадки, а соли сильных оснований – нет:
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
NH4NO3 + KOH → NH3↑ + H2O + KNO3 (при нагревании)
KNO3 + NaOH → реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются)
- Как отличитьсоли двух металлов, один из которых образует амфотерные соединения (например, Zn, Be, Al и др.):
Реагентом, которым можно отличить эти типы солей, являются щелочи:
Al(NO3)3 + 4KOH(р) → 3KNO3 + K[Al(OH)4] — осадок Al(OH)3 сначала образуется, а затем растворяется в избытке щелочи.
Cu(NO3)2 + 2KOH → Cu(OH)2↓ + 2KNO3 — осадок не растворяется.
- Как отличить гидроксиды двух металлов, один из которых образует амфотерные соединения (например, Zn, Be, Al и др.):
Этим реагентом являются щелочи:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] (растворение осадка)
Mg(OH)2 + KOH → реакция не идет.
- Как отличить соли двух металлов, оба из которых образует малорастворимые или нерастворимые гидроксиды:
С помощью щелочей. В результате этого образуются нерастворимые основания, которые могут отличаться по цвету. Но помните, что для этого надо знать цвета всех осадков, и часто нерастворимые основания могут иметь одинаковый цвет.
FeCl3 + 3KOH = Fe(OH)3↓ (бурый осадок) + 3KCl
CuBr2 + 2NaOH = Cu(OH)2↓(голубой осадок) + 2NaBr
- Как отличить соль и кислоту:
1) с металлом (выделение газа водорода в реакциях с кислотами-неокислителями)
KCl + Fe → реакция не идет
CuCl2 + Zn = ZnCl2 + Cu↓
2HCl + Fe → FeCl2 + H2↑
2) с кислыми карбонатами или сульфитами (выделение газа)
HCl + NaHCO3 → NaCl + CO2↑ + H2O
KCl + NaHCO3 → реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются).
- Как отличить кислую соль от средней:
Кислые соли слабых кислот, например гидрокарбонаты, реагируют с сильными кислотами с выделением газа:
KHCO3 + HCl → KCl + CO2↑ + H2O
KNO3+ HCl → реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются).
- Как отличить кислоту от воды:
1) Индикаторами: об этом смотри в пункте 1.
2) Если кислота сильная, то можно добавить соль слабой кислоты (например, K2CO3, KHCO3), чтобы выделился газ:
2HNO3 + K2CO3 → 2KNO3 + CO2↑ + H2O
H2O + K2CO3 → растворение соли без химической реакции, видимых признаков нет.
- Как отличить растворимую соль от щелочи:
Провести реакцию ионного обмена с образованием осадка или газа, например:
2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
NaCl + CuCl2 → реакция не идет, так как ни газ, ни осадок, ни малодиссоциирующее соединение не образуется.
- Как распознать присутствие отдельных солей:
Для этого необходимо знать все качественные реакции, цвета осадков, запахи газов, специфические свойства и т.п. Чтобы найти все варианты – смотри таблицу растворимости и таблицы качественных реакций выше).
- Общая схема качественного различения веществ:
Возможны два варианта:
Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор. Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2NaOH + MgCl2 = Mg(OH)2 ↓+ 2NaCl
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
С карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
А с нитратом серебра с образованием белого творожистого осадка AgCl
HCl + AgNO3 = HNO3 + AgCl↓
Примеры заданий из ЦТ и ЕГЭ, в которых необходимо было использовать знания о качественных реакциях:
Из ЦТ по химии:
В четырех пронумерованных пробирках находятся водные растворы неорганических соединений.
| Вещество | Номер пробирки |
| А) соляная кислота
Б) гидроксид калия В) иодид кальция Г) карбонат натрия |
1
2 3 4 |
О них известно следующее:
— при добавлении в пробирку 1 содержимого пробирки 2 приводит к образованию белого осадка;
— при смешивании содержимого пробирок 1 и 4 образуется газ (н.у.);
— при сливании растворов из пробирок 2 и 3 наблюдается помутнение.
Установите соответствие. Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность, например: А2Б3В4Г1.
Видео-объяснение:
Больше таких заданий из ЦТ по химии вы можете посмотреть, нажав на эту строку
Из ЕГЭ по химии:
Видео-объяснение:
Больше таких заданий из ЕГЭ по химии вы можете посмотреть, нажав на эту строку
Если что-то было упущено в этой статье или есть ошибки (опечатки), то пишите об этом в комментариях.
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ и ЦТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Больше заданий РТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЦТ вы можете найти здесь, нажав на эту строку
- Посмотреть все пробные варианты ЦТ вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Если вы сдаёте ЦТ по химии, то посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»