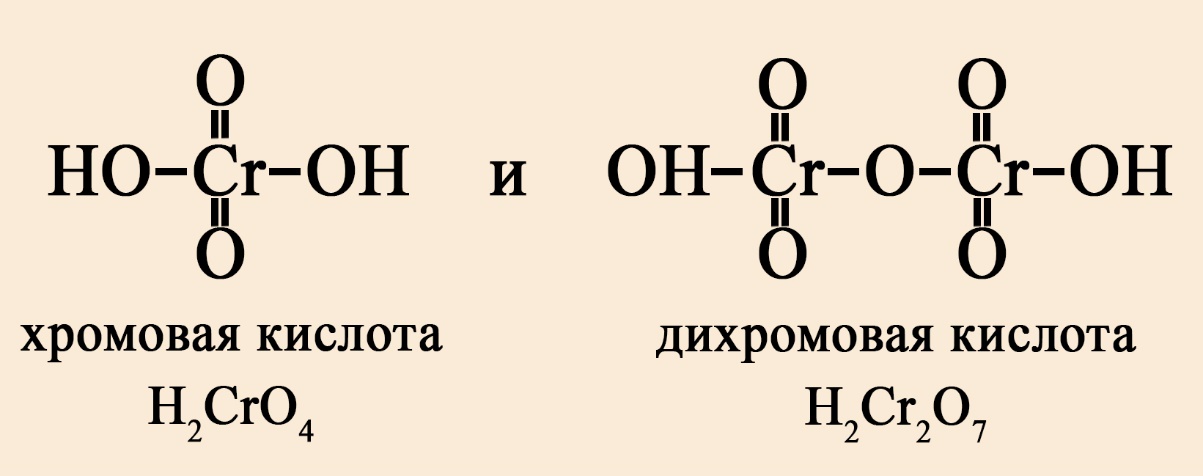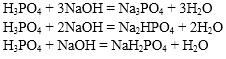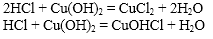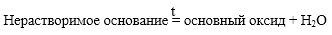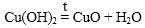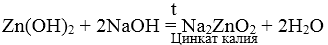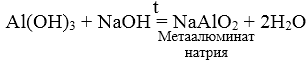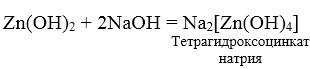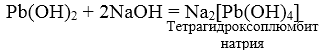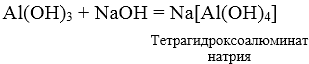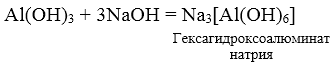4 июня 2021
В закладки
Обсудить
Жалоба
Основность кислот и типы солей
Основность кислоты определяется числом атомов водорода, которые способны заместиться на другие катионы. И не всегда совпадает просто с общим числом атомов водорода в молекуле.
Удобнее всего показать это на различных кислотах фосфора. Он, как отличник-перфекционист, очень любит валентность V. Из-за этого в фосфористой кислоте появляется связь P—H, а в фосфорноватистой кислоте таких связей аж две. Эта связь практически неполярная, образующий ее водород не замещается на другие катионы, то есть не считается «кислым».
Источник: vk.com/chem4you
Классификация кислот
Материал по химии
- Определение кислот
- Классификация кислот по составу
- Классификация кислот по основности
- Сильные и слабые кислоты
- Тривиальные названия некоторых кислот
- «Протон» или «катион»?
- Кислоты и индикаторы
Определение кислот
Кислоты ‒ это вещества, способные в растворах отдавать катион (протон) водорода.
Примеры диссоциации кислот:
HCl ↔ H+ + Cl‒
H2SO4 ↔ 2H+ + SO42‒
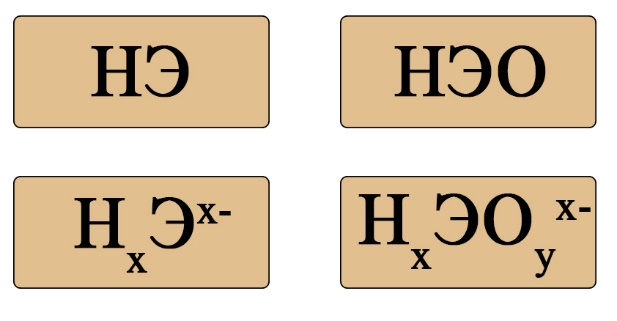
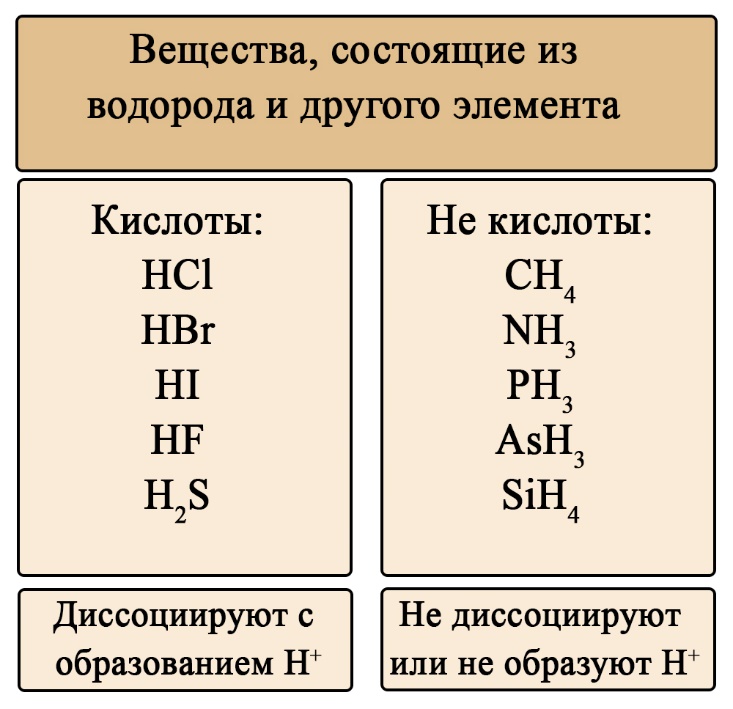
Если пока понятие диссоциации неизвестно, легче ориентироваться по общим формулам кислот:
Важен не только состав, но и последовательность. На первом месте должен стоять водород, за ним – элемент, если в составе есть кислород, то он должен стоять последним. Например, HCl – кислота (соответствует формуле HЭ), H2S – тоже кислота (на первом месте водород, на втором — сера), а вот NH3 несмотря на то, что состоит из водорода и элемента, не является кислотой, это легко определить по последовательности: в этой формуле сначала стоит элемент, а за ним – водород (иногда, чтобы запутать сдающего, составитель может написать не NH3, а H3N, Вы должны помнить, что NH3 (аммиак), PH3(фосфин), AsH3 (арсин), CH4 (метан) – не являются кислотами, так как в воде либо не диссоциируют, либо диссоциируют без образования протона водорода. H2SO4 – является кислотой, так как формула имеет порядок элементов «водород → элемент → кислород», а NaOH, тоже состоящая из элемента, кислорода и водорода – кислотой не является, так как тут последовательность будет такова: «элемент → кислород → водород».
Классификация кислот по составу
Кислоты можно разделить на кислородсодержащие и бескислородные. Не трудно догадаться, что бескислородные не содержат атомов кислорода, а кислородсодержащие — содержат. Кислородсодержащие кислоты образованы соответствующими оксидами, а бескислородные образованы прямым взаимодействием простых веществ.
Таб. Примеры бескислородных и кислородсодержащих кислот, образованных одним и тем же неметаллом
|
Бескислородные |
Кислородсодержащие |
|
HCl |
HClO4 |
|
H2S |
H2SO3 |
|
HBr |
HBrO |
|
HI |
HIO2 |
Классификация кислот по основности
Кислоты могут отдать столько водорода, сколько имеется в их составе (в большинстве случаев, есть исключения). Если может отдать максимум один водород – то кислота относится к одноосновным, если может отдать максимум два протона водорода – то двухосновная и так далее.
Например:
HCl ↔ H+ + Cl‒ (одноосновная)
H2SO4 ↔ 2H+ + SO42‒ (двухосновная)
H3PO4 ↔ 3H+ + PO43- (трехосновная/многоосновная)
Таб. Примеры кислот с разной основностью
|
Одноосновные (один водород) |
Двухосновные (два водорода) |
Многоосновные (три и более протона водорода) |
|
HNO3 |
H2S |
H3PO4 |
|
HF |
H2SiO3 |
H3BO3 |
|
HBrO |
H2CO3 |
H4P2O7 |
Сильные и слабые кислоты
От чего зависит сила кислот? В первую очередь от скорости отдачи протона водорода при диссоциации (чем быстрее кислота отдает протон водорода, тем она считается сильнее). Как определить скорость «на глаз», не имея под рукой никаких справочных материалов, кроме таблицы Менделеева?
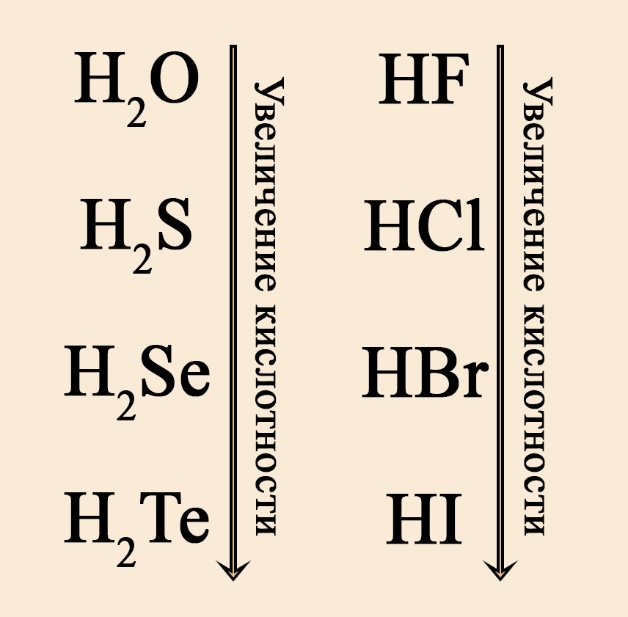
- Если кислота бескислородная, то скорость диссоциации можно определить по радиусу атома, образующего эту кислоту элемента. Напомним, что радиус увеличивается в ПС (периодической системе) сверху-вниз и справа-налево. Так, в ряду кислот HF → HCl → HBr → HI радиус увеличивается от фтора к йоду, так как йод стоит в ПС значительно ниже, чем фтор. Радиус фтора небольшой, поэтому протон водорода прочно связан со фтором, скорость диссоциации будет низкой, значит, кислота слабая. У йода пять электронных оболочек, между йодом и водородом большее расстояние, чем между фтором и водородом, поэтому молекула йодоводорода будет диссоциировать значительно быстрее, значит, кислота сильная. Аналогичную закономерность можно наблюдать в ряду кислот, образованных халькогенами (неметаллами VIА-группы): чем ниже халькоген, тем сильнее образуемая им кислота, поэтому H2S слабее H2Se, а H2Se слабее, чем H2Te.
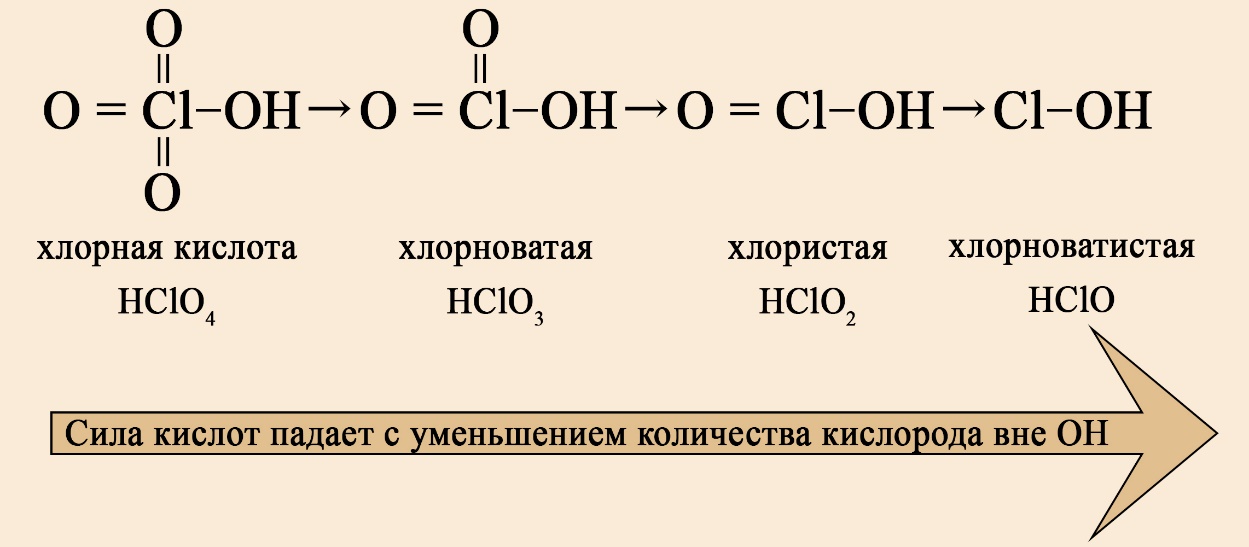
- Если кислота кислородсодержащая, то её сила зависит от количества кислорода, не входящего в гидроксо-группы. Чем больше кислорода вне -OH группы, тем сильнее кислота. Так, дихромовая кислота сильнее хромовой, потому как дихромовая кислота имеет четыре кислорода вне гидроксо-группы, а хромовая – два кислорода вне гидроксогруппы.
В ряду хлорсодержащих кислот наблюдается такая же закономерность:
Список сильных кислот: HI, HCl, HBr, HNO3, HClO4, HClO3, HBrO3, H2SO4, HMnO4, H2Cr2O7.
Список слабых кислот: H2S, HF, HNO2, H2SO3, H2CO3, HClO, карбоновые кислоты.
В действительности классификация кислот по их силе несколько богаче, и те кислоты, которые в школе записывают в слабые (например, ортофосфорную и фтороводородную) на самом деле относят к кислотам средней силы. Помимо классификации важно знать и названия кислот, а также их остатки. Остатками кислот называют отрицательно-заряженные ионы (анионы), которые образуются при диссоциации кислоты в воде. То есть остаток кислоты – это частица, которая остаётся, если отнять у кислоты весь водород. Вот несколько таблиц, в которых кислоты сгруппированы по силе, с указанием соответствующих кислотных остатков и примерами солей:
Таб. Самые сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HI |
йодоводородная |
I‒ |
NaI -йодид натрия |
|
HBr |
Бромоводородная |
Br‒ |
KBr – бромид калия |
|
HCl |
Хлороводородная, соляная |
Cl‒ |
CaCl2 – хлорид кальция |
|
HClO4 |
Хлорная |
ClO4‒ |
NaClO4 – перхлорат натрия |
|
H2SO4 |
Серная |
SO42‒ |
K2SO4 – сульфат калия |
|
HMnO4 |
Марганцовая |
MnO4‒ |
NaMnO4 – перманганат натрия |
Таб. Сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HClO3 |
Хлорноватая |
ClO3‒ |
KClO3 – хлорат калия |
|
HBrO3 |
Бромноватая |
BrO3‒ |
Ba(BrO3)2 – бромат бария |
|
H2Cr2O7 |
Дихромовая |
Cr2O72‒ |
(NH4)2Cr2O7 – дихромат аммония |
Таб. Кислоты средней силы и их остатки (в ОГЭ и ЕГЭ считаем слабыми)
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HNO2 |
Азотистая |
NO2‒ |
NaNO2 – нитрит натрия |
|
H3PO4 |
Фосфорная (ортофосфорная) |
PO43‒ |
(NH4)3PO4 – фосфат аммония |
|
HF |
Фтороводородная (плавиковая) |
F‒ |
CaF2 – фторид кальция |
|
HClO2 |
Хлористая |
ClO2‒ |
KClO2 – хлорит калия |
Таб. Слабые кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
H2S |
Сероводородная |
S2‒ |
MgS – сульфид магния |
|
HCN |
Циановодородная |
CN‒ |
KCN – цианид калия |
|
H2CO3 |
Угольная |
CO32‒ |
CaCO3 – карбонат кальция |
|
H2SO3 |
Сернистая |
SO32‒ |
BaSO3 – сульфит бария |
|
HClO |
Хлорноватистая |
ClO‒ |
NaClO – гипохлорит натрия |
|
H2SiO3 |
Кремниевая |
SiO32‒ |
K2SiO3 – силикат калия |
|
CH3COOH |
Уксусная |
CH3COO‒* |
CH3COONa – ацетат натрия |
*В органических кислотах водород пишется не в начале молекулы, а в конце, например:
CH3COOH – уксусная кислота, диссоциирует следующим образом:
CH3COOH ↔ CH3COO‒ + H+
C2H5COOH – пропионовая кислота
CH3CH2COOH ↔ CH3CH2COO‒ + H+
C3H7COOH – масляная кислота.
C3H7COOH ↔ C3H7COO‒ + H+
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- H2SO2
- HCl
- HNO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородная слабая
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HNO2
- HBr
- H3PO4
- одноосновная сильная
- одноосновная слабая
- многоосновная сильная
- многоосновная слабая
Задание по образцу ФИПИ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HF
- H2CO3
- H2SiO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородна слабая
Тривиальные названия некоторых кислот
Многие кислоты имеют альтернативное историческое название, например, хлороводородную кислоту еще называют соляной кислотой, потому что она образует самую популярную соль – NaCl (поваренная соль, используемая в быту). Фтороводородную кислоту называют плавиковой, так как она плавит стекло (поэтому данную кислоту не хранят в стеклянной таре). Муравьиную и щавелевую кислоты назвали так по источнику получения.
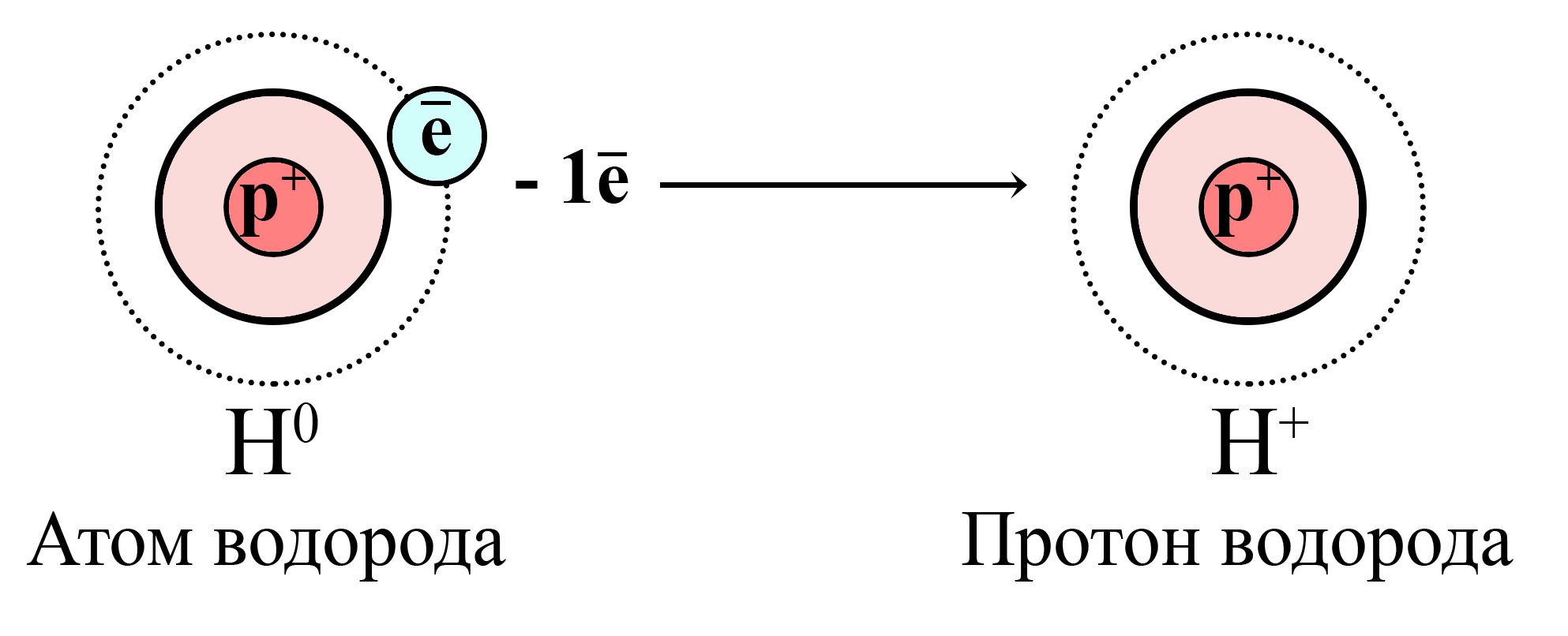
«Протон» или «катион»?
Для всех положительно заряженных частиц характерен термин «катион», однако, по отношению к водороду принято говорить «протон». А дело всё в том, что другие элементы при потере внешних электронов, все равно обладают электронами внутренних слоёв, тогда как водород, содержащий всего один электрон, потеряв его, становится протоном (нейтронов в ядре тоже нет).
Поэтому принято говорить, что кислота отдает не катион водорода, а протон водорода.
Кислоты и индикаторы
Для определения кислот в растворах можно использовать стандартные индикаторы (вещества, меняющие цвет в определенной среде): лакмус и метиловый оранжевый, фенолфталеин кислотами не окрашивается. Лакмус в кислых растворах (рН < 7) становится красным, а метиловый оранжевый – красным или розовым.
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н+ (или Н3О+).
По растворимости в воде кислоты можно поделить на растворимые и нерастворимые. Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые). Подробно про классификацию кислот можно прочитать здесь.
Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
Например, оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4
При этом оксид кремния (IV) с водой не реагирует:
SiO2 + H2O ≠
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
Например, хлор реагирует с водородом:
H20 + Cl20 → 2H+Cl—
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз раствора сульфата меди (II):
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + H2O + CO2
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
P + 5HNO3 → H3PO4 + 5NO2 + H2O
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н+ и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
Например, соляная кислота диссоциирует почти полностью:
HCl → H+ + Cl–
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O+ + Cl–
Многоосновные кислоты диссоциируют cтупенчато.
Например, сернистая кислота диссоциирует в две ступени:
H2SO3 ↔ H+ + HSO3–
HSO3– ↔ H+ + SO32–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
3. Кислоты реагируют с основаниями и основными оксидами.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
Например, гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
Cu(OH)2 + 2HBr → CuBr2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
Cu(OH)2 + H2SiO3 ≠
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
Например, уксусная кислота взаимодействует с гидроксидом алюминия:
3CH3COOH + Al(OH)3 → (CH3COO)3Al + 3H2O
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например, йодоводород можно окислить хлоридом меди (II):
4HI— + 2Cu+2 Cl2 → 4HCl + 2Cu+I + I20
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит. Такие реакции протекают по механизму ионного обмена.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Например, соляная кислота взаимодействует с нитратом серебра в растворе:
Ag+NO3— + H+Cl— → Ag+Cl—↓ + H+NO3—
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей.
Например, карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
CaCO3 + 2HCl → CaCl2 + H2O + CO2
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
Например, гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример: гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
H3PO4 + K2HPO4 → 2KH2PO4
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Например, гидроксокарбонат меди (II) растворяется в серной кислоте:
2H2SO4 + (CuOH)2CO3 → 2CuSO4 + 3H2O + CO2
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например, гидроксохлорид алюминия взаимодействует с соляной кислотой:
Al(OH)Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI и др.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Например, железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe + 2H+Cl → Fe+2Cl2 + H20
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
2HNO2 → NO + H2O + NO2
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
H2SiO3 → H2O + SiO2
2HI → H2 + I2
Азотная кислота HNO3 разлагается при нагревании или на свету:
4HNO3 → O2 + 2H2O + 4NO2
Химические свойства кислот
Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Классификация кислот.
В обычных условиях кислоты могут быть твердыми (фосфорная $H_3PO_4$; кремниевая $H_2SiO_3$) и жидкими (в чистом виде жидкостью является серная кислота $H_2SO_4$).
Такие газы, как хлороводород $HCl$, бромоводород $HBr$, сероводород $H_2S$, в водных растворах образуют соответствующие кислоты.
Разделение кислот на группы по различным признакам представлено в таблице.
Классификация кислот.
| Признаки классификации | Группы кислот | Примеры |
| Наличие кислорода в кислотном остатке | а) кислородные б) бескислородные |
$H_3PO_4, HNO_3$ $H_2S, HCl, HBr$ |
| Основность | а) одноосновные б) двухосновные в) трехосновные |
$HCl, HNO_3$ $H_2S, H_2SO_4$ $H_3PO_4$ |
| Растворимость в воде | а) растворимые б) нерастворимые |
$H_2SO_4, H_2S, HNO_3$ $H_2SiO_3$ |
| Летучесть | а) летучие б) нелетучие |
$H_2S, HCl, HNO_3$ $H_2SO_4, H_2SiO_3, H_3PO_4$ |
| Степень электролитической диссоциации | а) сильные б) слабые |
$H_2SO_4, HCl, HNO_3$ $H_2S, H_2SO_3, H_2CO_3$ |
| Стабильность | а) стабильные б) нестабильные |
$H_2SO_4, H_3PO_4, HCl$ $H_2SO_3, H_2CO_3, H_2SiO_3$ |
Часто путают понятия летучесть и устойчивость (стабильность). Летучими называют кислоты, молекулы которых легко переходят в газообразное состояние, т.е. испаряются. Например, соляная кислота является летучей, но устойчивой, стабильной кислотой. О летучести нестабильных кислот судить нельзя. Например, нелетучая нерастворимая кремниевая кислота разлагается на воду и $SiO_2$.
Водные растворы соляной, азотной, серной, фосфорной и ряда других кислот не имеют окраски. Водный раствор хромовой кислоты $H_2CrO_4$ имеет желтую окраску, марганцевой кислоты $HMnO_4$ — малиновую.
Свойства кислот
Кислый вкус, воздействие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами — эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
$HCl=H^{+}+Cl^–$,
$HNO_3=H^{+}+NO_3^{-}$,
$H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$.
Растворы кислот изменяют цвет индикаторов: лакмуса — в красный, метилового оранжевого — в розовый, цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли:
$2HCl+Zn=ZnCl_2+H_2↑$,
$2H^{+}+Zn=Zn^{2+}+H_2↑$.
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
$2HCl+ZnO=ZnCl_2+H_2O$,
$2H^{+}+ZnO=Zn^{2+}+H_2O$.
4. И те, и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовывать как средние, так и кислые соли (это реакции нейтрализации):
а) $H^{+}+OH^{–}=H_2O$.
Например, $HCl+NaOH=H_2O+NaCl;$
б) $H_2SO_4+NaOH={NaHSO_4}↙{text»кислая соль»}+H_2O$.
5. Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ:
$2H^{+}+CaCO_3=Ca^{2+}+H_2O+CO_2↑,$
$SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Взаимодействие $H_3PO_4$ с известняком прекратится из-за образования на поверхности последнего нерастворимого осадка $Ca_3(PO_4)_2$.
Особенности свойств азотной $HNO_3$ и концентрированной серной $H_2SO_4$(конц.) кислот обусловлены тем, что при их взаимодействии с простыми веществами (металлами и неметаллами) окислителями будут выступать не катионы $H^+$, а нитрат- и сульфат-ионы. Логично ожидать, что в результате таких реакций образуется не водород $H_2$, а другие вещества: обязательно соль и вода, а также один из продуктов восстановления нитрат- или сульфат-ионов в зависимости от концентрации кислот, положения металла в ряду напряжений и условий реакции (температуры).
Следует отметить, что третий продукт реакции металлов с этими кислотами образуется в «букете » — смеси с другими продуктами. Эти особенности химического поведения $HNO_3$ и $H_2SO_4$(конц.) наглядно иллюстрируют тезис теории химического строения о взаимном влиянии атомов в молекулах веществ.
Продукты взаимодействия простых веществ с азотной и серной кислотами.
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Mg$ | $Al$ | $Zn$ | $Fe$ |
| $HNO_3$ разбавленная |
$Mg(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Al(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Zn(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
| $HNO_3$ концентрированная |
$Mg(NO_3)_2$ $N_2O$ |
пассивирует | $Zn(NO_3)_2$ $N_2O$ |
пассивирует |
| $H_2SO_4$ разбавленная |
$MgSO_4$ $H_2$ |
$Al_2(SO_4)_3$ $H_2$ |
$ZnSO_4$ $H_2$ |
$FeSO_4$ $H_2$ |
| $H_2SO_4$ концентрированная горячая |
$MgSO_4$ $H_2S$ |
$Al_2(SO_4)_3$ $H_2S$ |
$ZnSO_4$ $H_2S$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ $S$ |
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Cr$ | $Cu$ | $P$ | $S$ |
| $Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Cr(NO_3)_3$ $NO$ |
$Cu(NO_3)_2$ $NO$ |
$H_3PO_4$ $NO$ |
$H_2SO_4$ $NO$ |
| пассивирует | пассивирует | $Cu(NO_3)_2$ $N_2O$ |
$H_3PO_4$ $N_2O$ |
$H_2SO_4$ $N_2O$ |
| $FeSO_4$ $H_2$ |
$CrSO_4$ $H_2$ |
— | — | — |
| $Fe_2(SO_4)_3$ $SO_2$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ |
$CuSO_4$ $SO_2$ |
$H_3PO_4$ $SO_2$ |
$SO_2$ $H_2O$ |
Химические свойства кислот
1. Сила кислот уменьшается в ряду:
HI → HClO4 → HBr → HCl → H2SO4 → H2SeO4 → HNO3 → HClO3 → HIO3 →
H2SO3 → HClO2 → H3PO4 → HF → HNO2 → CH3COOH → H2CO3 → H2S → H2SiO3.
Некоторые реакции, подтверждающие ряд кислот:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O т.е. H2CO3 слабее, чем HCl
K2CO3 + SO2 → K2SO3 + CO2 т.е. H2CO3 слабее, чем H2SO3
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O т.е. H2CO3 слабее, чем CH3COOH
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3 т.е. H2SiO3 слабее, чем H2CO3
3H2SO4 + 2K3PO4 → 3K2SO4 + 2H3PO4 т.е. H3PO4 слабее, чем H2SO4
Во всех этих реакциях образуются либо осадок, либо (более) слабая кислота.
Если осадка не образуется и обе кислоты сильные (т.е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
NaCl(тв.) + H2SO4(к) → NHSO4 + HCl
NaNO3(тв.) + H2SO4(к) → NaHSO4 + HNO3
Аналогичным образом можно получить и слабую плавиковую кислоту:
KF(тв.) + H2SO4(к) → KHSO4 + HF
HBr и HI (они также являются летучими) таким образом получать не удается, так как они окисляются концентрированной серной кислотой:
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
2. Летучесть кислот
Следующие кислоты являются летучими: HNO3, HF, HCl, HBr, HI, H2S, H2Se.
Остальные кислоты являются нелетучими.
3. Сила кислот (способность к диссоциации)
Сильные: HNO3, H2SO4, HCl, HBr, HI, HClO4, HClO3.
Слабые (все остальные): HF, H2CO3, H2SO3, HNO2, H3PO4, H2S, H2SiO3, все органические кислоты и другие.
4. Растворимость кислот в воде
Нерастворимыми кислотами являются: H2SiO3 и все высшие жирные кислоты, т.е. кислоты, содержащие 10 атомов углерода и больше. Например, C17H35COOH (стеариновая кислота).
5. Термическое разложение кислот
При нагревании разлагаются следующие кислоты:
H2CO3 → CO2 + H2O
H2SO3 → SO2 + H2O
4HNO3 → 4NO2 + O2 + 2H2O
H2SiO3 → SiO2 + H2O
Неустойчивыми являются H2CO3 и H2SO3.
6. Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2HCl + Mg(OH)2 → MgCl2 + 2H2O
Эти реакции идут, только если образующаяся соль существует в водном растворе, т.е. в таблице растворимости не должен стоять прочерк:
H2S + Al(OH)3 → реакция не идет, т.к. Al2S3 в водной среде разлагается (по сути, идет обратная реакция)
H2S + Cr(OH)3 → реакция не идет по той же причине.
Особенность кремниевой кислоты: из оснований она реагирует только с щелочами:
H2SiO3 + 2NaOH → Na2SiO3 + 2H2O
H2SiO3 + Cu(OH)2 → реакция не идет
H2SiO3 + Al(OH)3 → реакция не идет.
7. Взаимодействие с солями
Реакции с солями идут, если выделяется газ, выпадает осадок или образуется более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
8. Взаимодействие кислот-неокислителей с металлами
Металлы, стоящие в ряду активности металлов до водорода, взаимодействуют с кислотами-неокислителями с выделением водорода:
H2SO4(р) + Zn → ZnSO4 + H2
6HCl + 2Fe → 2FeCl3 + 3H2
Cu + HCl → реакция не идет.
9. Взаимодействие кислот-окислителей (H2SO4(к), HNO3(к) и HNO3(р)) с простыми и сложными веществами
9.1) Серная кислота
9.2) Азотная кислота
Физические свойства кислот
Твердые кислоты: H3PO4 (ортофосфорная кислота), H3BO3 (борная кислота), HIO4 (йодная кислота).
Жидкие кислоты: H2SO4, HNO3.
Большинство кислот растворяются в воде. Некоторые кислоты являются растворами газов в воде, например, HCl и H2S).
Химические свойства кислот
1. Кислоты взаимодействуют с основаниями с образованием соли и воды (реакция нейтрализации).
Если в реакциях нейтрализации участвуют многоосновные кислоты или многокислотные основания, то продуктами реакции могут быть не только средние соли.
2. Кислоты взаимодействуют с основными оксидами с образованием соли и воды.
Кислота + Основный оксид = соль + H2O
2HCl + CaO = CaCl2 + H2O
3. Кислоты взаимодействуют с амфотерными оксидами с образованием соли и воды.
Кислота + амфотерный оксид = соль + H2O
2HNO3 + ZnO = Zn(NO3)2 + H2O
4. Кислоты взаимодействуют с амфотерными гидроксидами с образованием соли и воды.
Кислота + амфотерный гидроксид = соль + H2O
3HCl + Cr(OH)3 = CrCl3 + 3H2O
5. Кислоты взаимодействуют с некоторыми средними солями с образованием новой соли новой кислоты.
Эти реакции возможно в том случае если в результате их образуется слабая кислота (в виде газа) или выпадает осадок (нерастворимая соль)
Кислота + соль = соль1 + Кислота1
HCl + AgNO3 = AgCl ↓+ HNO3
2CH3COOH + Na2CO3 = 2CH3COONa + CO2 ↑ + H2O
6. Кислоты взаимодействуют с металлами. Характер продуктов этих реакций зависит от природы и концентрации кислоты и от активности металла.
Активность металла определяется его положением в электрохимическом ряду напряжений.
Взаимодействие металлов с серной концентрированной кислотой:
|
Металлы |
Активные |
Средней активности |
Неактивные |
|
H2SO4 (конц.) |
Соль + H2O + H2S 8Na + 5H2SO4 = 4Na2SO4 + H2S +4H2O |
Соль + H2O + S 4H2SO4 + 3Zn = 3ZnSO4+4H2O+S |
Cоль + H2O + SO2 2H2SO4 + 2Ag = Ag2SO4+2H2O+SO2 |
Получение кислот
1. Бескислородоные кислоты получают путем синтеза водородных соединений неметаллов из простых веществ и последующего растворения полученных продуктов в воде.
Неметалл + H2 = водородное соединение неметалла;
Неметаллы: F2, Cl2, Br2, I2, S, Se
2. Оксокислоты получают взаимодействием кислотных оксидов с водой.
Кислотный оксид + H2O = оксокислота
SO3 + H2O = H2SO4
3. Большинство кислот можно получить взаимодействием солей с кислотами.
Соль + кислота = Соль1 + кислота1
2NaCl(тв.) + H2SO4(конц.) = 2HCl + Na2SO4
Основания
Физические свойства оснований
Все неорганические основания —твердые вещества, кроме NH4OH
Основание имеют разный цвет: гидроксид калия (KOH) — белого цвета, гидроксид меди (II) (Cu(OH)2) — голубого цвета
Некоторые растворимые в воде основания называются едкими щелочами:
NaOH — едкий натр
KOH — едкий кали
Химические свойства оснований
1. Основания взаимодействуют с кислотами с образованием соли и воды – реакция нейтрализации.
Основание + кислота = соль + H2O
KOH + HCl = KCl + H2O
2. Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды.
Щелочь + кислотный оксид = Соль + H2O
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
3. Растворы щелочей взаимодействуют с растворами солей, если в результате образуется нерастворимое основание (или выделяется газ) или соль.
Раствор щелочи + раствор соли = основание2 + соль2
2NaOH + CuSO4 = Cu(OH)2 ↓ + Na2SO4
4. Нерастворимые в воде основание при нагревании разлагаются на основный оксид и воду.
5. Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды.
Zn + 2NaOH + 2 H2O = Na2[Zn(OH)4] + H2
Получение оснований
1. Взаимодействие щелочных и щелочноземельных металлов с водой.
2Na + 2H2O = 2NaOH + H2
2. Взаимодействие оксидов щелочных и щелочноземельных металлов с водой.
BaO + H2O = Ba(OH)2
3. Получение нерастворимых оснований действием щелочей на растворимые соли металлов
Раствор щелочи + раствор соли = нераствор. основание + соль1
2NaOH + FeSO4 = Fe(OH)2 ↓ + Na2SO4
Амфотерные гидроксиды
Физические свойства
Все амфотерные гидроксиды — твердые вещества, не растворимые в воды. Окраска амфотерных гидроксидов зависит от характера входящих в их состав катионов металлов.
Химические свойства
Амфотерные гидроксиды реагируют как с кислотами, так и со щелочами.
1. Взаимодействие амфотерных гидроксидов с кислотами.
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2 H2O
Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O
2. Сплавление твердых гидроксидов с твердыми щелочами.
3. При взаимодействии амфотерных гидроксидов с избытком растворов щелочей образуются комплексы.
Химические свойства оснований и кислот
Кислоты ― это сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металла.
Общая формула кислот:
Hx (Ac), где Ac ― кислотный остаток, х ― число атомов водорода, равное валентности кислотного остатка.
Примеры кислот: HCl, HNO3, H2SO4, H3PO4.
Классификация кислот.
а) По основности
Основность кислоты ― это число атомов водорода, которые в молекуле кислоты могут замещаться атомами металла. По основности кислоты делятся на:
-
Одноосновные: HCl, HNO3, HCN и др.
-
Двухосновные: H2S, H2SO4, H2CO3 и др.
-
Трехосновные: H3PO4, H3BO3, H3AsO4 и др.
-
Четырехосновные: H4P2O7 и др.
Кислоты, молекулы которых содержат два и более атомов водорода, считаются многоосновными.
б) По содержанию атомов кислорода в молекуле кислоты делятся на:
-
Бескислородные: HCl, HBr, HCN, H2S и др.
-
Кислородсодержащие: HNO3, H2SO4, H3PO4 и др.
Химические свойства кислот.
-
Взаимодействие с металлами
Кислоты взаимодействуют с металлами, стоящими в ряду активности металлов левее водорода. В результате реакции образуется соль и выделяется водород (кроме кислот ― окислителей).
Mg + 2HCl = MgCl2 + H2
-
Взаимодействие с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. В результате реакции обмена образуются соль и вода.
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O
-
Взаимодействие кислот с основаниями и с амфотерными гидроксидами
Кислоты реагируют с основаниями и с амфотерными гидроксидами, образуя соль и воду.
3HCl + Cr(OH)3 = CrCl3 + 3H2O
-
Взаимодействие кислот с солями
Реакции обмена между кислотами и солями возможны, если в результате образуется практически нерастворимое в воде вещество (выпадает осадок), образуется летучее вещество (газ) или слабый электролит.
HCl + AgNO3 = HNO3 + AgCl (осадок белого цвета)
2HCl + Na2CO3 = 2NaCl + H2O + CO2 (газ)
Основания ― это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксильных групп ― ОН.
Общая формула оснований:
Me(OH)y, где y ― число гидроксильных групп, равное валентности металла.
Примеры оснований: NaOH, Ca(OH)2, Cо(OH)3
Классификация оснований.
а) По числу гидроксильных групп в молекуле
Количество гидроксильных групп в молекуле основания зависит от валентности металла. Основания делятся на:
-
Однокислотные: NaOH, KOH, LiOH и др.
-
Двухкислотные: Ca(OH)2, Fe(OH)2 и др.
-
Трехкислотные: Ni(OH)3, Bi(OH)3 и др.
б) По растворимости в воде основания делятся на:
-
Раситворимые: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2;
-
Нерастворимые: Cu(OH)2, Fe(OH)2, Fe(OH)3 и др.
Растворимые в воде основания называют щелочами.
Химические свойства оснований
-
Взаимодействие с кислотами
Реакции обмена между щелочами и кислотами называют реакциями нейтрализации.
NaOH + HCl = NaCl + H2O
Ca(OH)2 + 2HNO3 = Ca(NO3)2 +2 H2O
-
Взаимодействие с кислотными оксидами
6NaOH + P2O5 = 2Na3PO4 + 3H2O
-
Взаимодействие щелочей с растворимыми в воде солями
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 (осадок голубого цвета)